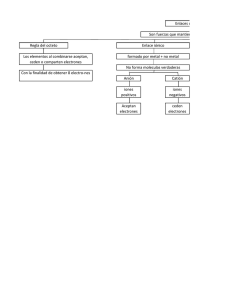
Trampas de Luz Carlos Ruiz Mejia García Vilchis Silvia Yoseline Godoy Jiménez Michelle EL ATOMO!!! Democrito y su maestro Leucipo de Mileto creian que el universo estaba conformado por atomos, pensaban que eran solidos, incomprensibles e indestructibles… Avogadro creia en la existencia de “moleculas elementales” y tenia la hipotesis de que si dos volumenes iguales de diferentes gases estan a la misma temperatura y presion, contienen el mismo numero de moleculas. A mayor presion se obtiene menor volumen y el volumen aumenta cuando aumenta la temperatura. Este comportamiento se puede resumir por medio de la formula V = CT/ P en donde C es una constante relacionada con el numero de moleculas. La cantidad mgnah es una fuerza (peso), es posible obtener la presion dividiendo está cantidad entre a (area). Rutherford se conveció de que en los atomos la carga positiva está concentrada en el centro, que ocupa una pequeña region del volumen total y que los electrones se distribuyen alrededor del centro. Bohr propuso que los electrones se movian en orbitas alrededor del núcleo y que se agrupaban en capas que se iban llenando sucesivamente, 1era Capa: 2 electrones 2da y 3 era Capa: 8 electrones 4ta y 5ta Capa: 18 y 32 electrones Añadiendo un electrón a cada uno de los gases nobles se obtienen gases alcalinos. LA LUZ!!! La luz es energia y gracias a las leyes de Maxwel quedo aclaro la naturaleza de la luz. Michel Faradai realizo varios experimentos sobre magnetismo, se resume asi, si un conductor porta las lineas de fuerza de un cuerpo magnetico, la perturbacion induce una corriente en el conductor. Hertz fue el primero en demostrar que era posible transmitir ondas electricas sin la necesidad de un conductor sus dispositivos permitieron la transmision de señales a unas cuantas decenas de metros. Lorenz explica el origen de la radiacion asegura que los electrones irradian al girar dentro de los atomos, los rayos luminosos se producen cuando los electrones giran rapidamente, y la frecuencia de la luz y la del giro de los electrones deben ser iguales Los rayos x tienen un cierto aspecto de frecuencia. De manera gruesa se clasifican en duros y blandos. Los primeros pueden atravesar mas sustancias que los segundos.Se propagan en linea recta a la velocidad de la luz.Se distinguen de la luz visible en que no presentan los fenomenos de reflexion, refraccion, ni interferencia al menos de no manera apreciable. los rayos Y son vibraciones electromagneticas de frecuencias muy grandes semejantes a los rayos x, son insensibles a la presencia de un campo magnetico, pueden producirse cuando un atomo expulsa un electrón a muy alta velocidad EFECTO FOTOELÉCTRICO Cuando la luz visible, los rayos x o los ultravioleta inciden sobre un gas o un metal se generan electrones. MATERIA SOLIDA!!! La mayoria de los sólidos son cristalinos, es decir, que los atomos o moleculas estan acomodados de tal manera que un cierto motivo o patron de ellos se repite de manera regular a lo largo de grandes distancias. CRISTALES IONICOS El atomo de sodio es neutro pero cuando se combina con los atomos de cloro para formar el cristal sede uno de sus electrones externos, el cuál es atrapado por uno de los atomos de cloro, las cargas negativas y positivas se atraen con fuerza según la let de Coulomb. CRISTALES COVALENTES Cuando un compuesto está formado por elementos del grupo 1 y 2 de la tabla periódica, en combinación con elementos del grupo 6 o 7 los cristales serán del tipo iónico. Los números de combinación altos (6 y 8) son más propios de los iónicos que de los covalentes . CRISTALES METALICOS En un cristal mecánico los electrones de valencia de los átomos que lo forman constituyen lo que se puede denominar como un gas de electrones. La interacción entre este gas y los iones positivos, da lugar a una fuerza de cohesión fuerte, tiene alta conductividad electrica y termica, son opacos y duros. Fuerzas de Van Der Waals Las fuerzas de Van Der Waals, son las fuerzas entre moléculas, distintas a aquellas debido a un enlace intermolecular o la interacción electroestática de iones con otros o con moléculas neutras. Amarre hidrogenoide El hidrogeno neutro solo tiene un electrón disponible, entonces solo puede formar amarre covalente con otra molécula, pero se sabe que bajo ciertas condiciones los átomos de hidrogeno pueden atraer a dos átomos, y que las fuerzas entre ellos no son débiles, a esto se le conoce como amarre hidrogenoide. ESTRUCTURA CRISTALINA La estructura cristalina es la forma sólida de cómo se ordenan y empaquetan los átomos, moléculas, o iones. Estos son empaquetados de manera ordenada y con patrones de repetición que se extienden en las tres dimensiones del espacio. DEFECTOS DE LA RED Los defectos de la red hablan de un cambio en la estructura normal de un cristal, estas se clasifican como puntuales, lineales y de superficie. PUNTALES: de 0 dimisiones, afectan a un punto en la red, perturbando únicamente a los vecinos mas próximos. LINEALES: se extienden en una dirección, y afectan a una fila de puntos de red. TEORIA DE BANDAS La teoría se basa en el hecho de que en una molécula los orbitales de un átomo se solapan produciendo un número discreto de orbitales moleculares. NIVELES DE ANERGIA MOLECULAR. Los niveles energéticos de una molécula también pueden describirse mediante un hamiltoniano cuántico, aunque aquí el cálculo de los niveles energéticos resulta mucho más complicado matemáticamente y con frecuencia se recurre a aproximaciones numéricas, para predecir los niveles energéticos. BANDAS DE ENERGIA De este modo el cristal se transforma en un sistema electrónico que obedece al principio de exclusión de Pauli, que imposibilita la existencia de dos electrones en el mismo estado, transformándose los niveles discretos de energía en bandas de energía donde la separación entre niveles energéticos se hace muy pequeña. CENTROS DE COLOR Es un tipo de defecto cristalográfico en el que un anión vacante en un cristal se llena de uno o mas electrones, dependiendo de la carga de los iones desaparecidos en el cristal. Los electrones en dichos sitios vacantes absorben luz en el espectro visible de forma que un material que suele ser transparente se vuelve de color. FORMACION DE CENTROS F Son producidos haciendo pasar por vapores de sodio sobre cristales de cloruro de sodio, de forma que los iones de cloruro se combinan con los iones de metal, produciendo defectos no estequiométricos dentro de la red. TRAMPAS DE LUZ Luminiscencia: Es la propiedad que tienen ciertos cuerpos de emitir luz tras haber absorbido energía de otra radiación (principalmente ultravioleta) sin elevar su temperatura. APLICACIONES Procesos microscópicos relacionados con la fotografía. Consiste en la formación de imágenes ópticas en una película altamente sensitiva a la luz , cuando se expone a ella por medio de una cámara. LOS LASER Un láser (amplificación de luz por emisión estimulada de radiación) es un dispositivo que utiliza un efecto de la mecánica cuántica, la emisión inducida o estimulada, para generar un haz de luz coherente tanto espacial como temporalmente. FUNCIONES DEL LASER un amplio número de múltiples aparatos, electrodomésticos y dispositivos electrónicos que vemos o que utilizamos a diario, funcionan con láser.