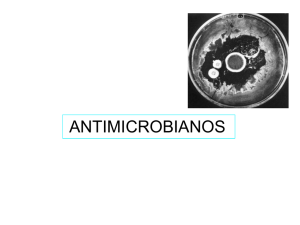
ERIKA ELLIES HOLLSTEIN 2015 El antibiograma es la prueba microbiológica que se realiza para determinar la susceptibilidad (sensibilidad o resistencia) de una bacteria a un grupo de antibióticos. Las técnicas de antibiograma son las utilizadas en el laboratorio de microbiología para estudiar la actividad de los antimicrobianos frente a los microorganismos responsables de las infecciones. Se considera como antimicrobiano cualquier sustancia con capacidad de matar o al menos de inhibir el crecimiento de los microorganismos y que sea susceptible de utilización como tratamiento en los pacientes Pueden ser naturales, sintéticos o semisintéticos (modificación química de un compuesto natural) La historia moderna de los antibióticos comienza con el descubrimiento de sustancias presentes en unos microorganismos capaces de matar a otros microorganismos. La utilización de antibióticos supuso un avance enorme en la esperanza de vida de las personas que padecían procesos infecciosos, aunque también supuso un aumento en los niveles de resistencia antibiótica. El antibiograma tiene cuatro utilidades principales: 1.- La utilidad básica del antibiograma es la instauración de un tratamiento antibiótico correcto al paciente. Es necesario conocer si el microorganismo responsable de la infección posee mecanismos que le confieran inmunidad frente a algún antibiótico para no incluirlo como terapia. 2.- En cuanto al tratamiento, el antibiograma no sólo es necesario en la instauración, también resulta útil en el seguimiento e incluso en la confirmación de tratamientos empíricos. En ocasiones la enfermedad infecciosa resulta grave y se comienza el tratamiento antes de conocer los datos de sensibilidad de la cepa. El antibiograma tiene que confirmar, o en su caso corregir el tratamiento. 3.- Otra aplicación de las técnicas de estudio de resistencia es la epidemiología. Es necesario detectar el aumento de los niveles de resistencia en los aislamientos clínicos para tomar medidas correctoras. Por otro lado también puede tener utilidad diagnóstica porque el perfil de resistencia puede en algún caso orientar en la identificación bacteriana. Existen multitud de antimicrobianos en el mercado y el número sigue creciendo porque el desarrollo de más mecanismos de resistencia por parte de los microorganismos se traduce en un esfuerzo mayor por fabricar más y mejores antibióticos. No es necesario contrastar la eficacia de todos los antibióticos para cada aislamiento bacteriano. Los criterios que se siguen para seleccionar que antimicrobianos se ensayan respondes a factores de diversa índole: Factores microbiológicos: Tipo de agente infeccioso y mecanismos de resistencia descritos previamente en su especie. Factores farmacológicos: Tipo de antimicrobiano y parámetros de absorción, distribución y eliminación. Factores del paciente: Tipo de infección. Factores de riesgo y estado general de salud. Situación inmunológica e hipersensibilidad. Experiencia anterior referente a los patrones de resistencia antibiótica más habituales para cada especie. El método Kirby-Bauer o método de difusión en agar es empleado para determinar la sensibilidad de un agente microbiano frente un antibiótico o quimioterápico. Este método comprende lo que se denomina un antibiograma o prueba de susceptibilidad bacteriana frente a drogas específicas. En el test de Kirby-Bauer, los filtros blancos que contienen antibiótico son colocados en una placa con bacterias. Los halos blancos donde se observa un escaso crecimiento bacteriano indica susceptibilidad al antibiótico testado. Sobre la superficie de una placa de agar Müller-Hinton (medio de cultivo rico, diseñado especialmente para hacer ensayos de sensibilidad) se inocula una cantidad estandarizada de bacterias, sembrándolas de forma uniforme para obtener después de la inoculación un "césped" bacteriano. A continuación se colocan discos de papel de filtro impregnados con concentraciones conocidas de los diferentes antibióticos. La elección de los antibióticos a probar dependen del germen y del foco de infección El antibiótico difundirá desde el papel filtro al agar de forma radial. Se incuba la placa durante 18-24 horas a 37 °C. Se debe respetar este parámetro, porque temperaturas menores pueden disminuir la velocidad del crecimiento del germen y la difusión del antibiótico, dando halos irregulares difíciles de medir. Luego se miden los halos de inhibición de desarrollo, interpretándose de acuerdo a tablas confeccionadas previamente. Los resultados se expresan como: Sensible (S), Intermedio o Moderadamente sensible (I) y Resistente (R). El tamaño del halo de inhibición de desarrollo variará en base a los siguientes parámetros o variables: La concentración de la droga. Sensibilidad bacteriana. Coeficiente de difusión de la droga en el agar. Tiempo y temperatura de incubación. 5.- pH y composición del medio. Se usan preparados comerciales que den resultados reproducibles, por ejemplo: agar MüllerHinton. Son cultivos aceptados por el comité de la OMS para la normalización de las pruebas de susceptibilidad. 6.- Profundidad del medio en las placas. Esto está estandarizado: se emplean placas de 9 cm de diámetro, y se agrega siempre el mismo volumen de medio de cultivo: 15 ml por placa. De esta manera las placas poseen siempre la misma altura de agar. 7.-Tamaño del inóculo. Debe estar estandarizado ya que si éste es muy pequeño dará una sensibilidad mayor a la real, y si el inóculo es muy denso pueden aparecer mutantes resistentes. En los métodos de difusión de mutantes resistentes aparecen como colonias aisladas dentro del halo de inhibición, por lo tanto esto indica que no se puede usar ese antibiótico y se debe informar como resistente. La forma rigurosa de estandarizar un inóculo es normalizando la turbidez por un método fotométrico utilizando una suspensión de sulfato de bario como estándar, según la escala de Mac Farland. Dentro de las posibilidades que se cuentan están: densidad del inóculo mal estandarizada, utilización de cultivos no puros, humedad o sequedad excesiva del medio de cultivo que puede conducir a un crecimiento demasiado confluente o pobre, y deterioro de los discos de aplicación. La Concentración mínima inhibitoria (MIC), en microbiología, es la concentración más baja de un antimicrobiano que inhibe el crecimiento de un microorganismo después de su incubación. La concentración mínima inhibitoria es importante en diagnósticos de laboratorio para confirmar la resistencia de microorganismos a un agente antimicrobiano y además para monitorizar la actividad de los nuevos agentes antimicrobianos. En medicina, la concentración mínima inhibitoria no sólo se usa para determinar la concentración de antimicrobiano que recibirá el paciente sino también el tipo de antimicrobianos a utilizar, lo que a su vez reduce la oportunidad de resistencia microbiana a agentes antimicrobianos específicos. Categorías de interpretaron: Sensible: El microorganismo presenta un gran área de inhibición causada por el fármaco. 95% éxito Intermedio: Se presenta un halo de inhibición mas reducido. Resistente: Presenta muy poco o casi nada de halo. Después de incubar las placas del antibiograma se procederá a la lectura de este. Se usa una regla y se mide el radio del halo de inhibición partiendo de desde donde está el disco de antibiótico hasta donde se inhibió el crecimiento. La longitud obtenida después se compararán con estándares que nos dirán si el medicamento será efectivo o no en el tratamiento. Antibiótico Resistente Intermedia Susceptible Ampicilina ≤ 13 14 - 16 ≥ 17 Amikacina ≤ 14 15 – 16 ≥ 17 Sulfisoxasol ≤ 12 13 - 16 ≥ 17 Gentamicina ≤ 12 13 – 14 ≥ 15 Cloranfenicol ≤ 12 13 - 17 ≥ 18 Ceftriaxona ≤ 12 14 – 20 ≥ 21 Ciprofloxacina ≤ 15 16 - 20 ≥ 21 Tetraciclina ≤ 14 15 - 18 ≥ 19 Acido Nalidixico ≤ 13 14 – 18 ≥ 19 Estrptomicina ≤ 11 12 – 14 ≥ 15 anamicina ≤ 13 14 - 17 ≥ 18 Trimetroprim/ Sulfametoxasol ≤ 10 11 – 15 ≥ 16 Dilución en Caldo: En el método de dilución en caldo, base de casi todos los métodos utilizados en la actualidad, se colocan concentraciones decrecientes del agente antimicrobiano, generalmente diluciones 1:2, en tubos con un caldo de cultivo que sostendrá el desarrollo del microorganismo Método de E-test: Consiste en aplicar sobre un medio de cultivo, donde se encuentra el microorganismo a ensayar, tiras plásticas que llevan incluidas un gradiente de concentración de un determinado ATB. Luego se incuba adecuadamente y se observa la formación de una elipse de inhibición de crecimiento. Método Automatizado: Este método se basa en micro diluciones sobre micro tubos. El crecimiento bacteriano se va a observar por la turbidez o fluorescencia de los micro tubos. Es útil para examinar una gran cantidad de muestras