Fisicoquímica I
Anuncio
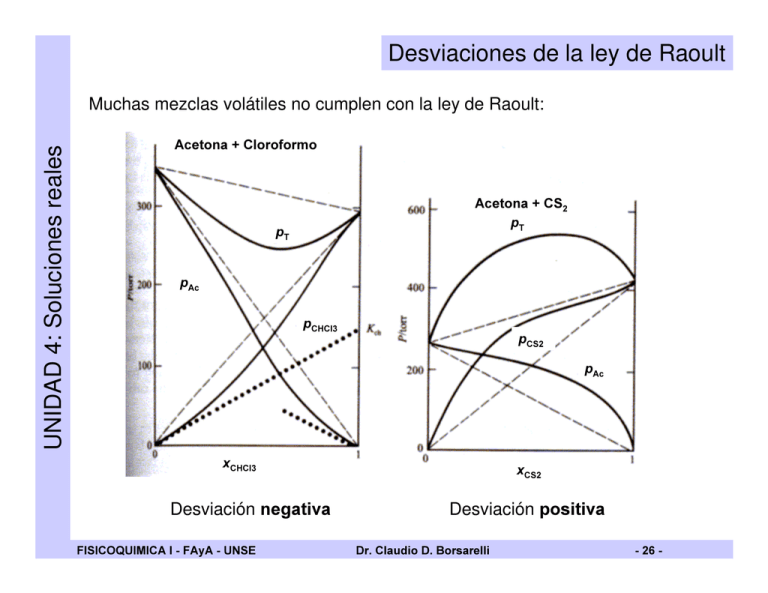
Desviaciones de la ley de Raoult UNIDAD 4: Soluciones reales Muchas mezclas volátiles no cumplen con la ley de Raoult: $FHWRQD&ORURIRUPR $FHWRQD&6 S7 S7 S$F S&+&O S&6 S$F [&+&O Desviación QHJDWLYD ),6,&248,0,&$, )$\$ 816( [&6 Desviación SRVLWLYD 'U&ODXGLR'%RUVDUHOOL Desviaciones de la ley de Raoult UNIDAD 4: Soluciones reales Las desviaciones surgen por LQWHUDFFLRQHVHVSHFtILFDVentre las moléculas de los componentes de la mezcla. Por ejemplo: Cl Cl C H Cl CH3 O C CH3 Unión puente hidrógeno Cl Cl Cl C H Cl C H Cl Cl Cl Cl C H Cl CH3 O C CH3 CH3 CH3 O C O C CH3 CH3 Interacciones dipolo-dipolo > Desviación 1(*$7,9$ ),6,&248,0,&$, )$\$ 816( En el caso de las mezclas Acetona – Cloroformo las desviaciones son negativas ya que la LQWHUDFFLyQ SWH + entre las moléculas de Acetona y Cloroformo es más intensa que las LQWHUDFFLRQHV GLSROR GLSROR que hay entre las moléculas de cada solvente. En general puede esperarse que: < Desviación 326,7,9$ 'U&ODXGLR'%RUVDUHOOL = Comportamiento ,'($/ En soluciones UHDOHVse producen desviaciones del comportamiento ideal. Por lo tanto las funciones de estado de la mezcla real difiere de los valores ideales. Se define este tipo de desviación como IXQFLyQGHH[FHVR UHDO LGHDO < ( = ∆< PH] − ∆< PH] con < = *+689etc. Benceno/Ciclohexano Tetracloroetano/Ciclopentano 5 3 9 (mm /mol) 400 E (J/mol) 800 E + UNIDAD 4: Soluciones reales Funciones de exceso 0 0.0 0.5 [(C6H6) ),6,&248,0,&$, )$\$ 816( 1.0 0 -5 -10 0.0 'U&ODXGLR'%RUVDUHOOL 0.5 1.0 [ (C2Cl4) Propiedades coligativas UNIDAD 4: Soluciones reales Las propiedades coligativas surgen de la reducción del potencial químico de un solvente, µA(l), por la presencia de soluto: µ $ (O ) = µ $ * (O ) + 57 ln [ $ La disminución de µ es debido a efecto entrópico más que entálpico: 6yOLGR /tTXLGRSXUR P 6ROXFLyQ 57OQ[$ 9DSRU 7I 7 I¶ Descenso crioscópico ),6,&248,0,&$, )$\$ 816( 7H 7H¶ Aumento ebulloscópico La presencia de soluto incrementa la entropía en la solución, resultando en una disminución a la tendencia de escape de las moléculas de solvente. 'U&ODXGLR'%RUVDUHOOL Ascenso ebulloscópico UNIDAD 4: Soluciones reales Para una solución formada por un solvente volátil y un soluto no volátil, el equilibrio de fases se alcanza cuando: 9DSRU$ /LTXLGR$ VROXWR% La última ec. se puede re-escribir como: µ $ * (J ) µ $ (O ) = µ $ (J ) = µ $ * (O ) + 57 ln [ $ µ $ * (J ) − µ $ * (O ) ∆*YDS ln(1 − [ % ) = = 57 57 ln(1 − [ % ) = ∆*YDS Suponiendo [B = 0, el punto de ebullición es 7(la temperatura para el solvente puro): ),6,&248,0,&$, )$\$ 816( 57 = ∆+YDS 57 ln(1) = 'U&ODXGLR'%RUVDUHOOL − ∆+YDS 57 * ∆6YDS 5 − ∆6YDS 5 UNIDAD 4: Soluciones reales Ascenso ebulloscópico La diferencia entre ambas ecuaciones da: ∆+YDS 1 1 ln(1 − [ % ) = − 5 7 7 * Para soluciones diluidas, [B << 1. Luego ln(1 – [B) ≈ – [B, entonces: ∆+YDS 1 1 − [% = 5 7 * 7 Como 7≈ 7se obtiene que: 1 7 −7 * ∆7 1 ≈ − = 77 * 7 *2 7 * 7 Finalmente: ∆+YDS ∆7 [% = 5 7 *2 Reordenando: 57 * 2 ∆7 = . HE [ % = ∆+YDS [% Solventes con alto 7*eb y baja ∆+vap tienen un importante ∆7. El ∆7 QRGHSHQGH de la naturaleza del solvente sino de su fracción molar ⇒ prop. FROLJDWLYD. ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL Descenso crioscópico UNIDAD 4: Soluciones reales El equilibrio que se considera es entre un sólido puro A y una solución en la presencia de un soluto no volátil: /tTXLGR$ VROXWR% µ $ (O ) µ $ * (V ) = µ $ * (O ) + 57 ln [ $ 6yOLGR$ En forma similar al ascenso ebulloscópico, se obtiene: 57 * 2 [% ∆7 = −. FU [ % = − ∆+ IXV En soluciones diluidas QB << QA y por tanto se obtiene: La molalidad del soluto es: P% = Q% Q $ 30 $ [% ≈ Q% Q$ , luego [B ≈ 30APB 30 $ 57 * 2 P% = −. ’FU P% ∆7 = − ∆+ IXV ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL Presión osmótica UNIDAD 4: Soluciones reales Considere el equilibrio entre una solución y el solvente puro, separados por una PHPEUDQD VHPLSHUPHDEOH por donde VROR ODV PROpFXODV GH VROYHQWH OD SXHGHQDWUDYHVDUOLEUHPHQWH. S S S S 3 K µ $* ( S ) > µ $ ( [ $ , S ) K µ $* ( S ) = µ $ ( [ $ , S + Π ) = µ $* ( S + Π ) + 57 ln [ $ Recordando que: µ $ * ( S + Π ) = µ $ * ( S ) + Comparando de obtiene: ),6,&248,0,&$, )$\$ 816( − 57 ln [ $ = ∫ ∫ S+Π S S+Π S 9P GS 9P GS 'U&ODXGLR'%RUVDUHOOL Presión osmótica UNIDAD 4: Soluciones reales Para soluciones diluidas [B Æ 0, y si el volumen molar del solvente aproximadamente constante: − 57 ln(1 − [ % ) = 9P ∫ S+Π S 57[ % ≈ 9P Π GS Q% ≈Π 57 Q $9P ⇒ es Q% ≈ 9P Π 57 Q$ Π = 57 [% ] Ecuación de Van’t Hoff La medición de la presión osmótica se utiliza para la determinación del peso molecular de proteínas y de polímeros sintéticos y naturales, los cuales no son permeables en la membrana. ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL Actividades Actividad del solvente UNIDAD 4: Soluciones reales El potencial químico de un solvente ideal o real esta dado por: µ$ = µ $* S$ + 57 ln * S $ µ $ = µ $* + 57 ln [ $ µ $ = µ $* + 57 ln D $ REAL DA = ACTIVIDAD de A ) DA ≡ fracción molar efectiva IDEAL (cumple Ley de Raoult) D$ = S$ S $* D $ → [ $ cuando [ $ → 1 Es más conveniente expresar DA como: D $ = γ $ [ $ donde γ A → 1 si [ $ → 1 Finalmente el potencial químico de un solvente se expresa: µ $ = µ $* + 57 ln [ $ + 57 ln γ $ El estado estándar es el liquido puro ([A=1) a 1 bar ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL IDEAL DESVIACIÓN Actividades UNIDAD 4: Soluciones reales Actividad del soluto: soluciones diluidas Para un soluto B que satisface la ley de Henry tiene una presión de vapor dada por: SB = .%[%. Entonces el potencial químico de B es: µ% = µ %* S% + 57 ln * S % .% * = µ % + 57 ln S* % + 57 ln [ % Como .B y SB* son característicos del soluto se puede re-definir un nuevo estándar: µ %⊥ Finalmente el potencial químico del soluto se expresa: ),6,&248,0,&$, )$\$ 816( = µ %* .% + 57 ln * S % µ % = µ %⊥ + 57 ln [ % 'U&ODXGLR'%RUVDUHOOL Actividades UNIDAD 4: Soluciones reales Actividad del soluto: soluciones reales Considerando la actividad del solvente: químico de B es: DB = γB [B. Entonces el potencial µ % = µ %⊥ + 57 ln D% µ % = µ %⊥ + 57 ln [ % + 57 ln γ % IDEAL DESVIACIÓN si [ % → 0, γ % → 1 y D% → [ % Condiciones de la ley de Henry ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL Actividades (MHPSORVLVWHPDFORURIRUPRDFHWRQD UNIDAD 4: Soluciones reales LEY DE RAOULT CHCl3 como solvente J&+&O LEY DE HENRY (CH3)2CO como soluto J$& D&+&O D$& si [ $ → 1, γ $ → 1 si [ % → 0, γ % → 1 Ley de Raoult Ley de Henry ),6,&248,0,&$, )$\$ 816( 'U&ODXGLR'%RUVDUHOOL
