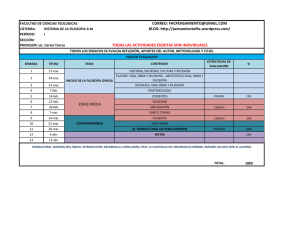
EVALUACIÓN DEL MÉTODO DILUCIÓN NEUTRALIZACIÓN APLICADO A UN DESINFECTANTE SEGÚN LA NORMA TÉCNICA COLOMBIANA 5473 DE 2007 JUAN CARLOS MARÍN DIAZ NATALIA FERNANDA NAVARRO PEÑA NATALIA SANTOS ARÉVALO TRABAJO DE GRADO Presentado como requisito parcial Para optar el titulo de MICROBIOLOGO INDUSTRIAL PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGIA INDUSTRIAL BOGOTÁ, D.C. 2008 NOTA DE ADVERTENCIA Artículo 23 de la Resolución N° 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. EVALUACIÓN DEL MÉTODO DILUCIÓN NEUTRALIZACIÓN APLICADO A UN DESINFECTANTE SEGÚN LA NORMA TÉCNICA COLOMBIANA 5473 DE 2007 JUAN CARLOS MARÍN DIAZ NATHALIA FERNANDA NAVARRO PEÑA NATALIA SANTOS ARÉVALO APROBADO __________________________________ Libardo Hernández, Químico Farmacéutico Director _______________________________ Janeth del Carmen Arias, Bacterióloga Asesor Cindy Fernandez, Microbióloga Industrial Jurado Joel Guarín, Químico Farmacéutico Jurado EVALUACIÓN DEL MÉTODO DILUCIÓN NEUTRALIZACIÓN APLICADO A UN DESINFECTANTE SEGÚN LA NORMA TÉCNICA COLOMBIANA 5473 DE 2007 JUAN CARLOS MARÍN DIAZ NATHALIA FERNANDA NAVARRO PEÑA NATALIA SANTOS ARÉVALO APROBADO _______________________ Dra. Angela Umaña, MPhil. Decano Académico _______________________ Janeth Arias, Bacterióloga. Director de Carrera DEDICATORIA Dedico este trabajo a la razón de mi vida, Marianita, mi hija; a mis padres por su apoyo incondicional y a Dios por las grandes oportunidades que me ha puesto en el camino. Nathalia Fernanda Navarro. A mis padres por su esfuerzo, dedicación y por el inmenso amor que cada día están dispuestos a ofrecerme. A William por enseñarme a amar sin condición y por impulsarme a ser cada vez mejor. Y sobre todo, a Dios, por permitirme crecer y lograr mis metas, por ayudarme a ser lo que soy en este momento. Natalia Santos Arévalo. Dedico este trabajo al señor Lobo y a mi negra por hacer posible día a día la realización de mis metas, a Karen por su apoyo, a Adriana, Martha y Marcela por su valiosa amistad y especialmente a Dorita quien estaría muy orgullosa de mi…. Juan Carlos Marín Díaz AGRADECIMIENTOS Agradecemos al Laboratorio VICAR S.A. por hacer posible la realización de este proyecto, especialmente al Profesor Libardo Hernández por su asesoría y su ayuda y a las microbiologas Nubia Castro y Viviana Peña por su paciencia, interés y apoyo. Agradecemos a nuestra Profesora Janeth Arias, por su compañía y constantes palabras de aliento. vi TABLA DE CONTENIDO Pag. 1. INTRODUCCION 3 2. MARCO TEORICO 2.1. El proceso de desinfección 2.2. Características de un desinfectante ideal 2.3. Modo de acción de los desinfectantes 2.4. Factores que influyen en la acción química de los desinfectantes 2.4.1. Limpieza adecuada 2.4.2. Carga orgánica 2.4.3. Tipo y porcentaje de microorganismo 2.4.4. Tiempo y temperatura 2.4.5. Ph 2.4.6. Nivel de dureza del agua 2.5. Importancia de la evaluación de desinfectantes 2.6. Evaluaciones de neutralización como experimentos de control para los test de eficacia antimicrobiana. 2.6.1 Métodos De Evaluación De Desinfectantes 2.6.2 Neutralización por inhibición química 2.6.3. Neutralización por dilución 2.7. Factores que afectan la neutralización de los antimicrobianos 2.7.1. Eficacia del Neutralizante 2.7.2. Toxicidad del Neutralizante 2.7.3. Diseños Para Evaluación De Neutralizantes 2.7.3.1. Recuperación en medio sólido 2.7.3.2. Recuperación en medio líquido 2.7.3.3. Recuperación por Filtración por Membrana 2.8. Normativa mundial sobre evaluacion de desinfectantes 2.8.1. Normas AFNOR 2.8.2. Normativa Europea 2.8.3. Normativa estadounidense 2.8.4. Normativa Colombiana. 9 9 9 10 10 10 11 11 11 11 11 12 12 13 14 15 3. JUSTIFICACIÓN 16 4. OBJETIVOS. 17 5. MATERIALES Y MÉTODOS. 5.1 Diseño de la investigación 5.1.1 Población de estudio y muestra 5.1.2 Variables del estudio 5.2. Métodos 5.2.1. Materiales 5.2.2. Medios de cultivo 5.2.3. Reactivos 5.2.4. Equipos 5.3. Metodología 5.3.1. Establecimiento de las condiciones experimentales para el método de ensayo dilución-neutralización 5.3.2. Implementación del método de ensayo dilución-neutralización según la norma técnica colombiana 5473 del 2007 18 18 18 18 18 18 18 19 19 19 vii 5 6 7 7 7 7 7 7 7 8 19 21 5.3.2.3. Determinación de las concentraciones bactericidas 5.3.2.4. Verificación de la ausencia de cualquier efecto letal en las condiciones del ensayo (parámetro A de la condición experimental) 5.3.2.5. Verificación de la ausencia de toxicidad del neutralizante (parámetro B de control del neutralizante) 5.3.2.6. Parámetro de estandarización del método 5.3.2.7. Incubación y recuento de la mezcla de ensayo y de las mezclas de control y estandarización 5.3.3. Verificación de la metodología 5.4. Recolección de la información 5.5. Análisis de información 6. RESULTADOS Y DISCUSIÓN 6.1. Establecimiento de las condiciones experimentales para el método de ensayo dilución-neutralización. 6.2. Implementación y Verificación del método de ensayo dilución-neutralización según la norma técnica colombiana 5473 del 2007. 6.2.1. Preparación de la Suspensión de Ensayo y Validación 6.2.2. Evaluación de las condiciones experimentales - Control A. 6.2.3. Verificación de la ausencia de toxicidad del neutralizante – Control B 6.2.4. Validación del método Dilución Neutralización – Control C 6.2.5. Ensayo NA – Método Dilución Neutralización 21 22 22 22 23 37 37 38 41 41 41 43 44 45 47 7. CONCLUSIONES 51 8. RECOMENDACIONES 52 9. REFERENCIAS 53 10. ANEXOS 55 viii RESUMEN En el ámbito médico, la desinfección constituye un procedimiento esencial para enfrentar la cadena de transmisión de infecciones. El objetivo de este estudio fue evaluar el método de dilución neutralización propuesto en la Norma Técnica Colombiana 5473 de 2007, mediante la utilización de un desinfectante en gel a base de alcohol. El ensayo se efectuó utilizando Pseudomonas aeruginosa ATCC 15442, Staphylococcus aureus ATCC 6538 y Enterococcus hirae ATCC 10541, como microorganismos de ensayo. Las temperaturas bajo las cuales se realizó el estudio fueron 20±1°C como temperatura obligatoria y 36±1°C y se emplearon cuatro tiempos de contacto entre el desinfectante y los microorganismos evaluados (0,2,5,10 minutos). El método fue realizado bajo condiciones limpias (0.3 g/l de albumina de suero bovino) y sucias (3g/l de albumina de suero bovino y 3g/l de eritrocitos de oveja). La implementación del método arrojó resultados precisos en cada una de las seis repeticiones realizadas en el ensayo. Los resultados obtenidos demostraron una reducción logarítmica superior a cinco, evidenciando la actividad bactericida ejercida por el desinfectante frente a los microorganismos control. El establecimiento de las condiciones experimentales y de la metodología demostró no incidir negativamente en el crecimiento de cada una de las cepas. Igualmente, el neutralizante utilizado no inhibió el desarrollo de los organismos de ensayo. El método fue verificado mediante el cumplimiento de los límites básicos establecidos por la norma. Los resultados sugieren que el método evaluado mediante la implementación del protocolo establecido en la Norma Técnica Colombiana 5473 de 2007, permite evaluar la eficacia de un desinfectante bajo condiciones experimentales escogidas y controladas. ABSTRACT In the medical area, disinfection constitutes an essential procedure in order to face the chain of transition of infections. The aim of this study was to evaluate the dilution-neutralization method proposed in the Colombian Technical Norm 5473/07, by using a gel alcohol-based disinfectant. This study was made using Pseudomonas aeruginosa ATCC 15442, Staphylococcus aureus ATCC 6538 and Enterococcus hirae ATCC 10541 taken as essay microorganisms. The study was realized to 20±1°C as obligatory temperature and additionally to 36±1°C. Four times of contact between microorganism and disinfectant were evaluated (0, 2, 5 and 10 minutes). The essay was realized both under clean conditions (0.3 g/l of albumen of bovine serum), and dirty conditions (3 g/l of albumen of bovine serum and 3g/l of sheep erythrocytes). The implementation of this method got precise results in each of six repetitions realized during the essay. The obtained results demonstrated a logarithmic reduction up to five, demonstrating the bactericidal activity exercised by the disinfectant to face the control microorganisms. The established experimental conditions and methodology demonstrated not to affect negatively the growth of each one of microorganisms. Similarly, the used neutralizant did not disable the development of the microorganisms of the essay. The method was checked by means of the fulfillment of the basic limits established by the norm. The obtained results suggest that the method evaluated by means of implementation of the protocol established in the Colombian Technical Norm 5473/07, allows evaluating the efficiency of a disinfectant under selected and controlled experimental conditions. 1. INTRODUCCIÓN El control microbiano en el área de la salud, constituye actualmente, uno de los pilares para la implementación de procesos que garanticen la seguridad a pacientes y personal que labora en el área. Por ello, la limpieza y la desinfección son el mecanismo principal al cual se debe acudir si se quiere mantener un ambiente libre de microorganismos que pueden llegar a alterar la salud de pacientes y personal médico. El proceso de desinfección juega un papel importante en la disminución de la carga microbiana presente tanto en el instrumental, como en las instalaciones de los centros médicos. Los mecanismos de desinfección empleados, deben asegurar la reducción de la carga microbiana presente en equipos o ambientes hasta niveles aceptables. Si bien la desinfección no garantiza una total destrucción de los microorganismos, permite ejercer un control sobre las poblaciones microbianas presentes, impidiendo que estas puedan poner en peligro un proceso productivo. En el campo de la salud, así como en la industria alimenticia, cosmética y farmacéutica, la desinfección permite elaborar productos inocuos, destinados al beneficio del ser humano. Por esta razón, es necesario asegurar la ausencia de microorganismos viables tanto en el sector salud como en cualquiera de las industrias anteriormente mencionadas. Este es por ende el objetivo de todo proceso de desinfección. Para la implementación de un plan de desinfección, es necesario realizar una valoración preliminar acerca del tipo de desinfectante a emplear, de acuerdo con la naturaleza del objeto que se desea poner en contacto con la sustancia desinfectante. De igual forma, es necesario determinar el comportamiento del desinfectante ante diversas situaciones ambientales que pueden alterar su efectividad en determinado proceso. Dentro de estas condiciones, se puede evaluar el efecto de la temperatura, el tiempo de contacto entre el desinfectante y la flora microbiana presente, así como la presencia de sustancias interferentes. Las determinaciones anteriormente nombradas, permiten conocer el espectro de acción del desinfectante frente a cualquier tipo de carga microbiana, lo cual se puede lograr conociendo la concentración bactericida del desinfectante empleado. 3 Considerando la importancia de determinar la concentración bactericida de un desinfectante, este trabajo tiene como finalidad evaluar experimentalmente el protocolo descrito por la Norma Técnica Colombiana 5473. De esta manera, este proyecto está orientado a establecer, implementar y verificar los procedimientos documentados en esta norma, para servir como base a nuevos estudios realizados por entidades, que quieran evaluar la capacidad bactericida de cualquier desinfectante que deseen emplear en sus procedimientos de rutina. Igualmente, este trabajo pretende suministrar información necesaria y contundente, que sirva como base para asegurar, que cualquier empresa que desee implementar los métodos evaluados en este proyecto, sea capaz de determinar cuál tipo de desinfectante utilizar para controlar la contaminación presente en un proceso y asegurar la obtención de productos seguros que beneficien a la comunidad. Así mismo, se espera que este trabajo demuestre la efectividad de los métodos reportados por la Norma Técnica Colombiana 5473, y permita asegurar la aplicación de estos procedimientos de evaluación en cualquier tipo de desinfectante utilizado en el sector salud, objetivo de los ensayos reportados por la norma. Finalmente, el deseo de esta investigación es demostrar la importancia del proceso de desinfección en el ámbito médico, y la efectividad de los métodos empleados para la determinación de la concentración bactericida de cualquier desinfectante químico. 4 2. MARCO TEÓRICO 2.1. EL PROCESO DE DESINFECCION. La Desinfección pretende eliminar o reducir el nivel de microorganismo vegetativos y otros organismos indeseables de equipos medico y superficies. El propósito es minimizar la infección o la colonización bacteriana y convertir los instrumentos en materiales seguros para su uso en pacientes. Esto puede se logrado gracias a la combinación de la limpieza, desinfección y la esterilización. Los requerimientos para una desinfección exitosa incluyen: • El monitoreo de los sistemas de control, • Equipos aptos para este propósito: Calibrados, monitoreados y validados. • Personal apropiadamente supervisado y entrenado. (Hoh, 2005). El método usado para la desinfección debe también tener en cuenta: • La contaminación presente, • La tolerancia de los objetos al calor, la presión, la humedad y los químicos, • La disponibilidad del equipo del procesamientos, • Riesgos asociados con el método escogido. (Hoh, 2005). La desinfección efectiva requiere control y monitoreo de todas la etapas del proceso. Los procesos de limpieza, desinfección y esterilización tienen como propósito remover o destruir microorganismos. La selección del método de limpieza y desinfección depende del riesgo de infección asociado con el uso del objeto a desinfectar. Esto también depende de la disponibilidad de método, del tiempo necesario para el proceso y de la naturaleza del objeto, por ejemplo su tolerancia al calor, a la humedad y a los agente químicos. El costo y la seguridad también deben ser considerados. (Steer, 2002). Los desinfectantes son agentes que matan microorganismos pero no necesariamente sus esporas y no deben aplicarse sobre tejidos sino sobre objetos inanimados como mesas, pisos, utensilios; son ejemplo de estos el cloro, hipoclorito, compuestos clorados, soda, sulfato de cobre, compuestos de amonio cuaternario (Jaime, 2002). 5 Los antisépticos son agentes microbicidas que pueden aplicarse sobre la piel y mucosas pero no pueden ser utilizados internamente, son ejemplos de ellos: los agentes mercuriales, nitrato de plata, solución de yodo, alcoholes, detergentes (Jaime, 2002) 2.2 CARACTERÍSTICAS DE UN DESINFECTANTE IDEAL. - Actividad antimicrobiana. Debe ser capaz de matar a los microorganismos. A baja concentración debe tener un amplio espectro de actividad antimicrobiana inactiva bacterias (Gram positivas, Gram negativas, micobacterias), virus, hongos, esporas,… - Solubilidad. Debe ser soluble en agua u otros solventes, en la proporción necesaria, para su uso efectivo. - Estabilidad. Durante el almacenamiento los cambios en sus propiedades deben ser mínimos y no deben causar una pérdida significativa de su acción germicida. - No debe ser tóxico para el hombre ni los animales. - Homogeneidad. La preparación debe ser uniforme en composición, de manera que los ingredientes activos estén presentes en cada aplicación. - No se debe combinar con materiales orgánicos extraños. - Debe ser tóxico para los microorganismos a la temperatura ambiente, para que al usar el agente no sea necesario elevar la temperatura más allá de la que se encuentra normalmente en el lugar donde se va a utilizar. - Capacidad para penetrar. Esto no es necesario si se requiere sólo una acción superficial. - No debe ser corrosivo, ni teñir el material que se trate. - Capacidad desodorante. Desodorizar mientras desinfecta es una propiedad deseable. Idealmente el desinfectante debe ser inodoro o tener un olor agradable. - Capacidad detergente. Un desinfectante que sea a la vez detergente cumple 2 objetivos: limpieza y desinfección: la acción limpiadora mejora la efectividad del desinfectante (www.ucv.ve/Farmacia/Micro_web/Catedras02/tema14.pdf -) - Tensión superficial baja - Con efecto residual - Económico (buena relación coste/eficacia) - No dañino para el medio ambiente - No inducir ni desarrollar resistencia (www.academia.cat/societats/famcl/libre/higiene/332.pdf) 6 No existe en el mercado un desinfectante que cumpla todas estas características. Se escoge uno u otro en función del tipo de microorganismos que queremos eliminar, del material sobre el que se apliquen, la temperatura y el pH de trabajo, el tiempo de actuación, la presencia de materia orgánica sobre el material a desinfectar. (www.academia.cat/societats/farmcl/llibre/higiene/332.pdf) 2.3 MODO DE ACCIÓN DE LOS DESINFECTANTES Los desinfectantes químicos actúan sobre las células microbianas de diferentes maneras, de acuerdo con el grupo químico al cual pertenecen y a las características fisicoquímicas de cada uno de ellos. Los principales mecanismos de acción son los siguientes: • Daño de la pared celular. • Alteración de la permeabilidad de la membrana y la pared celular. • Alteración de las moléculas de proteínas y ácidos nucleicos. • Inhibición de la síntesis de ácidos nucleicos. • Inhibición enzimática (www.ucv.ve/Farmacia/Micro_web/Catedras02/tema14.pdf -) 2.4 FACTORES QUE INFLUYEN EN LA ACCIÓN QUÍMICA DE LOS DESINFECTANTES 2.4.1. Limpieza adecuada: Se debe remover la suciedad antes en cada artículo para lograr una desinfección de manera eficaz. (Ninemeier, 2000). 2.4.2. Carga orgánica: La actividad desinfectante puede reducirse debido a la restricción que representan las fuertes cargas orgánicas en los ingredientes activos del desinfectante. Lo recomendable es que un desinfectante haya sido probado con una carga orgánica del 5%. (Ninemeier, 2000). 2.4.3. Tipo y porcentaje de microorganismo: Algunos microorganismos son mas resistentes a desinfectantes líquidos que otros como por ejemplo el bacilo de la tuberculosis. (Ninemeier, 2000). 2.6.4. Tiempo y temperatura: El tiempo indicado para destruir a los microorganismos debe especificarse en la etiqueta de los desinfectantes. Este es el tiempo durante el cual el desinfectante debe permanecer en contacto con el microorganismo para eliminarlo. (Ninemeier, 2000). 2.4.5. pH: Los desinfectantes se formulan dentro de un amplio rango de valores de pH para que sean mas efectivos. Algunos desinfectantes actúan mejor con un pH alcalino mayor que 7 mientras que otros lo hacen en condiciones acidas menor que 7. (Ninemeier, 2000). 7 2.4.6. Nivel de dureza del agua: los minerales como calcio y magnesio también pueden afectar la eficacia de un desinfectante interfiriendo con los ingredientes activos de la misma. (Ninemeier, 2000). Son muchos los desinfectantes químicos que se utilizan para controlar los agentes infecciosos. Existen en el mercado una gran variedad de marcas y fabricantes, pero en general los desinfectantes químicos pertenecen a alguna de las siguientes categorías: • Ácidos o álcalis • Clorados • Glutaraldehído • Mercuriales • Cuaternarios • Alcoholes • Formaldehído • Yodados • Fenoles .(www.academia.cat/societats/farmcl/llibre/higiene/332.pdf) Cuando se deba efectuar una desinfección utilizando desinfectantes químicos, deberá tenerse en cuenta que la resistencia relativa de los agentes a los desinfectantes depende de diversos factores entre los cuales se citan los siguientes: • El tiempo de contacto. • La concentración. • La presencia de material orgánico y suciedad. • La temperatura. • La humedad. • El tipo y número de microorganismos. • La condición y naturaleza de las superficies a descontaminar. • Los errores humanos. Dependiendo de cómo se manipulen los factores mencionados, el éxito logrado con los desinfectantes químicos variará desde una inactivación mínima del microorganismo a tratar, hasta una condición de esterilidad. (www.academia.cat/societats/farmcl/llibre/higiene/332.pdf). 2.5 IMPORTANCIA DE LA EVALUACIÓN DE DESINFECTANTES. 8 La política de adquisición y uso apropiado de desinfectantes es un elemento importante en la lucha contra las infecciones hospitalarias ya que, a causa del aumento de procedimientos de diagnóstico y terapéuticos, aumentan también las oportunidades de introducir gérmenes en cavidades corporales de las que habitualmente están ausentes. Existen métodos físicos y físico - químicos capaces de lograr una esterilización completa pero no siempre pueden ser utilizados en los dispositivos electrónicos u ópticos actuales, de alto costo y con gran presión de uso. Por lo tanto, la desinfección química (los desinfectantes) tiene un importante papel en el tratamiento del medio ambiente sanitario (Tabares, 2002). 2.6. EVALUACIONES DE NEUTRALIZACIÓN COMO EXPERIMENTOS DE CONTROL PARA LOS TEST DE EFICACIA ANTIMICROBIANA. Un test biocida mide la eficacia de un agente antimicrobial a partir del crecimiento aparente en el numero de microorganismos viable. El objetivo principal de un ensayo de eficacia antimicrobial es la determinación exacta de las células sobrevivientes en relación con el tiempo. Este requiere una neutralización efectiva del agente biocida en tiempos de muestreo específicos. Un test biocida cuidadosamente diseñado mide la eliminación de microorganismos a partir del numero de organismos capaces de crecer después de la exposición al agente antimicrobial. Para esto es necesario demostrar la adecuada neutralización del agente biocida para establecer la compatibilidad de los datos obtenidos (Ascenzi, 1996). 2.6.1 Métodos De Evaluación De Desinfectantes: Tres métodos han sido recientemente publicados detallando protocolos de evaluación de los neutralizantes: 2.6.2 Neutralización por inhibición química: Muchos biocidas pueden ser químicamente inactivados. Varios neutralizantes y medios de cultivo de dilución han sido formulados para este fin. Dentro de los más conocidos se encuentra el caldo Letheen y Thioglicolato para inactivar el desinfectante. La eficacia de los neutralizante fue originalmente demostrada con Staphylococcus aureus y posteriormente con una variedad de microorganismos. El caldo Letheen es efectivo en la recuperación de bacterias expuestas a compuestos de amonio cuaternario y biguanidas. El medio Thioglicolato es efectivo contra agentes mercuriales. Sin embargo la inactivación química de biocidas puede ser por si misma para algunas de las bacterias de interés. A pesar de la toxicidad de los neutralizantes, su uso puede ser conveniente debido a que los neutralizantes son de acción rápida (Ascenzi, 1996). 9 2.6.3. Neutralización por dilución: La concentración de un desinfectante ejerce un amplio efecto en su potencia. La relación entre la concentración y el efecto antimicrobial difiere entre los agentes biocidas pero es relativamente constante para un biocida particular. Esta relación es exponencial en la naturaleza (Ascenzi, 1996) 2.6.4 Neutralización por filtración: La dilución de un biocida por filtración es otro medio para neutralizar una solución desinfectante. Este procedimiento se basa en la filtración para separar los microorganismos en suspensión de la solución desinfectante. La membrana es luego removida, y ubicada en la superficie de un agar para luego ser incubada. Los nutrientes pasan a través de la membrana, y se puede posteriormente apreciar el crecimiento de colonias en la superficie de la membrana permitiendo la cuantificación de los microorganismos sobrevivientes. (Ascenzi, 1996). La inhibición del crecimiento puede ocurrir debido a la adherencia del persevante residual a la membrana. La filtración a través de materiales como el difloruro de polivinilo ayuda a disminuir esta adherencia. Adicionalmente, el preservante puede ser diluido o desprendido del filtro mediante enjuague con fluidos como peptona al 0.1%. La filtración por si sola no puede ser asumida como efectiva para la neutralización. La recuperación eficaz de microorganismos sobrevivientes por este procedimiento requiere una demostración de la eficacia de la neutralización mediante uno o varios ensayos. (Ascenzi, 1996). 2.7. FACTORES QUE AFECTAN LA NEUTRALIZACIÓN DE LOS ANTIMICROBIANOS Existen cuatro criterios que deben ser tenidos en cuenta en el diseño de un estudio de neutralización: 1. El neutralizante debe inhibir efectivamente la acción de la solución biocida. 2. El neutralizante no debe ser por si mismo toxico para los microorganismos de ensayo. 3. El neutralizante y el agente activo no se deben combinar para formar un compuesto toxico. 4. Estos criterios deben ser demostrados bajo condiciones similares a las condiciones normales para el empleo del desinfectante. (Ascenzi, 1996). Estos criterios pueden ser considerados por los siguientes factores: 2.7.1. Eficacia del Neutralizante: La eficacia del neutralizante usado en los experimentos de evaluación de bactericidas puede variar tanto con el organismo de estudio como con el biocida. Además, la sensibilidad del organismo al biocida y la concentración del mismo pueden tener un efecto importante en la eficacia del tratamiento de neutralización. Es 10 importante comparar la recuperación de los microorganismos del neutralizador en presencia y ausencia del biocida. Este agente biocida. (Ascenzi, 1996). 2.7.2. Toxicidad del Neutralizante: Diversos inhibidores químicos de antimicrobianos son tóxicos por sí mismos. Este factor puede ser estimado como una comparación en la recuperación entre dos poblaciones una expuesta al bactericida y otra respuesta a buffer fosfato. Los resultados finales deben mostrar microorganismos sobrevivientes en cantidades similares. (Ascenzi, 1996). 2.7.3. Diseños Para Evaluación De Neutralizantes 2.7.3.1. Recuperación en medio sólido: Los ensayos de suspensión para evaluar la eficacia antimicrobial usualmente cuantifican microorganismos sobrevivientes en medio sólido. Los organismos de ensayo son físicamente suspendidos en la solución de ensayo, y se toman alícuotas en intervalos de tiempo para determinar el número de microorganismos sobrevivientes sobre placas de agar. El procedimiento general para estos ensayos involucra la preparación de una suspensión del organismo de ensayo, usualmente a una 6 concentración de 10 UFC/ml. Las muestras son luego diluidas en un neutralizante y en un caldo de dilución. Estos pasos incluyen la neutralización del biocida, la dilución de los microorganismos sobrevivientes a niveles contables y la siembra en placas de agar para su recuperación. (Ascenzi, 1996). 2.7.3.2. Recuperación en medio líquido: Involucra la inoculación de un portador y el ensayo del portador para detectar microorganismos viables después de la desinfección en medio liquido. La inferencia hecha en estos ensayos es que el medio de recuperación permite el crecimiento de todos los microorganismos sobrevivientes al finalizar el periodo de desinfección. La determinación final de la eficacia es basada en la ausencia de crecimiento en el medio de cultivo líquido. Además este caldo debe servir tanto para neutralizar el desinfectante como para soportar el crecimiento de todos los microorganismos. (Ascenzi, 1996) 2.7.3.3. Recuperación por Filtración por Membrana: En este sistema se debe tener en cuenta el tipo de membrana empleado, el equipo de filtración, el medio, el diluyente de neutralización y la solución a ser evaluada. La filtración puede reducir la recuperación de los microorganismos debido a la muerte o adherencia de las células a las paredes de los embudos de filtración. Esta pérdida específica de la técnica puede estimarse comparando la población recuperada en el fluido diluyente con el conteo de células viables. La filtración por membrana permite incorporar un neutralizante especifico en el diluyente para superar el efecto del agente antimicrobial. (Ascenzi, 1996). 11 2.8. NORMATIVA MUNDIAL SOBRE EVALUACION DE DESINFECTANTES Hasta 1997 no existían normas europeas de evaluación de desinfectantes. Los diversos productos desinfectantes se evaluaban según normas oficiales en algunos países, siendo las más habituales las normas francesas AFNOR (Association Française de Normalisation), las alemanas DGHM (Deutsche Gesellschaft für Hygiene und Mikrobiologie) y las estadounidenses EPA y AOAC (Association of Official Analytical Chemists) (Tabares, 2002). 2.8.1. Normas AFNOR (Association Française de NORmalisation) Las normas AFNOR NFT 72 existen desde hace más de 25 años NF T72-170 (noviembre 1988). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua y neutralizables - Determinación de la actividad bactericida en presencia de sustancias interferentes de referencia - Método por dilución - neutralización. NF T72-171 (noviembre 1988). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua - Determinación de la actividad bactericida en presencia de sustancias interferentes de referencia - Método por filtración sobre membranas. NF T72-190 (1988). Desinfectantes de contacto utilizados en el estado líquido, miscibles al agua - Determinación de la actividad bactericida y fungicida y esporicida. NF T72-230 (1988). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua y neutralizables - Determinación de la actividad esporicida - Método por diluciónneutralización. NF T72-231 (1988). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua - Determinación de la actividad esporicida - Método por filtración sobre membranas. NF T72-281 (septiembre 1986). Procedimientos de desinfección de las superficies por vía aérea - Determinación de la actividad bactericida y fungicida y esporicida T72-300 (noviembre 1989). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua - Prueba(Ensayo) de suspensión por dilución-neutralización - Determinación de la eficacia de los productos sobre microorganismos diversos en las condiciones prácticas de empleo. T72-301 (noviembre 1989). Antisépticos y desinfectantes utilizados en el estado líquido, miscibles al agua - Prueba(Ensayo) de suspensión por filtración sobre membranas Determinación de la eficacia de los productos sobre microorganismos diversos en las condiciones prácticas de empleo 2.8.2. Normativa Europea Los proyectos europeos definidos por el Comité CEN/TC 216 se elaboran en tres fases: 12 • Fase 1: normas básicas de suspensión en agua destilada. Estas normas demuestran la existencia de alguna actividad en condiciones favorables. Sirven para calificar el producto de bactericida, fungicida ó esporicida. • Fase 2: normas de aplicación. En cada uso, las normas reproducen condiciones similares a los usos esperados del producto, en los campos agro-alimentario, industrial, médico y veterinario. Fase 2 – etapa 1: ensayos de suspensión con sustancias interferentes. Fase 2 – etapa 2: ensayos sobre superficies, como los portagérmenes de acero (desinfectantes) o las manos (antisépticos). • Fase 3: ensayos en el sitio. Por el momento, no existe ninguna norma de fase 3 (ICONTEC, 2006. NTC 5446) UNE-EN 1040:2006. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad bactericida básica de los antisépticos y desinfectantes químicos. Método de ensayo y requisitos (fase 1) UNE-EN 1275:2007. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad fungicida o levuricida básica de los antisépticos y desinfectantes químicos. Método de ensayo y requisitos (fase 1). UNE-EN 1276:1998. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad bactericida de los antisépticos y desinfectantes químicos utilizados en productos alimenticios, en la industria, en el hogar y en colectividad. Método de ensayo y requisitos (fase 2, etapa 1). UNE-EN 13610:2003. Desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad viricida frente a bacteriófagos de los desinfectantes químicos utilizados en el ámbito agroalimentario y en la industria. Método de ensayo y requisitos (fase 2, etapa 1). UNE-EN 13624:2004. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad fungicida de los desinfectantes químicos para instrumental utilizado en medicina. Método de ensayo y requisitos (fase 2, etapa 1). UNE-EN 13697:2002. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de superficie no porosa para la evaluación de la actividad bactericida y/o fungicida de los desinfectantes químicos utilizados en productos alimenticios, en la industria, en el hogar y en colectividad. Método de ensayo sin acción mecánica y requisitos (fase 2/etapa 2). UNE-EN 13697:2002 ERRATUM:2007. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de superficie no porosa para la evaluación de la actividad bactericida y/o 13 fungicida de los desinfectantes químicos utilizados en productos alimenticios, en la industria, en el hogar y en colectividad. Método de ensayo sin acción mecánica y requisitos (fase 2/etapa 2). UNE-EN 13704:2002. Desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad esporicida de los desinfectantes químicos utilizados en productos alimenticios, en la industria, en el hogar y en colectividades. Método de ensayo y requisitos (fase 2, etapa 1). UNE-EN 13727:2004. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad bactericida de los desinfectantes químicos para instrumental utilizado en medicina. Método de ensayo y requisitos (fase 2, etapa 1). UNE-EN 14204:2004. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad micobactericida de los antisépticos y desinfectantes químicos utilizados en veterinaria. Método de ensayo y requisitos (fase 2, etapa 1). (www.aenor.es/desarrollo/normalizacion/normas/buscadornormas.asp?pag=p - 122k -) 2.8.3. Normativa estadounidense. ASTM: Sociedad American Section of the International Association for Testing Materials (organismo de normalización de los Estados Unidos de América) ASTM E-2197-02. Standard Quantitative Disk carrier test method for determining the bactericidal, virucidal, fungicidal, mycobactericidal and sporicidal activities of liquid chemical germicides. ASTM International. Pa. USA. (Prueba de disco portador para actividades bactericida, virucida, fungicida, micobactericida y esporicida de germicidas químicos líquidos). ASTM E-2197-02. Standard Quantitative Disk carrier test method for determining the bactericidal, virucidal, fungicidal, mycobactericidal and sporicidal activities of liquid chemical germicides. ASTM International. Pa. USA. (Prueba de disco portador para actividades bactericida, virucida, fungicida, micobactericida y esporicida de germicidas químicos líquidos).( www.ivami.com/ - 10k) 2.8.4. Normativa Colombiana. NTC 4672 (primer actualización de 287/04 desinfectantes para uso hospitalario. Requisitos microbiológicos. 14 NTC 5408 2006-02-22. Método cuantitativo en suspensión para determinar la actividad tuberculicida de un desinfectante de alto nivel soluble en agua para uso hospitalario. NTC 5473 2007-03-21 desinfectantes químicos. Ensayo cuantitativo de suspensión para la evaluación de la actividad bactericida de los desinfectantes químicos para instrumental utilizado en el sector salud. Método de ensayo y requisitos (fase 2 etapa 1) 15 3. JUSTIFICACIÓN. La limpieza y la desinfección son aspectos primordiales que deben ser tenidos en cuenta a la hora de evaluar si un proceso es o no satisfactorio. La presencia de microorganismos contaminantes o ajenos al proceso es en muchos casos inevitable, pero depende de un correcto y adecuado proceso de desinfección. Es importante no solo escoger el desinfectante adecuado, sino determinar que la concentración a la cual se emplea es la más eficaz y la más rentable para quien lo utiliza. Por ello, la importancia de este proyecto de investigación consiste en demostrar experimentalmente, la eficacia del método dilución neutralización. Es por esto que este proyecto surge en respuesta a la necesidad de encontrar mecanismos estandarizados que aseguren la correcta determinación de la concentración bactericida de un desinfectante, útil al momento de emplear una sustancia química que disminuya la carga microbiana del instrumental empleado en el sector salud. La importancia de esta investigación radica en la posibilidad de economizar tiempo, producto desinfectante y dinero, a la vez de obtener seguridad en el proceso de desinfección, a través de una metodología estandarizada y normatizada por el Instituto de Normas Técnicas y Certificación ICONTEC. La precisión de esta metodología determinada por medio de la repetibilidad de los ensayos evaluados en esta investigación, permite demostrar la veracidad del procedimiento empleado y la seguridad de obtener en posteriores ensayos, resultados similares, verificables y con seguridad, contundentes. Finalmente, la relevancia de esta investigación radica en que constituye una manera útil de verificar la utilidad de la técnica dilución neutralización para la evaluación de desinfectantes en cualquier ámbito, con el fin de establecerla en caso de encontrarse un procedimiento de desinfección inadecuado. 16 4. OBJETIVOS. 4.1. OBJETIVO GENERAL. Evaluar el método dilución neutralización aplicado a un desinfectante en gel a base de alcohol, según la Norma Técnica Colombiana 5473 de 2007. 4.2. OBJETIVOS ESPECIFICOS • Establecer las condiciones experimentales para la implementación del método de ensayo dilución-neutralización. • Implementar el método de ensayo dilución-neutralización, utilizando un desinfectante en gel a base de alcohol, según la norma técnica colombiana 5473 del 2007. • Verificar la efectividad del método de ensayo dilución-neutralización, para la evaluación de un desinfectante en gel a base de alcohol. • Reportar los resultados obtenidos por medio de la elaboración de un informe del ensayo y un artículo científico, estableciendo un protocolo de esta metodología para ser aplicado en VICAR FARMACÉUTICA S.A. 17 5. MATERIALES Y MÉTODOS. 5.1 Diseño de la investigación (experimental o de investigación): El diseño de la investigación es de tipo experimental ya que se busca estandarizar, implementar y verificar el protocolo de dilución neutralización de la NTC 5473. Para ello se evaluaron variables como tiempo de contacto, temperatura de exposición, concentración de desinfectante, sustancias interferentes y cepas microbianas 5.1.1 Población de estudio y muestra: El objeto de estudio fue un desinfectante a base de alcohol 70%, empleado en el sector salud para la higiene de las manos. El producto fue sometido a las diferentes condiciones experimentales, a su concentración de uso. 5.1.2 Variables del estudio: Las variables del estudio fueron el desinfectante a evaluar, las cepas de referencia Pseudomonas aeruginosa, Staphylococcus aureus y Enterococcus hirae; el tiempo de contacto entre el desinfectante y cada uno de los microorganismos empleados, la temperatura y las sustancias interferentes. 5.2 Métodos: 5.2.1. Materiales: Tubos de ensayo. Frascos Schott de 500ml y 1000ml. Pipetas graduadas de 10 ml. Micropipeta de 100 a 1000µl. Cajas de petri de tamaño 90 mm a 100 mm. Asas desechables estériles. 5.2.2. Medios de cultivo: TSA agar tripticasa soya 5.2.3. Reactivos: Solución de cloruro de sodio triptona. 18 Solución de cloruro de sodio. Neutralizante: caldo Letheen Agua destilada estéril. Solución de albúmina de suero bovino Solución de albúmina de suero bovino y eritrocitos de oveja. 5.2.4. Equipos: Autoclave. Baño de agua. Incubadora. Cronómetro. Estufa. Horno de secado. Vortex. Centrífuga. Cámara de flujo laminar. 5.3. Metodología: 5.3.1. Establecimiento de las condiciones experimentales para el método de ensayo dilución-neutralización. Para la ejecución de la metodología, se tuvieron en cuenta las condiciones estipuladas por la norma. En cuanto a la temperatura, se consideró la temperatura obligatoria de 20º+/-1ºC y como temperatura adicional se empleó 36º +/- 1ºC. Para determinar el tiempo de contacto entre el desinfectante y los microorganismos de prueba, se llevó a cabo un ensayo preliminar utilizando el tiempo obligatorio de 60 minutos y cinco tiempos adicionales (0, 5, 10, 15 y 30 minutos). A partir de este ensayo se establecieron las condiciones particulares de este ensayo. Tabla 1. Las sustancias interferentes manejadas en el ensayo fueron solución de albúmina de suero bovino 0.3g/L en condiciones limpias y una mezcla de eritrocitos de oveja 3ml/L con solución de albúmina de suero bovino 3g/L para simular condiciones sucias. Para la preparación de la solución de albúmina de suero bovino se tomaron 48 microlitros de albúmina para preparar 160ml de solución. Para la solución que contenía eritrocitos (Condiciones sucias), se 19 tomaron 8ml de sangre de oveja desfibrinada estéril y se centrifugaron cuatro veces durante 10 minutos. Luego de desechar el sobrenadante se suspendió el precipitado en 8ml de diluyente para centrifugar de nuevo, hasta que el sobrenadante era amarillo claro o incoloro. Finalmente se tomaron 480 microlitros de eritrocitos en 160 ml de diluyente y 480 microlitros de albúmina de suero bovino. Los organismos de ensayo utilizados fueron los estipulados por la norma: Pseudomonas aeruginosa ATCC 15442, Staphylococcus aureus ATCC 6538 y Enterococcus hirae ATCC 10541. 20 5.3.2. Implementación del método de ensayo dilución-neutralización según la norma técnica colombiana 5473 del 2007. 5.3.2.1. Preparación de las suspensiones de los microorganismos de ensayo. Se prepararon dos suspensiones diferentes de cada microorganismo de ensayo: la suspensión de ensayo para efectuar el ensayo y la suspensión de validación para efectuar la validación de los controles y el método. Para preparar el cultivo de trabajo de los organismos de ensayo se realizo un cultivo de primera generación mediante siembra sobre medio TSA, incubando 24h a 37 °C. a partir de este cultivo se preparo un segundo subcultivo de la misma forma incubando durante un tiempo de 24h. a partir de este segundo subcultivo de preparo un tercer pase mediante el cual se realizo la suspensión de ensayo. Para esto se transfirieron asas de células al diluyente, ajustando el numero de células a un valor 8 8 comprendido entre 1.5 x 10 ufc/ml y 5.0 x 10 ufc/ml, mediante medición de absorbancia -6 utilizando un espectrofotómetro. Para el recuento se prepararon diluciones 10 y 10 -7 y se tomo una muestra de 1 ml de cada dilución por duplicado, inoculando utilizando la técnica de vertido en placa en medio TSA. Las cajas se incubaron durante 24h a 37°C. 5.3.2.2. Preparación de las suspensiones del organismo de validación. Se diluyo la suspensión de ensayo una cuarta parte de la dilución 10 2 -5 para obtener una 3 concentración comprendida entre 3 x 10 ufc/ml y 1.6 x 10 ufc/ml. Para el recuento se -1 preparo una dilución 10 y se tomo una muestra de 1 ml por duplicado utilizando la técnica de vertido en cajas en agar TSA. Las cajas se incubaron durante 24 h a 37°C. 5.3.2.3. Determinación de la actividad bactericida. Se pipeteó 1,0 ml de la sustancia interferente en un tubo. Se añadió 1,0 ml de la suspensión de ensayo. Se activó inmediatamente un cronómetro, se mezcló y se colocó el tubo en un baño de agua controlado a cada una de las temperaturas del ensayo. Transcurrido el tiempo, se añadió 8,0 ml del producto a evaluar. Se activó de nuevo el cronómetro al comienzo de la adición, se mezcló y se colocó el tubo en un baño de agua controlado a cada una de las temperaturas seleccionadas para cada uno de los tiempos de contacto seleccionados. Antes del final de cada uno de los tiempos, se mezcló de nuevo. Al terminar cada uno de los tiempos seleccionados, se tomó una muestra de 1,0 ml de la mezcla del ensayo Na y se transfirió a un tubo con 8,0 ml del neutralizante y 1,0 ml de agua. Se mezcló y se colocó en un baño de agua controlado a 20°C. Después de un tiempo de 21 neutralización de 5 min, se tomó inmediatamente una muestra de 1,0 ml de la mezcla del ensayo neutralizada Na por duplicado y se inoculó utilizando la técnica de vertido en placa, se incubó y se realizó recuento. 5.3.2.4. Verificación de la ausencia de cualquier efecto letal en las condiciones del ensayo (parámetro A de la condición experimental): Se pipeteó 1,0 ml de la sustancia interferente utilizada en un tubo. Se añadió 1,0 ml de la suspensión de validación, se activó inmediatamente el cronometro, se mezcló y se colocó el tubo en el baño de agua controlado a cada una de las temperaturas del ensayo durante 2 min. Transcurrido este tiempo, se añadió 8,0 ml de agua dura. Se activó de nuevo el cronómetro al comienzo de la adición, se mezcló y se colocó el tubo en el baño de agua controlado a cada una de las temperaturas del ensayo y durante cada uno de los tiempos seleccionados. Antes del final del tiempo, se mezcló de nuevo; transcurrido el tiempo seleccionado, se tomó una muestra de 1,0 ml de la mezcla de ensayo A por duplicado e se inoculó utilizando la técnica de vertido en cajas; se incubó y se realizó recuento. 5.3.2.5. Verificación de la ausencia de toxicidad del neutralizante (parámetro B de control del neutralizante): Se pipetearon 8,0 ml del neutralizante y 1,0 ml de agua en un tubo. Se añadió 1,0 ml de la suspensión de validación. Se activó el cronómetro al comienzo de la adición, se mezcló y se colocó el tubo en un baño de agua controlado a 20°C durante 5 min. Antes de concluir este tiempo, se mezcló transcurrido este tiempo, se tomó una muestra de 1,0 ml de esta mezcla B por duplicado y se inoculó utilizando la técnica de vertido en cajas; se incubó y se contaron las colonias. 5.3.2.6. Parámetro de estandarización del método: Se pipeteó 1,0 ml de la sustancia interferente en un tubo. Se añadió 1,0 ml de diluyente y se activó el cronómetro, se añadieron 8,0 ml del producto. Se mezcló y se colocó el tubo en un baño de agua controlado a cada una de las temperaturas del ensayo durante cada uno de los tiempos del ensayo; antes de concluir este tiempo, se mezcló de nuevo; transcurrido cada uno de los tiempos del ensayo, se transfirió 1,0 ml de la mezcla a un tubo con 8,0 ml de neutralizante. Se activó de nuevo el cronómetro al comienzo de la adición. Se mezcló y se colocó el tubo en un baño de agua controlado a 20°C durante 5 min. Se añadió 1,0 ml de la suspensión de validación. Se activó un cronómetro al comienzo de la adición y se mezcló. Se colocó el tubo en un baño de agua controlado durante 30 min. Antes 22 de concluir el tiempo, se mezcló de nuevo; transcurrido este tiempo, se tomó una muestra de 1,0 ml de la mezcla C por duplicado y se inoculó utilizando la técnica de vertido en cajas; se incubó y se contaron las colonias. 5.3.2.7. Incubación y recuento de la mezcla de ensayo y de las mezclas de control y estandarización: Se incubaron las cajas durante 24 h. Se realizó el recuento de las cajas y se determinó el número de unidades formadoras de colonias (ufc) en cada caja. Se anotó para cada placa el número exacto de colonias, se registró mayor a 330 para cualquier recuento mayor a 330 respectivamente, y se determinaron los valores Vc. Se calculó la cantidad de ufc/ml en la mezcla de ensayo Na y en las mezclas de verificación A, B y C. Figura 2. PREPARACIÓN DE LAS SUSPENSIONES DEL ORGANISMO DEL ENSAYO Cultivo de primera generación Subcultivar en medio TSA Incubar entre 18h – 24h Crecimiento masivo y puro del microorganismo de ensayo 23 NO SI Subcultivar en medio TSA (segundo subcultivo) Incubar entre 18h – 24h Crecimiento masivo y puro del microorganismo de ensayo Cultivo de trabajo SI Subcultivar en medio TSA (tercer subcultivo) Incubar entre 18h – 24h 24 NO Crecimiento masivo y puro del microorganismo de ensayo SI Cultivo de trabajo Transferir asadas Frasco schott de 500ml con 300 ml de solución salina Agitar en vortex 25 NO Transferir 10 ml de esta muestra a un tubo Adicionar solución salina Leer absorbancia en el espectrofotómetro Lectura mayor a 0.198 Lectura de abs.: 0.198 correspondiente al valor teórico del patrón 1 de Mac Farland SI -6 Preparar diluciones 10 y -7 10 con solución salina Sembrar cada una de las diluciones por duplicado en medio TSA Incubar entre 24h a 37°C. 26 Lectura menor a 0.198 NO Recuento entre 1.5 8 x 10 ufc/ml y 5.0 x 8 10 ufc/ml SI Suspensión de ensayo Diluir esta suspensión con solución salina, aprox. Una -5 cuarta parte la dilución 10 -1 Preparar dilución 10 y sembrar en medio TSA Incubar 24h a 37°C. Recuento entre 3.0 2 x 10 ufc/ml y 1.6x 3 10 ufc/ml 27 NO SI Suspensión de validación Ensayo NA (determinación de la ac4vidad bactericida) Sustancia interferente Suspensión de ensayo Pipetear 1,0 ml Pipetear 1,0 ml Tubo de ensayo Mezclar con vortex 10s Colocar tubo en baño de agua controlado a temperatura de ensayo 28 T2= 36 (±1)°C T1= 20 (±1) °C AcNvar cronómetro durante 2 min Solución de ensayo del desinfectante 8,0 ml Colocar tubo en baño de agua controlado a temperatura T1= 20 (±1) °C °C t A=0 min T2= 36 (±1) °C t B=2 min t C=5 min Tomar 1,0 ml de la mezcla de ensayo Na Tubo con 8,0 ml de neutralizante y 1,0 ml de agua Mezclar con vortex 10s. Colocar tubo en baño de agua controlado a 20 ±1°C 29 t D=10 min Dejar neutralizar durante 5 min Tomar muestra de 1,0 ml de esta mezcla por duplicado Sembrar por la técnica de verNdo en cajas. Incubar a 37°C, 24h SI Recuento N0 7 entre 1.5x10 7 ufc/ml y 5x10 ufc/ml NO Ensayo no valido Ensayo valido. (cumple especificacion NTC) RepeNr ensayo 30 Parámetro A de control de la condición experimental Sustancia interferente Pipetear 1,0 ml en un tubo Suspensión de validación Tomar 1,0 ml Mezclar en Vortex, 10s. Colocar tubo en baño de agua controlado temperatura T1, T2, Agua destilada esteril AcNvar cronómetro, 2min. 8,0 ml Mezclar en Vortex, 10s. Colocar tubo en baño de agua controlado a las temperaturas del ensayo T1, T2, durante los Nempos del ensayo tA, tB, tC, t D 31 Tomar una muestra de 1,0 ml de la mezcla de ensayo A por duplicado Sembrar por la técnica de de verNdo en cajas. Incubar a 37°C, 24h SI Recuento igual o superior a 0.5xNvo NO Ensayo no valido Ensayo valido. (Cumple especificación NTC) RepeNr ensayo 32 Parámetro B de control del neutralizante (Verificación de la ausencia de toxicidad del neutralizante) Neutralizante Suspensión de validación Pipetear 8,0 ml en un tubo Agua Pipetear 1,0 ml Añadir 1,0 ml AcNvar cronómetro Colocar tubo en baño de agua controlado a 20 (±1)°C, 5 min Mezclar en Vortex 10s Tomar muestra de 1,0 ml de esta mezcla B por duplicado Inocular uNlizando la técnica de verNdo en cajas Incubar a 37°C, 24 h. 33 SI Recuento igual o superior a 0.5xNvo Ensayo valido. (cumple especificacion NTC) NO Ensayo no valido RepeNr ensayo Parámetro C. Estandarización del método. Sustancia interferente Diluyente Desinfectante Pipetear 1,0 ml 1,0 ml 8,0 ml Colocar tubo en baño de agua T1 T2 durante tA. tB. tC. tD. 34 Mezclar en Vortex 10s Transferir 1,0 ml de la mezcla Tubo con 8,0 ml de neutralizante AcNvar cronómetro, 5min. Colocar el tubo en un baño de agua controlado a 20(±1)°C Suspensión de validación 1,0 ml AcNvar cronómetro, 30 min. Mezclar en vortex 10s Colocar el tubo en un baño de agua controlado a 20 (±1)°C 35 SI Recuento igual o superior a 0.5xNvo Ensayo valido. (cumple especificacion NTC) NO Ensayo no valido RepeNr ensayo 36 5.3.3. Verificación de la metodología Se llevó a cabo de acuerdo con los numerales 5.7 y 5.8 de la NTC 5473 del ICONTEC, mediante la comparación de la media aritmética de las replicas de los resultados obtenidos con los límites básicos (tabla 2) establecidos por la norma (Anexo 3). Tabla 2. Límites básicos establecidos por la NTC 5473 del ICONTEC. N 8 8 8.17 = LOG N = 8.70 7 7 7.17 = LOG No = 1.5 * 10 ufc/mL y 5 * 10 ufc/mL No 1.5 * 10 ufc/mL y 5 * 10 Está comprendido entre ufc/mL 7.70 Nvo 30 ufc/mL y 160 ufc/mL Nv 300 ufc/mL y 1600 ufc/mL A,B,C Son iguales o superiores a 0.5 (Nvo) Al menos una concentración debe demostrar un LOG R ≥ 5 y al menos una concentración debe demostrar un LOG R < 5 En el control de los recuentos de los valores medios ponderados el cociente no es inferior a 5 ni superior a 15 5.4. Recolección de la información. Para recolectar la información se emplearon los parámetros establecidos por la norma técnica colombiana 5473 a partir de la cual se tuvo en cuenta los procedimientos experimentales para la determinación de la actividad bactericida del desinfectante empleado. Además se obtuvo información partir de consulta bibliográfica con el fin de determinar los mecanismos de acción del proceso de desinfección y su aplicación en instrumental médico. Para la recopilación de los datos experimentales se empleó una matriz en la cual se registraron los resultados obtenidos en cada una de las replicas a las condiciones de 37 tiempo, temperatura, tipo de microorganismo, interferente y concentración del desinfectante evaluados. Por otra parte se emplearon tablas en la cual se registraron los resultados obtenidos a partir del conteo de células/ ml en cada uno de los ensayos y en los controles realizados. 5.5. Análisis de información Inicialmente se hizo una determinación de los valores Vc, que son los valores experimentales que se obtuvieron en el método de dilución-neutralización. Estos valores incluyen los valores de ensayo y los controles. En el método de dilución-neutralización se tuvo en cuenta valores Vc entre un limite entre 14 y 130 colonias. Para el calculo del numero de células/ ml de la suspensión de ensayo se calculó la media aritmética ponderada de los recuentos de dos diluciones escogidas de esta suspensión. Para esto se utilizara la siguiente formula: N= c (n1 + 0.1 n2 ) 10 -6 En donde: C es la suma de los valores Vc tenidos en cuenta; -6 N1 es el numero de los valores Vc tenidos en cuenta en la dilución inferior, es decir (10 ); -7 n2 es el numero de valores Vc tenidos en cuenta en la segunda dilución, es decir (10 ); -6 10 es el factor de dilución correspondiente a la dilución inferior. Para determinar el numero de células/ml en la mezcla de ensayo al comienzo del tiempo de contacto (No) es decir, al tiempo cero, se obtuvo la decima parte de la media aritmética ponderada de N (numero de células/ml en la suspensión de ensayo) debido a que por la adición del producto y de la sustancia interferente se obtiene una dilución a la decima parte. Para la determinación del número de microorganismos supervivientes/ml en la mezcla de ensayo al final del tiempo de contacto y antes de la neutralización (Na), se empleó la siguiente formula: Na= c x 10 n 38 en donde: c es la suma de los valores Vc tenidos en cuenta; n es el número de valores Vc tenidos en cuenta. Para calcular el número de células/ en la suspensión de validación Nv y el número de células/ml en las mezclas A, B, C al comienzo del tiempo de contacto (Nvo),se empleó la siguiente formula: Nv = c x 10 n Nvo= c n en donde: c es la suma de los valores Vc tenidos en cuenta; n es el número de valores Vc tenidos en cuenta. Para calcular el numero de sobrevivientes en el control de las condiciones experimentales (tiempo, temperatura, sustancia interferente), control del neutralizante y estandarización del método al final del tiempo de contacto, se empleó las siguiente formula: A, B, C = c n 39 donde : c es la suma de los valores Vc tenidos en cuenta; n es el número de valores Vc tenidos en cuenta La tabulación de los datos se hizo teniendo en cuenta la matriz de resultados relacionando lo obtenido en cada uno de los ensayo con las condiciones experimentales trabajadas. (Anexo3). 40 6. RESULTADOS Y DISCUSIÓN 6.1. Establecimiento de las condiciones experimentales para el método de ensayo dilución-neutralización. Las condiciones experimentales establecidas por la norma no presentaron modificaciones, a excepción del tiempo de contacto de 60 min, el cual fue omitido ya que las especificaciones del producto sugieren un tiempo de contacto corto para ejercer su acción bactericida. Se establecieron los tiempos de contacto 2, 5 y 10 minutos, luego de un ensayo preliminar que demostró que el producto ejercía acción bactericida en el menor tiempo de contacto (5 minutos). Las condiciones experimentales obligatorias y adicionales aplicadas en el ensayo se consignan en la tabla 1. 6.2. Implementación y Verificación del método de ensayo dilución-neutralización según la norma técnica colombiana 5473 del 2007. 6.2.1. Preparación de la Suspensión de Ensayo y Validación Para implementar el procedimiento de preparación de las suspensiones de Ensayo y Validación se trabajó inicialmente con la cepa de Staphylococcus aureus ATCC 6538. Para esto se tomó como referencia el tubo Nº 1 del patrón de McFarland cuya concentración 8 celular es equivalente a 3x10 UFC/ml, para cumplir con las exigencias de la norma que 8 determina que el recuento en esta suspensión debe ser entre 1.5x10 UFC/ml y 5.0x10 8 UFC/ml. La absorbancia reflejada por el patrón de McFarland fue 0.225 así que la suspensión fue calibrada hasta alcanzar una absorbancia de 0.2. Sin embargo, al realizar el 9 recuento este fue de 4x10 por lo cual fue necesario preparar una suspensión nueva. Se realizaron de nuevo los tres pases necesarios de la cepa y se ajustó la absorbancia tanto del patrón como de la suspensión. De forma similar el recuento no cumplía con las especificaciones de la norma. De acuerdo con lo anterior, se sugirió trabajar la suspensión utilizando solución salina como diluyente omitiendo la adición de triptona, ya que se tenía como hipótesis que esto podría estar interfiriendo con la absorbancia propia de la suspensión. Esto debido a que la triptona, posee una coloración amarilla que podría estar afectando los resultados emitidos por el colorímetro. Para comprobar este planteamiento se prepararon dos suspensiones, una empleando únicamente solución salina como diluyente y la otra utilizando el diluyente 41 especificado en la norma, es decir, solución salina más triptona. La absorbancia de ambas suspensiones fue similar al patrón de McFarland (0.199). Los resultados de los recuentos reflejaron que efectivamente, la suspensión elaborada solo con solución salina cumplía con las especificaciones de la norma Tabla 3, mientras que el recuento de la suspensión elaborada con triptona excedía los requerimientos de la norma. A partir de la Suspensión de Ensayo, se preparó la suspensión de validación, siguiendo las -5 especificaciones de la norma, es decir a partir de una cuarta parte de la dilución 10 de la Suspensión de ensayo. Igualmente se utilizó como diluyente solución salina y el recuento fue adecuado para llevar a cabo el procedimiento. Tabla 3. Para preparar la suspensión de Pseudomonas aeruginosa cepa ATCC 15442, se siguió el procedimiento descrito para la suspensión de Staphylococcus aureus, es decir, a partir del 9 patrón de McFarland. Sin embargo al realizar el recuento este era muy alto (10 ). Se pudo notar, que la turbidez que proporcionaba una colonia de P. aeruginosa era mayor comparada con una colonia de S. aureus. Por esta razón, se ajustó la absorbancia a un valor medio (0.16). Esta absorbancia emitió un recuento que permitió trabajar con esta suspensión y elaborar a partir de ella, la suspensión de validación. Tabla 3. Se ha reportado que Pseudomonas aeruginosa es un microorganismo formador de biopeliculas. Este tipo de microorganismos son capaces de producir polisacáridos y glicoproteinas para formar agregados entre si (Wirtanen. G, 2001). Este factor puede influir en la notoria turbidez generada por este microorganismo. Por esta razón no es recomendable emplear el patrón de McFarland para ajustar suspensiones de Pseudomonas aeruginosa. Para ello es posible elaborar una suspensión de alta concentración a partir de la cual se generen diluciones seriadas en base diez. Cada una de las diluciones se siembra por duplicado en agar TSA y se mide la absorbancia. Luego se genera una curva de UFC/ml vs. Absorbancia y por interpolación es posible realizar una aproximación que permita determinar a qué absorbancia se debe ajustar la suspensión para lograr el recuento deseado. En otros estudios como el realizado por Espigares. E, et.al., 2003; se recomienda ajustar espectofotométricamente la densidad de las suspensiones bacterianas a 620 nm de longitud de onda, para obtener una absorbancia de 0.2 a 0.3 para bacilos Gramnegativos y de 0.3 a 0.4 para cocos Grampositivos, lo cual puede ser útil al momento de preparar una suspensión 8 con un recuento comprendido entre 1 y 3x10 UFC/ml. 42 Por otra parte, para preparar la suspensión de la cepa de Enterococcus hirae, se utilizó como referencia la absorbancia emitida por la suspensión de S.aureus (0.19) al tratarse de microorganismos Grampositivos con morfología microscópicamente similar. La absorbancia final de la suspensión fue 0.18. El recuento establecido fue el adecuado para trabajar con esta suspensión. Tabla 3. Finalmente, se consideró como punto crítico de la evaluación del método, la preparación de las suspensiones, debido a que es la parte esencial que determina el éxito de los resultados y del procedimiento. Tabla 3. UFC/mL en las suspensiones bacterianas de Ensayo (N) y validación (NV) Microorganismo N LIMPIO 6.2.2. P aeruginosa 1,6 * 10 S. aureus 1,8*10 E. hirae 4.6 * 10 8 8 8 NV SUCIO 1,9 * 10 1,5*10 8 8 1.5 * 10 8 LIMPIO SUCIO 3,8*10 2 4,4*10 2 4,2*10 2 3,9*10 2 1.1 * 10 3 3 * 10 2 Evaluación de las condiciones experimentales - Control A. De acuerdo con la norma, los resultados de los recuentos obtenidos los parámetros de control no deben se menores a la mitad del recuento obtenido en cada parámetro al final del tiempo cero de contacto. Esta condición se dio satisfactoriamente en este parámetro, tal como se refleja en los resultados experimentales consignados en la tabla 4. Esto permitió determinar que ni las temperaturas trabajadas (20ºC y 36ºC), ni los interferentes, ni los tiempos de exposición incidieron de forma negativa en el crecimiento de los microorganismos. Anexo 3. Cabe aclarar que el diluyente empleado para el ensayo y los controles siguió siendo el especificado por la norma, excepto en la preparación de las suspensiones en las cuales se utilizó solamente solución salina, y esto no afectó de ninguna manera los resultados obtenidos. Los resultados fueron similares para los dos interferentes. 43 E hirae S.aureus P.aeruginosa Microorganismo Tabla 4. Parámetro A: Control de las condiciones experimentales seleccionadas (Promedio valores Vc UFC). 6.2.3. CONTROL A LIMPIO SUCIO 0min/ 20°C 0 min/ 36°C 2min/ 20°C 2 min/ 36°C 5 min/ 20°C 5 min/ 36°C 10 min/ 20°C 10 min/ 36°C 0min/ 20°C 0min/ 36°C 2min/ 20°C 2min/ 36°C 5min/ 20°C 5min/ 36°C 10min/ 20°C 10min/ 36°C 32 36 30 28 27 19 16 16 37 39 22 28 24 25 20,5 26 34 32 28 30 28 21 19 21 35,5 36,5 25 27,5 21 22,5 26 26 30 30 32 35 32 18 19 15 34 30 27 20,5 27 26 19 22 36 31 32 34 30 16 16 21 32 33 21 23 19 28 25 24,5 38 38 30 30 32 24 14 24 33,5 32,5 20 22,5 24 28 22 28 36 34 28 33 27 21 21 23 35 30 23,5 38,5 22,5 24,5 24,5 24,5 34,5 28,5 37 24,5 21,5 25 28,5 25 34 32 30,5 37 35,5 41,5 31,5 40,5 33 34 33 23 18 22,5 23 26 36 32,5 35 33 37,5 34 35 34 37 36 37 24,5 28,5 21,5 18 30 32 32 39 31,5 36,5 38 34 31,5 38,5 36 33,5 22,5 24 24,5 23 24 31 38 32 35 34,5 35,5 39 30,5 38 32,5 39 21,5 29 25,5 18 24 34,5 39 33 35 34,5 30 35 32 32 37 30 23,5 20 22,5 23 23 30,5 30 33 38 40 31 34,5 35 116 102 96 106.5 121 98 113.5 123 23 29.5 24.5 28.5 24 26 23 31 101 128 100 118 116 114 115 111.5 24 28.5 24.5 27.5 25 27 25 27.5 100 112.5 113 118 108.5 116.6 110 105 27 24 24.5 28 23 26.5 22.5 25.5 114 106 125 109 112 127 131 96 26 25 25 27.5 26 28 22.5 25.5 110 105.5 125 121 115 120.5 111 114 27 26.5 23 30 22 28 25 30 104 110 114.5 103.5 122.5 111 106 102 26.5 29.5 25.5 31.5 24 29 24 28 Verificación de la ausencia de toxicidad del neutralizante – Control B. El método de dilución neutralización implica el enfrentamiento de una suspensión bacteriana y un desinfectante bajo condiciones estándar, y la terminación de la reacción mediante la exposición a un neutralizante. En este estudio se utilizó caldo Letheen que es un medio altamente nutritivo compuesto por lecitina y tween 80, capaz de neutralizar o inhibir la acción 44 de los componentes activos de los desinfectantes. En este caso, el componente activo del desinfectante evaluado fue alcohol. Los datos recopilados en la Tabla 5, muestran que el neutralizante permitió ampliamente el crecimiento de los microorganismos evaluados, y no presentó efectos negativos que llegaran a ocasionar inhibición en los mismos. Ver anexo 3. Tabla 5. Parámetro B: Control del neutralizante (verificación de la ausencia de toxicidad del neutralizante Promedio valores Vc UFC). Microorganismo CONTROL B 33 36 34,5 P. aeruginosa 32 34 37 39 38 39 S. aureus 37 36 40 111 93.5 106.5 E. hirae 117 118 120 6.2.4. Validación del método Dilución Neutralización – Control C De igual manera que en los demás controles, el recuento de todas las replicas en los diferentes tiempos y temperaturas evaluados (Tabla 6), fue superior a la mitad del recuento obtenido en el parámetro al final del tiempo de contacto cero, para los tres microorganismos y las dos condiciones de limpieza simuladas. Ver anexo 3. Debido a que se trata de un procedimiento dispendioso, lo recomendable es que a la hora de aplicar la metodología de la norma se inicie con este control. 45 Este parámetro de control permitió determinar que el método esta diseñado para conocer la acción bactericida de cualquier desinfectante sin generar por si mismo efectos negativos sobre el microorganismo control. Tabla 6. Parámetro C: Validación del método de dilución neutralización (Promedio valores Vc UFC). E. hirae S. aureus p. aeruginosa Microorganismo CONTROL C LIMPIO SUCIO 0 min/ 20°C 0 min/ 36°C 2min/ 20°C 2 min/ 36°C 5 min/ 20°C 5 min/ 36°C 10 min/ 20°C 10 min/ 36°C 0 min/ 20°C 0 min/ 36°C 2 min/ 20°C 2 min/ 36°C 5 min/ 20°C 5 min/ 36°C 10 min/ 20°C 10 min/ 36°C 38 37 36,5 28,5 32 34,5 34 37,5 31,5 33,5 30,5 31,5 34,5 35 38,5 33,5 32 36,5 32,5 31 28,5 37,5 40,5 36 33,5 38 38 37 32 39 30 36 35,5 40 39 29 34 32 36 38 34 33,5 40,5 38,5 34,5 39 30 35 37 33 4 32 36,5 34,5 37 33,5 30,5 32 38 36 31 37 34 30,5 31,5 31,5 33,5 39 40 33 31,5 31,5 37 38 37,5 37,5 31,5 37 30 32,5 30 34 31,5 37,5 33,5 30 33 36 33 35 35,5 34 30 38 30 33 48,5 32 42,5 35 40,5 32 47,5 35,5 40,5 34,5 33,5 36,5 33 34,5 38,5 38,5 43,5 35,5 37,5 41,5 49 39,5 39 37 35,5 33,5 33,5 36,5 37 37,5 38,5 40,5 40 32 43 35,5 55 34,5 42 34 36 36,5 35,5 31,5 35,5 35 38 35 37 32,5 39 41,5 42,5 30,5 54 43,5 35,5 42 32,5 40,5 36 34 38,5 38 40,5 36 38 34,5 44,5 37 46 39 37,5 34 37 38,5 33 33,5 34,5 32,5 39,5 35,5 34,5 32,5 49 34 48,5 38,5 34 39 36,5 34,5 41 37,5 36 30 93.5 115.5 95 114 111.5 95.5 95 105.5 28 28.5 32.5 24 26.5 30.5 26 27 96.5 117 95.5 114.5 107 98 95.5 109 23.5 24.5 25.5 27.5 26 25.5 25 26.5 99 108.5 128.5 100.5 108.5 109.5 128.5 95 33.5 27.5 26 25.5 23.5 24 23.5 24.5 119.5 101 105 94 125 98.5 105 102 25.5 28 29.5 29 27 27.5 25.5 24 122 99.5 115.5 113.5 119 102 115.5 100.5 24 24.5 29 25.5 26 25 27 27 126.5 112 127 95.5 127.5 105.5 127 97.5 25 28.5 25.5 25.5 23.5 26 24 25.5 46 6.2.5. Ensayo NA – Método Dilución Neutralización Para llevar a cabo el método se utilizaron las suspensiones de Ensayo de cada uno de los microorganismos control propuestos en la norma. Se utilizó un desinfectante para manos en gel para estandarizar el procedimiento a una concentración de 80%. El principio activo del desinfectante es alcohol etílico y contiene además glicerina como emoliente y algunos conservantes. Sin embargo, además de permitir la estandarización del método, los desinfectantes de este tipo tienen una amplia utilización en el ámbito medico quirúrgico. Estudios como el realizado por Rochon-Edouard.S., et.al., 2003., establecen la importancia de los desinfectantes de manos basados en alcohol, para la prevención en la transmisión de enfermedades por manos del personal hospitalario. Igualmente, Gaonkar. T.A., et. Al., 2005, manifestaron que los productos basados en alcohol que contienen emolientes, permiten preservar la integridad de la piel a la vez que constituyen una alternativa viable de desinfección rápida. Kampf.G., et.al., 2003, reconocieron que la desinfección de manos con productos que contienen alcohol es considerada la vía mas efectiva para frenar la cadena de transmisión asociada a infección en el sector salud. En el ensayo se trabajaron las seis replicas de cada tiempo y cada temperatura a la vez con el fin de obtener bajo las mismas circunstancias de ensayo resultados precisos. Por razones de tiempo y comodidad se trabajo un interferente con las dos temperaturas seleccionadas (20ºC y 36ºC), con los seis tiempos iniciales (0 min, 5, 10, 15, 30 y 60 min) y las seis replicas para cada control y para el ensayo. Sin embargo los primeros resultados demostraron que para Staphylococcus aureus, luego de los 5 minutos de contacto no había crecimiento, es decir, que en los tiempos 15, 30 y 60 minutos el desinfectante eliminaba los microorganismos presentes y que en situaciones reales no se trabajan en procesos de desinfección en ámbito hospitalario donde se debe asegurar una desinfección rápida. Por esta razón los tiempos de contacto se cambiaron a tiempo 0, 2 minutos, 5 minutos y 10 minutos. En cuanto a la suspensión de ensayo, la norma exige que sea empleada antes de 2 horas luego de su preparación. Por la duración de cada uno de los procedimientos (ensayo y controles) esto no fue posible ya que por día se realizó un solo interferente. Lo que se procedió a realizar, fue conservar la suspensión en refrigeración a 2ºC aproximadamente, para ser empleada con el otro interferente. Sin embargo, se notó una disminución en el recuento tanto de la suspensión de ensayo como en la de validación. Por esta razón fue 47 necesario preparar una suspensión nueva para cada interferente. Los resultados de cada recuento fueron consignados en la Tabla 3. El comportamiento de cada cepa evaluada fue diferente. La cepa de S. aureus solo presentó crecimiento en el tiempo 0, el cual fue mayor a 330 que fue el límite máximo establecido por la norma (Tabla7). Esto debido a que en este tiempo, el desinfectante es neutralizado inmediatamente después de la adición del microorganismo, impidiendo que haya un tiempo de contacto suficiente entre el desinfectante y la suspensión. Tabla 7. Ensayo NA: Determinación de la actividad bactericida del producto (Promedio valores Vc UFC). E. hirae S. aureus P. aeruginosa Microorganismo ENSAYO LIMPIO SUCIO 0 min/ 20°C 0 min/ 36°C 2min/ 20°C 2 min/ 36°C 5 min/ 20°C 5 min/ 36°C 10 min/ 20°C 10 min/ 36°C 0 min/ 20°C 0 min/ 36°C 2 min/ 20°C 2 min/ 36°C 5 min/ 20°C 5 min/ 36°C 10 min/ 20°C 10 min/ 36°C >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 >330 >330 <14 <14 <14 <14 <14 <14 48 Tabla 8. Numero de supervivientes por ml (UFC/ml), en las mezclas de ensayo al final del tiempo de contacto t antes de la neutralización NA Microorganismo P. aeruginosa S. aureus E. hirae LIMPIO SUCIO 2 MIN 20C 2 MIN 36C 5 MIN 20C 5 MIN 36C 10 MIN 20C 10 MIN 36C 2 MIN 20C 2 MIN 36C 5 MIN 20 C 5 MIN 36C 10 MIN 20C 10 MIN 36 C <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 <140 En los demás tiempos evaluados no se presentó crecimiento del microorganismo, con lo cual se comprueba que el desinfectante es capaz de actuar desde 2 minutos de contacto (tabla 8). Estos resultados están de acuerdo con los resultados establecidos en estudios anteriores como en el realizado por Chatterjee. I., et.al., 2006, en el cual concentraciones mínimas de etanol causan ruptura celular y cambios irregulares en la apariencia de las mismas, así como afección en la función de la membrana celular, interferencia en la división celular, afección 49 en el crecimiento, variación en la composición de los ácidos grasos y en la síntesis de proteínas e inhibición en el transporte de nutrientes a la célula. Por otra parte, P. aeruginosa mostró crecimiento leve en todos los tiempos excepto en el tiempo 0 en el que el recuento en todas la replicas fue mayor a 330 (Tabla 7). Debido a que en las replicas de los tiempos 2, 5 y 10 los recuentos oscilaron entre10 y 15 colonias, se tomaron como menores a catorce por especificación de la norma, lo que permitió obtener valores Na menores a 140 (Tabla 8 ). La resistencia de P. aeruginosa es atribuida a varios factores que han sido consignados en diversos estudios. Russel. A.D., 1998, estableció que las bacterias Gramnegativas poseen reducida sensibilidad hacia los desinfectantes comparadas con los estafilococos debido a los lipopolisacaridos de su membrana externa que impiden el flujo de los desinfectantes al interior de la célula. Por otra parte, Gorisch. H, 2003, estableció que P. aeruginosa es capaz de crecer en etanol e inducir enzimas capaces de oxidarlo y metabolizarlo a acetato. En cuanto al comportamiento de E. hirae, se esperaba que fuera similar al de la cepa de S. aureus por la similitud morfológica y tintorial que existe entre estos dos microorganismos. Sin embargo, E. hirae a diferencia de S. aureus presentó crecimiento en los tiempos 2, 5 y 10 de ambos interferentes. Los resultados obtenidos con este microorganismo fueron similares a los de P. aeruginosa, es decir, aunque se presentó crecimiento, el número de colonias fue menor a 12 por lo cual se consideró la especificación de la norma y se reportó el resultado como menor a 140 (Tabla 8). Según el estudio realizado por Sakagami. Et al., 2002, los Enterococos son importantes patógenos nosocomiales cuyo factor de virulencia importante es su resistencia intrínseca y adquirida a muchos agentes antimicrobianos; esto podría explicar el crecimiento de la cepa de E. hirae, en los tiempos de contacto 2, 5 y 10min. En síntesis, el empleo de desinfectantes en gel cuyo principio activo es alcohol, pueden constituir un mecanismo importante de desinfección de manos en el ámbito hospitalario, y para que su efecto sea notorio en bacterias Gramnegativas y otros microorganismos de difícil eliminación se puede aumentar la concentración de alcohol al tiempo que se manejen emolientes que eviten el daño a la piel pero no interfieran en la acción bactericida del desinfectante. 50 7. CONCLUSIONES Se determinó que las condiciones experimentales del ensayo deben establecerse teniendo en cuenta las condiciones reales a las que se verá sometido el desinfectante a evaluar; para este fin, deben tenerse en cuenta las especificaciones del fabricante, el principio activo del desinfectante, su presentación e incluso el lugar donde se va a utilizar. Los resultados obtenidos en este estudio elucidan que el método dilución neutralización de la NTC 5473, resulta confiable para evaluar la actividad bactericida de un desinfectante. De este modo, la norma garantiza a quien emplee su método dilución neutralización, la consecución de resultados confiables y el control de los parámetros que pudieran tener un efecto letal sobre los microorganismos de la prueba. Mediante el análisis de los resultados obtenidos en el ensayo y en los parámetros de control se determinó que no se generan inhibiciones del crecimiento bacteriano por motivos diferentes a la acción del producto a evaluar, tal como la metodología, las condiciones experimentales y la sustancia neutralizante. La elaboración del informe del ensayo permitió reportar y verificar los resultados obtenidos, comparándolos con los límites exigidos por la norma en pro de determinar su validez. 51 8. RECOMENDACIONES. Utilizar solución salina y no el diluyente citado en la norma, para la preparación de las suspensiones de ensayo y validación, ya que este puede interferir con la lectura de la absorbancia. Si la suspensión de ensayo cumple con la absorbancia teórica del patrón número 1 de Mc -5 Farland, al utilizar la cuarta parte de la dilución 10 de la suspensión de ensayo, el recuento de la suspensión de validación cumple con el rango de especificación de la norma. Para la preparación de la suspensión de ensayo de P. aeruginosa y E. hirae, ajustar la suspensión a una concentración alta (abs: 0.2) y realizar el recuento, el cual servirá para preparar las suspensiones por el método de dilución. 52 9. REFERENCIAS Ascenzi, L. 1996. Handbook of disinfectants and antiseptics. New York. Marcel Kekker. Chatterjee.I., Somerville.G.A., Heilmann.C., Sahl.H., Maurer.H.H., and Herrmann.M. 2006. Very low etanol concentrations affect the viability and growth recovery in post-stationaryphase Staphylococcus aureus populations.Applied an Environmental Microbiology. Vol.72, Nº4. 2627-2636p. Gaonkar.T.A., Geraldo.I., Caraos.L., Modak.S.M. 2005. An alcohol hand rub containing a synergistic combination of an emollient and preservatives: prolonged activity against transient pathogens. Journal of Hospital Infection. 59 (12-18). Gorisch. H. 2003. The etanol oxidation system and its regulation in Pseudomonas aeruginosa. Biochimica et Biophysica Acta 1647. 98-102p. Hoh, C.S., y Berry, D.P. 2005. Decontamination and Sterilization. Infection in Surgery. The Medicine Publishing Company.. 282-284p ICONTEC, 2006. NTC 5446. Antisépticos y desinfectantes químicos. Ensayo cuantitativo de suspensión viricida de los antisépticos y desinfectantes químicos. Método de ensayo y requisitos (fase 2 etapa1). 37pp. IRM Institut de Recherché Microbiologique. NORMES FRANCAISES. Rue Newton – ZI MitryCompans 77290 MITRY MORY. www.irm.fr/espagnol/normes.htm - 14k Jaime Rodríguez, Carolina. 2002. Validación de desinfectantes usados en las áreas de producción de una industria farmacéutica en Bogotá. Microbiología Industrial. Pontificia Universidad Javeriana. Facultad de Ciencias. Bogota D.C. 75 pp. Kampf.G., Meyer.B., Goroncy.P. 2003. Comparison of two test methods for the determination of sufficient antimicrobial activity of three commonly used alcohol-based hand rubs for hygienic hand disinfection. Journal of Hospital Infection. 55 (220-225). 53 Ninemeier, J.D. 2000.Principios de desinfección: esterilización y reprocesamiento de instrumental medico y de laboratorio. Grupo editorial Iberoamérica. Quinta edición. México D. F. 341 p. Organización Panamericana de la Salud. 2002. Cabinas de seguridad biológica: uso, desinfección y mantenimiento. Washington, D.C. Rochon-Edouard.S., Pons.J:L., Veber.B., Larkin.M., Vassal.S., Lemeland.J.F. 2003. comparative in vitro and in vivo study of nine alcohol-based handrubs. Association for Professionals in Infection Control and Epidemiology. Vol.32, Nº4. Romero Tabares, Antonio. Actualización 2002. Informe sobre el desinfectante New Ger.... (N-Duopropenida). Consejería de Salud. Agencia de Evaluación de Tecnologías Sanitarias de Andalucía Rodríguez Pérez, Abilio Ubaldo. 2006. Evaluación de la actividad bactericida in vitro de soluciones antimicrobianas en uso. Revista Mexicana de Patología Clínica, Vol. 53, Núm. 2, pp 123-125. Steer, J.2002. Decontamination. Infection. The Medicine Publishing Company. 197-200p. Russell.A.D. 1998. Bacterial resistance to disinfectants: present knowledge and future problems. Journal of Hospital Infection. 43 (57-68). Wirtanen.G., Salo.S., Helander.I.M., Mattila.T. 2001. Microbiological methods for testing disinfectants efficiency on Pseudomonas biofilm. Colloids and Surfaces. 20(37-50). www.academia.cat/societats/farmcl/llibre/higiene/332.pdf www.aenor.es/desarrollo/normalizacion/normas/buscadornormas.asp?pag=p - 122k – www.gastroenlared.com.ar/template.php?pagina=./Articulos/AsistenciaEnEndoscopia/Asisten ciaGE.htm - 32k www.ucv.ve/Farmacia/Micro_web/Catedras02/tema14.pdf - 54 ANEXO 1. METODOLOGIA I 55 ANEXO 2. METODOLOGIA II 56 ANEXO 3 INFORME DEL ENSAYO Identificación de la muestra de desinfectante: Nombre del producto: Número de lote: Fabricante: Condiciones de almacenamiento: Sustancia acNva: Periodo del análisis: Resultados: CLEAN HANDS CL0G0072 ROPIN para VICAR FARMACÉUTICA S.A. Temperatura inferior a 30 ºC Alcohol eelico 70%. NOV/24/2007 hasta ENE/11/2007 Véanse Tablas 9 a 20 Conclusión: De acuerdo con la NTC 5473 del ICONTEC, el lote CL0G0072 del producto CLEAN HANDS, cuando se utiliza como indica el productor (sin diluir), posee actividad bactericida a partir de los dos minutos de contacto a 20 ºC y a 36 ºC tanto en condiciones limpias (0.3 g/L albúmina de suero bovino) como en condiciones sucias (3 g/L albúmina de suero bovino y 3 g/L eritrocitos de oveja); frente a las cepas mencionadas de Pseudomonas aeruginosa, Staphylococcus aureus y Enterococcus hirae. La media aritmética de la reducción de seis 5 réplicas fue mayor a 1.0 x 10 frente a los microorganismos mencionados en todos los casos y bajo la influencia de las variables propuestas. Bogotá Colombia, 2008-01-13 MARÍN DÍAZ JUAN CARLOS 1 NAVARRO PEÑA NATHALIA FERNANDA SANTOS ARÉVALO NATALIA 2 3 1,2,3, Estudiantes de Microbiología Industrial PONTIFICIA UNIVERSIDAD JAVERIANA 57 RESULTADOS DEL ENSAYO, VALIDACIÓN Y CONTROLES Explicaciones: VC: recuentos por ml X: media aritméNca R: reducción Tabla 9. INTERFERENTE LIMPIO 20 C Pseudomonas aeruginosa INTERFERENTE LIMPIO 20 C Pseudomonas aeruginosa NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 34,33 34,42 34,00 X VC 30,00 29,33 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI 17,50 SI CONTROL C 2 min 5 min 10 min X VC 29.5 34.08 35.33 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 34,42 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1,6 * 10 8 1,6 * 10 7 8.2 7.2 SI <140 <140 R ≥ 5? 58 <140 5,058 5,058 SI SI 5,058 SI Tabla 10. INTERFERENTE LIMPIO 36 C Pseudomonas aeruginosa INTERFERENTE LIMPIO 36 C Pseudomonas aeruginosa NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 33,5 34,42 35,33 X VC 31,66 19,83 19,83 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 32,83 33,58 35,41 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 34,42 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.6 * 10 8 1.6 * 10 7 8.2 7.2 SI <140 <140 R ≥ 5? 59 <140 5,058 5,058 5,058 SI SI SI Tabla 11. INTERFERENTE SUCIO 20 C Pseudomonas aeruginosa INTERFERENTE SUCIO 20 C Pseudomonas aeruginosa NV0 CONTROL A Control control A control B X VC C 2 min 5 min 10 min 34,5 34,42 33,25 X VC 23,08 22,91 22,83 SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI 30 ≤ X VC de NVO ≤ 160? CONTROL C 2 min 5 min X VC 36,66 X VC de C ≥ 0.5 NVO de C? SI 10 min 32,25 32,08333 SI SI CONTROL B N 1.9 * 10 N0 8 1.9 * 10 LOG N 7 8.27 LOG N0 7.27 X VC 34,42 X VC de B ≥ 0.5 NVO de B? SI XNA 7.17 ≤ LOG N0 ≤ 7.70? SI 2 min 5 min 10 min 2 min 5 min <140 <140 R ≥ 5? 60 R (LOG(N0/ NA)) <140 10 min 5,13 5,13 5,13 SI SI SI Tabla 12. INTERFERENTE SUCIO 36 C Pseudomonas aeruginosa INTERFERENTE SUCIO 36 C Pseudomonas aeruginosa NV0 CONTROL A control control A control B C 2 min 5 min 10 min X VC 33,5 34,42 35 X VC 26,66 25,66 25,16 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 35,75 37,5 33,42 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 34,42 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.9 * 10 8 1.9 * 10 7 8.27 7.27 SI <140 <140 R ≥ 5? 61 <140 5,13 5,13 5,13 SI SI SI Tabla 13. INTERFERENTE LIMPIO 20 C Staphylococcus aureus INTERFERENTE LIMPIO 20 C Staphylococcus aureus NV0 CONTROL A Control control A Control B C 2 min 5 min 10 min X VC 35,5 38,17 41,5 X VC 34,91 23,5 22,25 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 39,08 46,75 46,16 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 38,17 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.8 * 10 8 1.8 * 10 7 8.25 7.25 SI <140 <140 R ≥ 5? 62 <140 5,11 5,11 5,11 SI SI SI Tabla 14. INTERFERENTE LIMPIO 36 C Staphylococcus aureus INTERFERENTE LIMPIO 36 C Staphylococcus aureus NV0 CONTROL A control control A Control B C 2 min 5 min 10 min X VC 34 38,17 33,92 X VC 23,25 23,58 25,16 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 36,75 34,58 37,91 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 38,17 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.8 * 10 8 1.8 * 10 7 8.25 8.25 SI <140 <140 R ≥ 5? 63 <140 5,11 5,11 5,11 SI SI SI Tabla 15. INTERFERENTE SUCIO 20 C Staphylococcus aureus INTERFERENTE SUCIO 20 C Staphylococcus aureus NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 33 38,17 36,5 X VC 33,75 36,42 34,83 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 34,75 35,91 37,33 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 38,17 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.5 * 10 8 1.5 * 10 7 8.17 7.17 SI <140 <140 R ≥ 5? 64 <140 5.03 5.03 5.03 SI SI SI Tabla 16. INTERFERENTE SUCIO 36 C Staphylococcus aureus INTERFERENTE SUCIO 36 C Staphylococcus aureus NV0 CONTROL A control control A control B C 2 min 5 min 10 min X VC 33,92 38,17 36,58 X VC 34,92 35 33,92 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 36,33 35,33 35,75 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 38,17 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.5 * 10 8 1.5 * 10 7 8.17 7.17 SI <140 <140 R ≥ 5? 65 <140 5.03 5.03 5.03 SI SI SI Tabla 17. INTERFERENTE LIMPIO 20 C Enterococcus hirae INTERFERENTE LIMPIO 20 C Enterococcus hirae NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 107,5 116,5 110,5 X VC 111,8 116 114,6 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 109 117 109 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 116,5 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 4.6 * 10 8 4.6 * 10 7 8.66 7.66 SI <140 <140 R ≥ 5? 66 <140 5,51 5,51 5,51 SI SI SI Tabla 18. INTERFERENTE LIMPIO 36 C Enterococcus hirae INTERFERENTE LIMPIO 36 C Enterococcus hirae NV0 CONTROL A control control A control B C 2 min 5 min 10 min X VC 111,5 116,5 110 X VC 116,5 112,5 108 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 104 100 102 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 116,5 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 4.6 * 10 8 4.6 * 10 7 8.66 7.66 SI <140 <140 R ≥ 5? 67 <140 5,51 5,51 5,51 SI SI SI Tabla 19. INTERFERENTE SUCIO 20 C Enterococcus hirae INTERFERENTE SUCIO 20 C Enterococcus hirae NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 25,4 116,5 25,67 X VC 24 24 24,25 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 27,5 26,33 25,5 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 116,5 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.5 * 10 8 1.5 * 10 7 8.17 7.17 SI <140 <140 R ≥ 5? 68 <140 5,08 5,08 5,08 SI SI SI Tabla 20. INTERFERENTE SUCIO 36 C Enterococcus hirae INTERFERENTE SUCIO 36 C Enterococcus hirae NV0 CONTROL A Control control A control B C 2 min 5 min 10 min X VC 24,5 116,5 28 X VC 29 27,6 29,67 30 ≤ X VC de NVO ≤ 160? SI SI SI X VC de A ≥ 0.5 NVO de A? SI SI SI CONTROL C 2 min 5 min 10 min X VC 26,5 25 26 X VC de C ≥ 0.5 NVO de C? SI SI SI CONTROL B X VC 116,5 X VC de B ≥ 0.5 NVO de B? SI XNA N N0 LOG N LOG N0 R (LOG(N0/ NA)) 7.17 ≤ LOG N0 ≤ 7.70? 2 min 5 min 10 min 2 min 5 min 10 min 1.5 * 10 8 1.5 * 10 7 8.17 7.17 SI <140 <140 R ≥ 5? 69 <140 5,08 5,08 5,08 SI SI SI 70 71