
Emanuel CHRISTIAN SCHOOL QUIMICA 1º de Secundaria Alumno : ……………………………………………………………………………………………………. Docente : JUÁN JOSUÉ, MACARLUPÚ RUIZ Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 1º CLASE Química – 1º Secundaria CIENCIA Y MEDIO AMBIENTE INTRODUCCIÓN La curiosidad y la ambición por conocer algo más, llevó al hombre a descubrir muchos eventos naturales, inicialmente sin explicación lógica, y luego con su razonamiento llega a establecer leyes y principios, así nació la ciencia. Con el estudio de la Ciencia se logró grandes inventos. Actualmente todos los inventos tienen un soporte científico, nada se deja al azar. Este avance científico a desplazado a la naturaleza a tal punto que en algunos momentos no nos interesa si el medio donde vivimos será afectado. CIENCIA Es el conocimiento preciso, cierto y definido de las cosas por sus principios y causas. La ciencia surge del pensamiento para lograr explicar muchos eventos. ECOSISTEMA Es una comunidad de seres vivos cuyos procesos vitales se relacionan entre sí y se desarrollan en función de los factores físicos de un mismo ambiente. Los componentes de un ecosistema pueden ser: I. Los componentes vivos o bióticos como bacterias, plantas, animales y hombre. II. Los componentes no vivos o abióticos como agua, aire, luz, clima, relieve, suelo. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 1 Emanuel CHRISTIAN SCHOOL NIVELES DE ORGANIZACIÓN DE UN ECOSISTEMA I. Individuo: Es un solo ser vivo que posee características para sobrevivir en un ecosistema, cada individuo conserva características de sus antecesores formando así una especie. II. Población: Es un conjunto de individuos de la misma especie que se desenvuelven dentro de un ecosistema. III. Comunidad: Es el conjunto de poblaciones de distintas especies que viven en un mismo espacio. LA CADENA ALIMENTICIA Es una secuencia de productos que sirven de alimentos a todo ser vivo. Los alimentos se convierten en energía para desarrollar las funciones vitales. La cadena alimenticia está formado por: I. Productores: Son las plantas, que fabrican sus propios alimentos. A estas se denominan AUTÓTROFOS. II. Consumidores: Son los animales, que pueden ser primarios como los herbívoros o secundarios como los carnívoros. Estos no pueden fabricar sus propios alimentos, por ello se les llama HETERÓTROFOS. III. Descomponedores: Son los organismos encargados de desintegrar los animales muertos. La adaptación es un proceso que permite sobrevivir a un ser vivo en su medio ambiente. PRACTIQUEMOS 1. Completar: La ______________ es una ____________ que estudia las relaciones de los _____________ con su ambiente. Pág. 2 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2. Relacionar los componentes de un ecosistema: I. Biótico A. Bacteria II. Abiótico B. Aire C. Agua 3. Las plantas, ¿En qué nivel de organización de un ecosistema se clasifica? a) Productores b) Descomponedores c) Transformadores d) Consumidores primarios e) Consumidores secundarios 4. Con respecto a la siguiente lectura: ... Los coyotes fueron considerados una plaga por robar gallinas, motivo por el cual el hombre casi los eliminó. Pero su principal alimento lo constituían un grupo de roedores, que se alimentaban de tubérculos y raíces carnosas. Mientras los coyotes desaparecían, los roedores aumentaban sorprendentemente, causando daños en los cultivos y al ser humano. 5. ¿Qué componente de la cadena alimenticia estuvo a punto de desaparecer? _____________________________________________________________________ 6. ¿Qué componente de la cadena alimenticia empezó a sobrepoblarse? _________________________________________________________________________ 7. ¿Qué consecuencias trajo la casi eliminación de coyotes? _________________________________________________________________________ 8. ¿Quién fue el culpable de alterar esta cadena alimenticia? _________________________________________________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 3 Emanuel CHRISTIAN SCHOOL 9. Relacionar: I. Erupción volcánica II. Derrame de petróleo III. Construcción de edificios A. Alteración natural B. Alteración por acción humana IV. Huayco 10. ¿Qué elemento químico está presente en todos los seres vivos? ________________________________________________________________________ TAREA: 11. ¿A quiénes se les llama Autótrofos? ___________________________________________ 12. ¿Por qué el derrame de petróleo en el mar altera el ecosistema? ________________________________________________________________________ 13. ¿Qué sustancia química produce la muerte dulce? ________________________________________________________________________ 14. ¿Qué sustancia química se elimina en la respiración pulmonar? ________________________________________________________________________ 15. ¿Qué es ecosistema? ________________________________________________________________________ ________________________________________________________________________ Pág. 4 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 2º CLASE Química – 1º Secundaria UNIVERSO Y EL HOMBRE INTRODUCCIÓN El estudio del origen, estructura y formación del hombre y el Universo siempre ha sido complejo. Desde sus inicios el hombre se ha preguntado: ¿Cómo se formó el Universo? ¿Cuál es el origen del Universo? La teoría más aceptada es la “Teoría de la gran explosión” para explicar la formación del Universo; y la “Teoría de la evolución” para explicar el origen del Hombre. UNIVERSO: Es el sistema que presenta características definidas. Lo forman las estrellas, planetas, satélites y el mismo hombre. NASA Luna Sol Tierra Cometa El sistema solar donde se ubica nuestro planeta Tierra (tercer planeta, llamado “planeta azul”) pertenece a la galaxia llamada Vía Láctea. La Tierra presenta un satélite natural llamado Luna. El hombre ha enviado al espacio una serie de satélites artificiales para una mejor comunicación. El origen del Universo se basa en una partícula subatómica fundamental llamada protón y con ello la formación del primer elemento químico llamado hidrógeno. A partir de ello, se obtiene los demás elementos químicos. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 5 Emanuel CHRISTIAN SCHOOL El planeta Tierra presenta tres partes: núcleo, manto y corteza. La curiosidad y el interés por explorar el cielo y los astros han sido una constante en la Humanidad, desde la generación de teorías sobre la constitución hasta la construcción de distintas aeronaves para su exploración. El planeta Tierra está constituido por varios elementos que permiten la vida. Entre los principales elementos tenemos agua, aire y suelo. La capa sólida de la Tierra se le denomina Litósfera, la capa líquida se denomina Hidrósfera; y la capa gaseosa se denomina Atmósfera. El aire es una mezcla gaseosa formada por Nitrógeno (N 2) y Oxígeno (O2) principalmente, que forma parte de la atmósfera. La hidrósfera contiene principalmente agua cuya fórmula es H 2O. Distribución de los elementos en la corteza terrestre Elemento % en masa Oxígeno 49,20 Silicio 25,67 Aluminio 7,50 Hierro 4,71 Calcio 3,39 Sodio 2,63 Potasio 2,40 Magnesio 1,93 Hidrógeno 0,87 Titanio 0,58 Composición elemental media del cuerpo humano Elemento % en masa Oxígeno 65 Carbono 18 Hidrógeno 10 Nitrógeno 3,0 Fósforo 2,0 Calcio 1,0 PRACTIQUEMOS 1. Señale la composición del aire. ________________________________________________________________________ 2. ¿Qué explica la “Teoría de la evolución”? ________________________________________________________________________ Pág. 6 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3. ¿Quiénes forman al Universo? _________________________________________________________________________ 4. ¿A qué galaxia pertenece el planeta Tierra? _________________________________________________________________________ 5. ¿Cómo se llama el satélite natural de la Tierra? _________________________________________________________________________ 6. ¿Cuál es la partícula subatómica fundamental que permitió el origen del Universo? ______ __________________________________________________________________ 7. ¿Cuáles son las partes del planeta Tierra? ____________________ / ___________________ y ______________________________ 8. ¿Cuáles son los principales elementos que permiten la vida en el planeta Tierra? ____________________ / ___________________ y ______________________________ 9. ¿Qué utiliza el hombre para comunicarse de una manera rápida entre países lejanos? _________________________________________________________________________ 10. ¿Cuál es el primer elemento químico que se formó? _________________________________________________________________________ Completar: 11. La parte central del planeta Tierra se denomina: __________________________________ 12. La parte que rodea al manto de la Tierra se llama: ________________________________ 13. La atmósfera está formada principalmente de: ____________________________________ 14. ¿Cuál es la representación química del oxígeno gaseoso? __________________________ 15. ¿Cuál es la representación química del nitrógeno gaseoso? _________________________ 16. ¿Cuál es la representación química del agua líquida? _____________________________ 17. ¿Cuál es el porcentaje de oxígeno en el cuerpo humano? ___________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 7 Emanuel CHRISTIAN SCHOOL 18. ¿Cuál es el porcentaje de nitrógeno en el cuerpo humano? _________________________ 19. ¿Cuál es el porcentaje de silicio en la corteza terrestre? ___________________________ 20. Indique los tres elementos con mayor composición en el cuerpo humano. ____________________ / ___________________ y ______________________________ Resumen: Tierra Universo Elemento químico Tierra Pág. 8 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 3º CLASE Química – 1º Secundaria LA QUIMICA COMO CIENCIA INTRODUCCIÓN Todos los cuerpos materiales tangibles o intangibles que nos rodean: aire, agua, vestimenta, los alimentos, las pinturas, el papel, los plásticos, los medicamentos, las bebidas gasificadas, la generación de energía (eléctrica, luminosa, calorífica, etc.), están relacionados directamente con la ciencia química. Es más, si queremos ahondar en los misterios de la tierra y del aire, que son esenciales para la vida, debemos recurrir al estudio de la química, ya que ésta sirve de base o fundamento a las ciencias de la vida: la biología y la medicina. La química interviene casi en todos los aspectos de nuestra vida: cultura y entorno (social y ambiental); por lo tanto, es erróneo pensar que la química es meramente teórico, y sólo tiene que ver con fórmulas y nombres complicados de compuestos; cuando respiramos, digerimos los alimentos, lavamos con jabón, limpiamos los dientes con cierta pasta dental, cocemos los alimentos, etc. estamos practicando química. CONCEPTO DE QUÍMICA Es una ciencia natural en la observación y experimentación relacionado con los fenómenos que sufre la materia, de tal modo que de ella se estudie su composición, propiedades físicas y químicas, transformaciones que experimentan y leyes que gobiernan dichos cambios en su estructura interna, así como la energía involucrada en el proceso y los cambios de energía asociados con la materia. IMPORTANCIA DE LA QUÍMICA La química es una ciencia central, porque sirve de apoyo a otras ciencias como la física, la biología, la geología, la agronomía, la medicina, etc. Además, permite satisfacer las necesidades humanas en diferentes áreas o campos de la actividad humana. Veamos: En Medicina. En está área, la química aporta con la síntesis de los diferentes fármacos (antibióticos, analgésicos, antidepresivos, vacunas, vitaminas, hormonas, radioisótopos, pie), para el tratamiento de muchas enfermedades y para el mejoramiento de la salud en general. En Nutrición. La química permite sintetizar sustancias llamadas saborizantes y colorantes para mejorar ciertas propiedades de los alimentos, y que de ese modo, pueden ingerirse fácilmente; los preservantes, para que los alimentos no se deterioren en corto tiempo; también la química determina las sustancias vitales que requiere el organismo (minerales, vitaminas, proteínas, etc.). INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 9 Emanuel CHRISTIAN SCHOOL En Agricultura. Gracias a los productos químicos como abonos y fertilizantes, se aumenta la productividad del suelo y se logra satisfactoriamente las necesidades de alimentación; cada vez más crecientes, además, con el uso de insecticidas, fungicidas y pesticidas, se controla muchas enfermedades y plagas que afectan a las plantas. En Textilería y cuidado de la ropa. La química ayuda potencialmente a satisfacer esta necesidad, sintetizando muchas fibras textiles (rayón, orlón, dracón, nylón, etc.), colorantes para el teñido, sustancias para el lavado (jabones, detergentes, etc.), perservantes de fibras naturales y sintéticas, etc. Medio Ambiente. Ayuda en el tratamiento y control de las sustancias contaminantes que afectan severamente a nuestro ecosistema natural (agua, suelo y aire), y en la asistencia de los desastres ecológicos tales como derrames de petróleo, caída de lluvia ácida, incendios forestales y domésticos, etc. Otras Industrias. En la obtención de papel, cartón, resinas, ácidos (HCl, H2SO4, HNO3, etc.), fabricación de aleaciones y materiales resistentes o ligeros para construir naves espaciales, buques, vehículos terrestres, etc. Además, la química sirve de ayuda a la Arqueología (para determinar la antigüedad de restos fósiles y de ese modo fechar los restos hallados), Mineralogía (en técnicas de extracción y purificación de metales), Astronomía (combustibles químicos para los cohetes, ropa y alimentos concentrados para astronautas), etc. ACTIVIDAD RESPONDE BREVEMENTE 1. ¿QUE ES LA QUIMICA? ………………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………… 2. Menciona 2 puntos sobre la IMPORTANCIA DE LA QUIMICA ………………………………………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………………….. 3. ¿Cómo influye la química en la MEDICINA? ……………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………… 4. ¿Cómo influye la química en el MEDIO AMBIENTE? ……………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………… 5. ¿Cómo influye la química en la AGRICULTURA? ……………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………… 6. ¿Cómo influye la química en la TEXTILERIA? ……………………………………………………………………………………………………………………………………………………………… …………………………………………………………………………………………………………………………………………………… ANALIZA Y RESPONDE ¿Cómo la química influye en tu vida diaria? Te relacionas con ella ¿de qué manera? ……………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………… …………………………………………………………………… Pág. 10 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 4º CLASE Química – 1º Secundaria DIVISIÓN DE LA QUÍMICA Por su gran amplitud y desarrollo, la química se divide en: 1. QUÍMICA GENERAL. Estudia los principios básicos comunes a todas las ramas de la ciencia química. 2. QUÍMICA DESCRIPTIVA. Estudia las propiedades y la obtención de cada sustancia químicamente pura en forma particular. Podemos subdividirla en: 2.1. Química Inorgánica. Estudia todas las sustancias inanimadas o del reino mineral. 2.2. Química Orgánica. Estudia todas las sustancias que contienen carbono (con excepción de CO y CO2, carbonatas, etc.), ya sean éstos naturales (provenientes del reino animal y vegetal) o artificiales (plásticos, fibras textiles, etc.). 3. QUÍMICA ANALÍTICA. Estudia las técnicas para identificar, separar y cuantificar las sustancias orgánicas e inorgánicas presentes en una muestra material, o los elementos presentes en un compuesto químico. Se subdivide en: 3.1. Cualitativa. Estudia las técnicas para identificar las sustancias químicas (simples y compuestas) en una muestra material o los elementos químicos presentes en un compuesto. Así por ejemplo, se ha determinado que en el agua pura sólo hay dos elementos: hidrógeno y oxígeno; en la sal de mesa: cloro y sodio; en el azúcar de mesa: carbono, hidrógeno y oxígeno. 3.2. Cuantitativa. Estudia las técnicas para cuantificar las sustancias químicas puras en una muestra material o el porcentaje en peso que representa cada elemento en un compuesto, para luego de establecer su fórmula química. Así por ejemplo: tenemos que el agua hay 88.89% en pesa de oxígeno y 11,11% de hidrógeno, luego, la fórmula del agua será H 2O. 4. QUÍMICA APLICADA. Por su relación con otras ciencias y su aplicación práctica, podemos subdividirlas en: 4.1. Bioquímica. Estudia la composición, estructura y funciones de las moléculas complejas que forman sistemas biológicas, e intervienen en procesos químicos vitales, como la fotosíntesis, digestión, respiración, reproducción, circulación, etc. 4.2. Fisioquímica. Estudia todos los procesos en los que se relacionan los principios y leyes físicas y químicas como por ejemplo en la estructura atómica y molecular; termodinámica, propiedad desde los gases, líquidos y sólidos, etc. 4.3. Química Industrial. Estudia la aplicación de procesos químicos y los insumes para la obtención de productos químicos sintéticos a gran escala, como por ejemplo; los plásticos, caucho sintético, combustibles, fibras textiles, fertilizantes, insecticidas, jabones, detergentes, ácido sulfúrico, soda cáustica, cloro, sodio, etc. 4.4. Petroquímica. Estudia la aplicación de procesos y principios químicos para obtener los productos industriales a partir de los derivados del petróleo, carbón y gas natural. 4.5. Geoquímica. Estudia la composición química de la tierra. Los objetivos principales de la geoquímica son (1) la determinación absoluta y relativa de los elementos químicos en la tierra (atmósfera, hidrósfera y litosfera) y en sus minerales y rocas, intentando determinar las leyes o principios que rigen tal distribución y migración. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 11 Emanuel CHRISTIAN SCHOOL 4.6. 4.7. Astroquímica. Estudia la composición química de los astros, así por ejemplo se ha determinado que la atmósfera del planeta marte contiene nitrógeno (N 2), anhídrido carbónico (CO2), Helio (He) e Hidrógeno (H2). Farmoquímica. Estudia las propiedades de las sustancias químicas y su acción nociva o benéfica sobre los seres vivos. Por ejemplo la acción de la penicilina, las drogas, y antibióticos en seres humanos. ACTIVIDAD 01. Diferencia entre datos cualitativos y cuantitativos. ................................................................................................................................................. ................................................................................................................................................. 02. Clasifique los siguientes enunciados como cualitativos o cuantitativos. a. El sol se encuentra aproximadamente a 150 millones de Km. de la tierra (........... ) b. Leonardo De Vinci fue mejor pintor que Miguel Ángel (........... ) c. El hielo es menos denso que el agua (........... ) d. La mantequilla sabe mejor que la margarina. (........... ) e. En 18 g. de agua hay 32 g. de hidrógeno. (........... ) 03. La química es una ciencia experimental que no estudia la materia en cuanto se refiere a: a. Su composición. b. Sus propiedades físicas y química. c. Las leyes que gobernaran en sus transformaciones. d. Los cambios de energía asociados a la materia. e. Las leyes del movimiento que los gobierna. 04. Señala la disciplina que no se apoya de los conocimientos químicos: a. Física b. Arqueología c. Medicina d. Lengua y Literatura e. Mineralogía 05. Estudia los fundamentos o principios básicos comunes a todas las ramas de la ciencia química: a. Química descriptiva b. Química inorgánica c. Química general d. Química analítica e. Química aplicada 06. Para determinar la constitución y formula de un compuesto químicos en forma experimental se requiere conocimiento de: a. Química general b. Fisicoquímica c. Geoquímica d. Química descriptiva e. Química analítica. 07. Señale la disciplina que no pertenece a la química aplicada: a. Geoquímica b. Astroquímica d. Química Orgánica e. Química Industrial c. Petroquímica 08. Explique que significa el término Método Científico. ................................................................................................................................................. 09. ¿Cuál de los siguientes pasos no corresponden al método científico? a. Registro de datos. b. Comprobación experimental. c. Deducción de las fórmulas. d. Formulación de hipótesis e. Observación del fenómeno Pág. 12 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 5º CLASE Química – 1º Secundaria LA MATERIA INTRODUCCIÓN En nuestra aula de estudios encontramos muchos objetos de diferentes formas, tamaños y colores. También notamos la presencia del aire, por el viento originado por el ventilador o porque simplemente respiramos. Tus compañeros de aula también tienen diferentes tamaños. Todo lo anteriormente mencionado constituye la materia. MATERIA: Es todo aquello que tiene masa, ocupa un lugar en el espacio y es independiente de nuestros sentidos. Ejemplos de materia: lapicero, cuaderno, pizarra, carpeta, hombre, aire, ventilador, agua, etc. ENERGÍA: Es una forma disipada de materia. Es la capacidad de realizar trabajo. • Ley de conservación de la materia (Lavoisier): “La materia no se crea ni se destruye solo se transforma”. • Ley de conservación de la energía: “La energía no se crea ni se destruye solo se transforma”. En la primera ley, cuando se usa el término transformación, la materia puede cambiar de estructura interna o externa sin cambiar la masa. La estructura interna solo considerando átomos. En la segunda ley, cuando se usa el término transformación, la energía solo se convierte a un nuevo tipo de energía, sin alterar la cantidad de energía. Así por ejemplo, la energía cinética se puede convertir en energía eléctrica. Para las dos leyes se debe considerar eventos ideales con un rendimiento teórico de 100%. En forma experimental, la cantidad de materia y la cantidad de energía varía de acuerdo al proceso, entonces el rendimiento es menor del 100%. • Ley de conservación de la materia y de la energía (Albert Einstein): “La materia y su equivalente en energía permanece constante en el Universo”. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 13 Emanuel CHRISTIAN SCHOOL La relación materia-energía se da mediante la ecuación: E = energía m = masa c = constante de la velocidad de la luz La energía será expresada en “ergios”, que proviene de la relación. La masa se expresa en gramos y la velocidad de la luz es 300 000 km/s, que puede expresarse como 3 10 10 cm/s. Practiquemos: 1. Completar: “La cantidad de materia en un cuerpo se denomina______________________________________”. 1. De los mencionados, ¿cuáles son materia? I. Suelo II. Agua III. Hierro IV. Fuerza V. Aire ________________________________________________________________________________ 2. La fuerza de atracción gravitatoria que experimentan los cuerpos se denomina______________ 4. Completar: “La ____________ no varía con la posición, ni el lugar; y el ______________ varía de acuerdo a la posición y el lugar”. 5. Indique, ¿cuáles son tipos de energía? I. Calor II. Electricidad III. Presión ________________________________________________________________________________ 6. Marque con una X en el cuadro que indique la ley que se cumple en una explosión nuclear. Pág. 14 ( ) Ley de conservación de la materia ( ) Ley de conservación de la energía ( ) Ley de conservación de la materia y de la energía INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 7. ¿Hasta qué parte de la materia, se puede lograr la conservación de la masa? ________________ 8. Completar: “En la ley de la conservación de la materia, se debe considerar que los eventos tienen un rendimiento igual a:_______________________________________________________________”. 9. Completar “La energía no se crea ni se destruye, solo se transforma”. Corresponde a la ley _______________ 10. ¿Qué unidad se puede utilizar para expresar la energía? _________________________________________________ 11. ¿Cuál es el valor de la velocidad de la luz? (en km/s) ____________________________________________________ 2 12. La expresión: E m.c , ¿qué relación establece? _______________________________________________________ 13. Completar: La unidad “gramos” sirve para expresar la _____________________________________________ 14. Según Einstein, en una reacción nuclear parte de la masa se convierte en: ________________________________________________________________________________ ________________________________________________________________________________ 15. La definición: “Es la capacidad para realizar un trabajo”, corresponde a: ________________________________________________________________________________ ________________________________________________________________________________ Tarea Domiciliaria 1. Completar: “La masa mide la cantidad de ________________________________ en un cuerpo”. 2. De las proposiciones, ¿cuáles son características de la materia? I. Tiene forma y volumen definido. II. Tiene masa. III. Es perceptible por los sentidos. ________________________________________________________________________________ 3. ¿Qué mide el peso? ________________________________________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 15 Emanuel CHRISTIAN SCHOOL 4. ¿Por qué el peso varía de acuerdo al lugar? ________________________________________________________________________________ 5. Completar: “El calor y la electricidad son tipos de __________________________________________________”. 6. Marque la ley que se cumple durante la transformación de Hierro y Carbono en acero. I. Ley de Conservación de la materia. II. Ley de Conservación de la energía. III. Ley de Conservación de la materia y la energía. 7. Mide la cantidad de materia. ________________________________________________________________________________ 8. ¿Qué expresión establece una relación entre la materia y la energía?_______________________ 9. “La masa no se crea, ni se destruye solo se transforma”, enunciado que corresponde a la ley___________________ 10. El “ergio” es una unidad que se utiliza para expresar la_________________________________ 11. Exprese la velocidad de la luz en cm/s:______________________________________________ 12. Expresa por primera vez la relación materia-energía. ________________________________________________________________________________ ________________________________________________________________________________ 13. La ley de conservación de la materia fue propuesta por: ________________________________________________________________________________ 14. La masa se puede expresar en _____________________________________________________ 15. ¿Qué elementos químicos se usan en las bombas atómicas? ________________________________________________________________________________ ________________________________________________________________________________ Pág. 16 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 6º CLASE Química – 1º Secundaria ESTADOS DE AGREGACION DE LA MATERIA INTRODUCCIÓN Es común observar en la Naturaleza, el agua en estado sólido como hielo, en estado líquido como simplemente agua, o en estado gaseoso como vapor. Es decir, el agua es una de las sustancias que se puede encontrar en los tres estados. ESTADOSDEAGREGACIÓN Es la disposición atómica o molecular en una porción limitada de materia. Las fuerzas de atracción entre los átomos y/o moléculas determinan un estado de agregación. Existen tres estados de agregación: sólido, líquido, gaseoso y por la variación de la presión y la temperatura existen infinitos estados termodinámicos. En el Universo se conoce un cuarto estado llamado «PLASMÁTICO» que se encuentra a elevadas + temperaturas, formado principalmente por iones H y núcleos de Helio (He). La lava de los volcanes en erupción y el Sol se encuentran en estado plasmático. Los científicos en laboratorio han creado un quinto estado llamado SUB ENFRIADO con átomos suspendidos. Características de los estados de agregación: 1. Estado Sólido * Son compactos. * Tienen forma y volumen definido. * Son prácticamente incompresibles. * Las fuerzas de atracción molecular son más intensas que las fuerzas de repulsión. * Presentan las propiedades de inercia, impenetrabilidad, divisibilidad, extensión. 2. Estado líquido * No tienen forma definida. * Poseen volumen definido. * Son ligeramente compresibles * Las fuerzas de atracción molecular son similares a las fuerzas de repulsión. * Se expanden en forma limitada. * Son fluidos * Las fuerzas de atracción molecular en la superficie del líquido logran una tensión superficial. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 17 Emanuel CHRISTIAN SCHOOL 3. Estado gaseoso * No tienen forma definida. * No tiene volumen definido. * Son compresibles. * Las fuerzas de repulsión molecular son mayores que las fuerzas de atracción. * Son fluidos. * Se expanden en forma ilimitada. Practiquemos 1. Completar: “Al agua en estado sólido se denomina _______________________________________________”. 2. ¿Cuántos estados de agregación existen? ___________________________________________ 3. De los mencionados ¿cuáles se encuentran en estado sólido? I. Vidrio II. Vinagre III. Ozono IV. Cobre ________________________________________________________________________________ 4. Relacionar correctamente: I. Estado sólido A. Fluido II. Estado líquido B. Incompresible III. Estado gaseoso C. Expansión limitada 5. Establezca la relación correcta entre las fuerzas intermoleculares en el estado sólido: Fuerzas de atracción.................. Fuerzas de repulsión >, <, = 6. ¿Qué proposiciones son comunes para un gas y un líquido? I. Son estados condensados II. Son fluidos III. Son compresibles 7. Completar: “El cuarto estado, que se encuentra a elevadas temperaturas se denomina:__________________”. 8. Las siguientes características: I. Tienen forma definida. II. Tienen volumen definido III. Las fuerzas de atracción son intensas. Corresponde al estado______________________________ 9. La resistencia de un cuerpo a ser rayado se denomina:_________________________________ 10. ¿Qué propiedad de los líquidos explica la forma esférica __________________________________________ Pág. 18 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL de las gotas? Emanuel CHRISTIAN SCHOOL 11. ¿A qué se denominan fuerzas de cohesión? de adhesión? ______________________________________________________________ 12. ¿A qué se denominan fuerzas ______________________________________________________________ 13. Indique el estado de agregación para cada porción de materia: I. Lingote de Oro :______________________________________________________________ II. Aire :______________________________________________________________________ III. Alcohol :___________________________________________________________________ 14. ¿Qué es un fluido? ________________________________________________________________________________ 15. ¿Por qué la mayoría de gases son incoloros? ________________________________________________________________________________ Tarea Domiciliaria 1. Completar: “Al agua en estado líquido se denomina _______________________________________________”. 2. ¿Cuántos estados termodinámicos existen?____________________________________________ 3. De los mencionados, ¿cuáles se encuentran en estado líquido? I. Plata II. Mercurio III. Alcohol IV. Bronce 4. Relacionar correctamente: I. Estado sólido A. Compresible II. Estado líquido B. Compacto III. Estado gaseoso C. Fluido 5. Establezca la relación correcta entre las fuerzas intermoleculares en el estado gaseoso: Fuerzas de atracción.................. Fuerzas de repulsión >, <, = 6. ¿Qué proposiciones son comunes para un líquido y un sólido? I. Son estados condensados. II. Son fluidos. III. Son incompresibles. 7. Completar: La lava de un volcán en plena erupción se encuentra en estado____________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 19 Emanuel CHRISTIAN SCHOOL 8. Las siguientes características: I. Tienen volumen definido II. Es un fluido III. Tiene forma variable Corresponde al estado:_____________________________________________________________ 9. La resistencia de un cuerpo a cambiar su estado de reposo o de movimiento se denomina: _____________________ 10. ¿Qué propiedad de los líquidos explica la forma esférica de las pompas de jabón? ________________________________________________________________________________ 11. ¿Cómo se llaman a las fuerzas de atracción entre las moléculas de un líquido y las moléculas del recipiente que lo contiene? ________________________________________________________________________________ 12. ¿Cómo se llaman las fuerzas de atracción entre las moléculas de un mismo líquido?__________ 13. Indique el estado de agregación para cada porción de materia: I. Plancha de acero: _________________________________________ II. Aceite de cocina: _________________________________________ III. Helio: _________________________________________ 14. Debido al desplazamiento que puede experimentar un gas o un líquido se les considera como: ________________________________________________________________________________ 15. Los átomos Helio e Hidrógeno forman parte principalmente del estado:____________________ Pág. 20 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 1º BIMESTRE – 7º CLASE Química – 1º Secundaria PRACTICA DE LABORATORIO EXPERIMENTO Nº1 A. Materiales: * Un sobre de bicarbonato de sodio (NaHCO3) de 100 g. * Una botella de ácido acético (CH3COOH) como vinagre de 200 mililitros. * Un globo de fiesta infantil. * Un metro de hilo. * Cuatro servilletas. B. Procedimiento: 1. Se coloca la mitad de bicarbonato en un par de servilletas. 2. Se envuelve el bicarbonato y se asegura con el hilo. 3. Se introduce el paquete obtenido en la botella con vinagre. 4. Se jala el hilo dejando libre al bicarbonato. 5. Casi al instante colocar el globo de fiesta y observar que dicho globo se infla. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 21 Emanuel CHRISTIAN SCHOOL 6. El globo se ha llenado de dióxido de carbono llamado gas carbónico, se cierra y se retira. CUESTIONARIODELABORATORIO 1. ¿En qué estado se encuentra el bicarbonato de sodio? ________________________________________________________________________________ 2. ¿En qué estado se encuentra el vinagre? ________________________________________________________________________________ 3. Completar el siguiente cuadro: 4. Cuando el globo se infla, ¿qué propiedad del gas se puede explicar?_______________________ 5. Cuando se retira el globo de la botella, ¿qué sensación experimenta con respecto al peso y a la temperatura? • Con respecto a la temperatura: _________________________________ Más frío / más caliente / igual • Con respecto a la masa: ____________________________________ Más liviano / más pesado / igual 6. Al abrir la botella de vinagre, ¿qué sensación experimenta con respecto al olor?______________ volátil / no volátil 7. ¿Qué propiedad de los líquidos explica el olor del vinagre? ________________________________________________________________________________ 8. ¿Qué tipo de cambio experimentó el bicarbonato de sodio con el ácido acético? Físico ( ) Químico ( ) 9. ¿Por qué el globo se infla? ________________________________________________________________________________ Pág. 22 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 10. En este experimento, ¿se puede obtener el estado plasmático? ¿Por qué? ________________________________________________________________________________ 11. ¿Por qué el gas se desprende del líquido? ________________________________________________________________________________ 12. ¿Cuál es la fórmula química del gas desprendido? ________________________________________________________________________________ 13. ¿Cuál es la fórmula química del bicarbonato de sodio? ________________________________________________________________________________ 14. ¿Cómo se clasifica el vinagre? Compuesto químico ( ) Mezcla homogénea ( ) Mezcla heterogénea ( )} 15. Mencione tres propiedades del bicarbonato de sodio: a) ______________________________________________________________________________ b) ___________________________________________________________________________ c) _____________________________________________________________________________ Tarea Domiciliaria 1. Completar: “Al flujo de energía de un cuerpo caliente a un cuerpo frío se denomina:_____________________”. 2. El movimiento molecular en una sustancia se puede registrar mediante la___________________ 3. El mayor ordenamiento molecular o atómico se encuentra en el estado_____________________ 4. ¿Cuál es el punto de fusión del hielo en el nivel del mar? __________________________________________________ 5. En el equilibrio químico, los cuerpos alcanzan: I. Igual temperatura II. Igual calor III. Igual masa 6. La naftalina y el hielo seco se caracterizan por experimentar el proceso de_________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 23 Emanuel CHRISTIAN SCHOOL 7. En la flecha, indicar el cambio de estado: Gas ……………………………………………………….. Líquido 8. Cuando a un líquido se le enfría ocurre un proceso de ordenamiento regular atómico o molecular. ¿Cómo se denomina el proceso? ________________________________________________________________________________ 9. Por la energía, ¿cómo clasifica al proceso de ebullición? _________________________________________________ 10. Si el agua se hace hervir en Huaral, ¿cuál será el punto de ebullición?_____________________ =100ºC/<100ºC/>100ºC 11. ¿Qué sucede con el punto de ebullición de un líquido si se incrementa la presión del aire? _______________________________________________ no varía / aumenta / disminuye 12. Cuando en la ciudad de Iquitos llueve, ocurre un proceso llamado:_______________________ 13. ¿Cuándo se denomina punto de ebullición normal? ________________________________________________________________________________ 14. ¿Por qué los heladeros utilizan hielo seco, y no hielo de agua, para conservar sólidos a sus helados? ________________________________________________________________________________ 15. ¿Cómo se denomina el proceso que permite pasar de estado gaseoso a líquido por incremento de presión? ____________________________________________________________________________ Pág. 24 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 1º CLASE Química – 1º Secundaria DIVISION DE LA MATERIA Cuando se toma un cubo de hielo, éste se puede fraccionar hasta obtener raspadilla. A la porción de materia de forma definida y volumen definido se le llama cuerpo. Algunos ejemplos de cuerpos tenemos: El cuerpo se puede fraccionar por medios mecánicos hasta obtener polvo. Todas estas fracciones de la materia se pueden encontrar en sustancias, en estado sólido. En el estado sólido las moléculas y/o átomos están bien unidas evitando espacios libres llamados poros. La fuerza de unión entre átomos se denomina enlace químico. El agrupamiento de átomos forma una molécula. Las moléculas pueden ser monoatómicas, es decir, con un solo átomo, como por ejemplo los gases nobles. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 25 Emanuel CHRISTIAN SCHOOL Las moléculas pueden ser diatómicas, es decir, con dos átomos de un mismo elemento o de elementos diferentes. Las moléculas pueden ser triatómicas, es decir, con tres átomos de un mismo elemento o de elementos diferentes. Las moléculas pueden ser tetratómicas, es decir, con cuatro átomos de un mismo elemento o de elementos diferentes. PRACTIQUEMOS: 1. ¿Qué porción de materia tiene forma y volumen definido? ________________________________________________________________________________ 2. ¿Hasta qué parte de la materia se puede dividir un cuerpo? ________________________________________________________________________________ 3. ¿Cuál es la primera fracción que se puede obtener de la división de un cuerpo? ________________________________________________________________________________ 4. Compare el tamaño de fracción entre un fragmento y una partícula _______________________. <menor, >mayor, = igual 5. De los materiales señalados, ¿cuáles pueden presentarse como polvo? I. Hierro II. Azufre III. Mercurio ________________________________________________________________________________ 6. ¿Cómo se denomina a la fuerza de unión entre átomos? ________________________________________________________________________________ Pág. 26 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 7. ¿Cuántos átomos posee una molécula de neón? ________________________________________________________________________________ 8. Si la molécula SOx posee cuatro átomos, hallar “x”. ________________________________________________________________________________ 9. La molécula CnH2n+2 posee 11 átomos. Hallar “n”. ________________________________________________________________________________ 10. ¿Cómo se clasifica a la molécula del H2O por el número de átomos? ________________________________________________________________________________ 11. Represente la siguiente molécula: 12.¿Cuántos átomos posee la siguiente molécula? 13. Relacione correctamente: I. NH3 II. H2O A. Triatómica B. Diatómica C. Tetratómica ________________________________________________________________________________ 14. ¿Cuáles son cuerpos? I. Agua II.Mota III. Aire ________________________________________________________________________________ 15. Ordene por el número de átomos, en forma creciente: I. CO II. O3 III. Ne ___________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 27 Emanuel CHRISTIAN SCHOOL Tarea Domiciliaria 1. ¿Qué fracción se obtiene de la división de una partícula? ________________________________ 2. ¿En qué estado se pueden encontrar las fracciones fragmento y polvo?_____________________ 3. ¿Qué fracción se obtiene de la división de un cuerpo? ___________________________________ 4. Compare el tamaño de fracción entre una partícula y el polvo ____________________________ <menor, >mayor, =igual 5. De los materiales señalados, ¿cuáles pueden presentarse como polvo? I. Bromo II. Acero III. Madera ________________________________________________________________________________ 6. ¿Qué relación de tamaños existe entre una molécula de helio y una molécula de neón? _______________________. <menor, >mayor, =igual 7. El agrupamiento de átomos se denomina: ____________________________________________ 8. ¿Cuántos átomos existen en la molécula de amoníaco? __________________________________ 9. Si la molécula H2SOx presenta siete átomos, hallar “x” __________________________________ 10. La molécula CnH2n posee 18 átomos. Hallar el valor de “n”. _____________________________ 11. ¿Cuántos átomos posee la siguiente molécula? I. P4 12. Relacione correctamente: I. P4 II. CO II. CO I. H2O A. Monoatómica B. Diatómica C. Tetratómica ________________________________________________________________________________ 13. Indique un cuerpo: I. Aire II. Petróleo III. Lapicero ________________________________________________________________________________ 14. Ordene en forma creciente los tamaños de los siguientes átomos: I. Argón II. Neón III. Helio ________________________________________________________________________________ Pág. 28 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 2º CLASE Química – 1º Secundaria EL ÁTOMO Al realizar el análisis de una porción de materia nos encontramos cada vez con partes más pequeñas; las cuales nos proporcionan una serie de datos, que permiten conocer mejor a la materia. La física clásica no puede explicar las fuerzas que se presenta en la parte más interna de la materia. Por ejemplo la gravedad no actúa en la parte interna de la materia. Átomo Es una porción mínima de materia que conserva las propiedades de un elemento químico. Presenta dos partes: 1. Núcleo atómico: Es la parte central del átomo donde se concentra casi toda su masa. Contiene dos partículas subatómicas fundamentales: protón, de carga positiva, y neutrón, de carga neta cero. 2. Nube electrónica: Llamada zona extranuclear. Es la parte que rodea al núcleo atómico. Casi no tiene masa y determina el tamaño del átomo. Contiene una partícula subatómica elemental de carga negativa llamada electrón. Los protones y los neutrones están formados por porciones más pequeñas llamadas “Quarks”. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 29 Emanuel CHRISTIAN SCHOOL Definiciones atómicas 1. Número atómico (Z): Llamado carga nuclear e indica el número de protones. Es el parámetro que identifica a un elemento químico. Su valor está registrado en la tabla periódica. 2. Número de masa (A): Llamado número másico o número de nucleones. Determina en forma aproximada la masa del átomo en unidades llamadas u.m.a. (unidad de masa atómica). Indica el número de protones con el número de neutrones. En la mayoría de átomos, el número de masa es mayor que el número atómico. 3. Núclido: Es la representación de un átomo neutro, donde se coloca el símbolo químico, número atómico y número de masa. Un átomo es neutro cuando el número de protones es igual al número de electrones. Practiquemos 1. ¿Qué parte de la materia conserva las propiedades de un elemento químico? ________________________________________________________________________________ 2. ¿Qué parte del átomo determina el volumen del mismo? ________________________________________________________________________________ 3. ¿Qué partículas subatómicas fundamentales se encuentran en el núcleo atómico? ________________________________________________________________________________ 4. ¿Cuál es la relación entre tamaños de un protón con un electrón? _________________________ <menor, >mayor, =igual 5. ¿Quién descubrió el electrón? ________________________________________________________________________________ 6. ¿Cuál es la carga relativa de un protón? ________________________________________________________________________________ 7. ¿Qué parámetro identifica a un elemento químico? ________________________________________________________________________________ 8. A la suma del número de protones con el número de neutrones se le llama: _________________ Pág. 30 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 9. Si el número de protones es 26 y el número de neutrones es 30, hallar el número atómico y el número de masa. ________________________________________________________________________________ 56 10. Para el Núclido: 26Fe ; determine el número de protones. ________________________________________________________________________________ 11. Para el Núclido: 65 30Zn ; determine el número de neutrones. ________________________________________________________________________________ 12. Para el núclido: 64 29Cu ; determine el número de electrones. ________________________________________________________________________________ 13. Relacionar correctamente: ________________________________________________________________________________ 14. Determine el número de partículas subatómicas fundamentales, (entre protones, neutrones y 35 electrones) para la especie: 17Cl _____________________________________. 15. Un átomo posee un número de masa que resulta ser el doble del número de protones. Si el número de masa es 60, hallar el número de electrones. ________________________________________________________________________________ Tarea Domiciliaria 1. ¿En qué parte del átomo se concentra su masa? ________________________________________________________________________________ 2. ¿En qué parte del átomo, se encuentran los electrones? ________________________________________________________________________________ 3. ¿Qué partícula subatómica fundamental es elemental? ________________________________________________________________________________ 4. ¿Cuál es la relación entre tamaños de un electrón con un neutrón? ________________________ <menor, >mayor, =igual 5. ¿Quién descubrió el neutrón? ________________________________________________________________________________ 6. ¿Cuál es la carga relativa de un electrón? ________________________________________________________________________________ 7. ¿Qué relación existe entre el número de masa y el número atómico? _______________________ <menor, >mayor, =igual 8. A la cantidad de protones se le llama: ______________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 31 Emanuel CHRISTIAN SCHOOL 9. Si el número de protones es 80 y el número de neutrones es 120, hallar el número atómico y el número de masa. ________________________________________________________________________________ 10. Para el Núclido: 27 13Al ; determinar el número de protones. ________________________________________________________________________________ 11. Para el Núclido: 67 33As ; determinar el número de neutrones. ________________________________________________________________________________ 12. Para el Núclido: 53I127; determinar el número de electrones. ________________________________________________________________________________ 13. Relacionar correctamente: ________________________________________________________________________________ 14. Determine el número de partículas subatómicas fundamentales (entre protones, neutrones y 28 electrones) para la especie: 14Si ________________________________________________________________________________ 15. El número de neutrones es 3/2 del número de protones. Si el número atómico es 20, hallar el número de masa. ________________________________________________________________________________ Pág. 32 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 3º CLASE Química – 1º Secundaria CONSTRUYENDO UN ÁTOMO A. Materiales • • • • • 1 1 1 1 1 plastilina plastilina plastilina plastilina plastilina blanca roja amarilla negra azul • 1 tijera • 1 cartón duplex de 20 cm x 20 cm • 1 compas de lápiz • 1 hoja de papel bond B. Procedimiento 1. Sobre el cartón duplex hacer un círculo de radio 7cm 2. En la circunferencia formada extender la plastilina negra. 3. Formar una esfera con la plastilina blanca. 4. Colocar la plastilina blanca sobre la plastilina negra. 5. Con la plastilina amarilla hacer cuatro bolitas pequeñas y colocarlo sobre la plastilina blanca, de igual manera realizar tres bolitas pequeñas de plastilina azul y tres bolitas pequeñas de plastilina roja. 6. Retirar la esfera blanca y colocar en ella las cuatro bolitas amarillas y luego las tres bolitas azules (no juntas). INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 33 Emanuel CHRISTIAN SCHOOL 7. En la cartulina duplex con la ayuda del compás, realizar dos círculos concéntricos y luego colocar las bolitas rojas. 8. Colocar la esfera blanca con las bolitas azul y amarilla a su posición original. 9. En el papel bond, coloque las partes del átomo y ubíquelas en el trabajo. Practiquemos 1. ¿Qué se intenta representar con la experiencia? ________________________________________________________________________________ 2. ¿Qué representa la circunferencia negra? ________________________________________________________________________________ 3. ¿Qué representa la esfera blanca? ________________________________________________________________________________ 4. ¿Qué representa las bolitas amarillas? ________________________________________________________________________________ 5. ¿Qué representa las bolitas azules? ________________________________________________________________________________ Pág. 34 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 6. ¿Qué representa las bolitas rojas? ________________________________________________________________________________ 7. ¿Por qué las bolitas azules no pueden estar juntas? ________________________________________________________________________________ 8. ¿Por qué las bolitas rojas no pueden estar juntas? ________________________________________________________________________________ 9. ¿Qué información coloca en los recuadros de papel bond? ________________________________________________________________________________ 10. ¿Cuál es el valor del número atómico? ________________________________________________________________________________ 11. ¿Cuál es el valor del número de masa? ________________________________________________________________________________ 12. ¿De qué elemento se trata? ________________________________________________________________________________ 13. ¿Cuál es el símbolo químico? ________________________________________________________________________________ 14. Represente al Núclido: Tarea Domiciliaria 1. ¿Cuántas partículas posee el núcleo? ____________________________________ 2. ¿Cuántas partículas posee la nube electrónica? ____________________________________ 3. ¿Cuántos neutrones presenta? ____________________________________ 4. ¿Cuántos protones presenta? ____________________________________ 5. ¿Cuántos electrones posee? ____________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 35 Emanuel CHRISTIAN SCHOOL 6. ¿Por qué las bolitas amarillas pueden estar juntas? ________________________________________________________________________________ 7. ¿Qué representan los círculos alrededor del núcleo? ________________________________________________________________________________ 8. ¿Cuántos electrones posee el primer nivel? _______________________________________________ 9. Calcule la suma de “A+Z” ________________________________________________________________________________ 10. ¿Cuántos niveles posee dicho átomo? ________________________________________________________________________________ 11. ¿En cuántas partículas excede el número de neutrones al número de protones? ________________________________________________________________________________ 12. ¿Cuál es la diferencia entre el número de protones con el número de electrones? ________________________________________________________________________________ 13. ¿Cuántas partículas subatómicas posee el átomo? ________________________________________________________________________________ 14. Para la notación 7N14 , ¿cuántas bolitas rojas se usarán? ________________________________________________________________________________ 12 15. Para la notación 6C , ¿cuántas bolitas amarillas se usarán? ________________________________________________________________________________ Pág. 36 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 4º CLASE Química – 1º Secundaria DIVISIÓN DE LA MATERIA – ÁTOMO Durante el siglo XX se han producido numerosos fenómenos interesantes en el mundo de la ciencia. En Física: las teorías atómicas, la mecánica cuántica, la teoría de la relatividad. En Química: las nuevas técnicas de síntesis basadas en la estructura de las moléculas. Los átomos están formados por un núcleo que posee una serie de partículas subatómicas. Alrededor del núcleo se hallan en diferentes órbitas, los electrones. Las partículas subatómicas de las que se compone el núcleo son los protones y los neutrones. Las curiosidades acerca del tamaño y masa del átomo atrajeron a cientos de científicos durante un largo periodo en el que la falta de instrumentos y técnicas apropiadas impidió obtener respuestas satisfactorias. Posteriormente se diseñaron numerosos experimentos ingeniosos para determinar el tamaño y el peso de los diferentes átomos. El átomo más ligero, es el de hidrógeno, tiene una masa alrededor de 1,710-27 kg y un diámetro de aproximadamente 10-10 m. Recuerde que cada sustancia del Universo, las piedras, el mar, el hombre y hasta las estrellas más lejanas, están enteramente formada por pequeñas partículas llamadas átomos. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 37 Emanuel CHRISTIAN SCHOOL Practiquemos 1. Indicar con (V) verdadero y (F) falso según corresponda: I. A la porción definida de materia se llama partícula ........................................................... ( ) II. El elemento químico es la forma más sencilla de la materia .............................................. ( ) 2. Completar: “Al dividir un ________________________ se obtiene ________________________ que resultan ser de mayor tamaño que los fragmentos o los trozos”. 3. Relacionar: I. Protón A. Partícula positiva II. Electrón B. Partícula neutra C. Partícula negativa 4. ¿Qué relación existe entre los tamaños de una partícula y un fragmento? I. Mayor (>) II. Menor (<) III. Igual (=) ________________________________________________________________________________ 5. Elija la opción correcta: I. Una molécula está formada de uno o más átomos ______________________ II. El amoníaco presenta tres átomos por molécula ______________________ III. El átomo es la última parte de la división de la materia ______________________ 6. ¿En qué parte del átomo se concentra su masa? ________________________________________________________________________________ 7. ¿En qué región del átomo se encuentra los electrones? ________________________________________________________________________________ 8. ¿Qué mecanismo se utiliza para dividir la materia de partícula a polvo? ________________________________________________________________________________ 9. ¿Cuántos átomos posee la molécula del agua? ________________________________________________________________________________ Pág. 38 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 10. ¿Cuál es la partícula subatómica elemental? ________________________________________________________________________________ 11. Relacionar correctamente: I. CO2 A. Diatómica II. CO4 B. Triatómica C. Pentatómica 12. Completar: “La nube electrónica del átomo tiene carga __________________________ y el núcleo atómico tiene carga __________________________ debido a los protones”. 13. ¿Qué parte de la división de la materia es una tiza del profesor? ________________________________________________________________________________ 14. ¿En qué estado de la materia, se puede observar los fragmentos y las partículas? ________________________________________________________________________________ 15. ¿Qué parámetro mantiene unidos a los átomos en una molécula? ________________________________________________________________________________ Tarea Domiciliaria 1. Indicar con (V) verdadero y (F) falso según corresponda: I. Los cuerpos tiene forma irregular ................................................................ ( ) II. Los fragmentos tienen volumen definido ...................................................... ( ) 2. Completar: “Al fraccionar _______________________ la materia adquiere porciones muy pequeñas, que forman parte del polvo”. 3. Relacionar: I. Electrón A. Partícula positiva II. Neutrón B. Partícula negativa C. Partícula neutra INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 39 Emanuel CHRISTIAN SCHOOL 4. ¿Qué relación de tamaños existe entre una partícula y el polvo? I. Menor (<) II. Mayor (>) III. Igual (=) ________________________________________________________________________________ 5. Elija la opción correcta: I. Un átomo está formada de dos o más moléculas. _____________________________ II. El agua presenta dos átomos de hidrógeno. _____________________________ III. La masa del átomo se concentra en el núcleo atómico. _____________________________ 6. ¿Qué parte del átomo determina su tamaño? ________________________________________________________________________________ 7. ¿En qué región del átomo se encuentran los protones? ________________________________________________________________________________ 8. ¿Qué mecanismo se utiliza para separar los átomos de una molécula? ________________________________________________________________________________ 9. ¿Cuántos átomos posee la molécula del amoníaco? ________________________________________________________________________________ 10. ¿Cuáles son las partículas subatómicas no elementales ________________________________________________________________________________ 11. Relacionar correctamente: I. H2O A. Diatómica II. CO B. Triatómica C. Tetratómica 12. Completar: “La nube electrónica presenta ___________________ y el núcleo atómico posee _______________________ y _______________________”. 13. ¿Cuántos neutrones posee el deuterio? ________________________________________________________________________________ Pág. 40 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 5º CLASE Química – 1º Secundaria ELEMENTO QUÍMICO I Cuando se toma cualquier muestra de materia, se observa que está formada por sustancias, las cuales presentan una composición elemental. Una muestra de sal está formada por dos elementos sodio y cloro y una muestra de azúcar está formada por tres elementos químicos: carbono, hidrógeno, oxígeno. Elemento químico: Es una porción de materia de composición definida, invariable, inclusive ante una reacción química. En una reacción nuclear se pueden originar nuevos elementos químicos. Los nombres de los elementos se debe al descubridor que puede asignarle por el nombre del lugar, nacionalidad, planeta, algún científico o propiedad del elemento. Francio Lugar: Francia Plutonio Planeta: Plutón Curio Científico: Curie Radio Propiedad: Radiatividad Símbolo químico: Es la representación literal de un elemento utilizando una letra o dos letras. La primera letra es mayúscula y la segunda es minúscula. Las letras provienen de su nombre en español o latín. Ejemplos: Carbono símbolo: C (es la primera letra de su nombre en español) Potasio símbolo: K (es la primera letra de su nombre en Latín: Katrium) INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 41 Emanuel CHRISTIAN SCHOOL El titanio es un metal blanco plateado, duro, se emplea en aviones militares y submarinos nucleares. El dicloro es un gas denso y tóxico, de color verde claro. Es muy venenoso. Pág. 42 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL Practiquemos: 1. ¿Qué porción de materia conserva sus propiedades, aún en una reacción química? ________________________________________________________________________________ 2. ¿Cómo se representan a los elementos químicos? ________________________________________________________________________________ 3. ¿Qué gas se usa en los dirigibles? ________________________________________________________________________________ 4. ¿Qué metal duro se usa en la fabricación de aviones militares y submarinos nucleares? ________________________________________________________________________________ 5. Completar: “El dicloro es un gas de color _________________ que resulta ser muy ____________________”. 6. ¿Cuáles son las formas de presentación del oxígeno? ____________________________________ y ____________________________________ 7. Indique el símbolo químico de cada elemento: I. Carbono: _____________________ II. Hidrógeno: _____________________ 8. Indique el nombre de los siguientes elementos: I. He: ______________________________ II. B : ______________________________ 9. Relacione correctamente: I. Manganeso II. Cromo III. Oxígeno: _____________________ IV. Nitrógeno: _____________________ III. F : ______________________________ IV. Ar: ______________________________ A. Mg B. Mn C. Cr 10. ¿Qué elemento químico posee número atómico igual a quince? ________________________________________________________________________________ 11. ¿Cuál es el número atómico del calcio? ________________________________________________________________________________ 12. ¿Qué gases constituyen los mayores porcentajes en el aire? ________________________________________________________________________________ 13. ¿Qué no metal posee número atómico 5? ________________________________________________________________________________ 14. ¿Qué metal posee muy baja densidad? ________________________________________________________________________________ 15. ¿Cuántos elementos químicos existen? ___________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 43 Emanuel CHRISTIAN SCHOOL Tarea Domiciliaria 1. A la representación literal de un elemento químico, se le llama: ___________________________ 2. ¿Cuántas letras usa el símbolo del manganeso?_______________________________________ 3. ¿Cuál es el gas más ligero? _____________________________________________ 4. ¿Cuáles son las formas de presentación del carbono? ___________________ y ________________________ 5. ¿Qué sustancia es el más reactivo? _____________________________________________ 6. ¿A que se debe el nombre de Plutonio? _____________________________________________ 7. Indique el símbolo químico de los elementos: I. Litio: _______________________ II. Berilio: _______________________ 8. Indique el nombre de los siguientes elementos: I. S: ____________________________ II. Al: ____________________________ III. Neón: _______________________ IV. Sodio: _______________________ III. Si : ____________________________ IV. K: ____________________________ 9. Relacione correctamente: I. Calcio II. Vanadio A. C B. Ca C. V 10. ¿Qué elemento químico posee número atómico igual a 24? ________________________________________________________________________________ 11. ¿Cuál es el número atómico del manganeso? _____________________________________________ 12. ¿Cuál es el porcentaje de dioxígeno en el aire? ________________________________________________________________________________ 13. ¿Cuál es el porcentaje de dinitrógeno en el aire? ________________________________________________________________________________ Pág. 44 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 6º CLASE Química – 1º Secundaria ELEMENTO QUÍMICO II Actualmente se conocen 112 elementos químicos, con sus respectivos nombres y símbolos químicos. Dichos elementos están debidamente ordenados en una Tabla Periódica Moderna (T.P.M), que presenta a los elementos químicos por su número atómico. El fósforo blanco es una sustancia de aspecto céreo, blanca y muy tóxica. Es una sustancia muy reactiva. El selenio es indispensable para la salud. Se le utiliza en enzimas y en aminoácidos. El titanio, es un metal blanco plateado duro, es el menos denso de los metales. El zirconio es un metal muy poco común, se usa para fabricar recipientes de combustible nuclear. El hierro es el principal componente del núcleo terrestre. Es maleable (en láminas) y dúctil (en hilos). El cobalto es un metal duro de color blanco azuloso. Es un material magnético. El níquel es un metal blanco plateado muy poco reactivo. Se usa para proteger el hierro. El cobre, la plata y el oro también se conocen como metales de acuñación. Son maleables y dúctiles. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 45 Emanuel CHRISTIAN SCHOOL El cobre es un metal blando y se usa a menudo en aleaciones; latón (para objetos de plomería) y bronce (para estatuas). Tenemos algunas aleaciones importantes del Cobre: Se han identificado más de 200 enzimas que usan zinc. El cadmio es un elemento tóxico presente en nuestros alimentos y normalmente se ingiere en niveles cercanos al máximo tolerable. El riñón es el órgano más susceptible al cadmio. Los fumadores absorben niveles apreciables de cadmio con el humo del tabaco. El acero es una aleación de hierro con carbono. Practiquemos 1. ¿Qué elemento químico posee número atómico igual a 26? _____________________________________________ 2. ¿Cuál es el símbolo químico del cobalto? _____________________________________________ 3. ¿Qué elemento químico posee símbolo “Ni”? _____________________________________________ 4. ¿Qué metal se usa para fabricar recipientes de combustible nuclear? _____________________________________________ 5. Relacionar correctamente: I. Galio II. Germanio A. Ga B. Go C. Ge 6. Completar: “El hierro es el principal componente del ___________________________ terrestre”. 7. ¿Qué metal se usa para proteger al hierro? _____________________________________________ 8. ¿Qué aleación de cobre sirve para la elaboración de estatuas? _____________________________________________ Pág. 46 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 9. ¿Cuáles son los componentes del latón? _____________________________________________ 10. ¿Qué metal es tóxico y se encuentra en los alimentos? _____________________________________________ 11. ¿Cómo se conocen a los metales cobre, plata y oro? _____________________________________________ 12. ¿Qué sustancia reactiva, muy tóxica, tiene aspecto céreo? _____________________________________________ 13. ¿Cómo se denomina a la aleación de hierro y carbono? _____________________________________________ 14. Indique a los metales maleables: I. Hierro II. Cobre III. Fósforo ________________________________________________________________________________ 15. ¿Qué metal es duro, de color blanco azuloso? _____________________________________________ Tarea Domiciliaria 1. ¿Qué elemento químico posee número atómico igual a 30? _____________________________________________ 2. ¿Cuál es el símbolo químico del Paladio? _____________________________________________ 3. ¿Qué elemento químico tiene símbolo “Cd”? _____________________________________________ 4. ¿Qué metal es el principal componente del núcleo terrestre? _____________________________________________ 5. Relacionar correctamente: I. Arsénico II. Plata A. Ar B. As C. Ag 6. Completar: “El cobre, la plata y el oro se conocen como metales de ______________________”. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 47 Emanuel CHRISTIAN SCHOOL 7. ¿Cuáles son los componentes del bronce? _____________________________________________ 8. Relacionar: I. Monedas de níquel II. Bronce A. Más duro que el latón B. Resistente a la corrosión C. Para la plomería 9. ¿Cuáles son dúctiles? I. Cobre II. Hierro III. Fósforo ________________________________________________________________________________ 10. ¿Qué elemento es indispensable para la salud, se utiliza en enzimas y en aminoácidos? ________________________________________________________________________________ 11. Completar: “El _________________________ es el órgano más susceptible al cadmio”. 12. ¿Qué elemento absorben los fumadores, con el humo del tabaco? ________________________________________________________________________________ 13. ¿Cuáles son los componentes del acero? ________________________________________________________________________________ 14. ¿Qué elemento está presente en las aleaciones: latón, bronce y monedas de níquel? ________________________________________________________________________________ 15. ¿Qué aleación es más durable que la plata pura? ________________________________________________________________________________ Pág. 48 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 7º CLASE Química – 1º Secundaria NÚCLIDO Cuando miramos la Tabla Periódica encontramos una serie de números. Por el momento nos interesan dos números: 1. Número atómico (Z) Es el número que identifica a un elemento, señala el número de protones con el número de neutrones. 2. Número de masa (A) Es el número de nucleones, indica el número de protones con el número de neutrones. 3. Núclido Es la representación de un átomo neutro, indicando el símbolo químico, número atómico y número de masa. Cuando un átomo es neutro el número de protones es igual al número de electrones. 4. Ion Es un átomo cargado debido a la ganancia o pérdida de electrones. Si posee carga positiva se denomina catión y se forma por la pérdida de electrones, a este proceso se llama oxidación. Si posee carga negativa se denomina anión y se forma por la ganancia de electrones, a este proceso se llama reducción. 5. Estado de oxidación Es la carga de un ion. Indica el número de electrones ganados o perdidos. La notación de un ion será: INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 49 Emanuel CHRISTIAN SCHOOL Un elemento químico posee uno, dos, tres, cuatro o cinco estados de oxidación: Por el valor del estado de oxidación el elemento puede ser monovalente, divalente, trivalente, tetravalente ...; si es 1; 2; 3; 4; ... Practiquemos 1. ¿Cómo se le llama al número de protones? ________________________________________________________________________________ 2. ¿Cómo se le llama al número de nucleones? ________________________________________________________________________________ 3. Para la especie: ; determine el número de protones. ________________________________________________________________________________ 4. Para la especie: ; determine el número de neutrones. ________________________________________________________________________________ 5. ¿Cuántos electrones posee la especie: ? ________________________________________________________________________________ 6. Indique los estados de oxidación del hierro. ________________________________________________________________________________ 7. Relacione correctamente: 8. Un ion tripositivo posee 36 electrones. ¿Cuál es el número atómico? ________________________________________________________________________________ 9. Un anión monovalente presenta 18 electrones. ¿Cuál es el número atómico? ________________________________________________________________________________ Pág. 50 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 10. El número de neutrones excede en seis unidades al número de protones. Si el número de masa es 42, hallar el número atómico. ________________________________________________________________________________ 11. El número de protones de un átomo es 26 y el número de electrones es 23. Determinar su estado de oxidación. ________________________________________________________________________________ 12. Si un átomo posee 34 protones y 40 neutrones, hallar el número atómico y el número de masa. ________________________________________________________________________________ 13. El número de neutrones es 3/2 del número de protones. Si el número de masa es 80, hallar el número atómico. ________________________________________________________________________________ 14. Un ion dinegativo tiene un número de 18 electrones y 20 neutrones. Hallar el número de electrones. ________________________________________________________________________________ 15. Un anión divalente posee 18 electrones y 20 neutrones. Hallar el número de masa. ________________________________________________________________________________ Tarea Domiciliaria 1. ¿Qué parámetro identifica a un elemento? ________________________________________________________________________________ 2. ¿Qué determina el número de nucleones de un elemento? ________________________________________________________________________________ 3. Si un átomo posee 15 protones y 16 neutrones, determinar: número atómico y número de masa. ________________________________________________________________________________ 4. Para la especie: ; indique el número de protones. ________________________________________________________________________________ 5. Para la especie: ; determine el número de neutrones. ________________________________________________________________________________ 6. Para el ion: ; determine el número de electrones. ________________________________________________________________________________ 7. Si una especie química posee 26 protones y 23 electrones, ¿cuál es su estado de oxidación? ________________________________________________________________________________ 8. La suma del número atómico con el número de masa es 280 y el número de neutrones es 120. ¿Cuál es su número atómico? ________________________________________________________________________________ 9. Un anión monovalente posee 54 electrones. ¿Cuál es su número atómico? ________________________________________________________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 51 Emanuel CHRISTIAN SCHOOL 10. ¿Cómo se llama al ión positivo? ________________________________________________________________________________ 11. Un ion tripositivo posee 23 electrones. ¿Cuál es su número atómico? ________________________________________________________________________________ 12. Relacionar correctamente: 13. ¿Cómo se llama al ion negativo? ________________________________________________________________________________ 14. Un catión divalente de número de masa 64 posee 35 neutrones. Hallar el número de electrones. ________________________________________________________________________________ 15. Un ion trinegativo posee 54 electrones y número de masa 127. Hallar el número de neutrones. ________________________________________________________________________________ Pág. 52 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 8º CLASE Química – 1º Secundaria ELEMENTOS QUÍMICOS - NÚCLIDOS El 92%de toda la materia en el Universo es hidrógeno. Se conocen tres isótopos del hidrógeno: • Protio (solo un protón) • Deuterio (un protón y un neutrón) • Tritio (un protón y dos neutrones) El aluminio se encuentra en estado sólido a 25ºC, es de color plateado. Es ligero, no tóxico, no magnético. El aluminio es un elemento abundante en la corteza terrestre, pero no se encuentra libre en la naturaleza. El aluminio ha sido vinculado con la enfermedad de Alzheimer (demencia senil). El galio es un metal blanco plateado que puede ser líquido a temperatura cercana a la del ambiente. Se expande en estado sólido. Se usa para humedecer el vidrio o la porcelana, y forma un espejo brillante cuando éste es pintado sobre el vidrio. El galio es normalmente un subproducto de la fabricación del aluminio. Para representar a un átomo neutro indicando su número atómico y número de masa, con el respectivo símbolo químico; se utiliza el Núclido. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 53 Emanuel CHRISTIAN SCHOOL Practiquemos 1. Indicar con (V) verdadero y (F) falso según corresponda: I. El hidrógeno es el gas más ligero que existe ................................................................... ( ) II. El oxígeno se encuentra en un 70%en el aire ................................................................ ( ) 2. Completar: “La cantidad de protones de un átomo se determina con un parámetro llamado_______________”. 3. Relacionar: I. Potasio A. P II. Argón B. K C. Ar 4. ¿Qué elementos químicos se consideran principales en la formación de compuestos orgánicos? I. Carbono II. Hidrógeno III. Azufre ________________________________________________________________________________ 5. ¿Qué elemento químico se presenta como un sólido amarillo que puede formar el ácido sulfúrico? ________________________________________________________________________________ 6. ¿Qué aleación forma la mezcla de hierro con carbono? ________________________________________________________________________________ 7. ¿Cuántos elementos químicos se conocen actualmente? ________________________________________________________________________________ 8. Un átomo posee 26 protones y 30 neutrones. Halle el número atómico y el número de masa. ________________________________________________________________________________ 9. En un Núclido se cumple que: A+Z = 92. Si el número de neutrones es 32, hallar el valor de “Z”. ________________________________________________________________________________ Pág. 54 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 10. Para el Núclido: ; indique el número de protones. ________________________________________________________________________________ 11. Para el Núclido: ; indique el número de neutrones. ________________________________________________________________________________ 12. ¿Cuántas partículas subatómicas en total posee el núclido: 80 Br35 ? ________________________________________________________________________________ 13. ¿Qué elemento posee un protón por átomos? ________________________________________________________________________________ 14. ¿Qué elemento químico posee veinte protones por átomo? ________________________________________________________________________________ 15. Un elemento químico posee dos isótopos cuyos números de masa suman 65 y presentan en total 35 neutrones. ¿De qué elemento se trata? ________________________________________________________________________________ Tarea Domiciliaria 1. Indicar con (V) verdadero y (F) falso según corresponda: I. El hidrógeno es un gas combustible .................................................................... ( II. El oxígeno forma parte del amoníaco .................................................................... ( ) ) 2. Completar: “A la suma de protones y ___________________ se le conoce como número _______________”. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 55 Emanuel CHRISTIAN SCHOOL 3. Relacionar: I. Azufre A. Ar II. Arsénico B. S C. As 4. ¿Qué elementos químicos forman el agua? ________________________________________________________________________________ 5. ¿Qué elemento químico se presenta como un gas amarillo verdoso que puede formar el ácido clorhídrico? ________________________________________________________________________________ 6. ¿Qué elemento químico está presente en el grafito? ________________________________________________________________________________ 7. ¿Cuál es el primer elemento químico formador del Universo? ________________________________________________________________________________ 8. Un átomo posee 30 protones y 35 neutrones. Determine el número atómico y el número de masa. ________________________________________________________________________________ 9. En un Núclido se cumple que: A+Z = 84. Si el número de protones es 28, hallar el número de neutrones. ________________________________________________________________________________ 10. Para el Núclido: ; indique el número de protones. ________________________________________________________________________________ 11. Para el Núclido: Pág. 56 ; indique el número de neutrones. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 2º BIMESTRE – 9º CLASE Química – 1º Secundaria RECORDANDO A LOS NÚCLIDOS Indique el número de protones, neutrones, electrones y nucleones de los siguientes átomos. p+ = 1. 53 Cr 24 p+ = 9F 2. nº = 19 3. nº = 70 30 Zn - - nº = e- = e = e = 4. p+ = ¿Quiénes son los nucleones? ______________________________ 5. ¿Quiénes son las partículas fundamentales? ______________________________ 6. ¿Qué partícula fundamental tiene mayor masa? ______________________________ 7. ¿Cuál es la zona de mayor densidad en el átomo? ______________________________ 8. ¿Cuántos neutrones presenta el siguiente átomo : a) 0 9. b) 2 c) 4 2x 2 E 2x d) 6 ¿Cuál será el número de masa del siguiente elemento: a) 16 b) 17 c) 18 ? e) N.A. 3x E 3x 4 d) 19 si tiene 15 protones? e) N.A. 10. El número atómico de un elemento es 13. Hallar el número de protones. a) 10 b) 11 c) 12 d) 13 e) N.A. 11. El número de masa se calcula sumando: ______________________________ 12. El carbono – 14 se utiliza para determinar la antigüedad de los huesos. Hallar el número de nucleones. a) 6 b) 8 c) 10 d) 12 e) 14 13. El átomo xy E posee 12 protones y 10 neutrones. Hallar : (y - x) a) 12 b) 10 c) 22 d) 4 e) N.A. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 57 Emanuel CHRISTIAN SCHOOL 14. ¿Cuál es la zona de menor densidad en el átomo? ______________________________ 15. ¿Quién descubrió el núcleo atómico? __________________________________ TAREA DOMICILIARA 1. Señale (V) ó (F) de la especie I. Tiene 7 neutrones 2. ¿Cuántos nucleones hay : a) 8 b) 9 14 N 7 II. Tiene 7 protones III. Tiene 14 nucleones 16 O? 8 d) 15 e) N.A. c) 16 d) 70 e) N.A. 4. Si la carga nuclear es 17. ¿Cuántos protones hay? a) 12 b) 15 c) 17 d) 19 e) N.A. 3. ¿Cuántas partículas fundamentales hay : a) 20 b) 40 IV 8 electrones c) 60 40 Ca 20 ? 5. Si la relación de protones y neutrones es de 3 a 5 y su masa es 80. ¿Cuántos protones hay en dicho átomo? a) 20 b) 30 c) 40 d) 50 e) N.A. Relacione correctamente: 6. Número de masa p+ + e- 7. Nucleones Electrón 8. Partícula fundamental Nube electrónica 9. Número atómico Pudín de pasas 10. Rutherford Zona nuclear 11. Thompson Núcleo atómico 12. Alta densidad p+ , nº 13. Baja densidad Z 14. Movimiento ondulatorio p+ , nº , e- 15. Captura electrónica A Pág. 58 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 1º CLASE Química – 1º Secundaria MODELO ATOMICO IONES ¿Qué son Iones? Son átomos con carga electrica positiva ó negativa, que se obtiene por ganancia ó perdida de electrones durante las transformaciones químicas 1. Ion Negativo o Anión.- Se obtiene por ganancia de e-. Notación : A x zE Ejm.: 2. 35 1 1 7 Cl # e- = z + x # e- = 17 + 1 = 18e- Ion Positivo ó Catión.- Se obtiene por perdida de e-. Notación : A x zE Ejm.: 40 2 20 Ca #e=z-x # e- = 20 - 2 = 18e- INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 59 Emanuel CHRISTIAN SCHOOL Ejm.: Completar Notación Átomo A z # p+ N # e- 23 1 1 1 Na 1 6 2 8O Especies Isoelectrónicas 21 1 0Ne EJERCICIOS DE APLICACIÓN 1. ¿Cuántos electrones presenta a) 20 2. ¿Cuántos protones presenta a) 3 3. b) 5 b) 10 b) 18 d) 22 e) 42 d) 6 e) 11 d) 12 e) 23 d) 30 e) 35 1 1 3 ? 5B ¿Cuántos electrones presenta a) 17 ? c) 40 ¿Cuántos neutrones presenta a) 1 4. b) 18 40 2 20 Ca c) 2 23 1 ? 1 1 Na c) 11 35 1 ? 1 7 Cl c) 16 5. Un átomo posee 15p+ y es un catión divalente. ¿Cuántos e- presenta? a) 14 b) 13 c) 15 d) 17 e) 18 6. Un átomo tiene A = 30 y N = 16 y es anión monovalente. ¿Cuántos e- presenta? a) 15 b) 16 c) 14 d) 13 e) 30 7. Cierto elemento tiene A = 36 y presenta 18e-, si es catión trivalente. ¿Cuántos protones presenta? a) 18 b) 19 c) 21 d) 33 e) 36 8. La especie 19K+1, ¿cuántos e- presenta? a) 19 b) 17 c) 18 Pág. 60 d) 20 e) 21 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 9. 10. 11. La especie 42X-3 posee 19e- luego tiene a) 42nº b) 19p+ c) 19nº d) 16p+ e) 16nº La especie 33E+2 posee 17e- luego tiene a) 14nº b) 33nº c) 17nº d) 15nº e) 18nº Las siguientes especies a) 36 40 2 20 Ca ; b) 18 7 1 3 Li c) 38 ; 35 1 . Hallar el total de electrones 1 7 Cl d) 40 e) 82 Indique el número de electrones 22Ti+2 a) 22 b) 20 c) 18 d) 24 e) 11 Indique el número de protones 23V+3 a) 20 b) 23 c) 26 d) 11 e) 29 d) 27 e) 51 TAREA DOMICILIARIA 1. 2. 3. Indique el número de neutrones a) 18 4. b) 23 La siguiente especie a) 28 51 5 23V c) 28 59 2 , ¿cuántos e- presenta? 28 Ni b) 26 c) 30 d) 59 e) 31 5. Un átomo es anión divalente y posee 16p+. ¿Cuántos e- presenta? a) 14 b) 16 c) 18 d) 8 e) 32 6. Un átomo es anión trivalente y posee 17p+. ¿Cuántos e- presenta? a) 14 b) 17 c) 20 d) 23 e) 26 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 61 Emanuel CHRISTIAN SCHOOL 7. ¿Cuántos neutrones presenta a) 18 b) 19 40 1 ? 1 9K c) 20 d) 21 e) 40 8. Cierto átomo A = 35 y z = 26, si es un anión trivalente. ¿Cuántos neutrones posee? a) 26 b) 23 c) 29 d) 9 e) 35 9. Indique el total de electrones en las especies : a) 30 Pág. 62 b) 40 c) 50 40 1 19 X d) 60 28 1 14 Y 30 1 1 6W e) 70 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 2º CLASE Química – 1º Secundaria MODELO ATOMICO II p e z # p+ = # e- = z Cuando un terrícola pierde o gana plata ¿Cómo se forma un ion? Un ion se forma cuando un átomo gana o pierde electrones ¿Por qué se gana o pierde electrones? Comparemos con un salón de clase cada uno de ustedes es un tipo de átomo diferente cada uno tiene una fuerza “un poder”. De igual forma hay átomos que son muy fuertes como el fluor (que esta en los colinos) el cloro (que esta en la lejía) y otros átomos que son débiles, entonces los átomos fuertes le quitan electrones a los átomos débiles y de esta forma nace un ion, el que gano los electrones se carga negativamente y su nombre es anión y el que pierde electrones se carga positivamente y su nombre es catión. Anión F + 1e- 9F-1 9 Átomo anión Neutro Catión Mg - 2e- 12 Mg+2 12 catión Se forma cuando el átomo pierde electrones y se carga positivamente. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 63 Emanuel CHRISTIAN SCHOOL ISÓTOPOS Sus número de masa son diferente porque no tienen igual número de neutrones. 14 kg 12 kg 1 1H 2 1H 3 1H Protio Deuterio Tritio Ejm. : Isótopos del hidrógeno ISÓBAROS 50 kg 50 kg de de 20 Ca Ejm. : 40 18 Ar Son átomos de diferente elemento tienen diferente número atómico diferente número de neutrones pero igual masa atómica 40 ISÓTONOS Son átomos de elementos diferentes que poseen igual número de neutrones. Ejm. : 23 Na 11 24 Mg 12 N= N= , 78 As 33 79 Se 34 N= N= Isótonos Pág. 64 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL EJERCICIOS DE APLICACIÓN 1. Un átomo posee 10 partículas fundamentales y 4 neutrones. Calcule el número de protones. a) 3 b) 4 c) 5 2. Se tiene el siguiente catión 45 Sc 3 21 d) 6 e) 7 . Indique lo incorrecto : a) Posee 24 partículas neutras b) Presenta 17 electrones c) Presenta 66 partículas fundamentales d) Es un catión trivalente e) Presenta 45 nucleones fundamentales 3. Un elemento químico esta formado por 3 isótopos de números de masa consecutivos, si en total poseen 51 nucleones fundamentales y 24 protones. Calcule el número de neutrones del átomo más pesado. a) 8 b) 9 c) 10 d) 11 4. Cierto anión trivalente es isótono con el 12 6C e) 12 e isoelectrónico con el 10 Ne . Determine el número de masa de dicho anión. a) 11 b) 12 c) 13 d) 15 e) 16 5. Con respecto a la estructura atómica actual, indique (V) ó (F) según corresponda : I. La envoltura electrónica es una región muy densa. II. En el núcleo del átomo sólo se pueden encontrar protones y neutrones. III. Los electrones poseen trayectorias definidas. a) FVV 6. 12 6C b) VVV 13 C 6 14 C 6 a) Isóbaros 7. 9F 1 , 11 Na d) FFF e) FVF son : b) Isótonos 1 c) FFV c) Isótopos son : __________________ 8. Cuando se aplica pez : _________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 65 Emanuel CHRISTIAN SCHOOL 9. La suma de los números de masa de 2 isótopos es 26 y la suma de neutrones es 14. ¿Cuál es el número atómico? a) 4 10. Si A 7E b) 6 11. Si A 8X 14 N 7 es isóbaro con a) 28 c) 7 a) 36 c) 7 24 Mg . 12 b) 12 e) N.A. d) 29 e) N.A. . ¿Cuánto es 2A + 1? b) 14 es isótono con d) 8 ¿Cuánto es 3A + 1? c) 24 d) 61 e) N.A. TAREA DOMICILIARIA 1. Relacionar : 1. Isótopos Gana electrones 2. Isóbaros Pierde electrones 3. Isolelectronicos Igual número de electrones 4. Isótonos Igual número de masa 5. Catión Igual número de protones 6. Anión Igual número de mesones Igual número de neutrones 2. Respecto al anión 9F I. Tiene 9 protones II. Tiene 8 electrones III. Tiene 10 electrones Pág. 66 1 es falso que : INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3. Se tiene que “x” es isótopo con 6 C y es isóbaro con 14 N. Hallar el número de neutrones de “x”. a) 6 b) 14 c) 8 4. Se tiene que “y” es isóbaro con 40 Ca d) 5 y es isótopo con e) 7 18 Ar . Hallar la suma de protones neutrones y electrones. a) 40 b) 18 c) 58 d) 60 e) N.A. 5. De las siguientes especies. ¿Cuál no es isoelectrónica con las demás? a) 19 K 1 b) 20 Ca 2 c) 9F 1 d) 17 Cl 1 e) N.A. 6. Define a un elemento químico a) A b) n d) # e- c) Z e) N.A. 7. ¿Cuál de los siguientes iones tiene mayor número de electrones? a) 1H 1 b) 12 Mg 2 c) 13 Al 3 d) 11 Na 1 e) N.A. 8. ¿En qué se diferencian 2 isótopos? __________________________________ 9. Un catión se forma con un átomo fuerte __________________________________ INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 67 Emanuel CHRISTIAN SCHOOL 10. Un anión se forma con un átomo débil __________________________________ 11. Encuentra las siguientes palabras en el conjunto de letras que se muestra Isóbaro Isótono Isótopo Catión Anión Protón Neutrón Núcleo Subnivel Orbital Nivel Principal Energía Spin Magnético Rotación Masa atómica Difuso Nucleones Electrones Pág. 68 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 3º CLASE Química – 1º Secundaria APLICACIONES DE LOS TIPOS DE ATOMOS 1. El Núclido 3xx 12 R 4 presenta 15 neutrones. Determinar su número atómico. a) 15 2. b) 4 c) 11 d) 5 e) 6 c) 3 d) 4 e) 5 En el siguiente esquema: x3- - 4e- xm+ x1+ + 3e- xnEl valor de m + n es: a) 1 b) 2 3. Sean dos isótopos cuyos números de masa suman 30 y la suma de neutrones es 14. Calcular el número atómico común. a) 7 b) 8 c) 9 d) 10 e) 11 4. Dos isótopos de oxígeno ( 208 O ) difieren en dos neutrones. Determinar la cantidad de neutrones del isótopo más ligero. a) 10 b) 11 c) 12 5. e) 14 ¿Cuál de las alternativas contienen un par de isótopos? a) 164 C ; 174N 6. d) 13 b) 186O ; 199F 40 d) 39 1 9K ; 1 9 K 24 c) 23 1 1 Na ; 1 2 Mg e) 1315P ; 32 19S El catión X2+ es isóbaro con el 47 21 Sc . ¿Cuál es el número atómico de dicho catión si tiene 25 neutrones? a) 18 b) 20 c) 22 d) 24 e) 26 7. Los siguientes átomos : x(z = 6) y w(z = 7) presentan en total 28 nucleones. Si ambos son isóbaros. ¿Cuántos neutrones presentará el ión X2+? a) 4 b) 6 c) 8 d) 10 e) 12 8. Los números atómicos de dos isóbaros son 94 y 84 respectivamente. Si la suma de sus neutrones es 306. ¿Cuál es el número de masa de uno de los isóbaros? a) 89 b) 143 c) 121 d) 242 e) 175 9. Se tiene dos isótopos, la suma de sus números de neutrones es 40 y la diferencia de sus números atómicos es 20. Hallar el valor del mayor número de masa. a) 10 b) 20 c) 30 d) 40 e) 50 10. 50 Un átomo es isóbaro con 40 1 8 Q e isótono con 25 M . Hallar su número atómico. a) 15 b) 13 c) 12 d) 11 e) 10 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 69 Emanuel CHRISTIAN SCHOOL TAREA DOMICILIARIA 1. El anión monovalente, cuyo número de masa 35 posee igual número de neutrones y electrones. Determinar su número atómico. a) 15 b) 16 c) 17 d) 34 e) 36 2. Un catión divalente presenta 36 electrones y 38 neutrones. Calcular el número másico. a) 74 b) 75 c) 76 d) 77 e) 78 3. Un catión divalente de número másico 116 es isoelectrónico con un gas noble de número atómico 54. Señale el número de neutrones del catión. a) 56 b) 58 c) 60 d) 62 e) 64 4. Un elemento químico presenta 3 isótopos cuyos números de masa suman 706 y presentan en total 430 neutrones. Indique que elemento es a) 90Th b) 94Pu c) 92U d) 88Ra e) 86Rn 5. Un anión divalente es isoelectrónico con el ión 200 90Th Fr+1 y además es isótono con la especie 87 . Señalar el número de masa del anión. a) 186 b) 188 c) 190 d) 192 e) 194 6. Dos isótonos de números atómicos consecutivos poseen números de masa que suman 53. Calcular el número de masa del isótono liviano. a) 24 b) 28 c) 26 d) 23 e) 25 7. Dos isóbaros poseen números atómicos que suman 87 y presentan en total 93 neutrones. Indique el número de masa del isóbaro de menor carga nuclear. a) 82 b) 85 c) 90 d) 96 e) 100 8. Los iones X4+ ; Y3+ ; W2- son especies isoelectrónicas, cuyos números atómicos suman 155. Señale el número atómico de “X” a) 50 b) 54 c) 51 d) 53 e) 52 9. Indicar que especies presentan la relación correcta 24 a) 24 1 1 Na ; 1 2 Mg : isótonos b) 162C ; 164 C : isomásicos 40 43 Ca ; 21 Sc 1 : isoelectrónicos c) 20 d) 186O ; 164 C : presentan 30 nucleones 2 ; 60 Zn : 172 partículas fundamentales e) 54 26Fe 30 Pág. 70 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 4º CLASE Química – 1º Secundaria CONFIGURACION ELECTRONICA ¿Qué es Configuración Electrónica? Es la distribución de electrones en los Niveles, Subniveles y Orbitales bajo principios naturales y experimentales. PRINCIPIO DE AUFBAU (Construir) Los elementos de un átomo se distribuyen en los niveles y subniveles de menor a mayor Energía Relativa (E.R.). E.R. = n + Niveles de Energía (n) : Son los niveles ó capas del átomo. K n= 1 L 2 M 3 O N 4 5 P 6 Q 7 Cap as K L M N O P Q … … Nive l 1 2 3 4 5 6 7 … … Subniveles de Energía () : Subnivel Símbolo Valor de Sharp s 0 Principal p 1 Difusso d 2 Fundamental f 3 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 71 Emanuel CHRISTIAN SCHOOL Ejm. : Indique el orden de distribución de los electrones según el orden creciente de su energía relativa de los subniveles : 2p ; 1s; 6d ; 4f ; 3p. Subniveles n E.R. 2p 1s 6d 4f 3p Ordenando : ______________________________________ REGLA DE SARRUS Es una forma práctica para realizar la distribución electrónica por subniveles según el principio de Aufbau. Niveles (n) 1 2 3 4 5 6 7 s2 s2 s2 s2 s2 s2 s2 p6 p6 p6 p6 p6 p6 d10 d10 d10 d10 f14 f14 Subnivel () Capacidad real e- x nivel Forma larga: ____________________________________________________________ EJERCICIOS DE APLICACIÓN 1. Si se trata de la capa M es el nivel : a) 1 b) 2 c) 3 d) 4 e) 5 2. Si se trata de la capa Q es el nivel : a) 1 b) 3 c) 5 d) 6 e) 7 Pág. 72 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3. Si tenemos n = 6 es la capa : a) K b) M c) O d) P e) Q 4. Si tenemos n = 1 es la capa : a) K b) L c) M d) P e) Q 5. Si tenemos el subnivel sharp (s) que valor toma : a) 0 b) 1 c) 2 d) 3 e) 4 6. Si tenemos el subnivel principal (p) que valor toma : a) 0 b) 1 c) 2 d) 3 e) 4 7. Si : = 3 hablamos del subnivel a) s b) p c) d d) f e) g 8. Si : = 2 hablamos del subnivel a) s b) p c) d d) f e) g 9. Calcule la E.R. para el subnivel : 3d a) 1 b) 2 c) 3 d) 4 e) 5 10. Calcule la E.R. para el subnivel : 4f a) 1 b) 3 c) 5 d) 7 e) 9 11. Calcule la E.R. para el subnivel : 6s a) 5 b) 6 c) 7 d) 8 e) 4 12. Mencione la C.E. correcta para a) b) c) d) e) 35 Cl 17 1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p6 3s7 1s2 2s2 2p10 3s5 1s2 2s2 2p6 3s2 3p5 1s2 2s2 2p6 3s1 3p6 13. La C.E. para el Germanio con 32 protones es : a) 1s2 2s2 2p6 3s2 3p6 4s2 3d12 b) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 c) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 d) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 14. La cantidad de electrones para el 7N en su última capa es : a) 2 b) 3 c) 5 d) 6 e) 7 15. La cantidad de electrones para el 35Br en su capa L y su último nivel son : a) 8, 2 b) 2, 8 c) 8, 5 d) 5, 7 e) 8, 7 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 73 Emanuel CHRISTIAN SCHOOL TAREA DOMICILIARIA 1. Si se trata de la capa N es el nivel : a) 1 b) 2 c) 3 d) 4 e) 5 2. Si se trata de la capa P es el nivel : a) 2 b) 4 c) 6 d) 7 e) 8 3. Si hablamos de las capas L, M y N son los niveles a) 1, 2, 3 b) 2, 3, 4 c) 3, 4, 5 d) 4, 5, 6 4. Si hablamos del n = 7 es la capa : a) K b) M c) O d) P e) Q 5. Si tenemos el nivel cuarto es la capa : a) K b) L c) M d) N e) O 6. Si tenemos el subnivel difusso (d) el valor de es : a) 0 b) 1 c) 2 d) 3 e) 4 7. Si tenemos el subnivel fundamental (f) es valor de es : a) 0 b) 2 c) 3 d) 1 e) 4 8. Si : = 2 el subnivel es : a) s b) p c) d d) f e) g 9. Si : = 0 el subnivel es : a) s b) p c) d d) f e) g 10. La E.R. para el subnivel 7s es : a) 2 b) 3 c) 5 d) 7 e) 8 11. La E.R. para el subnivel 3d es : a) 2 b) 3 c) 4 d) 5 e) 6 12. Quienes poseen subniveles degenerados : a) 1s, 2s b) 2p, 3s c) 4s, 5s e) 2, 3, 5 d) 3d, 4d e) 4p, 4s 13. Haga la C.E. para los siguientes elementos : 7N, 12Mg , 26Fe 14. Calcule los electrones del último nivel para los elementos : 6C , 9F , 35Br 15. Haga la C.E. para los siguientes elementos y calcule los electrones del penúltimo y último nivel : 3Li , 8O , 20Ca , 32Ge Pág. 74 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 5º CLASE Química – 1º Secundaria CONFIGURACION ELECTRONICA II Esta semana, vamos a distribuir electrones entorno al núcleo atómico. 1. Distribución de Electrones en un Subnivel : Ejm. : 4s1 0 Graficamos los orbitales del subnivel y distribuimos uno a uno los electrones según su spin. 3p5 -1 0 +1 -1 0 +1 Distribuimos hasta que todos los orbitales estén semillenos y si la cantidad de electrones me alcanza procedo a llenarlos con el spin contrario 4d7 5p4 5f12 3d3 -2 -1 0 +1 -1 0 +1 -3 -2 -1 0 -2 -1 0 +1 +2 +1 +2 +3 +2 2. Regla de Energías Relativas (E.R.) : Sirve para sobre si un subnivel, respecto de otro posee más o menos energía, según : E.R. = n + INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 75 Emanuel CHRISTIAN SCHOOL n : N. C. Principal : N. C. Secundario Ejm. : Ordenar de menor a mayor energía relativa * 5p * 7s * 3d * 4s Sol. : Subniveles : 5p E.R. 7s 3d 7+0 3+2 4+0 6 7 5 : 5+1 E.R.(5p) = 6 E.R.(7s) = 7 4s 4 E.R.(3d) = 5 E.R.(4s) = 4 4s , 3d , 5p , 7s Ojo : Si los subniveles presentan igual energía relativa se denominan “degenerados”. Ejm. : * 4f * 7s * 6p * 5d E.R. (4f) = E.R. (7s) = E.R. (6p) = E.R. (5d) = 7 ¿Quién tiene mayor energía real? Rpta. : Quien posea mayor nivel Ejercicios: 1. Ordenar de menor a mayor energía relativa : 5d 3p 2s 4p 5f a) b) c) d) e) 3p , 2s , 5d , 4p , 5f 2s , 3p , 4p , 5d , 5f 5f , 5d , 2s , 4p , 3p 2s , 5f , 3p , 5d , 4p 4p , 3p , 5f , 2s , 5d 2. Realice la configuración electrónica de : 13Al a) b) c) d) e) Pág. 76 1s2 2p2 3s2 3p7 1s2 2p2 2p3 3s2 3p4 1s2 2s2 2p6 3s2 3p1 1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p6 3s2 3d1 3. ¿Cuántos subniveles se utilizan al realizar la configuración electrónica de 23V? a) 3 b) 4 c) 5 d) 6 e) 7 4. Señale cuántos subniveles “s” llenos para el 11Na a) 0 b) 1 c) 2 d) 3 e) 4 5. Un elemento presenta la siguiente configuración : 1s2 2s2 2p6 3s2 3p6 además posee 40 nucleones. Hallar su número de neutrones. a) 23 b) 22 c) 24 d) 18 e) 40 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 6. Un elemento presenta 30 nucleones y 16 neutrones realice su C.E. : 7. Cierto átomo presenta en su tercer nivel 16 electrones. Su número atómico es : a) 26 b) 28 c) 29 d) 27 e) 30 8. La configuración electrónica de un átomo termina en 4d7. ¿Cuántos electrones presenta en su último nivel? a) 2 b) 4 c) 6 d) 8 e) 9 9. Un electrón presenta como energía relativa 4 y se encuentra en el nivel “M”. Se encuentra en el subnivel. a) s b) p c) d d) f e) F.D. 10. Hallar el número máximo de electrons que puede contener un átomo con 2 subniveles “p” llenos. a) 35 b) 30 c) 20 d) 19 e) 18 TAREA: 1. Dar el número cuántico magnético donde se ubica el último electrón de la notación : 5d7 a) -2 b) -1 c) 0 d) +1 e) +2 2. Si el número cuántico magnético de 3px es +1 además su spin es -1/2. Hallar “x”. a) 2 b) 3 c) 4 d) 5 e) 6 3. Ordene de menor a mayor energía relativa : 3s 5p 6d 4f a) 3s , 5p , 6d , 4f b) 5p , 4f , 3s , 6d c) 3s , 5p , 4f , 6d d) 4f , 3s , 6d , 5p e) 6d , 5p , 4f , 3s 4. Realice la C.E. de 20Ca : a) 1s2 2s2 2p6 3s2 3p6 4s2 b) 1s2 2s2 2p6 3s2 3p8 c) 1s2 2s2 2p2 3s2 3d10 3p2 d) 1s2 2s2 3s2 3p6 4s2 3d6 e) 1s2 2s2 2p6 3s2 3d10 5. ¿Cuántos subniveles se utilizan al realizar la C.E. de 33As? a) 4 b) 5 c) 6 d) 7 e) 8 6. ¿Cuántos subniveles presenta : 50Sn? a) 1 b) 2 d) 4 e) 5 “p” llenos c) 3 7. Un elemento presenta la siguiente configuración: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5, además posee 80 nucleones. Hallar su número de neutrones. a) 35 b) 40 c) 45 d) 30 e) 50 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 77 Emanuel CHRISTIAN SCHOOL 8. Un elemento presenta 56 nucleones y 30 neutrones, realice su C.E. : 9. Un átomo presenta 3 electrones en el 4º nivel, su número atómico es : a) 20 b) 21 c) 24 d) 30 e) 31 10. Cierto elemento presenta en su tercer nivel 13 electrones. ¿Su número atómico es? a) 25 b) 19 c) 15 d) 27 e) 34 5 11. La C.E. de un átomo termina en 4p los electrones en su último nivel son : a) 5 b) 15 c) 17 d) 7 e) 1 Pág. 78 12. Un electrón presenta energía relativa igual a 5 si se encuentra en la capa “N”. ¿El subnivel es? a) s b) p c) d d) f e) g 13. Hallar el número máximo de electrones que puede contener un átomo con 3 subniveles “p” llenos. a) 53 d) 54 b) 36 e) 37 c) 35 14. Realizar la configuración electrónica de los 30 primeros elementos de la tabla periódica. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 6º CLASE Química – 1º Secundaria TABLA PERIODICA I ANTECEDENTES DE LA TABLA PERIÓDICA ACTUAL I. Triadas de Johan Döbereriner Los elementos que pertenecen a una triada poseen propiedades químicas semejantes. El elemento central posee un peso atómico aproximado o igual a la semisuma de los pesos atómicos de los elementos extremos. Ejemplo : II. Ordenamiento Meridional o Tornillo Telúrico de Chancourtois Dispuso los elementos siguiendo el orden de los pesos atómicos, sobre una curva helicoidal en el espacio, de modo que los pesos atómicos de los puntos que se correspondian en las sucesivas vueltas de la hélice diferencian en 16. III. Ley de las Octavas de Newlands Descubrió una sorprendente regularidad al ordenar los elementos entonces conocidos según el orden creciente de sus respectivos pesos atómicos, omitiendo al hidrógeno. Li Na Be Mg B Al C Si N P O S F Cl K INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 79 Emanuel CHRISTIAN SCHOOL Según la ordenación anterior cada octavo elemento subsiguiente a uno cualquiera tiene propiedades análogas a este; el Na y el K tienen propiedades parecidas al Li; el Mg tiene propiedades análogas a los del Be; el Si análogo en sus propiedades al C, etc. Puesto que el octavo elemento a partir de uno dado, era una especie de repetición del primero, tal como sucede con la nota octava de la escala musical. Newlands dio a esta relación el nombre de Ley de las Octavas. Pero esta regularidad se suspendió con los elementos que le siguen al potasio. IV. Tabla Periódica de Dimitri Mendeleiev y Lothar Meyer : Dio a conocer una ordenación (tabla) más completa de los elementos basadas en las propiedades químicas, como función del peso atómico. Simultáneamente Lothar Meyer, propuso una clasificación análoga a la de Mendeleiev, considerando las propiedades físicas (especialmente el volumen atómico) como función de los pesos atómicos relativos. Descripción de la Tabla de Mendeleiev La represento en una tabla de ocho columnas verticales (grupos), en las cuales ubicó los elementos de acuerdo con sus propiedades químicas y la composición de sus óxidos, de sus hidruros, de los cloruros; conservando el orden creciente de sus masas atómicas relativas. En resumen, Mendeleiev destacó con más claridad la importancia de la periocidad (algo que se repite con cierta regularidad); además de haber predicho la existencia de elementos (no descubiertos todavía), para los cuales reservó espacio en su tabla y adelantó sus propiedades. Sin embargo tuvo anomalías. El hidrógeno (H), elemento importante, no tenia un lugar adecuado en la Tabla. Los Metales y No Metales no se encuentran bien diferenciados. Solo destaca una valencia para cada elemento cuando algunos tienen más de una. Algunos elementos no cumplían con el orden creciente de sus pesos atómicos. Ejemplo : Debería de ser así Así esta I Te Te I 126,9 127,6 127,6 126,9 V. Tabla Periódica Moderna Actual Fue diseñada por Werner en base a la Ley de Moseley, quien de sus investigaciones concluyo que a cada elemento se le podía asignar un número entero que era proporcional a la raíz cuadrada de la frecuencia de los rayos x resultantes, y observó que ella era una función lineal de la posición del elemento en la Tabla Periódica. Por lo tanto las propiedades de los elementos químicos es una función periódica de su número atómico (Z). Pág. 80 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL EJERCICIOS: 1. Ordeno los elementos de 3 en 3 llamándolas triadas a) Newlands 7. Realizo trabajos de investigación con rayos X y descubre la ley periódica b) Döbereiner c) Moseley a) Moseley d) Meyer b) James W c) Döbereiner e) Chawcourtoins 2. Se tiene la siguiente triada : x , y , z ; si d) Newlands e) Lothar Meyer P.A.(x) = a , P.A.(y) = b. ¿Cuánto vale el P.A.(z)? a) (a + b)/3 b) (a + b)/2 c) (a - b)/2 d) 2b – a 8. En la siguiente triada, encontrar el valor de “x”. e) 2a – b a) 4 3. Se denominó ley de las octavas porque ordeno de : a) 3 en 3 b) 5 en 5 d) 8 en 8 e) N.A. b) 6 c) 7 d) 9 e) 11 9. En la siguiente triada, encontrar el valor de “x”. c) 7 en 7 4. Fue quien denominó la Ley de las a) 134 b) 135 c) 136 d) 137 e) 138 Octavas a) Döbereiner c) Meyer b) Newlands 10. La ley de octavas fue propuesta por: a) Newlands b) Mendeleiev c) Moseley d) Meyer e) Chancourtois d) James Werner e) Mendeleyec 5. Fue uno quien aporto para la primera tabla periódica debido a sus propiedades químicas a) Meyer c) Newlands b) Döbereiner d) Werner e) Mendeleyec 6. Pronostico la existencia de nuevos 11. Una “octava” poseía en su estructura ... elementos. a) 4 b) 7 c) 5 d) 8 e) 6 12. El ordenamiento llamado ley de octavas se basaba en: a) Número atómico b) Número electrónico c) Número cuántico d) Número general e) Masa atómica elementos, la clasificación de : a) Triadas d) Caracol Telúrico b) Octavas e) Ley Periódica c) 1ra. Tabla Periódica INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 81 Emanuel CHRISTIAN SCHOOL TAREA: 1. Las domino triadas porque ordeno de : a) 1 en 1 b) 3 en 3 d) 8 en 8 e) N.A. 7. Descubre la ley periódica moderna en función al número atómico (z) : c) 7 en 7 2. Fue quien denomino triadas hablamos de : a) Newlands b) Meyer d) Mendeleyec b) Döbereiner c) Moseley d) Werner e) Chancourtoins c) Moseley e) Döbereiner a) Newlands 8. A continuación se representa una “triada” de elementos, ¿cuál será el peso atómico del elemento “C”? 3. Si se tiene la triada : A , B , C ; si P.A.(A) = m , P.A.(B) = n. ¿Cuánto es P.A.(C)? a) m – n b) m + n d) 2m – n e) 2n – m a) 15 c) (m + n)/2 9. b) 30 c) 32 d) 39 2 e) 46 2 Hallar el valor de: R = 1/2(a +b +2ab), donde “a” y “b” se relacionan por la siguiente triada: 4. Ordeno de 7 en 7 la cual denomino ley de octavas, hablamos de : a) Döbereiner b) Newlands c) Meyer d) Werner a) 942 e) Mendeleyec b) 966 c) 964 d) 968 e) 965 10. Sea la siguiente triada de Dobereiner: 5. Fue uno quien aporto para la primera tabla periódica debido a sus propiedades físicas : a) Meyer c) Newlands e) Moseley b) Döbereiner d) Mendeleyec 6. Clasificación de elementos en grupos I al VIII y pronostico nuevos elementos : a) Ley de Octavas b) Triadas c) Ley Periódica Estimar la masa atómica aproximada del teluro. a) 124 b) 126 c) 128 d) 130 e) 126,7 11. Complete: ..., propuso un ordenamiento de los elementos en función creciente a sus pesos atómicos, observando que cada octavo elemento repetía aproximadamente las propiedades del primero. a) Newlands b) Mendeleiev c) Meyer d) Dobereiner e) Moseley d) 1ra Tabla Periódica e) Actual Tabla Periódica Pág. 82 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 3º BIMESTRE – 7º CLASE Química – 1º Secundaria TABLA PERIODICA II INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 83 Emanuel CHRISTIAN SCHOOL Pág. 84 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 85 Emanuel CHRISTIAN SCHOOL PRACTIQUEMOS: I. Indicar el símbolo, en qué grupo y familia se encuentran los siguientes elementos: a) Litio b) Berilio c) Calcio d) Cinc e) Germanio f) Bismuto g) Polonio h) Astato i) Argón j) Plomo k) Mercurio l) Francio m) Plata n) Tantalio o) Yodo p) Kripton q) Teluro r) Manganeso s) Silicio t) Potasio u) Azufre v) Escandio w) Platino x) Renio y) Cadmio z) Vanadio II. Ordene de manera creciente a sus grupos a los siguientes elementos: a) Potasio b) Vanadio c) Cobalto d) Cloro e) Galio f) Pág. 86 Magnesio INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL g) Fluor h) Titanio i) Oxigeno j) Neon k) Estaño l) Talio m) Cesio n) Fierro o) Ruterio III. Separar a los siguientes elementos por grupos y familias a) Hidrogeno b) Fierro c) Molibdeno d) Indio e) Plomo f) Lantano g) Zirconio h) Calcio i) Fosforo j) Selenio k) Bromo l) Oro m) Renio n) Cesio o) Rubidio INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 87 Emanuel CHRISTIAN SCHOOL TAREA: 1. Utilizando los elementos de la tabla periódica forma los nombres de todos los compañeros de tu salón e indicar a que familia y grupo pertenecen dichos elementos. 2. Investigar ¿cuál es el elemento químico presente en la tabla periódica más pesado? 3. Investigue y complete los siguientes términos: a) Halógeno b) Terreo c) Ionización d) Elemento e) Afinidad electrónica 4. Encuentra en el siguiente pupiletras el nombre de catorce elementos químicos. Luego, con los elementos encontrados elabora una lista de ellos e indica a que periodo, grupo y familia pertenecen. Pág. 88 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 1º CLASE Química – 1º Secundaria UBICACION DE LOS ELEMENTOS EN LA TABLA PERIODICA 1 IA VIII A 1 s2 s II A 2 III A IV A V A VI A VII A s2 p1 3 4 III B IV B V B VI B VII B d1 s d2 VIII B IB p3 p2 p 0 5 p5 II B d1 d3 p4 d 6 7 f1 f2 f14 f Para elementos representativos (Grupo A) Período : # período = mayor nivel en la C.E. Grupo # grupo : = #e- del último nivel Ejm. : (2e- = II A) Ca (z = 20) : 1s2 2s2 2p6 3s2 3p6 4s 2 20 Período = mayor nivel Período (n = 4) =4 Grupo = #e- último nivel = 2 II A 2 + 5 = 7e- = VII A Br (z = 35) : 1s2 2s2 2p6 3s2 3p6 4s 2 3d10 4p 5 35 Período = 4 Grupo = VII A INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Período (n = 4) Pág. 89 p6 Emanuel CHRISTIAN SCHOOL EJERCICIOS DE APLICACIÓN 1. Diga en que período y grupo esta el hidrógeno a) 1, I B 2. c) 1, I A d) 2, I A e) 2, I B b) 2, II A c) 2, VII A b) 2, I A c) 3, I B d) 3, I A b) 2, VII A c) 3, V A d) 3, VII B e) 3, VII A b) 4, IV A c) 4, II A d) 4, IV B e) 3, IV A d) 2, VI A e) 2, VII B Ubique al 11Na : a) 1, I A 4. 5. e) 3, II A Ubique al 17Cl : a) 1, II A Ubique al 32Ge : a) 3, IV A 6. b) 1, II A Ubique el 9F : a) 2, V A 3. (z = 1) Si un elemento de segundo periodo y grupo V A se trata del : a) 3Li 7. b) 4Be c) 7N d) 6C Si un elemento de tercer período y grupo III A se trata del : a) 10Ne b) 17Cl c) 16S d) 13Al 8. e) 12Mg Si un elemento de cuarto período y grupo VI A se trata de : a) 35 Br 9. e) 9F b) 20Ca c) 34Se d) 32Ge e) 33As Si un elemento termina su C.E. en … 4p3 se ubica en el grupo : a) I A Pág. 90 b) III A c) V A d) IV A e) VI A INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 10. Si un elemento termina su C.E. en …3s2 pertenece a la familia de : a) Alcalino 11. b) Boroide d) Halogeno e) Alcalino Terreo ¿Qué elemento pertenece a un boroide? a) 3Li 12. c) Carbonoide b) 9F c) 35Br d) 10Ne e) 13Al c) 17Cl d) 53I e) 52Te d) 1, VIII A e) 1, III A No es un halogeno : a) 9F b) 35Br TAREA DOMICILIARIA 4 2 1. Ubique al He : a) 1, II B 2. Ubique al a) 1, VI A b) 1, I A 12 C 6 c) 2, II A : b) 2, V A c) 1, V A d) 2, IV A e) 2, IV B 3. Ubique al aluminio que posee 13 protones : a) 2, III A b) 2, III B c) 3, III B d) 3, III A e) 4, III B d) 3, VII B e) 3, VII A 4. Si un átomo presenta A = 35 y n = 18 se ubica en : a) 2, IV A b) 3, V A c) 3, VI A 5. Si se tiene un átomo neutro con 15e- se ubica en : a) 3, V A b) 3, V B c) 3, II A d) 3, III A e) 3, III B INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 91 Emanuel CHRISTIAN SCHOOL 6. Si un átomo con 2 niveles y grupo II A se trata de : a) 3Li b) 6C c) 9F d) 4Be e) 2He 7. Si un elemento del tercer período y grupo VIII A se trata : a) 10Ne b) 17Cl c) 18Ar d) 20Ca e) 36Kr 8. Si un elemento de cuarto período y grupo I A se trata : a) 10Ne b) 17Cl c) 18Ar d) 20Ca e) 19K 9. Si un elemento termina su C.E. en …3p3 se ubica en el grupo : a) I A b) II A c) IV A d) V B e) V A 10. Si un elemento termina su C.E. en …4p5 pertenece a la familia : a) Alcalino b) Boroide c) Gas Noble d) Halógeno e) Carbonoide 11. Si un elemento termina su C.E. en …5s1 pertenece a la familia : a) Boroide b) Carbonoide c) Anfígeno d) Alcalino e) Alcalino Terreo 12. Si un elemento termina su C.E. en …4p4 pertenece a la familia : a) Halógeno Pág. 92 b) Gas Noble c) Alcalino d) Calcogeno INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL e) Boroide Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 2º CLASE Química – 1º Secundaria NOTACION LEWIS NOTACIÓN DE LEWIS Es la representación de los electrones de valencia (electrones del último nivel de energía) mediante puntos o asteriscos alrededor del símbolo del elemento. Cada punto o asterisco representa a un electrón. Ejemplo : Para el 10 Ne : C.E. : 1s2 2s2 2p6 Para el último nivel 8 2 + Núcle o Niv Neón N 2 1 Observación.- Los ocho puntos alrededor del neón representan a los electrones del último nivel de este átomo. Los elementos ubicados en un mismo grupo de la tabla periódica (Grupo A) tienen el mismo diagrama de Lewis, ya que presentan igual número de electrones de valencia. Grupo IA Notación de Li IIA B e IIIA B IVA VA VIA VIIA B N O F Gas Noble N a Lewis Regla del Octeto.- "Todos los átomos tienen la tendencia a completar 8 electrones en la última capa, o tener configuración de gas noble". EJERCICIOS DE APLICACIÓN 1. Determinar el número de electrones de valencia del nitrógeno (z = 7) a) 2 b) 3 c) 4 d) 5 e) 6 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 93 Emanuel CHRISTIAN SCHOOL 2. ¿Cuál de los siguientes elementos presenta mayor número de electrones de valencia? a) 3Li b) 12Mg c) 9F d) 16S e) 13Al 3. ¿Cuántos electrones de valencia encontramos en : E ? a) 1 b) 2 c) 3 d) 0 e) 4 4. En el problema anterior dicho elemento pertenece al grupo. a) IA b) IIA c) IIIA d) IIIBe) IIB 5. La representación Lewis para los carbonoides es: a) x b) x c) x d) x e) x 6. ¿Cuántos electrones de valencia encontramos en? x a) 1 b) 2 c) 3 d) 0 7. La representación Lewis para un átomo cuyo a) x b) x c) x e) 4 (z = 16) es: d) x e) x 8. ¿Cuál de los siguientes diagramas de Lewis representa a un elemento con 7 electrones de valencia? a) E b) E c) E d) E e) E 9. Si un elemento posee 20 nucleones y 10 neutrones. ¿Cuál es su notación Lewis? a) x Pág. 94 b) x c) x d) x e) x INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL TAREA DOMICILIARIA 1. La representación Lewis de un átomo cuyo z = 20 es: b) x a) x c) x e) x d) x 2. La representación Lewis de un átomo cuyo z = 15 es: b) x a) x c) x e) x d) x 3. Representar mediante Lewis : 6C : ................................................................ 11Na: .............................................................. 15P: .............................................................. 18Ar : ............................................................. 25Mn: ............................................................. 39Cu: .............................................................. 33As : .............................................................. 53I: ................................................................. 56Ba: .............................................................. 82Pb: .............................................................. 4. ¿Cuál de los siguientes diagramas de Lewis representa a un elemento con 7 electrones de valencia? a) E b) E d) E e) E c) E 5. Si un elemento posee 20 nucleones y 10 neutrones. ¿Cuál es su notación Lewis? a) x d) x b) x c) x e) x INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 95 Emanuel CHRISTIAN SCHOOL Pág. 96 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 3º CLASE Química – 1º Secundaria ENLACE QUIMICO CLASES DE ENLACE Iónico Covalente (Electrovalen te ó electrostátic o) x +n y Normal -n Coordinado xy Polar Apolar x-y x-x ENLACE IÓNICO.- Se caracteriza : Porque se da principalmente entre un metal (IA o IIA) y un no metal (VIA o VIIIA) Porque su diferencia de electronegatividades entre los átomos es mayor o igual a 1,7. Por la transferencia de e del átomo menos electronegativo al más electronegativo. ENLACE COVALENTE.- Se caracteriza : Por la comparación de e de los átomos que forman el enlace. Porque se da entre no metales Por la multiplicidad del enlace, puede ser : simple, doble, triple. En el Enlace Polar la compartición de e es desigual. En el Enlace Apolar la compartición de e es equitativa. En el Enlace Coordinado o Dativo un átomo es el que aporta los 2 e del enlace. FUERZA DE LOS ENLACES (Dif. en E. Iónico Ec. Polar Ec. Apolar < (Dif. en menor que 1,7) < (Dif. en mayor que 0) INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL 1,7) Pág. 97 Emanuel CHRISTIAN SCHOOL 3. Indique que pareja no presenta enlace Ejercicios: iónico 1. Son características del enlace iónico: 1. Se presenta en la combinación que se produce entre un metal y un no metal. 2. Se produce por transferencia b) NaBr d) CIO c) CaF e) NaCl de 4. Colocar “V” o “F” según corresponda electrones. 3. La a) KF atracción interatómica es de carácter electrostático. 4. La diferencia de electronegatividades I. HIO3 : enlace covalente coordinado II. O3 : enlace dativo III. NaF : enlace covalente polar IV. debe ser menor que 1,7. CO2 : enlace covalente apolar Son correctas: a) VVVV a) Sólo 1 b) Sólo 3 c) Sólo 4 b) VFVF d) VVVF c) VVFV e) FFFV d) 1, 2 y 3 e) 1, 2, 3 y 4 5. ¿Cuál de los enlaces es el más fuerte? 2. Un alcalino y un halógeno forman un enlace a) E. Dativo b) E. C. Polar c) E. C. Apolar d)E.Electrovalente e) E. Covalente a) Iónico c) electrostático e) a, b y c b) Electrovalente d) Polar 6. Indicar el compuesto que presenta enlace covalente polar. a) H2 d) NH3 Pág. 98 b) CO2 c) H2O e) Hay 2 respuestas INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 7. Señale la opción correcta con un aspa (x) CaCl2 Iónico 3. Los compuestos iónicos son sólidos cristalinos y quebradizos ( ) Covalente Polar Apolar 4. Los compuestos iónicos no se disuelven en agua. ( 8. Señale la opción correcta con un aspa (x) NaBr Iónico ) Señale la opción correcta con aspa: 5. NO2 Iónico Covalente Covalente Polar Apolar Apolar Polar 6. N2 Iónico Covalente TAREA DOMICILIARIA Apolar Polar 1. El cloruro de sodio (NaCl) es un compuesto iónico. ( ) 7. Indique el número de enlaces simples, dobles y triples para la siguiente estructura : H O N = O 2. El agua (H2O) es un compuesto covalente. ( ) a) 1, 2, 0 d) 0, 1, 2 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL b) 3, 1, 0 c) 1, 1, 1 e) 2, 1, 0 Pág. 99 Emanuel CHRISTIAN SCHOOL 8. Señale el compuesto donde existe enlace a) CH4 b) NH3 d) HCl enlaces e) NaCl a) 1 b) 2 d) 4 e) 5 c) 3 12. ¿Cuál de las siguientes sustancias presenta enlace covalente? covalente? b) NaCl c) Cl2O a) CaO b) NaCl d) KCl e) Cl2O e) Na2O 10. ¿Qué estructura posee enlace iónico? a) CO2 b) N2 d) H2O e) H2 Pág. 100 simples c) CO 9. ¿Cuál de las sustancias presenta enlace d) KCl cuántos presenta el HNO2 iónico. a) CaO 11. Indique c) KF INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL c) Na2O Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 4º CLASE Química – 1º Secundaria PRINCIPIOS DE LA NOMENCLATURA Es la parte de la química que se encarga de nombrar y formular las especies químicas, estudiándose de acuerdo a su función química. Función Química.- Es un conjunto de compuestos que tienen propiedades análogas en virtud a que se generan por un mismo grupo funcional. Por ejemplo: óxidos, ácidos, hidróxidos, etc Valencia.- Es un número que nos indica el número de electrones enlazantes que puede tener un átomo, o lo que es lo mismo decir, la cantidad de electrones que puede ceder, ganar o compartir un átomo. Ejemplo : La molécula de H2O O El O tiene 2e- 's compartidos con el H x Hx H El H sólo tiene 1e- para compartir La valencia del oxígeno es 2. La valencia del hidrógeno es 1 Molécula PH3 H x P x H Molécula N2 P tiene 3 e- 's compartidos. Su valencia es 3. x H N N N tiene 3 e- 's compartidos, su valencia es 3 Estado de Oxidación (E.O.).- También denominado Número de Oxidación (N.O.), es la carga real o aparente que tiene un átomo al combinarse, el cual se denota con un valor entero con signo. 1 H 1 Cl Cl : carga relativa -1 E.O. (Cl) = -1 1 H2 2 O E.O. (O) = -2 E.O (H) = +1 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 101 Emanuel CHRISTIAN SCHOOL Reglas para Hallar el E.O. 1. La carga negativa se le atribuye al átomo más electronegativo. CO2 Monóxido de carbono x x xx xx O C O x x x x x x E.N. (O) = 3,5 ; E.N. (C) = 2,5 Como el oxígeno es el más electronegativo, a él se le atribuye la carga negativa. Así : 4 2 C O2 E.N. (O) = -2 ; E.O. (C) = +4 2. Debemos considerar : Para el hidrógeno : E.O. (H) = +1 (generalmente) E.O. (H) = -1 (hidruros) Para el oxígeno : E.O. (O) = -2 (generalmente) E.O. (O) = -1 (peróxidos) Nota : F2O xx x Ox F F E.N. (F) = 4,0 ; E.N. (O) = 3,5 xx Como el F es más electronegativo, a él se le atribuye la carga negativa, así : 1 F2 2 O sólo en esta molécula E.O. (O) = +2 3. Debemos considerar : Para los metales alcalinos (Li , Na , K , ....) E.O. = +1 Para los metales alcalinos térreos (Be , Mg , Ca , ....) E.O. = +2 4. Todo elemento que se encuentra en sue estado libre o molecular, su carga es cero. Ejemplo : º H2 ; º O2 ; º N2 ; º Ne (E.O. = 0) 5. El estado de oxidación de un compuesto es cero (neutro). Ejemplo : 1 6 2 H2 S O4 1 5 2 H N O3 6. La suma algebraica de las cargas positivas y negativas en un radical es igual a la carga neta. Nota : Radical es un compuesto cargado. Ejemplo : (SO4)2- , (NO3)Pág. 102 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL Nomenclatura Clásica Prefijo 2 E.O. 3 E.O. Hiper ........... ico 4 E.O. Mayor E.O. x ........... ico x x x .......... oso x x x x x Hipo ............ oso Menor E.O. Estado de Oxidación de Elementos Comunes Elemento Metálico E.O. Elementos No Metálicos B Li Na K Rb Cs Ag +1 Si Be Ca Mg Ba Sr Zn Cd +2 P Hg - Cu +1 +2 As - Sb Fe - Co - Ni +2 +3 S - Se - Te Pt - Sn - Pb +2 +4 Cl - Br - I Au +1 +3 N Al - Ga +3 C INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL E.O. -3 +3 -4 +4 -3 +1 +3 +5 -3 +3 +5 -2 +2 +4 +6 -1 +1 +3 +5 +7 -3 +3 +5 -4 +2 +3 Pág. 103 Emanuel CHRISTIAN SCHOOL EJERCICIOS DE APLICACIÓN Hallar el estado de oxidación del elemento indicado con un aspa (x) en cada compuesto x 1. Ca O 15.Te+2 : ................................................. Te+4 : ................................................. Te+6 : ..................................................... x 2. Fe O x TAREA DOMICILIARIA x Hallar el estado de oxidación del elemento indicado con un aspa (x) en cada compuesto 3. Na2 O 4. Au2 O x 5. Ni2 O3 6. x 1. H Cl O4 x Al2 O3 x 2. H2 S O4 x x 7. H N O3 3. H2 C O3 x 4. N H3 Halla el E.O. del elemento marcado con un aspa (x): x 5. S iH4 x 6. H Cl x x ( N O3 )-1 7. H Br x 10. ( S O4 )-2 8. H2 S Halla el E.O. del elemento marcado con un aspa (x). Indicar el nombre de los siguientes iones: 9. ( C O3 )-2 * Fe+2 ión Ferroso 10. ( P O4 )-3 8. x 9. ( Cl O )-1 x x x Indicar el nombre de los siguientes iones : Fe +3 ión Férrico 11.Co +2 Co +3 : ................................................. : ................................................ 12.Ni+2 : ................................................ Ni+3 : ................................................ +2 13.S +4 S S+6 : ................................................. : ................................................ 11.Au+1 : ................................................ Au+ : ................................................ 12.C+2 : ................................................ +4 C : ................................................. 13.N+3 : ................................................ N+5 : ................................................. 14.Br+1 : ................................................. : ................................................. Br+3 : ................................................. 14.Se+2 : ................................................. Br+5 : ................................................. Se +4 : ................................................. Se +6 Br+7 Pág. 104 : : ................................................ ................................................. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 5º CLASE Química – 1º Secundaria FUNCIÓN OXIDO BASICO Son aquellos compuestos binarios donde el elemento químico actúa con más de una valencia. Los óxidos con mayor rapidez se obtienen a elevadas temperaturas. Los óxidos básicos tienen propiedades básicas y los óxidos ácidos tienen propiedades ácidas. Elemento Quí mi co O2 Óxi do INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 105 Emanuel CHRISTIAN SCHOOL ANFOTERO Son aquellos elementos que forman óxidos ácidos y en otras condiciones óxidos básicos. ELEMENTO COMO METAL COMO NO METAL Mn 2+, 3+ 4+, 6+, 7+ V 2+, 3+ 4+, 5+ Cr 2+, 3+ 3+, 6+ N 2+, 4+ 1+, 3+, 5+ ÓXIDOS METÁLICOS O BÁSICOS 1. 2. Óxido de Potasio Óxido Potásico Ca2O2 Ca2+ O2 3. K2O K1+ + O2- CaO Óxido de Calcio Óxido Calcico Cal Viva A3+ + O2- Al2O3 4. Óxido de Aluminio Óxido Alumínico Alumina 2+ CoO Óxido Cobalto Óxido de Cobalto II Co2O3 Óxido Cobáltico Óxido de Cobalto III PbO Óxido Plumboso Óxido de Plomo II PbO2 Óxido Plúmbico Óxido de Plomo IV Co 3+ 5. 2+ Pb 4+ NOMENCLATURA Para nombrar los compuestos químicos inorgánicos se siguen las normas de la IUPAC (unión internacional de química pura y aplicada). Se aceptan tres tipos de nomenclaturas para los compuestos inorgánicos, la sistemática, la nomenclatura de stock y la nomenclatura tradicional. Pág. 106 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL Nomenclatura Sistemática Para nombrar compuestos químicos según esta nomenclatura se utilizan los prefijos: MONO_, DI_, TRI_, TETRA_, PENTA_, HEXA_, HEPTA_ ... Cl2O3 I2O Trióxido de dicloro Monóxido de diodo Nomenclatura de Stock En este tipo de nomenclatura, cuando el elemento que forma el compuesto tiene más de una valencia, ésta se indica al final, en números romanos y entre paréntesis: Fe(OH)2 Hidróxido de hierro (II) Fe(OH)3 Hidróxido de hierro (III) Nomenclatura Clásica En esta nomenclatura para poder distinguir con qué valencia funcionan los elementos en ese compuesto se utilizan una serie de prefijos y sufijos: Hipo_ _oso 1 E.O 2 E.O 3 E.O 4 E.O E.O Mínima _oso E.O Menor _ico E.O Mayor E.O Máxima Per_ _ico EJERCICIOS DE APLICACIÓN 1. Señale las proposiciones correctas: 2. Determinar cuántos óxidos I. Metal + Oxígeno Óxido Básico básicos: II. El oxígeno forma óxidos con casi * CaO * CrO todos los elementos. * Br2O7 * Mn2O3 * SO3 * Mn2O7 III. El óxido C2O3 y Mn2O7 son son óxidos ácidos. IV. El óxido Na2O y CrO son básicos. a) 2 b) 3 a) Sólo I b) Sólo II d) 5 e) 6 d) I, II y III e) Todas c) I y II INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL c) 4 Pág. 107 Emanuel CHRISTIAN SCHOOL 3. Indique el nombre correcto de PbO. 7. Determinar cuántas relaciones son correctas: a) Óxido Plumoso b) Óxido Plomico c) Óxido Plúmblico d) Óxido Plumboso e) Óxido de Plomo 4. 5. ¿Cuál es la fórmula del óxido ferrico? a) Fe2O b) Fe2O2 d) Fe2O3 e) FeO 6. d) Mg3O e) MgO Óxido de Estroncio: SrO Óxido Férrico: Fe2O3 Óxido Clórico: C2O3 Óxido Perbrómico: Br2O7 a) 1 b) 2 d) 4 e) 5 c) Mg2O 9. a) 2 b) 3 d) 5 e) 6 Nombrar el producto: Co(2, 3) Co+3 + O-2 ……… Dar la fórmula del óxido cúprico. a) Óxido de Cobalto b) Óxido de Cobaltoso c) Óxido Cuproso a) CuO b) CuO2 d) CuO3 e) Cu3O Pág. 108 c) 3 8. Determinar el E.O de cromo en H2Cr2O7. magnesio. b) MgO4 Óxido de Cinc: Zn2O c) Fe3O2 Señale la fórmula del óxido de a) MgO2 c) Cu2O d) Óxido Cobaltico e) Óxido Carbónico INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL c) 4 Emanuel CHRISTIAN SCHOOL 10. Nombrar el producto: Au(1, 3) 3. Señalar el nombre correcto para A2O3 Au+1 + O-2 a) Óxido de Aluminio b) Óxido Plúmbico a) Óxido de Plata c) Óxido de Plomo b) Óxido Aúrico d) Óxido Plumboso c) Óxido Auroso e) Óxido de Oro d) Óxido Argentoso e) Óxido Argéntico 4. ¿Cuál es el nombre correcto para el PbO2? a) Óxido de Plomico b) Óxido Plúmbico TAREA DOMICILIARIA c) Óxido Plumboso 1. Dar el nombre correcto para el MgO: d) Óxido de Plomo e) Óxido Plomoso a) Óxido Magnesioso b) Óxido de Magnesio 5. Hallar la atomicidad del óxido ferroso. c) Óxido Magnésico d) b y c e) Ninguna a) 1 b) 2 d) 4 e) 5 c) 3 2. Indique la atomicidad del óxido de 6. Hallar la atomicidad del óxido férrico. magnesio: a) 1 b) 2 d) 4 e) 5 c) 3 a) 1 b) 2 d) 4 e) 5 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL c) 3 Pág. 109 Emanuel CHRISTIAN SCHOOL 7. Indique la atomicidad del óxido de magnesio. 10. Formular: Óxido Niqueloso Ni = +2, +3 a) 1 b) 2 d) 4 e) 5 c) 3 8. Señale la fórmula del óxido de magnesio. a) NiO b) Ni2O3 d) Ni3O e) Ni3O2 c) NiO3 11. Determinar el E.O de Platino en: Pt(OH)4 a) MgO2 b) Mg2O d) MgO4 e) Mg3O c) MgO a) 3 b) 1 d) 2 e) 5 c) 4 9. Formular: Óxido Aúrico 12. Determinar el E.O de carbono en Au = +1, +3 H2CO3. a) Au2O b) AuO3 d) Au3O2 e) AuO2 Pág. 110 c) Au2O3 a) 1 b) 2 d) 4 e) 5 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL c) 3 Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 6º CLASE Química – 1º Secundaria FUNCIÓN ANHÍDRIDOS ÓXIDOS ÁCIDOS O ANHÍDRIDOS.- Son compuestos binarios formados por un no metal y oxígeno. Su fórmula general es: N2OX Donde N es un no metal y la X el estado de oxidación del no metal (el 2 corresponde al estado de oxidación del oxígeno). E.O Fórmula N. sistemática N. stock N. tradicional (la más frecuente) F2O Monóxido de diflúor Óxido de flúor Anhídrido hipofluoroso Cl2O Monóxido de dicloro Óxido de cloro (I) Anhídrido hipocloroso) 2 SO Monóxido de azufre Óxido de azufre (II) Anhídrido hiposulfuroso 3 I2O3 Trióxido de diodo Óxido de Iodo (III) Anhídrido sulfuroso 4 SeO2 Dióxido de Selenio Óxido de selenio (IV) Anhídrido selenioso 5 Br2O5 Pentaóxido de dibromo Óxido de bromo (V) Anhídrido brómico 6 SO3 Trióxido de azufre Óxido de azufre (VI) Anhídrido sulfúrico 7 I2O7 Heptaóxido de diodo Óxido de Yodo (VII) Anhídrido periódico Valencia Fórmula N. sistemática * N. stock * N. tradicional 2 NO Óxido nitroso 4 NO2 Óxido nítrico 3 N2O3 Anhídrido nitroso 5 N2O5 Anhídrido nítrico 1 * Escribe los nombres que faltan en la tabla. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 111 Emanuel CHRISTIAN SCHOOL FUNCIONES OXÍGENADAS Función Óxido Elemento + Oxígeno Óxido Ex + O-2 E2Ox 1. Óxido Ácido (Anhídrido) No Metal + Oxígeno Óxido Ácido Los óxidos ácidos antiguamente recibían el nombre de anhídridos que significa ácidos sin agua Ejm. S+6 + O-2 SO3 (anhídrido sulfúrico) S : 2, 4, 6 Cl+1 + O-2 Cl2O (anhídrido hipocloroso) Cl : 1, 3, 5, 7 P+3 + O-2 P2O3 (anhídrido fosforoso) P : 1, 3, 5 (anhídrido brómico) Br : 1, 3, 5, 7 Br+5 + O-2 Br2O5 PRINCIPALES ESTADOS DE OXIDACIÓN DE LOS ELEMENTOS QUÍMICOS METALES NO METALES Li, Na, K, Rb, Cs, Fr, Ag = +1 F = -1 Be, Mg, Ca, Sr, Ba, Ra, Zn = +2 H=1 Fe, Co, N = 2, 3 O = -2 (Generalmente) Au = 1, 3 Cl, Br, I = 1, 3, 5, 7 Pb, Sn, Pt = 2, 4 S, Se, Te = 2, 4, 6 Cu, Hg = 1, 2 P = 1, 3, 5 Al = 3 B=3 C = 2, 4 Si = 4 As = 3, 5 Pág. 112 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL ANFÓTEROS Metal No Metal Mn 2, 3 No Metal 4, 6, 7 Metal Cr 2, 3 No Metal Metal 2, 4 N 3, 6 1, 3, 5 EJERCICIOS DE APLICACIÓN 1. 2. 3. 4. 5. Nombrar Cl2O7: a) Óxido Clórico b) Anhídrido Cloroso c) Anhídrido Hipocloroso d) Anhídrido Perclórico e) Anhídrido Clórico Nombrar SO2: a) Anhídrido Sulfuroso b) Anhídrido Sulfúrico c) Anhídrido Hiposulfuroso d) Anhídrido de Azufre e) Anhídrido Persulfúrico Nombrar P2O5: a) Óxido de Potasio b) Anhídrido Fosforoso c) Óxido Potásico d) Anhídrido Fosfórico e) Anhídrido Hipofosforoso Formular: Anhídrido Manganoso: Mn(4, 6, 7) a) MnO b) MnO2 c) Mn2O3 d) Mn2O7 e) MnO3 Formular: Anhídrido Teluroso: Te (2, 4, 6) a) Te2O b) Te2O c) TeO d) TeO2 e) TeO3 6. Formular Anhídrido Nitroso: N(1, 3, 5) a) NO b) N3O2 c) NO2 d) N2O3 e) N2O5 7. Nombrar Fe2O3 a) Peróxido de Hierro b) Peróxido Ferroso c) Óxido Férrico d) Óxido Ferroso e) Peróxido Férrico 8. Nombrar: Cr2O3 a) Peróxido de cromo b) Peróxido crómico c) Óxido cromoso d) anhídrido cromoso e) anhídrido cromoso 9. a) b) c) d) e) Nombrar los siguientes compuestos: B2O3 CO CO2 AsO AsO2 10. Un anhídrido Hepta – atómico es: a) Cl2O5 b) I2O7 c) CO2 d) N2O3 e) S2O5 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 113 Emanuel CHRISTIAN SCHOOL TAREA: 1. 2. Nombra: Au2O2 a) Peróxido de Oro b) Peroxido Auroso c) Óxido Auroso d) Óxido Aúrico e) Peróxido Aurico 6. Un anhídrido Hepta – atómico es: a) Cl2O5 b) I2O7 c) CO2 d) N2O3 e) S2O5 7. Indicar verdadero corresponda: Nombrar: Cu2O4 a) Peróxido de Cobre b) Óxido Cúprico c) Óxido Cúprico d) Peroxido Cuproso e) Óxido percuproso En los anhídridos el elemento es un no metal En los anhídridos el enlace es covalente a) VVV b) VVF c) FVV 5. Formular: Anhídrido Nitroso a) NO b) N2O3 c) N2O5 d) N2O4 e) N3O2 Formular: Anhídrido Sulfúrico a) SO3 b) SO2 d) S3O4 e) S4O5 c) SO e) VFV 8. Nombrar: Na2O2 a) Óxido de Sodio b) Anhídrido de Sodio c) Anhídrido Sodioso d) Anhídrido Hiposodioso e) Peróxido de Sodio 9. Nombrar: I2O a) Óxidos Iodoso b) Oxido Iódico c) Peroxido de Iodo d) Anhídrido Hipoyodoso e) Anhídrido Peroyódico Formular: Anhídrido Carbonoso a) CO b) C2O c) C2O3 d) CO2 e) C3O4 Pág. 114 según En los peróxidos el E.O (O)= -1 Nombrar: Br2O5 a) Anhídrido Bromoso b) Óxido Brómico c) Anhídrido Brómico d) Óxido Perbrómico e) Anhídrido Hipobromoso 4. falso d) FVF 3. o INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 7º CLASE Química – 1º Secundaria FUNCIÓN PEROXIDOS – HIDROXIDOS Peróxido s Oxido Básico + Oxigeno Peróxido CaO + O Ca+2 + (0-0)-2 Ca+2 O22 Ca2O4 (Peróxido de Calcio) Zn+2 + O22 Zn2O4 (Peróxido de Zinc) Fe+3 + O22 Fe2O6 (Peróxido de Hierro) Si el elemento metálico tiene 2 E.O actuará con su mayor E.O INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 115 Emanuel CHRISTIAN SCHOOL Hidróxidos Óxido Básico + H2O Hidróxido Formula General: M (OH)x x: E.O del metal Na2O + H2O Na(OH) (Hidróxido de Sodio) Ni(2, 3) Ni2O3 + H2O Ni(OH)3 (Hidróxido Niquélico) FeO + H2O Fe(OH)2 (Hidróxido terroso) Fe2O3 + H2O NiO + H2O Fe(OH)3 Hidróxido férrico Ni(OH)2 Hidróxido niqueloso Au2O3 + H2O Au(OH)3 Hidróxido áurico Pág. 116 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL EJERCICIOS DE APLICACIÓN 1. Nombrar : Pb(OH)4 a) Hidróxido plúmbico b) Hidróxido plumboso c) Óxido plúmbico d) Óxido de plomo e) Hidróxido hipo plumboso 2. Un hidróxido de hierro es hepta – atómico. ¿Cuál es su nombre? a) Hidróxido de hierro b) Hidróxido ferroso c) Hidróxido de fierro d) Hidróxido férrico e) Hidróxido hipo ferroso 3. Nombrar : Co(OH)3 a) Anhídrido cobaltoso b) Óxido cobáltico c) Anhídrido de cobalto d) Hidróxido cobaltito e) Hidróxido cobaltito 7. Formular: Peróxido de Cobalto a) COO2 b) CO2O c) CO2O6 d) CO2O3 e) CO 8. Nombrar: K(OH) a) Hidróxido de Potasio b) Óxido de Potasio c) Hidróxido Potásico d) Óxido Potásico e) Hidróxido Potasioso 9. Formular: Hidróxido Plomboso a) PbO2 b) Pb(OH) c) Pb2(OH) d) Pb(OH)2 e) Pb(OH)4 4. Formular : hidróxido auroso a) Au(OH) b) Au(OH)2 c) Au2(OH)3 d) Au3(OH)2 e) Au(OH)4 5. Nombrar: K2O2 a) Óxido de Potasio b) Hidróxido Potásico c) Óxido Potasioso d) Peroxido de Potasio e) Peróxido Potasioso 6. Nombrar Fe2O6 a) Peróxido de Hierro b) Peróxido Ferroso c) Óxido Férrico d) Óxido Ferroso e) Peróxido Férrico INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 117 Emanuel CHRISTIAN SCHOOL TAREA DOMICILIARIA 1. Un hidróxido hepta-atómico es: a) H3EO4 d) E(OH)6 b) E(OH)3 e) E3O4 5. c) H2EO2 2. Una característica de los hidróxido es: a) Sabor agrio b) Son estructuras covalentes c) Son de sabor cáusticos d) Son compuestos binarios e) Se genera así: Oxido Ácido + Agua 3. 4. En qué sustancias existe el “Puente Oxigeno” a) Óxidos Básicos b) Anhídridos c) Peróxidos d) Ácidos e) Hidruros Nombrar: Na2O2 a) Óxido de Sodio b) Anhídrido de Sodio c) Anhídrido Sodioso d) Anhídrido Hiposodioso e) Peróxido de Sodio Pág. 118 Nombrar : Pb(OH)2 a) Hidróxido plúmbico b) Hidróxido plumboso c) Óxido plúmbico d) Óxido de plomo e) Hidróxido hipo plumboso 6. Determinar el nombre de : PbO2 (Pb = +2, +4) a) Óxido plumboso b) Anhídrido plúmbico c) Óxido plúmbico d) Anhídrido plumboso e) Óxido de plomo 7. El nombre de : SnO2 (Sn = +2, +4) a) Óxido de azufre b) Anhídrido azufroso c) Óxido estannoso d) Anhídrido estannoso e) Óxido estannoso 8. Con los elementos de la tabla periódica formar los nombres de sus familiares y formar sus respectivos peróxidos y hidróxidos. INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 4º BIMESTRE – 8º CLASE Química – 1º Secundaria RETROALIMENTACION DE OXIDOS, PEROXIDOS E HIDROXIDOS FUNCIONES OXÍGENADAS Función Óxido Elemento + Oxígeno Óxido Ex + O-2 E2Ox ANFOTERO Son aquellos elementos que forman óxidos ácidos y en otras condiciones óxidos básicos. ELEMENTO COMO METAL COMO NO METAL Mn 2+, 3+ 4+, 6+, 7+ V 2+, 3+ 4+, 5+ Cr 2+, 3+ 3+, 6+ N 2+, 4+ 1+, 3+, 5+ Peróxidos Oxido Básico + Oxigeno Hidróxidos Óxido Básico + H2O Hidróxido Formula General: M (OH)x x: E.O del metal INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 119 Emanuel CHRISTIAN SCHOOL EJERCICIOS: 1. Determinar cuántas relaciones son 5. correctas: Indique el compuesto que presenta la mayor cantidad de átomos Óxido de Cinc: Zn2O molécula. Óxido de Estroncio: SrO a) Anhídrido perbromico Óxido Férrico: Fe2O3 b) Anhídrido carbonoso Óxido Clórico: C2O3 c) Anhídrido hipoteluroso Óxido Perbrómico: Br2O7 d) Óxido cobaltico a) 1 b) 2 d) 4 e) 5 por e) Óxido aluminico c) 3 6. Nombrar a los siguientes óxidos: a) Cl2O ________________________ b) SeO3 ________________________ b) Anhídrido Bórico e) Anhídrido de Plata c) I2O7 ________________________ c) Anhídrido de Bario d) SO2 ________________________ e) HgO ________________________ 2. Indicar el nombre correcto de: B2O3 a) Óxido Boroso 3. Indique el compuesto que presenta la mayor 4. d) Óxido de Berilio cantidad de átomos por 7. Calcule la suma de los átomos de los molécula. siguientes compuestos: a) Anhídrido hipobrumoso Hidróxido de Sodio b) Anhídrido nítrico Hidróxido de Bario c) Anhídrido brumico Hidróxido de Aluminio d) Anhídrido perbromico Hidróxido de Amonio e) Anhídrido clórico Hidróxido Cobaltoso ¿Qué alternativa contiene una a) 27 b) 25 d) 29 e) 31 c) 21 molécula hepta atómica? a) Óxido férrico 8. Nombrar: b) Anhídrido carbónico a) KOH _____________________ c) Anhídrido peryodico b) Mg(OH)2 _____________________ d) Óxido cobaltico c) Be(OH)2 _____________________ e) Anhídrido clorico d) Cu(OH) _____________________ e) NH4OH _____________________ Pág. 120 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL 9. Formular: 3. Señalar el nombre correcto para A2O3 a) Hidróxido Ferrico ______________ a) Óxido de Aluminio b) Hidróxido de Calcio ______________ b) Óxido Plúmbico c) Hidróxido Niquelito ______________ c) Óxido de Plomo d) Hidróxido de Sodio ______________ d) Óxido Plumboso e) Hidróxido Plumboso e) Óxido de Oro 10. Indicar el nombre correcto de SO3 a) Anhídrido Hiposulfuroso 4. ¿Cuál es el nombre correcto para el b) Óxido de Sulfuro PbO2? c) Óxido Sulfuroso a) Óxido de Plomico d) Anhídrido Sulfuroso b) Óxido Plúmbico e) Anhídrido Sulfúrico c) Óxido Plumboso d) Óxido de Plomo e) Óxido Plomoso 5. Hallar la atomicidad del óxido ferroso. a) 1 b) 2 d) 4 e) 5 c) 3 TAREA: 6. Indicar el nombre correcto de: CO 1. Dar el nombre correcto para el MgO: a) Óxido de Calcio a) Óxido Magnesioso b) Óxido de Litio b) Óxido de Magnesio c) Óxido de Plata c) Óxido Magnésico d) Anhídrido Carbónico d) b y c e) Anhídrido Carbonoso e) Ninguna 7. Indicar el nombre correcto de: B2O3 2. Indique la atomicidad del óxido de a) Óxido Boroso b) Anhídrido de Bario magnesio: a) 1 b) 2 d) 4 e) 5 c) 3 c) Anhídrido de Plata d) Anhídrido Bórico e) Hidróxido de Litio INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 121 Emanuel CHRISTIAN SCHOOL 8. Indicar el nombre correcto de Cl2O3 a) Anhídrido Hipocloroso b) Anhídrido Cloroso c) Anhídrido Clórico d) Anhídrido Perclórico e) Anhídrido Orico 9. Indicar el nombre correcto de C2O7 a) Anhídrido Hipocloroso b) Anhídrido Cloroso c) Anhídrido Clórico d) Anhídrido Perclórico e) Anhídrido Oroso 10. Indicar el nombre correcto de P2O3 a) Óxido de Plata b) Anhídrido Fosfórico c) Anhídrido de Plata d) Anhídrido Hipofosforoso e) Anhídrido Fosforoso 11. Indicar la fórmula del Hidróxido de Estroncio: a) Es(OH) b) Es(OH)3 c) Se(OH)2 d) Sr(OH)2 e) Sp(OH) Pág. 122 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Emanuel CHRISTIAN SCHOOL INICIA EN PÁGINA 119 INSTITUCIÓN EDUCATIVA PRIVADA CRISTIANO EMANUEL Pág. 123

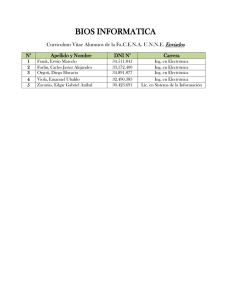





![[audio] Emanuel Patiño, maltrato en "Tierras de Oria" y Dejadnos crecer](http://s2.studylib.es/store/data/003772293_1-f7c7214ba721a9a46577d7e7366c1a79-300x300.png)