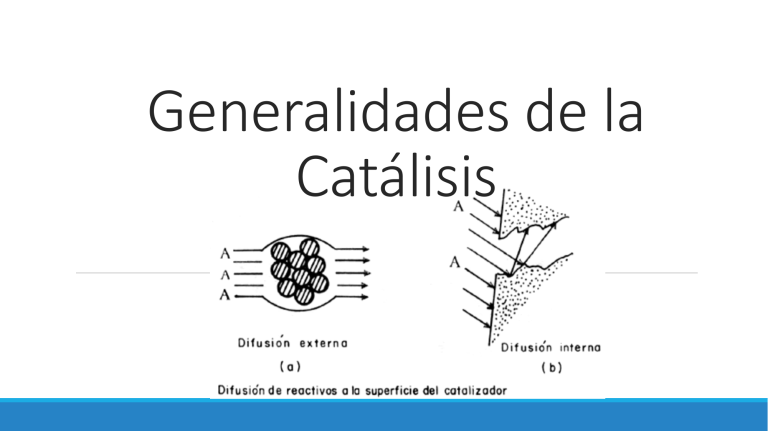
Generalidades de la Catálisis Historia de la catálisis • La piedra filosofal • Pirita Fermentación del vino (5 000 años a.C.) 1825 Fumiseri • 1817 Sir Humphrey Davy • 1812 Thenard • 1831 Oxidación de S02 • 1834 Faraday 1836 Berzelius 1939-1940 • 1920 Paul Sabatier • 1915 Síntesis de amoniaco ¿Qué es un catalizador? “Los Catalizadores son sustancias que disminuyen la Energía de Activación (Ea) de una reacción química consiguiendo que se desarrolle a mayor velocidad.” Propiedades de los Catalizadores Los Catalizadores presentan las siguientes características: 1. No son reactivos ni productos 2. Son eficaces aun cuando las cantidades empleadas son muy pequeñas 3. Se recuperan al final de la reacción 4. No aportan ni consumen energía 5. Son específicos 6. Funcionan igual tanto en un sentido de la reacción como en el otro TIPOS DE CATALIZADORES 1. Catalizadores Homogéneos El Ozono se destruye según la reacción O3 → O + O2 2. Catalizadores Heterogéneos Síntesis del amoníaco (proceso Haber): N2 + 3 H2 → 2 NH3 3. Enzimas, Biocatalizadores o Catalizadores Enzimáticos Óxidorreductasas Transferasas Hidrolasas Liasas Isomerasas Ligasas Algunos ejemplos más de Catalizadores son: El Paladio, Platino o el Níquel • EL ZINC • EL SODIO • EL PERMANGANATO POTÁSICO (KMNO4) ¿QUÉ ES CATÁLISIS? Consiste en un fenómeno en que una cantidad relativamente pequeña de un material extraño a la estequiometría, el catalizador, aumenta o disminuye la velocidad de una reacción química sin ser consumido en el proceso. La gran mayoría de los procesos químicos son procesos catalíticos, pudiendo así afirmarse que más del 80% de los productos de la industria química involucran un catalizador en una u otra fase de su producción Desactivación de catalizadores Mecanismos de la desactivación de los catalizadores. Desactivación en paralelo: 𝐴 →𝑅+𝑃 ↓ Desactivación en serie: 𝐴→𝑅→𝑃↓ Desactivación lateral: 𝐴→𝑅 𝑃→𝑃↓ Desactivación independiente. • bloqueo de la entrada de los poros por el sólido depositado. • El equilibrio o el envenenamiento reversible en el que se mantiene siempre alguna actividad. • La acción de regeneración. TIPOS DE CATÁLISIS CATÁLISIS CATÁLISIS HETEROGÉNEA HOMOGÉNEA CATÁLISIS ENZIMÁTICA AUTO-CATÁLISIS CATÁLISIS SUPERFICIAL CATÁLISIS MOLECULAR Catálisis Homogénea Reactivos y catalizador se encuentran en la misma fase. (Gas o sólido) Acceso fácil al mecanismo de reacción Ausencia efecto de envenenamiento. Aplicación industrial Polimerización de olefinas: polietileno Producción de biodiesel Adición de olefinas: polibutadieno Oxidación de olefinas: óxido de propileno Polimerización-condensación: fibra de poliéster. Tipos de catálisis homogénea Ácido especifico Base específica Catálisis Heterogénea Mecanismo catálisis heterogénea El proceso global de una reacción heterogénea procede a través de una serie de etapas representadas a continuación. 1.- Transferencia de masa del o los reactivos del seno del fluido a la superficie externa de la partícula de catalizador. 2.- Difusión del reactivo de la boca del poro, a través de los poros del catalizador, hacia la vecindad inmediata de la superficie catalítica interna. 3.- Adsorción del reactivo A sobre la superficie del catalizador. 4.- Reacción sobre la superficie de catalizador. 5.- Desorción de los productos de la superficie 6.- Difusión de los productos del interior de la partícula a la boca del poro en la superficie externa. 7.- Transferencia de masa de los productos de la superficie externa de la partícula al seno del fluido. Catálisis Enzimática Auto-catálisis La autocatálisis es el proceso mediante el cual un compuesto químico induce y controla una reacción química sobre sí mismo. Los compuestos autocatalíticos no son catalizadores en sentido estricto ya que su estructura química resulta alterada durante el proceso. Ejemplos de procesos auto-catalíticos









