- Ninguna Categoria
Estereoquímica: Isómeros, Quiralidad y Nomenclatura (R,S)
Anuncio
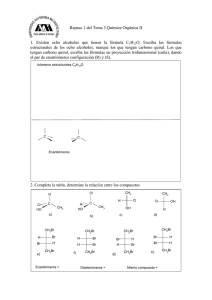
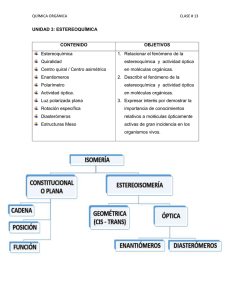
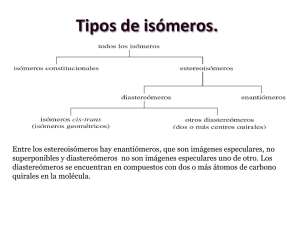
Estereoquímica QMC – 121. Química Orgánica I Semestre I - 2019 Introducción • Isómeros: compuestos con la misma fórmula molecular, pero con estructuras diferentes. Se clasifican en dos clases: isómeros de constitución y estereoisómeros. • Isómeros de constitución. Difieren en su conectividad. Ejemplos: etanol y éter dimetílico; 1-clorobutano y 2-clorobutano; pentano e isopentano; acetona y propionaldehido. Introducción • A diferencia de los isómeros de constitución, los átomos en los estereoisómeros están conectados de igual manera. Los estereoisómeros (también llamados isómeros de configuración) difieren de la manera en que sus átomos están ordenados en el espacio. Isómeros Isómeros de constitución Isómeros cis - trans Estereoisómeros Isómeros con centros asimétricos Isomería cis - trans • Resultan de la rotación restringida, que puede ser ocasionada por una estructura cíclica o por un doble enlace. Isómeros cis: sustituyentes del mismo lado del enlace. Isómeros trans: sustituyentes del lado opuesto del enlace. Ejemplos: cis-1-bromo-3-clorociclobutano cis-1,4-dimetilciclohexano trans-1-bromo-3-clorociclobutano trans-1,4-dimetilciclohexano Isomería cis - trans • Los compuestos con dobles enlaces carbono – carbono pueden tener isomería cis – trans. El doble enlace está compuesto de un enlace σ y de un enlace π (barrera de energía para ruptura del enlace π y rotación: 62 kcal/mol, demasiado alta para que ocurra la rotación). se rompe un enlace π isómero cis isómero trans Isomería cis - trans • Como la barrera que impide la rotación alrededor de un doble enlace C = C es demasiado alta, un compuesto con un doble enlace puede existir en dos formas distintas. Ejemplo: cis-2-penteno trans-2-penteno Isomería cis - trans • Los isómeros cis y trans tienen la misma fórmula molecular y los mismos enlaces, pero tienen distintas configuraciones, es decir, difieren en la manera en que los átomos se orientan en el espacio. • Pueden ser separados, porque son compuestos diferentes con propiedades físicas distintas. isómero cis P. Eb. = 3,7°C µ = 0,33 D isómero trans P. Eb. = 0,9°C µ=0D isómero cis P. Eb. = 60,3°C µ = 2,95 D isómero trans P. Eb. = 47,5°C µ=0D Isomería cis - trans • Si uno de los átomos de carbono sp2 está conectado a dos sustituyentes idénticos, el compuesto no puede tener isómeros cis y trans. los isómeros cis y trans no son posibles para estos compuestos, porque dos sustituyentes sobre un carbono sp2 son iguales Conformación y configuración • Las conformaciones (o confórmeros) son distintos ordenamientos espaciales del mismo compuesto. No se pueden separar y algunas son más estables que otras. Conformación y configuración • Los compuestos con distintas configuraciones son compuestos diferentes (por ejemplo, isómeros cis – trans). Pueden ser separados uno de otro. Se deben romper enlaces para interconvertir compuestos con diferentes configuraciones. Interconversión cis – trans en la visión • Nuestra capacidad de ver depende en parte de una interconversión de isómeros cis y trans que ocurre en nuestros ojos. Una proteína llamada opsina se une al cis-retinal (formado a partir de la vitamina A) en células fotorreceptoras en la retina para formar la rodopsina. Cuando la rodopsina absorbe luz, un doble enlace se interconvierte de cis a trans, generando un impulso nervioso que juega un rol importante en la visión. El transretinal es liberado de la opsina, se isomeriza nuevamente a isómero cis y comienza un nuevo ciclo. Para que se genere un impulso nervioso, un grupo de unas 500 células fotorreceptoras debe registrar de cinco a siete isomerizaciones de rodopsina por célula en un tiempo de unas pocas décimas de segundo. Interconversión cis – trans en la visión • Ciclo del cis y trans retinal y de la rodopsina. Objetos quirales • ¿Por qué no podemos ponernos el zapato derecho en el pie izquierdo? ¿Por qué no podemos ponernos el guante izquierdo en la mano derecha? • Las manos, los pies, los guantes y los zapatos tienen formas definidas, que calzan específicamente objetos diseñados para el mismo lado. Son objetos quirales (cheir = mano en griego). Un objeto quiral tiene una imagen en el espejo que no se puede superponer. Objetos no quirales • Una silla no es un objeto quiral. Su reflejo en el espejo se ve exactamente igual. Se dice que los objetos que no son quirales son aquirales. Un objeto aquiral tiene una imagen en el espejo que se puede superponer con el objeto. Centros asimétricos • También las moléculas pueden ser quirales. La causa usual de que una molécula sea quiral es un centro asimétrico. Un centro asimétrico (también llamado centro quiral, marcado con un asterisco) es un átomo que tiene enlaces con cuatro sustituyentes diferentes. Ejemplos: 4-octanol, 2-bromobutano. centro asimétrico Moléculas con centros asimétricos • Las moléculas pueden tener uno o varios centros asimétricos. La tetraciclina es un antibiótico de amplio espectro, porque es activo contra una amplia variedad de bacterias. ¿cuántos centros asimétricos posee la tetraciclina? Ver carbonos sp3. Isómeros con un centro asimétrico • Un compuesto con un centro asimétrico, como el 2bromobutano, puede existir como dos estereoisómeros. Los dos estereoisómeros son análogos con la mano derecha y la izquierda. Uno es la imagen en el espejo del otro y no se pueden superponer. Esto los hace moléculas diferentes. • Moléculas que son imágenes no superponibles en el espejo una de otra son llamadas enantiómeros. imagen en el espejo no superponible espejo los dos estereoisómeros del 2-bromobutano enantiómeros Isómeros con un centro asimétrico • Una molécula que posee una imagen no superponible en el espejo es quiral. Por ello, cada miembro de un par de enantiómeros es quiral. • Una molécula que tiene una imagen superponible en el espejo es aquiral. • La quiralidad es una propiedad de un objeto entero o de una molécula. enantiómeros moléculas idénticas Centros asimétricos y estereocentros • Un centro asimétrico es también llamado estereocentro (o centro estereogénico). Un estereocentro es un átomo en el cual el intercambio de dos grupos produce un estereoisómero. Los estereocentros incluyen: 1. Centros asimétricos, en los cuales el intercambio de dos grupos produce un enantiómero. 2. Los carbonos sp2 de un alqueno o los carbonos sp3 de un compuesto cíclico, en los que el intercambio de dos grupos convierte un isómero cis en isómero trans. Centros asimétricos y estereocentros • Si bien todos los centros asimétricos son estereocentros, no todos los estereocentros son centros asimétricos. Ejemplos: centro asimétrico estereocentro estereocentro estereocentro Representación de enantiómeros • Se pueden utilizar fórmulas en perspectiva (3 – D) o proyecciones de Fischer. Una fórmula en perspectiva muestra dos de los enlaces del centro asimétrico en el plano del papel, un enlace como una cuña sólida dirigida hacia adelante del plano del papel y el cuarto enlace como una cuña punteada extendiéndose por detrás del plano del papel. La cuña sólida y la cuña punteada deben estar adyacentes una de la otra. Ejemplo: par de enantiómeros del 2-bromobutano. fórmulas en perspectiva de los enantiómeros del 2-bromobutano Representación de enantiómeros • Una proyección de Fischer, diseñada a finales de los 1800 por Emil Fischer, representa un centro asimétrico como el punto de intersección de dos líneas perpendiculares. Las líneas horizontales representan los enlaces que proyectan fuera del plano del papel hacia el observador y las líneas verticales representan los enlaces que se extienden hacia la parte posterior del plano del papel, alejándose del observador. La cadena vertical se dibuja generalmente verticalmente, con el C-1 arriba. Ejemplo: enantiómeros del 2 – bromobutano. centro asimétrico proyecciones de Fischer de los enantiómeros del 2-bromobutano Representación de enantiómeros • Cuando se dibuja un enantiómero utilizando una proyección de Fischer, se pueden poner los cuatro átomos o grupos unidos al centro asimétrico en cualquier orden alrededor del centro. Para dibujar el segundo enatiómero, se intercambian dos de los átomos o grupos. No importa cuales dos de ellos se intercambian. Es mejor intercambiar los grupos de los enlaces horizontales, porque entonces los enantiómeros se ven como imágenes en el espejo. Sistema (R), (S) para designar enantiómeros • Para poder distinguir uno de dos enantiómeros, se utiliza un sistema de nomenclatura, que indica el ordenamiento de los átomos o grupos alrededor del centro asimétrico. Para cualquier par de enantiómeros con un centro asimétrico, un miembro tendrá la configuración (R) y el otro la configuración (S). Este sistema de nomenclatura es llamado sistema de Cahn – Ingold – Prelog, por los químicos que ganaron el Premio Nobel por haber diseñado el sistema. Sistema (R), (S) para designar enantiómeros • Reglas para nombrar los isómeros (R) y (S). 1. Cada uno de los cuatro grupos unidos al estereocentro recibe una prioridad a, b, c o d. La prioridad se asigna primero en base al número atómico del átomo que está unido en forma directa al estereocentro. El grupo con el número atómico menor recibe la prioridad más baja, d. El grupo con el siguiente número atómico más alto, recibe la siguiente prioridad en orden ascendente, c y así sucesivamente. En el caso de los isótopos, el isótopo con la mayor masa atómica recibe la prioridad más alta. Ejemplo: 2–butanol. Sistema (R), (S) para designar enantiómeros 2. Cuando la prioridad no se puede asignar en base al número atómico de los átomos que están unidos directamente al estereocentro, se examinan los siguientes grupos de átomos en los grupos sin asignar. Se asigna una prioridad en el primer punto de diferencia. 3. Se gira la fórmula (o modelo) de manera que el grupo con la prioridad menor (d) se pierda de la vista del observador. Luego se traza el camino de a a b y luego a c. Si la dirección de giro es en el sentido de las manecillas del reloj, el enantiómero es (R). Si la dirección de giro es en el sentido contrario al de las manecillas del reloj, el enantiómero es (S). Sistema (R), (S) para designar enantiómeros 4.Los grupos que contienen enlaces dobles o triples reciben la prioridad como si ambos átomos se duplicaran o se triplicaran. Por ello, el grupo vinilo, - CH = CH2, es de mayor prioridad que el grupo isopropilo, - CH(CH3)2. Sistema (R), (S) para designar enantiómeros • Para moléculas dibujadas en proyección de Fischer: 1. Ordenar los grupos (o átomos) unidos al centro asimétrico en orden de prioridad. 2. Dibujar una flecha de a a b a c. Si la flecha gira en sentido de las agujas del reloj, el enantiómero tiene configuración (R). Si apunta en sentido inverso, tiene configuración (S), siempre y cuando el grupo con la menor prioridad d esté en un enlace vertical. rotación horaria significa (R), pues H está en enlace vertical (R)-3-clorohexano (S)-3-clorohexano Sistema (R), (S) para designar enantiómeros 3. Si el grupo (o átomo) con la prioridad más baja está en un enlace horizontal, la respuesta obtenida de la dirección de la flecha será la opuesta a la correcta. Si la flecha apunta en dirección de las agujas del reloj, sugiriendo una configuración (R), el compuesto en realidad tendrá la configuración (S) y viceversa. Ejemplo: rotación horaria significa (S), pues H está en un enlace horizontal Actividad óptica de compuestos quirales • Los enantiómeros poseen las mismas propiedades físicas (puntos de ebullición, puntos de fusión, solubilidades, etc.). Una diferencia es la manera en la que interactúan con la luz polarizada plana (debido a la forma tridimensional distinta en la que los grupos unidos al centro asimétrico se encuentran) y otra la manera en que reaccionan con otros compuestos quirales. Actividad óptica de compuestos quirales • La luz blanca (proveniente de un foco o del sol) consiste de ondas electromagnéticas que oscilan en todas las direcciones. Por el contrario, todos los rayos de un haz de luz polarizada plana oscilan en un solo plano. La luz polarizada plana se obtiene al hacer pasar la luz blanca a través de un polarizador. Actividad óptica de compuestos quirales • En 1815, el físico francés Jean-Baptiste Biot descubrió que ciertos compuestos orgánicos naturales son capaces de hacer rotar el plano de polarización de la luz polarizada plana. Constató que algunos compuestos hacían rotar el plano de polarización hacia la derecha y otros hacia la izquierda. Propuso que la capacidad de las moléculas de hacer rotar el plano de polarización de la luz polarizada plana se debía a la asimetría de las moléculas. Posteriormente, se determinó que la asimetría se debía a que las moléculas poseen uno o más centros asimétricos. Actividad óptica de compuestos quirales • Cuando la luz polarizada plana pasa a través de una solución de moléculas aquirales en un polarímetro, la luz emerge de la solución con su plano de polarización sin cambio alguno. Actividad óptica de compuestos quirales • Cuando la luz polarizada plana pasa a través de una solución de moléculas quirales, la luz emerge con su plano de polarización con una rotación ya sea en sentido horario de las agujas del reloj o en sentido contrario. Si un enantiómero la hace rotar en sentido horario de las agujas del reloj, su imagen en el espejo la hará rotar exactamente el mismo ángulo, pero en sentido contrario. Actividad óptica de compuestos quirales • Un compuesto que hace rotar el plano de polarización de la luz polarizada plana (compuesto quiral) es ópticamente activo. Los compuestos aquirales son ópticamente inactivos. • Si un compuesto ópticamente activo hace rotar el plano de la luz polarizada en sentido horario de las agujas del reloj, se dice que el compuesto es dextrógiro y se coloca un prefijo (+)- (o a veces d) delante de su nombre. Si hace rotar el plano de la luz polarizada en sentido contrario al de las agujas del reloj, se dice que el compuesto es levógiro y se indica esto con un prefijo (-)- (o a veces l). Actividad óptica de compuestos quirales • No se debe confundir (+) y (-) con (R) y (S). Los símbolos (+) y (-) indican la dirección en la cual un compuesto ópticamente activo hace rotar el plano de polarización de la luz polarizada plana, mientras (R) y (S) indican el ordenamiento espacial de los grupos alrededor de un centro asimétrico. • Algunos compuestos con la configuración (R) son (+) y otros (-), mientras algunos compuestos con la configuración (S) son (+) y otros (-). Actividad óptica de compuestos quirales • Tanto el (S)-ácido láctico como el (S)-lactato de sodio tienen la configuración (S), pero el (S)-ácido láctico es dextrógiro, mientras el (S)-lactato de sodio es levógiro. • Se puede determinar si un compuesto es (R) o (S) en base a su estructura, pero la única manera de determinar si un compuesto es dextrógiro o levógiro es midiendo el ángulo y la dirección en que hace rotar la luz polarizada plana en un polarímetro. ácido (S)-(+)-láctico (S)-(-)-lactato de sodio Medición de la rotación específica • Si se hace pasar luz a través de dos polarizadores (lentes de polarización) en un ángulo de 90° uno respecto al otro, no pasa luz a través de ellos. Medición de la rotación específica • El ángulo de rotación de una sustancia ópticamente activa varía en función de la longitud de onda, por lo que la fuente de luz empleada para las mediciones debe ser monocromática. La mayor parte de los polarímetros utilizan la luz de una lámpara de sodio (línea D del sodio, longitud de onda = 589 nm). • Esquema simplificado de un polarímetro y sus componentes: fuente de luz, polarizador, tubo de muestra y analizador. Medición de la rotación específica • Se coloca la muestra a ser medida en el tubo de muestra. Si la muestra es ópticamente activa, hará rotar el plano de polarización. El analizador, por tanto, no bloqueará toda la luz y algo de luz llegará al ojo del observador. Este hará girar el analizador hasta que no pase luz a través del polarímetro. El ángulo de rotación del analizador se puede leer entonces en una escala graduada. Este valor, que se mide en grados, se denomina la rotación observada (α), que depende del número de moléculas ópticamente activas que la luz encontró en su camino, que a su vez dependen de la concentración de la muestra y de la longitud del tubo de muestra, además de la temperatura y la longitud de onda. Medición de la rotación específica • Cada compuesto ópticamente activo tiene una rotación específica característica. • Rotación específica. Rotación causada por una solución de 1,0 g de un compuesto por mL de solución en un tubo de muestra de 1,0 dm de longitud a una temperatura y longitud de onda específicas. [α]Tlambda = α/l x C [α] = rotación específica; α = rotación observada; T = temperatura en °C; l = longitud del tubo de muestra en decímetros; C = concentración de la muestra en g/L de solución. Cuando se usa la línea D del sodio, se indica como subíndice y la temperatura usual es de 20 °C. Medición de la rotación específica • Si un enantiómero tiene una rotación específica de +5,75°, la rotación específica del otro enantiómero será -5,75°, porque la molécula que es imagen en el espejo hace rotar el plano de polarización el mismo ángulo, pero en dirección opuesta. (R)-2-metil-1-butanol (S)-2-metil-1-butanol Rotación específica de algunos compuestos naturales Compuesto Rotación específica Compuesto Rotación específica Colesterol Cocaína -31,5 -16 Penicilina Progesterona +233 +172 Codeína Morfina -136 -132 Sacarosa Testosterona +66,5 +109 Mezcla racémica o racemato • Es una mezcla en cantidades iguales de dos enantiómeros (como el (R)-(-)-ácido láctico y el (S)-(+)ácido láctico). • Las mezclas racémicas son ópticamente inactivas, porque por cada molécula que hace rotar el plano de polarización en una dirección, existe una molécula que es su imagen en el espejo, que hace rotar el plano de polarización el mismo ángulo en sentido opuesto. Como resultado, la luz que emerge de una muestra de mezcla racémica tiene una rotación de 0°. Se utiliza el símbolo (±) para especificar una mezcla racémica. Por ejemplo, el (±)-2-bromobutano consiste de una mezcla de 50% de (+)-2-bromobutano y 50% de (-)-2bromobutano. Exceso enantiomérico • Para saber si una muestra particular de un compuesto consiste de un enantiómero, una mezcla racémica o una mezcla de enantiómeros en cantidades desiguales, se puede utilizar la rotación observada específica, que es la rotación específica de la muestra. • Por ejemplo, si una muestra de (S)-(+)-2bromobutano es enantioméricamente pura (solo un enantiómero está presente), tendrá una rotación observada específica de +23,1°. Exceso enantiomérico • Si una muestra de 2-bromobutano es una mezcla racémica, tendrá una rotación observada específica de 0°. • Si la rotación observada específica es positiva, pero menor que +23,1°, la muestra es una mezcla de enantiómeros y la mezcla contiene más del enantiómero (S) que del enantiómero (R), porque el enantiómero (S) es dextrógiro. Exceso enantiomérico • El exceso enantiomérico, llamado también pureza óptica, indica cuánto de exceso de un enantiómero está presente en una mezcla. Se puede calcular a partir de la rotación específica observada: exceso enantiomérico = (rotación observada específica/rotación específica del enantiómero puro) x 100% Exceso enantiomérico • Por ejemplo, si la muestra de 2-bromobutano tiene una rotación observada específica de +9,2°, entonces el exceso enantiomérico es 40%. En otras palabras, el exceso de uno de los dos enantiómeros comprende el 40% de la muestra. exceso enantiomérico = (+9,2/+23,1) x 100% = 40% Si la mezcla tiene un 40% de exceso enantiomérico, 40% de la mezcla es un exceso del enantiómero (S) y 60% es una mezcla racémica. Por tanto, la mezcla estará formada por un 70% del enantiómero (S) y un 30% del enantiómero (R). Compuestos con más de un centro asimétrico • Muchos compuestos orgánicos tienen más de un centro asimétrico. Cuanto más centros asimétricos tiene un compuesto, puede tener más estereoisómeros. Si se conoce el número de centros asimétricos, se puede calcular el número máximo de estereoisómeros para dicho compuesto. Un compuesto puede tener un máximo de 2n estereoisómeros, donde n es igual al número de centros asimétricos. Compuestos con más de un centro asimétrico • El 3-cloro-2-butanol tiene dos centros asimétricos. Puede tener un número máximo de cuatro (22 = 4) estereoisómeros. enantiómeros eritro enantiómeros treo fórmulas en perspectiva de los estereoisómeros del 3-cloro-2-butanol (alternadas) Compuestos con más de un centro asimétrico • Los cuatro estereoisómeros del 3-cloro-2-butanol consisten de dos pares de enantiómeros. Los estereoisómeros 1 y 2 son imágenes en el espejo no superponibles (enantiómeros). Los estereoisómeros 3 y 4 son también enantiómeros. Los estereoisómeros 1 y 3 no son idénticos y no son imágenes en el espejo uno de otro. Tales estereoisómeros son llamados diastereoisómeros. Los estereoisómeros 1 y 4, 2 y 3 y 2 y 4 son también pares de diastereoisómeros. enantiómeros eritro enantiómeros treo proyecciones de Fischer de los estereoisómeros del 3-cloro-2-butanol (eclipsadas) Compuestos con más de un centro asimétrico • En un par de estereoisómeros, la configuración de uno de los centros asimétricos es la misma en ambos, pero la configuración del otro centro asimétrico es diferente. • Los diastereoisómeros son estereoisómeros que no son enantiómeros (los isómeros cis – trans también son diastereoisómeros). Compuestos con más de un estereocentro • Los enantiómeros tienen propiedades físicas idénticas y propiedades químicas idénticas (reaccionan con reactivos aquirales a la misma velocidad). Los diastereoisómeros tienen propiedades físicas distintas (puntos de fusión, puntos de ebullición, solubilidades, rotaciones específicas, etc.) y propiedades químicas diferentes (reaccionan con reactivos aquirales a diferentes velocidades). Compuestos con más de un estereocentro • Cuando se dibujan estereoisómeros con dos centros asimétricos adyacentes en proyecciones de Fischer (en conformaciones eclipsadas), los enantiómeros con los hidrógenos del mismo lado de la cadena de carbono son llamados enantiómeros eritro, mientras que los que poseen los hidrógenos en lados opuestos son llamados enantiómeros treo. enantiómeros eritro enantiómeros treo fórmulas en perspectiva de los estereoisómeros del 3-cloro-2-butanol (eclipsadas) Compuestos con más de un estereocentro • Las fórmulas en tres dimensiones permiten mostrar los enantiómeros eritro y treo en conformaciones alternadas y eclipsadas. enantiómeros eritro enantiómeros treo enantiómeros eritro enantiómeros treo Estereoisómeros de compuestos cíclicos • El 1-bromo-2-metilciclopentano posee dos centros asimétricos y cuatro estereoisómeros. Como el compuesto es cíclico, los sustituyentes pueden ser cis o trans. Se puede dibujar los enantiómeros tanto para el isómero cis como para el isómero trans. Cada uno de los cuatro estereoisómeros es quiral. cis-1-bromo-2-metilciclopentano enantiómeros trans-1-bromo-2-metilciclopentano enantiómeros Estereoisómeros de compuestos cíclicos • El 1-bromo-3-metilciclohexano también tiene dos centros asimétricos. El átomo de carbono que forma el enlace con el bromo y un hidrógeno está también unido a dos grupos diferentes (-CH2CH(CH3)CH2CH2CH2y -CH2CH2CH2CH(CH3)CH2-), de modo que es un centro asimétrico. El átomo de carbono unido al grupo metilo y a un hidrógeno también está enlazado a dos grupos de cadenas de carbono, así que es también un centro asimétrico. estos dos grupos son distintos centro asimétrico centro asimétrico Estereoisómeros de compuestos cíclicos • Como el compuesto posee dos centros asimétricos, tiene cuatro estereoisómeros. Los enantiómeros pueden ser dibujados tanto para el isómero cis como para el isómero trans. Cada uno de los cuatro estereoisómeros es quiral. cis-1-bromo-3-metilciclohexano enantiómeros trans-1-bromo-3-metilciclohexano enantiómeros Estereoisómeros de compuestos cíclicos • El 1-bromo-3-metilciclobutano no posee centros asimétricos. El carbono 1 tiene un Br y un H unidos a él, pero sus otros dos grupos [-CH2CH(CH3)CH2-] son idénticos. Lo mismo sucede con el carbono 3. Como el compuesto no tiene un carbono con cuatro diferentes grupos unidos a él, tiene solo dos estereoisómeros, el isómero cis y el isómero trans. Ambos son aquirales. los dos grupos son iguales cis-1-bromo-3-metilciclobutano trans-1-bromo-3-metilciclobutano Estereoisómeros de compuestos cíclicos • El 1-bromo-4-metilciclohexano tampoco tiene centros asimétricos. Por ello, el compuesto tiene solo dos estereoisómeros, el isómero cis y el isómero trans. Ambos estereoisómeros son aquirales. cis-1-bromo-4-metilciclohexano trans-1-bromo-4-metilciclohexano Compuestos meso • Algunos compuestos con dos centros asimétricos tienen cuatro estereoisómeros. Sin embargo, algunos compuestos con dos centros asimétricos poseen solo tres estereoisómeros. Ejemplo: 2,3-dibromobutano. fórmulas en perspectiva de los estereoisómeros del 2,3-dibromobutano (alternadas) Compuestos meso • La imagen en el espejo del primer isómero es la misma molécula. Esto se puede ver más claramente cuando las fórmulas en tres dimensiones se dibujan en conformaciones eclipsadas o cuando se utilizan proyecciones de Fischer. fórmulas en perspectiva de los estereoisómeros del 2,3-dibromobutano (eclipsadas) proyecciones de Fischer de los estereoisómeros del 2,3-dibromobutano (eclipsadas) Compuestos meso • Se puede ver en imágenes en tres dimensiones que el compuesto 1 y su imagen en el espejo son idénticas. Asimismo, se puede ver 1 en proyección de Fischer y su imagen en el espejo (la única rotación permitida en las proyecciones de Fischer es de 180° en el plano del papel). imagen en el espejo superimponible imagen en el espejo superimponible Compuestos meso • El estereoisómero 1 es llamado compuesto meso. A pesar de que un compuesto meso tiene centros asimétricos, es aquiral, porque se puede superponer a su imagen en el espejo (meso = medio en griego). • Un plano de simetría corta un compuesto meso en dos mitades, que son la imagen en el espejo una de otra. compuestos meso Compuestos meso • Es fácil reconocer cuando un compuesto con dos centros asimétricos tiene un estereoisómero que es un compuesto meso, porque los cuatro átomos o grupos unidos a un centro asimétrico son idénticos a los cuatro átomos o grupos unidos al otro centro asimétrico. Ejemplo: compuesto meso compuesto meso enantiómeros enantiómeros Compuestos meso • En el caso de compuestos cíclicos, el isómero cis será un compuesto meso y el isómero trans estará constituido por un par de enantiómeros. compuesto meso compuesto meso enantiómeros enantiómeros Compuestos meso • En la fórmula tridimensional con el ciclohexano plano, el cis-1,2-dibromociclohexano parece tener un plano de simetría. Sin embargo, el ciclohexano no es un plano hexagonal, sino que existe preferentemente en la conformación silla. Esta no tiene un plano de simetría, pero la conformación bote si lo tiene. Entonces, ¿es el cis1,2-dibromociclohexano un compuesto meso? La respuesta es si. sin plano de simetría plano de simetría confórmero silla confórmero bote Compuestos meso • La existencia de un plano de simetría como criterio para la existencia de compuestos meso es válida para compuestos acíclicos. Para estos compuestos, es mejor observar la conformación eclipsada. Ejemplo: 2,3-dibromobutano. plano de simetría confórmero eclipsado sin plano de simetría confórmero alternado Nomenclatura de compuestos con más de un centro asimétrico • Si un compuesto tiene más de un centro asimétrico, los pasos para determinar si un centro asimétrico dado tiene la configuración (R) o (S) deben ser aplicados individualmente a cada uno de los centros asimétricos. Como ejemplo, nombremos uno de los estereoisómeros del 3-bromo-2-butanol. Nomenclatura de compuestos con más de un centro asimétrico • En primer lugar, se determinará la configuración de C-2. El OH tiene la mayor prioridad, el C-3 tiene la segunda (C unido a Br, C, H), luego el grupo CH3 tiene la tercera y finalmente el H la cuarta. Por tanto, la configuración del C-2 es (S). Nomenclatura de compuestos con más de un centro asimétrico • Luego, se determina la configuración en C-3. Se debe cambiar el ángulo de visión para ello, estableciéndose que la configuración de este átomo de carbono es (R). • Por ello, el nombre del isómero es (2S,3R)-3-bromo-2butanol. Nomenclatura de compuestos con más de un centro asimétrico • Se utiliza un procedimiento similar cuando se usan las proyecciones de Fischer. En el C-2, la dirección de rotación una vez determinadas las prioridades es en sentido horario, lo que indica una configuración (R). Sin embargo, como el enlace con el sustituyente de menor prioridad es horizontal, se invierte el sentido y la configuración es (S). Nomenclatura de compuestos con más de un centro asimétrico • Repitiendo los mismos pasos para el C-3, se determina que el centro asimétrico tiene la configuración (R). De esta manera, el isómero es el (2S,3R)-3-bromo-2-butanol. Nomenclatura de compuestos con más de un centro asimétrico • Los cuatro estereoisómeros del 3-bromo-2butanol se muestran a continuación. Nomenclatura de compuestos con más de un centro asimétrico • El ácido tartárico tiene tres estereoisómeros, porque cada uno de sus dos centros asimétricos tiene el mismo conjunto de cuatro sustituyentes. Se muestran a continuación el compuesto meso y el par de enantiómeros. ácido (2R,3S)-tartárico compuesto meso ácido (2R,3S)-tartárico compuesto meso ácido (2R,3R)-tartárico ácido (2S,3S)-tartárico enantiómeros ácido (2R,3R)-tartárico ácido (2S,3S)-tartárico enantiómeros Propiedades físicas de los estereoisómeros del ácido tartárico Estereoisómero Punto de fusión, °C Rotación específica (2R,3R)-(+)ácido tartárico 171 +11,98 Solubilidad, g/100 g H2O a 15 °C 139 (2S,3S)-(-)-ácido tartárico (2R,3S)-ácido tartárico (meso) (±)-ácido tartárico 171 -11,98 139 146 0 125 206 0 139 Separación de enantiómeros • Los enantiómeros no pueden ser separados por las técnicas usuales de separación, como la destilación fraccionada o la cristalización, porque sus puntos de ebullición y solubilidades idénticas hacen que destilen o cristalicen simultáneamente. Ejemplo: tartrato de sodio y amonio. cristales orientados hacia la derecha cristales orientados hacia la izquierda tartrato de sodio y amonio Separación de enantiómeros • Louis Pasteur fue el primero que logró separar un par de enantiómeros. Al trabajar con cristales de tartarato de sodio y amonio, notó que los cristales no eran idénticos. Después de separarlos con un par de pinzas y una lupa, encontró que una solución de un tipo de cristales hacía rotar la luz polarizada en un sentido y una solución del otro tipo hacía rotar la luz polarizada en el otro sentido. Separación de enantiómeros • El experimento de Pasteur dio origen a un nuevo término químico. El ácido tartárico se obtiene de las uvas, de modo que se lo llamó mezcla racémica (del latín racemus = racimo de uvas). De ahí que una mezcla de iguales cantidades de enantiómeros se llama mezcla racémica. La separación de enantiómeros se llama resolución de una mezcla racémica. Separación de enantiómeros • La separación manual realizada por Pasteur no es un método universal para separar enantiómeros, pues la mayoría no forman cristales que se pueden distinguir visualmente. Los enantiómeros se pueden separar por cromatografía sobre un medio quiral, que interactúa de manera distinta con un enantiómero (R) que con otro (S), haciendo que ambos migren a velocidades distintas a través de una columna rellena con medio quiral. material quiral Drogas quirales • Hasta hace poco, la mayor parte de los medicamentos con centros asimétricos se vendían como mezclas racémicas, por la dificultad de sintetizar enantiómeros puros y el alto costo de separar los enantiómeros. En 1992, la FDA de E.E.U.U. emitió una norma para lograr que las empresas farmacéuticas produjesen las drogas como enantiómeros puros. Las empresas se han ido adaptando a esta normativa. Drogas quirales • Los enantiómeros pueden tener propiedades fisiológicas similares o muy diferentes. Existen numerosos ejemplos de ello. La (S)-(+)-ketamina es cuatro veces más potente como anestésico que la (R)-(-)-ketamina y los efectos secundarios de esta droga están relacionados solo al isómero (R). El enantiómero (S) de Prozac, un antidepresivo, es un mejor bloqueador de la serotonina, pero se consume mucho más rápido que el isómero (R). La actividad del ibuprofeno, analgésico vendido con las marcas Advil, Nuprin y Motrin, reside principalmente en el enantiómero (S)-(+). Otros ejemplos son el ingrediente activo del Vicks Vapor y la metanfetamina (droga “speed). ingrediente activo de Vicks Vapor metanfetamina o “speed” Otros centros asimétricos • Otros átomos distintos al carbono pueden ser centros asimétricos. Cualquier átomo que tenga cuatro átomos o grupos diferentes unidos a él es un centro asimétrico. Por ejemplo, los siguientes pares de compuestos, con centros asimétricos de nitrógeno o fósforo, son enantiómeros. enantiómeros enantiómeros Otros centros asimétricos • Si uno de los cuatro grupos unidos al nitrógeno es un par de electrones, los enantiómeros no pueden ser separados, porque se interconvierten rápidamente a temperatura ambiente. Esta rápida interconversión es denominada inversión de amina. El par de electrones libres es necesario para la inversión, los iones amonio cuaternarios no muestran esta inversión. enantiómeros estado de transición orbital p Otros centros asimétricos • Una manera de imaginar la inversión de amina es compararla con un paraguas que se invierte por causa del viento. • La energía requerida para la inversión de amina es aproximadamente 6 kcal/mol (25 kJ/mol), cerca de dos veces la energía requerida para la rotación alrededor de un enlace simple C – C, pero suficientemente baja para permitir que los enantiómeros se interconviertan rápidamente a temperatura ambiente. Como resultado, los enantiómeros no se pueden separar.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados