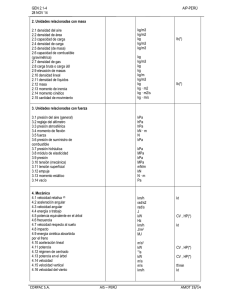
09/05/2011
Tutorial MATLAB
2.4 EQUILIBRIO EN SISTEMAS PVT
El tipo de sistema más comúnmente encontrado en aplicaciones de ingeniería química tiene las principales
variables características: presión, volumen, temperatura y composición. Tales sistemas están hechos de fluidos,
líquido o gas, y son sistemas designados PVT.
2.4.1
Equilibrio de Fases.
El equilibrio entre dos fases ocurre cuando el potencial químico de cada componente es el mismo en las dos
fases
(2.46)
donde
= potencial químico de la especie j en la fase I
= potencial químico de la especie j en la fase II
Debido a que la gran mayoría de sistemas químicos involucran fases de liquido y vapor, se usan muchas
relaciones de equilibrio liquido - vapor. En el rango desde los muy simples a los muy complejos.
Básicamente nosotros necesitamos una relación que nos permita la composición del vapor si conocemos
la composición del liquido o viceversa. El problema más común es un calculo de punto de burbuja: calcular la
temperatura T y la composición del vapor yj, dada la presión P y la composición del liquido x j. Esto
usualmente involucra un calculo de prueba y error, en solución iterativa debido a que las ecuaciones pueden
ser resueltas explícitamente solamente en los casos simples. Algunas veces se tienen cálculos de punto de
burbuja que se inician en valores conocidos de x j y T, y se deben encontrar P e yj. Esto es usualmente más
fácil que cuando la presión es conocida debido a que los cálculos de punto de burbuja usualmente no son
iterativos.
Los cálculos de punto de rocío se pueden hacer cuando se conoce la composición del vapor yj y P (o
T) y se quiere encontrar la composición del liquido x j (o P), los cálculos para evaporación “flash” se deben
hacer cuando se conocen ya sea x j o yj y deben combinarse las relaciones de equilibrio de fases, ecuaciones
de balance de componentes, y un balance de energía para encontrar el resto de incógnitas.
Nosotros asumiremos comportamiento ideal de la fase vapor en los ejemplos, por ejemplo, la presión
parcial del componente j en el vapor es igual al producto de la presión total P por la fracción molar del
componente j en la fase vapor yj (Ley de Dalton).
Pi = Pyi
(2.46)
Se pueden requerir correcciones para altas presiones
En la fase vapor se han usado extensamente varias aproximaciones,
plantasquimicas.com/…/sim2b.htm
1/13
09/05/2011
Tutorial MATLAB
1. Ley de Raoult. Los líquidos que obedecen la Ley de Raoult son denominados ideales
(2.47)
(2.47b)
es la presión de vapor del componente puro j. Las presiones de vapor son funciones de la
donde
temperatura solamente. Esta dependencia es a menudo descrita por
(2.48a)
o también
(2.48b)
Los coeficientes de la ecuación de Antoine son normalmente dados para la presión en mmHg y temperatura
en °C Ref. Tabla 2
Sin embargo es fácil convertir los parámetros a a diferentes unidades de presión y temperatura. Para pasar de
°C a °K es suficiente restar 273.15 del parámetro C. Para pasar de mmHg a Pascales es suficiente adicionar
el logaritmo (natural o decimal) del factor entre ambas unidades al parámetro A
ln(101325/760) = 4.8928
o
log(101325/760) = 2.124903
o
log(101.325/760) = -0.875097
para presión en Kpa
ln(101.325/760) = -2.0149853
Los parámetros para la Ec. 2.48b, en °C y mmHg para etanol. Ref. Tabla 2
A
B
C
8.21330 1652.050 231.480
son convertidos a °K y Pa
A
B
C
10.3382 1652.050 -41.67
plantasquimicas.com/…/sim2b.htm
2/13
09/05/2011
Tutorial MATLAB
parámetros para la Ec. 2.48b, en °C y Kpa
A
B
C
7.3382 1652.050 231.480
Una simple transformación puede usarse si se cambia el logaritmo común Ec. 248b, por por el logaritmo
natural Ec. 2.48a. Es suficiente multiplicar los parámetros A y B por ln(10) = 2.302585.
Los parámetros convertidos para usarlos con Ec. 2.48a. (para °C y kPa):
A
B
C
16.8968 3804.0 231.480
Estos parámetros se dan en la Tabla 1 del apéndice.
2. Volatilidad relativa. La volatilidad relativa α ij del componente i con respecto al componente j se define
por:
(2.49)
La volatilidad relativa tiende a ser constante para un gran número de sistemas. Por conveniencia es
frecuente mente usada así.
En un sistema binario la volatilidad relativa α del componente más volátil comparado con el componente
menos volátil es
(2.49b)
Rearreglando
(2.49c)
3. Valores K. Se usan extensamente las razones de vaporización o valores K, particularmente en la industria
del petróleo
plantasquimicas.com/…/sim2b.htm
3/13
09/05/2011
Tutorial MATLAB
(2.50)
Los valores K son funciones de la temperatura y composición, y en menor extensión de la presión.
4. Coeficientes de actividad. Para líquidos no ideales la Ley de Raoult debe ser modificada para
compensar la no-idealidad en la fase liquida. Los “factores de desviación” usados son denominados
coeficientes de actividad.
(2.51)
Ejemplo: Calculo del punto de burbuja
Usando las Ecs. (2.47) y (2.48) podemos calcular la temperatura de ebullición (punto de burbuja) de una
mezcla de componentes.
clear all
% Cálculo del punto de burbuja
% usando el método de Newton Raphson
% De la Ec. De Antoine
% ln(pi*) = Ai - (Bi/(T+Ci))
Ec 1.
% T=(-Bi./(log(Pop)-Ai))-Ci
Ec. 2
% La presión total es la suma de las presiones parciales
% P=sum(xi.Pi)
Ec. 3
%---------------------------------------------------------%%
% Mezcla Metanol, Etanol, 1-Propanol
% Parámetros A, B y C de la ecuación de Antoine
% para los componentes presentes en la mezcla
Ai=[16.5785, 16.8958, 16.1154];
Bi=[3638.27, 3795.17, 3483.67];
Ci=[239.5, 230.918, 205.807];
% Fracciones molares de la mezcla
xi =[.35, .25, 0.4];
%Presión de Operación, kPa
Pop=101.33;
% RANGO DE BUSQUEDA
% Temperaturas de ebullición de componentes a Pop
Ti=(-Bi./(log(Pop)-Ai))-Ci ;
T1=max(Ti);
T2=min(Ti);
%Metodo de Newton Raphson
T=T2;% Temperatura inicial supuesta
% Presión total para las condiciones iniciales
P=sum(xi.*exp(Ai - (Bi./(T+Ci)) ));
% Iteración Newton Raphson
while abs(Pop-P)>Pop/1000;
plantasquimicas.com/…/sim2b.htm
4/13
09/05/2011
Tutorial MATLAB
P=sum(xi.*(exp(Ai-Bi./(T+Ci))));
d1=(xi.*(exp(Ai-Bi./(T+Ci)))); % inicial
d2=sum(xi.*(exp(Ai-(Bi./((T+1)+Ci))))); % con incremento
d=d2-d1; diferenciación numérica
DF=sum(d);
T=T-(P-Pop)./DF; % Nuevo valor de T
end
BP=T;
%Salida de cálculos
fprintf('A la presión de= %g kPa se tiene:\n',Pop);
disp('1.- Temperaturas de ebullición de componentes puros:')
fprintf('
%4.4f °C \n',Ti')
fprintf('2.- El punto de Burbuja de la mezcla es= %g °C \n',BP);
Al ejecutar el programa se tiene:
>> burb_NR
A la presión de= 101.33 kPa se tiene:
1.- Temperaturas de ebullición de componentes puros:
64.7002 °C
78.1999 °C
97.1994 °C
2.- El punto de Burbuja de la mezcla es= 77.7299 °K
Referencia para parámetros de EC de Antoine:
Ecuación en log natural,
P= Kpa y T = °C
Ecuación en log decimal, P = mmHg y T = °C
: Tabla 1
: Tabla 2
Ejemplo: Calculo del punto de rocío
Modificamos el programa anterior con lo que se tieene el programa: dewp_NR
clear all
% Cálculo del punto de rocío
% usando el método de búsqueda
% De la Ec. De Antoine
% ln(pi*) = Ai - (Bi/(T+Ci))
Ec 1.
% T=(-Bi./(log(Pop)-Ai))-Ci
Ec. 2
% La presión total es la suma de las presiones parciales
% 1/P=sum(yi/Pi)
Ec. 3
%---------------------------------------------------------%%
% Mezcla Metanol, Etanol, 1-Propanol
% Parámetros A, B y C de la ecuación de Antoine
% para los componentes presentes en la mezcla
Ai=[16.5785, 16.8958, 16.1154];
Bi=[3638.27, 3795.17, 3483.67];
Ci=[239.5, 230.918, 205.807];
plantasquimicas.com/…/sim2b.htm
5/13
09/05/2011
Tutorial MATLAB
% Fracciones molares de la mezcla
yi =[.35, .25, 0.4];
% Presión de Operación, kPa
Pop=101.33;
%RANGO DE BUSQUEDA
% Temperaturas de ebullición de componentes a Pop
Ti=(-Bi./(log(Pop)-Ai))-Ci ;
% Rango de búsqueda
T1=max(Ti);
T2=min(Ti);
% Método de Newton Raphson
T=T2;% Temperatura inicial supuesta
% Presión total para las condiciones iniciales
iPop=1/Pop;
iP=sum(yi./(exp(Ai-Bi./(T+Ci))));
% Iteración Newton Raphson
while abs(iPop-iP)>iP/1000;
iP=sum(yi./(exp(Ai-Bi./(T+Ci))));
d1=(yi./(exp(Ai-Bi./(T+Ci)))); % inicial
d2=sum(yi./(exp(Ai-(Bi./((T+1)+Ci))))); % con incremento
d=d2-d1; %diferenciación numérica
DF=sum(d);
T=T+(iP-iPop)./DF; % Nuevo valor de T
end
DP=T;
% Crear la salida
disp(' ')
fprintf('A la presión de= %g kPa, se tiene:\n',Pop);
disp('1.- Temperaturas de ebullición de los componentes puros:')
fprintf('
%4.4f °C \n',Ti')
fprintf('3.- El punto de Rocío de la mezcla es= %g °C\n',DP);
>> dewp_NR
A la presión de= 101.33 kPa, se tiene:
1.- Temperaturas de ebullición de los componentes puros:
64.7002 °C
78.1999 °C
97.1994 °C
3.- El punto de Rocío de la mezcla es= 85.1143 °C
>>
Ejemplo: calculo de valores - K
De acuerdo a las Ec. (247b) y (2.50)
Tomando como temperatura del sistema 77.7299 °C cuando se produce el "flash"
clear all
% Cálculo de los valores-K
% De la Ec. De Antoine
plantasquimicas.com/…/sim2b.htm
6/13
09/05/2011
Tutorial MATLAB
% ln(pi*) = Ai - (Bi/(T+Ci))
Ec 1.
% presión de vapor del componente puro a la
% presión y temperatura de la mezcla
% Pi= exp(Ai-Bi./(T+Ci))))
Ec. 2
% E valor -K es:
% Ki = Pi/P
Ec. 3
%---------------------------------------------------------%%
% Mezcla Metanol, Etanol, 1-Propanol
%Parámetros A, B y C de la ecuación de Antoine
%para los componentes presentes en la mezcla
Ai=[16.5785, 16.8958, 16.1154];
Bi=[3638.27, 3795.17, 3483.67];
Ci=[239.5, 230.918, 205.807];
%Presión de Operación, kPa
P=101.33;
T= 77.7299 ; %°C
%Presion de Saturación
Pi=exp(Ai - (Bi./(T+Ci)) );
Ki=Pi/P;
%Salida de cálculos
fprintf('A la presión de= %g kPa :\n',P);
fprintf('y la temperatura de= %g °C, los valores-K son:\n',T);
fprintf('
%5.5f \n',[Ki]');
Al correr el programa se tiene:
>> valor_K
A la presión de= 101.33 kPa :
A la temperatura de= 77.7299 °C : los valores-K son
1.63435
0.98148
0.45409
>>
Si la composición del liquido es: xi =[0.35, 0.25, 0.4] podemos calcular directamente la composición del
vapor:
>> Ki=[1.63435
>> xi =[0.35,
>> yi=Ki.*xi
0.98148
0.45409];
0.25,
0.4];
yi =
0.5720
0.2454
0.1816
>>
Ejemplo: Diagrama TPXY programa diag_TPXY
clear all
% Diagrama TPXY
% De la Ec. De Antoine
% Presión de saturación de cada componente
% Pi= exp(Ai-Bi./(T+Ci))))
Ec. 1
% E valor -K es:
% Ki = Pi/P
Ec. 2
plantasquimicas.com/…/sim2b.htm
7/13
09/05/2011
Tutorial MATLAB
% Volatilidad relativa
% alfa= Ki(1)/Ki(2)
Ec. 3
% fraccion molar en el vapor
% yi=alfa*xi./(1+(alfa-1)*xi)
Ec. 4
%---------------------------------------------------------%%
% Etanol, 1-Propanol
% Parámetros A, B y C de la ecuación de Antoine
% para los componentes presentes en la mezcla
Ai=[16.8958, 16.1154];
Bi=[3795.17, 3483.67];
Ci=[230.918, 205.807];
% Presión de Operación, kPa
P=101.33;
T= 77.7299 ; %°C
% Presiones de saturación
Pi=exp(Ai - (Bi./(T+Ci)) );
% valores K
Ki=Pi/P;
alfa=Ki(1)/Ki(2);
% volatilidad relativa
xi=0:0.1:1;
% comp liquido
yi=alfa*xi./(1+(alfa-1)*xi); % comp. del vapor
%Salida de cálculos
y=xi;
plot(xi,yi,xi,y)
xlabel('xi')
ylabel('yi')
title('DIAGRAMA TPXY')
diag_TPXY
plantasquimicas.com/…/sim2b.htm
8/13
09/05/2011
Tutorial MATLAB
2.4.2 Cálculo de separadores flash
En la ingeniería de procesos químicos, los cálculos de separadores flash constituyen uno de los cálculos
básicos más frecuentemente empleados. Se requiere un cálculo flash para determinar el estado de cualquier
corriente de proceso que ha sufrido una transformación física o química, como ocurre cuando hay un
intercambio de calor, ya sea por un cambio de presión o un cambio de composición debido a una reacción.
Flash isotermo
Considérese un sistema con dos fases y NC número de componentes. El grado de libertad termodinámico de
este sistema será
F = NC - 2 + 2
Con T y P especificadas, se reduce a NC – 2. Así pues, si se especifican NC – 2 composiciones de la
mezcla, el estado del sistema queda termodinámicamente determinado.
Sea por ejemplo el sistema mostrado en la Fig. 11.
Si se toma 1 mol/hr de la corriente con las composiciones conocidas de la mezcla zi, i = 1,….,NC, a unas T y
P especificadas, y se desea calcular la distribución de la mezcla en V mol/hr de vapor de composición yi, i =
1,….,NC, y L mol/hr de líquido de composición xi, i = 1,….,NC. Se tienen por tanto 2 S incógnitas. Por otro
lado, hay S ecuaciones de balance de materia y S ecuaciones de coeficientes K especificados. Por tanto, el
problema está correctamente especificado.
Fig 11. Destilación "flash"
Las ecuaciones de balance son
zi = Vyi + Lxi
plantasquimicas.com/…/sim2b.htm
i = 1,.............,NC
9/13
09/05/2011
Tutorial MATLAB
y las ecuaciones en K son:
yi = Ki xi
i = 1,.............,NC
Para resolver el sistema, depende si utilizamos las ecuaciones de K para sustituir las variables yi o xi, se
pueden obtener dos expresiones en las ecuaciones de balance
Utilizando las expresiones en xi, resolvemos para xi, y se suman éstas, obtenemos
Utilizando las expresiones en yi, resolvemos para yi, y se suman éstas, obtenemos
Si ahora restamos ambas ecuaciones, siguiendo el método de resolución conocido como criterio de Rachford
- Rice, se obtiene
Como además
mol/hr, resulta
L = 1- V, ya que hemos tomado como base de cálculo la corriente de entrada
F=1
La única incógnita en esta ecuación es el flujo de vapor V, y por tanto su solución da V, que tendrá un valor
entre 0 y 1, y con V se determina L = 1 – V. Con ello, se calculan xi de la correspondiente expresión y se
obtienen yi de las ecuaciones en K.
Como se puede apreciar, cuando NC > 2 la ecuación anterior es no-lineal en V. La no-linealidad viene
introducida por las relaciones en K. Nótese además que como V está basada en una alimentación unitaria,
puede considerarse como una relación de flujo, es decir moles de vapor por mol de alimentación.
plantasquimicas.com/…/sim2b.htm
10/13
09/05/2011
Tutorial MATLAB
Ejemplo: Destilación "flash"
La mezcla de matanol, etanol y propanol que estamos estudiando, lo sometemos a destilación flash a 80 °C y
101.33 kPa, para determinar las cantidades de vapor y liquido a estas condiciones, resolvemos la ecuación de
Rachford - Rice haciendo uso de la función fzero de matlab, para lo cual escribimos el siguiente archivo;
flash.m
clear all
% Cálculo de destilación flash
% usando el método de Newton Raphson
% De la Ec. De Antoine
% Pi=exp(Ai - (Bi./(T+Ci)) );
Ec 1.
% Ecuación de Rachford - Rice
% sum((Ki-1.).*zi./(1.+(Ki-1.).*v))
Ec. 2
%---------------------------------------------------------%%
% Mezcla Metanol, Etanol, 1-Propanol
% Parámetros A, B y C de la ecuación de Antoine
% para los componentes presentes en la mezcla
Ai=[16.5785, 16.8958, 16.1154];
Bi=[3638.27, 3795.17, 3483.67];
Ci=[239.5, 230.918, 205.807];
zi =[.35, .25, 0.4];
%Presión de Operación, kPa
P=101.33;
T= 80; %°C
% Presion de Saturación
Pi=exp(Ai - (Bi./(T+Ci)) );
Ki=Pi/P;
% Solución numérica de la Ec. Rachford-Rice para encontrar v=V/F
v=fzero(@(v) sum((Ki-1.).*zi./(1.+(Ki-1.).*v)), 0.5);
fprintf('Moles de vapor = %g \n',v);
L=1-v;
fprintf('Moles de liquido = %g \n',L);
disp('Fracciones molares del liquido')
xi=zi./(1+v*(Ki-1))
disp('Fracciones molares del vapor')
yi= Ki.*xi
Se obtienen los siguientes resultados
>> flash
Moles de vapor = 0.309821
Moles de liquido = 0.690179
Fracciones molares del liquido
xi =
0.2824
0.2444
0.4732
Fracciones molares del vapor
plantasquimicas.com/…/sim2b.htm
11/13
09/05/2011
Tutorial MATLAB
yi =
0.5007
0.2624
0.2369
>>
2.4.3 Equilibrio Liquido-Vapor con UNTSIM
Ejemplo: Cálculos de equilibrio L-V
Ejemplo: Cálculos flash con UNTSIM
plantasquimicas.com/…/sim2b.htm
12/13
09/05/2011
Bioproce sos
Tutorial MATLAB
C iné tica y C atálisis
Fe nom e nos de
Transporte
Inge nie ría de
Procesos
C ontrol de Proce sos
De sarrollo Soste nible
Mode lam ie nto y
Sim ulación de Proce sos
Proce sos de
Se paración
Evaluación de
Proye ctos
Te rm odinám ica
Avanzada
[Ir a Modelamiento y Simulación de Procesos: Tabla de Contenido]
[Ir a Diseño de Plantas Químicas : Página Principal]
This Web site Copyright © by Diseño de Plantas Químicas. All rights reserved.
plantasquimicas.com/…/sim2b.htm
13/13