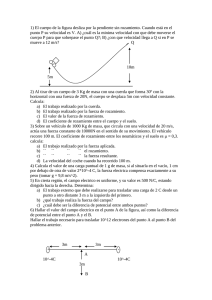
Examen Final de Física y Química. Todo el curso. 1º de Bachillerato Nombre: Fecha: 1. Una persona chuta una pelota desde una altura de 10 m y con una velocidad inicial de 5 m/s que forma un ángulo de 60º con la horizontal. Suponiendo ausencia de rozamiento con el aire: a) Determina el tiempo que tarda la pelota en llegar a la altura máxima y el valor de dicha altura. b) Determina el tiempo total que está en el aire y el alcance. (2 puntos) a) b) → 2. Una rueda cuyo radio es de 15 cm gira en torno a su eje a 3000 rpm. Acelera uniformemente y en 10 s alcanza las 4000 rpm. Calcula: a) La velocidad angular inicial y la velocidad angular final, expresadas en rad/s. (0,5 puntos) b) La aceleración angular expresada en rad/s2. (0,5 puntos) c) El ángulo que recorre en los 10 s, expresado en radianes y en vueltas. (0,5 puntos) a) b) c) 3. En el sistema de la figura, el coeficiente de rozamiento entre el plano inclinado y la masa de 10 kg es de 0,2 y el coeficiente de rozamiento entre el plano inclinado y la masa de 20 kg es de 0,1. Calcula la aceleración del sistema y la tensión de la cuerda. (2 puntos) __________________________ 4. Desde la parte inferior de un plano inclinado lanzamos hacia arriba un cuerpo con una velocidad inicial de 10 m/s, tal y como se indica en la figura. El cuerpo, de 15 kg de masa, recorre una distancia de 4 m sobre el plano hasta que se detiene. Calcula: a) La altura que alcanza el cuerpo. (0,25 puntos) b) El trabajo que realiza la fuerza de rozamiento. (0,5 puntos) c) El valor de la fuerza de rozamiento. (0,5 puntos) a) b) c) 5. Formula: a) 3-metil-heptan-1-ol (0,5 puntos) a) CH2-CH2-CH-CH2-CH2-CH2 -CH3 │ │ OH CH3 6. Nombra: a) CH3-CH=CH-C≡C-CH=CH-CH3 b) 3,4-hexadien-1-ino b) CH≡C-CH=C=CH-CH3 b) CH3-CH2-CH-CH2-CH2-CH3 │ CH2-CH3 (0,5 puntos) a) 2,6-octadien-4-ino b) 3-etilhexano 7. Una disolución acuosa de hidróxido de sodio al 20% en masa tiene una densidad de 1,25 g/mL. Calcula su molaridad. Datos: MA(Na)=23 u; MA(O)=16 u; MA(H)=1 u. (0,75 puntos) MM(NaOH)=23+16+1=40 g/mol 8. Cuando en un recipiente se juntan nitrógeno e hidrógeno se produce amoniaco. Se mezclan 200 g de nitrógeno con un exceso de hidrógeno. a) Calcula el volumen teórico de amoniaco que se obtendrá, medido a 20ºC y 1 atm de presión. (1punto) b) Si el rendimiento de la reacción es sólo del 80%, ¿cuál es el volumen real de amoniaco que se obtiene? (0,5 puntos) Datos: MA(N)=14 u; MA(H)=1 u. a) MM(N2)=14∙2=28 u T=20 ºC=293 K N2 + 3H2 → 2NH3 b)