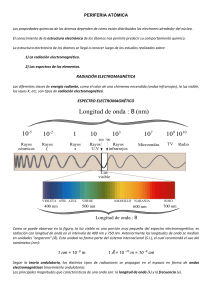
QUÍMICA 1 BLOQUE 2: INTERRELACIÓN DE LA MATERIA Y LA ENERGÍA QUÍMICA Es una ciencia que se dedica al estudio de la estructura, las propiedades, la composición y la transformación de la materia. Materia y Energía QUÍMICA Transformación MATERIA ENERGÍA Ocupa un espacio y tiene masa QUÍMICA Sólido Líquido Gaseoso Transformación MATERIA Ocupa un espacio y tiene masa ENERGÍA http://recursos.cnice.mec.es/quimica/ulloa2/3eso/3eso.html SÓLIDO Implica una forma y volumen definido y consiste en una fuerte atracción de las partículas de la materia (los movimientos entre las partículas es mínimo) LÍQUIDO No tiene una forma propia, pero si tiene un volumen definido. La fuerza de atracción entre las moléculas no es tan fuerte permitiendo así el movimiento de las partículas en su conjunto GAS Los gases no tienen ni forma ni volumen definidos, aunque ocupan todo el espacio disponible. Las partículas de la materia mantienen un gran movimiento y la fuerza de atracción entre ellas es mínima QUÍMICA Transformación MATERIA ENERGÍA Ocupa un espacio y tiene masa Sólido Líquido Gaseoso Propiedades generales (masa/volumen). Propiedades particulares (específicas de cada sustancia: Temperatura/densidad…) QUÍMICA Transformación MATERIA ENERGÍA Ocupa un espacio y tiene masa Sólido Líquido Gaseoso Propiedades generales (masa/volumen). Propiedades particulares (específicas de cada sustancia: Temperatura/densidad…) PROPIEDADES FÍSICAS Se definen como aquellos que pueden cambiar sin que esto altere la composición química de la materia MANIFESTACIÓNES DE LA MATERIA SUSTANCIAS PURAS: Formadas por el mismo tipo de elemento o compuesto. Cada sustancia pura tiene un conjunto de propiedades intensivas (independiente de la cantidad) que la distinguen de otra. MEZCLAS DE SUSTANCIAS: Combinación de varias sustancias puras que puede separarse mediante procedimientos físicos. No pierden sus propiedades y características ELEMENTOS: Formadas por un único tipo de átomos: no pueden descomponerse en otras mediante procedimientos químicos o físicos ordinarios SOLUCIÓNES O MEZCLAS HOMOGÉNEAS: Mezclas de sustancias cuyos componentes no pueden diferenciarse mediante procedimientos ópticos convencionales. Cualquier porción de la disolución tiene las mismas propiedades y composición MEZCLAS HETEROGENEAS: Mezclas de sustancias cuyos componentes pueden distinguirse a simple vista. Su composición y propiedades son diferentes en distintas partes de la mezcla H 2O H 2O C H O N P S COMPUESTOS: sustancia formada por la combinación de dos o más elementos de la tabla periódica y se representan con una formula química. Se pueden descomponer mediante procedimientos Físicos H 2O + -OH QUÍMICA Transformación MATERIA ENERGÍA Cambio o movimiento =TRABAJO QUÍMICA Transformación MATERIA ENERGÍA Cambio o movimiento =TRABAJO Calor Luz Electricidad Movimiento Energía Química ALGUNAS FORMAS DE ENERGÍA, SUS CARACTERÍSTICAS Y EJEMPLOS CINÉTICA POTENCIAL LUMINOSA CALORÍFICA EÓLICA ELECTRÍCA QUÍMICA QUÍMICA Transformación MATERIA Ocupa un espacio y tiene masa ENERGÍA Cambio o movimiento =TRABAJO Sólido Líquido Gaseoso Calor Luz Electricidad Movimiento Energía Química Propiedades generales (masa/volumen). Propiedades particulares (específicas de cada sustancia: Temperatura/densidad…) PROPIEDADES FÍSICAS Se definen como aquellos que pueden cambiar sin que esto altere la composición química de la materia QUÍMICA 1 BLOQUE 3: EL MODÉLO ATÓMICO ACTUAL Y SUS APLICACIÓNES George Ernst Stahl (1660 – 1734) ALEMÁN Alquimista y médico Antoine Laurent Lavoisier (1743 – 1794) FRANCES Y Teoría del flogisto (material inflamable liberado al momento de que la materia se quemaba). http://portalacademico.cch.unam.mx/alumno/quimica1/unidad1/reaccio nesQuimicas/leyconservacionmateria Refutó la teoría del flogisto La clave está en el oxígeno Postuló la ley de la conservación de la materia Aportación al concepto de elemento químico Cierto orden Nomenclatura química Joseph Louis Proust (1754 – 1826) FRANCES Compuesto: combinación en proporciones fijas de las sustancias. Ley de las proporciones definidas: un compuesto siempre está constituido por los mismos elementos y en la misma proporción en masa John Dalton (1766 – 1844) GRAN BRETAÑA Y http://portalacademico.cch.unam.mx/alumno/quimica1/unidad1/reaccio nesQuimicas/leydepropiedadesdefinidas Experimentó con las propiedades del físicas del aire y otros gases con base en los resultados de Proust. Postulado: “la materia está formada por átomos, entidades indivisibles e indestructibles” Masa relativa de los átomos Símbolos en elementos = TABLA (masa atómica) Sthal / Lavoisier / Proust y Dalton Modelo de Dalton Átomos: entidades indivisibles e indestructibles (4 postulados) Modelo de Rutherford Modelo planetario ¿? EL ÁTOMO ERA LA PARTÍCULA FUNDAMENTAL DE LA QUE ESTÁ CONSTITUIDA LA MATERIA Modelo de Thompson Átomo con masa de carga (+) con partículas (-) en su interior / budín de pasas Modelo de Bohr Modelo de órbita (3 postulados) http://portalacademico.cch.unam.mx/alumno/quimica1/unidad2/modelo s_atomicos/modelo_dalton El ÁTOMO eNúmero de protones (+) de cada elemento contenidos en el núcleo = NÚMERO ATÓMICO eeee- e- eeeee- NÚMERO DE MASA Protones + Neutrones = A Z ACOTACIÓNES e- Electrones Protones Neutrones e- MASA ATÓMICA DE UN ELEMENTO: considerando que es posible que algunos elementos tengan isótopos, es decir, átomos del mismo elemento con número de masa distinto y mismo número atómico, entonces, la masa atómica de un elemento es el promedio de las masas de sus isótopos. MODELO DE LA MECÁNICA CUÁNTICA DE SCHRODINGER Las soluciones a la ecuación de onda (ecuación diferencial) se conoce como funciones de onda u orbitales Función de onda (Ψ2): define la probabilidad de encontrar a un electrón en una región del espacio alrededor de un núcleo atómico No se puede definir la posición exacta del e- Número cuántico principal Número cuántico secundario n NIVELES DE ENERGÍA DEL ÁTOMO (Números cuánticos) I 0 1 1s2 2 2s2 2p6 3 3s2 3p6 3d10 4 4s2 4p6 4d10 4f14 s (nítido), p (principal), d (difuso), f (fundamental) 5 5s2 5p6 5d10 5f14 Momento magnético (m) Es la orientación del e- en el espacio bajo la influencia de un campo magnético 6 6s2 6p6 6d10 6f14 7 7s2 7p6 1 2 3 Número cuántico principal (n) Describe el nivel energético PRINCIPAL de un electrón, sus valores van desde 1 hasta 7 Número cuántico secundario (I) Indica el tipo de ORBITAL en el que se encuentra el átomo. Este valor es variable y determina el tipo de orbital o SUBNIVEL energético del electrón Spin o giro (s) Indica la orientación del giro del electrón sobre su propio eje. s p d f Tipos de orbitales 1 3 5 7 Capacidad de e- en cada orbital s pX py pz dxz REGLA DE HUND dyz dxy dx2-x2 dz2 SPIN O GIRO (Orientación del electrón) CONFIGURACIÓNES ELECTRÓNICAS Es la distribución de electrones en diferentes ORBITALES atómicos Los átomos con muchos PROTONES tienen mayor dificultad para retener a sus electrones más lejanos a su núcleo REGLAS 1. PRINCIPIO DE AUFBAU Los electrones ocupan los orbitales en orden creciente de energía 2. PRINCIPIO DE EXCLUSIÓN DE PAULI Un orbital puede estar ocupado sólo por dos electrones con spin de signo contrario 3. REGLA DE HUND Los electrones ocupan sus diferentes orbitales pero con diferente spin. Apareamiento. QUÍMICA 1 BLOQUE 4: LA INTERPRETACIÓN DE LA TABLA PERIÓDICA Lothar Meyer (1830-1895) / Dimitri I. Mendeliev (1834-1907) Información de los elementos Relación de masa atómica con las propiedades Mendeliev agrupó a los elementos de forma creciente de su masa atómica Reacción con el oxígeno Ley de la periodicidad química: las propiedades de un elemento están en función de su número atómico GRUPOS O FAMILIAS Nivel energético (n) PERIODOS Orbital (I) De elemento alcalino → Gas noble PROPIEDADES PERIÓDICAS ELECTRONEGATIVIDAD + Capacidad del núcleo atómico de un elemento para atraer a los electrones de otro átomo. - + - PROPIEDADES PERIÓDICAS RADIO ATÓMICO - Distancia que hay del centro del núcleo de un átomo al electrón más alejado de este. + - + PROPIEDADES PERIÓDICAS ENERGÍA DE IONIZACIÓN + Energía necesaria para separar un electrón de un átomo. Metales pierden eNo metales ganan e- + - -