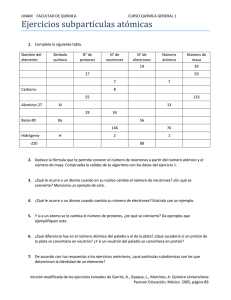
Ciencia y Tecnología 3° SECUNDARIA ESTRUCTURA ATÓMICA I.- ESTRUCTURA DEL ÁTOMO El átomo es la unidad estructural básica de la materia. ¿Cómo te imaginas un átomo? Los átomos están formados por protones, neutrones y electrones. Los electrones giran alrededor del núcleo, lugar donde se encuentran los protones y neutrones. El átomo es la forma más estable en la que encontraremos la materia, ya que a pesar de que las partículas subatómicas tienen masa, no pueden permaneces en forma aislada en la naturaleza. ¿Cómo podemos representar un átomo? Se puede hacer a través de un diagrama atómico, que es una representación sencilla de éste. Hasta ahora se ha logrado identificar 118 tipos de átomos diferentes, de los cuales 92 se encuentran en forma natural y los restantes han sido producidos en forma artificial en un laboratorio. Un conjunto de átomos del mismo tipo forma un elemento químico, + estos se representan con un símbolo formado por una letra (mayúscula) o dos letras (una mayúscula y una minúscula) que abrevian su nombre, llamado símbolo químico. Los átomos se diferencian entre sí por su cantidad de protones. Veamos un ejemplo: el hidrógeno tiene solo un protón. Cuando los átomos son neutros, el número de protones debe ser igual al número de electrones, entonces, el hidrógeno tiene un protón y un electrón. Todos los átomos de un elemento químico tienen el mismo número de protones, pero se pueden diferenciar en el número de neutrones. Por ejemplo, el hidrógeno puede no tener neutrones o poseer uno o dos neutrones, tal como muestran los siguientes diagramas atómicos: ACTIVIDAD 1. A partir de la información entregada, construye los diagramas atómicos de los siguientes átomos: Elemento Litio Flúor Oxígeno Protones 3 9 8 Neutrones 4 10 8 Electrones 3 9 8 Diagrama 1 Ciencia y Tecnología 3° SECUNDARIA II. NÚMERO ATÓMICO Y MÁSICO La cantidad de estas partículas subatómicas que poseen los diferentes átomos que conforman los elementos, les entregan sus propiedades a estos. Existen dos números que nos entregan información acerca de la cantidad de partículas subatómicas de un átomo: Número atómico (Z): Identifica a un elemento. Número másico (A): Determina el peso atómico. En el ejemplo anterior, el hidrógeno (H), tiene sólo un protón y un electrón (es decir, no tiene neutrones). Es importante recordar también que, en un átomo neutro, el número de electrones es igual al número de protones (electroneutralidad del átomo). Actividad 2. Observa la información de estos 10 elementos que se entregan en los recuadros y completa la tabla a continuación: Símbolo Z A protones (p+) Neutrones (n°) electrones (e-) 2 Ciencia y Tecnología 3° SECUNDARIA Actividad 3. Responde: a) Si un átomo neutro tiene 53 electrones y 74 neutrones, ¿cuál es su número atómico y su número másico? b) Si el número atómico del magnesio es 12, ¿cuántos protones posee?, ¿cuántos electrones posee si es eléctricamente neutro? c) La estructura del átomo de aluminio (número atómico, 13; número másico 27) es la siguiente: El núcleo está formado por 13 protones y 14 neutrones; la nube electrónica presenta 13 electrones. d) Verdadero ( ) Falso ( ) Fundamento: ______________________ _________________________________ _________________________________ e) Completa la siguiente tabla: 3 Ciencia y Tecnología 3° SECUNDARIA 4