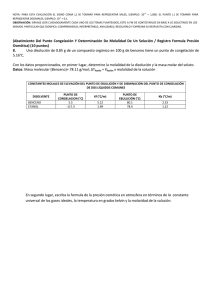
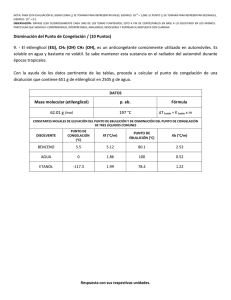
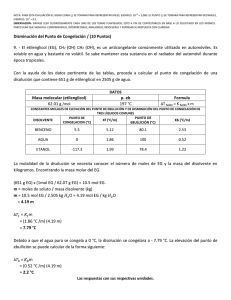
El punto de congelación, también denominado punto de congelamiento, es la temperatura en la cual una sustancia en estado líquido pasa a encontrarse en estado sólido. En otras palabras: el punto de congelación es el momento en el cual un líquido se solidifica. En el caso del agua pura (H2O), el punto de congelación es 0 °C. Esto quiere decir que, mientras esté a una temperatura superior a 0ºCe inferior a los 100ºC (ya que ese es su punto de ebullición), el agua se encontrará en estado líquido. Si la temperatura desciende por debajo de los 0ºC, el agua se congelará y pasará a convertirse en un sólido (hielo). Siguiendo con el ejemplo del agua, siempre tomando los valores teóricos (ya que en la práctica los procesos pueden darse a otras temperaturas), podemos ver cómo una sustancia va cambiando de estado de acuerdo a los diferentes puntos. Tomemos el agua a una temperatura ambiente de 20 °C: el agua será un líquido. Si se somete el líquido a un proceso de enfriamiento, cuando llegue a los 0 °C alcanzará su punto de congelación y se volverá un sólido. En cambio, si desde los 20ºC se empieza a calentar el agua, cuando alcance los 100ºC se encontrará con su punto de ebullición y se transformará en vapor. A pesar de que dicho valor, 0 °C, es en efecto el punto de congelación del agua, esto sólo se cumple si las condiciones de presión atmosférica son normales y si el agua no contiene un algo grado de impurezas. Si existen dichas impurezas, entonces es necesario conseguir que se congelen, que formen pequeñas semillas de hielo o núcleos para que colaboren con la congelación del líquido. Un estudio de simulación de agua a cargo de los investigadores H. Eugene Stanley y Pradeep Kumar desveló que en algunos casos el punto de congelación puede ser inferior a los 47 grados centígrados bajo cero, una diferencia abismal con el tradicional valor mencionado anteriormente. Si analizamos el punto de congelación de una solución (por ejemplo del agua marina, que es agua con sal), éste dependerá del tipo de solvente y de la molalidad del soluto en el solvente en cuestión. A mayor molalidad, el punto de congelación será inferior. La molalidad, por su parte, se expresa con la letra m y es el número de moles de soluto que se encuentran en un kilo de disolvente. Cuando se requiere la preparación de disoluciones de una molalidad en particular, es posible llevarla a cabo en un vaso de precipitados (un recipiente con forma de cilindro que se usa con frecuencia en el laboratorio, especialmente para calentar o preparar sustancias, y también para el traspaso de líquidos) y usar una balanza analítica para pesarla, sin olvidarse de anotar el peso del vaso antes de verter la sustancia para dar con el valor exacto. En el caso de la molaridad, un concepto que a veces se confunde con éste simplemente por su parecido a nivel ortográfico, la preparación de una solución requiere del uso de una matraz aforada (material volumétrico usado para la medición del volumen de un líquido según la capacidad del matraz mismo; posee un cuello estrecho y alto, lo cual incrementa la exactitud de las mediciones). Continuando con la molalidad, que afecta directamente el punto de congelación de ciertas soluciones, el mayor beneficio que aporta como método de medición es que no depende de la presión ni de la temperatura, ya que no está en función del volumen, y permite un cálculo más preciso que otros. La razón es que la temperatura y la presión de una disolución condicionan el volumen, y por eso cambia si lo hacen las primeras. El punto de congelación de un líquido es la temperatura a la cual la presión de vapor del líquido y del sólido se igualan, conservando la misma presión de vapor cuando están expuestos a una presión de una atmósfera, siendo dicho punto siempre inferior al de la solución pura. Por lo general, el sólido que se separa de la solución se encuentra en estado de pureza. Esto se da debido a la presencia de una pequeña cantidad de soluto no volátil que cambia la curva de equilibrio líquido - vapor. Se conoce como descenso crioscópico o depresión del punto de fusión a la disminución de la temperatura del punto de congelación que experimenta una disolución respecto a la del disolvente puro. Todas las disoluciones en las que, al enfriarse, el disolvente solidifica puro sin el soluto, tienen una temperatura de congelación inferior al disolvente puro. La magnitud del descenso crioscópico, ∆Tc, viene dada por la diferencia de temperaturas de congelación (o de fusión) del disolvente puro y de la disolución, Tf* y Tf, respectivamente. El descenso crioscópico es una de las propiedades coligativas y por lo tanto, la magnitud del descenso sólo depende de la naturaleza del disolvente y de la cantidad de soluto disuelta, es decir, es independiente de la naturaleza de este último. Cualquier soluto, en la misma cantidad, produce el mismo efecto. Es un indicador de pureza útil,por ejemplo, si se libera calor cuando se presenta la solidificación, demuestra cualquier impureza disuelta, presente sólamente en el líquido y no en el sólido. Las sustancias puras tienen un punto de congelación bien definido pero las mezclas generalmente se congelan sobre un rango de temperatura. Para muchas mezclas, la temperatura de congelación es un índice de pureza útil si se determina siguiendo correctamente los métodos. El punto de congelación se alcanza en una solución cuando la energía cinética de las moléculas se hace menor a medida que la temperatura disminuye; el aumento de las fuerzas intermoleculares de atracción y el descenso de la energía cinética son las causas de que los líquidos cristalicen. Las soluciones siempre se congelan a menor temperatura que el disolvente puro. La temperatura de congelación del agua pura es 0ºC. Medición de la temperatura de congelación Existen dos tipos de equipos que utilizan este fundamento de las propiedades coligativas de los líquidos para su funcionamiento, los críoscopios y los osmómetros, los cuales miden la depresión o abatimiento del punto de congelación, es decir, el volumen medido de la solución es colocado en el tubo de muestra y es sumergido en un baño de temperatura controlada. Luego un termopar y un vibrador son colocados dentro de la mezcla y la temperatura del baño es bajada hasta que la mezcla es super-enfriada. Entonces se activa el vibrador para inducir la cristalización del agua en la solución de prueba y el calor de fusión liberado eleva la temperatura hasta el punto de congelación. Por medio de un puente de Wheatstone, el punto de congelación registrado se convierte en una medida en términos de osmolaridad. El instrumento se calibra utilizando soluciones de referencia de cloruro de sodio que cubran el rango esperado de osmolaridades. Uno de los indicadores más susceptibles a la adición de materiales extraños en la leche es el punto crioscópico, el cual está regulado por las normas nacionales e internacionales, la leche fluida fresca deberá tener un punto crioscópico de 0.53 a -0.57 horvet o de -0.512 a 0.550°C. Cálculo del punto de congelación: Tc: diferencia entre los puntos de congelación de una solución y del disolvente puro. Kc: constante molal de congelación. Cuando el disolvente es agua el valor de la constante es: 1,86 ºC Kg/mol m: molalidad Aplicación de la fórmula: En 392 g de agua se disuelven 85 g de azúcar de caña (sacarosa). Determinar el punto de congelación de la solución resultante. Masa molecular de la sacarosa: 342 g/mol. Paso 1: determinar la molalidad de la solución: Paso 2: Determinar el punto de congelación Como el agua se congela por debajo de los 0ºC 0ºC– 1.179 = - 1.179°C.