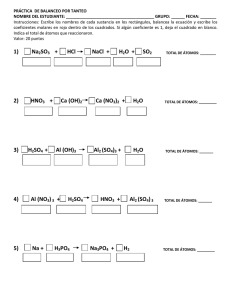
SÓLIDOS CRISTALINOS ANUAR GIMÉNEZ EL AMRANI 16615577-D ESTRUCTURAS CON UN SOLO TIPO DE ÁTOMO A. CÚBICA SIMPLE O PRIMITIVA: Red cuya celdilla unitaria es cúbica y en la que los átomos ocupan los vértices del cubo, dejando libre un hueco cúbico en el centro. -Número de átomos: 1 atm/celda. -Número de coordinación: 6 B. TETRAGONAL PRIMITIVA: Red cuya celdilla unidad es un paralelepípedo tetragonal (a=b≠c y α=β=ɣ=90º) con átomos dispuestos en sus vértices. -Número de átomos: 1 atm/celda. -Número de coordinación: 6 C. CÚBICA CENTRADA EN EL CUERPO BCC: Red cúbica en la que los átomos se encuentran dispuestos en los vértices del cubo y uno en el interior del mismo. Es decir, se trata de una red cúbica primitiva, con el hueco cúbico interior ocupado por un átomo. Presenta 6 huecos octaédricos y 12 huecos tetraédricos, no regulares. -Número de átomos: 2 atm/celdilla. -Número de coordinación: 8 (hueco cúbico) D. CÚBICA COMPACTA O CENTRADA EN LAS CARAS FCC: Red cúbica en la que los átomos se encuentran ocupando los vértices del cubo y el centro de todas las caras. Presenta 4 huecos octaédricos y 8 huecos tetraédricos. -Número de átomos: 4 atm/celdilla. -Número de coordinación: 12. E. HEXAGONAL COMPACTA HCP Red cuya celda unitaria es hexagonal, y posee átomos ocupando los vértices y el centro de 2 hexagonos regulares en dos planos perfectamente alineados separados entre sí por un plano intermedio con 3 átomos. -Número de átomos: 6 atm/celdilla. -Número de coordinación: 12. ESTRUCTURAS IÓNICAS DE FÓRMULA GENERAL MX F. ESTRUCTURA TIPO CLORURO DE CESIO (CsCl): Red cúbica primitiva de iones Cl- con cationes Cs+ en el centro. -Número de átomos: 1Cs+ y 1Cl- en el centro. -Número de coordinación Cs+ y Cl-: 8. (Electroneutralidad) -EJ. De cerámicas con esta red: CsBr, TlCl, TlBr; y aleaciones: CuZn, AlNi. G. ESTRUCTURA TIPO CLORURO DE SODIO (NaCl): Red cúbica centrada en las caras (FCC) de aniones Cl-, con cationes Na+ en todos los huecos octaédricos. -Número de átomos: 4Na+ y 4Cl-. -Número de coordinación Na+ y Cl-: 6. (HUECOS OCTAÉDRICOS) -EJ. De cerámicas con esta red: haluros alcalinos (menos Cs y Tl), MgO, CaO, FeO, NiO. H. ESTRUCTURA TIPO SULFURO DE ZINC (ZnS) (BLENDA Y WURTZITA): -Dos Polimorfos: BLENDA: Empaquetamientos ABCABC... WURTZITA: Empaquetamientos ABABAB... BLENDA: Red cúbica centrada en las caras (FCC) de aniones S2-, con cationes Zn2+ ocupando la mitad de los huecos tetraédricos de forma alterna. -Si todos los átomos fueran iguales, sería la estructura del Diamante Prop. Semiconductoras. -Número de átomos: 4 Zn2+ y 4 S2-. -Número de coordinación Zn2+ y S2-: 4. (HUECOS TETRAÉDRICOS) -EJ. De cerámicas con esta red: CdS, HgS. (Fotoconductores cerámicos, células solares) WURTZITA: Red Hexagonal Compacta (HCP) de aniones S2-, con cationes Zn2+ ocupando la mitad de los huecos tetraédricos. -Número de átomos: 2 Zn2+ y 2 S2-. -Número de coordinación Zn2+ y S2-: 4. (HUECOS TETRAÉDRICOS) ESTRUCTURAS IÓNICAS DE FÓRMULA GENERAL MX2 I. ESTRUCTURA TIPO FLUORITA Y ANTIFLUORITA (CaF2): Red cúbica centrada en las caras (FCC) de Ca ²+, con aniones F- ocupando todos los huecos tetraédricos. Como Ca ²+ es más voluminoso, el catión define la estructura. -Número de átomos: 4 Ca2+ y 4 F-. -Número de coordinación: 8 Ca2+ (CÚBICOS)y 4 F- (TETRAÉDRICOS) -EJ. De cerámicas con esta red: UO2, ThO2, CeO2… La estructura tipo ANTIFLUORITA resulta del intercambio de posiciones de los aniones y los cationes. J. ESTRUCTURA TIPO RUTILO (TiO2): Red hexagonal compacta (HCP) distorsionada de aniones O2- con cationes Ti4+ ocupando la mitad de los huecos tetraédricos. También se puede explicar como una red tetragonal con cationes Ti en el centro de huecos octaédricos, cuyos vértices están ocupados por aniones O. -La celda unidad es TETRAGONAL. -Número de átomos: 2 Ti4+ y 4 O2-. -Número de coordinación: 6 Ti (octaedro distorsionado) y 3 O (triángulo casi equilatero) -EJ. De cerámicas con esta red: UO2, ThO2, CeO2… -Forman hélices que favorecen la conductividad. -Usos: blanqueantes, pinturas… No tóxicos. -Polimorfo: ANATASA (cremas) K. ESTRUCTURA TIPO BETA-CRISTOBALITA (SiO2): -Red cúbica centrada en el cuerpo (BCC), de cationes silicio con la mitad de los huecos tetraédricos ocupados por silicio de manera alterna y átomos de Oxigeno cada 2 átomos de silicio. -También, Estructura tipo diamante de cationes de silicio con aniones oxígeno cada 2 átomos de Silicio. -Número de átomos: 8 Si y 16 O. -Número de coordinación: 4 Si y 2 O. ESTRUCTURAS COVALENTES EXTENSAS A. DIAMANTE: Estructura cúbica centrada en las caras con ocupación del 50% de los huecos tetraédricos de manera alterna. Los átomos ocupan las posiciones de Zn y S en la blenda. -Número de átomos: 8 C. -Número de coordinación: 4 (tetraédricos) B. CUARZO: Una forma de sílice. La forma beta consta de tetraedros [SiO4] unidos entre sí, cada O esta compartido por dos tetraedros. Los tetraedros forman hélices a lo largo del cristal, es un material anisotrópico y desvía el plano de la luz polarizada, según la dirección de la hélice (enantiomorfos). -Número de átomos: 8 C. -Número de coordinación: 4 (tetraédricos) C. GRAFITO: Polimorfo del carbono. Capas de átomos de carbono formando una red hexagonal, con enlaces C-C . La distancia entre láminas es de 3.35 Å y estan unidas entre sí por fuerzas de Van der Waals. -Número de átomos: 8 C. -Número de coordinación: 4 (tetraédricos)