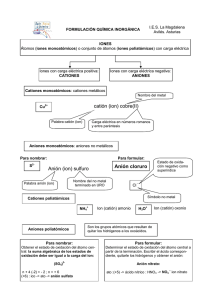
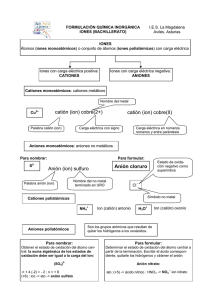
UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA NOMENCLATURA DE DE COMPUESTOS MOLECULARES BINARIOS Los procedimientos que se siguen para dar nombre a los compuestos moleculares binarios (formados por dos elementos) son similares a los que se emplean para nombrar los compuestos iónicos: 1. Por lo general se escribe primero el nombre del elemento que esta más a la derecha en la tabla periódica. Una excepción a esa regla es el caso de los compuestos que contienen oxigeno. El O2 se escribe siempre al último excepto cuando se combina con el flúor. 2. Si ambos elementos están en el mismo grupo de la tabla periódica, se nombran primero el que está más arriba. 3. Se añade la terminación –uro (-ido en el caso del oxigeno) al primer elemento y se inserta la palabra “de” entre los nombres de los dos elementos. 4. Se usan los prefijos griegos para indicar el número de átomos de cada elemento. Nunca se usa el prefijo monocon el segundo elemento. Si el prefijo termina a u o y el nombre del anión comienza con vocal (como en oxido), por lo general se omite la a u o. Los ejemplos siguientes ilustran estas reglas: Cl2O N2O NF3 P4S10 monóxido de dicloro tetróxido de nitrógeno trifluoruro de nitrógeno decasulfuro de tetrafósfo NO METAL 1 + NO METAL L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA PREFIJOS DE MOLECULARES Mono Di Tri Tetra Penta Hexa Hepta Octa Nona Deca Hentriaconta Dotriaconta TrItriaconta Tetratriaconta Pentatriaconta Hexatriaconta Heptatriaconta Octatriaconta Nonatriaconta Tetraconta Henhexaconta Dohexaconta Trihexaconta Tetrahexaconta Pentahexacontra Hexahexaconta Heptahexaconta Octahexaconta Nonahexaconta Heptaconta Hennonaconta Dononaconta Trinonaconta Tetranonaconta Pentanonaconta Hexanonaconta Heptanonaconta Octanonaconta Nonanonaconta 1 2 3 4 5 6 7 8 9 10 31 32 33 34 35 36 37 38 39 40 61 62 63 64 65 66 67 68 69 70 91 92 93 94 95 96 97 98 99 Hecta 100 2 Undeca 11 Henicosa 21 Dodeca 12 Docosa 22 Trideca 13 Tricosa 23 Tetradeca 14 Tetracosa 24 Pentadeca 15 Pentacosa 25 Hexadeca 16 Hexacosa 26 Heptadeca 17 Heptacosa 27 Octadeca 18 Octacosa 28 Nonadeca 19 Nonacosa 29 Icosa 20 Triaconta 30 Hentetraconta 41 Henpentaconta 51 Dotetraconta 42 Dopentaconta 52 Tritetraconta 43 Tripentaconta 53 Tetratetraconta 44 Tetrapentaconta 54 Pentatetraconta 45 Pentapentaconta 55 Hexatetraconta 46 Hexapentaconta 56 Heptatetraconta 47 Heptapentaconta 57 Octatetraconta 48 Octapentaconta 58 Nonatetraconta 49 Nonapentacona 59 Pentaconta 50 Hexaconta 60 Henheptaconta 71 Henoctaconta 81 Doheptaconta 72 Dooctaconta 82 Triheptaconta 73 Trioctaconta 83 Tetraheptaconta 74 Tetraoctaconta 84 Pentaheptaconta 75 Pentaoctaconta 84 Hexaheptaconta 76 Hexaoctaconta 86 Heptaheptaconta 77 Heptaoctaconta 87 Octaheptaconta 78 Octaoctaconta 88 Nonaheptaconta 79 Nonaoctaconta 89 Octaconta 80 Nonaconta 90 1- Se escribe primero el nombre del elemento que se encuentra mas hacia la Izquierda en la tabla periódica. 2- Si en la tabla periódica ambos elementos se encuentran en el mismo grupo primero se escribe el que tiene mayor número atómico. 3- Al nombre del segundo elemento se le asigna la terminación -uro. Se utiliza la preposición "de" entre los dos elemento. Si es oxigeno lleva la terminación -ido en lugar de -uro. 4- Los prefijos griegos se utilizan para indicar el número de atomos de cada L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA elemento excepto el primer elemento. EJEMPLO: Cl2O monoxido de dicloro NOMENCLATURA DE DE COMPUESTOS IÓNICOS Los compuestos iónicos normalmente consisten en combinaciones químicas de metales y no metales. Los metales forman iones positivos, y los no metales, los negativos. IONES POSITIVOS (CATIONES) 1. Los cationes que se forman a partir de átomos metálicos tienen el mismo nombre que el metal (iones monoatómicos). Ejemplo: Na+ ion sodio 2. Si un metal se puede formar cationes con diferente carga, la carga positiva se indica con un número romano entre paréntesis después del nombre del metal. Ejemplo: (III) Fe2+ ion hierro (II) y Fe3+ ion hierro 3. Los cationes formados a partir de átomos no metálicos tienen nombres que terminan en –io. Ejemplo: NH4+ ion amonio IONES NEGATIVOS (ANIONES) 1. Los aniones monoatómicos (de un átomo) tienen nombres que se forman eliminando la terminación del nombre del 3 L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA elemento y agregando la terminación: -uro; en caso del oxigeno es –ido N3- Ejemplo: ion nitruro CN- y ion cianuro 2. Los aniones poliatómicos (de muchos átomos) que contienen oxigeno tienen nombres que terminan en –ato o –ito. Estos aniones se llaman oxianiones. La terminación – ato se emplea para el oxianion más común de un elemento. La terminación –ito se usa para un oxianion que tiene la misma carga pero un átomo menos. Ejemplo: NO3- ion nitrato y NO2- ion nitrito 3. Se emplea prefijos cuando la serie de oxianiones de un elemento se extiende a cuatro miembros como es el caso de los halógenos. El prefijo per- para el de mayor número de oxígenos con la terminación –ato y el prefijo hipo- para el de menor número de oxígenos con la terminación –ito. Ejemplo: ClO4- ion perclorato ClO3- ion clorato ClO2- ion clorito ClO- ion hipoclorito 4. Los aniones que se obtienen agregando H+ a un oxianion se designa agregando como prefijo la palabra hidrogeno o dihidrogeno, según resulte apropiado: Ejemplo: CO32- ion carbonato y HCO3- ion hidrogeno carbonato PO43- ion fosfato y H2PO4- ion dihidrogeno fosfato COMPUESTOS IONICOS 4 L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA Los nombres de los compuestos iónicos se dan de la siguiente fórmula: ANIÓN + de + CATIÓN EJEMPLO: Al(NO3)3 nitrato de aluminio Cu(ClO4)2 perclorato de cobre (II) CATIONES Sodio Litio Cesio Rubidio Cadmio Hidrogeno Plata Calcio Magnesio Bario Berilio Estroncio Helio Cinc Aluminio Galio Arsenico(III) Arsenico(v) Antimonio(III) Antimonio(V) Carbono(II) Carbono(IV) Silicio Cromo(II) Cromo(III) Cromo(VI) Estaño(II) Estaño(IV) Platino(II) Platino(IV) 5 + Na Li+ Cs+ Rb+ Cd2+ H+ Ag+ Ca2+ Mg2+ Ba2+ Be2+ Sr2+ He2+ Zn2+ Al3+ Ga3+ As3+ As5+ Sb3+ Sb5+ C2+ C4+ Si4+ Cr2+ Cr3+ Cr6+ Sn2+ Sn4+ Pt2+ Pt4+ Cobalto(II) Cobalto(III) Cobre(I) Cobre(II) Hierro(II) Hierro(III) Plomo(II) Plomo(IV) Paladio(II) Paladio(IV) Niquel(II) Niquel(III) Mercurio(I) Mercurio(II) Manganeso(II) Manganeso(III) Manganeso(IV) Manganeso(VII) Platino(II) Platino(IV) Oro(I) Oro(III) Bismuto(III) Bismuto(V) Nitrogeno(III) Nitrogeno(V) Fosforo(III) Fosforo(V) Azufre(IV) Azufre(VI) Co2+ Co3+ Cu+ Cu2+ Fe2+ Fe3+ Pb2+ Pb4+ Pd2+ Pd4+ Ni2+ Ni3+ Hg22+ Hg2+ Mn2+ Mn3+ Mn4+ Mn7+ Pt2+ Pt4+ Au+ Au3+ Bi3+ Bi5+ N3+ N5+ P3+ P5+ S4+ S6+ Cloro(I) Cloro(III) Cloro(V) Cloro(VII) Bromo(I) Bromo(V) Yodo(I) Yodo(III) Yodo(V) Yodo(VII) Amonio Hidronio Nitrosilo Nitronio Seleninilo Selenonilo Metanio Carbonilo Selenocarbonilo Clorosilo Clorilo Perclorilo Sulfonio Fosfonio Estibonio Arsonio Tiofosforilo Tionitrosilo Sulfonilo(sulfurilo) Sulfinilo(tionilo) L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ Cl+ Cl3+ Cl5+ Cl7+ Br+ Br5+ I+ I3+ I5+ I7+ NH4+ H3O+ NO+ NO2+ SeO2+ SeO22+ CH5+ CO2+ CSe2+ ClO+ ClO2+ ClO3+ H3S+ PH4+ SbH4+ AsH4+ PS3+ NS+ SO22+ SO2+ UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA Selenio(IV) Selenio(VI) Cromilo Vanadilo(V) Vanadilo(VI) Se4+ Se6+ CrO22+ VO21+ VO22+ PO3+ CS2+ PbO22+ UO22+ PbO32+ Pirosulfurilo Neptunilo (V) Neptunilo(VI) Plutonilo(V) Plutonilo(VI) ReO4ReO42ReO32SiF62SiO32SiO44Si3O72Al2SiO62CrO42HCrO4Cr2O72MnO4MnO42MnO32Mn2O72C4C22HCO2HCOO1C2O42HC2O4CO32HCO32C2H3O2CH3COOC4H4O62C6H5COO1C6H5O73CNOCNSCNCN22Fe(CN)64Fe(CN)63As3- Boruro Metaborato Borato Piroborato Tetraborato Nitruro Azida Nitrito Nitrato Peroxonitrito Peroxonitrato Amuro Amiduro Antimoniuro Meta antimonito Antimonito(orto) Piroantimonito Meta antimoniato Antimoniato(orto) Piroantimoniato Fosfuro Metafosfito Fosfito(orto) Pirofosfito Hipofosfito Metafosfato Fosfato(orto) Pirofosfato Hipofosfato Fosfonato Fosfinato Dihidrogenofosfato Hidrogenofosfato Peroxodifosfato Peroxometafosfato Fosforilo Tiocarbonilo Plumbito Uranilo Plumbato S2O52+ NpO21+ NpO22+ PuO21+ PuO22+ ANIONES Hidruro Hidróxido Fluoruro Hidrogenodifluoruro Cloruro Hipoclorito Clorito Clorato Perclorato Bromuro Hipobromito Bromito Bromato Perbromato Yoduro Hipoyodito Yodito Yodato Peryodato Sulfuro Disulfuro Hidrogenosulfuro Sulfito Sulfato Hidrogenosulfito Hidrogenosulfato Disulfito Disulfato Peroxomonosulfato Peroxodisulfato Tiosulfito Tiosulfato Ditionato Tritionato Tetrationato 6 - H OHFHF2ClClOClO2ClO3ClO4BrBrOBrO2BrO3BrO4IIOIO2IO3IO4S2S22HSSO32SO42HSO3HSO4S2O52S2O72SO52S2O82S2O22S2O32S2O62S3O62S4O62- Perrenato Renato Renito Hexafluorosilicato Metasilcato Silicato(orto) Trisilicato Aluminosilicato Cromato Hidrogenocromato Dicromato Permanganato Manganato Manganito Dimanganato Carburo Acetiluro Formiato Formiato Oxalato Bioxalato Carbonato Hidrogenocarbonato Acetato Acetato Tartrato Benzoato Citrato Cianuro Cianato Tiocianato Cianamide Ferrocianuro Ferricianuro Arseniuro L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ B3BO2BO33B2O54B4O72N3N3NO2NO3NOO2NO4NH2NH22Sb3SbO2SbO33Sb2O54SbO3SbO43Sb2O74P3PO2PO33P2O54H2PO2PO3PO43P2O74P2O64PHO32PH2O2H2PO4HPO42P2O84PO53- UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA Ditionilo Seleniuro Hidrogenoseleniuro Selenito Seleniato Siliciuro Astato Bismutato Vanadato Rutenato Hexacloroplatinato 7 S2O42Se2HSeSeO32SeO42Si4AtO31BiO31VO31RuO41PtCl62- Meta arsenito Arsenito(orto) Piroarsenito Meta arseniato Arseniato(orto) Piroarseniato Òxido Peròxido Hiperòxido Ozonido Estanito AsO2AsO33As2O54AsO3AsO43As2O72O2O22O2O3HSnO21- Tripolifosfato Tetrapolifosfato Pentapolifosfato Teleriuro Telurito Teluriato Molibdato Wolframato Tungstato Molibdato Heptamolibdato L.Q.I. ENRIQUE GONZÁLEZ RODRÍGUEZ P3O101P4O131P5O161Te2TeO32TeO42MoO4 WO42WO42MoO42Mo7O241- UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADEMICA MULTIDISCIPLINARIA REYNOSA–AZTLAN DEPARTAMENTO DE QUIMICA INORGANICA NOMENCLATURA DE LOS ACIDOS Los ácidos con clase importante de compuestos que contienen hidrogeno y el nombre se derivan del nombre del anión con el siguiente método: 1. Ácidos basados en aniones cuyo nombre termina en –uro. Los aniones cuyo nombre termina en uro están asociados a ácidos cuyo nombre termina con –hídrico. EJEMPLO: Cl- ion cloruro S2- ion sulfuro HCl ácido clorhídrico H2S ácido sulfúrico 2. Ácidos basados en aniones cuyo nombre termina en –ato o –ito. Los aniones cuyos nombres terminan en –ato están asociados a ácidos cuyo nombre termina en –ico, en tanto que los aniones cuyo nombre termina en ito están asociados a ácidos cuyo nombre termina en –oso. Los prefijos del nombre del anión se conservan en el nombre del acido. EJEMPLO: ClO4ácido perclórico ClO3ácido clórico ClO2 ácido cloroso ClOácido hipocloroso