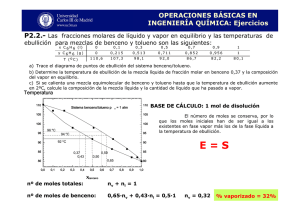
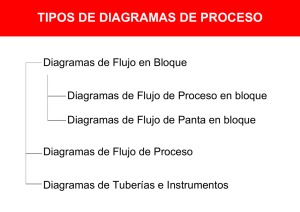
revisión bibliográfica
Anuncio

1. RESUMEN La contaminación ambiental es un cambio indeseable en las características físicas, químicas y biológicas del aire, del agua y del suelo, que puede afectar negativamente al hombre y a las especies animales y vegetales. Existe la contaminación del aire cuando los elementos que lo conforman sufren alteraciones o cuando se presentan sustancias extrañas en el mismo. Estas sustancias extrañas son gases y sólidos que se encuentran suspendidos en la atmósfera. La contaminación atmosférica es un síntoma de nuestra época. Su origen se remonta a los tiempos en que el hombre logró dominar el fuego; se acentuó con la Revolución industrial en el siglo pasado y, en la actualidad, se ha intensificado con las pruebas nucleares. Atrapada entre las montañas del Eje Volcánico Central, la ciudad de México ha sido, y es todavía, el centro cultural, político, económico y social de la nación mexicana. Es también la sede del mayor complejo urbano del mundo, uno de los ejemplos más notorios del fenómeno de concentración urbana en los países del Tercer Mundo. La situación ambiental de la ciudad de México se ha deteriorado muy rápidamente durante los últimos 40 años. Con toda seguridad, el problema más grave asociado al crecimiento de la ciudad son los altísimos niveles de contaminación atmosférica que se registran en la ciudad de México, y que desde fines de los años setenta vienen siendo un motivo de preocupación creciente para la población de la ciudad. La mayor parte de la contaminación atmosférica es generada por los escapes de los automóviles. La SEDUE ha estimado que la contaminación vehicular es responsable del 85 % de todos los contaminantes atmosféricos sobre la ciudad. Los vehículos producen la mayor parte del monóxido de carbono y de los residuos de hidrocarburos presentes en la atmósfera de la ciudad. Los hidrocarburos son producto de la combustión incompleta en estufas, hornos y quemadores; sin embargo, su fuente principal son los motores de automóviles. La causa es que cada vez que se aumenta o disminuye la velocidad de un automóvil, se reduce la eficiencia de la máquina, provocando una combustión incompleta. Este problema se acentúa en ciudades muy transitadas. El humo producido por los automóviles contiene cerca de 200 distintos hidrocarburos. La combustión de una tonelada de carbón produce casi 10 kg de hidrocarburos, algunos de los cuales son cancerígenos, entre éstos está el tolueno y el benceno. El benceno es un hidrocarburo aromático líquido, subproducto de la destilación del petróleo. Su punto de ebullición es de 80°C, presión de vapor 26°C: 100 mm Hg., se encuentra mezclado con los hidrocarburos de la gasolina o bencina. Además de los vehículos de motor, también son fuentes de emisiones de esta sustancia las coquerías, calderas, incineradores, refinerías, industria química, los depósitos de combustible y las estaciones de servicio (gasolineras). Para el hombre, las fuentes de exposición al benceno son su uso como disolvente de pinturas, colas, barnices y tintas de imprenta; como aditivo de la gasolina y en la síntesis químicas de compuestos orgánicos. El tolueno es muy utilizado como solvente en pinturas, barnices, pegamentos, esmaltes y lacas y como intermediario químico en la síntesis de compuestos orgánicos. A diferencia del benceno, este compuesto no produce anemia aplásica ni leucemia. Los hidrocarburos, como el tolueno y benceno, tienen efectos tóxicos mucho mayores cuando son aspirados al árbol traque-bronquial y producen irritación pulmonar. Debido a su baja tensión superficial y baja viscosidad, pequeñas cantidades de estos compuesto se extienden sobre grandes superficies, como la del pulmón, pudiendo, mediante la circulación sanguínea llegar a varios órganos y causarles daño. Por lo antes mencionado, el tolueno y benceno son contaminantes ambientales y ocupacionales, a los que están expuestos los humanos en gran medida y que pueden, incluso, causarles la muerte. La mayoría de los antecedentes toxicológicos en humanos mencionan la sintomatología clínica en las personas expuestas a ambos tóxicos y muy pocos son apoyados por estudios experimentales, por lo que nos propusimos, mediante estudios morfológicos, demostrar la citotoxicidad del tolueno y benceno en diversos órganos. Los resultados obtenidos pueden explicar los síntomas presentados por las personas expuestas a dichos tóxicos que pudieran coadyuvar a la realización de diagnósticos precisos y sobre todo a la prevención de intoxicaciones graves con fatales desenlaces. Metodología. Se realizaron dos experimentos uno para demostrar la citotoxicidad del tolueno y el otro la del benceno. En cada uno se trabajó con 48 ratas Wistar hembras de ± 250 g de peso, se formaron 8 lotes de animales de experimentación, 2 lotes testigo y 6 a los que se les administró por vía intragástrica dosis únicas de 1, 2 ó 3 g de tolueno o benceno/kg de peso corporal, y se mantuvieron con alimento y agua “ad libitum”. Los animales se sacrificaron 48 ó 72 h después de la intoxicación y mediante la técnica de disección anatómica se obtuvieron órganos de los siguientes sistemas corporales: Sistema Nervioso Central, Sistema Cardiovascular, Sistema Respiratorio, Sistema Linfático, Sistema Digestivo, Sistema Endocrino, Sistema Urinario, Sistema Reproductor Femenino, Sistema Reproductor Masculino. Se realizó el tratamiento histológico de los órganos (fijación, lavado, deshidratación, transparentación, inclusión en parafina, obtención de cortes y tinción), hasta la obtención de laminillas histológicas de cada órgano teñidas con las siguientes técnicas de coloración: hematoxilina-eosina, Martius Scarlet Blue (MSB), Papanicolaou, Tricrómica de Masson, Perls y Weil. Se llevó a cabo el análisis microscópico de las mismas, para determinar el efecto del tolueno o benceno en cada uno de los órganos de los animales intoxicados. Se obtuvieron fotografías con un fotomicroscopio Nikkon de los diferentes órganos de cada lote de animales intoxicados, así como de los testigos. Se observó que todos los órganos obtenidos de las ratas testigo no presentaron alteraciones histológicas conservando su morfología normal. El tolueno y benceno tuvieron efectos citotóxicos en la mayoría de los órganos de los diversos sistemas corporales de las ratas intoxicadas. Se concluye que el tolueno y benceno tuvieron efecto citotóxico a nivel orgánico, lo cual traería como consecuencia disfunción orgánica importante, que podría poner en riesgo la vida de los individuos. 2. INTRODUCCIÓN Muchas son las fuerzas que pueden cambiar la estructura y la composición del ambiente. Así, los eventos naturales como huracanes, terremotos, tifones y actividad volcánica, o bien, las acciones desarrolladas por el hombre, pueden introducir en el medio ambiente sustancias y elementos nuevos, que normalmente están distribuidos en forma amplia en la litosfera, la hidrosfera y la atmósfera, pero que, incrementadas sus cantidades o alteradas sus cualidades, pueden llegar a ser indeseables y tóxicos, causando problemas porque la naturaleza no puede asimilarlos. La contaminación ambiental es un cambio indeseable en las características físicas, químicas y biológicas del aire, del agua y del suelo, que puede afectar negativamente al hombre y a las especies animales y vegetales. Existe la contaminación del aire cuando los elementos que lo conforman sufren alteraciones o cuando se presentan sustancias extrañas en el mismo. Estas sustancias extrañas son gases y sólidos que se encuentran suspendidos en la atmósfera. La contaminación atmosférica es un síntoma de nuestra época. Su origen se remonta a los tiempos en que el hombre logró dominar el fuego; se acentuó con la Revolución industrial en el siglo pasado y, en la actualidad, se ha intensificado con las pruebas nucleares. La “modernización” de las formas de vida y la creciente cantidad de satisfactores que implica, ha incrementado aceleradamente la industrialización. Esta última impacta el medio ambiente cambiando y alterando sustancialmente la composición química del aire, de tal forma que, al aumentar las partículas en suspensión, los hidrocarburos, el bióxido de carbono (CO2), los óxidos de nitrógeno (NOx), el monóxido de carbono (CO) y el bióxido de sulfuro (SO2) en la atmósfera, se dificultará la vida. La enorme variedad de contaminantes liberados en el aire actúan sobre el hombre y su entorno en forma dañina no sólo cuando sus concentraciones son altas sino aún cuando son bajas pero permanentes. No es la consecuencia individual, sino la de conjunto de los contaminantes la que estimula severas alteraciones en el aire, actuando y manifestando disfrazadamente sus perjuicios. Éstos se conocerán en el largo plazo, bajo la forma de nuevos padecimientos respiratorios y quizás de efectos teratogénicos, esto es, malformaciones. No obstante, cuando los límites críticos de la contaminación sobrepasan el linde nocivo, se manifiestan enseguida en casos mortales. Así sucedió en 1930 en el Valle del Mosa, Bélgica, en que se produjeron 63 muertes; en Londres, Inglaterra, en 1952, con 4000 muertes y, más recientemente, en 1966, en la ciudad de Nueva York en Estados Unidos, con la defunción de 168 personas (Adame y Salín, 1997; Tyler, 1994; Cantú, 1992) Atrapada entre las montañas del Eje Volcánico Central, la cuenca de México ha sido, y es todavía, el centro cultural, político, económico y social de la nación mexicana. Es también la sede del mayor complejo urbano del mundo, uno de los ejemplos más notorios del fenómeno de concentración urbana en los países del Tercer Mundo. La situación ambiental de la cuenca de México se ha deteriorado muy rápidamente durante los últimos 40 años. Como en muchas otras partes de América Latina, la industrialización de México en el siglo XX trajo como resultado un proceso de migración acelerada de campesinos hacia las grandes ciudades. En su rápido crecimiento, la ciudad de México fue devorando los pueblos satélites de la antigua capital, hasta convertirse en la inmensa megalópolis que es actualmente. El conglomerado urbano ocupa la mayor parte del Distrito Federal, y también una fracción importante del vecino Estado de México. Las cadenas montañosas al sur y al oeste de la cuenca, hasta hace unos quince años poco afectadas por el crecimiento de la ciudad, sufren ya las consecuencias del desarrollo urbano explosivo. La cuenca de México, que ocupa sólo el 0.03 % de la superficie del país, es el hábitat de 22 % de su población y constituye un problema ambiental, social y político de inmensas proporciones (Ezcurra, 1995; Ludevid, 1998). Con toda seguridad, el problema más grave asociado al crecimiento de la ciudad son los altísimos niveles de contaminación atmosférica que se registran en la ciudad de México, y que desde fines de los años setenta vienen siendo un motivo de preocupación creciente para la población de la ciudad (SAHOP, 1978; SMA, 1978). Este problema es particularmente grave durante la temporada fría (diciembre a febrero) cuando las bajas temperaturas estabilizan la atmósfera sobre la ciudad y la falta de convección térmica permite la acumulación de contaminantes en la masa de aire estacionario que cubre la ciudad (SEDUE, 1986; Velasco Levy, 1983). Las partículas contaminantes del aire de la ciudad de México han demostrado desde hace ya varios años que la mayor parte de la contaminación atmosférica es generada por los escapes de los automóviles (Barfoot y col.,1984; Sigler y col. 1982). La SEDUE (1986) ha estimado que la contaminación vehicular es responsable del 85 % de todos los contaminantes atmosféricos sobre la ciudad. Aunque la calidad del aire durante la temporada lluviosa ha permanecido más o menos constante durante los últimos diez años, el total de partículas suspendidas durante la época seca está incrementándose a una tasa de aproximadamente 6 % anual (calculada de Fuentes-Gea y Hernández, 1984). Es interesante destacar que el número de automóviles en la ciudad está creciendo a la misma tasa (había 2 0000 000 de automóviles en 1980, y más de 3 500 000 a finales de 1986). El deterioro de la calidad del aire inducido por el crecimiento del número de automóviles es mucho más rápido que el crecimiento poblacional y la expansión urbana. Es predecible que, si la tendencia continúa, la contaminación atmosférica sea el primer factor en generar una crisis ambiental de grandes magnitudes en la ciudad de México. Según Bravo (1986, 1987), los vehículos producen la mayor parte del monóxido de carbono y de los residuos de hidrocarburos presentes en la atmósfera de la ciudad. Los HIDROCARBUROS son producto de la combustión incompleta en estufas, hornos y quemadores; sin embargo, su fuente principal son los motores de automóviles. La causa es que cada vez que se aumenta o disminuye la velocidad de un automóvil, se reduce la eficiencia de la máquina provocando una combustión incompleta. Este problema se acentúa en ciudades muy transitadas. El humo producido por los automóviles contiene cerca de 200 distintos hidrocarburos. La combustión de una tonelada de carbón produce casi 10 kg de hidrocarburos, algunos de los cuales son cancerígenos, entre éstos está el benceno, tolueno y xileno (Adame y Salín, 1997; Hansen, 2000; Petralia y col., 1999; Wong y col., 1999). BENCENO: es un hidrocarburo aromático líquido, subproducto de la destilación del petróleo. Su punto de ebullición es de 80°C, presión de vapor 26°C: 100 mm Hg., se encuentra mezclado con los hidrocarburos de la gasolina o bencina. La presencia de benceno en la gasolina incrementa su toxicidad. Sinónimos y nombres comerciales: Bencina, benzol, benzol de petróleo, ligroína, gasolina, bicarbonato de hidrógeno, aceite de hulla, ciclohexatrieno. Es un líquido incoloro, altamente volátil, de olor aromático. En la industria química, el benceno puro es la base más importante para los productos aromáticos intermedios, así como para los compuestos del grupo de los ciclos alifáticos. En base al benceno se elaboran material plástico, caucho sintético, colorantes, pinturas, barnices, resinas, materias primas para detergentes y plaguicidas. El benceno se presenta en la naturaleza en cantidades exiguas y en bajas concentraciones. Es parte constitutiva del petróleo crudo (máximo 0.4 g/l). El benceno se fabrica y procesa a nivel industrial como benceno puro. Normalmente se obtiene a partir del petróleo crudo. La nafta o gasolina común contiene entre 12 y 16 g/l de benceno y la nafta o gasolina especial (Super), hasta 24 g/l de benceno. Además de los vehículos de motor, también son fuentes de emisiones de esta sustancia las coquerías, calderas, incineradores, refinerías, industria química, los depósitos de combustible y las estaciones de servicio (gasolineras). Para el hombre, las fuentes de exposición al benceno son su uso como disolvente de pinturas, colas, barnices y tintas de imprenta; como aditivo de la gasolina y en la síntesis químicas de compuestos orgánicos. Las vías de ingreso más importantes son la respiratoria y la cutánea. La exposición por vía digestiva se considera como accidental, pero significativa por la elevada absorción intestinal del benceno (Albert, 1997; Dreisbach y Robertson, 1988). Se postula que el primer producto de la oxidación metabólica del benceno es un compuesto muy inestable, el óxido de benceno es un compuesto muy inestable, el óxido de benceno (Jerina y Daley, 1994). Este óxido, formado por la introducción de oxígeno en la molécula mediante el sistema del citocromo P450, se reordena para formar fenol. El éster sulfato de fenol es el principal metabolito urinario y el nivel de exposición de los trabajadores al benceno puede estimarse mediante la determinación del aumento del sulfato inorgánico excretado por la orina. Las hidroxilaciones posteriores del fenol producen la formación de hidroquinona y de 1, 2, 4- bencenotriol. Cuando se oxidan, estos polifenoles forman compuestos intermedios con uniones covalentes, potencialmente tóxicos, que pueden ser responsables de la toxicidad del benceno sobre la médula ósea (Goodman y col., 1994; Di Palma, 1987; Powley y Carlons, 1999; Lovern y col., 1999). TOLUENO: (C6H5CH3) es muy utilizado como solvente en pinturas, barnices, pegamentos, esmaltes y lacas y como intermediario químico en la síntesis de compuestos orgánicos. El tolueno es un depresor del SNC y en concentraciones bajas produce fatiga, debilidad y confusión. Es a causa de los efectos de solventes como el tolueno sobre el SNC que los “aspiradores de pegamentos” inhalan sus vapores. A diferencia del benceno, el tolueno no produce anemia aplásica, ni leucemia. No obstante, a menudo hay una mezcla de solventes en los pegamentos y el “aspirador de pegamento” suele estar expuesto a otros compuestos, además el tolueno (Goodman y Gilman, 1994). El principal metabolito del tolueno es el ácido hipúrico (Inove y col., 1998). ANTECEDENTES TOXICOLÓGICOS DEL BENCENO Y TOLUENO EN HUMANOS La toxicidad del benceno en el hombre es alrededor de 0.2 g/kg y del tolueno es de 0.5-1 g/kg. Todos los productos destilados del petróleo contienen hidrocarburos alifáticos de cadenas rectas o ramificadas y son utilizados como combustibles y solventes (como el benceno y el tolueno). Tienen efectos tóxicos mucho mayores cuando son aspirados al árbol traqueo bronquial que cuando simplemente se han ingerido. La aspiración directa de estas sustancias a los pulmones es causa principal de irritación pulmonar. Debido a que los hidrocarburos del petróleo tienen baja tensión superficial y baja viscosidad, pequeñas cantidades se extenderán sobre grandes superficies, tales como el pulmón. DATOS CLÍNICOS: La principal manifestación del envenenamiento agudo es el coma. La anemia ocurre después de la exposición crónica al benceno o tolueno. A. Envenenamiento agudo: 1. Por inhalación o ingestión: Los síntomas producidos por la exposición leve al benceno o tolueno son vértigo, debilidad, euforia, cefalea, náusea, vómito, opresión torácica e inestabilidad en la marcha. Si la exposición es más intensa, los síntomas progresan hacia visión borrosa, temblores, respiración rápida y superficial, irregularidad en el latido ventricular, incluyendo fibrilación, parálisis, inconsciencia y convulsiones. La excitación violenta o el delirio pueden preceder a la inconsciencia. Puede ocurrir daño hepatorrenal. (Krasniuk y col, 2000) 2. Por contacto cutáneo. El contacto cutáneo causa irritación, descamación y formación de grietas en la piel. (Petrov y col., 1999) B.- Envenenamiento crónico (por inhalación): Los síntomas incluyen cefalea, pérdida del apetito, somnolencia, nerviosismo y palidez. Después de la exposición al benceno o tolueno aparecen anemia, petequias y hemorragias anormales. La anemia puede progresar hasta la aplásica completa de la médula ósea, especialmente después de envenenamiento por benceno. La inhalación continua y repetida hasta el punto de causar euforia, ha producido encefalopatía irreversible con ataxia, temblor, labilidad emocional y atrofia cerebral difusa. La frecuencia de leucemia en trabajadores expuestos prolongadamente al benceno es 5 a 10 veces mayor que en la población no expuesta. (Krasniuk y col, 2000; Dreisbach y Robertson, 1988; Baak y col., 1999; Khuder y col., 1999) Trabajadores ocupacionalmente expuestos a etilbenceno y benceno presentaron alteraciones sen semen (viscosidad, licuefacción, número de espermatozoides, motilidad y morfología). (De Celis R. y col., 2000). Daño hematológico. La acción depresora del benceno y tolueno sobre la médula ósea se puede manifestar en las tres series de elementos sanguíneos (eritrocitos, leucocitos y plaquetas). Sin embargo, también puede haber una acción excitadora o cancerígena sobre las células hematológicas maduras o inmaduras para producir leucemia. (Albert, col., 1977); (Finkelstein, 2000; Kalnas y Teitelbaum, 2000). Las células más sensibles al beceno son las de médula ósea en los estadíos iniciales de su desarrollo (Snyder y col, 1977) y la detención de su maduración lleva al agotamiento gradual de las células circulantes. Un motivo importante de preocupación es la relación entre la exposición prolongada al benceno y la leucemia (Aksoy, 1985; Finkelstein, 2000,). Se han conducido estudios epidemiológicos con trabajadores de la industria de neumáticos y de fábricas de calzado, donde se usa benceno en forma extensiva. Entre los trabajadores que murieron por exposición al benceno, la muerte fue causada por leucemia o por anemia aplásica en proporciones casi iguales. (Kalnas y Teitelbaum, o por mieloma múltiple. (Teitelbaum y Bratbar, 2000; Goldstein y Salta, 2000; Zinder, 2000). Holz y col., 1995, determinaron los efectos genotóxicos del tolueno y benceno en trabajadores de diferentes áreas de una planta de producción de benceno y tolueno en la República Democrática Alemana. ANTECEDENTES TOXICOLÓGICOS DEL BENCENO Y TOLUENO EN RATAS En animales experimentales, las toxicidades del benceno y tolueno son similares sin importar la vía de administración, ya que ambos son metabolizados en hígado y son sus metabolitos los que producen dicha toxicidad y la concentración mortal varía de 2-5g/kg; el benceno es el más tóxico. Korsak y col. (2000) intoxicaron ratas por inhalación de vapores, en concentraciones de 123, 492 ó 1230 mg/m3, durante 3 meses, encontrando disminución de glóbulos rojos, aumento de glóbulos blancos y lesiones pulmonares. Lovern y col (1999) demostraron que el benceno produce hemato y mielotoxicidad en roedores. Estudios realizados en ratas en el Nacional Toxicology Program (1986), demostraron que el benceno produjo depleción linfoide, y en 1990 reportaron la toxicidad del tolueno en cerebro, vejiga urinaria, hígado, riñón, corazón y vías respiratorias, así como su efecto carcinogénico (Collins, 2002, Bonnet y col., 1994; Mc Michael, 1998; Glowa y col., 1986; Bruckner, 1991. Forster, 1994; Low y col., 1988, mencionan que el tolueno es neurotóxico, teratogénico, carcinogénico y produce desórdenes psiquiátricos. Saito, en 1993; Flanagan y col., 1990, indicaron que el tolueno produce los síntomas clínicos, como hiperactividad, ataxia, adicción, insomnio, disturbios en la memoria, euforia, alucinaciones, tinitus, ataxia, confusión, náusea, vómito y arritmias cardiacas. Por lo antes mencionado, el benceno y el tolueno son contaminantes ambientales y ocupacionales, a los que están expuestos los humanos en gran medida y que pueden causarles la muerte. La mayoría de los antecedentes toxicológicos en humanos mencionan la sintomatología clínica y muy pocos son apoyados por estudios experimentales, por lo que nos proponemos, mediante estudios morfológicos, explicar los síntomas presentados por las personas expuestas o dichos tóxicos que pudieran coadyuvar a la realización de diagnósticos precisos y sobre todo a la prevención de intoxicaciones graves con fatales desenlaces. Asimismo, acudiremos a presentar nuestros resultados a las Instituciones gubernamentales y privadas encargadas del control de la contaminación ambiental de la ciudad de México, con el fin de contribuir al mejoramiento de la calidad del ambiente, para que, se instituyan índices máximos permitidos de benceno y tolueno en la atmósfera. 3. MÉTODOS Y MATERIALES REVISIÓN BIBLIOGRÁFICA Se asistió a las Bibliotecas del Centro Médico Siglo XXI, CINVESTAV, Centro Médico "La Raza", FES Iztacala, Facultad de Medicina de la UNAM, UAM Iztapalapa y ENCB. Consulta vía INTERNET, para recopilar la bibliografía necesaria para la realización de este proyecto de investigación (se anexan las referencias bibliográficas consultadas). ADAME R.A. y SALIN P.D.A. 1997. Contaminación Ambiental. 1ª. Ed. Editorial Trillas. México. pp 11, 18, 24, 28, 29 AKSOY M. 1985. Benzene as a leukemogenic and carcinogenic agent. Am. J. Ind. Med. 8: 9-20 ALBERT L. A. 1997. Toxicología Ambiental. 2a. Ed. Editorial UTEHA. México. pp 7-10, 12-14, 23, 247-249, 251-253, 258, 260-261 BAAK Y. M., AHN B. Y., CHANG H. S., KIM J. H., KIM K. A. and LIM. Y. 1999. Aplastic anemia in a pretrochemical factory worker. Environ Health Perspect. 107 (10): 851-853 BAAK Y. M., AHN B. Y., CHANG H. S., KIM J. H., KIM K. A. Y LIM Y. 1999. Aplastic anemia in a pretrochemical factory worker. Environmental Health Perspectives, 107 (10): 851-853. BANCROFT J. D. and STEVENS A. 1982. Theory and practice of histologie and histochemical. 2ª. Ed. Editorial Churchill Livingstone, England. pp 136, 137, 155-168, 351353 BARFOOT K. M., VARGAS A.C., Mc ARTHUR J. D., JAIDAR A., GARCÍA S.F. y FUENTES G.V. 1984. Multi-elemental measurements of air particulate pollution at a site in México City. Atmospheric Environment. 18: 451-467 BILBAN M. 2004. Mutagenic testing of workers exposde to toluene-diisocyanates during plastics production process. Am J Ind Med., 45(5) 468-479. BONNET P., NUNGE H., ZAHM J. M., GANAIRE F. 1994. Ex vivo technique for evaluating the effect of chemical vapours on mucociliary activity. J Appl toxicol., 14(5): 369-374. BRAVO H. 1986. La atmósfera de la Zona Metropolitana de la Ciudad de México. Desarrollo y Medio Ambiente. Fund. Mex. Rest. Ambiental. 2: 2-3 BRAVO H. 1987. La contaminación del aire de México. Fundación Universo Veintiuno. México, D. F. pp 287 BURCH, H.C. 1969. Técnica Histológica. 1ª ed. Paz Montalvo, Madrid, p. 17-20, 30-57, 61-86, 92-103. CANTÚ M. P. C. 1992. Contaminación Ambiental. 1ª. Ed. Editorial Diana. México. pp 21, 22, 45, 48, 71, 72 COLLINS M. A. 2002. Toxicology of toluene diisocyanate. Appl Ocuup Environ Hyg., 17(12): 846-855. CONTRAN M. D., KUMAR V. Y ROBBINS S. L. 1995, Patología estructural y funcional. 5ª. ed. Interamericana – Mc Graw-Hill, Nueva York, p. 576-580. CONTRERAS R. R. 1989. Anatomía patológica general. 2ª. ed. Interamericana, México, p. 81-91. CURRAN R. C. 1990. Hystopathology. 3ª. ed. Harvey Millar Publishers, New York, p. 146-150 DE CELIS R., FERIA-VELASCO A., GONZÁLEZ-UNZAGA M., TORRES-CALLEJA J. and PEDRON N. N. 2000. Semen quality of workers occupationally exposed to hidrocarbons. Fertil Steril. 73(2): 221-228 DIPALMA J. R. 1987. Farmacología Médica. 4ª. Ed. Editorial Fournier. México. pp 15991600 DREISBACH R. H. y ROBERTSON W.O. 1988. Toxicología Clínica. 6a. Ed. Editorial Manual Moderno. México. pp 175, 177-180 ESCURRA E. 1995. El Medio Ambiente en la Cuenca de México. 1ª. Ed. Editorial La Ciencia. México. pp 9, 10, 79, 80, 81 FINKELSTEIN M. M. 2000. Leukemia after exposure to benzene: temporal trends and implications for standars. Am. J. Ind. Med. 38(1): 1-7 FOSTER L. M., TANNHAUSER M., TANNHAUSER S. L. 1994. Toxicology of toluene: aspects related to its abuse. Rev Saude Publica., 28(2): 167-172. FUENTES G. V. y HERNÁNDEZ A. A. C. 1984. Evaluación preliminar de la contaminación del aire por partículas en el Área Metropolitana del Valle de México. Memorias del IV Congreso Nacional de Ingeniería Sanitaria y Ambiental, Sociedad Mexicana de Ingeniería Sanitaria y Ambiental, México. pp 523-526 GOLDSTEIN B. D. and SHALAT S. L. 2000. The casual relation between benzene exposure and multiple myeloma. Blood. 95(4): 1512-1514 GOODMAN G. A., RALL T. W., NIES A. S., TAYLOR P. 1994. Las Bases Farmacológicas de la Terapéutica: Tóxicos ambientales no metálicos: contaminantes del aire, solventes y vapores y plaguicidas. 8ª. Ed. Editorial Panamericana. Buenos Aires. pp 1559, 1560, 1569 GORDON C. H. 2002. Significance of the renal effects of ethyl benzene in rodents for assessing human carcinogenic risk. Toxicological Sciences, 69: 30-41. GREIM. H. 1997. Human and experimental toxicology. Hum Exp Toxicol., 16(4): 189. HANSEN J. 2000. Elevated risk for male breast cancer after occupational exposure to gasoline and vehicular combustion products. Am. J. Ind. Med. 37(4): 349-352 HARTMAN D. E. 1987. Neuropsychological toxicology: identification and assessment of neurotoxic syndromes. Arch Clin Neuropsychol., 2(1): 45-65. HERRERA M. J., BECERRIL M. M., ARITA T. B. Y CASTAÑEDA H. M. 2005. Manual teórico-práctico de Anatomía humana. Escuela Nacional de Ciencias Biológicas, I.P.N., México, p. 25-32, 279-291. HERRERA M. J., BECERRIL M. M., ARITA T. B., CASTAÑEDA H. M., PÉREZ G. M. A. 1997. Manual Teórico-práctico de Anatomía Humana. Escuela Nacional de Ciencias Biológicas, I.P.N., México. pp 15, 16, 18-20 HOLZ O., SCHERER G., BRODMEIER S., KOOPS F., WARNECKE K., KRAUSE T., AUSTEN A., ANGERER J., TRICKER A. R., ADLKOFER F., ET AL. 1995. Determination of low level exposure to volatile aromatic hydrocarbons and genotoxic effects in workers at a styrene plant. Occup Environ Med., 52(6): 420-428. HUFF J. 2003. Absence of carcinogenic activity in Fischer rats and B6C3F1 mice following 103-week inhalation exposures to toluene. Int J. Occup Environ Health. 9(2): 138-146. JERINA D. M. and DALEY J. R. 1994. A new aspect of drug metabolism. Science. 185: 573-582 JO W. K. Y PACK K .W. 2000. Utilization of breath analysis for exposure estimates of benzene associated with active smoking. Environmental Research, 83(2): 180.187. KALNAS J. and TEITELBAUM D. T. 2000. Dermal absorption of benzene: implications for work practices and regulations. Int. J. Occup. Environ Health. 6(2): 114-121 KHUDER S. A., YOUNGDALE M. C., BISESI M. S. and SCHAUB E. A. 1999. Assesment of complete blood count variations among workers exposed to low levels of benzene. J. Ocup. Environ Med. 41(9): 821-826 KHUDER S. A., YOUNGDALE M. C., BISESI M. S. Y SCHAUB E. A. 1999. Assesment of complete blood count variations among workers exposed to low levels of benzene. Journal of Occupational and Environmental Medicine, 41(9): 821-826. KORSAK Z., STETKIEWICZ J., MAJCHEREK I., JAJTE J., RZDZYNCHIK 2000. Int. J. Occup. Med. Environ. Health. 13(2): 155-164 KRASNIUK E. P., CHERNIUK V. I., ROSSINSKAIA L. N. And CHUI T. S. 2000. The effect of manufacturing factors in asphalt-bitumen plants on the health of the workers. Lik Sprava. 2: 106-112 LOVERN M. R., MARIS M. E. and SCHLOSSER P. M. 1999. Use of a mathematical model of rodent in vitro benzene metabolism to predict human in vitro metabolism data. Carcinogenesis. 20(8): 1511-1520 LUDEVID A. M. 1998. El cambio Global en el Medio Ambiente. 1ª. Ed. Editorial Alfaomega. México. pp 49, 53, 55, 105, 251 LYNCH J. M., STANLEY S. R., MELLOR D. L., SPARE, D. P. Y INWOOD M. J. H. 1979. Métodos de laboratorio. 2a ed. Interamericana, México, p. 98, 99, 109. MCGREGOR D. 1994. The genetic toxicology of toluene. Mutat Res. 317(3): 213-228. MEDINSK Y. M. A., SABOURIN P. J., LUCIER G., BIRNBAUM L. S. Y HENDERSON R. F. 1989. A physiological model for simulation of benzene metabolism by rats and mice. Toxicology and Applied Pharmacology, 99(2): 193-206. NTP Toxicology and Carcinogenesis studies of benzene (CAS No. 100-41-4) in F344/N rats and B6C3F1 Mice. 1999. National Toxicology Program Technical Report Series, 466:1-231. NTP Toxicology and Carcinogenesis Studies of Comercial Grade 2,4 (80%)- and 2,6 (20%)- Toluene Diisocyanate (CAS No. 26471-62-5) in F344/N Rats and B6C3F1 Mice (Gavage Studies). 1986. National Toxicology Program., 251: 1-194. NTP Toxicology and Carcinogenesis Studies of Toluene (CAS No. 108-88-3) in F344/N Rats and B6C3F1 Mice (Inhalation Studies). 1990. National Toxicology Program., 371: 1253. NTP Toxicology and Carcinogenesis Studies of Vinyl Toluene (Mixed Isomers) (65%)-71% meta-isomer and 32-35% para-isomer) (CAS No. 25013-15-4) in F344/N Rats and B6C3F1 Mice (Inhalation Studies). 1990. National Toxicology Program., 375: 1-191. PATEL A. S., TALBOT E. D., ZBOROWSKI J. V., RYCHECK J. A., DELL D. Y SCHWERHA J. 2004. Risk of cancer as a result of community exposure to gasoline vapors. Archives of Environmental Health, 59(10): 497-503. PETRALIA S.A., VENA J. E., FREUDENHEIM J.L., DOSEMECI M., MICHALEK A., GOLDBERG M. S., BRASURE J. and GRAHAMS S. 1999. Risk of premenopausal breat cancer in association with occupational exposure to polycyclic aromatic hydrocarbons and benzene. Scand. J. Work Enrivon Health. 25 (3): 215-221 PETROV E., PERESLEGINA I. A., MINEEV B. A., MAIANSKAIA I. V. 1999. The effect of benzene derivatives on the body sensitization of children. Gig Sanit. 5: 42-44 POWLEY M. W. And CARLONS G. P. 1999. Species comparison of hepatic and pulmonary metabolism of benzene. Toxicology. 139(3): 207-217 PYATT D. 2004. Benzene and hematopoietic malignancies. Clinics in Occupational and Environmental Medicine, 4(3): 529-55. RANA S. V. Y VERMA Y. 2005. Biochemical toxicity of benzene. Journal of Environmental Biology, 26(2): 157-168. ROBINS S. L., CONTRAN, R. S. Y KUMAR V. 1999. Patología humana. 6ª. ed. Mc Graw Hill-Interamericana, México, p. 63,66. SAHOP (Secretaría de Asentimientos Humanos y Obras Públicas). 1978. Diagnóstico de la calidad atmosférica del Valle de México, Dirección General de Ecología Urbana, México. pp 85 SEDUE (Secretaría de Desarrollo Urbano y Ecología). 1986. Informe sobre estado del Medio Ambiente en México. pp 83 SIGLER A., FUENTES G.V. y VARGAS A.C. 1984. Análisis de la contaminación del aire por partículas en Ciudad Universitaria. Memorias del III Congreso Nacional de Ingeniería Sanitaria y Ambiental. Vol II. Sociedad Mexicana de Ingeniería Sanitaria y Ambiental, México pp 1-13 SILLS R. C., HONG H. L., FLAKE G., MOOMAW C., CLAYTON N., BOORMAN G.A., DUNNICK J., DEVEREUX T. R. 2004. o-Nitrotoluene-induced large intestinal tumors in B6C3FI mice model human colon cancer in their molecular pathogenesis. Carcinogénesis, 25(4): 605-612. SMA (Subsecretaría del Mejoramiento del Ambiente). 1978. Situación actual de la contaminación atmosférica en el área metropolitana de la Ciudad de México, Secretaría de Salubridad y Asistencia, Subsecretaría de Mejoramiento del Ambiente, México. pp 5, 7, 62 SNYDER R. 2000. Overview of the toxicology of benzene. Journal of Toxicology and Environmental Health, 61(5-6):339-46. SNYDER R. 2000. Recent developments in the understanding of benzene toxicity and leukemogenesis. Drug Chem. Toxicol. 23(1): 13-25 SNYDER R., WITZ G. Y GOLDSTEIN B.D. 1993. The toxicology of benzene. Environmental Health Perspectives, 100:293-306. TANG H. L., CHU K. H., CHEUK A., TSANG W. K. CHAN H. W. TONG K. L. 2005. Renal tubular acidosis and severe hypophosphataemia due to toluene inhalation. Hong Kong Med. J., 11(1): 50-53. TEITELBAUM D. T. and BRATBAR N. 2000. Benzene and multiple mieloma: appraisal of the scientific evidence. Blood. 95(9) 2995-2997 TOMASZEWSKI C., KIRK M., BINGHAM E., SALTZMAN B., COOK R., KULIG K. 1996. Urine toxicology screens in drivers suspected of driving while impaired from drugs. J. Toxicol Clin toxicol., 34(1): 37-44. TORTORA G. J. Y REYNOLDS G. S. 1996. Principles of Anatomy and Physiology. 8a. ed. Addison Wesley Longman, U.S.A., p. 847-873. Toxicology and carcinogenesis studies of o-nitrotoluene sulfone (CAS No. 88-72-2) in F344/N rats and B6C3F(1) mice (feed studies). 2002. National Toxicology Program., 504: 1-357 Toxicology and carcinogenesis studies of p-nitrotoluene (CAS No. 99-99-0) in F344/N rats and B6C3F(1) mice (feed studies). 2002. Nacional Toxicology Programa., 498: 1-277. TSATSAKIS A. M., DOLOPSAKIS G., TROULAKIS G., CHRISTODOULOU P., RELAKIS K., TRIKILIS N., MICHALODIMITRAKIS MN. 1997. Fatal and mon-fetal outcome by accidental intoxication with pain thinner. J. Clin. Forensic Med., 4(3): 133-137. TSUJIMOTO Y., WARASHINA M., NAM V. D., NODA T., SHIMIZU M, YAMAGUCHI Y., MORIWAKI H., MORIMOTO T., KAHIUVHI K., MAEDA Y. Y TANAKA M. 2005. Determination of urinary phenolic metabolites from rats treated with 1, 2, 3 and 1, 3, 5 – trimethylbenzenes. Journal of Occupational Health, 47(4): 337-339. TYLER M. G. 1994. Ecología y Medio Ambiente. 7ª. Ed. Editorial Iberoamérica. México, pp 15-16 URÍA G. E. y MORA V. M. C. 1996. Apuntes para el curso Teórico-práctico de Histología animal. Escuela Nacional de Ciencias Biológicas, I.P.N. México. Pp 131 VELASCO L. A. 1983. La contaminación atmosférica en la Ciudad de México. Ciencia y Desarrollo. 52: 59-68 WONG O., TRENT L., HARRIS F. 1999. Nested case-control study of leukaemia multiplemyeloma, and kidney cancer in a cohort of petroleum workers exposed to gasoline. Occup. Environ. Med. 56(4): 217-221 YAMAGUCHI H., KIDACHI Y., RYOYAMA K. 2002. Toluene at environmentally relevant low levels disrupts differentiation of astrocyte precursos cells. Arch Environ Health, 57(3): 232-238. YOUNG M. M. A. y YONG M. J. E. 1997. Ecología y Medio Ambiente. 1ª. Ed. Editorial Nueva Imagen. México. Pp 126-128, 161-163 ♦ SELECCIÓN DE DOSIS, VÍA DE ADMINISTRACIÓN Y TIEMPOS DE EXPOSICIÓN AL TOLUENO Y BENCENO La selección de dosis únicas (intoxicación aguda), se realizó en base a los niveles atmosféricos del tolueno y benceno en la ciudad de México, la vía de administración fue intragástrica y los tiempos de exposición fueron de 48 y 72 h. (tabla 1). Las dosis seleccionadas fueron 1, 2 y 3 g/kg de p.c., para cada uno de los contaminantes ambientales en estudio. LOTES DE ANIMALES DE EXPERIMENTACIÓN Se trabajó con 48 ratas Wistar de 180 a 250 g. Se formaron 8 lotes de animales, 2 lotes testigo y 6 experimentales como se indica a continuación en la tabla No. 1 Tabla No. 1 Lote Dosis única de benceno o tolueno administradas por vía intragástrica g/kg No. de animales Tiempos de exposición horas 1 2 3 4 5 6 7 8 Testigo Testigo 1 1 2 2 3 3 6 6 6 6 6 6 6 6 48 72 48 72 48 72 48 72 Al término de la exposición a las diferentes dosis de tolueno o benceno y tiempos de exposición, las ratas se anestesiaron con cloroformo y se les extrajo a c/u de ellas 2 ml de sangre de la vena hepática en la que se realizó cuenta de número de leucocitos/mm3 y cuenta diferencial (estudio hematológico). Enseguida, mediante la técnica de disección anatómica se obtuvieron los siguientes órganos. Sistema Nervioso Central: Sistema Cardiovascular: Sistema Respiratorio: Sistema Linfático: Sistema Digestivo: Sistema Endócrino: Sistema Urinario Sistema Reproductor femenino: Cerebro, cerebelo, tallo cerebral Corazón Tráquea y pulmones Bazo y Timo Hígado Glándulas suprarrenales, páncreas Riñones Ovarios, oviductos, útero y vagina Sistema Reproductor masculino: Testículos, epidídimos, próstata TRATAMIENTO HISTOLÓGICO DE LOS ÓRGANOS OBTENIDOS DE LAS RATAS DE EXPERIMENTACIÓN PARA SU ESTUDIO MICROSCÓPICO Los órganos mencionados se sometieron a todos los procesos de la técnica histológica (fijación, lavado, deshidratación, transparentación, inclusión en parafina, cortes y tinción), hasta la obtención de laminillas histológicas de cada órgano teñidas con la técnica de coloración Hematoxilina-Eosina y con técnicas histoquímicas como: Martius Scarlet Blue (MSB), Papanicolaou y Tricrómica de Masson (Herrera y col., 1997; Uría y Mora, 1996; Bancroft, 1982). FIJACIÓN Es la acción de fijar los componentes tisulares o celulares en un momento determinado, deteniendo sus funciones y estabilizando indefinidamente su estructura. Los objetivos de la fijación son : a) Prevenir los cambios post - mortem, como la autólisis y la putrefacción b) Preservar las estructuras de la manera más cercana a como éstas se encontraban en vida del ejemplar en estudio. c) Otorgar resistencia al material para que soporte las manipulaciones subsecuentes. d) Aumentar la afinidad natural por los colorantes que se emplearán para visualizar los diferentes componentes tisulares o celulares. Los tejidos se fijaron en una solución acuosa de formol al 10 % por más de 48 horas, posteriormente se obtuvieron fragmentos de 1 cm de cada uno de ellos, que se colocaron en bolsas de gasa, para evitar dañarlos con la manipulación, y se etiquetaron. DESHIDRATACIÓN Se realiza para eliminar el agua presente en los órganos, la cual interfiere en el proceso de transparentación e inclusión en parafina. Se llevó acabo utilizando alcohol etílico en concentraciones crecientes: a) Alcohol etílico al 30 %, 2 cambios de 30 minutos cada uno. b) Alcohol etílico al 50 %, 2 cambios de 30 minutos cada uno. c) Alcohol etílico al 60 %, 2 cambios de 30 minutos cada uno. d) Alcohol etílico al 70 %, 3 cambios de 30 minutos cada uno. e) Alcohol etílico al 80 %, 2 cambios de 30 minutos cada uno. f) Alcohol etílico al 96 %, 3 cambios de 30 minutos cada uno. g) Alcohol etílico absoluto, 3 cambios de 30 minutos cada uno. h) Alcohol etílico absoluto - sulfato de cobre, 1 cambio de 20 minutos i) Alcohol etílico absoluto - tolueno, 15 minutos. j) Tolueno, el tiempo necesario para la transparentación de los órganos, cuya finalidad es sustituir el alcohol y preparar las piezas para recibir la parafina. INCLUSIÓN EN PARAFINA Se realizó para tener un medio lo suficientemente duro y resistente para mantener intactos los componentes tisulares cuando se obtienen cortes de ellos en el microtomo Minot de parafina. INCLUSIÓN PRELIMINAR EN PARAFINA a) Parafina I-Xilol ( punto de fusión 51-54 ºC ), en la estufa a 55 ºC durante 15 minutos. b) Parafina I, en la estufa a 55 ºC durante 2 horas. c) Parafina II ( punto de fusión 54-56 ºC ), en la estufa a 55 ºC durante 2 horas. d) Parafina lll ( punto de fusión 56-58 ºC ), en la estufa a 55 ºC durante 2 horas. INCLUSIÓN DEFINITIVA EN PARAFINA Se utilizó parafina Histosek con punto de fusión de 56-58 ºC para formar los bloques cúbicos de parafina con los órganos en su interior, para lo cual se utilizó un molde metálico de inclusión, dividido en compartimentos cúbicos. OBTENCIÓN DE CORTES Con el microtomo de parafina se realizaron cortes de 6 a 8 micras, en el baño de flotación conteniendo agua con gelatina Q.P. marca Baker, se extendieron y se montaron en portaobjetos; para asegurar su adhesión al portaobjetos, se introdujeron en la estufa a 60 ºC, durante l8 horas. DESPARAFINACIÓN DE LOS CORTES a) 3 cambios en xilol y uno en alcohol etílico absoluto-xilol, durante 15 minutos en cada reactivo. b) Hidratar en alcohol etílico al 96%, alcohol etílico al 70% y agua de la llave, durante 15 minutos en cada reactivo (Herrera y col., 1997) COLORACIÓN Los cortes se tiñeron mediante las técnicas de Hematoxilina - Eosina, Tricrómica de Masson, Amarillo de Martius y Papanicolaou. TÉCNICA HEMATOXILINA – EOSINA Es una técnica topográfica en la que el colorante nuclear, primario y básico es la hematoxilina, que tiñe el núcleo y las estructuras citoplásmicas que tengan carga eléctrica negativa. El colorante secundario, de contraste y ácido es la eosina, que tiñe las estructuras citoplásmicas que presentan carga eléctrica positiva. La coloración hematoxilina-eosina es regresiva, ya que primero se tiñe en exceso y después se decolora con un diferenciador que es el alcohol ácido. A este proceso se le denomina diferenciación y es el paso crítico en la técnica de coloración, con él, se obtiene un cambio de color del colorante nuclear ( de morado a rosa), por lo que se hace necesario un vire en el pH para que el colorante adquiera una tonalidad morada o azul y de esta manera exista un buen contraste con el citoplasma celular (que se tiñe de rosa), lo cual permitirá un buen diagnóstico histológico. PROCEDIMIENTO * Desparafinación de los cortes * Colorear con Hematoxilina de Harris, durante 15 minutos. * Lavar con agua de la llave, durante 1 minuto. * Diferenciar en alcohol ácido, durante 15 segundos. * Lavar con agua de la llave, durante 1 minuto * Virar el pH con agua amoniacal, durante 15 segundos. * Lavar con agua de la llave, 3 cambios de 1 minuto cada uno. * Lavar con agua destilada, durante 5 minutos * Teñir con Eosina durante 1 minuto. * Deshidratar en alcohol etílico al 96% ( 10 segundos ), alcohol etílico absoluto-xilol ( 10 minutos ) y en xilol ( 3 cambios de 2 horas cada uno ) * Montar con resina sintética en xilol. RESULTADOS Núcleos Citoplasma o fondo Azules o Morados Rosa o Naranja (Herrera y col., 1997) TÉCNICA DE MARTIUS, SCARLET, BLUE ( MSB) El colorante amarillo de Martius junto con el ácido fosfotúngstico en solución alcohólica, son selectivos para teñir los glóbulos rojos; así como los depósitos de fibrina nueva; sin embargo, el ácido fosfotúngstico bloquea la tinción del músculo, la colágena y la mayoría de las fibras de tejido conectivo. El tratamiento con Xilidina de Ponceau tiñe el músculo y la fibrina madura. El exceso de colorante sobre la colágena se previene con el ácido fosfotúngstico de la primera aplicación. El tratamiento posterior con el ácido fosfotúngstico acuoso elimina los residuos de colorante rojo de las fibras colágenas. Finalmente el azul de metilo tiñe la colágena y depósitos de fibrina vieja PROCEDIMIENTO: ♦ Desparafinación de los cortes. ♦ Teñir con Hematoxilina de Harris, durante 3 min. ♦ Diferenciar en Alcohol ácido, durante 15 seg. ♦ Lavar con agua corriente, durante 1 minuto. ♦ Virar con agua amoniacal, durante 1 min. ♦ Lavar con agua corriente, durante 1 min ♦ Alcohol etílico al 50 %. durante 30 seg. ♦ Alcohol etílico al 70 %, durante 30 seg. ♦ Alcohol etílico al 96 %, durante 30 seg. ♦ Teñir con Amarillo Martius, durante 2 min. ♦ Lavar con agua destilada. ♦ Teñir con Xilidina de Ponceau, durante 4 min. ♦ Lavar con agua destilada ♦ Ácido Fosfotúngstico, durante 1 min. ♦ Lavar con agua destilada ♦ Teñir con Azul de Metilo, durante 3 min. ♦ Lavar con Ácido Acético al 1 % en agua ♦ Alcohol Absoluto, durante 1 min. ♦ Alcohol Absoluto – Xilol, durante 1 min. ♦ Xilol, durante 10 min. ♦ Montar con resina sintética en Xilol RESULTADOS Núcleo Morado Eritrocitos Amarillo Músculo Rojo Colágena Azul Fibrina La fibrina nueva se tiñe de color amarillo y la vieja de azul. (Bancroft, 1982) TÉCNICA TRICRÓMICA DE MASSON En general todas las tinciones tricrómicas se basan en los mismos principios teóricos. Después de teñir los núcleos con una laca se hace un tratamiento simultáneo con dos colorantes ácidos que se diferencian en sus propiedades fisicoquímicas, esto se debe a la diferente velocidad de penetración, el que está finalmente disperso penetra en corto tiempo en todas las estructuras mientras que el otro colorante, derivado del trifenilmetano (fucsina ácida y azul de anilina), se encuentra en solución coloidal de partículas gruesas, de forma que solo penetra en las estructuras más finas. La sustancia de difusión rápida se añade en cantidad excesiva, con lo que se facilita aún más su penetración. Si la coloración con el colorante de partículas gruesas se prolonga demasiado, se origina una sobrecoloración de todos los elementos tisulares. Con la mezcla de ácido fosfomolíbdico y fosfotúngstico se realiza una diferenciación, lo que significa retirar el colorante ácido de las estructuras finas para que puedan aceptar el otro colorante ácido. PROCEDIMIENTO ♦ Desparafinar e hidratar los cortes hasta agua ♦ Solución mordente de Bouin, 90 min. (60°C) ♦ Enfriar y lavar en agua corriente ♦ Lavar con agua destilada, durante 5 min. ♦ Hematoxilina de Weigert, durante 15 min. ♦ Lavar con agua destilada ♦ Teñir con solución fucsina ácida-escarlata de Biebrich, durante 2 min. ♦ Lavar con agua destilada ♦ Solución de ácido fosfotúngtico-fosfomolíbdico, durante 10 min. ♦ Lavar con agua destilada ♦ Solución de ácido acético glacial al 1 %, rápido 2 veces ♦ Alcohol etílico al 96 % I, durante 30 seg. ♦ Alcohol etílico al 96 % II, durante 30 seg. ♦ Alcohol etílico al 96 % III, durante 30 seg. ♦ Alcohol etílico absoluto, durante 1 min. ♦ Alcohol etílico absoluto-xilol, durante 1 min. ♦ Xilol, durante 10 min. ♦ Montar con resina sintética en Xiloleshidratar RESULTADOS Núcleo Negro o café obscuro Citoplasma, Queratina y Fibras musculares Rojo Colágena Azul (Bancroft, 1982) TÉCNICA DE PAPANICOLAOU La técnica de Papanicolaou es de rutina en el examen de células descamadas humanas, de manera que tiene valor diagnóstico; se puede emplear también en frotis de hemolinfa, en cortes por parafina, en donde proporciona datos indicativos y diferenciales entre el tejido colágeno y muscular; o bien, entre queratina y quitina. (Uria y Mora, 1996) PROCEDIMIENTO * Desparafinación de los cortes. * Teñir con Hematoxilina de Harris, durante 2 min. * Lavar con agua corriente * Diferenciar en alcohol ácido, durante 15 seg * Virar con agua amoniacal * Lavar con agua corriente. * Deshidratar con alcohol de 96%, durante 2 min. * Alcohol etílico al 50%, durante 30 seg. * Alcohol etílico al 70 %, durante 30 seg. * Alcohol etílico al 90%, durante 30 seg. * Teñir con Anaranjado G, durante 3 min * Alcohol etílico al 96% l, durante 30 seg. * Alcohol etílico al 96% ll, durante 30 seg. * Alcohol etílico al 96% lll, durante 30 seg. * Teñir con EA-50, durante 3 min. * Alcohol etílico al 96% l, durante 30 seg. * Alcohol etílico al 96% ll, durante 30 seg. * Alcohol etílico al 96% lll, durante 30 seg. * Alcohol etílico absoluto, durante 1 min. * Alcohol etílico absoluto-xilol, durante 1 min. * Xilol, durante 10 min. * Montar con resina sintética en Xilol RESULTADOS Núcleo Morados Citoplasma Rojo, Naranja Colágena Verde claro Músculo Rojo (Uría y Mora, 1996) Eritrocitos Naranja TÉCNICA DE WEIL La reacción de la coloración de Weil se basa en la reducción de las sales de cromo a bióxido crómico mediante la mielina. El bióxido crómico actúa como un mordente y forma una laca con la hematolina (Bancroft, 1982). PROCEDIMIENTO Desparafinar los cortes como se indica en el punto F. Hematoxilina alcohólica a 50 – 60°C. 1 hora 15 minutos Lavar con agua corriente Alumbre de fierro y amonio (Mallinckrodt). 30 minutos Lavar con agua destilada Solución de Weigert. 20 minutos Lavar con agua destilada Lavar con agua corriente Alcohol absoluto. 1 minuto Alcohol absoluto-Xilol. 1 minuto Xilol. 10 minutos Montar con resina sintética RESULTADOS Vainas de mielina Grisáceas TÉCNICA DE PERLS Los gránulos sideróticos se forman a partir de hierro y pueden ser de ferritina y/o hemosiderina dependiendo de las condiciones en que se encuentre la célula. En condiciones normales, se localizan depósitos en el citoplasma de los eritroblastos y eritrocitos de médula ósea, cuya síntesis de hemoglobina se está llevando a cabo por esta célula. PROCEDIMIENTO 1. Desparafinar e hidratar los cortes 2. Lavar con agua de la llave 3. Lavar con agua destilada 4. Transferir a una mezcla a partes iguales de Ferrocianuro de potasio al 2% y ácido clorhídrico al 2%, por 30 min. (se debe preparar al momento de usar porque se oxida rápidamente) 5. Lavar con ácido clorhídrico al 1%, por 1 minuto 6. Lavar con agua destilada 7. Teñir con rojo rápido nuclear por 90 segundos 8. Deshidratar y aclarar: Alcohol al 70% Alcohol al 96% Alcohol-Xilol Xilol 30 seg 30 seg 30 seg 15 minutos 9. Montar con resina sintética RESULTADOS Hemosiderina y sales férricas en color azul profundo INTEPRETACIÓN Gránulos sideróticos debido a la ferritina Azul claro a verde claro Gránulos debidos a la hemosiderinaq Azul intenso a negro Todos los gránulos sideróticos Rojo pálido ANÁLISIS MICROSCÓPICO Se realizó el análisis microscópico para determinar el efecto del tolueno o benceno en cada uno de los órganos de las ratas de experimentación. Obtención de fotografías con un fotomicroscopio Nikkon de los diferentes órganos de cada lote de animales intoxicados, así como de los testigos. 4. RESULTADOS A) Técnicos: elaboración de colecciones científicas de preparaciones histológicas y fotografías de los órganos de las ratas intoxicadas con tolueno o benceno. POR CUESTIÓN DE ESPACIO, A CONTINUACIÓN SE PRESENTAN ALGUNOS DE LOS RESULTADOS, DISCUSIÓN Y CONCLUSIONES OBTENIDOS SOBRE LA CITOTOXICIDAD DE LOS DOS CONTAMINANTES AMBIENTALES ESTUDIADOS. EN EL MOMENTO REQUERIDO EL MATERIAL COMPLETO SE ENCUENTRA EN EL LABORATORIO DE ANATOMÍA DEL DEPARTAMENTO DE MORFOLOGÍA DE LA ENCB. B) Formación de Recursos Humanos (Servicios Sociales y Tesistas), C) Difusión de Resultados (Conferencias Nacionales e Internacionales, Artículos Científicos Publicados). Esta información se encuentra al final de las siguientes fotografías y se han entregado los documentos comprobatorios en la Sección de Estudios de Posgrado e Investigación de la ENCB. CITOTOXICIDAD PRODUCIDA POR BENCENO EN ENCÉFALO DE RATAS RESULTADOS Se obtuvieron los siguientes resultados en el estudio histoquímico realizado en los órganos que constituyen el encéfalo de las ratas intoxicadas con benceno a concentraciones de 0, 1, 2 y 3 g de benceno/kg de peso. CEREBRO Con las técnicas de Papanicolaou (PAP) y Martius, Scarlet, Blue (MSB), en las ratas testigo, las seis capas histológicas que constituyen la corteza cerebral: capa molecular, granulosa externa, piramidal externa, granulosa interna, piramidal interna y polimorfa, no mostraron alteraciones histológicas, al igual que los vasos sanguíneos que irrigan a este órgano. Mediante la técnica de Weil, en la sustancia blanca tanto de las ratas testigo como de las tratadas con concentraciones de benceno de 1, 2 y 3 g de benceno/kg de peso, las estructuras histológicas como axones, vainas de mielina y tejido neuróglico fueron normales. Con la técnica de MSB, la sustancia gris y blanca del cerebro de las ratas intoxicadas con la dosis de 1 g de benceno/kg, presentó edema vasógeno de tipo exudado con pequeñas cantidades de fibrina poco polimerizada (amarilla) en algunos vasos sanguíneos. Solamente en dos animales se presentó leve edema citotóxico en algunos somas neuronales. Con la técnia de PAP se determinó en los vasos sanguíneos de la corteza y sustancia blanca leve vasodilatación y congestión. El edema vasógeno demostrado con la técnica de MSB en el cerebro de las ratas intoxicadas con 3 g de benceno/kg de peso fue severo, sobre todo en la corteza cerebral. La fibrina localizada alrededor de los vasos sanguíneos se observó muy polimerizada. Los somas neuronales no presentaron edema citotóxico. Mediante la técnica de PAP se demostró que la vasodilatación, congestión y cantidad de focos hemorrágicos fueron severos, especialmente en la sustancia gris. Hubo desorganización de las capas de la corteza cerebral en los grupos de ratas intoxicadas con 1, 2 y 3 g de benceno/kg de peso. CEREBELO Con las técnicas de MSB y PAP las capas que constituyen la corteza cerebelosa: molecular, de células de Purkinje y granulosa, al igual que los vasos sanguíneos que lo irrigan, presentaron histología en los animales de los grupos testigo. La técnica de Weil permitió observar la histología normal de los axones mielínicos que forman la sustancia blanca del cerebelo; así como del tejido neuróglico tanto de los grupos testigo como de los tratados con concentraciones de 1, 2 y 3 g de benceno/kg de peso. En los animales tratados con la dosis más baja; la técnica de MSB puso en evidencia un leve edema vasógeno en la capa molecular del cerebelo con fibrina poco polimerizada. Con la técnica de PAP se encontró un leve vasodilatación y congestión tanto en la sustancia blanca como en la gris, y escasos focos hemorrágicos pequeños, distribuidos tanto en corteza como en sustancia blanca. El edema vasógeno exudativo del grupo tratado con 2 g de benceno/kg de peso, observado con la técnica de MSB, fue igual que el presentado en los animales tratados con la dosis 1 g de benceno/kg de peso. La vasodilatación y congestión, así como la presencia de focos hemorrágicos identificados en sustancia gris y blanca con la técnica de PAP, fueron moderados. Se encontró que los cerebelos de las ratas tratadas con 3 g de benceno/kg de peso, con la técnica de MSB, no presentaron edema vasógeno. Pero con la técnica de PAP, si se observó moderada vasodilatación y congestión en sustancia gris y blanca. Los focos hemorrágicos que se presentaron fueron moderados. TALLO CEREBRAL Con las técnicas de MSB, PAP y Weil los animales del grupo testigo mostraron la histología normal del tallo cerebral, tanto en los cuerpos neuronales que constituyen los núcleos, como en los axones mielínicos y en los vasos sanguíneos. Esto también se observó en los grupos de ratas tratadas con la dosis de 1 g de benceno/kg de peso. Mediante la técnica de MSB se observó leve edema vasógeno sin fibrina en el tallo cerebral de las ratas a las que se les administró 2 ó 3 g de benceno/kg de peso. La técnica de PAP permitió evidenciar en el tallo cerebral, severos focos hemorrágicos y moderada vasodilatación y congestión, tanto a la dosis de 2 y 3 g de benceno/kg de peso. Con las técnicas de MSB se demostró que los vasos sanguíneos meningeos, estaban muy congestionados en los animales intoxicados con 1, 2 y 3 g de benceno/kg de peso. Mediante la técnica de Rojo Congo no se pudo demostrar la presencia de amiloide como parámetro para identificar si el edema vasógeno era de tipo exudado, ya que, como indica el fundamento de dicha técnica, sólo cuando esta sustancia es muy abundante, se puede observar al microscopio de luz polarizada, por lo que se deduce que la cantidad de amiloide era escasa o no había. En los siguientes cuadros se resumen las alteraciones encontradas en el encéfalo de rata intoxicadas con diferentes dosis de benceno. Corteza cerebral de ratas testigo. Se observan las seis capas que la constituyen: A) molecular, B) granulosa externa, C) piramidal interna, D) granulosa interna, E) piramidal interna y F) polimorfa. Técnica de MSB. 4x Corteza cerebral de rata intoxicada con 1 g de benceno/kg de peso y sacrificada 48 hs después. Moderada vasodilatación y congestión (flecha). Técnica de PAP. 10x Corteza cerebral de rata intoxicada 1 g de benceno/kg de peso y sacrificada 72 hs después. Moderado foco hemorrágico. Técnica de PAP. 10x Corteza cerebral de rata expuesta a 2 g de benceno/kg de peso y sacrificada 48 hs después. Vaso sanguíneo con gran cantidad de fibrina azul muy polimerizada (flecha). Técnica de MSB. 40x Sustancia gris cerebral de rata expuesta a 2 g de benceno/kg de peso y sacrificada 72 hs después. Capas corticales desorganizadas. Técnica de PAP. 4x Corteza cerebral de rata tratada con 3 g de benceno/kg de peso y sacrificada 48 hs después. Se observa severos focos hemorrágicos. Técnica de PAP. 40x Sustancia blanca de cerebral de rata intoxicada con 3 g de benceno/kg de peso y sacrificada 72 hs después. El tejido neuróglico (A) y las vainas de mielina (B) con histología normal. Técnica de Weil. 50x Corteza cerebelosa de rata testigo. Se observa histología normal de las capas (A) molecular, (B) de células de Purkinje y (C) granulosa (D) Substancia blanca. Técnica de MSB. 10x Capa molecular del cerebelo de rata intoxicada con 1 g de benceno/kg de peso y sacrificada 48 hs después. Vaso sanguíneo con leve edema vasógeno y muy poca cantidad de fibrina poco polimerizada (flecha). Técnica de MSB. 40x Corteza cerebelosa de rata tratada con 1 g de benceno/kg de peso y sacrificada 72 hs después. Vasodilatación y congestión moderados (A) y focos hemorrágicos moderados (B). Técnica de PAP. 10x Cerebelo de rata expuesta a 2 g de benceno/kg de peso y sacrificada 48 hs después. Moderado foco hemorrágico (flecha). Técnica de PAP. 10x Sustancia blanca de cerebelo de rata expuesta a 2 g de benceno/kg de peso y sacrificada 72 hs después. Se presenta morfología normal de los axones mielínicos (A), así como del tejido neurológico (B). Técnica de Weil. 40x Tallo cerebral de ratas testigo. Se presenta morfología normal en axones mielínicos (A) y tejido neuróglico (B). Técnica de PAP. 10x Tallo cerebral de rata intoxicada con 3 g de benceno/kg de peso y sacrificada 48 hs después. Se observa morfología normal de los axones mielínicos (flecha). Técnica de MSB. 40x Tallo cerebral de rata intoxicada con 3 g de benceno/kg de peso y sacrificada 72 hs después. Severa vasodilatación y congestión (A) y edema severo con fibrina polimerizada (B). Técnica de MSB. 40x Órgano Dosis de benceno (g/kg) Alteraciones Vasodilatación y congestión histológicas Focos hemorrágicos observadas Edema vasógeno Cerebro 1 2 3 leves moderadas severas no se presentaron moderados severos leve moderado severo Cerebelo 1 2 3 leves moderadas moderadas leves moderados moderados leve leve no se presentaron Tallo cerebral 1 2 3 no se presentaron moderados moderados no se presentaron severos severos no se presentaron moderado moderado CUADRO 1. ALTERACIONES HISTOLÓGICAS OBSERVADAS EN EL ENCÉFALO DE RATAS INTOXICADAS CON BENCENO. Órgano Dosis de benceno (g/kg) Cerebro 1 2 3 Cerebelo 1 2 3 Tallo cerebral 1 2 3 Alteraciones Edema citotóxico histológicas Desorganización estructural de capas celulares observadas Vainas de mielina leve no se presentó no se presentó corteza corteza corteza normales normales normales no se presentó no se presentó no se presentó no se presentó no se presentó no se presentó normales normales normales no se presentó no se presentó no se presentó no se presentó no se presentó no se presentó normales normales normales CUADRO 2. ALTERACIONES HISTOLÓGICAS OBSERVADAS EN EL ENCÉFALO DE RATAS INTOXICADAS CON BENCENO DISCUSIÓN La exposición a sustancias químicas presentes en el aire que se respira puede tener efectos adversos en la salud por lo que es importante conocer las posibles consecuencias; y considerarlas al elaborar un diagnóstico clínico o planes terapéuticos. Este trabajo forma parte de un proyecto de investigación, en el cual se estudiaron los efectos del benceno sobre el encéfalo y otros órganos como el corazón, en el cual se encontraron daños predisponentes a insuficiencia cardiaca congestiva. La insuficiencia es un síndrome caracterizado por la incapacidad del corazón para producir un gasto sistólico adecuado a las necesidades metabólicas de los tejidos. Las consecuencias hemodinámicas son disminución del gasto sistólico inferior al retorno venoso, lo que origina disminución del llenado del sistema arterial, y estancamiento de la sangre en el sistema venoso. Además, la insuficiencia cardiaca congestiva afecta diferentes órganos como son: pulmones, riñones hígado, bazo, sistema portal, tejido subcutáneo y cerebro. Las alteraciones observadas en este último son dilatación y congestión de los vasos que irrigan al cerebro. Todo lo anterior coincide con los daños encontrados en los órganos que constituyen el encéfalo. Los vasos sanguíneos, tanto de sustancia gris como blanca, se observan congestionados y dilatados al igual que los vasos que se encuentran en las meninges que rodean estos órganos. La congestión pasiva es el aumento en la cantidad de sangre dentro del aparato circulatorio con dilatación de los vasos microscópicos. Se produce por una disminución del flujo venoso sanguíneo. Esta congestión puede producir un incremento de la hemoglobina desoxigenada en la sangre, dando lugar a cianosis, uno de los síntomas que se observa en la intoxicación por benceno. La congestión pasiva observada es dosis respuesta, lo cual indica que a altas concentraciones de benceno (3 g/kg de peso), la insuficiencia cardiaca es mayor, produciendo un mayor grado de estancamiento de la sangre en los vasos que irrigan al encéfalo. La congestión de los lechos capilares está muy relacionada con la aparición de edema, que consiste en la acumulación de líquido en el espacio extracelular debido a la extravasación a través de los capilares que han perdido su capacidad de barrera favoreciendo la salida de líquido. El edema de origen inflamatorio, relacionado con un aumento en la permeabilidad endotelial, está constituido de dos fases: A) Fase líquida: contiene agua, iones, moléculas pequeñas y proteínas como fibrina, complemento y anticuerpos. B) Fase celular: formada por hemocito, leucocitos, linfocitos y macrófagos. Otros de los daños que se observa en el encéfalo de las ratas intoxicadas con benceno es el edema vasógeno, que se clasifica como tipo exudado y de origen inflamatorio en base a la cantidad y tipo de fibrina que se encuentra entre los vasos anguíneos y el tejido nervioso. La fibrina es un polímero formado por pequeñas proteínas fibrilares solubles como el fibrinógeno; el cual al salir de los vasos se polimeriza para formar la fibrina. Con la técnica histoquímica utilizada, se determina el grado de polimerización de ésta en base a la coloración; amarilla y fina la poco polimerizada, y azul y gruesos los polímeros grandes. Del estudio se observa que con 1 g de benceno/kg de peso, la cantidad de fibrina alrededor de los vasos sanguíneos es poca y en algunos no se presenta, pero al aumentar la concentración de benceno (2 kg/kg), la cantidad de fibrina aumenta y se observa más polimerizada. Esto concuerda con la congestión y dilatación observada, ya que al haber poca congestión, como sucede con 1 g de benceno/kg, la cantidad de proteínas extravasadas es menor. En el caso del edema vasógeno, se puede dar lugar a desmielinización y degeneración axonal cuando el edema es de larga evolución, pero al analizar las fibras mielínicas que se encuentran en el cerebro, cerebelo y tallo cerebral, no se observan alteraciones en las vainas mielínicas ni en los axones, por lo que el edema producido no es de larga evolución. Otra alteración relacionada con la congestión pasiva de los vasos sanguíneos es la presencia de focos hemorrágicos, que es la salida de sangre del interior del aparato circulatorio a los tejidos vecinos. El epitelio vascular es afectado, como en el caso del edema vasógeno tipo exudado, permitiendo la salida de eritrocitos por un fenómeno de diapédesis. En los órganos analizados se observa que la presencia de focos hemorrágicos coincide con el mayor grado de congestión, lo cual quiere decir que también es una alteración dosisrespuesta, consecuencia de la congestión pasiva. En el cerebelo, la presencia de focos hemorrágicos es moderada porque el grado de congestión en éste no es severo. El edema citotóxico observado en las ratas intoxicadas con 1 g de benceno/kg, no se puede considerar como un daño general producido por el benceno, debido a que sólo fueron dos animales los que lo presentaron. Esto puede ser debido a la alta sensibilidad de dichos animales ante la intoxicación con el benceno. Por lo tanto en este estudio se concluye que la presencia de congestión vasodilatación y edema vasógeno es dependiente de la dosis de benceno empleada. El edema vasógeno es de tipo exudado; y en el grado en el que se presenta, no da lugar a la producción de edema citotóxico ni desmielinización de los axones mielínicos del tejido nervioso. CITOTOXICIDAD PRODUCIDA POR EL BENCENO EN TRÁQUEA Y PULMONES DE RATAS RESULTADOS El análisis microscópico realizado en tráquea y pulmones de las ratas testigo y de las intoxicadas, por vía intragástrica, con las dosis de benceno seleccionadas, demostró lo siguiente: TRÁQUEA La morfología de las capas histológicas constituyentes de la tráquea de las ratas testigo fue normal, se demostró con las cuatro técnicas de coloración empleadas en este trabajo. La tráquea de las ratas tratadas con la dosis única de 1 g de benceno/kg de p.c. y sacrificadas 48 hr después, presentó las siguientes alteraciones histológicas: en el epitelio de revestimiento hubo leve formación de papilas, hiperplasia moderada y pérdida leve de cilios. De éstas, las dos primeras lesiones fueron más drásticas en los animales intoxicados con la misma dosis, pero expuestos durante 72 hs, presentándose además inflamación crónica moderada en la lámina propia, el resto de las capas histológicas presentaron morfología normal. El grado de las lesiones arriba mencionadas fue mayor en las ratas de experimentación intoxicadas con 2 g de benceno/kg de p.c. y sacrificadas 48 hr después, a excepción del proceso inflamatorio crónico observado en la lámina propia que fue leve, pero que además se presento en la submucosa. En ambas capas histológicas hubo firbrosis moderada. Estas alteraciones histológicas se demostraron mejor con la técnica de coloración Tricrómica de Masson. En animales intoxicados con la dosis más alta de benceno y expuestas durante 48 hs las lesiones fueron más drásticas. En el epitelio de revestimiento también se observó metaplasia epidermoide severa, las glándulas traqueales disminuyeron en cantidad, algunas presentaron morfología normal o bien con cambios morfológicos importantes como aumento en el diámetro de su luz y adelgazamiento epitelial; en el cartílago hialino, la capa adventicia y el músculo traqueal se observó normal. Las ratas de experimentación sacrificadas 72 hs después de la intoxicación única con la dosis más alta de benceno fueron las que presentaron alteraciones histológicas más drásticas en mayor cantidad. La hiperplasia epidermoide fue sustituida por metaplasia epidermoide, las glándulas traqueales en algunos animales disminuyeron en cantidad y presentaron cambios morfológicos importantes (como los arriba mencionados), o bien no se observaron; por que, en la capa submucosa hubo una severa fibrosis. En la capa adventicia se presentaron lesiones vasculares severas, como dilatación y congestión de los vasos sanguíneos. El músculo traqueal se mantuvo normal. PULMONES La morfología del parénquima pulmonar de las ratas testigo fue normal, lo cual se demostró mediante las cuatro técnicas de coloración empleadas en este trabajo. El pulmón de las ratas tratadas con la dosis única de 1 g de benceno/kg de p.c. y sacrificadas 48 h después, presentó las siguientes alteraciones histológicas: en el epitelio bronquiolar hubo severa formación de papilas, hiperplasia y esfacelación leves, dilatación y congestión vascular moderada. De éstas, las dos primeras lesiones fueron parecidas, la esfacelación fue moderada y las dos últimas lesiones fueron un poco más drásticas en los animales intoxicados con la misma dosis, pero expuestos durante 72 hs, presentándose además leve inflamación crónica nodular en la adventicia bronquial. En las ratas de experimentación intoxicadas con 2 g de benceno/kg de p.c. y sacrificadas 48 hs después, se observó que el grado de lesión fue parecida a la mencionada arriba en la formación de papilas y en la esfacelación, fue menor en la dilatación y congestión vascular, pero mayor en la hiperplasia y en la inflamación crónica nodular. Los animales intoxicados con la dosis más lata de benceno y expuestas durante 48 hs presentaron lesiones más drásticas, a excepción de la esfacelación que se mantuvo moderada, se observó que la hiperplasia epitelial fue sustituida por metaplasia epidermoide muy drástica, además se presentó hemólisis intravascular drástica, también se observó hemorragia y hemólisis interalveolar drástica. Las ratas de experimentación sacrificadas 72 hs después de la intoxicación única con la dosis más alta de benceno fueron las que presentaron más drásticas y mayor cantidad de alteraciones histológicas, se observó hemorragia interalveolar e intraalveolar además de hemólisis interalveolar muy drástica. Se observó la hemólisis interalveolar drástica, inflamación crónica difusa interalveolar además de la fibrosis drástica, hemólisis intravascular y la fibrosis drástica. Tráquea de rata testigo, en la que se observa: la capa mucosa formada por epitelio cilíndrico seudoestra-tificado ciliado y lámina propia; submucosa con glándulas traqueales acinosas compuestas de secreción mucosa y serosa; cartílago hialino y adventicia. Todas estas capas histológicas presentaron morfología normal. Tráquea de rata intoxicada con la dosis única de 1 g de benceno/Kg de p.c. y sacrificada 48 hs. después de la exposición. Se observa: En el epiteliode revestimiento, formación de papilas, leve hiperplasia moderada y pérdida de cilios leve; el resto de las capas histológicas: presentaron histología normal. Tráquea de rata intoxicada con la dosis única de 1 g de benceno/Kg de p.c. y sacrificada 72 h después de la exposición. Se observa: en el epitelio de revestimiento, formación de papilas moderada, hiperplasia severa y pérdida de cilios leve; la lámina propia presentó proceso inflamatorio crónico moderado; el resto de las capas histológicas presentaron histología normal. Tráquea de rata intoxicada con la dosis única de 2 g de benceno/Kg de p.c. y sacrificada 48 hs después. Se observa: en el epitelio de revestimiento, formación de papilas severa, hiperplasia severa y pérdida de cilios moderada; la lámina propia y la submucosa, presentaron inflamación crónica leve y fibrosis moderada. En las glándulas traqueales de la capa submucosa y en el resto de las capas histológicas se observó morfología normal. Tráquea de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c. y sacrificada 48 hs después. Se observa: formación de papilas severa, zonas con hiperplasia severa o con metaplasia epidermoide severa, moderada pérdida de cilios en el epitelio de revestimiento; en la lámina propia y submucosa se presentan reacción inflamatoria crónica y fibrosis moderadas, las glándulas traqueales con morfología normal Tráquea de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c., sacrificada 48 hs después. Se observa: formación de papilas severa, zonas con hiperplasia severa o con metaplasia epidermoide severa, moderada pérdida de cilios en el epitelio de revestimiento; en la lámina propia y submucosa se presentan reacción inflamatoria crónica y fibrosis moderadas; las glándulas traqueales disminuyen en cantidad y sufren importantes cambios morfológicos; el cartílago hialino conservó histología normal. Tráquea de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c. y sacrificadas 72 hs después. Se observa: metaplasia epidermoide y pérdida de cilios severas en el epitelio de revestimiento; en la lámina propia, leve reacción inflamatoria crónica y moderada fibrosis, las glándulas traqueales presentan disminución e importantes cambios morfológicos; la capa submucosa presenta inflamación crónica severa. Tráquea de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c. y sacrificadas 72 hs después. Se observa: formación de papilas, etaplasma epidermoide y pérdida de cilios severas en el epitelio de revestimiento; la lámina propia presenta inflamación crónica leve y fibrosis moderada; en la submucosa hay fibrosis severa y ausencia de glándulas traqueales; la capa adventicia presenta dilatación y congestión vasculares severas y fibrosis severa. Pulmón de rata intoxicada con la dosis única de 1 g de benceno/Kg de p.c., sacrificada 48 hs después de la exposición. Se observa: formación de papilas severa, hiperplasia y esfacelación leves en el epitelio bronquiolar; dilatación y congestión vascular moderadas. Pulmón de rata intoxicada con la dosis única de 1 g de benceno/Kg de p.c., sacrificada 72 hs después de la exposición. Se observa: formación de papilas severa, hiperplasia leve y moderada esfacelación en el epitelio bronquiolar, leve inflamación crónica nodular en la adventicia bronquiolar y dilatación y congestión vasculares severas. Pulmón de rata intoxicada con la dosis única de 2 g de benceno/Kg de p.c., sacrificada 48 hs después de la exposición. Se observa: formación de papilas severa hiperplasia y esfacelación moderadasen el epitelio bronquiolar, dilatación y congestión vascular leves, inflamación crónica nodular moderada. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c., sacrificada 48 hs después de la exposición. Se observa: formación de papilas severa, metaplasia epidermoide severa y esfacelación moderada en el epitelio de revestimiento; dilatación y congestión vasculares severas, inflamación crónica nodular severa; hemólisis intravascular severa. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c., sacrificada 48 hs después de la exposición. Se observa: dilatación y congestión vasculares severas, hemorragia y hemólisis interalveolares severas, reacción inflamatoria crónica interalveolar severa. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c. y sacrificada 72 hs después de la exposición. Se observa: formación de papilas, metaplasia epidermoide y esfacelación severas del epitelio bronquiolar; dilatación y congestión vascular severas; hemólisis intravascular severa; inflamación crónica nodular severa. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c., sacrificada 72 hrs después. Se observa: hemorragia interalveolar severa; hemorragia intraalveolar leve y hemólisis interalveolar leve. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c., sacrificada 72 hs después. Se observa: hemólisis interalveolar severa. Pulmón de rata intoxicada con la dosis única de 3 g de benceno/Kg de p.c. y sacrificada 72 hs después. Seobserva: hemólisis intravascular severa y fibrosis severa. DISCUSIÓN Las personas están expuestas a los efectos de sustancias químicas presentes en el aire que respiran, las más propensas a sufrir efectos tóxicos de los contaminantes atmosféricos son las que están en contacto con estos productos en el sitio de trabajo, por que ha menudo reciben dosis mayores de ellos que la población en general. A pesar de ello existe una gran desinformación tanto a nivel público como político y académico respecto a las exposiciones de la población a contaminantes. Los contaminantes atmosféricos penetra el cuerpo principalmente por vía inhalatoria llegando a los pulmones. La absorción del benceno se lleva a cabo a nivel de los alvéolos, en los cuales se efectúa el intercambio gaseoso, de ahí que el benceno pasa a la circulación sanguínea distribuyéndose a todos los órganos. Es importante realizar un estudio sobre la toxicidad del benceno como contaminante ambiental, debido a los escasos estudios realizados en México acerca de este compuesto a pesar de la gama tan amplia de usos que se le dan. Como podemos apreciar en los resultados la tráquea y pulmón de las ratas testigo presentaron una morfología normal, esto indica que el daño encontrado en los lotes de animales intoxicados con benceno fue en realidad debido al efecto del contaminante. En el epitelio de revestimiento se aprecia la formación de papilas, la presencia de un trastorno adquirido reversible del crecimiento celular en donde se manifiesta una formación excesiva de tejido, aumento de tamaño del tejido debido a un aumento en el número de células (hiperplasia), estos daños se observan en las ratas tratadas con la dosis única de 1 g de benceno/kg de p.c. y sacrificadas 48 hr. El daño se incrementó con el tiempo de exposición y con la dosis por lo que se considera dosis-dependiente tanto en tráquea como en pulmón. También en el epitelio de revestimiento se observa un trastorno adquirido en la diferenciación celular, es un cambio reversible, en el cual un tejido adulto es sustituido por otro tejido de tipo adulto (Metaplasia), esto se observó en las ratas tratadas con la dosis única de 3 g /kg de p.c. sacrificadas 48 y 96 hrs después tanto en tráquea como en pulmón. En tráquea a partir de la dosis de 1 g /kg de p.c. en adelante se observó la pérdida de cilios que fue desde leve, moderada, hasta severa por lo que se considera el daño dosis dependiente. En los cilios se encuentran los receptores para el oxígeno, al no estar estos y no haber oxígeno, se tiene hipoxia. En pulmón se observó un trastorno irreversible por isquemia se aprecian las células en una lápida sepulcral acidófila y opaca, hay pérdida de núcleos con la conservación de la forma celular y la arquitectura (necrosis de coagulación), también se observa desprendimiento del epitelio de revestimiento necrosado estos daños se presentan a partir de la dosis 1 g/kg de p.c. y van desde leves, moderados hasta severos, por lo que se considera que son dosis dependientes. Hay una reacción inespecífica del tejido vivo vascularizado a una agresión local, relacionada estrechamente con el proceso de reparación, se presenta un aumento de leucocitos monocucleares con formación de nódulos linfoides (inflamación crónica), se consideró dosis – dependiente ya que va desde leve, moderada hasta severa tanto en tráquea como en pulmón. En tráquea las glándulas mucosas conservan su estructura y su morfología en la dosis de 1 g /kg de p.c. en 48 hrs, pero en la dosis de 3 g/kg de p.c. sacrificadas 72 hs después, disminuyen y en las sacrificadas 72 hs después éstas son escasas o ausentes, el papel de estas glándulas es mantener húmeda y lubricada la tráquea y al estar ausentes se presenta una resequedad, con esto se justifica el hecho de que las ratas se observen alteradas ya que esta resequedad da una sensación de asfixia. El tejido cartilaginoso de la tráquea no se observa afectado en ninguno de los lotes. Egle, y Hudgins, en 1992 encontraron insuficiencia cardiaca en ratas intoxicadas con acroleína y considerando que la insuficiencia cardiaca consiste en un síndrome caracterizado por la incapacidad del corazón para producir un gastos sistólico adecuado a las necesidades metabólicas de los tejidos y las consecuencias hemodinámicas son disminución del gasto sistólico inferior al retorno venoso, lo que origina disminución del llenado del sistema arterial, y estancamiento de la sangre en el sistema venoso, la insuficiencia congestiva afecta diferentes órganos como son: pulmones, riñones, hígado, bazo, sistema portal, tejido subcutáneo y cerebro. Todo lo anterior coincide con los daños encontrados en tráquea y pulmón, los vasos sanguíneos se observan congestionados y dilatados. La insuficiencia cardiaca también da lugar a congestión pasiva como fenómeno sistémico que consiste en el aumento de la cantidad de sangre dentro del aparato circulatorio con dilatación de los vasos microscópicos producida por una disminución de flujo venoso sanguíneo. Esta congestión puede producir un incremento de la hemoglobina desoxigenada en la sangre, dando lugar a cianosis, uno de los síntomas que se observa en la intoxicación por el benceno. La congestión pasiva observada es dosis respuesta lo cual indica que a alta concentración de benceno 3 g/kg a las 72 hs) la insuficiencia cardiaca es mayor, produciendo un mayor grado de estancamiento de la sangre en los vasos que irrigan la tráquea y el pulmón. La congestión de los lechos capilares está muy relacionada con la aparición de edema, que consiste en la acumulación excesiva de líquido en el espacio extracelular debido a la extravasación a través de los capilares que han perdido su capacidad de barrera favoreciendo la salida de líquido. El edema de origen inflamatorio, relacionado con un aumento en la permeabilidad endotelial está constituido de dos fases: ♦ Fase líquida: contiene agua, iones, moléculas pequeñas y proteínas como fibrina, complemento y anticuerpos. ♦ Fase celular: formada por eritrocitos, leucocitos, linfocitos y macrófagos. Otro de los daños que se observan en la tráquea y el pulmón de las ratas intoxicadas con benceno es el edema, que se clasifica como tipo exudado y de origen inflamatorio en base a la cantidad y tipo de fibrina que se encuentra entre los vasos sanguíneos y el tejido. La fibrina es un polímero formado por pequeñas proteínas fibrilares solubles como el fibrinógeno; el cual al salir de los vasos se polimeriza para formar la fibrina. Con la técnica histoquímica, se determina el grado de polimerización de ésta en base a la coloración; amarilla la poco polimerizada, y azul los polímeros grandes. Del estudio se observa que con 1 g/kg a 72 hrs la cantidad de fibras colágenas al rededor de los vasos sanguíneos y en el tejido es poca y en algunos animales no se presenta, pero al aumentar la concentración de benceno ( 3 g/kg 72 hrs ) la cantidad de fibras colágena aumenta y se observa más polimerizada. Esto se debe probablemente a que se llevó a cabo un proceso de reparación REPARACIÓN Es el reemplazo de tejido muerto por tejido de granulación, que eventualmente habrá de madurar al tejido cicatrizal. En las heridas en que la lesión llega el tejido conectivo, la dermis de la piel o lámina propia de la mucosa del tubo digestivo, las células mesenquimatosas o precursoras se activan y proliferan dando origen a fibroblastos activos. Estas células las sintetizan y secretan componentes de la matriz extracelular como fibronectina, proteoglucanos y colágena tipo I y III. Los macrófagos casi siempre están presentes en el tejido de granulación, están ocupados eliminando del área el detrito extracelular, la fibrina y otras sustancias extrañas. Los fibroblastos secretan activamente componentes de la matriz extracelular, primero ácido hialurónico y después proteogluconos sulfatados. La síntesis de colágeno por los fibroblastos se empieza a las 48 hrs, pero su depósito no se evidencia en los tejidos hasta los cuatro días de producida la lesión. Al principio predomina el colágeno tipo III pero a los 7 a 8 días se destaca el tipo I, que eventualmente se convierte en el colágeno principal del tejido cicatrizal maduro. Esto concuerda con la congestión y dilatación observada, ya que al haber poca congestión, como sucede con 1 g/kg 48 hrs de benceno, la cantidad de proteínas extravasadas es menor. Otra alteración relacionada con la congestión pasiva de los vasos sanguíneos es la presencia de focos hemorrágicos, que es la salida de sangre del interior del aparato circulatorio a los tejidos vecinos. El epitelio vascular es afectado, como en el caso del edema tipo exudado, permitiendo la salida de eritrocitos por un fenómeno de diapédesis. En los órganos analizados se observa que la presencia de focos hemorrágicos coincide con el mayor grado de congestión, lo cual quiere decir que también es una alteración dosisrespuesta consecuencia de la congestión pasiva. En el pulmón la presencia de focos hemorrágicos va desde ligeros hasta severos. Otra de las lesiones observadas es la hemólisis extravascular que tiene lugar si se lesionan los eritrocitos. El erotrocito y su membrana son sensibles a la agresión por oxidantes exógenos y endógenos. En condiciones normales, el glutatión reducido (GSH) intracelular inactiva a estos oxidantes, pero la exposición al fármaco produce la oxidación de GSH a glutation, a través de la producción de peróxido de hidrógeno. Como la regeneración de GSH está dificultada en las células con déficit de glucosa -6- fosfato deshidrogenasa (G6PD), el peróxido de hidrógeno se acumula y lesiona otros elementos de los hematies. Cuando la hemoglobina se oxida se desnaturaliza formando precipitados (cuerpos de Heinz) en el interior de la célula. Estos cuerpos se pegan a la membrana disminuyendo la plasticidad del eritrocito y provocando la pérdida de la membrana, esta lesión se observó en los pulmones de las ratas intoxicadas con dosis de 1 g/kg a las 72 hrs en forma moderada y con dosis de 3 g/kg a las 48 y 72 hrs en la cual fue moderada hasta severa, por lo que se considera dosis dependiente. Con todo lo anterior y con base en los resultados encontrados se concluye que: ♦ Se logró determinar el efecto citotóxico producido por el benceno en tráquea y en pulmones de ratas intoxicadas experimentalmente ♦ Se logró la correlación de algunos daños orgánicos observados con la sintomatología clínica que presentan las personas y ratas expuestas a este contaminante ambiental. CITOTOXICIDAD PRODUCIDA POR EL BENCENO EN CORAZÓN DE RATAS RESULTADOS El análisis microscópico de los órganos en estudio de las ratas testigo y de las administradas con benceno demostró lo siguiente. CORAZÓN Con las técnicas de Papanicolaou (PAP); Martius, Scarlet, Blue (MSB) y Tricrómica de Masson; las fibras musculares estriadas cardiacas, los vasos sanguíneos y el tejido intersticial que constituyen al corazón de las ratas testigo nos presentaron alteraciones histológicas. Mediante las tres técnicas de coloración arriba mencionadas, pudo demostrarse en los animales tratados con las concentraciones de benceno de 1, 2 y 3/kg de peso, la presencia de severa dilatación y congestión de los vasos sanguíneos cardiaco. La técnica de PAP permitió demostrar además, focos hemorrágicos presentes entre las fibras musculares. El proceso de lisis eritrocitaria fue demostrado únicamente en los animales intoxicados conh la concentración de 2 g de benceno/kg de peso. La técnica Tricrómica de Masson permitió poner de manifiesto fibrosis en el tejido intersticial en las ratas tratadas únicamente con la concentración de 3 g de benceno/kg de peso. Con la técnica de MSB, no se observó la presencia de edema vasógeno en los vasos sanguíneos del corazón de las ratas tratadas con las tres dosis de benceno. Corazón de ratas testigo. Se observa la histología normal de: A) Fibras musculares estriadas cardiacas, B) Tejido intersticial y C) Vasos sanguíneos. Técnica de PAP. 10x Corazón de rata intoxicada con 2 g de benceno/kg de peso, sacrificada 48 h después. Se observa severa dilatación y congestión en los vasos sanguíneos intersticiales (flechas). Técnica de MSB. 10x Corazón de rata intoxicada con 2 g de benceno/kg de peso, sacrificada 72 h después. Lisis de eritrocitos (flechas)., Técnica de PAP. 10x Corazón de rata expuesta a la concentración de 3 g de benceno/kg de peso, sacrificada 48 h después, con severos focos hemorrágicos (flechas). Técnica de PAP. 10x Corazón de rata tratada con 3 g de benceno/kg de peso, sacrificada 72 h después, con fibrosis intersticial severa (flechas). Técnica Tricrómica de Masson. 10x CITOTOXICIDAD PRODUCIDA POR EL BENCENO EN RIÑONES DE RATAS RIÑONES Las técnicas de PAP, MSB y Tricrómica de Masson mostraron que tanto corteza renal (corpúsculos de Malpighi, túbulos contorneados proximales, túbulos contorneados distales, tejido intersiticial formado por tejido conjuntivo laxo y vasos sanguíneos), como médula (porción descendente y ascendente de las asas de Henle, tubos colectores, tejido intersitical y vasos sanguíneos), de las ratas testigo, presentaron histología normal. En los animales tratados con las concentraciones de 1, 2 y 3 g benceno/kg de peso, se observó severa dilatación y congestión de los vasos sanguíneos de la zona cortical de medular del riñón; así como la presencia de focos hemorrágicos, lo cual pudo demostrarse por medio de las técnicas antes mencionadas. Sólo uno de los animales intoxicados con la concentración de 3 g de benceno/kg de peso, presentó además cilindros de proteínas en el espacio capsular de los corpúsculos y en túbulos renales de la corteza y médula renales, lo cual se demostró con las técnicas de MSB y PAP. Riñón de rata testigo. Se observa la histología normal de: 1) Corteza: A) Corpúsculo renal (Glomérulo, Cápsula de Bowman y Espacio capsular), B) Túbulos contorneados proximales y C) Túbulos contorneados distales; 2) Médula: (Asas de Henle). Técnica de PAP. 10x Riñón de rata intoxicada con 1 g de benceno/kg de peso, sacrificada 48 h después. Corteza: A) Severa dilatación y congestión de los vasos sanguíneos. B) Focos hemorrágicos severos. Técnica de PAP. 10x Riñón de rata intoxicada con 1 g de benceno/kg de peso, sacrificada 48 h después. Médula: A) Severa vasodilatación y congestión, B) Focos hemorrágicos severos. Técnica de PAP. 10x Riñón de rata tratada con con 2 g de benceno/kg de peso, sacrificada 72 h después. Médula: A) Severa vasodilatación y congestión. B) Focos hemorrágicos severos. Técnica Tricrómica de Masson. 40x Riñón de rata expuesta a 3 g de benceno/kg de peso, sacrificada 48 h después. Corteza: A) Severa dilatación y congestión de los vasos sanguíneos. B) Focos hemorrágicos severos. Técnica de MSB. 40x Riñón de rata intoxicada con 3 g de benceno/kg de peso, sacrificada 72 h después. Corteza: Cilindros de proteínas en: A) El espacio capsular de los corpúsculos renales. B) Túbulos renales. Técnica de MSB. 10x Riñón de rata expuesta a 3 g de benceno/kg de peso, sacrificada 72 h después. 15 ppm de formaldehído. Médula: A) Severa dilatación y congestión de los vasos sanguíneos. B) Focos hemorrágicos severos. Técnica de MSB. 10x Riñón de rata expuesta a 3 g de benceno/kg de peso, sacrificada 72 h después. Médula: Cilindros de proteínas en túbulos renales (flecha). Técnica de MSB. 10x DISCUSIÓN No es posible lograr un desarrollo sustentable si no se cuenta con un población sana. A su vez, la salud de la población, es el resultado de múltiples interacciones físicas, biológicas, económicas, sociales y ambientales, de ahí que, si las condiciones en que las que se encuentran estos factores son favorables, también lo será la salud de la población. Las personas están expuestas a los efectos de sustancias químicas presentes en el aire que respiran, las más propensas a sufrir efectos tóxicos de los contaminantes son las que están en contacto con estos productos en el sitio de trabajo, porque a menudo reciben dosis mayores de ellos que la población en general. A pesar de ello, existe una gran desinformación tanto a nivel público como político y académico respecto a las exposiciones de la población a contaminantes. Es importante realizar un estudio sobre la toxicidad del benceno como contaminante ambiental, debido a los escasos estudios realizados en México acerca de este compuesto a pesar de la gama tan amplia de usos que se le dan. La mayoría de los investigadores han orientado sus trabajos hacia el estudio de trastornos neuropsíquicos, reacciones alérgicas, sintomatología y sobre todo los daños causados por el benceno a nivel de vías respiratorias superiores e inferiores. De ahí la importancia de investigar el daño que produce en otros órganos como corazón y riñones. En el corazón se encontraron daños relacionados con insuficiencia cardiaca congestiva, la cual es un estado fisiopatológico que resulta cuando se altera la función cardiaca, haciendo que el corazón sea incapaz de mantener un gasto cardiaco suficiente para las necesidades metabólicas son: disminución del gasto sistólico inferior al retorno venoso, lo que origina disminución del llenado del sistema arterial y estancamiento de la sangre en el sistema venoso. Lo anterior justifica la dilatación y congestión de los vasos sanguíneos encontrados en el corazón de las ratas intoxicadas con las tres concentraciones de benceno, cabe señalar que estas lesiones no fueron dosis-dependientes, sino severas desde la dosis de intoxicación más baja. La insuficiencia cardiaca también da lugar a la congestión pasiva como un fenómeno sistémico. La congestión pasiva es el aumento en la cantidad de sangre dentro del aparato circulatorio con dilatación de los vasos microscópicos. La congestión de los lechos capilares está muy relacionada con la aparición de edema, que consiste en la acumulación excesiva de líquido en el espacio extracelular debido a la extravasación a través de los capilares que han perdido su capacidad de barrera favoreciendo la salida de líquido. Como parte del proceso inflamatorio se produce edema, el cual no se observó en los vasos sanguíneos tanto de corazón como de riñones de las ratas intoxicadas con las tres dosis de benceno. Esto se debe probablemente a que se llevó a cabo un proceso de reparación celular, el cual generalmente implica dos procesos diferentes: 1) la regeneración, que es la sustitución del tejido lesionado por células parenquimatosas del mismo tipo y 2) la sustitución por tejido conjuntivo que en su estado permanente constituye una cicatriz. La fibrosis observada en el miocardio de los animales tratados con la dosis de 3 g de benceno/kg de peso se debe al proceso de cicatrización que se llevó a cabo. La fibrosis es la producción de fibras colágenas como parte del proceso de cicatrización o reconstrucción celular. En los primeros días después de la lesión, se presenta edema, el cual continua con un aumento de mucopolisacáridos ácidos. Después se inicia el descenso en loa cantidad de edema y en la concentración de mucopolisacáridos. Empiezan a parecer fibrillas reticulares con tendencia a disponerse en dirección perpendicular a los vasos. Posteriormente esas fibrillas se fusionan y constituyen abundantes haces de fibras colágenas acidófilas. Otra de las lesiones observadas en miocardio, es la presencia de focos hemorrágicos, que también se deben básicamente a una congestión intensa seguida por extravasación de eritrocitos, lo cual se denomina diapédesis de hematíes, que es la salida de sangre del interior del aparato circulatorio a los tejidos vecinos. Este tipo de lesión tampoco fue dosis dependiente. La hemólisis extravascular puede tener lugar si se lesionan los eritrocitos. El eritrocito y su membrana son sensibles a la agresión por oxidantes exógenos y endógenos. En condiciones normales, el glutation reducido (GSG) intracelular inactiva a estos oxidantes, pero la exposición al fármaco produce la oxidación de GSH a glutation, a través de la producción de H2O2. como la regeneración de GSH está dificultada en las células con déficit de glucosa-6-fosfato deshidrogenasa (G6PD), el peróxido de hidrógeno se acumula y lesiona otros elementos de los hematíes. Cuando la hemoglobina se oxida, se desnaturaliza formando precipitados (cuerpos de Heinz) en el interior de la célula. Estos cuerpos se pegan a la membrana disminuyendo la plasticidad del eritrocito y provocando la pérdida de la membrana. Esta lesión sólo se encontró en el miocardio de los animales intoxicados con la concentración de 2 g de benceno/kg de peso, debido probablemente a su sensibilidad de esta sustancia. La insuficiencia cardiaca congestiva afecta principalmente a los pulmones, pero también se encuentran lesionados otros órganos como: riñones, hígado, bazo, sistema portal, tejido subcutáneo y cerebro. La disminución del gasto cardiaco causa disminución del caudal sanguíneo renal. Esta disminución activa el sistema nervioso simpático y el sistema de renina-angiotensina, el que a su vez estimula la secreción de aldosterona y produce retención de agua y sal. Con ello aumenta el volumen sanguíneo total; de ahí que en corteza y médula renales de las ratas tratadas con las tres dosis de benceno se observaron vasos sanguíneos dilatados y congestionados. En los riñones que ya están bajo la influencia de la hipoperfusión, relacionada con el estado de shock o con el estrechamiento arteriolar de la hipertensión, la disminución del gasto cardiaco puede producir nefrotoxicidad, causada por la ingestión, inyección o inhalación de algún agente tóxico que lesiona de forma directa a las células tubulares y en la cual es notable la presencia de cilindros de proteínas en los tubos contorneados distales y los conductos colectores, dichos cilindros consisten en proteína de Tamm - Horsfall que en estado normal es secretada por el epitelio tubular. Este daño coincide con el encontrado en uno de los animales de experimentación el cual fue expuesto a 3 g de benceno/kg de peso, probablemente no se encontró este tipo de lesión en los demás animales debido a su sensibilidad de los animales ante la intoxicación con benceno. Además de que la necrosis tubular aguda es una causa fundamental de la insuficiencia Renal Aguda (IRA), ésta a su vez está asociada con la interrupción brusca de la función renal, acompañada a menudo de intensa oliguria, o más raramente de anuria, uno de los síntomas reportados por intoxicación con benceno. Por lo tanto se concluye que las lesiones histológicas encontradas en el corazón de las ratas de experimentación fueron severa congestión y dilatación de los vasos sanguíneos, severos focos hemorrágicos, fibrosis y lisis de eritrocitos. La presencia de dilatación y congestión vasculares, así como de focos hemorrágicos en corazón no es dependiente de la dosis de benceno empleada. La fibrosis y la lisis eritrocitaria sólo se encontraron en miocardio de uno de los animales expuestos a 3 g de benceno/kg y en otro expuesto a 2 g de benceno/kg respectivamente. No se observó la presencia de edema en los vasos sanguíneos corazón de las ratas tratadas con las tres dosis de benceno. Los procesos patológicos que se presentaron en corteza y médula renales de las ratas de experimentación fueron: severa dilatación y congestión de los vasos sanguíneos, focos hemorrágicos severos, así como la presencia de cilindros de proteínas en el espacio capsular de los corpúsculos y en túbulos renales. La dilatación y congestión de los vasos sanguíneos y los focos hemorrágicos en corteza y médula renales no son dependientes de las dosis de benceno utilizadas. La presencia de cilindros de proteínas en el espacio capsular de los corpúsculos y en túbulos de la corteza y médula renales, sólo se encontró en uno de los animales intoxicados con la concentración más alta de benceno. No se observó edema en los vasos sanguíneos de corteza y médula renales de las ratas tratadas con las tres dosis de benceno. Se corrobora que el benceno es citotóxico a nivel de miocardio y parénquima renal. EN BAZO E HÍGADO • Solamente las ratas tratadas con las diferentes dosis de benceno (1, 2 ó 3 g/kg de peso), presentaron alteraciones histológicas significativas tanto en la pulpa esplénica como en el parénquima hepático. • En la pulpa blanca del bazo se observó disminución en la celularidad del tejido linfoide (linfopoyesis disminuída). • La pulpa roja del bazo presentó lisis eritrocitaria. • El grado de ambas lesiones se incrementó con el aumento de la dosis de benceno (dosis-dependiente). • Se concluye que el benceno tiene efecto citotóxico a nivel de las células precursoras de las células maduras del tejido linfoide. • En el parénquima hepático se observó: vacuolización de los hepatocitos congestión o éxtasis de la vena centrolobulillar y de los capilares sinusoides, infiltrado inflamatorio de tipo crónico, presencia de núcleos pleomóficos e hipercrómicos y hemosiderina en el citoplasma de las células Kupffer. • El infiltrado inflamatorio y la congestión de los vasos hepáticos no aumentó conforme a la dosis de benceno. • La vacuolización de los hepatocitos se extendió hacia el centro del parénquima conforme aumentó la dosis de benceno. • La cantidad de núcleos pelomórficos e hipercrómicos fue mayor a la dosis más alta. • La hemosiderina en el citoplasma de las células de Kiupffer no fue dosisdependiente. • Se concluye que el benceno produce daño a nivel de parénquima hepático a partir de la dosis más baja administrada a las ratas, sin embargo dicho daño es reversible dada la regeneración morfológica observada en este órgano. EN OVARIOS, OVIDUCTOS, ÚTERO Y VAGINA • No se demostró efecto citotóxico del benceno en ovario, oviducto, útero y vagina en las ratas experimentalmente con la dosis de 1, 2 ó 3/kg de peso). • Se concluye que en el ovario no hubo alteración a nivel de desarrollo folicular ni la producción de gametos sexuales femeninos por lo que el benceno no afecta el ciclo sexual de las ratas hembra. EN TESTÍCULOS, EPIDÍDIMOS, CONDUCTOS DEFERENTES Y PRÓSTATA • El benceno fue citotóxico a nivel testicular. Produjo disminución en la producción de espermatozoides, disminución o inhibición en el número de las células de Leydig y fibrosis intersticial. • La disminución en la producción de espermatozoides puede explicarse morfológicamente por la disminución en el número de las células de Leydig o por la producción de la testosterona que en la hormona que estimula las últimas etapas de la espermatogénesis. • Los resultados mencionados sugieren que el benceno puede causar disminución en la producción de gametos sexuales masculinos. • En los conductos que participan en el transporte de espermatozoides (epidídimo y conducto deferente), el benceno no tienen efecto citotóxico. EN PÁNCREAS Y GLÁNDULAS SUPRARRENALES • El benceno administrado a ratas Wistar en concentraciones de 1, 2 ó 3 g/kg de peso no causó daño macroscópico ni histológico en órganos como páncreas y glándulas suprarrenales. • No produce alteración en el peso ni en el comportamiento de los animales a las dosis y vía de administración utilizada. • Para experimentos posteriores se sugiere aumentar la dosis de benceno y/o el tiempo de intoxicación de los animales. EN TIMO • El benceno es citotóxico a nivel tímico. • Los procesos patológicos que se presentaron en los lobulillos del timo fueron: dilatación y congestión vasculares, desarreglo en la distribución de los timocitos corticales y medulares, en la zona medular hubo: ausencia de corpúsculos de Hassall, presencia de células grandes, células binucleadas, infiltrado inflamatorio de tipo crónico y huecos tisulares. • La ditatación y congestión vasculares así como el desarreglo en la distribución de los timocitos fueron dosis dependientes. La ausencia de Corpúsculos de Hassall se observó en todos los animales de experimentación; el resto de las lesiones sólo se observaron en las ratas tratadas con la dosis más alta de benceno. • Los cambios vasculares presentes en este órgano pudieron deberse al proceso inflamatorio de tipo crónico presente sobre todo en las ratas intoxicadas con la dosis de 3 g de benceno/kg de peso. • Algunos de los animales tratados con la dosis de 3 g de benceno/kg de peso presentaron deplesión linfocítica en la médula de los lobulillos, lo cual explica la presencia de huecos tisulares y signos de regeneración linfocítica dados por la presencia de linfoblastos y células binucleadas. Bazo de ratas intoxicadas experimentalmente con la dosis de 1 g/de benceno/kg de peso. Se observa: a) disminución leve en la celularidad del tejido linfoide nodular alrededor de la arteria central y b) lisis eritrocítica. Técnica Hematoxilina-Eosina. Aumento 4x Bazo de ratas intoxicadas experimentalmente con 2 g de benceno/kg de peso. Se observa: a) disminución moderada del tejido linfoide nodular, b) incremento en la lisis de los eritrocitos. Técnica Hematoxilina-Eosina. Aumento 4x Bazo de ratas intoxicadas experimentalmente con 3 g de benceno/kg de peso. Se observa: a) destrucción severa del tejido linfoide nodular, b) lisis eritrocitaria severa en la pulpa roja. Técnica Hematoxilina-Eosina. Aumento 4x Hígado de ratas intoxicadas experimentalmente con 1 g de benceno/kg de peso. Se observa: a) vacuolización de los hepatocitos subcapsulares, b) congestión de los capilares sinusoides, c) infiltrado inflamatorio crónico. Técnica HematoxilinaEosina. Aumento 10x Hígado de ratas intoxicadas experimentalmente con 2 g de benceno/kg de peso. Se observa: c) infiltrado inflamatorio de tipo crónico, 1) congestión de la vena centrolobulillar, 2) hemosiderina en el citoplasma de células de Kupffer, 3) reacción inflamatoria crónica. Técnica Hematoxilina-Eosina. Aumento 10x Hígado de ratas intoxicadas experimentalmente con 2 g de benceno/kg de peso. Se observa: 1) vacuolización de los hepatocitos, 2) núcleos pleomórficos. Técnica Hematoxilina-Eosina. Aumento 40x Hígado de ratas intoxicadas experimentalmente con 3 g de benceno/kg de peso. Se observa: 1) infiltrado inflamatorio de tipo crónico, 2) congestión de la vena centrolobulillar, 3) vacuolización de los hepatocitos. Técnica HematoxilinaEosina. Aumento 40x Hígado de ratas intoxicadas experimentalmente con 3 g de benceno/kg de peso. Se observa: 1) vacuolización de los hepatocitos, 2) núcleos pleomórficos. Técnica Hematoxilina-Eosina. Aumento 40x Testículo. Tejido intersticial de ratas intoxicadas con 1 g de benceno/kg de peso con fibrosis leve (A). Técnica Hematoxilina-Eosina. Aumento 10x Testículo de rata expuesta a 2 g de benceno/kg de peso. Obsérvese fibrosis moderada (B). Técnica Hematoxilina-Eosina. Aumento 10x Testículo de rata expuesta a 3 g de benceno/kg de peso. Obsérvese la fibrosis severa entre los túbulos seminíferos que contiene (C). Técnica HematoxilinaEosina. Aumento 10x Lobulillo tímico de rata intoxicada con de rata expuesta a 1 g de benceno/kg de peso. A) corteza, B) médula, C) vasodilatación y éstasis. Ausencia de Corpúsculos de Hassall en la médula del lobulillo. Técnica Hematoxilina-Eosina. Aumento 10x Timo de rata expuesta a la dosis 2 g de benceno/kg de peso. A) corteza, B) médula, C) aumento en la vasodilatación y estasis. Ausencia de Corpúsculos de Hassall medulares. Técnica Hematoxilina-Eosina. Aumento 10x Timo de rata intoxicada con la dosis de 3 g de benceno/kg de peso. A) corteza, B) médula, ambas con profundo desarreglo en la distribución de los timocitos, C) vasodilatación y estasis severas. Ausencia de Corpúsculos de Hassall medulares. Técnica Hematoxilina-Eosina. Aumento 10x Zona medular de un lobulillo tímico de rata tratada con la dosis de 3 g de benceno/kg de peso. Se observó: A) células grandes de aproximadamente 40 micras de diámetro, B) células binucleadas. Ausencia de Corpúsculos de Hassall Médula de un lobulillo tímico de rata tratada con la dosis de 3 g de benceno/kg de peso. Se observó: A) huecos tisulares, B) infiltrado inflamatorio de tipo crónico. Ausencia de Corpúsculos de Hassall. Técnica Hematoxilina-Eosina 40x CONCLUSIONES 1. Los órganos de todas las ratas testigos no presentaron alteraciones morfológicas, conservaron su morfología normal. 2. Los órganos del Sistema Respiratorio (tráquea y pulmón) de las ratas tratadas con benceno presentaron lesiones severas precancerosas, vasculares e inflamatorias como fueron: hiperplasia epitelial, metaplasia epidermoide, enfisema pulmonar, vasodilatación y congestión y reacción inflamatoria de tipo crónico. 3. Del Sistema Urinario se estudiaron los riñones de las ratas intoxicadas con las diferentes dosis de benceno y se demostró que esta última substancia fue citotóxica. Se presentaron lesiones precancerosas (hiperplasia mesangial) vasculares (dilatación y congestión de vasos sanguíneos capilares), e inflamatorias (de tipo crónico). 4. Del Sistema Linfático fueron estudiados bazo y timo, encontrándose en ambos, alteraciones histológicas severas. En bazo hubo linfopoyesis disminuída y lisis eritrocitaria. En timo se observaron lesiones vasculares, ausencia y Corpúsculos de Hassall, proceso inflamatorio de tipo crónico y linfopoyesis disminuída. 5. Los órganos estudiados del Sistema Reproductor Femenino de las ratas tratadas con benceno no presentaron lesiones histológicas. 6. Solamente en el testículo de los ratas expuestas a benceno presentó daños histológicos, como: disminución en la producción de espermatozoides y en el número de células de Leydig. En los conductos que participan en el transporte de espermatozoides, epidídimos y conductos deferentes, así como en próstata, el benceno no ejerció efecto tóxico alguno. 7. El hígado, que es una glándula anexa al tubo digestivo presentó vacuolización de los hepatocitos y lesiones vasculares e inflamatorias. 8. El páncreas y las glándulas suprarrenales, órganos pertenecientes al Sistema Endocrino conservaron su morfología normal. 9. Del Sistema Cardiovascular se estudió el corazón de las ratas de experimentación, encontrándose a nivel de miocardio daños vasculares y necróticos (necrosis de coagulación de las fibras musculares estriadas cardiacas), así como inflamatorios de tipo crónico. 10. En el cerebro, cerebelo y tallo cerebral (Sistema Nervioso Central), el benceno sí causó alteraciones histológicas severas. En el cerebro se presentaron lesiones vasculares y de tipo inflamatorio (edema vasógeno). En cerebelo también hubo lesiones vasculares y hemorrágicas. El tallo cerebral de las ratas tratadas con benceno mostró lesiones de tipo vascular e inflamatorias. 11. Como puede observarse el benceno ejerció efecto citotóxico en varios órganos de diversos sistemas orgánicos de las ratas intoxicadas, lo cual trae como consecuencia disfunción orgánica importante que pone en riesgo la vida. CITOTOXICIDAD PRODUCIDA POR EL TOLUENO EN TRÁQUEA Y PULMONES DE RATAS RESULTADOS El análisis microscópico realizado en tráquea y pulmones de las ratas testigo y de las intoxicadas con las tres dosis de tolueno, demostró lo siguiente: TRÁQUEA La estructura histológica de las capas que constituyen la tráquea (mucosa, submucosa, cartílago hialino y adventicia) de todas las ratas testigos fue normal. (Cuadro 1, figura 1). En las capas mucosa y submucosa de tráquea de las ratas intoxicadas con las dosis únicas correspondientes a 1, 2 y 3 g de tolueno/kg de p.c. se observaron las siguientes alteraciones histológicas: hiperplasia y metaplasia del epitelio de revestimiento, inflamación crónica en la lámina propia, las glándulas traqueales presentaron hiperplasia e hipertrofia. (Cuadro No. 1). Las ratas intoxicadas con la dosis única de tolueno correspondiente a 1 g/kg presentaron en la capa mucosa hiperplasia moderada en el epitelio de revestimiento e inflamación crónica moderada en la lámina propia (figura 2). Lo mismo se observó en los animales tratados con la dosis única de 2 g/kg, observándose además metaplasia epitelial moderada (figuras 3 y 4). En las ratas intoxicadas con 3 g/kg de tolueno sólo se observó metaplasia epitelial severa, inflamación crónica moderada en la lámina propia, varias glándulas traqueales presentaron morfología normal y sólo en algunas presentaron hiperplasia e hipertrofia de su epitelio (figuras 5 y 6). Los tiempos de exposición (48 ó 72 h) posteriores a la administración de las 3 dosis únicas de tolueno no influyeron en el grado de las lesiones observadas. PULMONES La estructura histológica del parénquima pulmonar de todas las ratas testigo fue normal. (Cuadro No. 2, figura 7). Las alteraciones histológicas presentes en las ratas intoxicadas con las 3 dosis de tolueno se observaron únicamente en bronquiolos, vasos sanguíneos y paredes alveolares fueron las siguientes: en la capa mucosa de los bronquiolos formaron papilas, en el epitelio bronquiolar hubo hiperplasia y metaplasia, inflamación crónica en la lámina propia, lesiones vasculares como dilatación, congestión y lisis eritrocítica e inflamación crónica interalveolar (Cuadro No. 2). En todas las ratas intoxicadas con tolueno en la capa mucosa hubo formación de papilas en los bronquilos que se observaron como elevaciones del epitelio de revestimiento y de la lámina propia subyacente. (figuras 8, 9, 12, 13, 16, 17, 18). La hiperplasia epitelial (aumento en el número de células) también se observó en todos los animales tratados con tolueno, siendo leve en los tratados con la dosis correspondiente a 1 g/kg de p.c. (figuras 8 y 9) y severa en los tratados con 2 g/kg (figuras 12 y 13) o con 3 g/kg (figuras 16 y 17). La metaplasia epitelial (cambio de un epitelio maduro por otro), solamente se observó en las ratas tratadas con la dosis correspondiente de 3 g/kg (figuras 16 y 18). La inflamación crónica en la lámina propia de los bronquiolos fue moderada en los animales tratados con la dosis de 2 g/kg (figuras 12 y 13) y severa con la dosis de 3 g/kg (figuras 16 y 18). En los vasos sanguíneos del parénquima pulmonar de todas las ratas intoxicadas se observó dilatación y congestión, siendo el grado de lesión severa en los tratados con la dosis más alta (figuras 18 y 19) y en el resto de los animales fue moderada (figuras 8, 10, 11, 14, 15). Hubo lisis eritrocítica severa en todos los animales a los que se les administró las diferentes dosis de tolueno (figuras 8, 10, 11, 14, 15, 18 y 19). La inflamación crónica interalveolar fue severa en los tratados con 3 g/kg de tolueno y en el resto de los animales fue moderada. Los tiempos de exposición (48 ó 72 h) posteriores a la administración de las dosis únicas de tolueno no influyeron en el grado de las lesiones observadas. Figura 1. Tráquea de rata testigo con estructura histológica normal, se observa el epitelio cilíndrico seudoestratificado ciliado, la lámina propia, cartílago hialino y adventicia. Técnica hematoxilina-eosina. Figura 2. Tráquea de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa hiperplasia moderada del epitelio de revestimiento, en la lámina propia hay reacción inflamatoria crónica moderada. Técnica hematoxilina-eosina. Figura 3 . Tráquea de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observan zonas de hiperplasia moderada y otras de metaplasia moderada en el epitelio de revestimiento. Reacción inflamatoria crónica moderada en la lámina propia. Técnica hematoxilina-eosina. Figura 4 . Tráquea de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observan zonas de hiperplasia moderada y otras de metaplasia moderada en el epitelio de revestimiento. Reacción inflamatoria crónica moderada en la lámina propia. Técnica hematoxilina-eosina Figura 5. Tráquea de rata intoxicada con 3 g de tolueno/kg. Se observa metaplasia severa del epitelio de revestimiento. Inflamación crónica moderada en la lámina propia y aumento en el tamaño de las glándulas traqueales en la submucosa. Cartílago hialino, músculo de Reisseinsen y adventicia con histología normal. Técnica hematoxilina-eosina. Figura 6. Tráquea de rata intoxicada con 3 g de tolueno/kg. Se observa metaplasia severa del epitelio de revestimiento. Inflamación crónica moderada en la lámina propia y aumento en el tamaño de las glándulas traqueales en la submucosa. Cartílago hialino, músculo de Reisseinsen y adventicia con histología normal. Técnica hematoxilina-eosina. Figura 7. Pulmón de rata testigo. A) bronquio intrapulmonar, B) bronquiolo, C) alvéolos pulmonares. Técnica hematoxilina-eosina. Figura 8. Pulmón de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa bronquiolo con formación de papilas severa en la capa mucosa e hiperplasia epitelial leve. Dilatación y congestión vasculares moderadas y lisis eritrocítica severa. Inflamación crónica interalveolar moderada. Técnica hematoxilina-eosina. Figura 9. Pulmón de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa bronquiolo con formación de papilas severa en la capa mucosa e hiperplasia epitelial leve. Dilatación y congestión vasculares moderadas y lisis eritrocítica severa. Inflamación crónica interalveolar moderada. Técnica hematoxilina-eosina. Figura 10. Pulmón de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa dilatación y congestión vasculares moderadas, lisis eritrocítica severa. Inflamación crónica interalveolar moderada. Técnica hematoxilina-eosina. Figura 11. Pulmón de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa dilatación y congestión vasculares moderadas, lisis eritrocítica severa. Inflamación crónica interalveolar moderada. Técnica hematoxilina-eosina. Figura 12. Pulmón de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa un bronquiolo con formación de papilas e hiperplasia severa en el epitelio de revestimiento. Inflamación crónica moderada en la lámina propia. Técnica hematoxilina-eosina. Figura 13. Pulmón de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa un bronquiolo con formación de papilas e hiperplasia severa en el epitelio de revestimiento. Inflamación crónica moderada en la lámina propia. Técnica hematoxilina-eosina Figura 14. Pulmón de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa dilatación y congestión vascular severa (++), lisis eritrocítica severa. Reacción inflamatoria crónica interalveolar severa. Técnica hematoxilina-eosina. Figura 15. Pulmón de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa dilatación y congestión vascular severa (++), lisis eritrocítica severa. Reacción inflamatoria crónica interalveolar severa. Técnica hematoxilina-eosina. Figura 16. Pulmón de rata intoxicada con la dosis única de 3 g de tolueno/kg. Se observa en un bronquiolo con formación de papilas y zonas de hiperplasia y metaplasia epitelial severa, reacción inflamatoria crónica severa en la lámina propia e interalveolar. Técnica hematoxilina-eosina. Figura 17. Pulmón de rata intoxicada con la dosis única de 3 g de tolueno/kg. Se observa en un bronquiolo con formación de papilas y zonas de hiperplasia y metaplasia epitelial severa, reacción inflamatoria crónica severa en la lámina propia e interalveolar. Técnica hematoxilina-eosina. Figura 18. Pulmón de rata intoxicada con la dosis única de 3 g de tolueno/kg. Se observa en un bronquiolo formación de papilas y zonas de hiperplasia y metaplasia epitelial severas, inflamación crónica severa en la lámina propia e interalveolar, dilatación y congestión vasculares severas, lisis eritrocítica severa. Técnica hematoxilina-eosina. Figura 19. Pulmón de rata intoxicada con la dosis única de 3 g de tolueno/kg. Se observa en un bronquiolo formación de papilas y zonas de hiperplasia y metaplasia epitelial severas, inflamación crónica severa en la lámina propia e interalveolar, dilatación y congestión vasculares severas, lisis eritrocítica severa. Técnica hematoxilina-eosina. DISCUSIÓN DE RESULTADOS Como se puede apreciar, la tráquea y pulmones de las ratas testigo presentaron morfología normal, lo que indica que las alteraciones histológicas observadas en los animales intoxicados con tolueno se debieron al efecto del este tóxico. En el epitelio de revestimiento traqueal y bronquiolar hubo formación de papilas y la presencia de un trastorno adquirido reversible del crecimiento celular con formación excesiva de tejido (hiperplasia). Otra alteración observada fue la metaplasia epidermoide, que es un trastorno adquirido y reversible en la diferenciación celular, en el cual un tejido adulto es sustituido por otro tejido adulto. Dichas lesiones pueden anteceder a un daño irreversible de tipo canceroso, ante el estímulo constante del contaminante. (19) En tráquea y pulmones de las ratas intoxicadas se observaron lesiones vasculares. Los vasos sanguíneos estuvieron dilatados y congestionados. Al respecto Egle y Hudgins, en 1992, encontraron insuficiencia cardiaca en ratas intoxicadas con tolueno cuyas consecuencias hemodinámicas son: aumento del llenado del sistema arterial y estancamiento en el sistema venoso, lo cual da lugar a congestión pasiva vascular, consistente en el aumento de la cantidad de sangre en los vasos sanguíneos, con dilatación de los vasos microscópicos, como consecuencia de una disminución del flujo venoso. La hemólisis intravascular y extravascular tiene lugar si se lesionan los eritrocitos. El eritrocito y su membrana son sensibles a la agresión por oxidantes exógenos y endógenos. En condiciones normales el glutatión reducido (GSH) intracelular inactiva estos oxidantes. Es probable que la exposición a tolueno produjera la oxidación del GSH a glutatión, a través de la producción de peróxido de hidrógeno, éste último se acumula y hace que la hemoglobina se oxide y desnaturalice, formando precipitados (cuerpos de Heinz), éstos se pegan a la membrana del eritrocito, disminuyendo su elasticidad y provocando pérdida de la membrana y salida de la hemoglobina. También se observó inflamación crónica en los órganos estudiados en todos los animales intoxicados con tolueno. La inflamación es la reacción de los tejidos vivos a todas las formas de lesión. El proceso inflamatorio destruye, diluye o contiene al agente dañino y prepara el camino para la reparación que es el proceso mediante el cual las células perdidas o destruídas son reemplazadas por células vivas. Si bien la inflamación y la reparación son procesos distintos, están entrelazados en la respuesta de los tejidos a la lesión. La reacción inflamatoria crónica se origina por estímulos lesivos que originan infiltración de células mononucleares (linfocitos, macrófagos y células plasmáticas) y proliferación de fibroblastos. La inflamación crónica puede seguir a la inflamación aguda o bien, la respuesta puede ser crónica desde el inicio, como sucedió en los animales intoxicados con tolueno. La reparación suele acompañar a la inflamación crónica y a menudo los fibroblastos y la colágena están entremezclados con células inflamatorias crónicas. En los animales intoxicados con tolueno no se observaron procesos de reparación, sería de interés repetir el experimento y aumentar los tiempos de exposición, para observar si la inflamación crónica se acentúa con el tiempo y se observan procesos de reparación tisular. (Robins, pags 29, 42, 43, 44) CONCLUSIONES Por lo observado, se puede decir que se comprobó que el tolueno tuvo efecto citotóxico en los órganos de estudio (tráquea y pulmones). En general, el grado de las lesiones observadas fue mayor en los animales intoxicados con la dosis correspondiente a 3 g de tolueno/kg de p.c. 1 2 2 3 3 4 5 6 7 8 (-) no se observó 3 2 0 Testigos 0 Testigos 1 72 48 72 48 72 48 72 48 Dosis Tiempo administrada de exposición tolueno h g/kg 1 Lote No. de S A -- -- moderada moderada moderada moderada -- -- severa severa moderada moderada -- -- -- -- Metaplasia moderada moderada moderada moderada moderada moderada -- Inflamación crónica -- O Hiperplasia C Lámina propia U Epitelio de Revestimiento M Normales o con hiperplasia e hipertrofia Normales o con hiperplasia e hipertrofia -- -- -- -- -- -- Glándulas Traqueales SUBMUCOSA CUADRO No. 1. ALTERACIONES HISTOLÓGICAS PRODUCIDAS POR TOLUENO EN LAS CAPAS MUCOSA Y SUBMUCOSA DE LA TRÁQUEA DE RATAS WISTAR HEMBRAS A DIFERENTES TIEMPOS DE EXPOSICIÓN. 1 2 2 3 3 4 5 6 7 8 (-) no se observó 3 2 0 Testigos 0 Testigos 1 72 48 72 48 72 48 72 48 Dosis de Tiempo de tolueno exposición administrada h g/kg 1 Lote No. severa severa severa severa severa severa -- -- severa severa severa severa leve leve -- -- severa severa -- -- -- -- -- -- severa severa moderada moderada -- -- -- -- Formación Hiperplasia Metaplasia Inflamación de papilas crónica LÁMINA PROPIA M U C O S A E P I T E L I O C A P A severa severa moderada moderada moderada moderada -- -- severa severa severa severa severa severa -- -- Dilatación Lisis y eritrocítica congestión VASOS SANGUÍNEOS severa severa moderada moderada moderada moderada -- -- Inflamación crónica interalveolar CUADRO No. 2. ALTERACIONES HISTOLÓGICAS PRODUCIDAS POR TOLUENO EN PULMONES DE RATAS WISTAR HEMBRAS A DIFERENTES TIEMPOS DE EXPOSICIÓN CITOTOXICIDAD PRODUCIDA POR EL TOLUENO EN HÍGADO E INTESTINO DELGADO DE RATAS RESULTADOS El análisis microscópico realizado en hígado e intestino delgado de las ratas testigo y de las intoxicadas con las 3 dosis de tolueno seleccionadas, demostró lo siguiente: HÍGADO La estructura histológica del parénquima hepático (lobulillos, espacios de Kiernan y vasos sanguíneos) de las ratas testigo fue normal (cuadro 1, figura 1). En el hígado de las ratas intoxicadas con las dosis únicas correspondientes a 1, 2 y 3 g de tolueno/kg de p.c. se observaron las siguientes alteraciones histológicas: dilatación y congestión en las venas centrolobulillares, así como en los vasos sanguíneos interlobulillares, en estos últimos además hubo lisis eritrocítica. (cuadro No. 1) En las venas centrolobulillares de todas las ratas tratadas con cualquiera de las 2 dosis únicas de tolueno (1 ó 2 g/kg), la dilatación y congestión vasculares fueron leves (figuras 2 y 4) y en las intoxicadas con 3 g de tolueno/kg fueron moderadas (figura 6). En los vasos sanguíneos interlobulillares de los animales intoxicados con la dosis de 1 g de tolueno/kg fueron moderadas (figura 3), con la dosis de 2 g/kg moderadas (figura 5) y con 3 g tolueno/kg severas (figuras 7 y 8). La lisis eritrocítica intravascular observada fue leve, presentándose sólamente en los tratados con 2 g/kg (figura 5) o con 3 g de tolueno/kg (figuras 7 y 8). Los tiempos de exposición (48 ó 72 h) posteriores a la administración de dosis únicas de tolueno no influyeron en el grado de las lesiones observadas. INTESTINO DELGADO La estructura histológica de las 4 capas que constituyen el intestino delgado (duodeno o yeyuno) de todas las ratas testigo fue normal (cuadro 2, figura 9). Las alteraciones histológicas observadas en la capa mucosa del intestino delgado de los animales tratados con cualquiera de las 3 dosis de tolueno correspondientes a 1, 2 ó 3 g/kg fueron las siguientes: necrosis y esfacelación de la porción distal de las vellosidades intestinales así como de las glándulas de Lieberkühn e inflamación crónica en la lámina propia (cuadro No. 2). En el resto de las capas histológicas intestinales (submucosa, muscular y serosa) la morfología fue normal. Por lo que respecta a la necrosis y esfacelación observadas en la porción distal de las vellosidades intestinales, el grado de lesión se incrementó con el aumento de la dosis correspondiente de tolueno, ya que en las ratas tratadas con 1 g/kg fueron leves (figuras 10 y 11), con 2 g/kg moderadas (figuras 12 y 13) y con 3 g/kg severas (figuras 14, 15, 16 y 17). Estas mismas lesiones se presentaron en las glándulas de Lieberkühn, solamente en las ratas tratadas con 2 g de tolueno/kg en las que fueron leves (figuras 12 y 13) y con 3 g/kg fueron severas (figuras 14, 15, 16 y 17). La inflamación crónica presentada en la lámina propia de todos los animales intoxicados fue leve (figuras 10 a 17). Los tiempos de exposición posteriores a la intoxicación de los animales con tolueno no influyeron en el grado de las lesiones observadas. Figura 1. Hígado de rata testigo. Lobulillo hepático en el que se observa la vena centrolobulillar, cordones de hepatocitos y capilares sinusoides. Técnica hematoxilina-eosina. Figura 2. Lobulillo hepático de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa dilatación y congestión leves en la vena centrolobulillar, los cordones de hepatocitos y capilares sinusoides conservan morfología normal. Técnica Hematoxilina-eosina. Figura 3. Parénquima hepático de rata intoxicada con 1 g de tolueno/kg. Se observa dilatación y congestión moderadas en un vaso sanguíneo interlobulillar. Técnica hematoxilina-eosina. Figura 4. Lobulillo hepático de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa dilatación y congestión leves en la vena centrolobulillar, los cordones de hepatocitos y capilares sinusoides conservan morfología normal. Técnica hematoxilina-eosina. Figura 5. Parénquima hepático de rata intoxicada con 2 g de tolueno/kg. Se observa dilatación y congestión moderadas en un vaso sanguíneo interlobulillar, lisis eritrocítica leve. Técnica hematoxilina-eosina. Figura 6. Lobulillo hepático de rata intoxicada con 3 g de tolueno/kg. Se observa dilatación y congestión moderadas en la vena centrolobulillar. Técnica hematoxilina-eosina. Figura 7. Hígado de rata intoxicada con la dosis única de 3 g de tolueno/kg. Dilatación y congestión severa de vasos sanguíneos interlobulillares, lisis eritrocítica leve. Técnica hematoxilina-eosina Figura 8. Hígado de rata intoxicada con la dosis única de 3 g de tolueno/kg. Dilatación y congestión severa de vasos sanguíneos interlobulillares, lisis eritrocítica leve. Técnica hematoxilina-eosina. Figura 9. Intestino delgado de rata testigo (duodeno). Se observa A) capa mucosa con glándulas de Lieberkühn, B) capas submucosa con glándulas de Brunner, C) capa muscular y D) capa serosa. Técnica hematoxilina-eosina. Figura 10. Yeyuno de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa necrosis y esfacelación leves de la porción distal de las vellosidades intestinales, reacción inflamatoria crónica leve en la lámina propia. La submucosa, muscular y serosa presentan morfología normal. Técnica hematoxilina-eosina Figura 11. Yeyuno de rata intoxicada con la dosis única de 1 g de tolueno/kg. Se observa necrosis y esfacelación leves de la porción distal de las vellosidades intestinales, reacción inflamatoria crónica leve en la lámina propia. La submucosa, muscular y serosa presentan morfología normal. Técnica hematoxilina-eosina Figura 12. Duodeno de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa necrosis y esfacelación de las vellosidades intestinales, iniciándose estas lesiones en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. Las capas submucosa, muscular y serosa presentan morfología normal. Técnica hematoxilina-eosina. Figura 13. Yeyuno de rata intoxicada con la dosis única de 2 g de tolueno/kg. Se observa necrosis y esfacelación moderadas de las vellosidades intestinales, iniciándose estas lesiones en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. Las capas submucosa, muscular y serosa presentan morfología normal. Técnica hematoxilina-eosina. Figura 14. Duodeno de rata intoxicada con 3 g de tolueno/kg. La necrosis y esfacelación severas se observan en las vellosidades intestinales y en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. En las capas histológicas restantes la morfología es normal. Técnica hematoxilina-eosina. Figura 15. Yeyuno de rata intoxicada con 3 g de tolueno/kg. La necrosis y esfacelación severas se observan en las vellosidades intestinales y en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. En las capas histológicas restantes la morfología es normal. Técnica hematoxilina-eosina. Figura 16. Yeyuno de rata intoxicada con 3 g de tolueno/kg. La necrosis y esfacelación severa se observan en las vellosidades intestinales y en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. En las capas histológicas restantes la morfología es normal. Técnica hematoxilinaeosina. Figura 17. Yeyuno de rata intoxicada con 3 g de tolueno/kg. La necrosis y esfacelación severa se observan en las vellosidades intestinales y en las glándulas de Lieberkühn, reacción inflamatoria crónica leve en la lámina propia. En las capas histológicas restantes la morfología es normal. Técnica hematoxilinaeosina. DISCUSIÓN Como se puede apreciar, el hígado y el intestino delgado de las ratas testigo presentaron histología normal, lo que indica que las alteraciones histológicas encontradas en las intoxicadas con las 3 dosis de tolueno (1, 2 y 3 g/kg de p.c.) se debieron a este tóxico. En el hígado de las ratas intoxicadas se observaron principalmente lesiones de tipo vascular. Los vasos sanguíneos estuvieron dilatados y congestionados. Al respecto Egle y Hudgins, en 1992, encontraron insuficiencia cardiaca en ratas intoxicadas con tolueno cuyas consecuencias hemodinámicas son: aumento del llenado del sistema arterial y estancamiento en el sistema venoso, lo cual da lugar a congestión pasiva vascular, consistente en el aumento de la cantidad de sangre en los vasos sanguíneos, con dilatación de los vasos microscópicos, como consecuencia de una disminución del flujo venoso. La hemólisis intravascular y extravascular tiene lugar si se lesionan los eritrocitos. El eritrocito y su membrana son sensibles a la agresión por oxidantes exógenos y endógenos. En condiciones normales el glutatión reducido (GSH) intracelular inactiva estos oxidantes. Es probable que la exposición a tolueno produjera la oxidación del GSH a glutatión, a través de la producción de peróxido de hidrógeno, éste último se acumula y hace que la hemoglobina se oxide y desnaturalice, formando precipitados (cuerpos de Heinz), éstos se pegan a la membrana del eritrocito, disminuyendo su elasticidad y provocando pérdida de la membrana y salida de la hemoglobina. En el intestino delgado (duodeno y yeyuno) se observó necrosis (muerte celular) y esfacelación (desde las vellosidades intestinales y en las glándulas de Lieberkühn). La necrosis puede definirse como los cambios morfológicos causados por la acción degradadota progresiva de enzimas sobre la célula lesionada mortalmente. Hay dos procesos esenciales que desencadenan los cambios de la necrosis: 1) digestión enzimática de la célula y 2) desnaturalización de proteínas. Las enzimas catalíticas se derivan de los lisosomas de las células muertas, la necrosis requiere de horas para desarrollarse. Los datos distintivos de la muerte celular se encuentran en el núcleo. Al morir la célula aparecen cambios nucleares adicionales. Puede readucirse la basofilia de la cromatina (cariolisis), cambio que quizá refleje la activación de la DNA asa conforme disminuye el pH de la célula. Posteriormente se presenta picnosis, caracterizada por disminución del volumen nuclear y basofilia aumentada. Aquí el DNA se condensa en una masa basófila sólida. Por último, en la cariorrexis, el núcleo picnótico se fragmenta y en uno o dos días el núcleo desaparece totalmente de la célula necrótica, en tanto que al citoplasma puede transformarse en una masa acidófila granular y opaca, tal y como se observó microscópicamente en la mucosa de estos órganos. La acidofilia (afinidad por los colorantes ácidos como la eosina) es originada, en parte, por la desnaturalización de las proteínas ectoplásmicas, y en parte por la activación de la ácidorribonucleasa que destruye al RNA citoplásmico normalmente basófilo. El tolueno pudo haber desencadenado todos estos cambios en las células que condujeron a la necrosis celular observada y a su desprendimiento (esfacelación) posterior de las capas más profundas de estos órganos, dichas células necróticas y sus restos quedan eliminadas por un proceso combinado de digestión y fragmentación enzimática con fagocitosis por leucocitos depuratores. (Robins, pags, 14, 15, 16, 17). También se observó inflamación crónica en la lámina propia del intestino de todos los animales intoxicados con tolueno. La inflamación es la reacción de los tejidos vivos a todas las formas de lesión. El proceso inflamatorio destruye, diluye o contiene al agente dañino y prepara el camino para la reparación que es el proceso mediante el cual las células perdidas o destruídas son reemplazadas por células vivas. Si bien la inflamación y la reparación son procesos distintos, están entrelazados en la respuesta de los tejidos a la lesión. La reacción inflamatoria crónica se origina por estímulos lesivos que originan infiltración de células mononucleares (linfocitos, macrófagos y células plasmáticas) y proliferación de fibroblastos. La inflamación crónica puede seguir a la inflamación aguda o bien, la respuesta puede ser crónica desde el inicio, como sucedió en los animales intoxicados con tolueno. La reparación suele acompañar a la inflamación crónica y a menudo los fibroblastos y la colágena están entremezclados con células inflamatorias crónicas. En los animales intoxicados con tolueno no se observaron procesos de reparación, sería de interés repetir el experimento y aumentar los tiempos de exposición, para observar si la inflamación crónica se acentúa con el tiempo y se observan procesos de reparación tisular. (Robins, pags 29, 42, 43, 44) CONCLUSIONES Por lo observado, se puede decir que se comprobó que el tolueno tuvo efecto citotóxico en los órganos de estudio (hígado e intestino delgado). En general, el grado de las lesiones observadas fue mayor en las ratas intoxicadas con la dosis correspondiente a 3 g de tolueno/kg de p.c. Testigo Testigo 1 1 2 2 3 3 1 2 3 4 5 6 7 8 (-) no se observaron Dosis única de tolueno administrada g/kg Lote No. 72 48 72 48 72 48 72 48 Tiempo de exposición h moderadas moderadas leves leves leves leves -- -- Dilatación y congestión en vena centrolobulillar severas severas moderadas moderadas moderadas moderadas -- Dilatación y congestión en vasos sanguíneos interlobulillares -- leves leves leves leves -- -- -- -- Lisis eritrocítica en vasos sanguíneos interlobulillares Cuadro No. 1. Alteraciones histológicas producidas por tolueno en hígado de ratas Wistar hembras a diferentes tiempos de exposición Testigo Testigo 1 1 2 2 3 3 1 2 3 4 5 6 7 8 (-) no se observaron Dosis administrada de tolueno g/kg Lote No. 72 48 72 48 72 48 72 48 Tiempo de exposición h severas severas moderadas moderadas leves leves -- Vellosidades intestinales Necrosis y esfacelación -- severas severas leves leves -- -- -- Glándulas de Lieberkühn Necrosis y esfacelación -- CAPA MUCOSA leve leve leve leve leve leve -- -- Inflamación crónica Lámina propia Cuadro No. 2. Alteraciones histológicas, observadas en la capa mucosa del intestino delgado (duodeno o yeyuno) en las ratas Wistar hembras intoxicadas con tolueno a diferentes tiempos de exposición. CITOTOXICIDAD PRODUCIDA POR EL TOLUENO EN BAZO Y TIMO DE RATAS De los contaminantes ambientales más comunes en las áreas urbanas se tienen los hidrocarburos como el tolueno, subproducto de la destilación del petróleo, el cual se encuentra mezclado con los hidrocarburos de la gasolina. Para el hombre, las fuentes de exposición al tolueno son su uso como disolvente de pinturas, colas, barnices y tintas de imprenta, como aditivo de la gasolina y en la síntesis químicas de compuestos orgánicos. Puesto que el tolueno es un contaminante ambiental y ocupacional al que están expuestos los humanos, nos propusimos, mediante estudios morfológicos investigar su citotoxicidad en bazo y timo de ratas intoxicadas, así como en otros órganos. Se trabajó con 48 ratas Wistar hembras de + 250 g de peso, se formaron 8 lotes de animales, 2 lotes testigos y 6 a los que se les administraron por vía intragástrica dosis únicas de 1, 2 ó 3 g de tolueno/kg de peso corporal, se mantuvieron con alimento y agua “ad libitum” y se sacrificaron 48 ó 72 h después de la intoxicación. Mediante la técnica de disección anatómica se obtuvieron el bazo y timo de cada uno de ellos. Se realizó el tratamiento histológico de los órganos hasta la obtención de laminillas histológicas teñidas con las técnicas de coloración hematoxilina-eosina, Papanicolaou (PAP), Martius Scarlet Blue (MSB) y Perls. Se realizó el análisis microscópico para determinar el efecto del tolueno en los órganos de estudio. Los procesos patológicos observados en bazo fueron: disminución en la celularidad del tejido linfoide en pulpa blanca y roja, dilatación y congestión vasculares, lisis eritrocítica y presenvia de gránulos de hemosiderina. En los lobulillos tímicos se presentó desorganización y disminución en la celularidad en corteza y médula, dilatación y congestión vasculares, lisis eritrocítica hemorragia, edema, gránulos de hemosiderina y ausencia de corpúsculos de Hassal. El grado de las lesiones fue dosis y tiempo de exposición dependientes. El tolueno tuvo efecto citotóxico en bazo y timo de las ratas intoxicadas a nivel de las células precursoras de los linfocitos y de los corpúsculos de Hassal, dando lugar a linfopoyesis disminuída, produjo también cambios vasculares drásticos. METODOLOGÍA Revisión Bibliográfica Selección de dosis de tolueno, vía de administración y tiempos de exposición Cálculo de las alícuotas de tolueno por administrar a las ratas de experimentación,representativas de las dosis seleccionadas (1. 2 y 3 g/kg de p.c.) Formación de lotes de animales de experimentación Administración de una dosis única de tolueno, por vía intragástrica, de las dosis seleccionadas a ratas Wistar hembra. tiempos de exposición: 48 y 72 hs. Sacrificio de los animales y mediante la técnica de disección anatómica, obtención de bazo y timo Procesamiento histológico de los órganos. Técnicas de tinción: Hematoxilina-eosina, Martius Scarlet Blue (MSB), Papanicolaou (PAP) y Perls Obtención, discusión y conclusiones de resultados Lobulillos tímicos de ratas testigos con histología normal. A) corteza, B) médula, C) corpúsculos de Hassal. Técnica Hematoxilina-eosina Timo de rata intoxicada con la dosis única de 1 g de tolueno/kg de p.c. y 48 h de exposición. Técnica Papanicolaou Timo de ratas intoxicadas con la dosis única de 1 g de tolueno/kg de p.c. y 72 h de exposición. Técnica Papanicolaou Timo de ratas intoxicadas con la dosis única de 2 g de tolueno/kg de p.c. y 48 h de exposición Timo de ratas intoxicadas con la dosis única de 2 g de tolueno/kg de p.c. y 72 h de exposición. Técnicas Papanicolaou (arriba) Técnica de Masson (abajo) Timo de ratas intoxicadas con la dosis única de 3 g de tolueno/kg de p.c. y 72 h de exposición. Técnias: Martius Scarlet blue (arriba) Papanicolaou (abajo) Bazo de rata testigo con histología normal. A) pulpa blanca, B) pulpa roja, (→) arteriola central. Técnica hematoxilina-eosina. Bazo de rata intoxicada con la dosis única de 1 g de tolueno/kg de p.c. y 48 h de exposición. Técnica Hematoxilina-eosina Bazo de rata intoxicada con la dosis única de 1 g de tolueno/kg de p.c. y 72 h de exposición. Técnica Hematoxilina-eosina Bazo de rata intoxicada con la dosis única de 2 g de tolueno/kg de p.c. y 48 h de exposición. Técnica Hematoxilina-eosina Bazo de rata intoxicada con la dosis única de 2 g de tolueno/kg de p.c. y 72 h de exposición. Técnica Hematolina-eosina Bazo de ratas intoxicadas con la dosis única de 3 g de tolueno/kg de p.c. y 48 ó 72 h de exposición. Técnica Perls - 0.0 48 72 48 72 48 72 0.0 1 1 2 2 3 3 Severa Severa Moderada Leve - - - B Disminución de la celularidad Severa (6+) Severa (6+) Severa (5+) Moderada (4+) Moderada (3+) Leve - C Diltación y congestión vasculares Moderada (4+) Moderada (4+) Moderada (3+) - - - - D Lisis eritrocítica El grado de lesión se representa con: (+, 3+, 4+, 5+ y 6+) Con las letras A a G y flechas se localizan las lesiones en las fotografías Severa (6+) Severa (6+) Severa (5+) Moderada Leve (+) Leve (+) A Desorganización de la celularidad Tiempo de exposición Hs Dosis de tolueno administrada mg/kg de p.c. Moderada (4+) Moderada (4+) Moderada (3+) - - - - E Hemorragia Severo (6+) Severo (6+) Severo (5+) Moderado (4+) Moderada (3+) - - F Edema Moderada (4+) Moderada (4+) No hay No hay No hay No hay - Moderada (3+) No hay No hay Presentes G Ausencia de corpúsculos de Hassall - - - (flechas) Gránulos de Hemosideri-na CUADRO NO. 1. CITOTOXICIDAD PRODUCIDA POR TOLUENO EN TIMO DE RATAS HEMBRA 48 72 48 72 48 72 0.0 1 1 2 2 3 3 Severa (3+) Severa (3+) Severa (+) Moderada Leve (2+) Leve (+) No se presentó Disminución de la celularidad de pulpa blanca y pulpa roja A C B Severa (3+) Severa (3+) Severa (+) Moderada No se presentaron No se presentaron Severa (3+) Severa (3+) Severa (+) Moderada (3+) Moderada (2+) Moderada (+) No se presentó Lisis eritrocítica Diltación y congestión vasculares No se presentaron El grado de lesión se representa con: (+, 2+ ó 3+) Con las letras A a C y flechas se localizan las lesiones en las fotografías Tiempo de exposición Hs Dosis g de tolueno/kg de p.c. Severa (3+) Severa (3+) Severa (+) Moderada Leve (2+) Leve (+) No se presentaron Presencia de gránulos de hemosiderina CUADRO NO. 2. ALTERACIONES HISTOLÓGICAS CAUSADAS POR TOLUENO (CONTAMINANTE AMBIENTAL), EN BAZO DE RATAS HEMBRA CONCLUSIONES Se concluye que el tolueno tiene efecto citotóxico en timo y bazo, a nivel de las células precursoras de los linfocitos maduros, dando esto lugar a linfopoyesis disminuida; así como a cambios vasculares drásticos CITOTOXICIDAD PRODUCIDA POR EL TOLUENO EN ESÓFAGO Y ESTÓMAGO DE RATAS El desarrollo tecnológico ha traído consigo grandes problemas de contaminación, que ponen en riesgo la condición de vida de todas las especies, incluyendo al hombre; por lo que se hace indispensable desarrollar investigaciones ambientales, al mismo tiempo que se logran avances en la tecnología. La contaminación atmosférica ha despertado gran preocupación, debido a los altos niveles alcanzados sobre todo en las grandes urbes como la ciudad de México y su área metropolitana. El tolueno es un contaminante ambiental y ocupacional, las poblaciones expuestas presentan lesiones orgánicas que provocan serios deterioros en la salud. Los objetivos del presente trabajo son: Determinar el efecto citotóxico producido por el tolueno en esófago y estómago de ratas intoxicadas experimentalmente y correlacionar los daños orgánicos observados con la sintomatología clínica que presentan las personas expuestas a este tóxico ambiental. En base a los niveles atmosféricos de tolueno existentes en la ciudad de México se realizó la selección de dosis (1, 2 ó 3 g/Kg de p.c.), las cuales se administraron por una sola vez y por vía intragástrica a 48 ratas Wistar hembras de 10 semanas de edad; los tiempos de exposición fueron de 48 ó 72 h. Los animales se sacrificaron con cloroformo y mediante la técnica anatómica de disección, se obtuvieron esófago y estómago de cada uno de ellos, mismos que se trataron histológicamente hasta la obtención de laminillas teñidas con la técnica de coloración: hematoxilina-eosina y Papanicolaou. Se realizó el análisis microscópico para determinar la citotoxicidad del tolueno en los órganos de estudio. METODOLOGÍA Revisión bibliográfica Selección de dosis, vía de administración y tiempos de exposición al tolueno Administración de dosis únicas de tolueno a los animales de experimentación Sacrificio de los animales de experimentación Tratamiento histológico de esófago y estómago obtenidos de las ratas de experimentación para su estudio microscópico Resultados Discusión de resultados Conclusiones Figura 1. Esófago de rata intoxicada con la dosis única de 1 g de tolueno/Kg de p.c. sacrificada 48 h después. A) Lámina propia con dilatación y congestión leves de vasos sanguíneos. Técnica PAP. Figura 2. Esófago de rata intoxicada con la dosis única de 1 g de tolueno/Kg de p.c. sacrificada 72 h después. A) Moderada dilatación y congestión de vasos sanguíneos en lámina propia. Técnica PAP. Figura 3. Esófago de rata intoxicada con la dosis única de 2 g de tolueno/Kg de p.c. sacrificada 48 h después. A) Moderada vasodilatación y congestión B) Capa adventicia vasodiltación y congestión moderadas. Técnica PAP. Figura 4. Esófago de rata intoxicada con la dosis única de 2 g de tolueno/Kg de p.c. sacrificada 72 h después. A) Moderada dilatación y congestión de vasos sanguíneos en la lámina propia. Técnica PAP. Figura 5. Esófago de rata intoxicada con la dosis de 3 g de tolueno/Kg de p.c. sacrificada 48 h después. A) Severa dilatación y congestión en vasos sanguíneos de la lámina propia. Técnica PAP. Figura 6. Esófago de rata intoxicada con la dosis de 3 g de tolueno/Kg de p.c. y sacrificada 72 h después. (A y B) dilatación y congestión severas en vasos sanguíneos de la lámina propia. Técnica PAP. Figura 7. Esófago de rata intoxicada con la dosis de 3 g de tolueno/Kg de p.c. sacrificada 72 h después. A) Severa dilatación y congestión de vasos sanguíneos en la capa adventicia. B) Severa inflamación crónica en capa adventicia. Técnica PAP. Figura 8. Estómago de rata intoxidada con la dosis única de 1 g de tolueno/Kg de peso y sacrificada 48 h después. En la mucosa se observa: A y C) Dilatación y congestión vasculares, B) eosinofilia leve. En la submucosa: D) eosinofilia leve. Técnica Papanicolaou Figuras 9 y 10. Estómago de ratas intoxicadas con la dosis única de 2 g de tolueno/Kg de peso y sacrificadas 48 h después. En la mucosa se observa: A) Necrosis y esfacelación leves, B) Hemorragia leve. En la submucosa: C) Hemorragia y eosinofilia moderadas. En la capa muscular: E) Hemorragia y eosinofilia moderadas. En la serosa: F) Diltación y congestión vasculares moderadas. Técnicas hematolina-eosina y Papanicolaou. Figura 11 y 12. Estómago de ratas intoxicadas con la dosis única de 2 g de tolueno/Kg de peso y expuestas durante 72 h. En la capa mucosa se observa: A) Necrosis y esfacelación leves de la capa mucosa, B) Hemorragia severa, C) eosinofilia leve. En la capa submucosa: D) eosinofilia leve. En la capa serosa: E) Dilatación y congestión vasculares leves. Técnicas Papanicolaou y MSB. Figura 13 y 14. Estómago de ratas intoxicadas con la dosis única de 3 g de tolueno/Kg de peso y sacrificadas 48 h después. En la capa mucosa se observa: A) Necrosis y esfacelación severas, B) Hemorragia moderada. En la capa submucosa: C) Inflamación moderada, D) Diltación y congestión vasculares moderadas, E) Eosinofilia moderada. En la capa serosa: H) vasodilatación y congestión moderadas. Técnicas hematoxilina-eosina y Papanicolaou. Figuras 15 y 16. Estómago de ratas intoxicadas con la dosis única de 3 g de tolueno/Kg de peso y sacrificadas 72 h después. En la capa mucosa se observa: A) Necrosis y esfacelación severas, B) Hemorragia severa, C) Inflamación moderada. En la capa submucosa: D) Hemorragia, E) Eosinofilia moderada, En la CONCLUSIONES El tolueno ejerció efecto citotóxico en esófago y estómago de las ratas de experimentación, el grado de las lesiones observadas fue proporcional al incremento de la dosis y puede explicar la sintomatología digestivas que presentan las personas expuestas a este tóxico ambiental y ocupacional. B) Formación de recursos humanos: Servicios Sociales Nombre del Alumno Isaid Viveros Hernández Rafael García Lucena Escuela ENCB ENCB Tesistas Isaid Viveros Hernández Rafael García Lucena Beatriz Meléndez Chávez Nancy Vidal García Claudia Arriaga López Víctor Maturano Jiménez ENCB ENCB ENCB ENCB ENCB FES, Zaragoza Los documentos comprobatorios se encuentran en cuanto se requieran a la disposición en el Laboratorio de Anatomía. Departamento de Morfología C) Difusión de Resultados Conferencias Nacionales: (14) 1. Citotoxicidad del benceno en bazo y timo de ratas. XXVII Congreso Nacional de Histología. Facultad de Ciencias de la UNAM. Octubre 2003 2. Estudio histopatológico en encéfalo de ratas intoxicadas con benceno. XXVII Congreso Nacional de Histología. Facultad de Ciencias de la UNAM. Octubre 2003 3. Evaluación histológica del efecto protector antiulcerante de la raíz de la planta diente de león (Taraxacum officinale) en estómago de ratas. XXVII Congreso Nacional de Histología. Facultad de Ciencias de la UNAM. Octubre 2003 4. Efecto de la semilla codo de fraile (Thevetia thevetioides) sobre el peso corporal en ratas hembras. V Congreso Mexicano de Etnobiología. Universidad Autónoma de Chapingo. Noviembre 2003 5. Efecto protector ulcerante del extracto de la corteza de Bocconia arborea S. Wats. V Congreso Mexicano de Etnobiología. Universidad Autónoma de Chapingo. Noviembre 2003 6. Histopatología en esófago y estómago de ratas intoxicadas con benceno. XXVIII Congreso Nacional de Histología Universidad Autónoma Metropolitana. Unidad Iztapalapa Octubre 2004 7. Determinación de la toxicidad producida por benceno en tráquea y pulmones de ratas. XXVIII Congreso Nacional de Histología Universidad Autónoma Metropolitana. Unidad Iztapalapa Octubre 2004 8. Estudio histológico del efecto protector antiulcerante de Malva parviflora en ratas. XXVIII Congreso Nacional de Histología Universidad Autónoma Metropolitana. Unidad Iztapalapa Octubre 2004 9. Determinación histológica del efecto antiinflamatorio de la planta Bocconia alborea de ratas. XXVIII Congreso Nacional de Histología Universidad Autónoma Metropolitana. Unidad Iztapalapa Octubre 2004 10. Estudio histológico del efecto protector antiulcerante de Malva parviflora de ratas. XXIV Jornadas de Químicos Clínicos. II Encuentro Regional. Hospital General de Centro Médico de Especialidades “La Raza”. Agosto 2005 11. Estudio histológico en sistema respiratorio de ratas intoxicadas con benceno. XXIV Jornadas de Químicos Clínicos. II Encuentro Regional. Hospital General de Centro Médico de Especialidades “La Raza”. Agosto 2005 12. Toxicidad producida por benceno en yeyuno e hígado de ratas. XXIV Jornadas de Químicos Clínicos. II Encuentro Regional. Hospital General de Centro Médico de Especialidades “La Raza”. Agosto 2005 13. Histopatología producida por benceno en riñones de ratas. XXIX Congreso Nacional de Histología Universidad Autónoma de Tlaxcala. Octubre 2005 14. Histopatología producida por el extracto acuoso de la planta medicinal Hypericum paniculatum H.B.K. en órganos de ratas. XXIX Congreso Nacional de Histología Universidad Autónoma de Tlaxcala. Octubre 2005 Los documentos comprobatorios se encuentran en cuanto se requieran a la disposición en el Laboratorio de Anatomía. Departamento de Morfología Conferencias Internacionales: (5) 1. Estudio toxicológico e histológico en ratón tratado con el colorante natural obtenido del duramen de Dalbergia congestiflora. VII Simposio de Botánica. Jardín Botánico Nacional Ciudad de la Habana Cuba. Junio 2003 2. Efecto protector antiulcerante de Taraxacum officinale Web en rata. VII Simposio de Botánica. Jardín Botánico Nacional Ciudad de la Habana Cuba. Junio 2003 3. Evaluación del efecto protector antiulcerante de Taxaracum officinale en ratas ulceradas con HCl y píloro ligado. 4th Internacional Scientific Congreso. CNIC 2005. Palacio de Convenciones de la Habana Cuba. Junio de 2005 4. Estudio del efecto hipoglucemiante del extracto de Malva parviflora L. en ratones a los que se les indujo la diabetes con aloxana. 4th Internacional Scientific Congreso. CNIC 2005. Palacio de Convenciones de la Habana Cuba. Junio de 2005 5. Efecto del extracto de Tlanchalagua (Hypericum paniculatum H.B.K.) sobre el peso corporal de ratas hembra. 4th Internacional Scientific Congreso. CNIC 2005. Palacio de Convenciones de la Habana Cuba. Junio de 2005 Los documentos comprobatorios se encuentran en cuanto se requieran a la disposición en el Laboratorio de Anatomía. Departamento de Morfología Publicaciones: (2) 1. Herrera M. J., Hernández G. R. I., Becerril M. M., Castañeda H. M. 2004. Histopatología pulmonar en ratas tratadas con Delta 9 tetrahidro canabinol. Revista Mexicana de Ciencias Farmacéuticas, 35(1):5-9 2. Herrera M. J., Berdeja M. B. M., Castañeda H. M., 2006. Efecto citotóxico producido por benceno en riñones de rata. En prensa Los documentos comprobatorios se encuentran en cuanto se requieran a la disposición en el Laboratorio de Anatomía. Departamento de Morfología