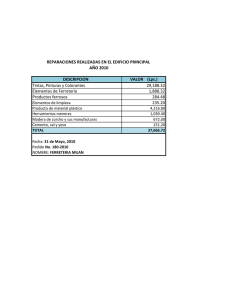
identificación y cuantificación de colorantes naturales
Anuncio

IDENTIFICACIÓN Y CUANTIFICACIÓN DE COLORANTES NATURALES EN CINCO ESPECIES VEGETALES NATIVAS RESUMEN El objetivo de este proyecto fue caracterizar las propiedades colorantes y tintóreas de cinco especies nativas, la corteza de Palo de sangre (Bocconia arborea Wat), Nance (Byrsonima crassifolia (L). HBK) y Palo de pito (Erythrina berteroana Urban), rizoma de Zarzaparrilla, (Smilax domingensis Willd.) y la hierba Pericón (Tagetes lucida Cav.). La metodología incluyó colecta, identificación botánica, extracción y caracterización fitoquímica, cuantificación de flavonoides y prueba de estabilidad comparando con aquellos utilizados por la industria como colorantes de cosméticos y tintes en fibras. De acuerdo a los resultados obtenidos, el extracto de B. crassifolia corteza presentó el mayor rendimiento de extracción (60%). En todos los extractos se observaron flavonoides y compuestos fenólicos, el extracto de T. lucida presentó el mayor porcentaje (0.3%) de flavonoides totales expresados en quercetina. Se demostró que los extractos de las 5 plantas nativas, son efectivas para ser utilizadas como tintes en textiles y colorantes en cosméticos, además pueden proveer al cosmético otras propiedades como antioxidantes y/o preservantes. Se determinó una marcada diferencia en el estimado de costos de producción de los colorantes naturales y el precio de venta de los sintéticos pero por las restricciones de uso, efectos adversos y toxicidad se justifica el uso de los colorantes naturales. De acuerdo a los resultados de estabilidad los extractos de B. arborea, T. lucida y E. berteroana podrían utilizarse para colorear sistemas alimentarios o cosméticos a pH 3. El extracto de S. domingensis y E. berteroana, presentó el pH óptimo a 4. El extracto menos estable fue el B. crassifolia. 1 ABSTRACT The aim of this research was to characterize the colorant and dyeing properties of five native species, the bark of Palo de sangre (Bocconia arborea Wat), Nance (Byrsonima crassifolia (L). HBK) and Palo de pito (Erythrina berteroana Urban), the rhizome of Zarzaparrilla (Smilax domingensis Willd.) and the herb Pericón (Tagetes lucida Cav.). The methodology included in-site collection, botanical identification, phytochemical extraction and characterization, quantitation of flavonoids, and color stability, comparing them with those used by industry as cosmetic colorants and fiber dyes. Results show that B. crassifolia extract showed the higher extraction yield (60%). In all the extracts, flavonoids and phenolics were found; T. lucida extract showed the higher concentration of flavonoids (0.3%) expressed as quercetin. It was demonstrated that the five species were effective as fiber dye and cosmetic colorant, providing also a possible role as anti-oxidants and preservatives. It is evident the difference between estimated production cost from natural dyes and the sale price of synthetic colorants, but the use restrictions, adverse effects and toxicity of the synthetic ones, justify the use of natural colorants. According to stability results, the extracts from B. arborea, T. lucida and E. berteroana could be used as natural colorants for food and cosmetics at pH 3. Extract from S. domingensis and E. berteroana, showed better stability at pH 4. Least stable extracts was B. crassifolia. 2 PARTE I I.1 INTRODUCCIÓN Guatemala es un país con gran diversidad biológica y cultural, su flora es muy variada, e incluye especies provenientes de la masa continental del norte y especies neotropicales del sur. Esta diversidad permite tener algunas plantas nativas de la región mesoamericana, a las que se les atribuyen diversas propiedades y usos, pero que no están lo suficientemente estudiadas para ser aprovechadas al máximo. Derivado de la riqueza natural, los productos extraídos de ésta, podrían ser procesados dentro del país para darles un valor agregado. Una industria local que los utilice como materia prima podría representar un incentivo para incrementar la producción en el mercado nacional y expandirse al mercado internacional, tal es el caso de los colorantes naturales. Las plantas utilizadas como colorantes se dividen en varios grupos: Colorantes naturales, tintes naturales y pigmentos naturales. Los colorantes naturales son productos que se adicionan a los alimentos para proporcionarles un color en específico y hacerlos más agradables a la vista. Los tintes naturales se usan para teñir telas, madera y cuero. Finalmente, los pigmentos naturales son los compuestos responsables del color visible de una planta; además de ser utilizados por la industria farmacéutica y cosmética. Los tintes son sustancias, ya sea naturales o químicas que sirven para teñir fibras vegetales o animales; y los mordientes son sustancias que fijan el color a las fibras. La tinción con tintes y mordientes naturales fue la forma de poner color a los textiles, hasta que a mediados del siglo XIX aparece el primer colorante artificial. A partir de esto la creación de nuevos tintes, mas baratos y con mejores resultados fue sustituyendo a los tintes naturales. A la par de la síntesis de tintes químicos fue también posible crear mordientes químicos sintéticos que reemplazaron a los mordientes naturales por las mismas razones por lo que fueron reemplazados los tintes naturales. La introducción de productos sintéticos al mercado, provocó un abaratamiento de la producción, pero con el paso del tiempo, la ineficacia del manejo de los desechos ha provocado también grandes niveles de contaminación. Debido a la preocupación de algunos consumidores, el interés por consumir productos orgánicos se convirtió inclusive en una moda. Actualmente, el mundo se ve invadido por una tendencia ecológica o protección del medio ambiente, lo que está cambiando muchos patrones de comportamiento, incluyendo las corrientes de la moda y así se habla de la “ecología en el vestir” o de los “ecotextiles”, en esta moda ecológica se contempla entre otros requisitos, el teñido con tintes naturales. El uso de sustancias provenientes de la naturaleza, han tomado auge, tal es el caso de los cosméticos naturales o verdes, donde todos las materias primas involucradas son de origen vegetal, o los llamados fitocosméticos que incluyen dentro de su formulación 1 o más componentes de origen vegetal. Es por ello que en años recientes se ha renovado el interés en colorantes naturales por las limitaciones en el uso de algunos colorantes sintéticos en alimentos, medicamentos y en productos cosméticos debido a su toxicidad. Son frecuentes las denuncias por el uso de colorantes no adecuados en estos productos de uso humano. Esto ha 3 originado un considerable interés mundial en el desarrollo de los colorantes naturales. Un indicativo de ello, es el número y distribución de las patentes reportadas a nivel mundial, en los últimos cinco años de un total de 427 patentes 356 están referidas a colorantes naturales y 71 a colorantes sintéticos. En Guatemala esta tendencia ha motivado, a instituciones, industrias y comunidades a rescatar e introducir actividades artesanales con énfasis en productos artesanales como la elaboración de productos y textiles teñidos con tintes naturales y la investigación de pigmentos y colorantes vegetales en alimentos y cosméticos, ya que los sintéticos representan un riesgo para la salud del consumidor. La presente investigación tuvo como objetivo la detección de cinco especies vegetales nativas que presentaron colorantes naturales que no habían sido investigados previamente y que presentaron dentro de su composición compuestos fenólicos; que por la composición química reportada en la literatura, constituyen un potencial en la industria farmaceútica, alimenticia y/o cosmética, especialmente como colorantes, tintes, pigmentos y/o antioxidantes, por lo que se realizó la extracción a partir de la droga vegetal, se caracterizó químicamente, se cuantificó y se evaluó la estabilidad, comparándolos con colorantes utilizados en las diferentes industrias, se realizaron pruebas de coloración en cosméticos y de tinción en fibras. En esta forma, se obtuvo información básica y aplicada que se espera pueda ser aprovechada por grupos de investigación multidisciplinarios; para el desarrollo de nuevos productos dentro de una visión de sostenibilidad, escalamiento productivo y desarrollo de tecnología apropiada para la explotación sostenible de los recursos nativos. En el presente estudio se identificaron en las cortezas de Palo de sangre (B. arborea), Nance (B. crassifolia) y Árbol de pito (E. berteroana); en el rizoma de Zarzaparrilla (S. domingensis) y planta entera de Pericón (T. lucida) pigmentos vegetales tales como flavonoides, cumarinas, taninos, los cuales demostraron potencial como colorantes y tintes vegetales. Se demostró que los extractos de las 5 plantas nativas, son efectivas para ser utilizadas como tintes y colorantes en cosméticos y además pueden proveer al cosmético otras propiedades propias de cada planta dependiendo de su composición química y actividad farmacológica. Según los resultados obtenidos en el estimado de costos de producción de los colorantes naturales y el precio de venta de los colorantes sintéticos disponibles en el mercado, se observa una marcada diferencia, siendo más costosos los colorantes naturales. Sin embargo la mayoría de colorantes artificiales posee restricciones de uso y algunos se encuentran restringidos a productos específicos por los efectos adversos y toxicidad que presentan aún en bajas cantidades; por lo que se justifica la sustitución de los colorantes sintéticos por los colorantes naturales a pesar de que se puedan incrementar los costos de producción. 4 I.2 PLANTEAMIENTO DEL PROBLEMA (Antecedentes y Justificación del trabajo de investigación) I.2.1 Antecedentes Colorantes Naturales de Origen Vegetal: Los colorantes están presentes en casi todas las plantas, de estos, unos son producidos directamente por la actividad fisiológica de las plantas, mientras que otros son producto de transformaciones artificiales de sustancias de procedencia vegetal. Los que se encuentran ya formados en la naturaleza, suelen estar disueltos o formando depósitos granulares en las células superficiales de las plantas. Los colorantes vegetales se encuentran mayormente concentrados en las vacuolas celulares de un sinnúmero de plantas, en donde a su vez sin encontrarse en estado puro, se asocian con otros principios como aceites, resinas, y en particular con los taninos que son de carácter astringente (Lock, 1997). Los pigmentos son el resultado de procesos muy complejos logrados a través de la acción fotosintética de las partes verdes de la planta mediante síntesis. Entre estos tenemos a los derivados: Carotenoides, clorofílicos, antociánicos y flavónicos (Lock, 1997). Estos colorantes eran los que hasta principios de siglo utilizaban las industrias textiles y que fueron sustituidos paulatinamente por los colorantes orgánicos artificiales. Como ejemplo tenemos la hematoxilina, el achiote y el añil. Los colorantes son sustancias químicas capaces de dar color a los cuerpos. Se pueden clasificar por su estructura química, por el método de aplicación o por su utilización. La clasificación por estructura química se funda en las teorías básicas del color y en el concepto de grupos cromóforos. Los cromóforos son grupos funcionales que producen color en compuestos orgánicos. Los auxocromos son grupos funcionales que modifican el color producido por el cromóforo. Las plantas utilizadas como colorantes se dividen en varios grupos: Colorantes naturales, tintes naturales y pigmentos naturales. Los colorantes naturales son productos que se adicionan a los alimentos para proporcionarles un color en específico y hacerlos más agradables a la vista. Los tintes naturales se usan para teñir telas, madera y cuero. Finalmente, los pigmentos naturales son los compuestos responsables del color visible de una planta; además de ser utilizados por la industria farmacéutica (Lock, 1997). Producción: Con respecto a los colorantes naturales, en el ámbito internacional son pocos los que se comercializan, entre las especies vegetales más usadas se citan las siguientes: Bixa orellana, cuya producción anual se estima en alrededor de 10,000 toneladas; Lawsonia inermis y Haematoxylum campechianum, ésta última especie nativa de las regiones tropicales de México. Los colorantes que tienen mercado en la industria textil son derivados de las siguientes especies: Acacia farnesiana, Reseda luteola y Juglans sp. Otros colorantes de uso local o regional son los obtenidos de Arctostaphylos nochistlanensis, Monnina schlechtenda y Quercus sp. (Lock, 1997). 5 Aprovechamiento: Los colorantes extraídos de plantas e industrializados a través de un simple beneficio proporcionan la materia prima de colores base. En el caso de México el más popular es el derivado de la flor de muerto (Tagetes erecta), del cual es el principal productor en el ámbito mundial. Aunque, existen otras especies con cierta popularidad como: Palo de sangre (Bocconia arborea) de cuyas cápsulas (frutos) se obtiene un colorante amarillo con mercado internacional; el follaje de Reseda luteola se emplea para la extracción de un tinte muy apreciado en la industria textil. El mercado demandante de colores vegetales corresponde a los países industrializados, principalmente Estados Unidos, Canadá, Japón y los integrantes de la Unión Europea (Zamora, 2001). Colorantes Vegetales que se utilizan actualmente: Rojo de Chica: Materia colorante roja que se obtiene por fermentación de las hojas de Bignonia chica HBK. Arrabidaea chica. Nombres comunes en Panamá: chica (Guaymí) digó, chisná, bejuco nimi, magueb (Cuna). La planta es muy abundante en América tropical y se conoce de sus propiedades tintoriales desde épocas lejanas. El colorante sirve para teñir todo tipo de fibras y objetos artesanales y los indígenas lo utilizan como pintura corporal y como remedio para las picadas de mosquito. En la parte norte de Panamá (Chiriquí, Veraguas y Coclé) se identificaron tres especies de esta planta. Este colorante también es la base para teñir de negro las fibras. Esto se logra enterrando durante un día, la fibra ya teñida de rojo en barro de lugares pantanosos, o ribera de ríos donde haya mucha acumulación de materia vegetal en descomposición. Amarillo de Cúrcuma: Nombre químico: Curcumina. Se encuentra en la raíz de la Curcuma longa L. Nombres comunes: cúrcuma, camotillo, yuquilla. El cultivo de esta planta originaria del Sur de Asia, se extendió en los siglos pasados a los países de la zona tropical, en atención a su alto rendimiento en la producción de principios colorantes, y también como especia alimenticia pues se usa en la preparación de mostaza y como ingrediente básico del curry. Se reportan también usos medicinales (diurético, anti-diarreico y antiinflamatorio), como repelente contra insectos, y en la elaboración del papel de cúrcuma para indicador en laboratorios. En Costa Rica está en estudio su industrialización para la obtención de colorantes para alimentos. Bixina: Se encuentra en la pasta colorante llamada achiote procedente del arbusto llamado Bixa orellana L., que es originario de las regiones tropicales de América. Su cultivo se ha extendido desde hace mucho tiempo a todos los países tropicales hasta Polinesia y Madagascar. Se ha encontrado en sepulturas antiguas del Perú. Es un ácido carboxílico carotenoide y tiene sabor insípido, por lo que es adecuado para dar color a las comidas, arroz, margarinas, quesos y bebidas en general, contribuyendo de esta forma a la dieta humana. Además se usa en productos cosméticos con el mismo fin. También se incluye en la dieta de aves de corral para mejorar la coloración de la yema del huevo. 6 Desde la época colonial se reporta la costumbre indígena de untarse la cara y el cuerpo con la pasta de achiote para colorearlo: Todavía se utiliza entre los chocoes, cunas y guaymíes con el fin de pintarse el cuerpo. Les gusta contrastar el rojo con el colorante azul de la jagua (Genipa oblongifolia R. et. P.). Además también se utiliza para colorear las fibras vegetales con que las mujeres guaymíes tejen las chácaras y los chocoes pintan las maderas de Balso talladas por ellos. Dentro de la artesanía de consumo guatemalteco, es característica la costumbre de colorear el arroz, la gallina, la masa de maíz de los tamales y el puerco frito seco, con achiote. También se le utiliza mezclada con el colorante de la "chica", para obtener un rojo-naranja o se usa sola para teñir de naranja, hirviendo la fibra junto con el colorante. También puede teñirse por contacto directo de la pasta sobre la fibra, aunque de esta forma el color no tiene mucha duración. Para las comidas la técnica de extracción consiste en calentar la semilla en aceite por 15 minutos, pasando después la mezcla por un colador para separar la semilla. El sedimento es aceitoso y este es lo que se utiliza para mezclar con los alimentos y darles color (Zamora, 2001; Ibarhim, 2000). Colorantes Antociánicos: Las antocianinas son un grupo de pigmentos rojizos, solubles en agua, ampliamente difundidos en el reino vegetal. Numerosas frutas, vegetales, flores y raíces deben sus atractivos colores a este tipo de compuestos, presentes en la savia de las células. Su acusado color rojo, hizo surgir interés por su estructura química. Actualmente se conocen bastante bien las estructuras del grupo de las antocianinas, pero no tanto la fisicoquímica de los pigmentos complejos y de sus reacciones de degradación. El término antocianina se aplica para el glicósido y el de antocianidina para la aglicona. Las antocianinas están basadas químicamente en una única estructura aromática, aquella de la cianidina y todas se consideran derivadas de ella por adición o sustracción de grupos hidroxilo, por mutilación o por glicosidación. Las antocianinas son derivados del catión flavilio básico. Un pigmento antociánico generalmente compuesto por un aglicón (una antocianidina) esterificada por uno o más azucares, rara vez se encuentran aglicoles libres en los alimentos, excepto como componentes en trazas, de las reacciones de degradación. Las antocianinas están consideradas dentro del grupo de los flavonoides, ya que poseen el esqueleto característico C6-C3-C6 y el mismo origen biosintético, pero difieren en que absorben fuertemente en la región visible del espectro por su alto grado de conjugación. Las antocianinas son pigmentos naturales no tóxicos, solubles en agua, que desarrollan gran variedad de colores que van desde el naranja al azul, también presentan propiedades antioxidantes benéficas para la salud. Son insolubles en agua y se solubilizan reduciéndolos en un medio alcalino. Bajo la adición de hidrosulfito de sodio, en presencia de hidróxido de sodio. De esta manera se forma un leuco-éster. Estos compuestos tienen gran afinidad hacia la fibra textil. Se tiñe a una temperatura de aproximadamente 60ºC durante 45 min. Cuando se encuentra sobre la fibra, el colorante se oxida con agua pura o con algún agente oxidante, como peróxido de hidrógeno y se transforma de esta forma en pigmento insoluble. 7 Las antocianinas como pigmentos naturales inocuos tienen considerable potencia en la industria alimenticia pero, a diferencia de los pigmentos rojos sintéticos que se utilizan actualmente, las antocianinas no son estables especialmente en soluciones neutras y alcalinas, ocurriendo fácilmente cambios durante el procesamiento crudo y el almacenaje, los que se manifiestan en la pérdida del color, oscurecimiento del producto y formación de precipitados en los extractos. Por tal motivo su uso se prefiere a pH ácido como en una gran cantidad de las bebidas comerciales (Lock, 1997; Gómez, 2006). Son también sensibles a las variaciones de pH, a pH 3 el pigmento está presente como sales de flavilio de color rojo, a pH 8 es de color violeta y a pH 11 de color azul. Estudios recientes reportan que el color de las antocianinas se hace resistente a las variaciones de pH cuando se encuentran como productos de condensación con catequizas en presencia de aldehídos, siendo estos últimos casos de mayor valor como agentes de coloración de alimentos. Las antocianinas juegan un rol importante en la producción de vinos, siendo la fuente comercial más antigua de antocianina, la enocianina, extracto coloreado frecuentemente extraído de las uvas, originalmente fue utilizada para intensificar el color de los vinos, pero en los últimos años ha encontrado aplicaciones como colorante de alimentos. Asimismo se está haciendo importante la extracción de antocianinas de otras fuentes naturales como el maíz morado, la col, el camote y los rábanos. El contenido total de antocianinas en las plantas varía dependiendo de factores como: Especie, variedad, estado fisiológico de la planta, posición del fruto en la planta y aplicación de productos químicos, etc. Se consideran que tienen como función en la planta el ser atractores de insectos para los procesos de polinización y diseminación de las semillas. Aunque la literatura reporta más de 250 antocianinas, se hace necesaria una mayor investigación para darles un mejor uso y sean más competitivas como alternativas viables a los colorantes sintéticos hoy en uso. Hay seis antocianidinas (agliconas de antocianinas) comunes, siendo la cianidina la más común y responsable del color magenta, los colores rojo-naranja se deben a al perlargonidina (con un grupo hidroxilo menos que la cianidina), mientras que los colores violeta y azul a la delfinidina (con un grupo hidroxilo más). También son comunes tres metil-ésteres: peonidina, derivada de la cianidina, petunidina y malvidina, basadas en la delfinidina. Cada una de las seis antocinidinas ocurre con unidades de azúcar, la variación está en el tipo de azúcar, del número y de la posición en los que están unidos. Entre los monosacáridos comunes podemos mencionar a la glucosa, galactosa, ramnosa, xilosa y arabinosa y como disacáridos a la rutinosa, sambubuiosa, soforosa, gentibiosa y tirosa. Basadas en su glicosidación, pueden clasificarse como 3-monoglicósidos, 3-biósidos, 3,5diglicósidos y 3,7-diglicósidos, siendo estos últimos menos comunes. Si hubiera tres unidades de azúcar, las tres pueden estar en posición 3, o dos en posición 3 y una en 5. Únicamente un pigmento ha sido reportado con más de tres unidades de azúcar. Las antocianinas aciladas están siendo descritas con mayor frecuencia en los últimos años, con sustituyentes alifáticos, aromáticos y azúcares; siendo los principales grupos acilantes los 8 ácidos fenólicos como p-coumarico, caféico, ferúlico o sináptico y algunas veces los ácidos acético, masónico y p-hidroxibenzoico; entre ellos se encuentran preferentemente en el azúcar del C-3 (Lock, 1997). Colorantes Flavónicos: Son compuestos polifenólicos caracterizados por una estructura química basada en un esqueleto C6-C3-C6, esto es un anillo bencénico unido a una cadena propánica y esta a su vez a otro anillo bencénico. Dependiendo del grado de saturación y patrón de sustitución de grupos funcionales en la estructura base, se da lugar a flavonoides con designaciones comunes como flavanoles, flavonas, chalconas, auronas, isoflavonoides, etc., así como a sus derivados glicosidados que portan moléculas de azúcares e incluso derivados ácidos de azúcares. Suelen encontrarse también parcialmente polimerizados dando lugar a dímeros, trímeros, etc., hasta formar complejos multienlazados como los taninos condensados. Estos compuestos se encuentran de manera natural en los alimentos, particularmente en los vegetales. En general el sabor que aportan a los alimentos suele ser amargo llegando incluso a provocar sensaciones de astringencia dependiendo de lo condensados que sean los taninos. El sabor puede variar dependiendo de las sustituciones presentadas en el esqueleto llegando incluso a usarse como edulcorantes cientos de veces más dulces que la glucosa. Los flavonoides se emplearon durante mucho tiempo como colorantes de lana y actualmente se usan en la conservación de grasas o jugos de fruta por las propiedades antioxidantes de algunas polihidroxiflavonas. Los glucósidos de dihidrochalconas se utilizan como edulcorantes. La acción farmacológica es también extensa y variada son bien conocidas sus actividades contra la fragilidad capilar (bioflavonoides), dilatadores de las coronarias (proantocianidinas), espasmolítica (glicósidos de apigenina), antihepatotóxica, colerética y diurética. Actúan como antioxidantes, limitan la acción de los radicales libres (oxidantes) reduciendo el riesgo de cáncer y enfermedades cardíacas, mejoran los síntomas alérgicos y de artritis, aumentan la actividad de la vitamina C, refuerzan los vasos sanguíneos, bloquean la progresión de las cataratas y la degeneración macular, evitan las tufaradas de calor en la menopausia y combaten otros síntomas. Tienen actividades biológicas con propiedades diversas como antimicrobianas, anticancerígeno, antimutagénicos. Algunas isoflavonas lipófilas, están dotadas de propiedades estrogénicas. La hidrogenación de las chalconas del limón, da derivados azucarados empleados como edulcorantes (Lock, 1997). Materiales para teñir y teñiduras: La literatura sobre el tema del tejido en los altiplanos es sumamente escasa. La única obra específica al respecto es Guatemala Textiles. Otras referencias sobre los tejidos de los altiplanos se hallan dispersas en diferentes categorías: informes respecto del traje y tejido, como expresión cultural enmarcada en un estudio más amplio. El arte de tejer, se practica en los pueblos que orillan el lago de Atitlán y en Sololá principal centro mercantil de la región. Además el territorio de Antigua Guatemala, la zona de Tecpán, la de Chichicastenango, la de San Francisco Momostenango, la de Quetzaltenango-Salcajá, 9 Totonicapán, la de San Pedro San Marcos, Huehuetenango, Cobán Rabinal y ciento diez localidades del altiplano. En Zunil, el hilo para la parte central de ciertos guipiles es teñido en azul claro; en Tactic, las partes laterales son ligeramente teñidas. Los tejedores de Zunil sacan el tinte de las hojas de la sacatinta (Jacobinia spicigera Schlecht), planta de gran importancia para la industria de la tintura en la región de Totonicapán. El arte del tinte se practica en las casas en conexión con una de las actividades más importantes de los altiplanos. La industria de Salcajá depende principalmente de la producción del índigo (Indigofera suffruticosa Mill e I. guatemalensis). La planta llamada cuajatinta proviene de la costa y es llevada a los mercados en forma de grandes paquetes de hojas verdes. El tinte original comprende una mezcla de índigo natural, índigo en polvo y anilina importada, el fijador para el índigo consiste en cenizas de madera procedente de Cajolá y cal de San Francisco el Alto. El palo de Campeche (Haematoxylum campechianum L.) procedente de Petén se compran en palos ya partidos en el mercado de Momosteango. Para prepararlo se parten los palos de un rojo oscuro en pequeñas astillas y se reducen a fibras golpeándlas entre dos piedras. Los tintoreros de los altiplanos utilizan tres tintes más: un negro auxiliar (aliso, Alnus spp.), el palo amarillo (Chlorophora tinctoria L.) y el palo de Brasil (Haematoxylum brasilitto Karst). Los tejedores de géneros de Momostenango disponen de dos cafés naturales. Uno viene del árbol aliso que crece en esta zona. La oscura corteza de un castaño rojizo, se tritura entre piedras y las fibras se echan en agua caliente. El segundo tinte café se obtiene al mezclar pedazos de palo del Brasil reducidos a astillas con pedazos de madera de Campeche en la misma condición. Los tintes amarillos se obtienen hirviendo fibras del palo amarillo en agua. Esta madera llega al mercado desde el departamento limítrofe de Huehuetenango, al norte de Momostenango. También se usan unos amarillos comerciales para producir dicho color. El azul es un color importante, lo producen con tres material el palo de Campeche, el índigo y los polvos para teñir de origen comercial. El rojo de los tejidos es teñido con cochinilla o grana así llamada a causa de la forma granulada de los insectos secos procedente de la Antigua. Stephens hace varias referencias a la industria, otrora floreciente en las regiones de Antigua y Amatitlán. Describe la extensión de tierras sembradas con nopal, el cacto-pera espinoso que alimenta a los insectos. La crianza de las cochinillas floreció en muchas localidades donde se ha vuelto cosa de leyenda. Generalmente para teñir emplean una mezcla de cochinilla chinche negrita (Lantana camara L.) para dar más color y 50 limones más o menos maduros. En Chuamanzana, una aldea de Chichicastenango los tintóreos usan el alumbre como fijador en lugar de limón (O`Neale, 1979). Existe en la familia de los Coccidios un género que es utilizado por sus diversos principios oleíferos o cerosos. Entre los principales están Coccus baccharis, C. cacti, C. pela, C. cariocoe, C. rosoe, C. adiporfera. Algunos de los productos son la cera de Chilca (Baccharis 10 lanceolata) que es producida por C. baccharis. Esta cera es un artículo utilizado en las regiones vinícolas de Catamarca, Tucumán y Valle Calchaquí. Se utiliza en esos lugares para barnizar el interior poroso de las tinajas cocidas que se emplean en la fermentación de vinos. La solución etérea, expuesta a una temperatura baja o concentrándola por destilación parcial da un abundante precipitado de escamitas blancas conservando el líquido su color amarillo obscuro (Luján & Toledo, 1986). Estudios realizados: Mejía en 1927 describe plantas tintóreas de Guatemala entre ellas: El camotillo (Curcuma tintórea) rizoma tuberoso del cual se extrae un tinte amarillo anaranjado pero poco fijo, poco soluble en agua, más soluble en alcohol, éter y aceites. La mora (Maclura tintoria) de su madera se extrae un tinte amarillo bastante fijo soluble en agua, sirve para teñir la lana y la seda. Yemas de huevo (Berbis) la madera contiene un tinte amarillo soluble en agua, alcohol y alcohol amílico. Si se añade un poco de álcali a la solución ésta toma un tinto rojo pero un exceso la vuelve a su tinte primitivo. Se precipita por el cloruro de estaño. Tiñe hamaca de la corteza se extrae un tinte amarillo fijo, muy empleado para teñir la jarcia. El árbol de pito (Erythrina colerodendron) la corteza contiene una materia tintórea amarilla. Achiote (Bixa orellana) dentro del fruto capsular cónico y de valvas rugosas se extrae tinte colorado. El árbol de Campeche (Haematoxylon mexicana) la madera contiene una materia colorante rojo violada, se emplea para colorar los vinos y para su falsificación. Jiquilite (Indigofera añil) produce el color azul que se llama añil por decantación se obtiene el producto extraído. Tintoche, es un árbol de la Verapz, cuya madera contiene en abundancia una meteria colorante azul. Yagua o Irayol (Genipa amaericana) de la corteza se extrae una materia colorante azul. Ojo de venado (Mucirna altissima) de la corteza se produce una materia tintórea negra bastante soluble con el agua. Mashaste de tinaco de las hojas se extrae también un buen tinte negro. Saca tinta (Jacobina tinctoria) semejante al añil muy usada para teñir el hilo de las telas de algodón. Aguilar en 1966 describe en su obra Aspectos de la flor útil de Guatemala el uso de las flores de Subín (Acacia farnesiana), las cuales producen un tinte amarillo empleado para teñir telas de seda y papel tapiz. El Conacaste (Enterolobium cyclocarpun) la madera y la corteza producen un tinte negro, el palo de Campeche (Haematoxylon campechianum), el cual produce la hematoxylina, el palo de Brasil (Haematoxylon brasileto), su madera rojiza produce un tinte o colorante azul o violeta. Irayol de montaña (Genipa americana) el fruto, madera y corteza produce un tinte o colorante azul negruzco. Llorasangre (Croton draco) por incisión de la corteza del tronco, exuda sabia roja que al solidificarse forma una sustacia resinosa, insípida e inodora con el nombre de sangre de drago la cual se emplea en medicina. La madera produce un tinte rojo. Primavera (Tabebuia chrysantha) de la madera se obtiene un tinte morado. Tecomasúchil (Cochlospormum hibiscoides) de la madera se obtiene un tinte de color anaranjado. Tornasol (Thespesia populnea) sus frutos producen un tinte amarillo. Nacascole (Caesalpinea coriaria) madera y frutos producen tintes negro, azul y rojo. Un trabajo realizado en la Escuela de Biología de la USAC, se describieron las especies con propiedades tintóreas, entre ellas se mencionan: Familia Acanthaceae, género Justicia, la más utilizada la sacatinta (J. spicigera) que junto con el indigo es empleada para el tinte azul oscuro característico de los tejidos de lana del 11 altiplano. Se cree que esta planta fue usada por los antiguos mayas para pintar paredes y otras superficies. La tinta (J. tinctoria) las hojas son maceradas en agua caliente producen una solución azul usada para lavar ropa blanca. Familia Bixaceae la más utilizada es el achiote (Bixa orellana) y algunas variedades B. orellana var urucurana, B. orellana var leyocarpa. Familia Lauraceae la más sobresaliente el aguacate (Persea americana) las mujeres indígenas a menudo hierven la corteza con tintes para textiles para fijar los tintes. La semilla del aguacate es astringente y contiene un jugo lechoso que cuando se expone al aire se enrojece y ennegrece paulatinamente, por lo que puede utilizarse para fabricar una indeleble tinción para marcar la ropa. También machacada y mezclada con la cáscara de ciertas plantas y agregándole dicromato de potasio produce un tinte para cueros. Familia Leguminosas, Haematoxylon brasiletto la madera contiene un materia colorante, incolora, cristalizable y soluble en agua, llamada brasilina que al contacto del aire y de los cuerpos oxidantes se transforma en otro principio cristalizado pero de color rojo que al disolverse deja un líquido teñido de rojo carmesí utilizado en tintorería. El cocimiento primero es amarillo, tornándose rojo después pasa del bermellón si se añade alumbre. Si se utiliza para teñir la lana, la seda, el algodón unido a otras sustancias puede dar diversos matices de rojo; también se usa en la pintura al temple y al óleo. Combinando las lacas formadas con los óxidos metálicos particularmente con el hierro y la alúmina se utiliza en las pinturas. La brsilina cristaliza en agujas amarillo rojizas que palidecen a la luz. Al contacto de los ácidos pasa esta sustancia al amarillo y por los álcalis al violeta. Palo de tinta (Haematoxylon campechianum) su propiedad tintórea se debe a una sustancia llamada hematoxilina o hematina, la materia colorante se extrae por medio de agua hirviendo, con el agua pura se obtiene un tinte amarillo rojizo, con el que contiene carbonato de cal resulta de color vivo, se pasa al violeta en presencia de bicarbonato. Género Indigo, Jiquilete (Indigofera guatemalensis, I. lespedezioides), frijolillo (I. miniata), I. montana, I. mucronata llamado añilillo en Yucatán y Tabasco, I. suffructicosa es la planta indigófera que más se ha explotado como planta tintórea. I. tinctoria llamada jiquelite la planta ha sido usada desde tiempo inmemorial en Centro América y México para obtener el tinte indigo. El indigo se obtiene de varias especies de indigófera. La materia colorante no se encuentra formada en la planta, sino que resulta de las operaciones, de macerar la planta en agua para que se desprenda bajo la influencia de la fermentación, el principio que la planta contiene y que después al oxidarse se convierte en el producto que le llaman añil o indigo. Como fijadores se ha utilizado las hojas machacadas de tempate (Jatropha curcas), la cáscara del fruto del aguacate (Persea gratissima), solución de romero (Rosmarinus officinalis) de la cual se dice que preserva el color negro y la apariencia de nuevo en las telas (Matta, 1980). En 2001 Calderón, realiza la obtención del extracto colorante acuoso a partir de los rechazos de exportación de la producción nacional de dos variedades de pitahaya, a nivel de planta piloto, en el cual se concluyó que el colorante natural extraído de la pulpa se asemejó al colorante sintético rojo No. 3 y el colorante obtenido de la cáscara se asemejó al colorante sintético rojo No. 40, se determinó que el compuesto que le da color a la pitahaya pertenece al subgrupo de las betacianinas, del grupo de las betalaínas, también recomiendan que el colorante puede usarse en medios de pH entre 5 y 6. 12 En 2004, en un estudio de tesis de la Escuela de Ingeniería Química, se realizó la extracción de los pigmentos tipo flavonoides contenidos en las flores del subín (Acacia farnesiana L. Willd) los cuales demostraron que con acetona se obtiene un mayor rendimiento, y el extracto metabólico presentó el mayor número de pigmentos colorantes tipo flavonoides (Del Cid, 2004). En 2005 Arguijo, describe las plantas tintóreas utilizadas en la comunidad de Pozo Seco Chisec, Alta Verapaz reportando un total de 35 especies entre las cuales se menciona achiote (Bixa orellana), aguacate (Persea americana), apazote (Teloxys ambrasioides), anona (Annona reticulata), barajo (Cassia alata), bledo (Amaranthus hybridus), cacho de venado (Acacia sp), caoba (Switenia macrophylla), coco (Cocus nucifera), cúrcuma (Curcuma longa), flor de muerto (Tagetes tenuifolia), guarumo (Cecropia obtusifolia), guayaba (Psidium guajaba), guineo (Musa sapientum), jocote marañon (Anacardium occidentale), macuy (Solanum americanum), mango (Manguifera indica), morro (Crescentia cujete), nance (Byrsonima crassifolia), naranjillo (Trichillia sp.), palo de pito (Erythrina sp.), pelo de león (Cuscuta sp.), santo domingo (Baccharis trinervis), Sunza (Licania plathypus), teca (Tectona grandis), tem (Justicia tinctoria), tres puntas (Neurolaena lobata). El Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (CYTED) financió un proyecto sobre Antocianos y betalaínas colorantes naturales de aplicación industrial (Gascón A, et al.) En el 2006, se evaluaron 2 especies forestales Aliso y Encino con potencial para su uso en la industria textil en el teñido de fibras caracterizando los pigmentos presentes y pruebas fisicoquímicas para determinar la capacidad tintórea de dichas especies (Cano T, 2006). En el 2007, se realizó un proyecto, para obtener tintes naturales a nivel laboratorio y planta piloto de la corteza de 3 especies forestales guatemaltecas: chaperno (Lonchocarpus rugosus), quebracho (Lisyloma bahamense) y aliso (Alnus arguta), utilizando 3 solventes (agua y alcohol etilico al 35% y al 70%), con el fin de teñir fibras naturales de lana, maguey y algodón que cumplan con las especificaciones exigidas por el mercado nacional e internacional. Se evaluó la calidad de los extractos tintóreos obtenidos a nivel de laboratorio realizando la caracterización fisicoquímica para comprobar la presencia de pigmentos colorantes por medio de pruebas calorimétricas y cromatográficas y pruebas fisicoquímicas (Cano T, 2007). 13 I.2.2 Justificación Actualmente la mayoría de la industria guatemalteca es de transformación, se importa la mayor parte de los insumos que se consumen, varios productos agrícolas que son materia prima para diferentes industrias, se exportan sin ninguna transformación industrial y en el caso de las especies vegetales, no han sido lo suficientemente estudiadas para ser aprovechadas al máximo, tal es el caso de las especies utilizadas como colorantes o tintes. En los países desarrollados se ha observado una tendencia de los consumidores hacia los productos naturales, así como una mayor preocupación sobre la toxicidad de los aditivos sintéticos. Ello se traduce no sólo en una tendencia de mercado, sino que la legislación es cada vez más restrictiva sobre el uso de este tipo de aditivos, particularmente los colorantes. En años recientes se ha renovado el interés en colorantes naturales, por nuevas limitaciones en el uso de algunos colorantes sintéticos en alimentos, medicamentos y en productos cosméticos por la toxicidad que presentan. Esto ha originado un considerable interés mundial en el desarrollo de los colorantes naturales, en muchos países se ha prohibido el uso de algunos colorantes sintéticos, por su toxicidad. La lista autorizada en los países miembros de la UE comprende 24 colorantes, de los cuales 12 son de origen natural, por lo cual las investigaciones se orientan hacia los productos naturales. Guatemala por ser un país rico en biodiversidad, se han utilizado las plantas con propiedades tintóreas desde hace tiempo, sin embargo ha sido a nivel artesanal, son muy pocos los estudios que validan y le dan un uso industrial a las especies vegetales como pigmentos y colorantes en alimentos o cosméticos. Por su naturaleza, ciertos pigmentos naturales además de sus características cromáticas poseen otras propiedades de interés medicinal e industrial, siendo una razón que justifica plenamente la importancia de dicha investigación, es por ello que se seleccionaron cinco especies vegetales pericón (Tagetes lucida), planta entera, Palo de sangre (Bocconia arborea) corteza y cápsula, Palo de pito (Erythrina berteroana) corteza, Nance (Byrsonima crassifolia) corteza, Zarzaparrilla (Smilax domingensis) rizoma, las cuales presentan compuestos fenólicos que pueden emplearse como colorantes, tintes o pigmentos tanto en cosméticos, alimentos o textiles. Por lo que surgió la necesidad de evaluar el potencial que pueden presentar dichas especies y estudiar los aspectos relacionados con la extracción, purificación y estabilización de los pigmentos naturales, las cuales por su composición fitoquímica, particularmente importante en flavonoides y su actividad biológica reportada, pueden ser utilizadas como colorantes, tintes, antioxidantes, preservantes tanto en la industria alimenticia, cosmética y medicinal. 14 I.3 OBJETIVOS E HIPOTESIS I.3.1 Objetivos I.3.1.1 General Identificar los pigmentos vegetales presentes en cinco especies nativas seleccionadas en base a su composición química, uso popular y cultivo sostenible. Evaluar el potencial de los pigmentos identificados en las especies en estudio como sustitutos de colorantes sintéticos. I.3.1.2 Específicos Extraer los pigmentos presentes en las diferentes drogas vegetales de las cinco especies nativas, utilizando técnicas de extracción con disolventes de distinta polaridad. Identificar flavonoides y antocianinas en extractos vegetales de las cinco especies nativas por cromatografía en capa fina. Cuantificar los flavonoides y antocianinas mayoritarios presentes en los extractos vegetales por espectrofotometría UV/VIS. Evaluar la estabilidad de los colorantes naturales como posibles sustitutos de colorantes sintéticos. Comparar el costo de producción de los colorantes naturales identificados, en relación al costo en el mercado de los colorantes sintéticos utilizados en la industria. I.3.1.3 Hipótesis Los flavonoides y antocianinas presentes en al menos uno de los extractos de cinco especies nativas poseen las características para ser utilizadas como alternativas naturales de consumo de los colorantes artificiales. 15 I.4 METODOLOGIA I.4.1 Las Variables 1.4.1.1 Variables independientes Las especies vegetales en estudio: Pericón (Tagetes lucida) planta entera, Palo de sangre (Bocconia arborea) corteza y cápsula, Palo de pito (Erythrina berteroana) corteza, Nance (Byrsonima crassifolia) corteza, Zarzaparrilla (Smilax domingensis) rizoma. 1.4.1.2 Variables dependientes Caracterización fitoquímica, estabilidad de los colorantes. I.4.2 Indicadores Presencia o ausencia de los metabolitos, espectros de absorción Coloración presentada en las diferentes pruebas Costos de producción. I.4.3 Estrategia Metodológica I.4.3.1 Población y Muestra Población: Especies nativas que posean, dentro de su composición química, flavonoides y antocianinas o aquellas utilizadas popularmente como colorantes. Muestra: Cinco especies nativas Pericón (T. lucida) planta entera, Palo de sangre (B. arborea) corteza y cápsula, Palo de pito (E. berteroana) corteza, Nance (B. crassifolia) corteza, Zarzaparrilla (S. domingensis) rizoma. I.4.4 El Método Obtención de materia vegetal: Se realizó una colecta de cada una de las especies: T. lucida se colectó en el ICTA Chimaltenango, E. berteroana se colectó en Santa Rosa; B. arborea en Sacatepéquez, B. crassifolia y S. domingensis en Suchitepéquez, se tomó una muestra botánica la cual se depositó en el Herbario BIGU de la Escuela de Biología para su determinación, para la extracción se colectaron aproximadamente 1 Kg de la droga vegetal. Lugar de colecta Coordenadas geográficas ICTA Chimaltenango 14°39´36´´ 90°49´10´´ Finca Cacaotal, Samayac 14°33´115´´ Suchitepéquez 91°28´009´´ Los Esclavos Santa Rosa 14°16´42`` 90°17´57´´ Cuesta las Cañas 14°35´0´´ Sacatepéquez 90°43´0´´ Humedad relativa % 74.73 Temperatura °C 16-29 Altura msnm 1,793 66-90 23-25 450 86.6 20-28 847 75 14-22 1,400 16 Materiales y Equipo: Balanza analítica Balanza semianalítica Hornos Estufa eléctrica Mortero de porcelana Pistilo de porcelana Pliego de película plástica (parafilm) Pliego de papel filtro Whatman No. 1 Embudo büchner Espectrofotómetro UV-Visible Potenciómetro Molino Cromatofolios de silica gel Cámaras cromatográficas Asperjador de vidrio Rotaevaporador Percolador de acero inoxidable Desecadora Equipo para reflujo Reactivos: Etanol 95% Acido clorhídrico concentrado Ftalato ácido de potasio Hidróxido de potasio Colorante artificial Rojo No. 40 Warner-Jenkinson Company FD & C Colorante artificial Rojo No. 3 Warner-Jenkinson Company FD & C Colorante artificial Rojo No. 2 Warner-Jenkinson Company FD & C Colorante artificial Amarillo No. 5 Warner-Jenkinson Company FD & C Colorante artificial Amarillo No. 3 Warner-Jenkinson Company FD & C Disolventes, reactivos y estándares para análisis cromatográfico para flavonoides. Cristalería: Vaso de precipitar Vaso de precipitar Probeta Probeta Probeta Matraz kitazato Balones aforados Balones aforados Pipetas volumétricas TD Pipetas volumétricas TD Pipetas volumétricas TD 1L 500 ml 50 ml 25 ml 10 ml 500 ml 500 ml 100 ml 1 ml 2 ml 5 ml 17 Pipetas volumétricas TD 10 ml Tubos de ensayo 30 ml Métodos: Procedimiento de extracción de los colorantes: Pesar de 100 a 200 g de la parte de cada especie en estudio y realizar una percolación utilizando como disolvente extractor (etanol 95%, ácido clorhídrico 0.1N en proporción 85:15) en una relación 1:5 o 1:10 dependiendo de la materia vegetal, dejar 24 h en reposo y posteriormente concentrar el disolvente extraído hasta obtener una consistencia grado miel, secar en desecador hasta sequedad y almacenar en refrigeración para su posterior análisis. Procedimiento para realizar la cuantificación de colorantes naturales: Prepararción del extracto: Tomar una alícuota de aproximadamente 25 ml de la solución de cada uno de los extractos, filtrar utilizando papel Whatman No. 1 en un embudo Büchner, tomar 2 ml de la alícuota filtrada y enrazar en un balón de 100 ml utilizando el disolvente para la lectura de absorbancia (etanol 95%, ácido clorhídrico 0.1N en proporción 85:15, rotular como solución 1B), a la solución resultante determinar la longitud máxima absorbancia en la región visible del espectromagnético y la absorbancia en esa longitud de onda. El contenido total de antocianinas es calculado con la ayuda del peso de la parte de la especia utilizada, volumen de disolvente, el factor de dilución y valores de ε (coeficiente de extinción). Repetir el procedimientos en las otras soluciones 2A 3A, 4A y 5A y rotular como solución 2B, 3B, 4B y 5B respectivamente (Fuentes, 2004; Fuleki, 1968; Lock, 1997; Gómez, 2006). . Cuantificación de colorantes naturales comparando con soluciones concentración conocida de rojo No. 2: Preparar 1 L de 3 soluciones amortiguadoras a pH: 3, 4 y 5 de la siguiente manera: de pH 3: Disolver en 500 ml de agua destilada 14.1327 g de ftalato ácido de potasio con 7 ml de ácido clorhídrico 4.40 M y aforar a 1 L. pH 4: Disolver en 500 ml de agua destilada 20.3822 g de ftalato ácido de potasio con 2 ml de ácido clorhídrico 0.10 M y aforar a 1 L. pH 5: Disolver en 500 ml de agua destilada 14.0714 g de ftalato ácido de potasio con 10 ml de hidróxido de sodio 3.11 M y aforar a 1 L. A tres balones aforados de 100 ml agregar 2 ml de la solución filtrada 1A, cada uno enrazar utilizando diferentes soluciones buffer (pH 3, 4 y 5) rotular como 1A3, 1A4 y 1A5 respectivamente, determinar la longitud máxima absorbancia en la región visible del espectro electromagnético a los distintos valores de pH. Repetir el procedimiento con las otras soluciones filtradas 2A, 3A, 4A y 5A. Rotulándolas como 2A3, 2A4, 2A5, 3A3, 3A4, 3A5, 4A3, 4A4, 4A5 y 5 respectivamente. 18 Preparar soluciones de concentración 0.1 g/L aproximadamente, de cada uno de los estándares (rojo No. 2, Rojo No. 3 y Rojo No. 40) a pH 3, 4 y 5. Determinar la longitud de máxima absorbancia en la región visible del espectro electromagnético para cada una de las soluciones de colorantes artificiales a diferentes pH. Comparar la longitud de máxima absorbancia de las diferentes muestras con la longitud de máxima absorbancia de los diferentes estándares a distintos valores de pH. Cnsiderar para el resto del trabajo sólo aquellas muestras en las que la longitud de máxima absorbancia en la región visible del espectro electromagnético (a un pH determinado) coincida con la de algún colorante artificial a los mismos valores de pH. Elaborar una curva de calibración entre 1 ppm y 10 ppm para el colorante artificial Rojo No. 2, utilizando el buffer en el cual la longitud de máxima absorbancia sea igual, tanto para la muestra como para el estándar y realizar la lectura de absorbancia de las diferentes muestras, a ese valor de longitud de onda, para obtener un equivalente de concentración de los colorantes naturales en función del colorante artificial (1 g de de la especie vegetal equivale a X mg de rojo No. 2). Cálculos para determinar la cantidad total de colorantes naturales presentes en las diferentes muestras: Para determinar el total de colorantes naturales presentes en las diferentes muestras utilizar la siguiente fórmula: T Acy mg/100 g = Abs * VD * VD/ME * VTE/CF * PM/E, donde T Acy mg/100 g: Total de antocianinas (colorantes naturales) (mg) presentes en las especies vegetales (100 g). Abs: valor de absorbancia leído en la solución 1B. VTE: volumen final de la solución 1A (ml) VD: volumen final de la solución 1B (ml), solución preparada para medir la absorbancia. ME: volumen de muestra del extracto que fue diluida en la solución 1 B en ml. CF: cantidad de la especie vegetal utilizada. PM: peso molecular de la antocianina presente en la especie vegetal. ε: coeficiente de extinción molar de la antocianina presente en la especie vegetal. Cálculos para realizar la determinación de la cantidad total de antocianinas expresadas en términos de equivalentes de rojo No. 2: Para determinar la cantidad de antocianinas expresadas en términos de mg de rojo No. 2 por gramo de las especies vegetales a pH 4 se utiliza la siguiente fórmula: Y = Con * VD * VTE/ (MEpH * CF) Y: mg de rojo No.2/g de la especie vegetal Con: concentración (g/l) de rojo No.2 obtenido al despejar concentración de la ecuación la curva de calibración para el colorante No. 2 19 VD: volumen final de la solución 1 A4 (ml) solución preparada para medir la absorbancia. VTE: volumen final de la solución 1 A (ml) MEpH: volumen de muestra del extracto 1 A que fue diluida en la solución buffer a pH 4, solución 1 A4 (ml) CF: cantidad de especie vegetal utilizada (g) Procedimiento para evaluar la estabilidad de colorantes naturales: Evaluar la estabilidad de los colorantes presentes en cada una de las diferentes muestras, a los valores de pH (3, 4 y 5) donde las muestras presenten el mismo valor de longitud de máxima absorbancia en la región visible del espectro electromagnético que alguno de los estándares (rojo No.3P, rojo No. 40, amarillo No. 5, amarillo No. 6, cochinilla) y a 40°C, para mantener las muestras a ésta temperatura colocar en una incubadora calibrada para mantener dicha temperatura; la incubadora permanece conectada durante todo el tiempo que dure la parte experimental. Las muestras se monitorean frecuentemente. Leer las muestras a la longitud de onda de máxima absorbancia determinada anteriormente, para cada muestra a un valor específico de pH y temperatura. Llevar 5 tubos simultáneos conteniendo la misma muestra (pericón, nance, zarzaparrilla, palo de pito y palo de sangre) realizar el seguimiento cada día hasta que la absorbancia de una de las muestras baje alrededor del 80% del valor inicial. El procedimiento que se indica a continuación se realiza para cada muestra que cumpla con las condiciones mencionadas anteriormente. Agregar 20 ml de solución amortiguadora pH 3 a 10 tubos de 30 ml e identificar 5 como (T1, pH1) y 5 como (T2, pH1). Agregar 20 ml de solución amortiguadora pH 4 a 10 tubos de 30 ml e identificar 5 como (T1, pH2) y 5 como (T2, pH2). Agregar 20 ml de solución amortiguadora pH 5 a 10 tubos de 30 ml e identificar 5 como (T1, pH3) y 5 como (T2, pH3). Agregar una cantidad de extracto de cada muestra para que brinden un valor de absorbancia entre 0.4 y 0.6 unidades en la región visible del espectro electromagnético. Realizar las determinaciones para cada tubo cada día como se indicó al inicio. Cálculos para determinar la estabilidad de colorantes: El modelo matemático que se utiliza: Ab = a * Ln (t) + b; donde Ab es absorbancia, t: tiempo, a y b son las constantes. Para poder comparar las diferentes muestras entre sí, se procede a calcular la primera derivada de cada una de las ecuaciones, así se determina el cambio de la absorbancia, respecto al tiempo; es decir, la estabilidad que presenta cada extracto. 20 Al dividir d Absorbancia/ de tiempo de dos extractos, se puede conocer cuantas veces más inestable es un solución de colorantes respecto a otra. De esta manera se procede con todas las muestras. Caracterización química: (Lock, 1994, 1997; Wagner, 1996; Solis, 2005) Investigación de flavonoides y antocianinas: Ensayos macro y semimicro: Extraer 3 g de material vegetal pulverizado con 10 ml de etanol o metanol al 80 por ciento, filtrar y concentrar. Enfriar a temperatura ambiente y triturar el residuo con 15 ml de éter de petróleo hasta que la extracción sea incolora. Disolver el residuo en 30 ml de metanol al 80%, filtrar y dividir en 5 tubos: Tubo 1: agregar 0.5 ml de ácido sulfúrico concentrado. Tubo 2: agregar 3 a 5 gotas de cloruro férrico al 10% (p/v). Tubo 3: agregar 0.5 ml de ácido clorhídrico concentrado y calentar en baño de maría por 5 min (prueba para leucoantocianinas). Tubo 4: agregar magnesio metálico y 0.5 ml de ácido clorhídrico concentrado. Tubo 5: testigo. Evaluar las reacciones, cambios de color y/o formación de precipitado comparados con el testigo. Desarrollo inmediato de color flavonas y flavonoles (amarillo a rojo), flavanonoles (rojo a magenta), flavanonas (rojo, magenta, violeta, azul), isoflavonas (amarillo); isoflavononas, chalconas y auronas no dan coloración. Cromatografía en capa fina: Extraer 1 g de material vegetal seco pulverizado con 10 ml de metanol por 5 min en baño de maría a 60°C. Filtrar la solución y aplicar sobre las cromatoplacas de silicagel 60 F254. Como estándar emplear solución de flavonoides al 0.05% en metanol (10 μl). (quercetina, rutina, ácido clorogénico, hiperósido). Fase móvil: acetato de etilo-ácido fórmico-ácido acético glacial-agua (100:11:11:27), n-butanol-ácido acético-agua (40:10:50); acetato de etilo-ácido fórmico-ácido acético glacial-etilmetilcetona-agua (50:7:3:30:10) Detección: Sin tratamiento químico: UV 254 nm fluorescencia, zonas azules o amarillas. UV 365 nm, dependiendo la estructura fluorescen amarillo, azul o verde. Reactivo de Productos Naturales (NP/PEG). Fluorescencia intensa en UV-365 nm. Solución 1: solución metanólica al 1% de difenilboriloxietilamina (NP). Solución 2: solución etanólica al 5% de polietilenglicol 4000 (PEG). Aplicar a la placa vapores de amoniaco para intensificar el color de las manchas (37, 41-43). Investigación de antraquinonas: Prueba de Bornträger: Extraer 3 g de material vegetal pulverizado con 10 mL de etanol al 80 por ciento, filtrar y concentrar en baño de maría (60°C). Disolver el residuo con 30 mL de agua destilada y filtrar. Extraer con 10 mL de benceno. A la fase bencénica 21 añadir 5 mL de solución de test de amonio y agitar. Observar cambios de color en la fase alcalina (color rojo, rosado: positivo). Prueba de Bortränger modificado: Calentar 0.3 g de material vegetal pulverizado con 10 mL de hidróxido de potasio alcohólico 0.5 N y 1 mL de peróxido de hidrógeno al 3 por ciento y calentar 10 minutos en baño de maría a 60°C. Añadir 10 gotas de ácido acético glacial para acidificar. Extraer con 10 mL de benceno. A la capa bencénica adicionar 5 mL de solución de prueba de amonio y agitar. Observar cambios de color en fase alcalina (color rojo, rosado: positivo). Cromatografía en capa fina: Extraer 0.5 g de material vegetal seco pulverizado con 5 mL de metanol en baño maría (60°C) por 5 minutos. Filtrar y aplicar 10 μL en la cromatoplaca de silicagel 60 F254. Estándar: solución al 0.1 por ciento en metanol de antraquinonas (10 μL). (Aloína, flangulina A/B, glucofrangulina A/B y sus agliconas, reina, aloe-emodina, extracto de sen) Fase móvil: • acetato de etilo-metanol-agua (100:17:13), • acetato de etilo-metanol-agua (100:13.5:10). Detección: Sin tratamiento químico: UV 254nm fluorescencia, UV 365 nm fluorescencia amarilla o rojo-café. Solución etanólica de hidróxido de potasio al 5 o 10 por ciento. Antraquinonas: zonas rojas en visible y fluorescencia roja en UV-365 nm. Antronas y antranolas: zona amarillas en visible y fluorescencia amarilla en UV-365 nm. Investigación de cumarinas: Ensayos macro y semimicro: Medir 5 mL de extracto vegetal metanólico. Agregar 1 mL de agua destilada hirviendo. Con un capilar aplicar 2 manchas en papel filtro. A una mancha agregar 1 gota de hidróxido de potasio 0.5N. Observar bajo luz ultravioleta de 365 nm (fluorescencia azul o verde: positivo). Cromatografía en capa fina: A 1 g de material vegetal adicionar 10 mL de metanol y calentar 30 minutos en baño de maría. Filtrar y evaporar hasta 1 mL. Aplicar 20 μL en una cromatoplaca de sílica gel 60 F254. Utilizar como estándar canela en metanol al 1 por ciento, umbeliferona, ácido p-cumárico, cumarina.). Fase móvil: • tolueno-acetato de etilo (93:7); • tolueno-éter (1:1 saturado con 10% de ácido acético, 50 mL de tolueno y 50 mL de éter son mezclados durante 5 min con 50 mL de ácido acético al 10%, se filtra y se descarta la fase de abajo, y la mezcla de tolueno-éter es usada). Detección: Sin tratamiento químico UV 254nm fluorescencia. UV 365 nm todas las cumarinas muestras una intensa fluorescencia azul o verde- azul. 22 Solución etanólica de hidróxido de potasio al 5 o 10 por ciento. UV-365 nm fluorescencia azul o verde. Investigación de taninos: Ensayos macro y semimicro: Extraer 10 g de material vegetal pulverizado con 30 mL de etanol o metanol al 80 por ciento, filtrar y evaporar a sequedad. Añadir 25 mL de agua caliente al residuo y agitar con varilla y dejar enfriar. Agregar 1 mL de solución de cloruro de sodio al 10 por ciento y filtrar. Adicionar 3 mL del filtrado a 4 tubos de ensayo: Tubo 1: testigo. Tubo 2: agregar 4 a 5 gotas de solución de gelatina al 1 por ciento (p/v). Tubo 3: agregar 4 a 5 gotas de gelatina-sal (1 por ciento de gelatina y cloruro de sodio al 10 por ciento). Tubo 4: agregar 3 a 4 gotas de solución de cloruro férrico al 10 por ciento (p/v). Observar la formación de precipitado y/o cambio de coloración. Con cloruro férrico: grisáceo-negro: catecol; negro-azulado: pirogalol) Análisis de Cuantitativo de Flavonoides por Espectrofotometría UV/VIS (Real Farmacopea Española, 2002): Disolución madre. En un matraz de fondo redondo de 100 ml poner 0.8 g de droga pulverizada (500), 1 ml de una disolución de 5 g/l de hexametilentetramina, 20 ml de acetona y 7 ml de ácido clorhídrico. Calentar a ebullición la mezcla a reflujo durante 30 min. Filtrar el líquido a través de algodón hidrófilo a un matraz de 100 ml. Añadir el algodón hidrófilo al residuo en el matraz de fondo redondo y extraer dos veces con 20 ml, cada vez, de acetona, calentando a ebullición a reflujo cada una de las veces durante 10 min. Dejar enfriar a temperatura ambiente, filtrar el líquido a través de algodón hidrófilo y después filtrar las disoluciones de acetona reunidas a través de un papel de filtro a un matraz aforado y diluir hasta 100 ml con acetona lavando el matraz y el filtro. Poner 20 ml de la disolución en una ampolla de decantación, añadir 20 ml de agua y extraer la mezcla una vez con 15 ml y luego tres veces con 10 ml, cada vez, de acetato de etilo. Reunir los extractos de acetato de etilo en una ampolla de decantación, lavar dos veces con 50 ml, cada vez, de agua, filtrar el extracto sobre 10 g de sulfato de sodio anhidro a un matraz aforado de 50 ml y diluir hasta 50 ml con acetato de etilo. Disolución problema. A 10 ml de la disolución madre añadir 1 ml de reactivo de cloruro de aluminio y diluir hasta 25 ml con una disolución al 5 % V/V de ácido acético glacial en metanol. Disolución de compensación. Diluir 10 ml de la disolución madre hasta 25 ml con una disolución al 5 % V/V de ácido acético glacial en metanol. Medir la absorbancia de la disolución problema después de 30 min, por comparación con la disolución de compensación a 425 nm. Calcular el contenido en porcentaje de flavonoides, calculado como hiperósido, a partir de la expresión: tomando la absorbancia específica del hiperósido como 500 nm. A = absorbancia a 425 nm, 23 m = masa de la sustancia a examinar en gramos (42). A × 1,25 ————— m Técnica de tinción (Lock, 1997): Preparar una solución al 1% de extracto en etanol al 85%. Lavar la lana con agua caliente, seguidamente enjuagar con agua fría y lavar con jabón, dejar remojando con agua fría toda la noche para limpiar bien la lana. Técnica de tinción en frío: Sumergir 5g de la lana en 25 mL de la solución al 1% del extracto y dejar reposar durante 10 h. Técnica de tinción en caliente: Sumergir 5g de la lana en 50 mL de la solución al 1% del extracto y calentar hasta ebullición durante 30 min y dejar reposar durante 10 h. Técnica de tinción utilizando mordiente: Prepara una solución con mordiente 0.5 g de sulfato de aluminio en 50 mL de agua. Sumergir la lana en la solución y calentar durante 1h, agregar 25 mL de la solución del extracto y calentar a ebullición durante 1 h y dejar reposar durante 10 h. Fórmulas de cosméticos utilizados: Gel: Materias Primas: • Carbopol • Trietanolamina • Parabenos (Preservantes) • Agua c.s.p 5% 1% 2% 100 % Procedimiento: • Disolver el carbopol en agua, con agitación constante hasta que se encuentre solución transparente. • Agregar los preservantes y agitar. • Agregar trietanolamina para obtener la viscosidad deseada. Shampoo: Materias Primas: • Lauril sulfato de sodio (texapon) • Amida de coco • Cloruro de sodio (sal) • Parabenos (Preservantes) • Agua c.s.p 8% 4% 0.75 % 2% 100 % 24 Procedimiento: • Disolver el lauril sulfato de sodio y la amida de coco en agua, con agitación constante hasta que se encuentre solución transparente. • Agregar los preservantes y agitar. • Agregar el cloruro de sodio y mezclar para obtener la viscosidad deseada. Loción: Materias Primas: • Alcohol etílico al 70% 40 % • Propileglicol 3% • Glicerina 3% • Agua c.s.p 100 % Procedimiento: • Mezclas todas las materias primas con agitación constante hasta que se encuentre solución transparente. Procedimiento de coloración de cosméticos: De los cosméticos base se colocaron 50 mL en un vaso de precipitar de 100 mL y se adicionaron 5 mL de cada extracto a las diferentes concentraciones y posteriormete se realizaron las comparaciones visuales con los pantones. I.4.5 La Técnica Estadística Las muestras de colectaron en el lugar de mayor distribución de cada especie, identificando para cada una de ellas, el lugar de colecta. En éste tipo de estudios, donde no existen datos numéricos confiables al respecto de la cantidad de colorantes y su estabilidad; el tamaño de la muestra es igual al nivel de confianza elevada al cuadrado; siendo que el nivel de confianza es igual a Z (1.64), fue necesario efectuar tres repeticiones de cada uno de los análisis para obtener un nivel de confianza del 90%. Se presentó la información mediante tablas y gráficas de interacción, que indican el grado de desviación de cada punto y permiten observar la relación existente entre las diferentes variables. Además se elaboraron gráficas de estadística descriptiva, obteniendo la desviación estándar y la media para cada grupo de datos. En el caso de la caracterización fitoquímica se indicó la presencia o ausencia de los metabolitos detectados y en las pruebas de coloración y tinción se indicaron los colores obtenidos de acuerdo a una comparación con estándares universales mediante la visualización con un pantone. I.4.6 Los Instrumentos utilizados: Se utilizaron cuadernos para el registro de las actividades realizadas diariamente y resultados obtenidos, además de la documentación registrada en la bitácora del 25 laboratorio. Se elaboraron informes mensuales y trimestrales para indicar el avance de la investigación. Se utilizó el equipo, materiales e infraestructura del Laboratorio de Investigación de Productos Naturales para los análisis fitoquímicos y pruebas de estabilidad, coloración y tinción. 26 PARTE II MARCO TEÓRICO (CONCEPTUAL) Especies seleccionadas: Nance (Byrsonima crassifolia (L). HBK) (Malphigiaceae) Nombres comúnes: Nanche, Tapal. Descripción botánica: Árbol de 3-10 m de alto, copa extendida, tronco recto, corteza café, rugosa, rosada por dentro. Hojas siempre verdes, ovaladas o elípticas, 5-20 cm de largo, puntiagudas. Flores de 5 pétalos, amarillas o anaranjadas, 1-2 cm de ancho, numerosas, en grupos. Frutos en drupa carnosa, 8-22 mm de diámetro portados aisladamente en racimos de 2-15 piel delicada, amarilla; carnaza blanca, gruesa, jugosa, ácida, olor peculiar, con una semilla negra dura (Cáceres, 1996). Hábitat y distribución geográfica: Nativa de México a Sur América y el Caribe; en bosques secos y tropicales hasta 1,800 msnm. En Guatemala se ha descrito en Alta Verapaz, Baja Verapaz, Chiquimula, El Progreso, El Quiché, Escuintla, Huehuetenango, Izabal, Jalapa, Jutiapa, Petén, Quetzaltenango, Retalhuleu, San Marcos, Santa Rosa, Suchitepéquez y Zacapa (Cáceres, 1996). Obtención: La corteza rugosa, de color café por fuera y rosada por dentro, se colecta en época seca y se seca al sol durante 2-3 semanas. Se necesita suelo rocoso, arenoso y alcalino, se adapta a oxisoles y ultisoles bien drenados, requiere precipitación pluvial superior a 2,000 mm/año (Cáceres, 1996). Usos etnomédicos y populares: La decocción de corteza y flores se usa por vía oral, para tratar afecciones respiratorias, digestivas, dolor de muelas, hemorragias, parasitosis, mordedura de serpiente. El fruto se usa para tratar fiebres y las semillas para la disentería. Tópicamente se utiliza para el tratamiento de afecciones dermatomucosas y tumores. La corteza, se utiliza en la industria de cueros y para teñir de color café claro hilos de algodón. La cáscara del fruto se utiliza para teñir hilos de algodón de color encarnado. Del fruto verde se obtiene una tinta (Cáceres, 1996). Química: La corteza contiene taninos (20-30%), ácido oxálico (2.7%), glucósidos, flavonoides, proantocianidinas (epicatequina) (8), saponinas, sesquiterpenlactonas y triterpenos (β-amirina). La raíz tiene flavonoides, glicósidos cardiotónicos, sesquiterpenlactonas, taninos y triterpenos (Cáceres, 1996; Geiss, 1995). Actividad farmacológica: Estudios antimicrobianos demuestran que la decocción de la corteza, hojas y raíz, es activa contra Escherichia coli y Staphylococcus aureus. La tintura de la corteza es activa contra Shigella flexineri, Salmonella typhi, Vibrio cholerae, Streptococcus pneumoniae, S. pyogenes, Candida albicans, C. krusei, y C. parapsilosis. De cinco órganos de la planta, se ha comprobado que la corteza es la más activa contra bacterias. Además estudios en ratas ha demostrado que la corteza y las hojas poseen efecto espasmolítico (Cáceres, 1996; Navarro, 1996). 27 Farmacognosia: La materia vegetal utilizada como medicina es la corteza seca, que debe reunir las mismas características fisicoquímicas y sanitarias de la materia prima utilizada para la elaboración de productos fitofarmacéuticos. En la revisión bibliográfica realizada se encontraron pocas referencias sobre la relación entre la actividad farmacológica atribuida y la composición química, no hay estudios tendientes a la formulación de productos fitofarmacéuticos (Cáceres, 1996). Pericón (Tagetes lucida Cav.) (Asteraceae/Compositae) Nombres comúnes: Pericón, Jolomocox, Ucá, Iyá. Descripción botánica: Hierba perenne, aromática, erecta, 30-95 cm de alto. Se levanta desde una base corta, gruesa y leñosa. Cimosamente ramificada; ramas escasas, resinosa al secarse. Hojas opuestas, oblongo-lanceoladas, 5-10 cm de largo, puntiagudas, finamente dentadas, con numerosas glándulas oleosas. Flores amarillas en pequeñas cabezuelas terminales; receptáculo cilíndrico 9-10 mm de diámetro; 5-7 filarios subulados en el ápice, brácteas 3. Aquenios 6-7 mm de largo, estriados, papus escamoso, 3 mm de largo (Cáceres, 1996). Hábitat y distribución geográfica: Nativa de México a Honduras en bosques de encino y laderas de 1,000-2,000 msnm. Es abundante en la época de lluvia, desaparece en época seca. En Guatemala se ha descrito en Chimaltenango, El Quiché, Jalapa, Guatemala, Huehuetenango, Petén, Quetzaltenango, Sacatepéquez y San Marcos (Cáceres, 1996). Obtención: Se obtiene principalmente por recolección de plantas silvestres, los grupos que se dedican a su obtención manejan en forma rudimentaria los campos de crecimiento silvestre. Se colecta toda la planta en su máxima floración. Cuando se separa las hojas y flores de los tallos, se secan a la sombra; puede secarse toda la planta y luego separar las hojas y flores por aporreo (Cáceres, 1996). Usos etnomédicos y populares: La infusión de flores y hojas se usa por vía oral para aliviar el parto, tratar anemia, inflamación de los ojos, afecciones nerviosas, gastrointestinales, respiratorias, dolor menstrual, mordedura de escorpión, hepatitis, paludismo, reumatismo, retención urinaria, afecciones nerviosas, tumores y úlceras. El humo de las hojas y flores se utilizan para ahuyentar mosquitos. Las flores y hojas se usan para aromatizar los elotes cocidos (Cáceres, 1996). Química: Las hojas y flores contienen aceite esencial (limoneno, 16.5%; β- ocimeno, 14%; βcariofileno, 28%; mirceno, 4-5%; anetol, alilanisol, estragol, éter metílico de eugenol, tagetona, dihidrotagetona, tetrahidrotagetona, linalool), alcaloides cuaternarios, flavonoides (quercetagetina, patuletina, isoramnetina) (Abdala, 1999), saponinas, taninos, leucoantocianinas, ácido gálico, poliacetilenos, glicósidos cianogénicos, cumarinas (dimetilalileter de 7-hidroxicumarina, 7-metoxicumarina y 6,7,8-trimetoxicumarina), derivados de tiofen, α-tertienilo; poliacetilenos (5-(3-buten-1-inil)-2,2’-bitienol), goma, dextrina, grasas, pectina, tres resinas acídicas, taninos y sales minerales (Cáceres, 1996). Acción farmacológica: La tintura y extracto acuoso de hojas y flores son activos contra E. coli, Shigella dysenterie, S. flexneri, S. typhi, S. pyogenes. También poseen actividad funguicida. En modelos animales, se han comprobado efectos: antiespasmódico sobre el músculo liso, 28 depresor del SNC, hipotensor, broncodilatador e inmunomodulador, entre otros (Cáceres, 1996). Famacognosia: La materia médica son las hojas y flores secas. Según la norma guatemalteca obligatoria, la materia seca vegetal para la infusión debe ser aromática, las hojas y flores estar enteras, el extracto acuoso en masa tener un máximo de 32% y el material no contener más del 10% de humedad (Cáceres, 1996). Zarzaparrilla (Smilax domingensis Willd.) (Smilacaceae) Nombres comúnes: Zarzaparrilla, Palo de la vida, Diente de chucho, Cuculmeca. Descripción botánica: Glabras completamente. Tallos teretes, escasamente armados en la parte inferior con aguijones robustos recurvados. Hojas 6-15 x 1.5-10 cm, 1.4-6 veces más largas que anchas, ovadas, lanceolado-ovadas o lanceoladas, 5-nervias desde la base, las nervaduras primarias prominentes en el envés, no impresas en el haz, el par exterior submarginal, las nervaduras secundarias conspicuas, algo prominentes, reticuladas. Pecíolos 0.5-2 cm. Umbelas estaminadas solitarias; pedúnculo 1-5 mm, más corto que el pecíolo subyacente, terete o algo aplanado. Umbelas pistiladas solitarias; pedúnculo 1-5 mm, más corto que el pecíolo subyacente, subterete. Tépalos de las flores estaminadas 4-6 mm; filamentos 2-4 mm, anteras 1-2 mm. Tépalos de las flores pistiladas, c. 4 mm. Bayas 7-10 mm, rojas purpúreas o negras (Robles, 1998). Hábitat y distribución geográfica: Es nativa de América, se desarrolla en bosques húmedos hasta 1,300 msnm. En Guatemala se ha descrito en Alta Verapaz, Izabal, Petén, San Marcos, Suchitepéquez, Quetzaltenango y Santa Rosa (Cáceres, 1996). Obtención: Se obtiene por recolección en los campos de crecimiento silvestre. Se recomienda su manejo para cultivo, con el fin de garantizar su aprovisionamiento sostenido. Necesita suelo bien drenado, caliente, a media sombra, abundante humedad y condiciones boscosas para que la enredadera trepe. El rizoma se colecta al final de las lluvias y se seca al sol (Cáceres, 1996). Usos etnomédicos y populares: La decocción del rizoma se usa por vía oral para tratar anemia, afecciones gastrointestinales, hinchazón, malaria, dolor de riñones, enfermedades de la sangre y venéreas, hepatitis, reumatismo y tumores. Tópicamente, se usa para diversas afecciones dermatomucosas. Las raíces de varias especies del género se han utilizado como colorantes de refrescos o como componentes de arreglos florales (Robles, 1998). Química: El tamizaje fitoquímico indica la presencia de alcaloides, aceite esencial, esteroles insaturados, glicósidos esteroidales (saponinas, cardenólidos, bufadienólidos); flavonoides, antocianinas, leucoantocianinas, taninos, polifenoles, resinas, azúcares y grasas. Se han aislado agliconas esteroidales (parillina, sarsapagenina, smilagenina); β-sitosterol, stigmasterol, ácido sarsápico, ácidos grasos y sales minerales (Robles, 1998; Li, 2002). Actividad farmacológica: La decocción y tintura poseen actividad antirreumática, antiinflamatoria y diurética. Tópicamente, posee actividad antifúngica, antiprurítica, cicatrizal y desinflamante. Además, la tintura es activa contra bacterias gramnegativo y grampositivo. 29 La decocción y extracto metanólico son activos contra C. albicans y dermatofitos. Estudios realizados indican que también posee actividad antioxidante. Estudios clínicos con 50 pacientes con vaginitis por C. albicans demuestran que los óvulos de tintura se comportan en forma similar a Nystatina. En la ejecución de proyectos con OEA, CATIE-FONTAGRO y DIGI estudios antimicrobianos demostraron que el extracto etanólico del rizoma presentó actividad contra S. aureus (0.25 mg/ml), S. typhi (0.5 mg/ml), Mycobacterium smegmatis (0.25 mg/ml), Bacillus subtilis (0.25 mg/ml), Pseudomonas aeruginosa (0.25 mg/ml), E. coli (1 mg/ml) y Cryptococcus neoformans (0.5 mg/ml) (CATIE, 2003). Farmacognosia: La materia médica son rizomas secos. Macroscópicamente son manojos de 60-70 cm de largo, con arrugas longitudinales, color rojo–café y xilema amarillo lignificado (Gatusso, 2003). Palo de pito (Erythrina berteroana Urban) (Papilonaceae) Nombres comúnes: Palo de Pito, Coralillo y T ´zite Descripción botánica: Árbol de 10 m de altura o menos, abundantemente armado con vértebras sólidas. Hojas suaves, lustrosas (13) sueltas rómbico-ovaladas o rómbicoorbiculares, de 5-15 cm de largo, el ápice agudo o algunas veces redondo, lampiño, pálido en la parte inferior; cáliz subcoriaceo tubular, soporte pálido o fuertemente rojo, de 5.5-9.5 cm de largo, generalmente obtuso. Alas un poco más largas que la quilla o igual, de 7.5-14 mm de largo. Vainas algunas veces leñosas, de 11-28 cm de largo x 1.5 cm de ancho, profundamente constriñidas las semillas, poco enroscadas al principio y mucho más en su madurez. Semillas numerosas, de color escarlata, con una pequeña línea negra que se extiende desde el hilum, mide 1 cm de largo. Florea de diciembre a marzo (Russo, 1990). Hábitat y distribución geográfica: Su origen es desconocido, pero América Central y Africa son candidatos, por poseer mayor cantidad de especies nativas. Se desarrolla en zonas tropicales y subtropicales, húmedas (precipitación de 1,500 a 4,000 mm por año), a elevaciones de 1800 msnm. Se encuentra ampliamente distribuída desde el sur de México hasta Colombia. (Russo, 1990). Se desarrolla en suelos ácidos (arriba de pH 4), con elevada saturación de aluminio. En Guatemala se ha descrito en Alta Verapaz, Chimaltenango, Sacatepéquez y todo el oriente del país; es decir, El Progreso, Zacapa, Chiquimula, Jutiapa, Jalapa (Powell, 1993). Obtención: Se obtiene de plantaciones silvestres y de cercos vivos en donde se le brinda mantenimiento (Powell, 1993). El árbol florea en los meses de diciembre a marzo y los frutos se desarrollan de febrero a abril, se colectan cuando el color se ha vuelto más oscuro (Russo, 1990). Usos etnomédicos y populares: La decocción de las semillas, la corteza o las flores, se utiliza para afecciones musculares, en el tratamiento de la corea, la parálisis infantil y como narcótico. Las flores son ingeridas en ensalada y producen somnolencia. La corteza, las flores y las hojas son utilizadas para producir hipnosis e inducir el sueño. La decocción de las hojas se utiliza en buches para infecciones de la encia (Russo, 1990). También se utiliza para aliviar 30 los dolores menstruales (Powel, 1993). Se han aislado dos colorantes de su corteza y las semillas se utilizan en la manufactura de brazaletes, gargantillas y artículos decorativos (Arriaza, 1981). También se aprovecha como especie forrajera para la alimentación animal, y como sombra de otros cultivos como café y cacao (Powel. 1993). Química: Se han aislado varios alcaloides de las semillas (eritroidina, hipaforina, eritramina, eritrocoraloidina, eritralina y eritratina). Además contienen aceites esenciales, aceites insaturados, resinas, albúmina, goma, azúcares y ácidos orgánicos. Las flores contienen alcaloides, flavonoides, antocianinas (cianidina –3- glicósido y cianidina –3- monoglicósido), alantoína, colina, fructosa, glucosa y triptófano. La corteza y las flores contienen coraloidina, alcaloide con efectos similares al curare. La corteza contiene materias colorantes, una amarilla que es una resina neutra y una roja que es un alcaloide con propiedades narcóticas. En hojas se han identificado varios aminoácidos, entre los que se encuentran la isoleucina, fanilalanina, leucina, lisina, treonina y valina (Arriaza, 1981). Actividad farmacológica: Los alcaloides tetracíclicos poseen actividad paralizante de los músculos, similar a la acción del curare. Por lo que se utilizan en padecimientos reumáticos. Algunos de los flavonoides poseen actividad antifúngica y antibiótica. Las lectinas y proteasas se utilizan en investigación científica (Powell,1993). Farmacognosia: La materia médica son las semillas, flores y corteza seca (Arriaza, 1981). Palo de Sangre (Bocconia arborea Wat.) (Papaveraceae) Nombre común: Palo de Sangre, Palo Sagrado. Descripción botánica: Árbol o arbusto siempre verde de 3-8 m de altura, con tronco solitario o ramificado desde la base, de corteza muy fisurada, formando placas; ramillas tomentosas, con las hojas agrupadas hacia el extremo. Hojas más o menos elípticas, de 15-25 x 6-9 cm, con el margen hendido hasta el nervio medio, oblongo-lanceolados, acuminados, aserrados; son glabras en el haz, de color verde algo glauco, mientras que el envés es grisáceo-tomentoso. Pecíolos de 1-5 cm de largo. Inflorescencias en panículas laxas de 20-30 cm de longitud, con numerosas flores sobre pedicelos de 5-10 mm de largo. Cáliz con 2 sépalos de 7-10 mm de largo; corola ausente. Androceo con alrededor de 12 estambres con anteras lineares de unos 6 mm de largo; estilo de 5-6 mm de longitud, persistente. Fruto en cápsula elipsoide, estrechándose hacia ambos extremos, amarillenta, de unos 6-7 mm de largo, conteniendo semillas de unos 6 mm de largo, oscuras, brillantes, ligeramente reticuladas, con un arilo rojizo (Nash, 1976). Hábitat y distribución geográfica: Nativo de América, se desarrolla en el ecosistema templado y tropical. Obtención: Es un árbol común que crece de forma silvestre en los campos. Usos etnomédicos y populares: En la medicina popular se utiliza un extracto acuoso de la corteza fresca para el tratamiento de diversas enfermedades; como por ejemplo, el tratamiento de la diabetes, el cáncer, los problemas inflamatorios y las infecciones bacterianas. El aceite de la semilla se utiliza tópicamente contra la sarna. El aceite de la semilla también se utiliza 31 como insecticida para matar pulgas. De los frutos se obtiene un colorante amarillo con mercado internacional. Se utiliza en la fabricación de artesanias. Química: Contiene alcaloides (6-acetonildihidroqueleritina, dihidroqueleritrina, queleritrina, queleritridimerina, sanguinarina, dihidrosanguinarina, oxisanguinarina). También se han aislado otros alcaloides del extracto metanólico de la corteza (dihidroqueleritrina, 6acetonildihidroqueleritrina y queleritrina) (Navarro, 1999). La corteza y el tallo contienen también, taninos, pigmentos y resinas; mientras que la semilla contiene aceites y grasas. Farmacognosia: La droga vegetal a utilizar es la corteza, raíz y hoja desecada de la planta. Actividad farmacológica: Los alcaloides aislados de la corteza poseen actividad antimicrobiana, citotóxica y antinflamatoria confirmada por numerosos autores. Otros alcaloides (dihidroqueleritrina, 6-acetonildihidroqueleritrina y queleritrina) han presentado actividad antioxidante in vitro e in vivo (Navarro, 1999). Dos de estos alcaloides han mostrado actividad antimicrobiana considerable contra bacterias gramnegativas y grampositivas y Candida albicans (Navarro, 1996). El extracto de la corteza posee mayor actividad antifúngica que el obtenido de raíz y hojas. 32 III.1 RESULTADOS 3.1.1 Porcentaje de Rendimiento de la extracción En la siguiente tabla se observa los rendimientos obtenidos de cada droga vegetal en la cual la corteza de nance presenta el mayor rendimiento obtenido y el menor rendimiento lo presenta el palo de pito. Especie vegetal Palo de sangre arborea) corteza Tabla No. 1 Peso de la materia vegetal (g) Cuesta las cañas, 200.0 Antigua Guatemala, Sacatepéquez Samayac, 300.0 Suchitepéquez Rio Los esclavos, 241.6 Santa Rosa Samayac, 300.0 Suchitepéquez ICTA, 100.0 Chimaltenango Procedencia (B. Nance (B. crassifolia) corteza Palo de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Peso del extracto obtenido (g) 27.9 Rendimiento obtenido (%) 13.95 180 60.0 26.93 11.15 46.3 15.43 21 21.0 Fuente: Datos experimentales 3.1.2 Caracterización fitoquímica En los siguientes cuadros se observan los ensayos macro y semimicro y la cromatografía en capa fina (CCF) de los metabolitos identificados en cada uno de los extractos. 3.1.2.1 Flavonoides: Como fase móvil se utilizó: n-butanol, ácido acético glacial, agua (40:10:50) Revelador: Reactivo de productos naturales (polietilenglicol 4000 5% y difenilborioxiletilamina 1%) Se utilizó como fase estacionaria una cromatoplaca de silica gel 60F254 En la tabla No. 2 se observan los resultados de flavonoides con los ensayos macro y semimicro donde se identificaron compuestos fenólicos, flavonoides y antocianinas de acuerdo a los cambios de coloración observados en cada extracto analizado. 33 Tabla No. 2 Especie Resultados Palo de sangre (B. arborea) Coloración roja con HCl, corteza Mg y calentamiento. Nance (B. crassifolia) Coloración roja con HCl, corteza Mg y calentamiento, negro azulado con FeCl3 Árbol de pito Se observó cambio de (E. berteroana) corteza coloración se tornó naranja intenso Zarzaparrilla Se observó cambio de coloración, se presentó una (S. domingensis) rizoma coloración rojo cereza intensa con HCl, Mg y calentamiento Pericón (T. lucida) planta Se intensificó el color verde entera Observación Presencia de flavonoides, posibles flavanonoles Presencia de compuestos fenólicos y flavonoides tipo flavanonas Presencia de flavonoides de tipo flavonas y flavonoles Presencia de flavonoides y antocianinas posible presencia de flavanonas. Posible presencia de compuestos fenólicos y flavonoides tipo isoflavononas, chalconas y auronas Fuente: Datos experimentales Ensayos macro y semimicro para flavonoides 1 2 3 4 5 1. pericón, 2. zarzaparrilla, 3. palo de sangre, 4. nance, 5. palo de pito En la tabla No. 3 se observan los resultados de la CCF en la cual el extracto que presentó mayor número de bandas fue el de palo de sangre, y en la zarzaparrilla se identificó la presencia de ácido clorogénico. 34 Especie Vegetal/Estándar Palo de sangre (B. arborea), corteza Nance (B. crassifolia) corteza Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Estándar de Ácido caféico Estándar de Ácido clorogénico Resultados Tabla No. 3 Rf. Interpretación Presenta siete bandas En UV: fluorescencia intensa amarillonaranja En VIS: color café 0.13,0.30, Presencia de flavonoides 0.42,0.5, 0.65, 0.80, 0.92 Se observó una banda En UV: rojo En VIS: rojo Presenta cinco bandas En UV: se observa fluorescencia de coloración celeste y amarilla. En VIS: color amarillo Presenta tres bandas: En UV: fluorescencia de color verde, En VIS: color amarillo naranja Presenta dos bandas: En UV: Fluorescencia azul celeste. En VIS: color amarillo Presenta una banda En UV: fluorescencia verde En VIS: amarillo En UV: Presenta una fluorescencia verde En VIS: amarilla. 0.13 Presencia de compuestos fenólicos 0.23, 0.49, 0.91 0.34, Presencia de flavonoides. 0.60, 0.19, 0.44, 0.85 Presencia de flavonoides. Se identifica la presencia de ácido clorogénico en en el extracto de Zarzaparrilla, por coincidir los Rf 0.5, 0.83 Presencia de compuestos fenólicos y flavonoides 0.92 0.5 35 Estándar de rutina En UV: color naranja En VIS: amarilla 0.6 Estándar de kaemferol Presenta una banda con florescencia azul celeste En VIS: amarilla 0.97 Fuente: Datos experimentales Cromatografía en capa fina de flavonoides en UV 365 nm 1 2 3 4 5 6 7 8 9 1. palo de pito, 2. nance, 3. palo de sangre 4. zarzaparrilla, 5. pericón, 6. ácido caféico, 7. ácido clorogénico, 8. rutina 9. kaemferol Cromatografía en capa fina de flavonoides en VIS 1 2 3 4 5 6 7 8 9 1. palo de pito, 2. nance, 3. palo de sangre 4. zarzaparrilla, 5. pericón, 6. ácido caféico, 7. ácido clorogénico, 8. rutina 9. kaemferol 3.1.2.2 Taninos Se realizaron ensayos en tubo para evaluar la presencia de taninos ya que pueden ser compuestos responsables de color. En la siguiente tabla se observan los resultados obtenidos evidenciando únicamente el nance la presencia de taninos de tipo pirogalol 36 Tabla No. 4 Especie Resultados Palo de sangre (B. arborea) Negativo para taninos, no corteza presentó precipitado con NaCl, gelatina- NaCl y mostró una coloración naranja con FeCl3 Nance (B. crassifolia) Presentó precipitados con corteza los reactivos utilizados y mostró una coloración negro azulado con FeCl3 Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Negativo para taninos, no presentó precipitado con NaCl, gelatina- NaCl y mostró una coloración verde oscura con FeCl3 Negativo para taninos, no presentó precipitado con NaCl, gelatina- NaCl y mostró una coloración verde oscura con FeCl3 Negativo para taninos, no presentó precipitado con NaCl, gelatina- NaCl y mostró una coloración verde oscura con FeCl3 Observación Presencia de fenólicos compuestos Presencia de taninos tipo pirogalol Presencia fenólicos de compuestos Presencia fenólicos de compuestos Presencia fenólicos de compuestos Fuente: Datos experimentales 3.1.2.3 Cumarinas En la siguiente tabla se observan los resultados obtenidos de los extractos con KOH un resultado positivo lo constituye una fluorescencia intensa al UV, por lo que se determinó que únicamente el pericón presentó cumarinas. Tabla No. 5 Especie Resultados Observación Palo de sangre (B. arborea) Negativo, no presentó No se detectaron cumarinas corteza fluorescencia al UV Nance (B. crassifolia) corteza Negativo, no presentó fluorescencia al UV Árbol de pito Negativo, no presentó (E. berteroana) corteza fluorescencia al UV Zarzaparrilla Negativo, no presentó (S. domingensis) rizoma fluorescencia al UV Pericón (T. lucida) planta Presentó fluorescencia Presencia de cumarinas entera azul celeste intensa 37 Fuente: Datos experimentales Identificación de Cumarinas en UV 365 1 2 3 4 5 6 7 1. palo de pito, 2. nance, 3. palo de sangre, 4. zarzaparrilla, 5. pericón, 6. ácido cumárico, 7. umbeliferona 3.1.2.4 Antraquinonas En la siguiente tabla se observan los resultados obtenidos al realizar la prueba de Bornträger, la cual se considera positivo cuando se torna rojo o rosado; ninguno de los extractos mostró cambios de color en la fase alcalina. Especie Palo de sangre (B. arborea) corteza Nance (B. crassifolia) corteza Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Tabla No. 6 Resultados Observación Negativo, no presentó No se cambio de coloración antraquinonas Negativo, no presentó cambio de coloración Negativo, no presentó cambio de coloración Negativo, no presentó cambio de coloración Negativo, no presentó cambio de coloración detectaron Fuente: Datos experimentales Metabolitos presentes en los extractos: En la siguiente tabla se observan los metabolitos identificados en el tamizaje fitoquímico de los cinco extractos analizados, en el cual se demuestra que todas las muestras presentaron flavonoides, el nance presentó taninos, el pericón cumarinas y ninguna de las muestras presentó antraquinonas. Especie Palo de sangre (B. arborea) corteza Nance (B. crassifolia) corteza Tabla No. 7 Metabolitos identificados Flavonoides Taninos Cumarinas Antraquinonas +++ ------+++ +++ 38 --- --- Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera +++ --- --- --- +++ --- --- --- +++ --- +++ --- +++ (presencia del metabolito) --- (ausencia del metabolito) Fuente: Datos experimentales 3.1.3 Cuantificación de flavonoides En la siguiente tabla se observa el porcentaje de flavonoides totales expresados en hiperósido en cada uno de los extractos a 425 nm de 3 repeticiones, en la cual se observa que el pericón mostró el mayor porcentaje. Tabla No. 8 Especie vegetal Porcentaje de flavonoides totales expresado en hiperósido Palo de sangre (B. arborea) corteza 0.0339 Nance (B. crassifolia) corteza 0.0145 Árbol de pito (E. berteroana) corteza 0.0222 Zarzaparrilla (S. domingensis) rizoma 0.0216 Pericón (T. lucida) planta entera 0.2927 Fuente: Datos experimentales 3.1.4 Determinación de absorbancia máxima: En la siguiente tabla se observa la longitud de onda en la cual se determinó la absorbancia máxima a una concentración de 0.1 mg/mL de cada uno de los extractos, de acuerdo a la longitud de onda que se presentan las bandas, se confirma la presencia de flavonoides en los extractos, ya que todos los extractos muestran una banda en rangos de absorción a 270-280 nm y el palo de sangre es el que presenta una mayor absorbancia. Nombre de la Especie. Palo de sangre (B. arborea) corteza Nance (B. crassifolia) corteza Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Tabla No. 9 Longitud de Absorbancia onda máxima 280nm. 1.82540 280nm. 0.70110 274nm. 1.95550 283nm. 0.87759 280nm. 1.52970 Fuente: Datos experimentales 39 En la tabla No. 10 se observa la longitud de onda de máxima absorbancia de los estándares y las especies naturales nativas en la región visible del espectro electromagnético mostrando la cochinilla una longitud de onda similar a los extractos, mientras que el rojo 3 es similar al extracto de palo de sangre. Nombre del Extracto Tabla No.10 Longitud de onda de mayor absorbancia Palo de sangre (B. arborea) corteza Nance (B. crassifolia) corteza 280nm 244nm 273nm 273nm 337nm 283nm 328nm 290nm 344nm 261nm 429nm 314nm 485nm 277nm Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Amarillo No. 5 Amarillo No. 6 Cochinilla 311nm 236nm 485nm Rojo No. 3P Colorante o estándar con similar longitud de onda máxima Cochinilla Rojo No. 3 Cochinilla Cochinilla Ninguno Cochinilla Ninguno Ninguno Ninguno Ninguno Ninguno Ninguno Ninguno Árbol de pito, Nance, Zarzaparrilla, Palo de Sangre. Ninguno Palo de Sangre Ninguno Fuente: Datos experimentales 3.1.5 Cálculo de equivalentes de color de los diferentes extractos vegetales con respecto a los colorantes sintéticos a 480nm: La determinación de mg/ml se realiza basada en la similitud colorimétrica que presenta cada extracto respecto a los colorantes sintéticos que se utilizaron como estándares, a una longitud de onda de 480nm y a una concentración de 0.10 mg/ml de cada uno de los extractos, ya que teóricamente el colorante presenta la mayor absorbancia. En la tabla No. 11 se muestran los miligramos equivalentes de extractos vegetales con colorantes sintéticos a 480nm, observándose que el palo de sangre presenta la mayor concentración equivalente al amarillo No.6. 40 Tabla No. 11 mg/ml mg/ml Extracto a mg/ml equivalentes 0.10 mg/mL. equivalentes equivalentes de amarillo de amarillo de rojo No. 3 No. 6 No. 5 Palo de sangre (B. ---------27.92 4.58 arborea) corteza Nance (B. crassifolia) 1.089 ------------------corteza Árbol de pito (E. 1.04 ------------------berteroana) corteza Zarzaparrilla ---------6.90 0.099 (S. domingensis) rizoma Pericón (T. lucida) 1.10 ------------------planta entera mg/ml equivalentes de cochinilla 13.53 ------------------- 3.48 ---------- Fuente: Datos experimentales 3.1.6 Cálculo de equivalentes de color de los diferentes extractos vegetales con respecto a los colorantes sintéticos a su longitud de máxima absorbancia: La determinación de mg/ml se realiza basada en la similitud de los pico de máxima absorbancia que presenta cada extracto respecto a los colorantes sintéticos que se utilizaron como estándares, a una longitud de onda donde ambos tenga igual o similar picos de máxima absorbancia, realizando la curva de calibración a la longitud de onda del estándar a una concentración de 0.10 mg/mL. En la tabla No. 12 se muestra la equivalencia de concentración de los extractos con el colorante natural cochinilla presentando la mayor concentración el palo de sangre seguido del palo de pito. 41 Nombre Extracto Tabla No. 12 mg/ml mg/ml del mg/ml equivalentes equivalentes equivalentes de amarillo de amarillo de rojo No. 3 No. 6 No. 5 de (B. ---------------------0.567 Palo sangre arborea) corteza Nance (B. crassifolia) corteza Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera mg/ml equivalentes de cochinilla 265.625 ------------- ---------- ---------- 99.93 ------------- ---------- ---------- 203.19 ------------- ---------- ---------- 77.50 ------------- ---------- ---------- ---------- Fuente: Datos experimentales 3.1.7 Espectro de absorción a diferentes pH de los extractos de las especies en estudio: Se realizó un barrido para cada una de las especies nativas en estudio y los estándares de los colorantes en estudio a pH 3, 4, 5; así poder observar donde presentan su máxima absorbancia. En la tabla No. 13 se observa la longitud de onda de máxima absorbancia de los estándares y las especies naturales nativas a pH 3, en la región visible del espectro electromagnético. Tabla No. 13 Nombre del Extracto Longitud de onda de mayor absorbancia Palo de sangre (B. arborea) corteza 307nm 323nm Nance (B. crassifolia) corteza 306nm 360nm 424nm Árbol de pito 338nm (E. berteroana) corteza 487nm 656nm Zarzaparrilla (S. domingensis) 306nm rizoma 325nm 485nm 42 Pericón (T. lucida) planta entera 342nm 676nm 623nm 430nm 656nm 306nm 485nm 316nm 485nm 532nm 318nm 485nm 512 nm Amarillo No.5 Amarillo No.6 Cochinilla Rojo No.3 Rojo No. 40 Fuente: Datos experimentales En la Tabla No. 14 se observa la longitud de onda de máxima absorbancia de los estándares y las especies naturales nativas a pH 4, en la región visible del espectro electromagnético. Tabla No. 14 Longitud de onda de mayor absorbancia Palo de sangre (B. arborea) corteza 322nm 382nm Nance (B. crassifolia) corteza 308nm Árbol de pito 339nm (E. berteroana) corteza 486nm Zarzaparrilla (S. domingensis) 308nm rizoma 323nm 486nm Pericón (T. lucida) planta entera 341nm 308nm Amarillo No.5 308nm 430nm Amarillo No.6 308nm 485nm Cochinilla 308nm 485nm 496nm Rojo No.3 531nm 307nm 430nm Rojo No. 40 510 nm Nombre del Extracto Fuente: Datos experimentales 43 En la Tabla No. 15 se observa la longitud de onda de máxima absorbancia de los estándares y las especies naturales nativas a pH 5, en la región visible del espectro electromagnético. Tabla No. 15 Nombre del Extracto Longitud de onda de mayor absorbancia Palo de sangre (B. arborea) corteza 305nm 323nm 396nm Nance (B. crassifolia) corteza 304nm 357nm 365nm Árbol de pito 304nm (E. berteroana) corteza 337nm Zarzaparrilla (S. domingensis) 304nm rizoma 323nm 486nm Pericón (T. lucida) planta entera 304nm 340nm 486nm Amarillo No.5 427nm 533nm Amarillo No.6 316nm 485nm Cochinilla 304nm 485nm 494nm Rojo No.3 528nm 311nm 350nm Rojo No. 40 506 nm Fuente: Datos experimentales Pruebas de tinción: Se realizaron pruebas de tinción en lana y se observó la capacidad tintórea de los diferentes extractos se anotó el color correspondiente al pantone de Comex. 44 Tabla No.16 Especie Palo de sangre arborea) corteza Nance (B. corteza Frío (B. Ámbar I-209 crassifolia) Natuzzi F3-09 Resultados de Color Caliente Mordiente Goleen Tejocote H2-13 H2-12 Ladrillo F3-12 Cartón H4-09 Árbol de pito (E. berteroana) corteza Polen J3-07 Pátzcuaro J3-06 Leopardo J3-09 Zarzaparrilla (S. domingensis) rizoma Calcuta G1-03 Bacalao H2-06 Ocre H3-12 Pericón (T. lucida) planta entera Limón real J3-11 Grillo J3-14 Marañón J3-13 Fuente: Datos experimentales 45 Prueba de coloración en cosméticos: Nance (B. crassifolia) corteza Gel: pH 7 No. 1 2 3 Tabla No. 17 Color según Pantone Color COMEX® denominación internacional No. Nombre 0.5 % 148 U G-06 Mamey 1% 150 C H2-09 Chabacana Extracto sin diluir 167 C F2-13 Paprika Concentración Fuente: Datos experimentales Loción: pH: 5 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 18 Color Color según pantone denominación COMEX® internacional No. Nombre 1345 C H2-08 Galleta 1365 C H2-10 Naranjosa 152 U G2-13 Guaraná Fuente: Datos experimentales Shampoo: pH 9 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 19 Color según Color denominación pantone COMEX® internacional No. Nombre 4715 C F4-10 Maple 1675 U D3-11 Durazno 470 U F4-09 Tasmania Fuente: Datos experimentales Todas las muestras de nance: 46 Zarzaparrilla (S. domingensis) rizoma Gel: pH 7 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 20 Color Color según pantone denominación COMEX® internacional No. Nombre 116 U H1-10 Mango 1375 C H1-13 Jarabe 158 C G2-14 Puebla Fuente: Datos experimentales Loción: pH 5 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Color denominación internacional 122 U 1375 C 1595 C Tabla No. 21 Color según pantone COMEX® No. Nombre H1-11 Holanda H1-13 Jarabe G2-12 Magma Fuente: Datos experimentales Shampoo: pH 8 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 22 Color Color según pantone denominación COMEX® internacional No. Nombre 1385 C H2-12 Tejocote 173 C R0-16 Oaxaca 167 U E3-09 Monarca Fuente: Datos experimentales Todas las muestras de zarzaparrilla: 47 Pericón (T. lucida) planta entera Gel: pH 7 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Color denominación internacional 3985 C 582 C 4485 C Tabla No. 23 Color según pantone COMEX® No. Nombre J3-14 Grillo K3-12 Salamandra J4-13 Gipy Fuente: Datos experimentales Loción: pH 5 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 24 Color Color según pantone denominación COMEX® Nombre internacional No. 118 C I3-13 Marañón 164 U I4-12 Bellota 147 U J4-12 Camaleón Fuente: Datos experimentales Shampoo: pH 8 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 25 Color Color según pantone denominación COMEX® internacional No. Nombre 117 C J3-12 Marañon 1405 U I4-13 Barro 463 C I4-14 Lirio Fuente: Datos experimentales Todas las muestras de pericón: 48 Àrbol de pito (E. berteroana) corteza Gel: pH 7 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 26 Color según pantone Color COMEX® denominación internacional No. Nombre 107 C K1-12 Oruga 124 C J2-12 León 101 C K1-09 March Fuente: Datos experimentales Loción: pH 5 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 27 Color Color según pantone denominación COMEX® Nombre internacional No. 601 C K1-06 Adivinanza 124 C K2-06 Tula 124 C K2-06 Tula Fuente: Datos experimentales Shampoo: pH 8 No. 1 2 3 Concentración 0.5 % 1% Extracto sin diluir Tabla No. 28 Color Color según denominación pantone COMEX® internacional No. Nombre 110 C J2-13 Pradera 124 C J2-12 León -----------El colorante no se disolvió Fuente: Datos experimentales Todas las muestras de palo de pito: 49 Palo de sangre (B. arborea) corteza Gel: pH 7 No. Concentración 1 2 3 0.5 % 1% Extracto sin diluir Color denominación internacional 1375 C 151 C ---------------- Tabla No. 29 Color según pantone COMEX® No. Nombre H1-13 Jarabe G1-14 Hallowen El colorante no se disolvió Fuente: Datos experimentales Loción: pH 5 No. Concentración 1 2 3 0.5 % 1% Extracto sin diluir Color denominación internacional 1495 C 1585 C 158 C Tabla No. 30 Color según pantone COMEX® No. Nombre H1-12 Noviembre G1-13 Nierman G2-14 Puebla Fuente: Datos experimentales Shampoo: pH 7 No. Concentración 1 2 3 0.5 % 1% Extracto sin diluir Color denominación internacional 138 C 166 C 158 C Tabla No. 31 Color según pantone COMEX® No. Nombre H2-14 Olmeca F1-14 Zanahoria G2-14 Puebla Fuente: Datos experimentales Todas las muestras de palo de sangre: 50 Costo de producción de colorantes naturales y costo de venta de los colorantes sintéticos En la siguiente tabla se muestra el costo de producción por gramo de los colorantes naturales, en el cual se demuestra que de acuerdo a los rendimientos obtenidos en cada especie, el nance es el que presenta el costo menor (Q10.78) y el costo más alto lo presenta el pericón (Q72.29) Tabla No. 32 Especie vegetal Palo de sangre (B. arborea) corteza g producidos Costo de Producción por gramo en Q. 28 180 57,57 10,78 27 46 65,80 42,18 21 72,29 Nance (B. crassifolia) corteza Árbol de pito (E. berteroana) corteza Zarzaparrilla (S. domingensis) rizoma Pericón (T. lucida) planta entera Fuente: Datos experimentales En la siguiente tabla se muestra el costo de los colorantes sintéticos, los cuales se comercializan de Q 0.25-0.62 por g. Tabla No. 33 Colorante Costo de Venta por gramo en Q. Rojo No. 3 Eritrosina Rojo No. 40 Allura Amarillo No. 5 Tartrazina Amarillo No. 6 Amarillo Crepúsculo Cochinilla 0,25 0,35 0,25 0,27 0,62 Fuente: Datos experimentales Estudio de Estabilidad En las siguientes gráficas se muestra la estabilidad de cada extracto y estándar a los diferentes pH, mostrando el número de días a los cuales disminuye el 80% de su concentración inicial. 51 Gráfica No. 1 Estabilidad Àrbol de Pito (E. berteroana) % Concentración 140,00 120,00 100,00 pH3 80,00 pH4 60,00 pH5 40,00 20,00 0,00 2 1 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Días Gráfica No. 2 , Estabilidad Zarzaparilla (S. dominguensis) % Concentración 120,0 100,0 80,0 pH3 60,0 pH4 pH5 40,0 20,0 0,0 1 2 3 4 5 6 Días Gráfica No. 3 Estabilidad Pericón (T. lucida) % Concentración 120,00 100,00 80,00 pH3 60,00 pH4 40,00 pH5 20,00 0,00 1 2 3 4 5 6 7 8 Días 52 9 10 11 12 13 14 Gráfica No. 4 Estabilidad Cochinilla % Concentración 120,00 100,00 80,00 pH3 pH4 60,00 pH5 40,00 20,00 0,00 1 2 3 4 5 6 Días Gráfica No. 5 Estabilidad Tartrazina FD&C, amarillo No. 5 % Concentración 140 120 100 pH3 80 pH4 60 pH5 40 20 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Día Gráfica No. 6 % Concentración Estabilidad Amarillo Crepúsculo FD&C amarillo No. 6 120 100 80 pH3 60 pH4 pH5 40 20 0 1 2 3 4 5 6 7 8 9 Días 53 10 11 12 13 14 15 16 Gráfica No. 7 % Concentración Estabilidad Allura FD&C rojo No. 40 140,00 120,00 100,00 pH3 pH4 pH5 80,00 60,00 40,00 20,00 0,00 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Días Gráfica No. 8 Estabilidad Eritrosina FD&C, rojo No. 3 % Concentración 140 120 100 pH3 80 pH4 60 pH5 40 20 0 1 2 3 4 5 6 7 8 9 Días 54 1 1 1 1 1 1 1 III.2 Discusión de Resultados Se seleccionaron 5 especies vegetales nativas de América, que por la composición química reportada en la literatura, constituyen un potencial en la industria farmaceútica, alimenticia y/o cosmética, especialmente como colorantes, tintes, pigmentos y/o antioxidantes. Se realizó una extracción con un disolvente polar (etanol al 95%) con ácido clorhídrico para favorecer la separación e identificación de los colorantes presentes en las especies, ya que de acuerdo a la estructura química de los metabolitos de interés (flavonoides y antocianinas), son más afines en disolventes polares tipo metanol o etanol, para la cual se seleccionó etanol, por su baja toxicidad y uso en farmacia y cosmética. Se realizó por percolación ya que es una técnica exhaustiva que agota el material vegetal y se asegura la extracción total de los metabolitos de interés. De acuerdo a los resultados obtenidos se observó que B. crassifolia (nance) corteza presentó el mayor rendimiento de extracción (60%) y el menor rendimiento lo presentó E. berteroana (palo de pito) corteza (11%). Lo cual nos demuestra la rentabilidad del nance respecto a las otras especies. Para la caracterización fitoquímica, se realizaron ensayos macro y semimicro y cromatografía en capa fina (CCF) de los principales grupos químicos responsables del color en la mayoría de las especies vegetales, los cuales son compuestos fenólicos como flavonoides, antocianinas, taninos, cumarinas y antraquinonas. En todos los extractos se observaron flavonoides y compuestos fenólicos con los ensayos macro y semimicro y en la CCF el extracto que presentó mayor número de bandas, identificándose posibles flavanonoles fue B. arborea (palo de sangre), en la literatura se reportan taninos, pigmentos y resinas. En el extracto de S. domingensis (zarzaparrilla) se identificó la presencia de ácido clorogénico y posibles flavanonas y de acuerdo a la literatura se reportan flavonoides, antocianinas, leucoantocianinas, taninos y polifenoles. El extracto de B. crassifolia (nance) se identificó la presencia de compuestos fenólicos tales como flavonoides tipo flavanonas y taninos que de acuerdo a la literatura se reporta la presencia de taninos, flavonoides y proantocianidinas (Cáceres, 1996). En un estudio se realizó el tamizaje fotoquímico en diferentes extractos mostrando únicamente en el extracto de acetato de etilo flavonoides en muy poca cantidad y taninos abundantemente en el extracto acetato de etilo y metanol (Vázquez et al., 1999). En el extracto de E. berteroana (árbol de pito) se identificaron posibles flavonas y flavononoles, en la literatura se reportan en las flores flavonoides, antocianinas y en la corteza materias colorantes, resina neutra amarilla y una roja que es un alcaloide y de la corteza y semillas se han aislado dos colorantes utilizados en la manufactura de brazaletes, gargantillas y artículos decorativos. En el extracto de T. lucida (pericón) se identificaron isoflavononas, chalconas, auronas y cumarinas, en la literatura se reporta flavonoides (quercetagetina, patuletina, isoramnetina), taninos, leucoantocianidinas y cumarinas (7-metoxicumarina). 55 Se demostró en los ensayos cualitativos la presencia de flavonoides en todas las especies, por la cual se realizó una cuantificación por espectrofotometría UV/VIS, determinando el porcentaje de flavonoides totales expresado en hiperósido, siguiendo el método de la Real Farmacopea Española (2002), realizando las mediciones a 425 nm, en la cual se determinó que el pericón fue el que presentó mayor porcentaje (0.3%) y el menor porcentaje de flavonoides lo presentó el nance (0.01%). De acuerdo a la revisión realizada no se reportan datos de cuantificación de flavonoides presentes en dichas especies, por lo estos datos constituyen un primer reporte respecto al porcentaje de flavonoides, y como la presencia de los metabolitos secundarios es variable en cada especie y dependen de la época de recolección, estado fenológico de la especie, clima, suelo, altitud, etc, no se pueden comparar con otras especies vegetales, por lo que para establecer los límites máximos y mínimos de flavonoides en cada especie, se debería realizar un estudio incluyendo algunas de las variables mencionadas más importantes, para determinar si es aceptable o no el porcentaje determinado y de esta manera garantizar la calidad en las especies, siempre y cuando sean estos metabolitos los que se utilicen como marcadores. Se determinó la longitud de onda a la cual los extractos mostraban la absorbancia máxima, presentándose en todas las especies un rango entre 274-283 nm, lo cual confirma que los compuestos presentes en las especies corresponde a flavonoides tipo flavonas (250-280 nm), flavonoles (250-280 nm) o isoflavonas (275-295 nm) (Lock, 1997). Al compararlos con estándares de colorantes artificiales amarillo No. 5 (261 y 429 nm), amarillo No. 6 (314, 485nm) y rojo No. 3 (236 y 485nm), se observó que ninguno de los extractos presenta máximos de absorción similares a los estándares, únicamente el palo de sangre presenta una banda similar al rojo No. 3. Por lo que se decidió incluir un estándar de colorante natural (cochinilla), el cual es sustituto de los colorantes rojo No. 2, rojo No. 3, rojo No. 19 y rojo No. 40, se observó que los extractos de árbol de pito, nance, zarzaparrilla y palo de sangre son similares, ya que la cochinilla absorbió a 277 nm. Se realizó el cálculo de equivalentes de color de los diferentes extractos con respecto a los colorantes sintéticos a 480 nm y se evidenció que el extracto de palo de sangre es el que presentó la mayor concentración equivalente al amarillo No. 6, con una concentración de 27.92 mg/ml y respecto a la longitud de onda máxima de los extractos, se estableció la similitud respecto a la cochinilla determinándose que el palo de sangre y el palo de pito presentan la mayor equivalencia con concentraciones de 266 y 203 mg/ml. Se realizó una evaluación espectrofotométrica a diferentes pH (3, 4, 5) añadiendo soluciones buffer y se observó un cambio de las longitudes de onda, presentando un desplazamiento mayor, respecto al observado inicialmente en los extractos etanólicos, lo cual demuestra que cambios de pH afectan los máximos de absorción de los espectros obtenidos con disolventes como el etanol. Sin embargo al compararlos entre los diferentes pH no se observan cambios significativos, únicamente en el palo de sangre a pH 4 su absorbancia máxima se presentó a una longitud de onda de (322 nm) siendo mayor respecto a pH 3 (307 nm) y pH 5 (305 nm). En el nance y la zarzaparrilla se mantiene la máxima absorbancia a los diferentes pH entre 304 y 308 nm, en el palo de pito y pericón se presenta la máxima absorbancia a pH 3 y pH 4 a una longitud de onda de 338 y 341 nm respectivamente, mientras que pH 5 disminuye a 304 nm. 56 La coloración constituye un elemento subjetivo para la evaluación de la calidad de un producto; está frecuentemente relacionada con la presencia de impurezas, la calidad tecnológica, condiciones de almacenamiento e invasión bacteriana. Desde el punto de vista tecnológico se busca obtener un poder colorante seguro, estable, reproducible y eficaz; utilizando las dosis más pequeñas de colorante. Este aspecto, es principalmente importante en países europeos que poseen diversas campañas de información al respecto, lanzadas por asociaciones de consumidores. También es importante mencionar que las cantidades de colorante utilizadas en sistemas alimenticios son menores en relación a las utilizadas en sistemas cosméticos, farmacéuticos y en la industria textil (Multon, 2000). Por lo que se procedió a evaluar de forma preliminar el comportamiento de los colorantes naturales obtenidos de las cinco especies nativas, en sistemas cosméticos y en el teñido de fibras. Actualmente, el mundo se ve invadido por una tendencia ecológica o protección del medio ambiente, lo que está cambiando muchos patrones de comportamiento, incluyendo las corrientes de la moda y así se habla de la “ecología en el vestir” o de los “ecotextiles”. En esta moda ecológica se contempla entre otros requisitos, el teñido con tintes naturales (Lock, 1997). Por lo que para evaluar el potencial tintóreo de las especies se procedió a realizar la técnica de tinción utilizando tres formas, método directo en frío, método directo en caliente y método indirecto con mordiente. Se observó que en todos los extractos, el color se intensificó con la técnica en caliente y utilizando mordiente. Los colores del palo de sangre fueron los más intensos presentándose tonalidades entre amarillo a rojo naranja, en la literatura se reporta el uso de los frutos por su color amarillo utilizándolo en la fabricación de artesanías, también se describe una especie perteneciente al mismo género, Bocconia integrifolia (pincullo) corteza, utilizada en el teñido de fibras, de la cual se obtiene una coloración amarillo- naranja. El nance presentó tonalidades semejantes al beige, dentro de los usos etnomédicos y populares se reporta el uso de la corteza y la cáscara del fruto para teñir hilos de algodón de color café claro, del fruto verde se obtiene una tinta y por la presencia de taninos (20-30%) se utiliza en la industria de cueros. El palo de pito presentó colores incluidos en los amarillos, se reportan dos colorantes de su corteza y las semillas utilizados en la manufactura de brazaletes, gargantillas y artículos decorativos. Como especies tintóreas se reportan las cortezas de Erythryna cristagalli (pisonay) y E. edulis (basul) utilizadas por su color beige. La zarzaparrilla presentó tonalidades en los amarillo- naranja, se reporta que las raíces de varias especies del género se han utilizado como colorantes de refrescos, pero no se indica su uso como tinte, por lo que constituiría un primer reporte como planta tintórea. El pericón presentó tonalidades verdes, y no se reporta su uso como planta tintórea, sólo otras especies de Tagetes se han utilizado por su color amarillo. De acuerdo a los resultados obtenidos se demostró el potencial de las cinco especies como plantas tintóreas, sin embargo faltaría realizar pruebas fisicoquímicas y fisico-mecánicas para determinar la resistencia y solidez del tinte en las fibras. 57 Igualmente por la tendencia de la cosmética hacia lo natural se decidió realizar pruebas de coloración en tres diferentes productos. Se escogieron los cosméticos tipo acuosos: gel, shampoo y loción, para realizar las pruebas de colorantes, debido que los extractos eran de tipo etanólicos, éstos debían disolverse completamente en cada cosmético para poder ser incorporados. Se elaboraron los cosméticos como base, para después ser coloreados en pequeñas porciones con los extractos. Las concentraciones de los extractos fueron de 0.5 %, 1 % y extracto concentrado, para poder observar la gama de tonalidades de colores de los diferentes extractos vegetales, a tres diferentes concentraciones, los cuales solamente se utilizaron para colorear el cosmético, es decir hacer más atractiva su presentación, y no con fines de pigmentación, es decir que el cosmético no coloree la piel al ser aplicado (esmalte de uñas, tinte capilar, sombras, etc); por lo anterior, las concentraciones de los extractos pueden ser inferiores a 0.5 % o bien utilizarse sin diluir, dependerá del formulador. Los colorantes de origen animal y vegetal han sido casi totalmente sustituidos por los derivados orgánicos sintéticos del alquitrán, conocidos como anilinas, los cuales deben ser perfectamente adecuados no sólo en su aspecto técnico (pureza de tonos, compatibilidad entre el pH del colorante y del cosmético, etc) sino médico para evitar efectos tóxicos irritantes o sensibilizantes. Sin embargo, actualmente el uso de sustancias provenientes de la naturaleza, han tomado auge, tal es el caso de los cosméticos naturales o verdes, donde todos las materias primas involucradas son de origen vegetal, o los llamados fitocosméticos que incluyen dentro de su formulación 1 o más componentes de origen vegetal. En el presente estudio se demostró que los extractos de las 5 plantas nativas, son efectivas para ser utilizadas como colorantes en cosméticos y además pueden proveer al cosmético otras propiedades propias de cada planta dependiendo de su composición química y actividad farmacológica. El pH es importante en un cosmético, ya que éste al ser aplicado en la piel, debe tener el valor igual a la parte de la piel donde se aplique (cuero cabelludo, uñas, dermis, etc), que es de 5.5. El colorante influye de manera significativa en la variación de pH, estabilidad de cosmético (separación de fases en emulsiones, etc.), como se observa en los resultados los valores de pH en geles, shampoo y loción, son diferentes en las pruebas realizadas en los extractos vegetales y por lo tanto en la formulación debe incluirse correctores de pH (ácidos o bases, según el caso), para poder observar el color del cosmético final; dentro del proyecto de investigación no se realizó debido a que el propósito del mismo era determinar el uso en cosméticos no diseñar una formulación con los mismos. La evaluación del color es subjetiva, ya que se realizó de forma visual al compara el color del cosmético con un pantone que tiene los códigos internacionales de colorantes, sin embargo su adquisición es difícil, por tal razón se analizaron también con pantone de pinturas marca COMEX que puede ser adquirido más fácilmente. De acuerdo a los resultados obtenidos se pudo observar que al diluir el extracto al 1% se obtienen colores más intensos, con una mayor brillantez, que se incorporan mejor a las diferentes bases de los cosméticos, en el extracto concentrado es difícil lograr la solubilidad en 58 las bases, no son estables y se obtienen en la mayoría dos fases y se observan partículas en suspensión que no es posible homogenizar cambiando la apariencia del cosmético. En el caso del nance se observaron colores amarillo-naranja tanto en la loción como en el gel ya que se mantiene un rango de pH de 5 y 7 respectivamente, mientras que en el shampoo, se incrementa el pH a 9, el color se torna más rojo; por la presencia de taninos pueden aprovecharse las propiedades astringentes en lociones tónicas faciales, pero hay que considerar que se pueden presentar incompatibilidades con los otros componentes de la formulación por lo que deben seleccionarse adecuadamente los constituyentes auxiliares para evitar dichos problemas; por la actividad antimicrobiana y antifúgica reportada en los extractos de corteza de nance, podrían utilizarse no sólo como colorantes, sino también como preservantes en los cosméticos y por los flavonoides y antocianinas pueden mostrar un efecto antioxidante en la formulación. En el extracto de pericón se observaron colores amarillo - verdoso en el gel y loción, intensificándose a verde- café en el shampoo; se han reportado flavonoides que pueden considerarse antioxidantes el cual podría ser aprovechado en cosméticos faciales y ha presentado actividad antimicrobiana y funguicida, el cual podría aprovecharse como preservante y algunas furanocumarinas han reportado actividad fotodinámicas las cuales se han aprovechado para incorporarlas en protectores solares. En el extracto de zarzaparrilla se observaron tonalidades amarillo-naranja en la loción y gel mientras que en el shampoo por el incremento de pH se presentaron tonalidades más intensas en colo rojo; en dicha especie se ha reportado actividad cicatrizante y antiinflamatoria, la cual se podría aprovechar para incorporar el extracto en cremas antiarrugas y cicatrizantes y por su propiedad antifúgica se podría incorporar en geles para los pies, por su actividad antimicrobiana podría utilizarse como preservante y por la presencia de flavonoides, que han demostrado actividad antioxidante, se podría incorporar en cremas antiedad o agentes antisolares como fotoprotectores. En el extracto de palo de pito se observaron coloraciones de amarillo - naranja en el gel y la loción y en el shampoo se intensificó el naranja; por la presencia de flavonoides, antocianinas y ácidos orgánicos se podría aprovechar en cremas humectantes, antiedad, antioxidantes, los flavonoides han reportado antividad antifúngica y antibiótica los cuales igualmente podrían constituirse como preservantes. El extracto de palo de sangre presentó tonalidades naranja-rojo en el gel y loción intensificándose el rojo en el shampoo; por la presencia de taninos podría constituirse como un astringente en tónicos faciales, por los flavonoides como antioxidantes, además de la propiedad antimicrobiana como preservante y por su propiedad antiinflamatoria podría ser utilizado en cremas faciales y corporales; las cuales son de las actividades más deseadas en los cosméticos. De acuerdo a los resultados obtenidos se puede visualizar el potencial cosmético en las cinco especies como colorante, ya que presentaron colores interesantes para la industria, en su mayoría amarillo-naranja-rojo, se incorporaron a las diferentes bases evaluadas a una concentración del 1%, lo cual es algo rentable; por lo que se debe continuar con el diseño de 59 formulaciones para evaluar su estabilidad y aprovechar las propiedades reportadas para su estudio y validación en una indicación específica (antioxidante, preservante, cicatrizante, humectante, antiarrugas, fotoprotectoras, etc). Según los resultados obtenidos en el estimado de costos de producción de los colorantes naturales y el precio de venta de los colorantes sintéticos disponibles en el mercado, se observa una marcada diferencia. Sin embargo la mayoría de colorantes artificiales posee restricciones de uso y algunos se encuentran restringidos a productos específicos por los efectos adversos y toxicidad que presentan aún en bajas cantidades. La Eritrosina se consideraba un aporte nutricional de yodo, pero estudios americanos demostraron la formación de tumores tiroideos en estudios in vivo, además de transtornos neurofisiológicos, por lo que en la actualidad su uso se encuentra limitado. Por otra parte el Rojo No. 40 únicamente puede utilizarse en alimentos que contienen grasas, además se han reportado estudios toxicológicos mostrando resultados contradictorios sobre su efecto mutagénico y teratogénico, y en la Unión Europeano no está permitido. El Rojo Amaranto fue retirado por la FDA de la lista de colorantes permitidos en 1976, debido a que se sospecha que puede ser carcinogénico y ha mostrado embriotoxicidad en estudios in vivo. (Lock, 1997; Multon, 2000). En cuanto a los colorantes amarillos la FDA establece que debe especificarse el uso en la etiqueta de los productos; especialmente en el caso del amarillo No. 6 que puede provocar severas reacciones alérgicas. En el caso del amarillo No. 5 no debe especificarse su nombre como tal en la etiqueta, ya que puede provocar alergias en algunas personas particularmente en aquellas que son sensibles a la aspirina (Lewis, R; 1989). Por lo que se justifica la investigación en colorantes naturales, por no mostrar efectos dañinos a la salud y no necesitar certificación para ser utilizados en procesos industriales, lo cual les confiere importantes ventajas, además de las propiedades que presentan las especies vegetales como agentes antioxidantes, antimicrobianos, etc. Es por ello que en años recientes se ha renovado el interés en colorantes naturales por las limitaciones en el uso de algunos colorantes sintéticos en alimentos, medicamentos y en productos cosméticos debido a su toxicidad. Son frecuentes las denuncias por el uso de colorantes no adecuados en estos productos de uso humano. Esto ha originado un considerable interés mundial en el desarrollo de los colorantes naturales. Un indicativo de ello, es el número y distribución de las patentes reportadas a nivel mundial, en los últimos cinco años de un total de 427 patentes 356 están referidas a colorantes naturales y 71 a colorantes sintéticos (Lock, 1997). En las gráficas de estadística descriptiva, que muestran los resultados del estudio de estabilidad, de los extractos de las plantas investigadas a 40º C y tres diferentes pH (3, 4 y 5); puede observarse que el extracto de B. arborea no es afectado grandemente por el pH, ya que presenta un comportamiento similar a los diferentes valores de pH ensayados, lo cual se corrobora estadísticamente con un valor de p=0.5822. El pH 3 parece ser el mejor para conservar la concentración inicial. Este comportamiento también se observa en el extracto de E. berteroana, que muestra mayor estabilidad a este pH, con un valor de p=0.005; mientras que a pH 4 y 5 se observan signos de inestabilidad desde el segundo día, ya que la 60 concentración aumenta por la aglomeración de sustancias en partículas que al principio no son perceptibles al ojo humano, pero sí son evidentes espectrofotométricamente. Según lo discutido anteriormente, estos dos extractos podrían utilizarse para colorear sistemas alimentarios o cosméticos formulados a pH 3 que incluyan en su formulación un sistema de buffer que asegure el pH del sistema hasta el momento del consumo. Entre los sistemas alimentarios que se formulan a este pH pueden mencionarse las bebidas resfrescantes sin alcohol, frutas enlatadas y conservas de frutas (Charley, 2006). El extracto de T. lucida a simple vista parece comportarse de la misma manera a los diferentes pH, pero estadísticamente se estableció que existe diferencia significativa entre los diferentes pH (p<0.0001) y el extracto posee mayor estabilidad a pH 4 (P<0.05). Aunque es importante mencionar que la concentración inicial no varía grandemente a pH 3 y 5, lo que aumenta de gran manera su aplicabilidad. El extracto de S. domingensis y T. lucida posee un pH óptimo de almacenamiento de 4(P<0.05). Por lo que puede emplearse en sistemas alimenticios como conservas de vegetales (Charley, 2006), o formulaciones medicinales que posean en su composición un buffer adecuado. El extracto menos estable es el de B. crassifolia que se mostró inestable a los tres pH ensayados, aunque parece mayor estabilidad a pH 5; sin embargo su aplicación en la formulación de sistemas alimentarios o cosméticos sería muy difícil y limitada. Con respecto al tiempo en que permanecen estables a condiciones extremas, antes de alcanzar el 80 % de concentración; el extracto que se perfila como el más promisorio es el de T. lucida, ya que conservó más del 80% de su concentración al menos durante trece días en todos los pH ensayados. El otro extracto que conservó más del 80% de su concentración a pH 3 fue el de E. berteroana, que permaneció sobre dicho porcentaje durante 16 días. Excluyendo el extracto de B. crassifolia, el resto de extractos estudiados alcanzan el 80% de su concentración inicial en un rango de 6 a 8 días. Todo lo discutido sobre la estabilidad de los extractos vegetales estudiados, permite recomendar condiciones especiales de almacenamiento de los productos finales en que pudieran utilizarse, como por ejemplo: Uso de frascos ámbar de vidrio por la propiedad fotosensible de los flavonoides, metabolitos responsables del color observado en los mismos. Almacenamiento a temperatura ambiente (25±2º C) o en refrigeración (5±3ºC), dependiendo el uso y la formulación del sistema cosmético, alimenticio o farmacéutico. En cuanto a los colorantes artificiales, sometidos a las mismas condiciones extremas de temperatura y pH, se estableció que la estabilidad está fuertemente influenciada por el pH presentando una diferencia estadísticamente significativa (p<0.05) como lo indica la literatura; siendo así que los colorantes de origen azoico (tartrazina FD&C amarillo No. 5, allura FD&C rojo No. 40 y cochinilla) como los de origen diverso (eritrosina FD&C rojo No. 3), presentan otras coloraciones muy diferentes a pH básico o ácido respectivamente (Multon, 2000). Esto explicaría el comportamiento observado en todos los colorantes artificiales sometidos al estudio de estabilidad. El amarillo FD&C No. 5 y el rojo FD&C No. 40, presentaron cierta estabilidad a pH 3 (p<0.05). El amarillo No. 5 conservó su concentración sobre el 80% durante 15 días; mientras 61 que el amarillo FD&C No. 6 a pH 5 conservó su concentración sobre el 80% durante 16 días (p<0.05). El rojo FD&C No. 3 también mostró cierta estabilidad a pH5, pero junto con el resto de colorantes artificiales y la cochinilla mostraron signos de inestabilidad dentro de los primeros cinco días. Durante este período se observó turbidez, precipitación de partículas, partículas en suspensión, etc. Es importante hacer notar que según la bibliografía consultada la mayoría de los colorantes artificiales posee un uso regulado y específico, por su potencial efecto tóxico a largo plazo. Por ejemplo la eritrosina FD&C rojo No. 3, según la normativa europea solamente puede utilizarse para brindar color a cerezas para cóctel, cerezas en conservas y confites en concentraciones de 1.25 mg/Kg (Multon, 2000); mientras que los colorantes de origen vegetal no tienen límite cuantitativo de uso en esta misma normativa, entre ellos se pueden mencionar: clorofila, caramelo, carbón vegetal, carotenos, extracto de paprika, rojo remolacha, antocianos, etc. 62 PARTE IV. IV.1 CONCLUSIONES 4.1.1 Se identificaron en las cortezas de Palo de sangre (B. arborea), Nance (B. crassifolia), y Árbol de pito (E. berteroana); en el rizoma de Zarzaparrilla (S. domingensis) y planta entera de Pericón (T. lucida) pigmentos vegetales tales como flavonoides, cumarinas, taninos, los cuales demostraron potencial como colorantes y tintes vegetales. 4.1.2 El extracto de Nance (B. crassifolia) corteza presentó el mayor rendimiento de extracción (60%) y el menor rendimiento lo presentó árbol de pito (E. berteroana) corteza (11%). 4.1.3 En todos los extractos se observaron flavonoides y compuestos fenólicos con los ensayos macro y semimicro y en la CCF el extracto que presentó mayor número de bandas, identificándose posibles flavanonoles fue palo de sangre (B. arborea). 4.1.4 En el extracto de zarzaparrilla (S. domingensis) se identificó la presencia de ácido clorogénico y posibles flavanonas, en el extracto de nance (B. crassifolia) compuestos fenólicos tales como flavonoides tipo flavanonas y taninos, en el extracto de árbol de pito (E. berteroana) posibles flavonas y flavononoles y en el extracto de pericón (T. lucida) isoflavononas, chalconas, auronas y cumarinas. 4.1.5 El extracto de pericón presentó el mayor porcentaje (0.3%) de flavonoides totales expresados en quercetina y el menor porcentaje de flavonoides lo presentó el nance (0.01%). 4.1.6 En todas las especies se presentaron sus máximos de absorción en un rango entre 274283 nm, lo cual confirma la presencia de flavonoides tipo flavonas (250-280 nm), flavonoles (250-280 nm) o isoflavonas (275-295 nm). 4.1.7 Se observó que en todos los extractos, en las pruebas de tinción el color se intensificó con la técnica en caliente y utilizando mordiente, los colores del palo de sangre fueron los más intensos presentándose tonalidades entre amarillo a rojo naranja, el nance presentó tonalidades semejantes al beige, el palo de pito colores amarillos, la zarzaparrilla tonalidades en los amarillo-naranja y el pericón presentó tonalidades verdes. 4.1.8 Se demostró que los extractos de las 5 plantas nativas, son efectivas para ser utilizadas como colorantes en cosméticos y además pueden proveer al cosmético otras propiedades propias de cada planta dependiendo de su composición química y actividad farmacológica. 4.1.9 Se observó en las pruebas de coloración en cosméticos que al diluir el extracto al 1% se obtienen colores más intensos, con una mayor brillantez, que se incorporan mejor a las diferentes bases de los cosméticos. 4.1.10 En el extracto de nance se observaron colores amarillo-naranja tanto en la loción como en el gel ya que se mantiene un rango de pH de 5 y 7 respectivamente, mientras que en el shampoo, se incrementa el pH a 9, el color se torna más rojo. 63 4.1.11 El extracto de pericón presentó colores amarillo - verdoso en el gel y loción, intensificándose a verde- café en el shampoo; en el extracto de zarzaparrilla se observaron tonalidades amarillo-naranja en la loción y gel mientras que en el shampoo por el incremento de pH se presentaron tonalidades más intensas en colo rojo. 4.1.12 El extracto de palo de pito presentó coloraciones de amarillo - naranja en el gel y la loción y en el shampoo se intensificó el naranja y el extracto de palo de sangre presentó tonalidades naranja-rojo en el gel y loción, intensificándose el rojo en el shampoo. 4.1.13 Se observó una marcada diferencia en el estimado de costos de producción de los colorantes naturales y el precio de venta de los colorantes sintéticos disponibles en el mercado, sin embargo la mayoría de colorantes artificiales posee restricciones de uso y algunos se encuentran restringidos a productos específicos por los efectos adversos y toxicidad que presentan aún en bajas cantidades. 4.1.14 En el estudio de estabilidad se observó que el extracto de palo de sangre (B. arborea) no se ve afectado grandemente por el pH; sin embargo la concentración se mantiene más estable a pH 3. 4.1.15 El extracto de pericón (T. lucida) presentó diferencia significativa entre los diferentes pH, siendo más estable a pH 3. 4.1.16 El extracto de árbol de pito (E. berteroana) mostró mayor estabilidad a pH 3, mientras que a pH 4 y 5 se observaron signos de inestabilidad desde el segundo día, ya que la concentración aumenta por la aglomeración de sustancias en partículas que al principio no son perceptibles al ojo humano, pero sí son evidentes espectrofotométricamente. 4.1.17 Los extractos de palo de sangre (B. arborea), pericón (T. lucida) y árbol de pito (E. berteroana) podrían utilizarse para colorear sistemas alimentarios o cosméticos formulados a pH3 que incluyan en su formulación un sistema de buffer que asegure el pH del sistema hasta el momento del consumo, en sistemas alimentarios tales como bebidas resfrescantes sin alcohol, frutas enlatadas y conservas de frutas. 4.1.18 El extracto de zarzaparrilla (S. domingensis), al igual que el de árbol de pito (E. berteroana), se encuentra afectado por el pH, por lo que el pH óptimo de almacenamiento para el mismo es de 4, pudiendo emplearse en sistemas alimenticios como conservas de vegetales o formulaciones medicinales que posean en su composición un buffer adecuado. 4.1.19 El extracto menos estable es el de nance (B. crassifolia) que se mostró inestable a los tres pH ensayados por lo que su aplicación en la formulación de sistemas alimentarios o cosméticos sería muy difícil y limitada. 4.1.20 A excepción de palo de sangre (B. arborea) la estabilidad de todos los extractos se ve afectada por el pH con valores de p<0.05. 4.1.21 El amarillo No. 6, rojo No. 3 y cochinilla mostraron mayor estabilidad a pH 5, mientras el amarillo No. 5 y rojo No. 40 a pH 3 (p<0.05). 64 4.1.22 El amarillo No. 5 a pH 3 y el amarillo No. 6 a pH 5 fueron los más estables a lo largo del tiempo. 4.1.23 Como lo indica la bibliografía la estabilidad de los colorantes artificiales se ve influenciada por el pH (p<0.05). 65 IV.2 RECOMENDACIONES 4.2.1 Realizar extracciones de los pigmentos vegetales identificados en las especies a escala piloto para transferir la tecnología a los diferentes sectores productivos. 4.2.2 Diseñar formulaciones cosméticas y/o medicinales utilizando las especies vegetales que presentaron las características ideales como colorante natural. 4.2.3 Evaluar las propiedades antioxidantes o preservantes de las especies en productos fitocosméticos, medicinales o alimenticios. 4.2.4 Caracterizar mediante pruebas fisicoquímicas y fisico-mecánicas las fibras teñidas con las especies vegetales, para determinar la potencialidad como especies tintóreas. 4.2.5 Establecer los parámetros de calidad de cada especie, incluyendo las variables que afectan la producción de metabolitos secundarios (clima, altitud, localidad, etc). 4.2.6 Desarrollar monografías farmacopeicas de las especies mesoamericanas mediante la caracterización fisicoquímica para beneficiar al sector productivo y regulatorio en el registro de los productos que se comercialicen utilizando dichas especies. 66 IV.3 REFERENCIAS BIBLIOGRÁFICAS 1. Abdala, L.R. 1999. Flavonoids of the aereal parts from Tagetes lucida (Asteraceae). Biochemical Sistematics and Ecology. 27, 754-757. 2. Adams, C.D. 1972. Flowering Plants of Jamaica. University of the West Indies. Mona, pp. 65. 3. Alcorn, J.B. 1985. Huastec Mayan Ethobotany. University of Texas Press, Austin, pp. 792. 4. Aguilar, J.I. 1966. Aspectos de la Flora útil de Guatemala. Tipografía Nacional. Guatemala, pp. 318-325 5. Arguijo, G.P. et al. 2005. Documentación de la Flora con Potencial tintóreo de la comunidad Pozo Seco, Municipio de Chisec, Alta Verapaz. Tikalia XXIII (2): 83-93. 6. Arriaza, O. 1981.Contribución al Estudio Farmacológico de Erythrina berteroana Urban (Palo de pito) comoHipnótico. Tesis Fac. CCQQ y Farmacia, USAC. Guatemala., 44 p. 7. Baublis, A. et al. 1994. Anthocyanins pigments: comparison of extract stability. Journal of Food Science. 59. 8. Cacace, J.E. & Mazza, G. 2003. Optimization of extraction of anthocyanins from black currants with aqueous ethanol. Journal of Food Science, 68(1), 240–248. 9. Cáceres, A. Plantas de Uso Medicinal en Guatemala. Guatemala, Ed. Universitaria. 1996, 404 p. 10. Cano, T. 2006. Evaluación de la capacidad de tinción de los tintes obtenidos de dos especies forestales guatemaltecas, en el proceso de teñido de fibras, lana y maguey. Informe Final Proyecto DIGI 32-06. Universidad de San Carlos de Guatemala. 11. Cano, T. 2007. Estudio tecnológico sobre los tintes naturales extraídos de la corteza de tres especies forestales cultivadas para teñir fibras naturales que cumplan con especificaciones de calidad exigidas por el mercado. Informe Final Proyecto DIGI 2007. Universidad de San Carlos de Guatemala. 12. Calderón, J.E. 2001. Obtención del extracto colorante acuoso, a partir de los rechazos de exportación de la producción nacional de dos variables de pitahaya, a nivel de plata piloto. Informe Final Proyecto Fodecyt 13-99. Consejo Nacional de Ciencia y Tecnología, Universidad de San Carlos de Guatemala. 72 p. 13. Charley, H. 2006. Tecnología de Alimentos, Procesos químicos y físicos en la preparación de alimentos. Editorial Limusa. Mexico. 768 pp (651-681) 14. COUNCIL OF EUROPE (2002-2003) European Pharmacopoeia, 4ª Ed., incluidos los Suplementos 4.1 a 4.8. Strasbourg: Council of Europe. 15. Del Cid, H. 2004. Extracción a nivel de laboratorio de los pigmentos colorants del tipo flavonoides contenidos en la flor del subín (Acacia farnesiana (L.) Willd) proveniente de un bosque silvestre guatemalteco. Tesis de Ingeniería Química. USAC. 69 p. 16. Farré-Rovira, R. 1982. Los colorantes alimentarios de los alimentos. Alimentaria. 387: 21-32. 17. Fuentes, W. 2004. Extracción, Cuantificación y Estabilidad de Colorantes Naturales, Presentes en los Frutos de Prunus capuli, Rubus urticaefolius y Sambucus canadensis, como Alternativas Naturales de consumo de los Colorantes Artificiales Rojo No. 40, No. 3 y No. 2, en bebidas en el Rango de pH: 3, 4 y 5. Tesis. Fac. CCQQ y Farmacia, USAC, Guatemala. 75 p. 18. Fuleki, T. & Francis, F. 1968. Quantitative methods for anthocyanins extractios and determination of total anthocyanins in cranberries. Journal of Food Science. USA. 33. 19. Gascón, A. et al., Antocianos y betalaínas colorantes naturales de aplicación industrial CYTED. 547.869 G247 20. Gattuso, S.J. 2003. Caracteres exomorfológicos y anatómicos de S. domingensis Willdenow (Smilacaceae) (en preparación). 67 21. Geiss, F. et al. 1995. Proanthocyanidins with (+)-Epicatechin Units From Byrsonima crassifolia Bark. Phytochemistry. 39, 635-643. 22. Gómez, E. et al. 2006. Comparison of chromatic properties, stability and antioxidant capacity of anthocyanin-based aqueous extracts from grape pomace obtained from different vinification methods. Food Chemistry 97: 87–94. 23. Huft, M.J. 1994. Flora mesoamericana. UNAM, Natural History Museum, Missouri Botanical Garden, Mexico. 6:21. 24. Ibrahim, M. et al. 2000. Sistemas Silvopastoriles en América Central, experiencias de CATIE. Costa Rica. 18. 25. Informe Final del Proyecto DIGI: Caracterización de extractos y aromas como fuente para el desarrollo agroindustrial. Diciembre 2001. 26. Informe Final del Proyecto FONTAGRO-CATIE:Desarrollo del Manejo Sostenible de Smilax sp. en Ecosistemas Naturales y Agroforestales en América Central desde la Producción hasta la Comercialización. Febrero, 2003. 27. Informe Final del Proyecto OEA: Aprovechamiento de la Flora Regional como fuente de fármacos anticáncer y antiparasitario. Diciembre, 2002. 28. Lewis, R. 1989. Food Additives Handbook. Internacional. Thomson Publishing. USA. 598 (15-20). 29. Li, S.Y. et al. 2002. New phenolic constituents from Smilax bracteata. Journal of Natural Products 65 (3):262-266. 30. Lock, O. 1994. Investigación Fitoquímica. 2ª. Ed. Fondo Editorial. Perú. 300 p. 31. Lock, O. 1997. Colorantes naturales. Fondo editorial de la Pontificia Universidad Católica del Perú. Primera edición. Perú. 274 p. 32. Luján, L. & Toledo, R. 1986. Jícaras y Guacales en la Cultura Mesoamericana. Subcentro Regional de Artesanías y Artes populares. Guatemala.389 p. 33. Matta, D. Beltran, A.E. Zelada, E. 1980. Descripción botánica de algunas plantas con propiedades tintóreas. Departamento de Botánica. USAC. 35 p. 34. Merken, H.M. & Beecher, G.R. 2000. Measurement of food flavonoids by high-performance liquid chromatography: A review. J. Agric Food Chem. 48(3): 577-599. 35. Multon, J. 2000. Aditivos y Auxiliares de Fabricación en las industrias Agroalimentarias. 2ª edición. Editorial Acribia, S. A. España 806 (343-374) 36. Muñoz, O. et al. 2003. Antocianos, colorantes naturales de aplicación industrial. Fitoterapia. 2: 147-152. 37. Nash, D. & Dieterle, J. 1976. Flora of Guatemala. Field Museum of Natural History. Vol. 4. 38. Navarro, V. & Delgado, G. 1999. Two Antimicrobial alkaloids from Bocconia arborea. Journal of Ethnopharmacoly. 66, 223-226. 39. Navarro, V. et al. 1996. Antimicrobial evaluation of some plant used in Mexican traditional medicine form the treatment o infectious diseases. Journal of Ethnopharmacoly. 53, 143147. 40. O´Neal, L. 1979. Tejidos de los Altiplanos de Guatemala. Tomo I. Segunda Edición. Seminario de Integración Social Guatemalteca. Ministerio de Educación. Guatemala. 462 p. 41. Osborne, J. & Osborne, L. 1965. Indian Crafts of Guatemala and El Salvador. Oklahoma Press Norman. 385 p. 42. Pasczola, D. 1998. Natural Colors: Pigments of imagination. Food Technology. USA. 52. 43. Pinillos, M. 1985. Rendimiento de Bixina extraída de semilla de Bixa orellana (Achiote). Tesis. Fac. Ingeniería, USAC, Guatemala. 50 p. 44. Powell, M. et al. 1993. Erythrina production and use: A Field Manual. Nitrogen Fixing Tree Asociation, USA, 34. 45. Real Farmacopea Española. 2002. 2ª Ed. Madrid: Ministerio de Sanidad y Consumo. 2801 p. 68 46. Rijke, E. et al. 2006. Analytical separation and detection methods for flavonoids. Journal of Chromatography A, 1112: 31–63. 47. Robles, G. & Villalobos, R. 1998. Plantas medicinales del género Smilax en Centroamérica. CATIE y CYTED. Costa Rica. 48. Roig, J.T. 1992. Plantas Medicinales, Aromáticas o Venenosas de Cuba. Ed. CientíficoTécnica, La Habana, pp 786-788. 49. Rubinskiene, M. et al. 2005. Impact of various factors on the composition and stability of black currant anthocyanins. Food Research International 38: 867–871. 50. Russo, R. 1990. Erythrina berteroana Urban. Escuela de Agricultura de la Región Tropical Húmeda. Costa Rica. 454. 51. Santizo, R. 1996. La importancia del Descrude del Hilo de Algodón en el Proceso de Tintura Artesanal. Tesis Fac. Ingeniería, USAC, Guatemala. 56 p. 52. Solis, P., Guerrero, N., Gatusso, S., Cáceres, A. 2005. Manual de Caracterización y Análisis de Drogas Vegetales y Productos Fitoterapéuticos. OEA/AICD/AE089/03. 132 p. 53. Standley, P.C. & Williams, L.O. 1970. Flora of Guatemala. Fieldiana: Botany 24(3):94-95. 54. Torskangerpoll, K. & Andersen, M. 2005. Colour stability of anthocyanins in aqueous solutions at various pH values. Food Chemistry, 89(3): 427–440. 55. Vanaclocha, B. & Cañigueral, S. 1998. Vademécum de Fitoterapia. España. Ed. Masson. 1148 p. 56. Vázquez, M., González, A.R., Cazares, L., Moreno, MN., García, A.N. 1999. Antimicrobial activity of Byrsonima crassifolia (L.) H.B.K. J. Ethnopharmacol (66): 79-82. 57. Wagner, H. & Bladt, S. 1996. Plant drug analysis. A TLC Atlas. Berlin: Springer. 58. Zamora, M. et al. 2001. Análisis de la Información Sobre Productos Forestales No Maderero en México. Proyecto Información y Análisis para el Manejo Forestal Sostenible. FAO. Unión Europea. Chile. 122 p. 59. Zomlefer, W. 1994. Guide to the flowering plant families. University of North Carolina Press. Chapel Hill. 60. Zulin, S. et al. 1992. Quantitative Comparison of the stability of anthocyanins from Brassica oleracea Tradescantia pallida in non-sugar drink model and protein model systems. Journal of Food Science. 57. 69 IV.4 ANEXOS 70 4.4.1 Análisis estadístico del Estudio de Estabilidad (ANOVA) Pericón (T. lucida) Number of obs = 126 Root MSE = 2.44522 R-squared = 0.8989 Adj R-squared = 0.8851 Source | Partial SS df MS F Prob > F -----------+---------------------------------------------------Model | 5848.99486 15 389.932991 65.22 0.0000 | ph | 227.632875 2 113.816438 19.04 0.0000 das | 5621.36199 13 432.412461 72.32 0.0000 | Residual | 657.698572 110 5.97907792 -----------+---------------------------------------------------Total | 6506.69344 125 52.0535475 Existe diferencia significativa entre pH (p<0.0001) | Summary of planta 1 pH | Mean Std. Dev. Freq. ------------+-----------------------------------1| 88.095 6.9330708 42 2 | 91.143334 6.5389134 42 3 | 90.696429 7.8944892 42 ------------+-----------------------------------Total | 89.978254 7.2148144 126 Los pH 1 y 2 son los que difieren significativamente (p<0.05) T. lucida Mean planta1 by ph level 94 92 90 88 86 1 1.5 2 pH 2.5 3 71 Árbol de pito (E. berteroana) Number of obs = 117 Root MSE = 1.86506 R-squared = 0.8655 Adj R-squared = 0.8471 Source | Partial SS df MS F Prob > F -----------+---------------------------------------------------Model | 2283.63783 14 163.116988 46.89 0.0000 | ph | 268.199736 2 134.099868 38.55 0.0000 das | 2015.43809 12 167.953174 48.28 0.0000 | Residual | 354.802803 102 3.47845885 -----------+---------------------------------------------------Total | 2638.44063 116 22.7451778 Existe diferencia significativa entre pH (p<0.0001) | Summary of planta 1 pH | Mean Std. Dev. Freq. ------------+-----------------------------------1| 88.095 6.9330708 42 2 | 91.143334 6.5389134 42 3 | 90.696429 7.8944892 42 ------------+-----------------------------------Total | 89.978254 7.2148144 126 El ph 1 es significativamente diferente a 2 (p=0.005) y a 3 (p=0.009) E. berteroana Mean planta2 by ph level 102 100 98 96 94 1 1.5 2 pH 2.5 3 72 Nance (B. crassifolia) Number of obs = 45 R-squared = 0.5967 Root MSE = 15.2366 Adj R-squared = 0.5330 Source | Partial SS df MS F Prob > F -----------+---------------------------------------------------Model | 13053.4285 6 2175.57142 9.37 0.0000 | ph | 1853.80006 2 926.900028 3.99 0.0267 das | 11199.6285 4 2799.90712 12.06 0.0000 | Residual | 8821.86768 38 232.154413 -----------+---------------------------------------------------Total | 21875.2962 44 497.165823 Existe diferencia significativa entre pH (p=0.0267) | Summary of planta 3 pH | Mean Std. Dev. Freq. ------------+-----------------------------------1 | 86.917334 24.887305 15 2 | 73.165999 25.312251 15 3 | 86.641334 13.03913 15 ------------+-----------------------------------Total | 82.241556 22.297216 45 El pH 2 es significativamente diferente a los otros dos (p<0.05) B. crassifolia Mean planta3 by ph level 100 90 80 70 60 1 1.5 2 pH 2.5 3 73 Palo de sangre (B. arborea) Number of obs = 54 R-squared = 0.8758 Root MSE = 3.12773 Adj R-squared = 0.8568 Source | Partial SS df MS F Prob > F -----------+---------------------------------------------------Model | 3171.81547 7 453.116496 46.32 0.0000 | ph | 10.6747135 2 5.33735677 0.55 0.5832 das | 3161.14076 5 632.228152 64.63 0.0000 | Residual | 450.003894 46 9.78269334 -----------+---------------------------------------------------Total | 3621.81937 53 68.3362145 No hay diferencia significativa entre pH (p=0.5822) B. arborea Mean planta4 by ph level 95 90 85 80 1 1.5 2 pH 2.5 3 Zarzaparrilla (S. domingensis) Number of obs = 54 R-squared = 0.7878 Root MSE = 5.45866 Adj R-squared = 0.7555 Source | Partial SS df MS F Prob > F -----------+---------------------------------------------------Model | 5088.47449 7 726.924928 24.40 0.0000 | ph | 336.550241 2 168.27512 5.65 0.0064 das | 4751.92425 5 950.38485 31.90 | Residual | 1370.65892 46 29.7969331 -----------+---------------------------------------------------Total | 6459.13342 53 121.870442 Existe diferencia significativa entre pH (p=0.0064) 74 0.0000 | Summary of planta 5 pH | Mean Std. Dev. Freq. ------------+-----------------------------------1 | 85.968334 14.204211 18 2 | 90.553333 7.1738315 18 3 | 84.756666 10.340622 18 ------------+-----------------------------------Total | 87.092778 11.039495 54 El pH 2 es significativamente diferente a los otros dos (p<0.05) S. domingensis 90 85 80 1.5 1 4.4.2 2 pH 2.5 3 Gráficas de la curva de calibración a 480 nm de los colorantes sintéticos Curva de Calibracion de Rojo No.2P a 480nm Absorbancia Mean planta5 by ph level 95 0.05 0.04 0.03 0.02 0.01 0 0.0001 Serie1 Serie2 Lineal (Serie2) 0.0002 0.0003 Concentración 0.0004 0.0005 y = 0.0098x - 0.0021 R2 = 0.9926 75 Curva de Calibración Rojo No. 3P a 480nm. Absorbancia 2 1.5 1 0.5 0 0.01 0.02 Serie1 Serie2 Lineal (Serie2) 0.03 0.04 y = 0.3883x + 0.0063 R2 = 0.9999 Concentración Curva de Calibración de Rojo No. 40 a 480 nm Absorbancia 0.08 0.06 0.04 0.02 0 0.0001 0.0002 Serie1 Serie2 Lineal (Serie2) 0.0003 0.0004 Concentración 0.0005 y = 0.0149x - 0.0136 R2 = 0.9916 Curva de Calibración de Amarillo No. 6 a 480nm Absorbancia 0.08 0.06 0.04 0.02 0 0.0001 Serie1 Serie2 Lineal (Serie2) 0.0002 0.0003 0.0004 0.0005 y = 0.015x - 8E-06 R2 = 0.9991 Concentración 76 Curva de Calibración Amarillo No. 5 a 480 0.08 0.06 0.05 0.04 0.03 0.02 0.01 0 0.0002 0.0001 Serie1 Serie2 Lineal (Serie2) 0.0003 0.0004 0.0005 y = 0.014x + 1E-05 R2 = 0.9999 Concentración Curva de Calibración Cochinilla a 480nm 0.04 Absorbancia Absorbancia 0.07 0.035 0.03 0.025 0.02 0.015 0.01 0.005 0 0.0001 Serie1 Abs Lineal (Abs) 0.0002 0.0003 0.0004 Concentración 0.0005 y = 0.0067x + 0.0013 R2 = 0.9989 77 PARTE V V.1 INFORME FINANCIERO Se muestra en la siguiente tabla lo ejecutado en cada renglón presupuestario, que de acuerdo a lo asignado en el proyecto (Q 335,582.50) se ejecutó un 95% (318,854.79). Renglón 122 181 214 241 243 244 245 249 261 262 266 267 268 269 272 273 291 292 295 298 323 Nombre del gasto Ejecutado Q Impresión, encuadernación y rep 1,000.00 Estudios, investigaciones y proyectos de 109,875.00 factibilidad Productos agroforestales, madera, 500.00 corcho y sus manufacturas Papel de escritorio 126.50 Productos de papel o cartón 532.00 Productos de artes gráficas 35.80 Libros, revistas y periódicos 1,200.00 Otros productos de papel, cartón o 177.00 impresos Elementos y compuestos químicos 21,180.08 Combustibles y lubricantes 615.00 Productos medicinales y farmacéuticos 32.95 Tintes, pinturas y colorantes 826.00 Productos plásticos, nylon, vinil y pvc 998.50 Otros productos químicos y conexos 156.80 Productos de vidrio 11,826.05 Productos de loza y porcelana 290.00 Útiles de oficina 244.09 Útiles de limpieza y productos sanitarios 500.00 Útiles menores médico-quirúrgicos y de 2,882.85 laboratorio Accesorios y repuestos en general 7,189.50 Equipo médico-sanitario y de 128,159.17 laboratorio Gastos administrativos 30,507.50 Total 318,854.79 (95%) 78