formulación inorgánica - Colegio Coop. Alcázar
Anuncio

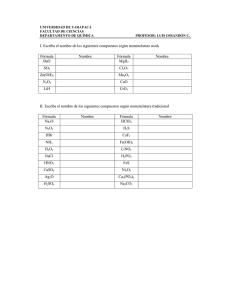
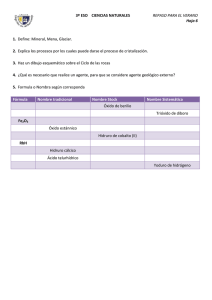
FORMULACIÓN INORGÁNICA 1. 2. 3. 4. 5. 6. 7. Elementos Químicos. Valencia. Combinaciones binarias del Oxígeno: Óxidos Combinaciones binarias del Hidrógeno: Hidruros e Hidrácidos Ácidos Oxácidos Hidróxidos, Bases o Álcalis. Sales. a. b. c. d. e. Iones: Cationes y Aniones. Sales neutras. Sales ácidas. Sales básicas. Sales mixtas. 8. Peróxidos Dep. de Física y Química - Curso 2011/12 1 1. VALENCIA Es la capacidad de combinación que tienen los elementos químicos. La valencia de un elemento viene dada por el número de átomos de hidrógeno que se combinan con un átomo de ese elemento. 2. ELEMENTOS QUÍMICOS Los elementos químicos se características son: dividen en metales METALES • • • • • y no metales, cuyas NO METALES Sólidos a temperatura ambiente. (salvo el Mercurio que es liquido) Poseen brillo característico Buenos conductores de la corriente eléctrica. Por lo general, muy densos. Tendencia a perder electrones • Pueden ser sólidos, líquidos gaseosos • • No tienen brillo Malos conductores de la corriente y del calor. Menos densos que los metales. Tendencia a ganar electrones • • Valencias más comunes: METALES VALENCIA 1 Litio Sodio Potasio Rubidio Cesio Francio Plata Li Na K Rb Cs Fr Ag VALENCIAS 1, 2 Cobre Mercurio Cu Hg VALENCIAS 2, 4 Platino Plomo Estaño Pt Pb Sn VALENCIA 2 Berilio Magnesio Calcio Estroncio Zinc Cadmio Bario Radio VALENCIAS 1, 3 Oro Talio Be Mg Ca Sr Zn Cd Ba Ra Au Tl VALENCIAS 2, 3, 6 Cromo Cr VALENCIA 3 Aluminio Al VALENCIAS 2, 3 Níquel Cobalto Hierro VALENCIAS 2, 3, 4, 6, 7 Manganeso Ni Co Fe Mn NO METALES. VALENCIA -1 Flúor F VALENCIAS +/-2, 4, 6 S Azufre Se Selenio Te Teluro VALENCIAS2, +/-4 Carbono C VALENCIAS +/- 1, 3, 5, 7 Cloro Cl Bromo Br Yodo I VALENCIAS 1, 2, +/- 3, 4, 5 Nitrógeno N VALENCIA 2, 4 Silicio Si VALENCIA -2 Oxígeno VALENCIAS +/- 3, 5 Fósforo Arsénico Antimonio VALENCIA 3 Boro O P As Sb B Dep. de Física y Química - Curso 2011/12 2 3. COMBINACIONES BINARIAS DEL OXÍGENO METAL + OXÍGENO Æ OXIDO METALICO NO METAL + OXÍGENO Æ ÓXIDO NO METÁLICO (ANHÍDRIDO) • Notación tradicional: óxido de anhídrido • nombre del metal o no metal + + hipo per oso (menor) + nombre del no metal ico (mayor) oso oso ico ico + Notación de Stock: óxido de + nombre del metal o no metal + valencia del elemento en números romanos y entre paréntesis • Notación sistemática (IUPAC): Prefijo + óxido de mono-, di-, tri, tetra-, penta-, hexa-, nombre del elemento + prefijo + hepa-. Li + O Æ Li2O Ca + O Æ CaO Fe + O Æ FeO Fe + O Æ Fe2O3 ÓXIDOS METÁLICOS Tradicional Stock Óxido de Litio Óxido de Litio (I) Óxido de Calcio Óxido de Calcio (II) Óxido Ferroso Óxido de Hierro (II) Óxido Férrico Óxido de Hierro (III) Sistemática Monóxido de dilitio. Monóxido de Calcio Monóxido de Hierro Trióxido de dihierro ÓXIDOS NO METÁLICOS (ANHÍDRIDOS) Tradicional Stock Cl + O Æ Cl2O Cl + O Æ Cl2O3 Cl + O Æ Cl2O5 Cl + O Æ Cl2O7 S + O Æ SO S + O Æ SO2 S + O Æ SO3 Sistemática Anhídrido Hipocloroso Anhídrido Cloroso Anhídrido Clórico Anhídrido Perclórico Anhídrido Hiposulfuroso Anhídrido Sulfuroso Óxido de Cloro (I) Óxido de Cloro (III) Óxido de Cloro (V) Óxido de Cloro (VII) Óxido de Azufre (II) Óxido de Azufre (IV) Monóxido de dicloro Trióxido de dicloro Pentóxido de dicloro Heptóxido de dicloro Monóxido de Azufre Dióxido de Azufre Anhídrido Sulfúrico Óxido de Azufre (VI) Trióxido de Azufre Dep. de Física y Química - Curso 2011/12 3 4. COMBINACIONES BINARIAS DEL HIDRÓGENO METAL + HIDRÓGENO Æ HIDRURO METÁLICO NO METAL + HIDRÓGENO Æ HIDRURO NO METÁLICO • • HIDRUROS METALICOS Nomenclatura tradicional Hidruro de • oso (menor) + ico (mayor) Notación de Stock: Hidruro de • nombre del metal + nombre del metal + + valencia del elemento en números romanos y entre paréntesis Notación sistemática (IUPAC): Prefijo + mono-, di-, tri, tetra-, penta-, hexa-, hepa-. hidruro de + nombre del elemento HIDRUROS METÁLICOS Tradicional Stock Li + H Æ LiH Be + H Æ BeH2 Pb + H Æ PbH2 Pb + H Æ PbH4 Al + H Æ AlH3 • Hidruro de Litio Hidruro de Berilio Hidruro Plumboso Hidruro Plúmbico Hidruro de aluminio Hidruro de Litio (I) Hidruro de Berilio (II) Hidruro Plumboso (II) Hidruro Plúmbico (IV) Hidruro de aluminio (III) Sistemática Monohidruro de Litio Dihidruro de berilio Dihidruro de Plomo Tetrahidruro de Plomo Trihidruro de Aluminio HIDRUROS NO METÁLICOS Æ HIDRÁCIDOS: Los hidruros formados con los elementos de los grupos de anfígenos y halógenos • Nomenclatura tradicional Ácido • + nombre del no metal + -hídrico Notación de Stock: Hidruro de + nombre del no metal + valencia del elemento en números romanos y entre paréntesis Dep. de Física y Química - Curso 2011/12 4 • Notación sistemática (IUPAC): Nombre del no metal F + H Æ HF Cl + H Æ HCl Br + H Æ HBr I + H Æ HI S + H Æ H2S Se + H Æ H2Se Te + H Æ H2Te + -uro de + prefijo HIDRUROS NO METÁLICOS Tradicional Stock Hidruro de fluor (I) Ácido fluorhídrico Hidruro de cloro (I) Ácido clorhídrico Hidruro de bromo (I) Ácido bromhídrico Hidruro yodo (I) Ácido yodhídrico Hidruro de azufre (II) Ácido sulfhídrico Hidruro de selenio (II) Ácido selenhídrico Hidruro de teluro (II) Ácido telurhídrico hidrógeno Sistemática Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Sulfuro de dihidrógeno Seleniuro de dihidrógeno Telururo de dihidrógeno Æ RESTO DE HIDRUROS DE NO METALES Se nombran igual que los hidrácidos HIDRUROS NO METÁLICOS Tradicional Stock Amoníaco Hidruro de nitrógeno (III) N + H Æ NH3 Fosfatina o fosfina Hidruro de fósforo (III) P + H Æ PH3 Arsina o arsenamina Hidruro de arsénico (III) As + H Æ AsH3 Estibina Hidruro de antimonio (III) Sb + H Æ SbH3 Metano Hidruro de carbono (IV) C + H Æ CH4 Hidruro de silicio (IV) Silano Si + H Æ SiH4 Borano Hidruro de boro (III) B + H Æ BH3 Sistemática Trihidruro de nitrógeno Trihidruro de fósforo Trihidruro de arsénico Trihidruro de antimonio Tetrahidruro de carbono Tetrahidruro de silicio Trihidruro de boro Dep. de Física y Química - Curso 2011/12 5 5. ACIDOS OXÁCIDOS Son compuestos ternarios de OXÍGENO, HIDRÓGENO y NO METAL. Se obtienen por adición de agua a un anhídrido (óxido no metálico). ANHÍDRIDO + AGUA Æ ÁCIDO La nomenclatura es la misma que para anhídridos, según la terminología tradicional, aunque precediendo la palabra ácido. Este es el único tipo de compuestos en el que permanece la nomenclatura antigua. La IUPAC propone una nueva nomenclatura, que aún está poco extendida dado que cuesta bastante deshabituarse de decir, por ejemplo ácido sulfúrico, que es un compuesto de uso frecuente, a decir tetraoxosulfato (VI) de hidrógeno, como propone la IUPAC. Ella misma admite como válida la nomenclatura tradicional en este tipo de compuestos ÁCIDOS DE HALÓGENOS (Cl, Br, I) Cl2O + H2O Æ H2Cl2O2 Æ HClO Cl2O3 + H2O Æ H2Cl2O4 Æ HClO2 Cl2O5 + H2O Æ H2Cl2O6 Æ HClO3 Cl2O7 + H2O Æ H2Cl2O8 Æ HClO4 Anhídrido hipocloroso Anhídrido cloroso Anhídrido clórico Anhídrido perclórico Anhídrido hiposulfuroso Anhídrido sulfuroso Anhídrido sSulfúrico Anhídrido hiponitroso Anhídrido nitroso Anhídrido nítrico Anhídrido fosforoso Anhídrido fosfórico Anhídrido Carbónico Anhídrido silícico ÁCIDOS DE ANFÍGENOS (S, Se, Te) SO + H2O Æ H2SO2 SO2 + H2O Æ H2SO3 SO3 + H2O Æ H2SO4 ÁCIDOS DE NITRÓGENO N2O + H2O Æ H2N2O2 Æ HNO N2O3 + H2O Æ H2N2O4 Æ HNO2 N2O5 + H2O Æ H2N2O6 Æ HNO3 Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclórico Ácido hiposulfuroso Ácido sulfuroso Ácido sulfúrico Ácido hiponitroso Ácido nitroso Ácido nítrico ÁCIDOS DE NITROGENOIDEOS (P, As, Sb) P2O3 + H2O Æ H2P2O4 Æ HPO2 Ácido metafosforoso P2O3 + 2 H2O Æ H4P2O5 Ácido pirofosforoso P2O3 + 3 H2O Æ H6P2O6 Æ H3PO3 Ácido (orto)fosforoso P2O5 + H2O Æ H2P2O6 Æ HPO3 Ácido metafosfórico P2O5 + 2 H2O Æ H4P2O7 Ácido pirofosfórico P2O5 + 3 H2O Æ H6P2O8 Æ H3PO4 Ácido (orto)fosfórico ÁCIDOS DE CARBONOIDEOS CO2 + H2O Æ H2CO3 SiO2 + H2O Æ H2SiO3 SiO2+ 2 H2O Æ H4SiO4 Ácido Carbónico Ácido metasilícico Ácido (orto)silícico Dep. de Física y Química - Curso 2011/12 6 6. HIDRÓXIDOS, BASES o ÁLCALIS Son compuestos ternarios de HIDRÓGENO, OXÍGENO y un METAL. Se obtienen por adición de agua a óxidos metálicos. OXIDO METÁLICO + AGUA --> HIDRÓXIDO • Nomenclatura tradicional Hidróxido de • nombre del metal oso (menor) + ico (mayor) Notación de Stock: Hidróxido de • + nombre del metal + + valencia del elemento en números romanos y entre paréntesis Notación sistemática (IUPAC): Prefijo + Hidróxido de + + nombre del metal Se puede considerar que el anión hidroxilo (OH-) actúa, frente a los metales, con valencia 1. HIDRÓXIDOS Hidróxido de Litio Hidróxido de Calcio Hidróxido Ferroso Hidróxido Férrico Hidróxido Niquélico LiOH Ca(OH)2 Fe(OH)2 Fe(OH)3 Ni(OH)3 Hidróxido de Sodio Hidróxido de Bario Hidróxido Plumboso Hidróxido Plúmbico Hidróxido de Plata NaOH Ba(OH)2 Pb(OH)2 Pb(OH)4 AgOH Dep. de Física y Química - Curso 2011/12 7 7. SALES Las sales provienen de sustituir, total o parcialmente, los Hidrógenos de un ácido por metales a. IONES • CATIÓN: - n+ Provienen de la disociación de una base: M(OH)n --> M + n OH Se nombran igual que el hidróxido del cual provienen. CATIONES + Catión Litio Li Catión Sodio 2+ Ca Catión Bario Catión Calcio Catión Plumboso Fe2+ Catión Ferroso 3+ Catión Plúmbico Fe Catión Férrico Ni3+ Catión Plata Catión Niquélico • Na+ Ba2+ Pb2+ Pb4+ Ag+ ANIÓN: n- + Provienen de la disociación de un ácido. AHn --> A + nH Se nombran según el ácido del que provienen, cambiando las terminaciones: TERMINACIÓN ÁCIDO -hídrico -oso -ico HNO HNO2 HNO3 TERMINACIÓN ANIÓN -uro -ito -ato Aniones de Nitrógeno: NO NO2 NO3 - ácido hiponitroso ácido nitroso ácido nítrico anión hiponitrito anión nitrito anión nitrato Aniones de Nitrogenoideos: P, As, Sb: HPO2 H4P2O5 H3PO3 HPO3 H4P2O7 H3PO4 ácido metafosforoso ácido pirofosforoso ácido (orto)fosforoso ácido metafosfórico ácido pirofosfórico ácido (orto)fosfórico PO2 P2O54PO33- anión metafosfito anión pirofosfito anión (orto)fosfito PO3 P2O74PO4 3- anión metafosfato anión pirofosfato anión (orto)fosfato Aniones de Carbonoideos H2CO3 H2SiO3 H4SiO4 ácido carbónico ácido metasilícico ácido (orto)silícico CO3 2SiO3 2SiO4 4- anión carbonato anión metasilicato anión (orto)silicato Dep. de Física y Química - Curso 2011/12 8 Aniones de Halógenos y Anfígenos HF HCl HBr H 2S H2Se H2Te Ácido Fluorhídrico Ácido Clorhídrico Ácido Bromhídrico Ácido Sulfhídrico Ácido Selenhídrico Ácido Telurhídrico FCl Br S2Se2Te2- Anión Fluoruro Anión Cloruro Anión Bromuro Anión Sulfuro Anión Seleniuro Anión Telururo b. Sales Neutras Las sales se obtienen mediante las reacciones de NEUTRALIZACIÓN. ÁCIDO + BASE ÆSAL + AGUA H2SO4 + 2 NaOH Æ Na2S04 + 2H20 Provienen de la unión de cationes y aniones compensando sus cargas. Se nombran según el anión y catión del que provienen. Anión sulfato + Catión férrico Æ Sulfato férrico (sal) SO42-+ Fe3+ Æ Fe2(S04 )3 c. Sales ácidas Provienen de la unión de cationes y aniones compensando sus cargas, pero con un anión al que le quedan restos protónicos. ANIONES ÁCIDOS DEL ÁCIDO FOSFÓRICO ácido fosfórico anión dihidrógeno fosfato anión bifosfato o hidrógeno fosfato HPO4 2H3PO4 H2PO4 anión fosfato PO4 3- Bifosfato niqueloso Æ NiHPO4 d. Sales básicas Provienen de la unión de cationes y aniones compensando sus cargas, pero con un catión al que le quedan restos de hidroxilos. CATIONES BÁSICOS DEL HIDRÓXIDO DE ALUMINIO Hidróxido Alumínico catión dihidroxialuminio Catión hidroxialuminio catión alumnio Al(OH)3 Al(OH)2 + Al(OH)2+ Al3+ Dihidroxi nitrito d alumnio o nitrito de dihidroxialumnio Æ Al(OH)2NO2 Dep. de Física y Química - Curso 2011/12 9 e. Sales mixtas Provienen de la unión de cationes y aniones compensando sus cargas, pero con un catión al que le quedan restos de hidroxilos y con un anión al que le quedan restos protónicos. Bicarbonato hidroxiplúmbico Æ Pb(OH)(HCO3)3 8. PERÓXIDOS Son compuestos binarios del Oxígeno, generalmente con un metal, en los que aparece 2el anión peroxo O2 Peróxidos Li2O + O --> Li2O2 CaO + O --> CaO2 FeO + O --> FeO2 H2O + O --> H2O2 Peróxido de Litio Peróxido de Calcio Peróxido Ferroso Peróxido de Hidrógeno Dep. de Física y Química - Curso 2011/12 10