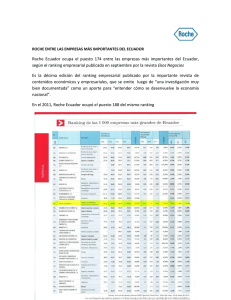
autorizado en europa tarceva® como terapia de
Anuncio

Esta nueva estrategia consiste en continuar con un tratamiento biológico hasta que la enfermedad progrese, tras una primera línea con quimioterapia AUTORIZADO EN EUROPA TARCEVA® COMO TERAPIA DE MANTENIMIENTO EN CÁNCER DE PULMÓN NO MICROCÍTICO AVANZADO CON ENFERMEDAD ESTABLE • Este nuevo esquema de tratamiento con Erlotinib retrasa un 47% el avance de la enfermedad, en comparación con placebo. • La terapia biológica utilizada en la fase de mantenimiento ha de ser bien tolerada y comprometer lo menos posible la calidad de vida de los pacientes. • Erlotinib es el primer fármaco autorizado en España para el cáncer de pulmón no microcítico que no actúa como la quimioterapia. Madrid, 4 de mayo de 2010.- La Comisión Europea ha autorizado el uso de Tarceva® (Erlotinib) como terapia de mantenimiento en pacientes con cáncer de pulmón no microcítico avanzado y con enfermedad estable tras haber recibido un tratamiento de primera línea con quimioterapia basada en platino. Esta autorización se basa en los datos del ensayo clínico fase III SATURN, cuyos resultados muestran que con esta novedosa pauta de tratamiento: • Tarceva® mejora la supervivencia global un 39%, aumentando la mediana de supervivencia más de dos meses (11,9 frente a 9,6 meses), en comparación con placebo. • Retrasa el avance de la enfermedad un 47%, en comparación con placebo. Los pacientes con cáncer de pulmón y con enfermedad estable, -el tamaño del tumor se mantiene esencialmente igual que antes de haber recibido un tratamiento con quimioterapia- presentan un avance más rápido de la enfermedad y un peor pronóstico en comparación con aquellos que responden completa o parcialmente al régimen quimioterápico inicial. Asimismo, son más resistentes a líneas de tratamiento posteriores con quimioterapia. “La aprobación europea de Tarceva® como terapia de mantenimiento permite a los pacientes contar con una oportunidad más de tratamiento y refuerza el papel de este fármaco oral en el tratamiento de esta enfermedad”, ha explicado el doctor Hal Barron, responsable médico y vicepresidente de Genentech, que pertenece al Grupo Roche. “De esta forma el paciente cuenta con la posibilidad de seguir recibiendo tratamiento sin esperar a que la enfermedad vuelva a progresar, manteniendo un mayor control sobre la misma, lo cual puede ayudarle a vivir más tiempo”. En Europa, Erlotinib ya está aprobado para el tratamiento de pacientes con enfermedad localmente avanzada o diseminada, tras haber fracasado, al menos a un esquema de quimioterapia previo. Desde hace sólo unos días Tarceva® cuenta con esta aprobación como terapia de mantenimiento también en los Estados Unidos. Una nueva estrategia para detener la progresión de la enfermedad En pacientes que no han recibido un tratamiento que incluye Bevacizumab, tradicionalmente el abordaje consiste en aplicar quimioterapia, -doblete que incluye platino-, hasta un máximo de 4 - 6 ciclos. De este modo, los pacientes no vuelven a recibir otra terapia hasta que su enfermedad progresa (recaída). Sin embargo, los nuevos datos muestran que es posible mejorar la SLP si, -tras la quimioterapia inicial-, el paciente continúa siendo tratado con una terapia biológica hasta que la enfermedad avanza de nuevo. Esta nueva estrategia se conoce como ‘terapia de mantenimiento’. Esta novedosa forma de tratar a los pacientes, -a la que podrían ser candidatos aproximadamente el 60% de aquellos con enfermedad avanzada-, requiere no sólo de una terapia que aumente la supervivencia sino que además, sea bien tolerada e interfiera lo menos posible sobre la calidad de vida del paciente. De hecho, en las terapias de mantenimiento la baja toxicidad es clave porque los pacientes han recibido ya varios ciclos de quimioterapia. El cáncer de pulmón es el tumor más común en todo el mundo con millón y medio de nuevos casos diagnosticados cada año. El 85% de todos los carcinomas pulmonares es del tipo no microcítico, que suele caracterizarse por su rápida progresión; menos de un 5% de los pacientes afectados por este tipo de tumor sigue vivo al cabo de cinco años. Acerca del estudio SATURN Se trata de un estudio multicéntrico, doble ciego randomizado y prospectivo fase III diseñado para evaluar la eficacia de Erlotinib / placebo en pacientes con cáncer de pulmón no microcítico avanzado, recurrente o metastásico, que no habían progresado tras recibir en primera línea una quimioterapia basada en platino. El estudio incluyó a más de 880 pacientes de aproximadamente 160 centros de los cuales 438 fueron tratados con Erlotinib y 451, con placebo. Entre los hospitales, participaron tres españoles: el Clínico Lozano Blesa de Zaragoza, el Central de Asturias y el Complejo Hospitalario de A Coruña. El objetivo primario es la supervivencia libre de progresión, que asciende al 47%, frente al grupo de pacientes con enfermedad estable tratados con placebo (Hazard ratio= 0.68. valor p <0.0001). En cuanto a la supervivencia global en este grupo, ésta llegó al 39% de beneficio en comparación con el grupo al que se administraba placebo (Hazard ratio= 0.72. valor p=0.0019). Los efectos adversos observados coinciden con los ya conocidos previamente. Tarceva® Hasta contar con esta nueva autorización, estaba aprobado en España y el resto de países de la Unión Europea como tratamiento de segunda línea en pacientes con cáncer de pulmón no microcítico avanzado tras fracasar con la quimioterapia. Es el primer fármaco autorizado en nuestro país para el cáncer de pulmón que no actúa como los quimioterápicos. Su uso ha demostrado aumentar la supervivencia y retrasar la aparición de los síntomas de la enfermedad. Erlotinib fue diseñado para inhibir el receptor del factor de crecimiento epidérmico humano (HER1/EGFR), uno de los principales receptores involucrados en el crecimiento celular en casos de cáncer de pulmón no microcítico y otros tumores sólidos. El receptor HER1, también conocido como EGFR, es un componente clave de la vía de transmisión de señales implicada en la formación y el crecimiento de numerosos tipos de cáncer. Además Tarceva es el primer fármaco en una década en demostrar que al combinarse con la quimioterapia consigue mejorar la supervivencia en pacientes con cáncer de páncreas. En España se ha aprobado para tratar esta enfermedad en fase avanzada. Roche Roche, cuya sede central se halla en Basilea (Suiza), es una compañía líder del sector de la salud, centrada en la investigación y con la potencia combinada de la integración farmacéuticadiagnóstica. Roche es la mayor empresa biotecnológica del mundo y tiene medicamentos auténticamente diferenciados en las áreas de oncología, virología, inflamación, metabolismo y sistema nervioso central. Roche también es el líder mundial en diagnóstico in vitro, incluido el diagnóstico histológico del cáncer, y pionero en el control de la diabetes. La estrategia de Roche en medicina personalizada tiene como fin proporcionar medicamentos y herramientas diagnósticas que hagan posible mejoras tangibles de la salud, la calidad de vida y la esperanza de vida de los pacientes. En el año 2009 Roche, con más de 80.000 empleados en todo el mundo, invirtió casi 10.000 millones de francos suizos en investigación y desarrollo. Las ventas alcanzaron la cifra de 49.100 millones de francos suizos. Genentech (Estados Unidos) es un miembro de plena propiedad del Grupo Roche. Roche posee una participación mayoritaria en Chugai Pharmaceutical (Japón). Más información en www.roche.com Todas las marcas comerciales mencionadas en este comunicado de prensa están protegidas por la ley.