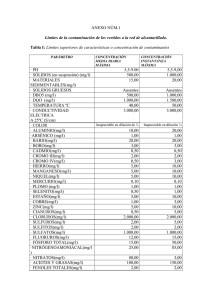
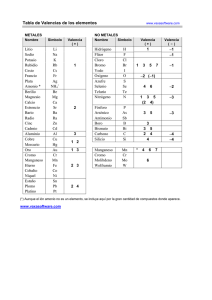
Experimentación en Química Inorgánica
1
PRÁCTICA VIII. CROMO
Reacciones del Cromo
Material
Reactivos
Cápsula de Porcelana de 250 ml
Dicromato amónico (s)
Dicromato potásico (s)
Vasos de Precipitados de 100 ml
Cinc
Dicromato potásico (0.1M)
Vidrio de reloj
Tiocinato de potasio (0.5 M)
Alumbre de cromo (0.1M)
Tubos de ensayo
Ácido sulfúrico (concentrado)
Peroxidisulfato potásico (s)
Cuentagotas
Acido clorhídrico (concentrado)
Hidróxido sódico 1M
Espátula
Nitrato de plata 1M
Eter
Pinza de madera
Peróxido de hidrógeno (20 vol)
Cloruro sódico (s)
Sistema de filtración a vacío
Acetona
Yoduro potásico 0.1M
(Kitasato) con placa filtrante
OBJETIVOS
El objeto de estas pruebas es la comprobación experimental del comportamiento químico del cromo en:
- Formación de diferentes oxoaniones de cromo(VI), en función del pH.
- Formación de peroxocompuestos de cromo(VI).
- Preparación de otros compuestos de cromo(VI), por vía seca.
- Reacciones de oxidación-reducción del cromo(III) a cromo(VI) y (II) respectivamente.
- Reactividad rédox en estado sólido para el cromo(VI).
(NH 4)2Cr 2O 7
∆
Cr 2O 3
NH 4+
AgCrO 4
Ag
+
CrO 42OH -
CrO 2Cl 2
OH
H+
-
Cr 2O72- +e
Cr(OH 2)63+
K+
H 2SO 4
H SO
K2Cr 2O 7 2 4 CrO 3
NaCl
Esquema 1. Diagrama de flujo del Cromo
Figura 4. Diagramas de Frost de
Cr.
Experimentación en Química Inorgánica
2
Figura 5. Especies de Cromo(VI) en función del pH.
Figura 6. Diagrama de Pourbaix del Cromo
PROCEDIMIENTO
1. En sendos tubos de ensayo que contienen 1 mL de dicromato potásico 0.1M añadir:
a) Gota a gota hidróxido sódico 1M.
b) Cuatro gotas de peróxido de hidrógeno (20 vol), cuatro de HCl (1M) y un volumen igual de éter
c) Repetir el ensayo b) utilizando una disolución alcalina. Esperar al menos media hora para observar
resultados y agitar.
2. En tubo de ensayo, añadir unas gotas de ácido sulfúrico concentrado sobre dicromato potásico sólido.
Adicionar cloruro sódico sólido. Colocar en la boca del tubo un papel de filtro humedecido con unas
gotas de yoduro potásico (0.1M) y calentar suavemente.
3. Añadir a una disolución de alumbre de cromo(III) 0.1M.
a) Unas gotas de ácido clorhídrico cocentrado y un trozo de cinc.
b) Peroxidisulfato de potasio (500 mg) y cinco gotas de nitrato de plata 1M. Ajustar a pH ácido con
HCl. Calentar. Añadir más K2S2O8 si fuese necesario.
Experimentación en Química Inorgánica
3
PREGUNTAS
1.- Escribe todas las reacciones que tienen lugar en las diferentes pruebas, fundamentándolas en las
observaciones realizadas.
2.- ¿De qué color es el anión cromato?.
3.- Formular el cloruro de cromilo. Escribir su reacción de síntesis. ¿Qué gas se desprende al
calentarlo?. Escribir la reacción química de la detección de dicho gas.
Experimentación en Química Inorgánica
4
PRÁCTICA IX. MANGANESO
Reacciones del Manganeso
Material
Reactivos
Tubos de ensayo
Sulfato de manganeso(II) 0.1M
Permanganato potásico
Vaso de 100 ml
Hidróxido sódico 1M
Hidróxido sódico (s)
Cuentagotas
Peróxido de hidrógeno (20 vol.)
Acido sulfúrico (concentrado)
Papel indicador
Acido clorhídrico 1M
Bismutato sódico (s)
Pinza de madera
Acido nítrico 1M
Yoduro potásico 0.1 M
Espátula
Sistema de filtración a vacío
(Kitasato) con placa filtrante
OBJETIVO
1. Comprobar una serie de reacciones típicas del manganeso(II) en disolución acuosa como:
- pH al que precipita el hidróxido.
- reacciones de oxidación a manganeso(IV) y (VII).
2. Obtener otros estados de oxidación del manganeso muy inestables.
Figura 7. Diagrama de Frost del Mn
Figura 8. Diagrama de Pourbaix del Mn
Experimentación en Química Inorgánica
MnO 4+e-
+e-
Mn(OH 2)62+
5
OH -
Mn(OH) 2
-e-
MnO(OH)
+eOH -
MnO 2
MnO 4= +e
Esquema 2. Diagrama de Flujo del Mn
PROCEDIMIENTO
1. Utilizar 1 mL de una disolución de sulfato de manganeso(II) 0.1M para los siguientes ensayos y
adicionar:
a)
Hidróxido sódico 1M.
b)
Un ml de hidróxido sódico 1M y 1 ml de peróxido de hidrógeno. Filtrar con embudo y papel
de filtro, lavar el precipitado con agua, y calentarlo en baño de arena con ácido clorhídrico
diluido. Comprobar el desprendimiento de cloro.
c)
Un ml de ácido nítrico1M y una microespátula de bismutato sódico. Calentar si es necesario.
2. EN VITRINA : Utilizando permanganato potásico sólido:
a)
Utilizando un vaso de precipitados de 100 mL, añadir una pequeña cantidad (dos
microespátulas) de permanganato a una disolución muy concentrada de hidróxido sódico
(seis lentejas en 5 mL de agua) y hervir hasta casi sequedad. Enfriar la disolución y acidular
con 1 mL de ácido HCl concentrado.
PREGUNTAS
1.- Escribe todas las reacciones que tengan lugar e interprétalas en base a las observaciones
realizadas.
2.- Formular el anión permanganato. ¿Qué color tiene?.