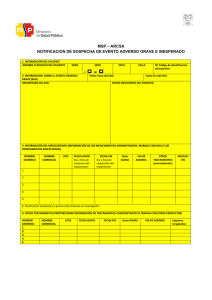
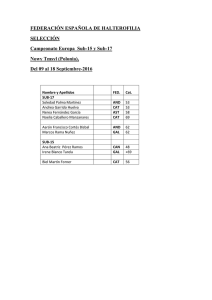
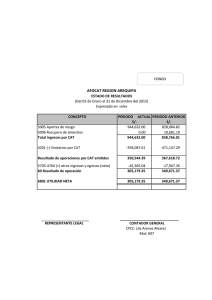
Enfermedad por arañazo de gato
Anuncio

sumario TEMAS DE HOY Enfermedad por arañazo de gato M. CRUZ ARNÉS, J. VILA ÁLVAREZ*, C. SAÁ REQUEJO*, J. C. MUÑOZ GARCÍA Especialistas en MFy C , Centro de Salud San Fernando, Móstoles y *Centro de Salud Miguel Servet, Alcorcón. Madrid. Introducción La enfermedad por arañazo de gato (EAG) es una enfermedad infecciosa de curso benigno, causada por Bartonella henselae. Aunque constituye una de las causas más frecuentes de linfadenopatía regional dolorosa en niños y adultos jóvenes, el 20% de los casos acontece en mayores de 20 años (60% en varones). El número estimado de casos anuales en Estados Unidos es de 24.000, requiriendo hospitalización un 8,3%. La incidencia de EAG se sitúa en 0,77-0,86/10.000 hab./año para pacientes hospitalizados y en 9,3/10.000 hab./año para enfermos ambulatorios (1-3,7,14,16,22). Agente patógeno La primera descripción de EAG la realizaron en 1950 Debré y Mollaret. Wear y cols. postularon inicialmente como agente etiológico de la EAG a Afipia felis (4,7), pero luego se observó que los pacientes no presentaban un aumento del título de anticuerpos ni reacción inmune celular contra A. felis. Posteriormente se aisló Rochalimaea henselae (bacilo gram negativo α-proteobacteria) a partir de cultivos de tejido linfático de adenopatías de pacientes inmunocompetentes con EAG(5,7). Estudios serológicos mediante inmunofluorescencia indirecta mostraron títulos elevados anti-Rochalimaea en el suero de estos pacientes. Se ha identificado recientemente por PCR el ADN de R. henselae en el pus y tejido linfático procedente de las adenopatías de los pacientes con EAG. Es- 152 MARZO 2001 tudios genotípicos del gen de Rochalimaea determinaron que los miembros de este género eran más cercanos a Bartonella baciliformis y se propuso una unificación de los dos géneros. Así, Bartonella henselae es el nombre que reemplaza al anterior de R. henselae (6). Se ha objetivado la participación de los gatos en la transmisión del agente causal de la EAG. El contacto con cachorros y gatos adultos se ha documentado en el 95% de los casos de EAG y menos del 1% de los pacientes con esta enfermedad no tienen historia de contacto con animales, aunque se han observado casos de EAG en enfermos con lesiones en la piel que han estado en contacto con saliva de gatos infectados. La enfermedad presenta tendencia estacional (otoño e invierno), en relación con el nacimiento de las nuevas camadas de gatos. El 70-80% de los gatos que han estado en contacto con pacientes con EAG presentan hemocultivos positivos y títulos serológicos elevados de anticuerpos anti-B. henselae (frente al 38% en los gatos de sujetos sanos). Las garrapatas y pulgas están implicadas en la transmisión de B. henselae. Se ha aislado B. henselae en pulgas de gatos seropositivos, demostrándose que los pacientes que tienen gatos con pulgas presentan mayor riesgo de desarrollar EAG (7). Los gatos que transmiten la infección permanecen generalmente asintomáticos (7). Clínica La EAG puede afectar numerosos órganos y causar gran variedad de manifestaciones clínicas. Comienza en el 25-94% de los casos como una pápula o pústula de 0,5 a 1 cm. de diámetro en el lugar de inoculación, como un granuloma ocular con o sin conjuntivitis, o como una erosión en las membranas mucosas. La lesión primaria se desarrolla entre tres y diez días después del arañazo y puede persistir hasta ocho semanas. La pápula de inoculación está presente en la mitad de los casos. Posteriormente aparece la linfadenopatía regional asociando síntomas sistémicos variables. La expresión de la enfermedad varía desde una adenopatía crónica autolimitada a casos de enfermedad sistémica grave. La linfadenopatía es la presentación más frecuente, observándose en más del 80% de los casos. En un 50% de los casos se acompaña de febrícula y MEG, asociando con frecuencia variable cefalea, odinofagia y anorexia. La localización de la adenopatía depende del lugar de inoculación. Los ganglios axilares son los más afectados, seguidos de los cervicales, submandibulares, inguinales, femorales y poplíteos. La afección de un único grupo ganglionar es más frecuente que la múltiple. El tamaño de las adenopatías se normaliza entre los 2 y 6 meses. TEMAS DE HOY Tabla 1.Diagnóstico diferencial de la enfermedad por arañazo de gato 1. Causas de linfadenopatía crónica: - Toxoplasma - Sporothix schenkii - Linfadenitis bacteriana inespecífica - Linfogranuloma venéreo - Sífilis - Infección por micobacterias típicas o atípicas - Tularemia - Brucelosis - Mononucleosis - Blastomicosis - Histoplasmosis - Micosis sistémicas - Aspergillus fumigatus - Infección por herpes simple tipo 6 - Infección por VIH - Neoplasias - Linfomas (linfoma inmunoblástico de células grandes o histiocítico difuso). - Histiocitosis X - Quiste tireogloso, higroma quístico, quiste dermoide - Sarcoidosis - Enfermedades del tejido conectivo - Enf. de Kawasaki - Enf. de Kikuchi - Fenitoína 2. Diagnóstico diferencial de las complicaciones neurológicas de EAG: - Procesos primarios cerebrales - Encefalitis aguda: vírica, rickettsias, fúngica, metabólica y tóxica Entre un 5-20% de los pacientes con EAG presentan otras manifestaciones clínicas distintas de la linfadenopatía, entre las que destacan el síndrome oculoglandular de Parinaud, manifestaciones oculares (neuroretinitis, retinitis, exudado macular y edema de cabeza del nervio óptico), manifestaciones neurológicas (encefalitis, meningitis, mielitis, arteritis cerebral, radiculitis, polineuritis, parálisis de Bell, afectación de pares craneales), manifestaciones pulmonares (neumonía y derrame pleural (0,2%) (7,8), abscesos hepáticos y esplénicos, y manifestaciones musculoesqueléticas (osteomielitis, abscesos paravertebrales) (1,7,10,14-17). En pacientes inmunodeprimidos la EAG puede tener un curso agudo o subagudo, con afectación local o complicaciones sistémicas. Es frecuente la afectación ósea y cutánea múltiple. Pueden presentar shock séptico, hipotensión, acidosis metabólica, infiltrados pulmonares y fiebre persistente. Cada vez son más frecuentes las manifestaciones atípicas de EAG o de infección por Bartonella en individuos infectados de sida: angiomatosis bacilar cutánea, peliosis bacilar hepática y bacteriemia. Otras manifestaciones menos frecuentes (7) de la EAG serían la endocarditis, hepatitis anictérica, artritis reactiva, linfedema, tiroiditis, uretritis, tumores mamarios inflamatorios (9) y enfermedad sistémica grave con shock séptico generalmente reversible. Una manifestación poco común, aunque potencialmente grave, es la trombocitopenia. Diagnóstico Históricamente, el diagnóstico de EAG típica requería la presencia de al menos tres de los siguientes criterios (1,7,10): historia de contacto con animales (normalmente gatos sanos) con arañazo o lesión primaria dérmica u ocular, linfadenopatía regional que se desarrolla una o dos semanas después del contacto (con cultivos y serologías negativas para otras causas de linfadenopatía), prueba cutánea positiva para la EAG, y biopsia ganglionar compatible con EAG. El diagnóstico puede resultar más dificil de no existir la lesión primaria de inoculación o no haber historia previa de contacto con un animal. En el examen histopatológico del material obtenido por punción o biopsia ganglionar (indicada en casos atípicos o de diagnóstico dudoso) se objetiva hiperplasia linfoide con proliferación arteriolar, hiperplasia reticulocitaria y dilatación de paredes arteriales. Posteriormente aparecen granulomas, algunos con áreas de necrosis que pueden confluir para formar microabscesos o abscesos francos en fases más evolucionadas. Se evidencian pequeños organismos pleomórficos gramnegativos mediante la tinción argéntica de Warthin-Starry (5,7,10,18). Aunque los organismos son técnicamente cultivables (mediante cultivo directo en agar sangre, cultivo tisular y método de lisis centrifugación), los laboratorios hospitalarios con frecuencia no utilizan los medios apropiados para aislar B. hensalae o desechan las muestras de forma temprana (precisan 2-3 semanas de incubación) (5,7,10). Las colonias que crecen en agar sangre son pequeñas, de color grisáceo blanquecino, con morfología irregular y se adhieren a la superficie de agar. Mediante la tinción de Giménez se visualizan bacilos con tendencia a la autoadhesión y a la formación de grandes masas (7,10). Actualmente es posible realizar el diagnóstico definitivo mediante la titulación de anticuerpos séricos utilizando enzimoinmunoanálisis para IgM e IgG y técnicas de inmunofluorescencia indirecta (sensibilidad 88% y especificidad 97%, mayor que para ELISA). El método más rentable cuando se dispone de muestras tisulares o de pus es la reacción en ca- MARZO 2001 153 CENTRO DE SALUD Tabla 2. Recomendaciones de tratamiento para EAG Enfermedad diseminada (7) eritromicina 2g i.v./24h o ciprofloxacino 800 mg i.v./24h, luego ciclo largo de AB oral Angiomatosis bacilar (1,7) eritromicina 500 mg/6h o doxiciclina 100 mg/12 h (3 semanas) Afectación ósea (7,10) eritromicina Neuroretinitis (23) doxiciclina, cotrimoxazol o rifampicina vía oral Abscesos hepáticos-esplénicos (7) gentamicina i.v. Encefalopatía (17) eritromicina o gentamicina i.v. Tumor mamario inflamatorio (9) claritromicina 250 mg/12 h (3 semanas) 38ºC con persistencia de astenia, anorexia y cefalea, presencia de trastornos sistémicos graves (abscesos hepáticos y esplénicos, manifestaciones oculares, neurológicas, pulmonares, musculoesqueléticas), inmunodeprimidos (angiomatosis bacilar cutánea, peliosis hepática, bacteriemia), la antibioterapia se muestra efectiva, con rápida resolución de los signos y síntomas, siendo de elección eritromicina, doxiciclina, rifampicina, cotrimoxazol, ciprofloxacino y gentamicina (1,7,10,19). La azitromicina constituye una alternativa eficaz en el tratamiento de la EAG según trabajos recientes (12,13,20,21). La duración del tratamiento oscila según los estudios entre 15 y 21 días, y se puede finalizar siempre que las adenopatías hayan disminuido de tamaño (hasta 10 mm de diámetro), el paciente haya permanecido afebril al menos una semana y sin sintomatología general durante 10 días. En casos de bacteriemia, se debe mantener el tratamiento durante al menos 6 semanas (7). Las adenopatías evolucionan con supuración y dolor local en aproximadamente un 15% de los enfermos con EAG típica. El drenaje con aguja de gran calibre alivia los síntomas y proporciona material para realizar el diagnóstico. Este procedimiento no presenta el inconveniente de la aparición de fístulas (21), objetivado con las técnicas de incisión y drenaje a pesar de proceder a través de piel sana a 1-2 cm de la lesión (7). Evolución dena de la polimerasa. Presenta mayor sensibilidad que el cultivo para detectar Bartonella en aspirados de tejido linfático y establece el diagnóstico de forma más temprana (detección e identificación de la especie en uno o dos días, comparados con las 2-3 semanas necesarias para el aislamiento primario e identificación mediante cultivo) (1,7,10,11,17). Tratamiento Resulta controvertido el papel y la selección de la terapia antibiótica en el tratamiento de la enfermedad por arañazo de gato, porque es una entidad en la que muchos pacientes no presentan una afectación importante, siendo muy común la resolución espontánea. En pacientes inmunocompetentes y con enfermedad leve (adenitis, fiebre intermitente inferior a 38ºC o escasa repercusión sistémica) probablemente no requiera tratamiento, aunque algunos estudios han demostrado la desaparición más rápida de las adenopatías con tratamiento antibiótico. En enfermedad moderada o grave (fiebre prolongada mayor de 154 MARZO 2001 El pronóstico es bueno. La linfadenopatía se resuelve espontáneamente entre los dos y los seis meses salvo afectación ganglionar masiva (en este caso puede persistir linfadenopatía ligera o moderada durante 1-2 años). Los adultos presentan ocasionalmente secuelas transitorias (astenia crónica, artralgias y cefalea). En inmunocompetentes no se han descrito complicaciones letales ni secuelas irreversibles. Prevención Las actividades preventivas son esenciales en el control de la enfermedad. Los gatos, particularmente los jóvenes, son la principal fuente de infección por Bartonella henselae. Es indispensable evitar mordeduras y arañazos de estos animales o proceder a la desinfección precoz de las heridas (1). En niños e inmunodeprimidos se recomienda evitar el contacto repetido con animales domésticos. Algunos autores postulan la extracción de las garras de los gatos (7) y la inmunización en los animales domésticos (no disponible en la actualidad). Bibliografía 1. Kurbasic M, Jones VF, Maxfield CM. Radiological case of the month. Atypical cat-scratch disease. Arch Pediatr Adolesc Med 1999;153:761-762. sumario TEMAS DE HOY 2. Shenep JL. Cat scratch disease and Bartonella henselae infections in children. Pediatr Ann 1996;25:518-523. triou A, Nicolaidou P. Cat-scratch disease in Greece. Arch Dis Child 1998;78:64-66. 3. Klein JD. Cat scratch disease. Pediatr Rev 1994;15:348-353. 15. De Ruiter CJ, Ganley TJ, Dormans JP, Meyer JS, Finn LS. Inguinal swelling in 5 years old girl (clinical conference). Clin Orthop 1998;350:268-270, 273-275. 4. Wear DJ, Margilein AM, Hadfield TL, Fisher GW, Schlagel CJ, King FM. Cat scratch disease: a bacterial infection. Science 1983;221:1403-1405. 5. Boyce S, Pena JR, Davis DA. An ulcerate nodule associated with lymphadenopathy. Arch Dermatol 1999;135:985-988. 6. Brenner DJ, O´Connor SP, Winkler HH, Steigerwalt AG. Proposal to unify the genera Bartonella and vinsonii comb. nov., Bartonella henselae comb. nov., and Bartonella elizabethae comb. nov., and to remove the family Bartonellaceae from the order Rickettsiales. Int J Syst Bacteriol 1993;43:777-786. 7. Smith DL. Cat-scratch disease and related clinical syndromes. Am Fam Physician 1997;55:1783-1789,1794-1794. 8. Abbasi S. Pulmonary manifestations of cat scratch disease. Pediatr Infect Dis J 1995;14:547-548. 9. Fortune SM, Kaelin CM, Gulizia JM, Daily JP. Cat scratch disease presenting as a breast mass. Obstet Gynecol 2000; 95(6Pt2):1027. 16. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 1-1998. An 11 years old boy with seizure (clinical conference). N Engl J Med 1998;338:112119. 17. Armengol CE, Hendley JO. Cat scratch disease encephalopathy: a cause of status epilepticus in school-aged children. J Pediatr 1999;134:635-638. 18. Kacker A, Kuhel WI, Hoda RS. Quiz case 2. Cat scratch disease. Arch Otolaryngol Head Neck Surg 2000;126:667,681-2. 19. Bohlmann BJ. Treatment of cat scratch disease (comment, letter). N Engl J Med 1999;340:1842. 20. Walterspiel JN. Treatment of cat scratch disease (letter). N Engl J Med 1999;340:1842-3. 21. Giladi M, Ephros M. Treatment of cat scratch disease (letter). N Engl J Med 1999;340:1843. 10. Midani S, Ayoub EM, Anderson B. Cat scratch disease. Adv Pediatr 1996;43:397-422. 22. Numakazi K, Chiba S, Ueno H. Infected dog and cat bites (letter). N Engl J Med 1999;340:1842. 11. Anderson BA, Sims K, Regnery R, et al. Detection of Rochalimaea henselae DNA in specimens from cat scratch disease patients by PCR. J Clin Microbiol 1994;32:942-948. 23. Gray AV, Reed JB, Wendel RT, Morse LS. Bartonella henselae infection associated with peripapillary angioma, branch retinal artery occlusion, and severe vision loss. Am J Ophthalmol 1999; 127:223-4. 12. Giladi M, Avidor B. Cat scratch disease. N Engl J Med 1999;340:108. 13. Bass JW, Freitas BC, Freitas AD, et al. Prospective randomized double blind placebo-controlled evaluation of azithromycin for treatment of cat scratch disease. Pediatr Infec Dis J 1998;17:447-52. 14. Karpathios T, Golphinos C, Psychou P, Garoufi A, Papadimi- Correspondencia: Miguel Cruz Arnés C/ Tacona, 37 - 2ºA 28030 Madrid MARZO 2001 155