trabajo colaborativo No.1
Anuncio

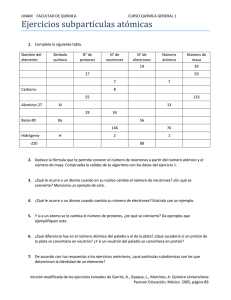
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA TAREA 2 TRABAJO COLABORATIVO No.1 Este trabajo consiste en desarrollar las siguientes 15 preguntas, todas ellas con igual valor. Esta actividad tiene una ponderación de 100 puntos. En el taller existen preguntas de selección múltiple con única y múltiple respuesta, también será necesario desarrollar algunos ejercicios. ¡¡Favor sustentar todas las respuestas!! 1. En la tabla 1 ilustrar ejemplos que permitan establecer la diferencia entre elementos, sustancias y compuestos. Realizar una breve descripción para cada uno de ellos. Tabla 1 Ejemplos Breve descripción Elementos Sustancias Compuestos 2. ¿Cuántos electrones poseen los elementos con un número atómico de Z=31 y Z=49? 3. Si la representación de un átomo es 1s2 2s2 2p5, cuáles de las siguientes aseveraciones son ciertas a. Tiene 2 niveles energéticos b. Tiene 3 orbitales p en el segundo nivel c. Le falta por llenar un orbital d. Tiene número atómico nueve 4. En los átomos poli electrónicos existe un efecto protector por parte de los electrones cercanos al núcleo, que reduce la atracción electroestática entre los protones del núcleo, que tienen carga positiva y los electrones externos. A este efecto se le conoce como: a. Distribución parcial de cargas b. Carga formal efectiva UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD Escuela de Ciencias Agrícolas, Pecuarias y del Ambiente 358005-Química inorgánica c. Carga neta electrónica d. Carga nuclear efectiva 5. Completar la tabla 2: Tabla 2 Elemento Protones U Electrones 146 Na 11 Ca2+ 20 S Neutrones Número de masa 238 23 20 16 32 6. El radio atómico del sodio en el sodio metálico es de 1,90 Å. Calcular el volumen de un mol de átomos de sodio en el sodio metálico y el porcentaje del volumen atómico-gramo ocupado por los átomos. 7. En cada uno de los siguientes pares, indique cuál será el ion de mayor diámetro. Justificar la respuesta mediante la configuración electrónica. a. b. c. d. Mn++ y Zn++ Ti++ y Fe++ F- y O= S= y Se= 8. Realizar una breve descripción de la siguiente figura que resulta al graficar el radio atómico de algunos elementos contra el número atómico. 2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD Escuela de Ciencias Agrícolas, Pecuarias y del Ambiente 358005-Química inorgánica 9. Escribir el símbolo atómico ( a. b. c. d. e. para cada uno de los isótopos que se describen a continuación. Z=6, número de neutrones igual a 7 El isótopo del carbono con número de masa de 13 Z=19, A=44 El isótopo del calcio con número de masa de 41 El isótopo que tiene 19 protones y 16 neutrones. 10. Explicar porque la reactividad de los elementos del grupo VII A es tan elevada al compararla con la de los gases nobles. ¿Serán los gases nobles nocivos para el medio ambiente? 11. Describir como es el comportamiento de la reactividad en la tabla periódica. ¿Existe una tendencia generalizada en los grupos y periodos?, ¿Cuál es el elemento mas reactivo de la tabla periódica?, ¿Cómo es la reactividad de los metales de transición? 12. Como se logrará explicar que los valores de la afinidad electrónica del azufre sean tan diferentes: Primera afinidad electrónica: 200 kJ/mol Segunda afinidad electrónica: -649 kJ/mol. 13. Consultar como influye la presencia de los óxidos de nitrógeno en el proceso de formación del ozono de la estratosfera. Ilustrar con reacciones. ¿Cuáles son las fuentes más comunes para la formación de los óxidos de nitrógeno? 14. ¿Cuáles son las propiedades del oxígeno diatómico?, ¿Por qué esta es una sustancia paramagnética?, Qué tipos de compuestos puede formar el oxígeno? 15. Al observar la tabla 3, donde se encuentran los puntos de fusión y de ebullición de algunos elementos y desde el conocimiento de sus propiedades periódicas. ¿Cómo se podrá explicar este comportamiento? Propiedad física Punto de fusión (°C) Punto de ebullición (°C) F -223 -187 Tabla 3 Cl -102 -35 Br -7 59 I 114 183 3