Tema 8 - IES Gabriela Mistral
Anuncio

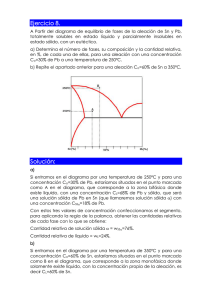
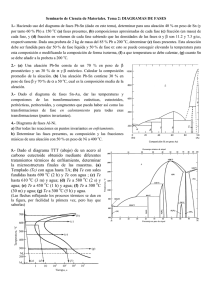
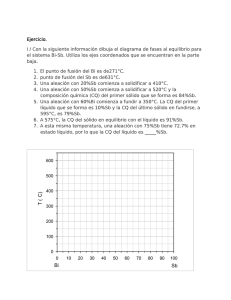
Bloque I: Materiales Tema 8: Estructura atómica y cristalina de los materiales. Aleaciones y diagramas de fases. Guion 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Estructura atómica. Modelos atómicos. Enlace químico. Covalente e iónico. Estructura cristalina. Sistemas cristalinos. Concepto de aleaciones. Componentes de una aleación. Composición de una aleación. Fases de las aleaciones. Diagrama de equilibrio de fases. Diagramas binarios de elementos totalmente solubles en estado líquido y sólido. Determinación de la cantidad de fases. Regla de la palanca. Diagramas de fases de aleaciones totalmente solubles en estado líquido y totalmente insolubles en estado sólido. Diagramas de fases de aleaciones totalmente solubles en estado líquido y parcialmente solubles en estado sólido. Análisis del diagrama Fe-C 1. Estructura atómica El átomo Electrones Protones + neutrones = nucleones Estructura atómica El conocimiento de la estructura atómica nos permite interpretar las semejanzas y diferencias de los elementos. La química es una ciencia experimental en permanente expansión. Electrones suponen prácticamente todo el volumen del átomo, pero sólo una pequeña parte de su masa. 2. Modelos atómicos Teoría atómica de Dalton 1803-1808 Los átomos según Dalton Modelo atómico de Thomson 1897 Descubrió el electrón. Teoría del “pudin de ciruelas” Modelo atómico de Rutherford 1911 Descubrimiento de electrones girando alrededor del núcleo. Modelo atómico de Bohr 1913 Electrones girando solo en determinados niveles de energía 3. Enlace químico. Covalente e iónico • En la naturaleza, la mayoría de los átomos están agrupados por una razón meramente energética: todos los sistemas tienden a la mínima energía y, a menor energía, mayor estabilidad. A+B AB • En la formación de un enlace químico siempre se produce un cambio en la configuración electrónica respecto a la de los átomos aislados, lo que significa que los átomos enlazados adquieren una configuración electrónica más estable. • En 1916 Kossel y Lewis establecen de forma independiente la: TEORÍA ELECTRÓNICA DE VALENCIA Enlace covalente Lewis: regla del octeto. Compartición de pares de electrones por dos o más átomos no metálicos. Enlace covalente: simple, doble o triple. Estructura o diagrama de Lewis Enlace iónico Kossel: regla del octeto. Metales (electropositivos) + No metales (electronegativos) Atracción electrostática entre iones = RED CRISTALINA Valencia iónica o electrovalencia. 4. Estructura cristalina. Sistemas cristalinos. Estructura cristalina Los metales y las aleaciones metálicas forman CRISTALES Los cristales son redes en las que se distribuyen los átomos según una secuencia regular que se repite en tres dimensiones. Índice o número de coordinación. Tipos de redes cristalinas Tipos de redes cristalinas Aclaraciones redes cristalinas De entre ellos, hemos saber que la mayor parte de los metales, aproximadamente el 90% cristalizan en tres estructuras cristalinas densamente empaquetadas, que son: Cúbica centrada en el cuerpo (BCC) Cúbica centrada en las caras (FCC) Hexagonal compacto (HCP) Video sobre redes cristalinas http://www.youtube.com/watch?v=Rmi1c7zr6Q 5. Concepto de aleaciones Aleación Mezcla homogénea de dos o más metales, o de uno o más metales con algún o algunos elementos no metálicos. METALES: en estado elemental (estado de oxidación nulo) NO METALES: P, C, Si, S, As Generalmente llevados a altas temperaturas para que se fundan. 6. Componentes de una aleación Componentes de una aleación Los distintos elementos que forman parte de una aleación son los componentes de la aleación. 7. Composición de una aleación Composición de una aleación La composición de una aleación es indicar la proporción en la que se encuentran los componentes de una aleación. Base de la aleación: componente o componentes que están en mayor proporción. Traza de la aleación: componente o componentes que están en menor proporción. 8. Fases de las aleaciones Fase Fase es una porción homogénea de un sistema caracterizado por una estructura y una organización atómica constante y, por tanto, con características físicas y químicas uniformes. Al conjunto de las representaciones de los estados posibles se le denomina diagrama de fases. 9. Diagramas de equilibrio de fases Diagramas de fases Los diagramas de fases son representaciones de los estados posibles de un material dependiendo de las variables de presión, temperatura y concentración. Ojo: En los metales, la fusión se realiza a presión constante (1 atm) por lo que las únicas variables que intervienen en el diagrama de fases son temperatura y concentración. Regla de las fases de Gibbs Sistema en equilibrio. Características: 1. Número de fases F 2. Grado de libertad L 3. Número de componentes C Diagrama agua pura vs metales 10. Determinación de la cantidad de fases. Regla de la palanca Cantidad de fases Se aplica la Regla de Gibbs F + L = C + N En diagramas de fases a presión variable (agua) N = 2 En diagramas de fases a presión constante (metales) N = 1 Ejercicio de aplicación: Calcule el número de grados de libertad en tres puntos “críticos” del diagrama de fases del agua pura y en el diagrama de fases de dos metales totalmente miscibles. Regla de la palanca Método empleado para conocer el porcentaje de fase sólida y líquida presentes en una aleación a una cierta concentración cuando se encuentra a una temperatura. El protocolo a seguir consiste en trazar la línea vertical X (por la concentración que deseamos analizar) y la línea isoterma de la temperatura indicada, línea horizontal L-O-S, en el diagrama de equilibrio de la aleación AB. Determinando su intersección el punto O y la intersección con las líneas de liquidus y solidus los puntos L y S. 11. Diagramas binarios de elementos totalmente solubles en estado líquido y sólido. Tipo I Aleaciones Tipo I En línea liquidus, solidus y en zona bifásica: F=2 C=2 N=1 L= 1 Para determinar las concentraciones de cada elemento en un punto determinado se aplicará la Ley de la Palanca 12. Aleaciones totalmente solubles en estado líquido e insolubles en estado sólido. Tipo II Aleaciones tipo II Zona L + A: 2 fases (cristales A + líquido) zona hipoeutéctica Zona L+B: 2 fases (cristales B + líquido) zona hipereutéctica Punto eutéctico: aleación con punto de fusión más bajo. Coexisten Asólido, Bsólido y la fase líquida L. Grado de libertad=0 lo que significa que la solidificación se produce a temperatura constante. 13. Aleaciones totalmente solubles en estado líquido y parcialmente insolubles en estado sólido. Tipo III Aleaciones tipo III Temperatura eutéctica Los metales presentan cierta solubilidad en estado sólido. Ejemplo: aleación Pb-Sn 14. Análisis del diagrama Fe-C Aleaciones Hierro-Carbono Aceros. Gran aplicación en la industria Variedad α.- cristaliza en BCC hasta 768 ºC en la red cúbica centrada. Disuelve muy poco carbono, un 0,008% a temperatura ambiente. Es magnético. Fe Variedad β.- cristaliza en FCC. Se encuentra entre 768 ºC y 910 ºC. Es similar al hierro α pero no es magnético. Variedad γ.- cristaliza en BCC. Se encuentra entre 910 ºC y 1.400 ºC. Disuelve fácilmente el carbono, hasta el 1,76%. Es diamagnético. Variedad δ.- cristaliza entre 1.400 ºC y 1.539 ºC en la red cúbica centrada. Puede disolver hasta un 0,1% de carbono. No tiene aplicaciones siderúrgicas. Aleaciones Hierro-Carbono Entre 0,08 % y 1,76% C Superior a 1,76% 6,67% Aceros Fundiciones Cementita Diagrama Fe-C Composición La introducción del carbono en el Fe modifica las propiedades de este de forma muy significativa y es necesario conocer que ocurre en los aceros al aumentar el % de C. La primera clasificación de los aceros la realizaremos de acuerdo a su estructura de equilibrio. • Hipoeutectoides: Menos de 0.8%C (estructura de ferrita y perlita). • Eutectoides: 0.8%C (estructura de perlita). • Hipereutectoides: Mas de 0.8%C y menos de 2.14%C (estructura de cementita y perlita). Según aumenta el contenido de carbono se produce una deformación mayor en las redes cristalinas, en las soluciones sólidas y da lugar a la aparición de cementita (Fe3C), constituyente muy duro y frágil, en mayor cantidad. Diagrama Fe-C Estructura Estructura cristalina.- no es uniforme, varía según los constituyentes de la aleación. Estructura micrográfica.- el elemento fundamental es el grano, por lo que es necesario controlar su formación y desarrollo en los tratamientos térmicos. Cuanto mayor sea el grano, peores son las propiedades de los aceros, excepto la capacidad para trabajarlo en máquinas. Estructura macrográfica.- depende de las impurezas que contenga la aleación. Diagrama Fe-C Constitución Ferrita: solución sólida de carbono en hierro α. Es el más blando y dúctil (90 HB). Disuelve muy poco carbono (menos de 0,008%) por lo que se considera hiero α. Cementita: es el carburo de hierro (Fe3C). Es el más duro y frágil (800HB). Perlita: es el microconstituyente eutectoide formado por ferrita (86,5%) y cementita (13,5%). Tiene una estructura laminar si el enfriamiento ha sido lento (sorbítica). Si se vuelve a calentar la cementita forma glóbulos en la ferrita (globular). Austenita: es una solución sólida por inserción de carbono en hierro γ (hasta 1,76% de C). No se encuentra a temperatura ambiente. Es blando, deformable, tenaz y muy resistente al desgaste. Es el constituyente más denso y no es magnética. Ledeburita: es una aleación eutéctica de ferrita y cementita. Es propio de las fundiciones. Martensita: es una solución sobresaturada de carbono en hierro α. Se obtiene por enfriamiento rápido de la austenita y se presenta en forma de agujas. Después de la cementita, es el más duro y frágil. Tiene propiedades magnéticas. Bainita: también se produce por una transformación isotérmica de la austenita. Se produce en un temple defectuoso y su fin es la transformación total de la austenita en bainita. Sus propiedades son intermedias entre la perlita y la martensita. Diagrama Fe-C Constitución Diagrama Fe-C La línea ABCD es la línea de liquidus y la línea AHJECF es la línea de solidus. Los puntos más destacables de diagrama son: Punto A: temperatura de solidificación del hierro puro (1.539 ºC). Punto C: aleación eutéctica (4,3% de C), compuesta por austenita y cementita formando ledeburita. Punto E: máxima solubilidad de C en Fe α (1,76% de C). Punto D: límite del diagrama (6,67% de C), corresponde a la cementita pura (100% cementita). Punto S: ó eutectoide: la austenita se transforma en perlita (0,89% de C).