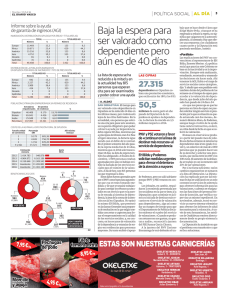
ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE
Anuncio

ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI (M = Li, Na, Rb y Cs) LUIS ALFREDO RODRÍGUEZ GONZÁLEZ Trabajo presentado para optar por el título de Master en Ciencias-Física Director Ph.D. JESÚS EVELIO DIOSA ASTAIZA Co-Director Ph. D. RUBÉN ANTONIO VARGAS ZAPATA UNIVERSIDAD DEL VALLE FACULTAD DE CIENCIAS NATURALES Y EXACTAS POSGRADO EN CIENCIAS-FÍSICA CALI – COLOMBIA FEBRERO - 2011 Dedicado a mis padres y hermanos. A mi linda novia Lorena. Y una mención especial a mi Tío Huberto. AUTORIZACIÓN PARA PUBLICAR TESIS DE MAESTRIA EN LA PAGINA WEB DE LA DIVISION DE BIBLIOTECA O CUALQUIER OTRA BASE DE DATOS (INTERNET) QUE LA BIBLIOTECA O UNIVERSIDAD DEL VALLE DISPONGA EN ELLO Yo, LUIS ALFREDO RODRÍGUEZ GONZÁLEZ, mayor de edad identificado con Cédula de Ciudadanía No 16.379.554 de Cali (Valle), autor de: ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI (M = Li, Na, Rb y Cs), autorizo para que ésta sea puesta (texto completo) en la página web de la División de Biblioteca de la Universidad del Valle o cualquier otra base de datos que la Universidad disponga para ello. Expido esta autorización bajo el entendido que no recibiré ninguna contraprestación económica, en tanto que se busca divulgar conocimientos académicos sin ningún interés comercial. En constancia de lo expuesto firmo a los 25 días del mes de Mayo de 2011. C.C. 16.379.554 de Cali RESUMEN Medidas de difracción de rayos X (XRD), calorimetría de barrido diferencial (DSC) y espectroscopia de impedancia compleja fueron llevadas a cabo en policristales basados en AgI y MI (M = Li, Na, Rb y Cs). Los policristales fueron crecidos usando el método de evaporación lenta (HI acuoso como solvente). Las tres técnicas de medida nos permitieron determinar la configuración estructural de los policristales crecidos y conocer los mecanismos de transporte seguidos por el Ag+ en el electrolito. El método de crecimiento empleado logró que el AgI y el MI cristalizara de dos formas diferentes: como policristales bifásicos y, como policristales ternarios acompañados de pequeñas cantidades de AgI. Los policristales obtenidos presentaron una gran estabilidad térmica, mostrando solamente una anomalía alrededor de 149 ºC causada por la transición de fase del AgI. Sólo el sistema CsAg2I3 presentó una pequeña transición estructural a 130 ºC (en un barrido de calentamiento) ó 110 ºC (en un barrido de enfriamiento). Esta transición estructural permitió que el CsAg2I3 se convirtiera en un conductor superiónico. Una discusión más detallada sobre los mecanismos de transporte en cada electrolito se realizó. Un circuito equivalente ha sido propuesto para simular los espectros de impedancia de la celda Ag/electrolito/Ag, donde se consideró el ruido inducido por los cables a altas frecuencias y procesos de absorción reversible en la interfaz electrolito-electrodo. AGRADECIMIENTOS Es evidente que sí al final sólo una persona es quien defiende a muerte las ideas plasmadas en su trabajo, son muchas otras las que han contribuido a la realización del mismo. Algunos con implicaciones directas que aportan en su momento y otros con implicaciones indirectas que lograr aportar toda una vida. Es imposible valorar quien(es) aporta(n) más (y ni me importa averiguarlo!), lo realmente importante es que al final han aportado. Y aunque algunos colegas lo pongan en duda, su ayuda divina me ha reconfortado e inspirado en situaciones complejas, por eso quiero iniciar mis agradecimientos reconociendo la labor divina e invisible de Dios. Continuo mis agradecimientos refiriéndome a las cinco personas a quienes dedico este trabajo, y quiero dejar claro que el orden de mención no prioriza sentimientos. Agradezco a mis Padres quienes, desde que inicie mi formación académica, han creído ciegamente en mis capacidades y nunca me han desamparado. Es inconmensurable el esfuerzo que ambos han hecho para que a mi alcance éste todo lo necesario. Nunca fue imperioso trabajar porque priorizaron mis estudios sobre todas las cosas. Agradezco a mis hermanos, Andrés y Fabián, por ser lo que son… MIS HERMANOS. En compañía de ellos compartí momentos de máxima diversión y siempre vi sus manos extendidas cada vez que los necesitaba. Deben saber que cuentan incondicionalmente conmigo. Ahora es el turno de la última personita que llego a hacer parte de esta familia; es mi compañera de estudio, mi colega de trabajo, mi mejor amiga,… mi amada Lorena. Sólo tú sabes por lo que he tenido que pasar mientras escribía este trabajo. Tuvisteis que soportar mis amarguras, mis quejas, mis frustraciones y hasta mis enfermedades, pero nunca me distes la espalda. Quedo corto al tratar de agradecer todo lo que has hecho por mí. A mi familia de segundo, tercer y órdenes superiores (primos, tíos, abuelas, suegros, cuñados,…) quiero agradecer por su acompañamiento continuo. Con más de un rezo me ayudaron a presentar exámenes, a escribir este documento, a presentarme a becas doctorales,… en fin, sé que gracias a su Fe inquebrantable he podido lograr cumplir mis metas. No los nombro uno a uno porque la lista es ENORME! Agradezco al profesor Evelio Diosa por dirigir este trabajo. Pese a todas las dificultades que supuso el desarrollo del mismo, me apoyó y estuvo al tanto de todo. Su ayuda fue vital para solucionar todas las dificultades que supone escribir una tesis, corregirla, y luego concertar con el posgrado para fijar fechas de defensas. Agradezco también al profesor Rubén Vargas por acogerme en su grupo, por su apoyo tanto intelectual como financiero (pues un trabajo como estos requiere de inversión). A todos los miembros del grupo les doy las gracias por todo lo que me han aportado. Lo cierto es que ha sido más lo que yo he aprendido de ellos que lo que yo he podido aportarles. El ambiente que creaban en el grupo hacia que me sintiera muy cómodo trabajando. Al igual que mi familia de órdenes superiores, no los nombro, pues no quiero excluir a ninguno en dicha lista. Hay una persona que merece un agradecimiento especial, puesto que gracias a su ayuda fue posible realizar la caracterización eléctrica de los sistemas en estudio. James Zapata, muchísimas gracias porque, de manera desinteresada, invertisteis mucho de tu tiempo para realizarme dichas medidas. Además soy testigo de los riesgos que corristeis por realizarlas (no se preocupen que su salud nunca estuve en riesgo). Cierro este apartado (y si alguien ha faltado por agradecerle, de seguro ya lo habré hecho personalmente) agradeciendo a los jurados que participaron en la revisión de éste trabajo –Dr. Diego Arias y el Dr. Eval Vacca –. Sus aportes contribuyeron a fortalecer los resultados plasmados en esta tesis. ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CONTENIDO CONTENIDO ............................................................................................................................... 1 INTRODUCCIÓN ........................................................................................................................ 3 1 CONDUCTIVIDAD IONICA .............................................................................................. 5 1.1 CONDUCTORES DE IONES EN ESTADO SOLIDO ............................................................. 5 1.2 CONDUCCIÓN IONICA EN ELECTROLITOS SÓLIDOS....................................................... 6 1.3 MECANISMOS DE CONDUCCIÓN ................................................................................... 8 Referencias .............................................................................................................................. 11 2 ESTADO DEL ARTE ......................................................................................................... 12 2.1 YODURO DE PLATA (AgI) ............................................................................................. 12 2.2 AgI DOPADO CON YODUROS ALCALINOS .................................................................... 16 Referencias .............................................................................................................................. 17 3 CRECIMIENTO DE CRISTALES. EVAPORACIÓN LENTA ........................................ 19 3.1 CRISTALIZACION .......................................................................................................... 19 3.2 NUCLEACIÓN ............................................................................................................... 21 3.2.1 Nucleación Primaria ............................................................................................ 21 3.2.2 Nucleación Secundaria ........................................................................................ 23 3.3 CRECIMIENTO DE CRISTALES ....................................................................................... 23 3.4 TÉCNICAS DE CRECIMIENTO DE CRISTALES ................................................................. 25 3.5 CRECIMIENTO POR EVAPORACIÓN LENTA .................................................................. 26 3.6 PREPARACIÓN DE LAS ELECTROLITOS SÓLIDOS: CRECIMIENTO DE LOS CRISTALES ... 26 3.6.1 Etapas de la preparación ..................................................................................... 27 Referencias .............................................................................................................................. 29 4 TECNICAS DE CARACTERIZACIÓN ............................................................................ 30 4.1 DIFRACCIÓN DE RAYOS X (XRD) .................................................................................. 30 4.1.1 Ley de Bragg ........................................................................................................ 31 4.1.2 Principio Básico del funcionamiento del XRD ..................................................... 32 4.1.3 Detalles experimentales ...................................................................................... 33 4.2 CALORIMETRIA DE BARRIDO DIFERENCIAL (DSC) ....................................................... 34 4.2.1 DSC DE FLUJO DE CALOR ..................................................................................... 35 1 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4.2.2 ENTALPIA ............................................................................................................. 36 4.2.3 Detalles experimentales ...................................................................................... 38 4.3 ESPECTROSCOPIA DE IMPEDANCIA ............................................................................. 39 4.3.1 Un vistazo a la Espectroscopia de Impedancia.................................................... 39 4.3.2 Circuito Equivalente en Electrolitos Sólidos ........................................................ 42 4.3.3 Detalles experimentales ...................................................................................... 47 Referencias .............................................................................................................................. 49 5 RESULTADOS ................................................................................................................... 50 5.1 ESTUDIO DE LA CONFIGURACIÓN ESTRUCTURAL: DIFRACCIÓN DE RAYOS X ............. 50 5.2 ANALISIS TÉRMICO: CALORIMETRIA DE BARRIDO DIFERENCIAL ................................ 58 5.3 CARACTERIZACIÓN ELECTRICA .................................................................................... 63 5.3.1 Representación Cole-Cole. Curvas de Conductividad ......................................... 63 LiI – AgI ................................................................................................................................ 63 NaI – AgI .............................................................................................................................. 65 RbAg4I5 – AgI ....................................................................................................................... 67 CsAg2I3 – AgI ........................................................................................................................ 69 5.3.2 Conductividad DC. Energía de Activación ........................................................... 71 5.3.3 Mecanismos de conducción en sistemas binarios MI-AgI (M = Li, Na) ............... 76 5.3.4 Conductividad Superiónica del CsAg2I3. .............................................................. 78 5.3.5 Circuito Equivalente en los Electrolitos Sólidos. ................................................. 81 Referencias .............................................................................................................................. 84 6 CONCLUSIONES .............................................................................................................. 86 2 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González INTRODUCCIÓN En los últimos años se ha manifestado un gran interés por el estudio de los llamados conductores iónicos rápidos, o conductores superiónicos. Los conductores superiónicos son aquellos materiales que permiten el movimiento macroscópico de iones a través de su estructura, alcanzando valores excepcionalmente altos de conductividad iónica en estado sólido (similares a los electrolitos líquidos). Esta peculiaridad hace de ellos pieza clave en diversas aplicaciones entre las que se encuentran los sensores, las baterías recargables o las pilas de combustible. En este sentido, todavía hay interesantes fronteras por superar, por ejemplo extender la duración o capacidad de las baterías de litio actuales, o la reducción de la temperatura de funcionamiento de las celdas de combustible de oxígeno, debido a las malas prestaciones de los materiales empleados como electrolitos a temperatura ambiente. Para estas aplicaciones es fundamental que la oposición al transporte de carga sea la menor posible, por lo que el interés en los llamados conductores iónicos rápidos ha sido, y continúa siendo, muy elevada. Desde su descubrimiento a inicios del siglo pasado, el yoduro de plata (AgI) ha sido el conductor iónico más estudiado gracias a su alta conductividad iónica por encima de 420 K. Y aunque ya es mucho lo que se sabe de él, su estudio no ha cesado, por el contrario, viene en aumento y la palabra Conductividad Iónica sigue estando estrechamente relacionada con él, como lo indica la siguiente figura: 100 Numero de Publicaciones 90 80 70 60 50 40 30 20 10 0 2010 2005 2000 1995 1990 1985 1980 1975 1970 1965 1960 1955 1950 Año Gráfico del número de publicaciones a través de los años del AgI. La búsqueda se realizó usando el motor de búsqueda ScienceDirect usando como palabras claves: AgI (línea azul) y AgI + Ionic Conductivity (línea roja). 3 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Se puede percibir como el estudio de la conductividad iónica puede ser modulado por el interés que despierta el AgI. Funcionalizar el AgI continua produciendo mucho interés, pues todavía se desea alcanzar los mismos valores de conductividad del -AgI a temperatura ambiente. Es por eso que en materiales “top” de nuestros días (por ejemplo, nanotubos de carbón) se busca obtener mejores prestaciones de sus propiedades eléctricas. El objetivo principal de este trabajo es caracterizar policristales de AgI dopados con yoduros alcalinos MI (M = Li, Na, Rb y Cs) crecidos bajo el método de evaporación lenta, usando como solvente ácido yodhídrico, HI, en una solución acuosa del 57 %. Para caracterizarlos se realizaron medidas de difracción de rayos X, calorimetría de barrido diferencial y espectroscopia de impedancia. A través de estos tres métodos se pretende explicar el tipo de policristal cristalizado luego del crecimiento y discutir los mecanismos de transporte seguidos por el Ag+. 4 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 1 1 CONDUCTIVIDAD IÓNICA 1.1 CONDUCTORES DE IONES EN ESTADO SÓLIDO Para que la conducción eléctrica se lleve a cabo es necesario que una gran cantidad de electrones y/o iones migren largas distancias a través del material. Cuando el portador de carga móvil es un ión, el material es considerado un conductor iónico. Si bien la mayoría de los materiales conductores poseen solamente un tipo de portador de carga, la conducción iónica puede ser acompañada por conducción electrónica en materiales de conducción mixta [1]. Los materiales de conducción eléctrica puede ser clasificados de acuerdo al tipo de portador de carga y a sus valores de conductividad, (-1 cm-1 ó S cm-1). En la figura1.1 se muestra el rango de conductividades típicas. Además, los valores de conductividad están fuertemente ligados con la temperatura. En general, un incremento en la temperatura produce un incremento en la conducción en todos los materiales, excepto en los metales. Los metales poseen alta conducción a bajas temperaturas [2]. Materiales en estado sólido que exhiben alta conductividad iónica y una despreciable conductividad electrónica son llamados Conductores Iónicos Sólidos. La conductividad iónica de un electrolito sólido puede variar entre 10-10 y 10-5 -1cm-1. Los llamados Sólidos Superiónicos ó Conductores de iones rápidos son electrolitos sólidos que exhiben una alta conducción iónica a temperaturas cercanas al ambiente, comparable a la conductividad alcanza por los electrolitos líquidos [3]. Electrolitos sólidos de iones rápidos (en inglés, fast ionic conductors) poseen conductividades que van desde 10-5 a 100 -1cm-1 [4]. Existen un sinnúmero de ventajas que proporcionan los electrolitos sólidos en comparación con los electrolitos líquidos: miniaturización del sistema, alta estabilidad mecánica (no hay derrames de la solución), mayor durabilidad, desempeño a altas temperaturas, entre otros. Los primeros trabajos en conductores iónicos fueron desarrollados por Tubandt y Lorentz, en 1914, justamente en uno de los conductores iónicos más importantes, el AgI. Ellos mostraron que el AgI exhibía un comportamiento eléctrico inusual con conductividades iónicas comparables a los electrolitos líquidos en el rango de temperaturas de 150 ºC a 550 ºC [5]. El descubrimiento de los sólidos electrolitos RbAg4I5 y Na--alumina en 1967 aumentó la cantidad 5 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González de investigadores trabajando en materiales iónicos en estado sólido [6,7]. Estos dos materiales poseen una alta conductividad a temperatura ambiente. En las siguientes décadas, un gran número de materiales con una amplia variedad de iones móviles han sido reportados. La investigación activa en el campo de la conductividad iónica en estado sólido recibe especial atención debido a sus potenciales aplicaciones como la construcción de baterías y celdas de combustible [8]. La búsqueda de nuevos materiales que puedan combinarse para obtener mejores prestaciones ha ramificado el campo de la conducción iónica. Según sea el tipo de material, podemos categorizar los electrolito sólido en: compuestos cristalinos, polímeros y vidrios [9] Conductores Iónicos Conductores de iones rápidos Electrolitos Sólidos Aislantes log 6 5 4 3 2 1 0 -1 -2 -3 -4 -5 -6 -7 -8 -9 -10 -11 -12 Conductores Electrónicos Metales Semiconductores Aislantes Figura 1.1. Clasificación de la conductividad eléctrica en sólidos según el tipo de portador y su magnitud [10]. 1.2 CONDUCCIÓN IÓNICA EN ELECTROLITOS SÓLIDOS En electrolitos sólidos, los iones móviles se desplazan a través de la estructura por medio de saltos entre sitios disponibles, bajo la influencia de un campo eléctrico. Estos iones móviles pueden ser cationes o aniones tales como H+, Li+ Na+ Ag+, O2- y F- [11,12], pero energéticamente resulta ser más probable que un catión se mueva a través de una subred aniónica, puesto que su radio iónico es más pequeño que la de su contraparte aniónica. El 6 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González mecanismo de transporte considera que los saltos de los iones se realizan a través de vacancias y/o intersticios [13]. La formación de un defecto Schottky generado térmicamente (un par vacancia-ion), la existencia de impurezas cargadas o simplemente la creación de algunas posiciones regulares en la red cristalina permiten la migración por vacancias. En éste proceso, un ión salta a un sitio vacío vecino dejando su posición original vacía, que podría ser ocupada por un ión de la misma clase cercana a ella (figura 1.2.a). Para formar un defecto Frenkel, los iones son movidos de sus sitios de red a sitios intersticiales. Estos sitios intersticiales se encuentran vacíos en una estructura cristalina ideal. Los iones localizados en sitios intersticiales pueden saltar a sitios intersticiales vecinos (figura 1.2.b) [14]. La estructura de la subred “inmóvil” en los electrolitos cristalinos define los sitios por los cuales el ión móvil puede trasladarse y pueden generar caminos de conducción en una, dos o tres dimensiones. Por tanto, el éxito de una buena conducción iónica no solamente depende del ión móvil, los iones inmóviles juegan un papel importante en la formación de “autopistas” para que los portadores de carga transiten. a) b) - + - - - + - + - - + - + + - + - - + - + - + - + - + - + - + - + - + + - + - + - + - + c) E=0 Dg a x=0 E x=0 Figura 1.2. Representación esquemática del movimiento del ión a través de (a) defectos Frenkel y (b) defectos Schottky. (c) Barrera de potencial para un ión con y sin el gradiente de campo eléctrico, E. a es un espacio interatómico. 7 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González La conductividad iónica de un material depende de la concentración de las especies móviles (n), su carga (q) y movilidad (), la cual es expresada por la ecuación: =nq (1.2.1) Con el fin de incrementar el valor de n, dopajes aliovalente o heterovalentes resultan ser una buena solución, los cuales involucran el reemplazo parcial de una clase de ión con otra provocando una deformación espacial y de carga. La conductividad puede ser aumentada súbitamente si generamos simultáneamente intersticios iónicos o vacancias que necesariamente induzcan migraciones para poder preservar el balance de carga. Richard et. al. propusieron una clasificación mecanicista y sugirieron tres tipos de mecanismos de migración del ion, los cuales son [15]: 1. Transporte convencional de defectos por procesos de saltos no correlacionados; el transporte es por medio de procesos de saltos convencionales pero la concentración de defectos es muy alta. 2. Mecanismos altamente correlacionados; el transporte del ión es efectuado por un movimiento colectivo de muchos iones. 3. Mecanismos de difusión casi líquidos; aquí la subred de los iones no móviles es altamente desordenada permitiéndole a los iones móviles moverse libremente con superficies de potencial plano. Todos estos procesos están controlados por procesos de difusión térmicamente activados y la energía libre requerida para que un ión salte a un sitio de red vecino energéticamente equivalente es representada por la energía libre de Gibbs DGm. Para describir la conducción iónica, el Modelo de Camino Aleatorio (en inglés, Random Walk Model) de las especies móviles es generalmente usado. En este modelo, los iones móviles se mueven independientemente los unos de los otros y la difusión es causada por los saltos aislados [11,16,17]. 1.3 MECANISMOS DE CONDUCCIÓN Para que se dé lugar la conducción iónica es necesario que existan sitios disponibles para que los iones móviles puedan desplazarse. Defectos puntuales tipo Frenkel o Schottky son 8 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González necesarios para el transporte de iones. La figura 1.2.a, b representa los movimientos del ión en defectos Frenkel y Schottky, respectivamente. Debido a las vibraciones térmicas, en ocasiones los iones reciben la energía suficiente para ser empujados dentro de sitios intersticiales o a sitios de red vacantes cercanas, esto permite la conducción de iones. Cuando se aplica un gradiente de campo eléctrico a través de la muestra (ver figura1.2.c), la conductividad eléctrica resultante puede ser expresada por medio de la siguiente ecuación general = ni q i i i (1.3.1) Donde ni, qi y i son la concentración, carga y movilidad, respectivamente, de la i-ésima especie de carga móvil. En su mayoría, los portadores de carga son generados térmicamente debido a pares de defectos Frenkel o Schottky. En estado de equilibrio, el número de defectos es dado por n f = NN 1/ 2 exp g f / 2kT n s = N exp g s / 2kT (1.3.2) (1.3.3) Donde los sufijos f y s están asociados a defectos Frenkel y Schottky, respectivamente; g es la energía de formación; N y N’ son el número de posiciones de red normales y sitios intersticiales, respectivamente; k es la constante de Boltzmann; y T la temperatura. Puesto que los mecanismos de conducción se dan a través de saltos entre vacancias o intersticios, la probabilidad que el ión salte a un sitio u otro puede ser descrita a través del modelo de Einstein: P = 0 exp Dg / kT (1.3.4) Donde 0 es la frecuencia vibracional de los iones alrededor de sus posiciones medias en un pozo de potencial con una barrera de altura Dg. Dg es la energía libre de Gibbs para la migración de iones, y puede ser expresada como Dg = Dh TDS (1.3.5) 9 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González donde Dh y DS son la entalpia y entropía de migración, respectivamente. En ausencia de un gradiente de campo eléctrico externo esta ecuación representa un número igual de iones saltando en todas las direcciones, en equilibrio termodinámico. Cuando aplicamos un campo eléctrico, E, a lo largo de una dirección (en la dirección x para la figura 1.2.c), la probabilidad de salto de los iones a lo largo de la dirección del campo eléctrico se ve alterada. En la misma dirección del campo: P = 0 exp Dg qaE / 2 / kT (1.3.6) En dirección contraria del campo P = 0 exp Dg qaE / 2 / kT (1.3.7) Así, el número de iones por unidad de volumen moviéndose en la dirección de campo es n = nP P nqaE / kT P (1.3.8) donde se asume que qaE << kT. Aquí n es el número de portadores de carga por unidad de volumen. La densidad de corriente, j, definida como la cantidad de carga que atraviesa una unidad de área por unidad de tiempo, puede ser escrita como j = n qa = nq 2 a 2 PE / kT (1.3.9) Por tanto, la conductividad iónica puede ser expresada como = j / E = na 2 q 2 / kT 0 exp Dg / kT (1.3.10) en el caso de sólidos con defectos Frenkel = NN 1 / 2 a 2 q 2 / kT 0 exp g f / 2 Dg / kT (1.3.11) En el caso de sólidos con defectos Schottky = N a 2 q 2 / kT 0 exp g s / 2 Dg / kT (1.3.12) A parte de los mecanismos de conducción anteriores gobernados por la concentración de defectos Frenkel y Schottky generados térmicamente, la conductividad iónica también puede ser alterada por el dopaje mediante impurezas. Sin embargo, en solidos superiónicos, el número de portadores de carga móviles es extremadamente grande, por lo tanto, la energía de formación de defectos, es decir gf y gs, es despreciablemente pequeño. Así, para sólidos superiónicos, la 10 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González ecuación 1.3.11 y 1.3.12 son ligeramente modificadas y puede ser generalizada a la siguiente ecuación tipo Arrhenius: = A exp E a / kT T (1.3.13) Donde A/T es el factor preexponencial según sea el tipo de defecto y Ea Dg es conocida como la Energía de Activación [18]. Esta ecuación tipo Arrhenius muestra la manera como la conductividad iónica depende de la temperatura y es válida sólo en regímenes de temperatura donde el material no sufre ninguna transformación. La facilidad con la que un ión puede saltar y la apertura de caminos de conducción en la estructura cristalina están estrechamente relacionadas con la energía de activación [11,19]. Referencias [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] R. A. Huggins. Ionics, 8 (2002) 300-313. A. R. West. Solid State Chemistry and its Applications, John Wiley & Sons, Chichester, (1984). P. Mcgeehin y A. Hooper. J. Mater. Sci., 12 1 (1977) 1-27. H. Tuller y P. K. Moon. Mater. Sci. Eng. B, 1 2 (1988) 171-191. C. Tubandt y E. Lorentz. Z. Phys Chem., 87 5 (1914) 513-542. Y. –F. Y. Yao y J. T. Kummer. J. Inorg. Nucl. Chem., 29 9 (1967) 2453-2466 B. B. Owens y G.R. Argue. Science., 157 3786 (1967) 308-310. P. Knauth y H. L. Tuller. J. Am. Ceram. Soc., 85 7 (2002) 1654-1680 J. B. Bates, J. C. Wang y N. J. Dudney. Phys. Today, 35 7 (1982) 46-53 G. Cakmak. Synthesis and Characterization of Ion Conducting Solid Polyelectrolites and Alkali Fluorooxoborate, Tesis Doctoral, Stuttgart (2009). M. Jansen. Angew. Chem. Int. Ed. Engl., 30 12 (1991) 1547-1558. W. V. Gool. Annu. Rev. Mater. Sci., 4 (1974) 311-335. G. C. Farrington y J. L. Briant. Science., 204 4400 (1979) 1371-1379 S. Chandra. Superionic Solids: Principles and Applications. North Holland, Amsterdan (1981) C. Richard and A Catlow. J. Chem. Soc. Faraday Trans., 86 8 (1990) 1167-1176. J. B. Goddenough. Proc. R. Soc. London. Ser. A., 393 1805 (1984) 215-234. J. R. Manning. Am. J. Phys., 36 10 (1968) 922-923. R.C. Agrawal y R. K. Gupta. J. Mater. Sci., 34 (1999) 1131-1162. P. Padma Kumar y S. Yashonath. J. Chem. Sci., 118 1 (2006) 135-154. 11 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 2 2 ESTADO DEL ARTE 2.1 YODURO DE PLATA (AgI) Se sabe con certeza que, en estado sólido, el yoduro de plata puede ser encontrado en tres diferentes fases: A presión atmosférica y por debajo de 420 K podemos encontrarlo en su fase (-AgI) y en su fase (-AgI), mientras que por encima de 420 K, el AgI se encuentra en su fase más atractiva, la fase (-AgI). Sin embargo, Mellander et. al. reportó la existencia de dos nuevas fases a medida que se aplica presión [1]. Si se incrementa la presión a temperatura ambiente, el AgI se transforma, vía fase tetragonal IV [2], a una estructura de fase III tipo “rocksalt” (rs-AgI), estructura similar al NaCl. Dentro de esta fase la conductividad incrementa rápidamente al incrementar la temperatura, alcanzando valores de 0.5 -1cm-1 justo por debajo de la frontera de la transición rs . Trabajos recientes han mostrado que a presiones extremadamente altas ( 11.3 GPa), el AgI transforma de su fase rs-AgI a una fase V con una estructura tipo KOH [3]. Todas las fases conocidas del AgI se encuentran representadas en el diagrama de fase p-T de la figura 2.1. Debido a las altas prestaciones en conducción, resulta de mucho interés estudiar el AgI sometido a altas presiones, pero como nuestro estudio se centra en presiones cercanas a 200 KPa (presión a la cual se hacen las pastillas para medidas de impedancia en el presente trabajo), restringiremos nuestra discusión a las fases , y . De todas las diferentes formas que puede adoptar el AgI, su fase (-AgI) es la que mayor interés despierta gracias a su gran conductividad iónica por encima de 420 K. Como se mencionó anteriormente, Tubandt fue el primero científico en observar el aumento súbito de la conductividad en el AgI luego de ser sometido a una transición de fase . Este incremento es de un factor de ~ 4000, logrando valores de conductividad de 1.3 -1cm-1 [4]. Medidas de transporte han confirmado que la conducción en el -AgI es predominantemente iónica debido al movimiento de Ag+, y la conducción electrónica resulta ser muy baja en comparación con la conducción iónica (~107 veces más baja) [5]. Pero, ¿Cómo se explica este salto tan abrupto en la conductividad iónica? 12 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Figura 2.1. Diagrama de fase p-T del AgI. Región I() corresponde al -AgI, región II/II’(/) correspondiente a la mezcla de fases -AgI y -AgI, región III tiene una estructura tipo NaCl y la región IV es una fase tetragonal. A las más altas presiones se marca una región V correspondiente a una fase del AgI con estructura similar al KHO. Gráfica original tomada de la referencia [3] La explicación se encuentra en la estructura cristalina del -AgI. En el cristal del -AgI, los iones de I- adoptan un empaquetamiento centrado en el cuerpo (bcp) mientras que el catión de Ag+ puede ser estadísticamente distribuido entre sitios octaédricos, tetraédricos y trigonales. De acuerdo a Strock [6,7], una celda unitaria cubica de I-, con a = 504 pm, proporciona 42 posiciones posibles para que 2 átomos de Ag+ se ordenen, de las cuales 6 posiciones son octaédricas [6(b)], 12 posiciones son tetraédricas [12(d)] y 24 posiciones son trigonales [24(h)]. Las distancias Ag+I- en los intersticios de la subred aniónica son listados a continuación [8]: Posiciones 6(b) tienen 2 vecinos cercanos I- a 252 pm Posiciones 12(d) tienen 4 vecinos cercanos I- a 282 pm Posiciones 24(h) tienen 3 vecinos cercanos I- a 267 pm. En la figura 2.2 se muestran las posiciones accesibles del Ag+ en la estructura del I-, así como los modos de coordinación. Esta gran cantidad de intersticios posibles para el Ag+, junto con los altos valores de conductividad iónica, lleva a pensar que el -AgI se comportaba como un sólido de I- con una “subred fundida” de Ag+ dentro de la subred aniónica. Sin embargo, estudios de difracción de rayos X y radiación de neutrones, tanto en monocristales como en polvos de AgI, mostró claramente que el Ag+ ocupaba preferencialmente las posiciones tetraédricas [9-12] Así, la difusión del Ag+ se da a través de saltos entre posiciones tetraédricas, usando como puente las posiciones trigonales (demostrado a través de simulaciones con el 13 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Método de Monte Carlo Inverso (RMC, siglas en inglés) [13,14]), donde un cambio de coordinación 434 promueve saltos con valores de energía de activación muy bajos (Ea ~ 0.05 eV) [15]. Por lo tanto, la alta conductividad del -AgI es la combinación de varios factores: baja carga del Ag+ (es un ión monovalente). un gran número de sitios vacantes en los cuales se puede mover. una estructura con muchos caminos abiertos para el transporte del catión. baja coordinación, así como ligeros cambios de coordinación mientras se mueve, hace que la energía de activación sea muy baja. 6(b) Sitios Octaédricos 12(d) Sitios tetraédricos I- 24(h) Sitios trigonales Figura 2.2. Estructura cristalina del -AgI. Los aniones de I forman una red cubica centrada en el cuerpo mientras que los cationes de Ag tiene 42 sitios disponibles para ubicarse dentro de la celda. Las líneas que enlazan los sitios tetraédricos y trigonales representan el camino preferente por el cual el Ag+ se mueve por la estructura. Las líneas rojas representan las coordinaciones octaédricas y tetraédricas. Por otra parte, en condiciones de presión atmosférica y temperatura ambiente podemos encontrar dos posibles fases del AgI: -AgI y -AgI. Según sea el tipo de preparación o las condiciones a la que se someta el AgI, es posible encontrar una de las dos fases o ambas mezcladas. Por ejemplo, Patnaik et. al. [16] obtuvo la fase -AgI a través de tres métodos de preparación: por reacciones químicas acuosas entre LiI y AgNO3, reacciones semi-acuosas entre el Ag2O y HI, y por síntesis mecano-químicas que involucran directamente polvos de Ag e I. Pero la fase -AgI resulta ser la fase más común y las más probable de obtener, pues muestra una gran estabilidad a la hora de formar la sal en estado sólido. Es por eso que el polvo de AgI comercial, de alta pureza, se encuentra primordialmente en la fase -AgI. El -AgI posee una 14 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González estructura tipo wurzita hexagonal (grupo espacial: P63 mc [17]) mientras que la fase -AgI posee una estructura tipo zincblende o esfarelita (grupo espacial: F43m [18]) (ver figura 2.3). Sin embargo, tanto el -AgI como el -AgI tienen esencialmente el mismo calor específico, entalpía y temperatura de transición (T = 420 K) al pasar a la fase -AgI [19]. Ambas estructuras poseen igual número de posiciones tetraédricas de dos tipos, T+ y T-, localizadas a las mismas distancias, por arriba y por abajo, de capas aniónicas de empaquetamiento cerrado. Los cationes de Ag son distribuidos en estos sitios tetraédricos de tal manera que las posiciones de un solo tipo (T+ o T-) sean ocupadas, las otras posiciones tetraédricas permanecerán vacantes. Como resultado de tal distribución de cationes, celdas elementales de las fases y no tienen centro de inversión. Esta particularidad permite usar monocristales con estructuras tipo wurzita o esferalita como materiales piezoeléctricos y óptico-acústicos [20]. La conductividad iónica alcanzada por monocristales (policristales) de -AgI y -AgI, por separado (mezclados), es típicamente la de un conductor iónico normal y es gobernada por defectos de Frenkel térmicamente activados [16,21]. En el caso del -AgI, los estudios de conducción iónica han sido poco abordados pero algunos autores [16,22,23] muestran que la conductividad del -AgI policristalino a temperatura ambiente es un orden de magnitud mayor que la conductividad del -AgI, además de tener una menor energía de activación. Se asume que la conducción del -AgI, superior al -AgI, es causada por un gran número de posiciones catiónicas vacías presentes dentro de su estructura [24]. Se ha encontrado que la conducción iónica del -AgI policristalino mejora sí el sistema es sometido a presión o es macerado. Una explicación razonable de este aumento en la conducción se basa en el hecho que el -AgI sometido a un tratamiento mecánico puede pasar fácilmente a una estructura politipo /-AgI [20]. A pesar de un gran número de posiciones tetraédricas vacantes en el -AgI y -AgI, los desplazamientos del ión Ag+ a través de los sitios tetraédricos libres son energéticamente obstaculizados cuando las distancias catión-catión en estos casos son más cortas (0.325 nm y 0.187 nm para el -AgI y -AgI, respectivamente) que la distancia entre los cationes de Ag+ en los sitios regulares (0.428 nm). Por consiguiente, la concentración de defectos Frenkel en ambas fases podría ser muy baja. Esta es la razón por la cual se observa experimentalmente una conductividad relativamente baja en el -AgI. [20]. 15 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González a) b) Ag+ + Ag I- I- Figura 2.3. Estructura cristalina del a) -AgI y b)-AgI. La coordinación tetraédrica en ambas estructuras es representada por líneas rojas. 2.2 AgI DOPADO CON YODUROS ALCALINOS Las propiedades superiónicas exhibidas por el yoduro de plata a temperaturas por arriba de 420 K han fomentado una serie de estudios de los diagramas de fase binarios del tipo AgI-MI, donde M es un metal alcalino [25-28]. Con el fin de potencializar estos materiales en aplicaciones tecnológicas (por ejemplo, baterías en estado sólido), existe gran interés en identificar fases bifásicas o compuestos ternarios (MAgAIB) que logren exhibir valores de conductividad cercanos, o superior, al mostrado por el -AgI, con transiciones superionicas a temperaturas cercanas al ambiente. Hasta la fecha, el compuesto ternario más sobresaliente ha sido el RbAg4I5, pues tiene una conductividad iónica excepcionalmente alta ( = 0.21 -1cm-1 [29]), lo que ha motivado diversos estudios de sus propiedades físicas, incluyendo investigaciones acerca de los mecanismos de conducción del Ag+ [30,31] y las dos transiciones de fase exhibidas a bajas temperaturas [32]. A temperatura ambiente, su estructura cristalina es cubica con un parámetro de red a ~11.2 Å [33,34]. El grupo espacial fue designado a uno de los dos pares enantiomórficos P4132 y P4332. En este arreglo, las subred de I- adopta una estructura similar a la que adoptan los átomos en la estructura -Mn, y el Rb+ se coordina a seis aniones. Los 16 iones de Ag+ por celda unidad pueden distribuirse de formas diferentes sobre 60 ó 72 sitios. Otros dos compuestos ternarios que se pueden obtener son, por parte del potasio, el KAg4I5 y KAg2I3, y por parte del cesio, el CsAg2I3 y Cs2AgI3; aunque se ha encontrado que el KAg2I3 y Cs2AgI3 son fases muy poco estables a temperatura ambiente, además poseen una pobre conductividad iónica, cercana a los 10-8 -1cm-1 [18,25,35,36]. El KAg4I5 posee un desempeño superiónico cercano al RbAg4I5, pues a temperatura ambiente alcanza una conductividad = 0.08 -1cm-1 [37]. Por su parte, el CsAg2I3 resulta ser un conductor iónico normal ( ~ 10-5 16 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González -1cm-1 [38]), aunque en este trabajo reportaremos un súbito aumento de la conductividad cercano a 380 K gracias a una transición de fase estructural sufrida por éste compuesto. De otro lado, se ha encontrado que los alcalinos de bajo número atómico (Li y Na) no logran formar un compuesto ternario con el AgI. Muchos intentan usarlos como fases dopantes que logren aumentar la concentración de defectos para que el Ag+ se mueva mejor, y así, aumentar la conductividad de las fases y del AgI para desplazar la temperatura de transición de la fase -AgI a valores cercanos al ambiente o para reducir el salto de la transición [39]. Referencias [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] B. –E- Mellander, B. Baranowski y A. Lundén. Phys. Rev. B., 23 (1981) 3770-3773. D.A. Keen y S. Hull, J. Phys. Condens. Matter, 5 (1993) 23-32 A. Hao. J. Appl. Phys., 101 (2007) 053701 V. Kharton. Handbook of Solid State Electrochemistry. Fundamentals, Materials and their Applications, Volume 1, Wiley-CVH, Weinheim - Alemania (2009) pag. 20. W. Jost y K. Weiss Z. Phys. Chem. Neue Folge, 2 (1954) 112-114. L.W. Strock, Z. Phys. Chem B, 25 (1934) 411 L.W. Strock, Z. Phys. Chem B, 31 (1936) 132 W. –K. Li, G. –D Zhou y T. C. W. Mak. Advanced Structural Inorganic Chemistry, Oxford University Press, Gran Bretaña (2008) pag. 384 W. Bührer y W. Hälg. Helv. Phys. Acta, 47 (1974) 27 R. J. Cava, F. Reidinger y B. J. Wuensh. Solid. State. Commun, 24 (1977) 411 Y. Tsuchiya, S. Tamaki y Y Waseda. J. Physc. C: Solid State Phys, 12 (1979) 5361 A. F. Wright y B. E. F. Fender. J. Phys. C: Solid State Phys, 10 (1977) 2261 R. L. McGreevy. J. Phys.: Condens. Matter, 13 (2001) R877 M. G.Tucker, D. A. Keen, M. T. Dove, A. L. Goodwin y Q. Hui. J. Phys. Condens. Mater, 19 (2007) 335218. L. E. Smart y E. A. Moore. Solid State Chemistry. An Introduction. Tercera Edición, CRC Press Taylor & Francis Group, New York (2005) pag 218 J. R. G. Patnaik y C. S. Sunandana. J. Phys. Chem Solids, 59 (1998) 1059-1069 G. Burley. J. Chem. Phys., 38 (1963) 2807-2812 R. B. Wilsey. Phil. Mag., 42 (1921) 262-263 R. Shaviv, E.F. Westrum Jr. y F. Grønvold, et al., J. Chem. Thermodyn. 21 (1989) 631. N. F. Uvarov, E. F. Hairetdinov, A. I. Rykov y Yu. T. Pavlyukhin. Solid State Ionics, 96 (1997) 233-237. 17 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] J. –S. Lee, S. Adams y J. Maier, Journal of Physics and Chemistry of Solids, 61 (2000) 16071622 H. Hoshino y M. Shimoji, J. Phys. Chem. Solids, 35 (1974) 321-326 V. I. Baranovskij, B. G. Lurie y A. N. Murin, Doklady AN SSSR 105 (1955) 1188 T. Takahashi, K. Kuwabara y O. Yamamoto, J. Electrochem. Soc., 116 (1959) 357 J. N. Bradley y P. D. Greene. Trans. Faraday Soc., 62 (1966) 2069 J. N. Bradley y P. D. Greene. Trans. Faraday Soc., 63 (1967) 424 O. Yamamoto. Fast-Ion Transport in Solids, (B. Scrosati, A. Magistris, C. M. Mori y G. Mariotto, Eds.), NATO ASI series, Vol. E, 250, Kluwer Academic Publishers, Dordrecht (1993) pag. 203. A. Wojakowska, E. Krzyak y A. Wojakowski. Thermochim. Acta, 344 (2000) 55. S. Geller, J. R. Akridge, y S. A. Wilber. Phys. Rev. B, 19 (1979) 5396 D. Wilmer, K. Funke y C. J. Carlile. Ber. Bunsenges. Phys. Chem., 95 (1991) 1137. K. Funke, T. Kloidt, D. Wilmer y C. J. Carlile. Solid State Ionics, 53+56 (1992) 947 S. Geller. Phys. Rev. B. 14 (1976) 4345 J. N. Bradley y P. D. Greene. Trans. Faraday Soc., 63 (1967) 2516 S. Geller. Science, 157 (1967) 310 S. Hull, D. A. Keen, D. S. Sivia y P. Berastegui. J Solid State Chem., 165 (2002) 363-371 S. Hull y P. Berastegui. J. Solid State Chem, 177 (2004) 3156-3173 S. E. Rao y R. C. Bhuniya, J. Mater. Sci. Lett., 3 (1984) 221 Rafiuddin y M. Hassan. Solid State Communications, 144 (2007) 293–295 D. Peña Lara, R. A. Vargas y H. Correa. Solid State Ionics, 175 (2004) 451-453 H. Correa, D. Peña y R. A. Vargas. Rev. Col. Fis., 38 (2006) 481-484 18 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 3 3 CRECIMIENTO DE CRISTALES. EVAPORACIÓN LENTA Desde hace mucho tiempo, el crecimiento de cristales ha sido una de las más fascinantes áreas de investigación. Aunque las bases teóricas para entender el crecimiento de cristales empezó durante el último cuarto del siglo XX con el concepto de equilibrio de fase de Gibbs a través de un tratamiento termodinámico, el hombre practica el crecimiento de cristales y/o los procesos de cristalización desde 1500 a.C. cuando se empezó a cristalizar la sal y el azúcar. Así, el crecimiento de cristales puede ser tratado como una actividad científica ancestral [1]. Muchos científicos ajenos a esta área piensan que el crecimiento de sólidos cristalinos resulta ser un simple juego de cocina, donde combinando muchas sustancias, y sometiéndolas a presión y temperatura, se consigue crecer estructuras cristalinas muy vistosas. Científicos dedicados al crecimiento de cristales piensan todo lo contrario y con un sinnúmero de trabajos publicados en este campo muestran que obtener cristales va más allá de un simple juego de cocina. Además, en la mayoría de los casos obtener cristales de alta calidad es una tarea complicada que requiere técnicas muy sofisticadas y un entendimiento profundo de los procesos que ocurren en la cristalización. A continuación describiremos brevemente diferentes aspectos del crecimiento de cristales tales como la cristalización, la nucleación y los procesos de crecimiento. Finalmente, discutiremos la técnica de crecimiento empleada y los pasos para crecer los cristales en estudio. 3.1 CRISTALIZACION Llamamos cristalización al proceso por el cual los átomos, moléculas o iones son arreglados así mismo en un patrón repetido y en estado sólido. Hay numerosos métodos para obtener cristales y su uso se restringe al tipo de compuesto que queremos cristalizar. La gran mayoría de métodos de cristalización requieren ciertas condiciones para poder obtener los mejores resultados. Se requieren de ciertas zonas en el laboratorio donde la temperatura permanezca relativamente constante, con niveles de vibraciones mínimos, y a oscuras. Además requiere que el experimentalista sea lo más paciente posible ya que el crecimiento de cristales puede requerir desde unos cuantos minutos hasta algunos años! 19 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Teóricamente, la cristalización inicia cuando la concentración de un compuesto en un solvente es mayor que la solubilidad producto del compuesto. Sin embargo, en la mayoría de los casos la cristalización es cinemáticamente obstaculizada y los cristales solamente se formarán en soluciones supersaturadas. Existen varias formas de alcanzar este grado de supersaturación. Lo más sencillo es incrementar la concentración por evaporación del solvente hasta que la cristalización inicie. Esto se logra dejando abierto el recipiente que contiene la solución para que parte del solvente se evapore espontáneamente. Otra forma de obtener solución supersaturada es sacando partido al hecho que los compuestos se disuelven mejor en solventes calientes que en solventes fríos aunque se debe tener cuidado porque a altas temperaturas los cristales tienden a crecer con twinned o con desorden estático. Existen otras formas de superasaturación en donde se usan solventes binarios. Inicialmente, la cristalización es un proceso a dos etapas: la nucleación y el crecimiento de cristales; requiriendo un cambio en la energía libre de Gibbs (Ver figura 3.1). Tanto la nucleación como el crecimiento de cristales dependen del grado de supersaturación, pero usualmente a “ordenes” diferentes [2]. Figura 3.1. Representación esquemática de la cristalización. 20 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 3.2 NUCLEACIÓN La primera etapa del proceso para obtener cristales es la nucleación. Núcleos cristalinos son la primera forma “embrional”, que pueden tener unos cuantos nanómetros de tamaño, los cuales crecerán para producir cristales tangibles. Así, la nucleación es la primera formación de la fase sólida. Esto ocurre debido al agrupamiento de moléculas o iones en una fusión, solución o vapor supersaturado que empezarán a crecer en estado sólido en vez de redisolverse. Dos tipos de nucleación son distinguidos (llamados primarios y secundarios) junto con otros mecanismos que se desprenden de ellos. Para comprender un poco los tipos de nucleación y sobre qué condiciones aplican, usaremos el sistema hielo-agua a modo de ejemplo [2]: 1. Agua cuidadosamente purificada, destilada y filtrada: se enfriará hasta por debajo de -30 ºC antes de formar hielo debido a Nucleación Primaria Homogénea. (Este tipo de agua es conocida como Agua Superenfriada) 2. Agua del grifo: forma hielo alrededor de -6 ºC como consecuencia de Nucleación Primaria Heterogénea. 3. Cristalización continua de hielo en un retenedor Bed Crystallizer operando entre -2 o -3 ºC lo logra a través de Nucleación Secundaria. 3.2.1 Nucleación Primaria La nucleación primaria es aquella en la cual el origen de la fase sólida nueva no se encuentra condicionada ni influida por la presencia de la fase sólida que la origina. En otras palabras, es la nucleación de una fase sólida en una disolución totalmente libre de cualquier clase de partículas de la fase sólida o bien, que contenga sólo partículas extrañas a la fase sólida que se forma [1]. La nucleación primaria ocurre principalmente a altos niveles de supersaturación y prevalece durante los procesos de cristalización y precipitación. Este modo de nucleación puede ser subdividido en homogénea (ocurre espontáneamente en soluciones puras) o heterogénea (en presencia de partículas de “polvo” en suspensión o superficies sólidas) [3]. Nucleación Primaria Homogénea: La nucleación homogénea ocurre en ausencia de una interfase sólida. Se trata de la nucleación que se da en un sistema que no contiene ninguna partícula en absoluto de la fase sólida. Las teorías clásicas de nucleación primaria asumen que 21 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González en una disolución sobresaturada los átomos o moléculas se combinan en una serie de reacciones para producir agregados ordenados o embriones. La energía libre total del embrión es la suma de dos términos: la energía libre debida a la formación de un nuevo volumen y la energía libre debida a la nueva superficie creada. Figura 3.2. Representación esquemática del proceso de nucleación homogénea. Idea extraída de la tesis doctoral de la ref. [4] Nucleación Primaria Heterogénea: La mayor parte de la nucleación primaria en la práctica es heterogénea. Ésta es inducida por superficies diferentes a las del soluto, principalmente por partículas de polvo atmosférico presentes en la disolución o sobre las paredes. La nucleación heterogénea es mucho más sencilla que la homogénea: la formación de la nueva fase exige la presencia de partículas sólidas preexistentes (llamados nucleantes heterogéneos) con capacidad de atraer y retener en su superficie las especies que constituirán el futuro cristal (figura 3.3.), a través de la denominada etapa de crecimiento cristalino. La superficie del nucleante heterogéneo facilita la formación de la nueva fase, por lo que actúa como catalizador de la nucleación y facilita la génesis de los gérmenes de la fase en nucleación. Sin embargo, sí el núcleo heterogéneo es una sustancia cristalina, su formación deberá haberse producido a través de un mecanismo de nucleación homogénea. En este tipo de nucleación, el núcleo presenta una composición diferente al resto del cristal. Al ser más sencilla se puede llevar a cabo con valores más bajos de sobresaturación. Todos los sistemas (especialmente los líquidos) contienen partículas sólidas extrañas (polvo, partículas de las paredes del recipiente, etc) muy difíciles y en muchos casos imposibles de eliminar del sistema. Por esta razón, en condiciones normales, si no se utilizan medidas especiales, los sistemas con sobresaturación menores que las correspondientes al valor crítico para la nucleación homogénea, tenderán a formar partículas de la nueva fase mediante nucleación heterogénea. Cabe resaltar que la nucleación es, en muchos casos, un proceso endotérmico, mientras que el crecimiento de cristales es un proceso exotérmico. Se debe adicionar calor para inducir la nucleación y quitar calor para crecer los cristales. 22 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Figura 3.3. Nucleación heterogénea a través de una partícula nucleante. Idea extraída de la tesis doctoral de la ref. [4]. 3.2.2 Nucleación Secundaria Es la producida debido a cristales de soluto ya existentes en la disolución o deliberadamente añadidos. Es el tipo de nucleación más frecuente en la industria. En nuestro caso, los sistemas en estudio fueron crecidos sin usar métodos que produjeran nucleaciones secundarias adrede, por lo que no entraremos en detalles. 3.3 CRECIMIENTO DE CRISTALES El crecimiento de cristales es un proceso de difusión e integración, modificado por el efecto de las superficies sólidas en la cual estos ocurren (ver figura 3.4). Solutos de iones/moléculas alcanzan las caras de los cristales crecidos por difusión a través de la fase liquida. En la superficie, estos iones/moléculas disueltos deben organizarse en la red espacial a través una capa de absorción [5]. Ni los procesos de difusión o los procesos de interface tendrían lugar a menos que la solución sea supersaturada. La velocidad del crecimiento de cristales puede ser expresado como la velocidad de desplazamiento de una cara del cristal, sin embargo, usualmente tiene diferentes velocidades de crecimiento lineal. Ocurren variaciones en la forma del cristal cuando caras individuales crecen a diferentes velocidades. La velocidad de crecimiento está determinada por la cara que crece más lenta [2]. El crecimiento de cristales en solución involucra dos procesos principales [3]: 1. Transporte de masa de la solución a la superficie del cristal por difusión, convección o una combinación de los dos mecanismos. 23 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 2. La incorporación de material dentro de la red cristalina a través de la superficie del cristal es descrito por procesos de reacción superficial. El segundo paso puede ser subdividido en tres etapas: i) Absorción de la primera unidad de crecimiento en la superficie del cristal. ii) Liberación de parte de su capa de solvatación, después del cual la unidad de crecimiento difunde dentro de la capa de absorción hasta que ésta sea incorporada dentro de la red, o deja la capa de absorción y retorna a la solución. iii) Si la unidad de crecimiento alcanza un punto donde ésta pueda ser formada dentro de la red, perderá su capa de solvatación antes de su incorporación final a la red. Puesto que los procesos cinéticos ocurren consecutivamente, la concentración de la solución se ajusta a sí misma para que la velocidad de los dos procesos sea iguales en estado estacionario. En la mayoría de los casos, más de un mecanismo influye en la velocidad de crecimiento del cristal. Si los diferentes mecanismos toman lugar en paralelo, el mecanismo más veloz controla la velocidad de todo el crecimiento. Si el proceso toma lugar en serie, como en el caso de difusión en el volumen seguido de reacciones superficiales, luego el mecanismo de todo el crecimiento es controlado por el más lento de los procesos. Capa de Absorción Fuerza motriz Para la difusión Cristal Ci Fuerza motriz Para la reacción Pelicula Inactiva Razón de Supersaturación Concentración C C* Volumen de la Solución S= C C* Figura 3.4. Crecimiento en la interfaz cristal-solución. Diagrama extraído de la referencia [3] 24 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González El crecimiento de cristales puede generar monocristales o policristales. Si queremos obtener monocristales, debemos limitar el crecimiento sobre una única unidad “embrional” que controlará el tamaño y la orientación cristalina de la estructura. Con más de un núcleo de crecimiento, el proceso final dará como resultado granos cristalinos agromerados con fronteras que rompen la periodicidad del cristal. La formación de varios núcleos embrionales producirá el crecimiento de policristales. 3.4 TÉCNICAS DE CRECIMIENTO DE CRISTALES Como mencionamos anteriormente, el crecimiento de cristales es un proceso químico homogéneo o heterogéneo que involucra sólidos, líquidos o gases, ya sea de manera individual o en conjunto, para formar una sustancia sólida homogénea con un arreglo atómico tridimensional. Tabla 3.1. Clasificación de los procesos de crecimiento de cristales [1]. T 1. Sólido - Sólido Sólido Dec. T 2. Líquido - Sólido i) Crecimiento en fusión Sólido Devitrificación Strain annealing Cambio de fase polimórfica Precipitación de solución sólida Material fusionado Cristal Bridgman-Stockbarger Kyropoulos Czochralski Zoning Verneuil Dec. T ii) Crecimiento en flujo Sólido(s) + Agente(s) de Flujo Cristal(es) Baja T Cristal(es) Evaporación Enfriamiento lento Solución hirviente iii) Crecimiento en solución Sólido(s) + Solvente iv) Crecimiento hidrotérmico Sólido(s) + Solvente v) Solución + Gel Cristal Reacción Complex decomplex Reducción química Reducción de solubilidad Difusión por contador de flujo Solución Cristal(es) + productos Vapor(es) Solido Sublimación-condensación Sputtering Procesos epitaxiales Implantación - ión Alta T Alta P Cristal(es) Sinterización hidrotérmica Reacción hidrotérmica Gradiente de temperature normal Gradiente de temperature inverso Baja T Crecimiento en Gel 3. Gas - Sólido 25 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Varias técnicas han sido desarrolladas y aplicadas para crecer cristales según sea el proceso químico involucrado. Todos los procesos de crecimiento de cristales pueden ser clasificados de acuerdo al esquema en la tabla 3.1. [1]. La gran variedad de técnicas hace que el crecimiento de cristales deje de ser un simple procedimiento de “cocina” y se convierta en toda un área de la ciencia de materiales. Son muchas las técnicas, pero nos centraremos en los procesos de crecimiento donde se involucran líquidos (solventes) y sólidos (solutos a cristalizar), haciendo especial énfasis en la técnica empleada para crecer los policristales caracterizados en este trabajo: Evaporación lenta. 3.5 CRECIMIENTO POR EVAPORACIÓN LENTA El crecimiento de cristales a través de evaporación lenta del disolvente hace parte de las técnicas de crecimiento en solución a bajas temperaturas (bajas temperaturas significa temperaturas justo por encima del ambiente). El crecimiento en solución resulta ser una de las técnicas más empleada por su simpleza. Esta técnica es especialmente utilizada cuando los materiales a cristalizar son inestables o se descomponen a altas temperaturas. Para crecer los cristales, disolvemos pequeñas partículas del material a cristalizar en un solvente con un considerable nivel de solubilidad. Para que inicie el crecimiento es necesario que el nivel de saturación aumente, y esto se logra a través de la evaporación del solvente. En todo el proceso, la temperatura se mantiene constante y es lo suficientemente elevada para que la evaporación se lleve a cabo. Con solventes no tóxicos como el agua, la evaporación se puede llevar a cabo dentro del laboratorio y expuesto al ambiente, de lo contrario se requiere que el sistema de crecimiento sea aislado del personal para evitar inhalación del solvente. Una de las ventajas del crecimiento por evaporación lenta es que los cristales crecen bajo una temperatura constante, a diferencia de otras técnicas de crecimiento en solución donde se requieren variar la temperatura muy lentamente, pero su principal desventaja es el tiempo que toman los sistemas en cristalizarse pues no se puede tener un control de la velocidad de crecimiento. 3.6 PREPARACIÓN DE LAS ELECTROLITOS SÓLIDOS: CRECIMIENTO DE LOS CRISTALES Son muchos los métodos empleados para obtener cristales de AgI. Por ejemplo, en 1963, Burley et. al. [6] listó 18 procedimientos diferentes para obtener cristales de -AgI (o /-AgI). El crecimiento de los cristales en estudio se realizó usando el método de evaporación lenta, empleando como solvente el ácido yodhídrico (HI) disuelto al 57 % en agua. La elección de un buen solvente garantiza un crecimiento adecuado. No es una novedad el uso de HI como solvente para crecer cristales. Lakatos et. al.[7] uso por primera vez el HI como solvente para 26 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González crecer cristales de AgI, y desde ese preciso momento varios científicos lo han usado para obtener tanto monocristales como policristales de AgI, o AgI dopado con otras sales [6-10]. El HI es un ácido muy fuerte pero muy poco estable, por lo que fácilmente oxida los yoduros (I-) [11]. Esta peculiaridad permite que el AgI en polvo, o cualquier yoduro alcalino tipo MI (M = Li, Na, Rb, Cs), fácilmente se disuelva en Ag+ e I-, o M+ e I-, respectivamente. Una vez el H+ y el exceso de I- empieza a evaporarse, la solución se supersatura y el proceso de nucleación entre los componentes disueltos inicia. Ya que la formación de núcleos embrionales no es controlada, el resultado final del crecimiento da sistemas policristalinos. 3.6.1 Etapas de la preparación Para el crecimiento de cristales por evaporación lenta usamos polvos comerciales de alta pureza de AgI y MI. Una relación molar de 4:1 entre el AgI y MI, respectivamente, ha despertado mucho interés en el pasado, pues para algunos alcalinos como el potasio y el rubidio, la cristalización genera un nuevo compuesto con prestaciones eléctricas mucho mejores que el AgI a temperatura ambiente [12-14]. Por tal razón, las mezclas de AgI y MI (M = Li, Na, Rb y Cs) se realizarán siguiendo esa relación molar. La tabla 3.2 registra la cantidad de polvo que es necesario para que, teóricamente, 3 gr del policristal crezcan conservando tal relación molar. La determinación de las masas se realiza siguiendo una regla de tres simple que relaciona los pesos moleculares de cada molécula con el peso molecular total de la mezcla y la cantidad de masa que se desea obtener. Tabla 3.2. Valores de las cantidades de polvo usados para la preparación de los policristales. Relación molar AgI 1 LiI : 4 AgI 1 NaI : 4 AgI 1 RbI : 4 AgI 1 CsI : 4 AgI Masa del AgI (gr) Masa del MI (gr) 3.0000 2.6264 2.5877 2.4477 2.3498 -0.3750 0.4130 0.5535 0.6504 Pureza del MI 99.9 % (Alfa Aesar) 99.9 % (Aldrich) 97.5 %. (Carlos Erba) 99.9 % (Aldrich) 99.9 % (Aldrich) A continuación, describiremos brevemente las etapas que seguimos para crecer los cristales. 1. Disolvemos polvos de AgI de alta pureza en una solución acuosa al 57 % de HI. Agitamos la solución hasta que las partículas de AgI sean completamente disueltas. La solución debe estar sobresaturada de HI acuoso (figura 3.5.a.). 2. Disolvemos polvos de MI de alta pureza en una solución acuosa al 57 % de HI. Agitamos la solución hasta que las partículas de MI sean completamente disueltas. La solución debe estar sobresaturada de HI acuoso (figura 3.5.b.). 27 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4AgI + MI + HI + 4AgI + HI a. Solución sobresaturada MI + HI b. c. Solución sobresaturada Salida al ambiente Cristales Vapor T = 50 ºC 4AgI + MI + HI Horno e. Solución residual d. Figura 3.5. Diferentes etapas del crecimiento de los cristales: (a) AgI disuelto en HI acuoso. (b) MI disuelto en HI acuoso. (c) Mezcla de las soluciones a y b. (d) Evaporación lenta de los cristales por 2 semanas y a 50 ºC. (e) Crecimiento de cristales y una pequeña cantidad de solución residual. 3. Mezclamos las soluciones del paso 1 y 2 en un recipiente abierto (figura 3.5.c). Para este experimento se usaron beaker de 25 ml. 4. La mezcla final del paso 3 se ubica dentro de un horno a 50 ºC, aislado del laboratorio. 5. Con las cantidades listadas en la tabla 3.2, el crecimiento de cristales tarda 2 semanas (figura 3.5.e.). Las irregularidades de los beakers usados para disolver las soluciones son grandes fuentes de nucleación; los cristales crecen de manera lineal o en pequeños granos cristalinos y en el fondo se acumula una pequeña cantidad de solución residual que no puede evaporarse, pues los cristales crecidos evitan su evaporación. Fotografías de los cristales crecidos son mostrados en la figura 3.6. 28 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 6. Los cristales son retirados de los beakers y secados. Los policristales son pulverizados hasta que queden prácticamente en polvo para la caracterización estructural y térmica, y son troquelados a 0.2 MPa en dirección uniaxial para la caracterización eléctrica. Un pulverizado previo al troquelado es conveniente para reducir efectos de fronteras de granos. a. b. Figura 3.6. Fotografías de los tipos de cristales crecidos: a) Forma laminar para el CsI-AgI. b) Forma de granos pequeños como el NaI-AgI. Referencias [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] G. Dhanaraj, K. Bryrappa, V. Prasad y M. Dudley. Springer Handbook of Crystal Growth. Springer, Berlin Heidbelberg (2010) J. W. Mullin. Crystallization Fourth Edition., Butterworth-Heinemann, Oxford (2001) A. G. Jones. Crystallization Process Systems, Butterworth-Heinemann, Oxford (2002) Bernat Isern Amengual. Estudio sobre los factores cinéticos implicados en la litiasis renal oxalocálcica: nucleación heterogénea e inhibidores de la cristalización. Tesis Doctoral, Universitat de les Illes Balears (2007). M. Volmer. Kinetik der phasenbildung, Steinkoff, Dresden, Germany (1939). G. Burley., The Amercan Mineralogist, 48 (1963) 1266-1276. E. Lakatos y K.H. Lieser, Z. Phys. Chem. N.F., 48 (1966) 228. G. Cochrane y N. H. Fletcher. J. Phys. Chem. Solids, 32 (1971) 2557-2567. B. Vonnegut, H. Chessin y R. E. Passarelli Jr., United States Patent, Patente No. 3.877.642 (1975). J. –S. Lee, S. Adams y J. Maier. J. Phys. Chem. Solids, 61 (2000) 1607 – 1622. R. S. Feigelson. 50 years Progress in Crystal Growth, Elsevier B.V. Amsterdam, The Netherlands (2004) p. 190. R. A. Vargas, M. B. Salamon y C. P. Flynn. Phys. Rev. B., 17 1 (1977) 269-281. S. Hull, D. A. Keen, D. S. Sivia y P. Berastegui. J. Solid State Chem., 165, (2002) 363-371. T. N. Blanton, S. Jagannthan y M. E. Irving. United State Patent, Patente No. 6.383.405 (2002). 29 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 4 4 TÉCNICAS DE CARACTERIZACIÓN Para el análisis de los diferentes sistemas cristalizados se usaron tres técnicas experimentales que permitieron caracterizar estructural, térmica y eléctricamente los policristales. El estudio estructural se realizó a través de Difracción de Rayos X; las anomalías térmicas presentes a temperaturas que van desde el ambiente hasta 190 ºC se realizó a través de la Calorimetría de Barrido Diferencial (DSC, siglas en inglés); y la caracterización eléctrica por medio de Espectroscopia de Impedancia Compleja. 4.1 DIFRACCIÓN DE RAYOS X (XRD) La difracción de rayos X es una técnica versátil, analítica y no destructiva para la identificación y determinación cuantitativa de los diferentes compuestos cristalinos, conocidos como “fases”, presentes en un material. En la difracción de rayos X (XRD), un haz colimado de rayos X se hace incidir sobre una muestra y es difractado por las fases cristalinas presentes en ella. La intensidad de los rayos X difractados es medido como función del ángulo de difracción y la orientación de la muestra. El patrón de difracción obtenido es usado para identificar las fases cristalinas en la muestra, además de otras propiedades estructurales. Una red cristalina es un arreglo regular periódico tridimensional de átomos en el espacio. Este arreglo espacial forma una serie de planos paralelos separados, unos de otros, una distancia d, la cual varía de acuerdo a la naturaleza del material. En cualquier sistema policristalino, los planos pueden estar en diferentes orientaciones, cada uno con su espaciado d determinado. La condición para que un material policristalino genere un patrón de difracción discreto es que la longitud de onda de la radiación, , debe ser comparable, o menor, que el espaciamiento interatómico de la red. En la práctica, esto significa que solamente los rayos X, electrones o neutrones de alta energía pueden ser usados para extraer información estructural de la red cristalina. 30 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4.1.1 Ley de Bragg La ley de Bragg relaciona la distancia interplanar dhkl y el ángulo de Bragg hkl (hkl son los índices de Miller) como sigue: n = 2dhklsenhkl (4.1.1) Esta expresión es una forma conveniente de la relación geométrica para determinar la distribución angular de las intensidades de los picos en el patrón de difracción, donde n es un número entero, es la longitud de onda de la radiación, d es el espaciamiento de la red cristalina y es el ángulo entre el haz incidente y el plano atómico, como se muestra en la figura 4.1. La ecuación de Bragg parte del supuesto que los planos atómicos responsables de los picos de difracción se comportan como un espejo especular, por lo que el ángulo de incidencia es igual al plano de reflexión. La diferencia de caminos entre el haz incidente y el haz reflejado de los planos consecutivos es (x–y). El ángulo entre el haz incidente y el haz trasmitido es igual a 2, y y = xcos2. Sin embargo, cos2 = 1 – 2sen2, mientras que xsen = d. Por tanto, el espaciamiento interplanar será (x-y) = 2dsen. y 2 d x Figura 4.1. Condición para que los haces reflejados de planos sucesivos estén en fase, y así poder superponerse constructivamente. Ley de Bragg La distancia d entre los planos de red es función de los índices de Miller y de los parámetros de red del cristal. Por ejemplo, en el caso de una red cubica donde a = b = c, = = = 90º, la ecuación de Bragg será d hkl = a h k2 l2 2 (4.1.2) En la ecuación 4.1.1, el entero n está referido al orden de la reflexión. Una reflexión hkl de primer orden (n = 1) corresponde a la diferencia de camino de una sola longitud de onda entre el haz incidente y el haz reflejado en el plano (hkl), una reflexión de segundo orden corresponde a la diferencia de camino de dos veces la longitud de onda, y así sucesivamente. 31 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4.1.2 Principio Básico del funcionamiento del XRD Un difractómetro orientado al análisis cristalográfico a partir de muestras policristalinas está construido en torno a un goniómetro con configuración -2, donde la fuente de rayos X y el detector de rayos X se encuentran ensamblados siguiendo una geometría Bragg-Brentano. Todo este ensamble controla el alineamiento del haz, así como la posición y la orientación de la muestra respecto al detector. Un esquema muy elemental de la geometría Bragg-Brentano es mostrado en la figura 4.2. El sistema requiere de radiación monocromática generada por excitación de radiación K de un metal puro (Cu, por ejemplo) y luego filtrando el haz por la imposición de una lámina que absorbe fuertemente la componente de la radiación K (K) sin producir una reducción significativa de la intensidad de la componente (K). Esto puede estar acompañado por un filtro el cual tiene un borde de absorción que cae exactamente entre K y K. Un buen ejemplo es el uso de un filtro de niquel con un borde de absorción a E = 8.33 keV para la radiación de cobre, la cual transmitirá el haz CuK (8.05 keV), pero no el haz CuK (8.90 eV). Variando el ángulo , las condiciones de la ley de Bragg son logradas para los diferentes espaciados d en el material polifásico y un pico de intensidad considerable se alcanzará donde las ondas reflejadas se superpongan constructivamente. El gráfico de la posición angular y las intensidades de los picos difractados resultantes producen un patrón característico de cada fase presente en la muestra (ver figura 4.3). Círculo Focal Fuente Rotación del espécimen Detector 2 Rotación del detector Muestra Figura 4.2. Representación esquemática de una muestra montada sobre un goniómetro, el cual puede ser rotado alrededor de uno o más ejes, y el detector el cual puede viajar a lo largo del círculo focal en la geometría Bragg-Brentano 32 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 2000 20 °C Intensidad 1500 1000 500 0 -AgI NaI -500 10 20 30 2 40 50 60 Figura 4.3. Difractograma de Rayos X para policristales en polvo de NaI-AgI. En la parte inferior del gráfico se representa el espectro indexado de la fase -AgI y NaI. Por comparación directa podemos certificar la existencia de éstas dos fases en el policristal. 4.1.3 Detalles experimentales Las medidas de difracción de rayos X en polvo se realizaron en un Difractómetro MultiPropósito PANalytical modelo X’Pert PRO perteneciente al Centro de Asistencia a la Investigación de la Universidad Complutense de Madrid (ver figura 4.4). Este difractómetro permitió realizar medidas a diferentes isotermas. Todos los sistemas fueron medidos a dos diferentes isotermas (T = 20 y 120 ºC). Sólo los policristales crecidos usando como precursores CsI y AgI se realizaron a 7 diferentes isotermas. El difractómetro está equipado con un detector rápido X’Celerator, una fuente de radiación CuK (K = 1.5406 Å) a 40 mA y 45 kV. Se analizaron las muestras en una región 5º < 2 < 60º, a una velocidad de barrido 2 de 0.02º por segundos. Para identificar las fases presentes en cada policristal se hace uso de los patrones de difracción indexados en la base de datos PDF-2 perteneciente al Centro Internacional para Datos de Difracción (ICDD, siglas en inglés). 33 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Figura 4.4. Difractómetro Multi-Propósito PANalytical modelo X’Pert PRO (Universidad Complutense de Madrid ) 4.2 CALORIMETRÍA DE BARRIDO DIFERENCIAL (DSC) En esencia, la Calorimetría de Barrido Diferencial (DSC) mide la temperatura y el flujo de calor asociado con la transición de un material como función del tiempo y la temperatura, en una atmosfera controlada. Esta medida proporciona información cualitativa y cuantitativa de los cambios físico y químicos que involucran procesos endotérmicos, exotérmicos o cambios en la capacidad calorífica. DSC fue el nombre dado por Perkin-Elmer a los primeros calorímetros de potencia compensada disponibles en el mercado. IUPAC ha usado el término DSC a cualquier aparato capaz de medir la potencia térmica en un barrido de temperatura independientemente del modo en que se realice [1]. En un experimento de DSC, la referencia y la muestra son calentadas por un horno, cuyas temperaturas varían linealmente con el tiempo. La diferencia en temperatura entre la muestra y la referencia es determinada como función de la temperatura del horno. Inicialmente, la diferencia de temperatura es cero. Cuando hay un cambio físico en la muestra, por ejemplo, una transición de fase, el calor intercambiado con en el entorno cambia, y una diferencia en temperatura es observado entre la muestra y la referencia. La versatilidad de la técnica nos permite extraer información de un material: transiciones vítreas, puntos de fusión y ebullición, temperatura y tiempos de cristalización, porcentaje de cristalinidad, calor de fusión y reacciones, calor específico, velocidad y grado de curado, reacciones cinéticas, pureza, entre otras [1]. Un termograma DSC generalizado es mostrado en la figura 4.5, donde se representan las transiciones más comunes, así como su comportamiento. 34 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Flujo de Calor Exotérmico Luis Alfredo Rodríguez González Oxidación Y descomposición Punto de Fusión Transición Vitrea Curado Cristalización Temperatura Figura 4.5. Gráfico esquemático de los diferentes procesos térmicos observados en medidas de DSC 4.2.1 DSC DE FLUJO DE CALOR Usualmente un DSC de flujo de calor (Heat flux DSC) consiste de una celda que contiene dos cápsulas, una con la muestra en estudio y otra con un material de referencia (en ocasiones, la referencia es la misma capsula vacía), separadas por un puente que actúa como un disipador de calor rodeado por un bloque calefactor que se encuentra, internamente, a temperatura constante (ver figura 4.6). El bloque encierra el calentador, los sensores y los soportes. Los soportes son plataformas donde se ubican las cápsulas. El disipador de calor logra una transferencia rápida de calor que permite obtener tiempos razonablemente bajos para alcanzar un estado estacionario. El comportamiento diferencial de la muestra y la referencia es usado para determinar las propiedades térmicas de la muestra. Un sensor de temperatura es ubicado en la base de cada plataforma. Asociado con la celda esta un horno y un sensor del horno. El horno es diseñado para suministrar calor a una razón lineal. Sin embargo, no solamente la razón de calentamiento debe ser lineal, también lo debe ser la razón de enfriamiento. Esto se logra enfriando el bloque que recubre la celda, donde el calor compite contra el bloque frio, o un refrigerante puede ser nebulizado dentro del bloque. Finalmente, algún gas inerte, llamado gas de purga, fluye dentro de la celda [2]. 35 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Sección Transversal de la celda de DSC Anillo de plata LID Cámara de la muestra Capsula Referencia Capsula con la muestra Disco termoeléctrico (constantan) Disco Cromel Entrada gas Cable alumel Juntura termocupla Bloque calefactor Cable cromel Figura 4.6. Sección transversal de una celda de DSC de flujo de calor de un TA Instruments 2920 [2]. La operación de un DSC de flujo de calor se basa en el equivalente térmico de la ley de Ohm. La ley de Ohm dicta que la corriente es igual al voltaje divido por la resistencia; su análogo térmico seria: DT Q = R (4.2.1) donde Q es la velocidad de flujo de calor, DT es la diferencia entre la muestra y la referencia, y R es la resistencia térmica del disco disipador de calor. 4.2.2 ENTALPIA En termodinámica, la relación dU = Q (4.3.1) (donde dU es el cambio de energía interna y Q la cantidad de calor añadido al sistema) indica que la energía interna es usada como una función de estado que caracteriza el sistema a volumen constante y sin que ningún trabajo sea desarrollado hacia, o por, el sistema. La mayoría de los procesos reales se dan a presión constante; para tales procesos, Gibbs introduce una nueva función de estado, entalpia H H U pV (4.3.2) Donde p y V son presión y volumen, respectivamente. Así, la entalpia como función de estado es similar a la energía interna, pero esta tiene una corrección debido al trabajo del volumen. Sin 36 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González embargo, los cambios de volumen con la temperatura para sólidos y líquidos son pequeños; por lo tanto la diferencia entre la entalpia y la energía interna es también muy pequeña. La entalpia es especialmente útil en procesos que se dan a presión constante. Para tales procesos dH = dU pdV (4.3.3) DH = Q (4.3.4) y Así, el incremento de entalpia de un sistema en equilibrio es igual al calor suministrado al sistema. En la práctica, la diferencia de entalpia es generalmente usada, ya que la entalpia absoluta de la muestra no puede ser medida directamente, pero puede ser medida sí la capacidad calorífica en todo el rango de temperaturas (en Kelvin) es conocido. Figura 4.7. Determinación de la entalpia de formación para la transición -AgI, y viceversa, luego de un segundo ciclo de enfriamiento/calentamiento. El cálculo es realizado por el software incorporado al instrumento de medida (TA Instrument 2920) 37 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González En DSC, el incremento de la entalpia en un pico endotérmico o exotérmico puede ser calculado de la siguiente expresión DH = K DSC A mq (4.3.5) donde A es el área bajo la curva del pico a estudiar, m es la masa de la muestra (mg), q es la velocidad de calentamiento (ºC/min) y KDSC es un coeficiente proporcional usualmente llamado la constante del instrumento. El DH obtenido tendría unidades de J/g. Para determinar A, el pico debe ser integrado. La mayoría de los DSC modernos traen incorporados un software que permite calcular este valor. Para la integración, los puntos de inicio y fin del pico debe ser determinados (ver figura 4.7) [2]. 4.2.3 Detalles experimentales Las medidas de DSC se realizaron sobre todos los sistemas en estudio. Adicionalmente, se realizaron medidas sobre polvo de AgI de alta pureza (99.9%) y AgI crecido por el método de preparación empleado en este trabajo. Los diferentes polvos fueron medidos en un TA Instrument 2920, perteneciente al grupo de Transiciones de Fase en Sistemas no Metálicos – UNIVALLE (ver figura 4.8). Figura 4.8. DSC TA Instrument 2920 (TRANSFASE – UNIVALLE) 38 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Alrededor de 5 mg de polvo fue usado para realizar las medidas en cada muestra. Como todos los sistemas contienen yodo en su estructura, fue necesario encapsularlos, sellando completamente la capsula que los contiene, para evitar contaminar la celda. Se usaron capsulas de aluminio y la referencia fue una capsula de aluminio sellada y vacía. Como gas de purga se utilizó N2. Se realizaron dos ciclos continuos de calentamiento/enfriamiento a razón de 10 ºC/min, iniciando a temperatura ambiente. La temperatura más alta que se alcanzó en cada barrido fue de 170 ºC. Para determinar las temperaturas de transición, así como su incremento de entalpia, se utilizó el software que viene incorporado en el equipo de medida. 4.3 ESPECTROSCOPIA DE IMPEDANCIA 4.3.1 Un vistazo a la Espectroscopia de Impedancia La Espectroscopia de Impedancia es un poderoso método usado en la caracterización electroquímica de los materiales. Es capaz de determinar la contribución de todos los componentes que hacen parte de la celda a caracterizar (electrodos, muestra, cables,…). La respuesta eléctrica de un sistema puede ser determinado por varios procesos simples en electroquímica del estado sólido. La propiedad clave de la espectroscopia de impedancia es su capacidad única de distinguir las diferentes etapas en un proceso electroquímico incluyendo información detallada acerca de la superficie y las propiedades del bulk. Para ilustrar, en ocasiones la resistencia en un material conductor de iones es causado no solamente por el volumen (bulk) del material sino por la contribución de las fronteras del grano. Con una corriente directa (dc) medimos solamente la contribución total de la resistencia de la celda, la cual es la suma de todos los procesos de conducción individuales. En contraste con las medidas dc, medidas de la resistencia con corrientes, ó voltajes, alternos (ac) dependientes de la frecuencia, generalmente dan más información detallada de las propiedades eléctricas del sistema. Medidas de Impedancia Electroquímica son desarrolladas aplicando un pequeño potencial eléctrico (ó corriente) sinusoidal a una celda electroquímica, y midiendo la corriente (o potencial eléctrico) respuesta sobre un amplio rango de frecuencias. Procesos resistivos individuales usualmente pueden ser distinguidos variando la frecuencia en varios órdenes de magnitud. La señal “excitadora” de un voltaje sinusoidal como función del tiempo es representada por: E = E0 cost (4.3.1) 39 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González donde E0 es la amplitud del potencial aplicado, la frecuencia radial de la señal potencial ( = 2f) y t el tiempo. De forma compleja, la ecuación 4.3.1 puede ser expresada como: E = E0 cost iE 0 sent = E0 e it (4.3.2) La respuesta para la perturbación aplicada es una señal sinusoidal de la corriente, modificada en fase y amplitud respecto a la señal entrante, y expresada por: I = I 0 cost iI 0 sent = I 0 e i t (4.3.3) donde es el cambio de fase e I0 la amplitud de la señal respuesta. Para evaluar la impedancia de un sistema podemos hacer una analogía a la ley de Ohm. Determinamos la impedancia total del sistema (Z) como: Z= E e it E E = 0i t = 0 e i I I 0e I0 (4.3.4) La impedancia puede ser transformada de la notación compleja a las coordenadas cartesianas ix usando la transformación de Euler, la cual es e = cos x isenx . Así, de forma compleja, la impedancia será representada como: Z= E 0 i e = Z cos i Z sen I0 (4.3.5) La impedancia puede ser separada en una parte real y otra parte imaginaria Z = Z Z (4.3.6) La parte real e imaginaria de la impedancia esta descrita por Z = Re( Z ) = Z cos y Z = Im(Z ) = Z sen , respectivamente. El modulo (representado por Z ) y el ángulo de fase , puede ser derivado con las siguientes ecuaciones: Z = Re 2 Z Im 2 Z 1 2 (4.3.7) = tan 1 ImZ ReZ (4.3.8) 40 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González La resistencia medida puede ser simplificada a la resistencia óhmica (R) en la ecuación de impedancia anterior si el ángulo de fase es igual a 0, donde no hay diferencia de fase entre la corriente y el potencial eléctrico: =0 Z= E0 =R I0 (4.3.9) La corriente retrasa la fase del potencial en /2 en el caso de un capacitor puro con un valor de capacitancia C, y su resistencia estaría dada por: E0 1 = I 0 C y = 2 Z = i 1 C (4.3.10) Dos métodos de representación gráfica son frecuentemente aplicados para la función compleja Z en orden de analizar las medidas de impedancia. El primero de ellos se conoce como el gráfico de Nyquist o gráfico de Argand, donde las partes real e imaginaria son graficadas, cada una, sobre ejes lineales, como se muestra en la figura 4.9. La impedancia puede ser representada como un vector siendo Z su longitud y el ángulo entre este vector y el eje x. Las frecuencias más bajas son representadas en los valores más altos en el eje x del gráfico de Nyquist. Esta representación es ampliamente usada para la interpretación de los materiales conductores iónicos. La segunda forma de representar los datos es llamada diagrama de Bode. Aquí se representan tanto Z y como función de la frecuencia. -Z’’ |Z| Z’ Figura 4.9. Representación gráfica de una espectro de impedancia: Gráfico de Nyquist 41 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4.3.2 Circuito Equivalente en Electrolitos Sólidos Como se discutió anteriormente, podemos evaluar las propiedades de transporte de carga en un electrolito sólido aplicando un pequeño potencial eléctrico alterno con frecuencias variables. Este método requiere de dos electrodos de conducción electrónica que rodean ambas caras del electrolito a estudiar. La celda electroquímica formada por el electrolito y los electrodos posee el aspecto del esquema mostrado en la figura 4.10. Generalmente se asume que la corriente eléctrica dentro de la fase sólida que se encuentra entre los electrodos (electrolito) es debida a especies iónicas, que son bloqueadas en la interface electrolito/electrodo. Consideraciones tanto experimentales como teóricas han mostrado que tal interface entre un electrolito sólido, de conducción puramente iónica, y el electrodo, de conducción puramente electrónica, puede ser fácilmente modelado como un capacitor de placas paralelas [3,4]. El exceso de cargas iónicas en un lado de la interface iónicamente bloqueante es balanceada por el exceso de carga electrónica en el electrodo metálico adyacente. Conductor Electrónico (Electrodos) Electrolito Sólido Interfaces Iónicamente Bloqueante Figura 4.10. Arreglo experimental simple generalmente usado para medidas A.C. de frecuencia variable para evaluar el transporte iónico en un electrolito sólido. A bajas frecuencias, la combinación de los fenómenos de bloqueo en la interfaz junto con el movimiento de iones a través del electrolito puede ser simulado con un capacitor Cint en serie con una resistencia Re (ver figura 4.11), siendo Re la resistencia ofrecida por la microestructura del electrolito al paso de los iones y Cint la capacitancia debido al almacenamiento de carga en la interfaz iónicamente bloqueante [4]. Las propiedades capacitivas de ambas interfaces están combinadas en una única capacitancia Cint. 42 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Re Cint Figura 4.11. Circuito equivalente simple del comportamiento de una celda electroquímica a bajas frecuencias, con un conductor iónico entre dos electrodos iónicamente bloqueantes pero electrónicamente conductor. La impedancia para el arreglo circuital de la figura 4.11 es: Z 1 = Re 1 1 = Re i iC int C int (4.3.11) A altas frecuencias, sin embargo, la configuración experimental mostrada en la figura 4.11 empieza a exhibir los efectos de una capacitancia geométrica adicional debido a la presencia de un material (electrolito) con una constante dieléctrica finita entre los dos electrodos metálicos paralelos. Esta capacitancia de capas plano paralelas, Cgeom, actúa a través de toda la celda, y típicamente tiene valores muy pequeños. Adicionando está nueva capacitancia, el circuito equivalente se convierte en el mostrado en la figura 4.12; comúnmente llamado Circuito Equivalente de Debye. Cgeom Re Cint Figura 4.12. Circuito equivalente de Debye correspondiente a la configuración física de un electrolito sólido entre dos electrodos electrónicamente conductores pero iónicamente bloqueantes. Calculando la impedancia total del circuito equivalente de Debye, tenemos que ZD = Z1 = 1 iC geomZ 1 Re i 1 C int 1 1 iC geom Re i C int Re i = 1 C geom C int 1 C int iC geom Re (4.3.12) Típicamente, los valores de Cint y Cgeom son bastante diferentes (Cint 10-6 F/cm2 y Cgeom 10-12 F/cm2), por tanto podemos considerar despreciable la razón entre estas capacitancias (es decir, Cgeom/Cint 0). Así pues, la ecuación 4.3.12 la podemos reescribir como: 43 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 1 C int ZD 1 iC geom Re Re i (4.3.13) A frecuencias muy bajas, 0 Z D Re i 1 Cint (4.3.14) la ecuación 4.3.13 simula un arreglo en serie entre Re y Cint (es similar a la ecuación 4.3.11). A frecuencias muy altas, ZD Re 1 iC geom Re (4.3.15) el valor de ZD será similar a la impedancia para un arreglo entre Re y Cgeom, en paralelo. Cgeom Re Re Cint -Z’’ 0 Re Z’ Figura 4.13. Esquema del gráfico en el plano complejo para el arreglo experimental mostrado en la figura 4.10 que corresponde al circuito equivalente de Debye mostrado en la figura 4.12 a bajas frecuencias, la celda simula un arreglo paralelo entre Re y Cgeom. A altas frecuencias, la celda simula un arreglo en serie entre R e y Cint Un gráfico Cole-Cole (-Z’’ vs Z’) para el circuito equivalente de Debye es mostrado en la figura 4.13, donde la ecuación 4.3.14 representa una línea vertical que corta al eje real en Re mientras que la ecuación 4.3.15 representa un semicírculo centrado en el eje real, que lo corta en cero y en Re. Si la temperatura es variada, los tiempos de relajación para cada elemento capacitivo (int = ReCint y geom = ReCgeom) cambian, y la porción observable en el gráfico Cole-Cole cambia, así 44 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González para el caso de electrolitos sólidos conductores de iones activados térmicamente, el aumento en la temperatura hace más visible los efectos capacitivos de la interfaz y los efectos capacitivos debido a procesos dieléctricos se hacen menos visibles. En la figura 4.13 vemos como el uso de electrodos iónicamente bloqueantes y perfectamente acoplados a la superficie del electrolito genera una línea completamente vertical a las frecuencias más bajas, que corta el eje real de la impedancia en Re. Si el acople entre la superficie del electrolito y el electrodo en la interfaz no es perfecto, como ocurre en la mayoría de los casos, el valor de Cint se reduce, y su valor es tan comparable como Cgeom. Esta disminución en Cint produce alteraciones en el gráfico de la figura 4.13, pues a frecuencias intermedias existirá una competición entre ambos procesos capacitivos (ver figura 4.14). -Z’’ Cint disminuye Re Z’ Figura 4.14. Cambio típico en el espectro de impedancia sí los valores de los dos capacitores (Cint y Cgeom) no son lo suficientemente diferentes el uno del otro. Por otro lado, experimentalmente es común que la tendencia lineal a las bajas frecuencias no sea completamente vertical. Por lo general, esta tendencia lineal esta inclinada un determinado ángulo respecto al eje real, como se ilustra en la figura 4.15. Este fenómeno que genera una desviación al circuito ideal de Debye está relacionado con procesos de difusión que ocurren en la interfaz electrolito/electrodo. Debido a esto, no podemos considerar la interfaz como un capacitor ideal Cint, por lo que su respuesta eléctrica debe ser reemplazada por un elemento de circuito que posee una impedancia de la forma ZW = W i (4.3.16) 45 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Zw es conocido como la impedancia de Warburg y es utilizada para simular los procesos de difusión que ocurren en la interfaz electrolito/electrodo (W es conocido como la constante de Warburg). La expresión 4.3.16 conocida como Impedancia Warburg de longitud infinita (ó simplemente impedancia Warburg) fue introducida, en electroquímica, en 1899. Zw es obtenida de la solución de la segunda Ley de Fick (la ecuación de difusión) para la difusión unidimensional de una partícula en un espacio semi-infinito [5]. A las bajas frecuencias, la impedancia de Warburg sigue un comportamiento lineal formando un ángulo de 45º con respecto al eje real. -Z’’ Re Z’ Figura 4.15.Espectro de impedancia complejo mostrando una línea recta inclinada 45º respecto al eje real en las bajas frecuencias. Este tipo de comportamiento es bien descrito por una impedancia de Warburg. Ahora, considerar un capacitor ideal Cgeom es asumir que tanto la superficie de la muestra como la de los electrodos que lo rodean son homogéneas. Irregularidades en la superficie del electrodo, causada por superficies rugosas y no uniformemente distribuidas, generan una dispersión en los parámetros [6]. Esta dispersión produce una depresión en el semicírculo generado a frecuencias intermedias y altas. Este comportamiento es común en los sistemas reales y se acentúan más en sistemas con comportamientos no lineales. Por tanto, resulta conveniente reemplazar el capacitor ideal Cgeom por un Elemento de Fase Constante (CPE) [7,8]. La impedancia de un elemento CPE es expresada como: Z CPE = 1 Q(i ) n (4.3.17) donde Q sería el valor de capacitancia “ideal” y n una constante empírica que tiene valores entre 0 y 1. Un CPE actúa como un capacitor ideal cuando n es igual a 1, y como una resistencia ideal cuando n es igual a 0 [9]. De esta manera, el parámetro n es una medida del grado de depresión del semicírculo. Será un semicírculo perfecto si n = 1, y aumentará la depresión conforme n sea menor que 1. 46 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Finalmente llegamos al circuito equivalente mostrado en la figura 4.16.b. Esta configuración circuital simula bastante bien los procesos eléctricos en electrolitos sólidos reales, donde procesos de difusión entre la interfaz electrolito/electrodo y acoples de superficies heterogéneas son posibles. La figura 4.16.a muestra el gráfico de impedancia para éste circuito equivalente. -Z’’ Re Z’ CPE W Re Figura 4.16. Arriba, Espectro de impedancia compleja generalizado para un electrolito sólido conductor iónico medido usando electrodos de longitud semi-infinito (línea continua), comparado con el espectro de impedancia compleja del circuito equivalente de Debye (línea punteada) Abajo, Circuito equivalente que mejor simula el gráfico de impedancia de un sistema real, donde se reemplazan los capacitores por un elemento de fase constante (CPE) y una impedancia de Warburg (W). 4.3.3 Detalles experimentales Las medidas de impedancia fueron realizadas usando un analizador de impedancia HP4192 perteneciente al Centro de Investigación en Nanociencia y Nanotecnologia (CIN2) de la Universidad Autónoma de Barcelona. Para poder efectuar las medidas fue necesario pulverizar los policristales mediante macerado manual por más de 30 min y luego prensarlos uniaxialmente a 200 KPa, formando pastillas cilíndricas de 0.3 mm de espesor y 1.3 mm de radio. Se usó pintura de plata como electrodo, formando así una celda electroquímica Ag|muestra|Ag. Como estímulo a los electrolitos, se aplicó un voltaje sinusoidal de 300 mV de amplitud, variando su frecuencia desde 5Hz a 2 MHz. 47 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Cada barrido de impedancia se realizó a una determinada isoterma. Un ciclo completo de temperatura se llevó cabo, con pasos de temperatura que oscilaban entre 5 y 10 ºC. El ciclo consta de un barrido de calentamiento que va desde temperatura ambiente hasta 180 – 190 ºC, seguido de un barrido de enfriamiento hasta alcanzar nuevamente la temperatura ambiente. Las velocidades de calentamiento (enfriamiento) entre cada isoterma fueron de 3 ºC/min aprox. Las medidas de impedancia se realizaron bajo una atmósfera inerte (N2). Figura4.17. Estación usada para realizar las medidas de impedancia (CIN2-UAB) Figura 4.18. Sonda de medida La figura 4.17 muestra la estación de medidas de impedancia. La estación consta básicamente de tres módulos (módulo de control de temperatura, módulo de medidas de impedancia AC y módulo de control de gases y sendado de termopares). Todos los módulos se encuentran perfectamente acoplados, lo que permite automatizar completamente las diferentes etapas de la medida. El módulo de temperatura está compuesto por un horno tubular donde se incorpora la 48 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González muestra a través de sonda (ver figura 4.18); el módulo de medidas de impedancia AC está compuesto por el analizador de impedancia y finalmente el módulo de control de gases y sensado de temperatura controla el tipo de gas inerte que se desea usar (N2, He, O2, Ar) y las termocuplas que sensa la temperatura alrededor de la muestra. La sonda de medida está fabricada sobre un soporte de alúmina, mientras que los contactos son hilos de plata que conectan los electrodos con el analizador de impedancia. Las medidas de impedancia se realizan a dos puntas que se conectan a los 4 terminales del analizador. Referencias [1] [2] [3] [4] [5] [6] [7] [8] [9] A. R. H. Goodwin, K. N. Marsh y W. A. Wakeham. Measurement of the Thermodynamic Properties of Single Phases, Experimental Thermodynamics Volumen 6, Elsevier, Amsterdam (2003) pag 349. J. D. Menczel y R. Bruce Prime. Thermal Analysis of Polymers. Fundamentals and Applications, John Wiley & Sons, New Jersey (2009) pag 21 I. D. Raistrick, C. Ho y R. A. Huggins. J. Electrochem. Soc., 123 (1976) 1469 R. A. Huggins. Ionics, 8 (2002) 300-313. E. Barsoukov y J. R. Macdonald. Impedance Spectroscopy Theory, Experiment, and Applications, Segunda Edición, John Wiley & SonNew Jersey (2005) pag 84 W. Scheider. J. Phys. Chem.,79 (1975) 127-136 J. F. McCann y S. P. S. Badwall. J. Electrochem. Soc., 129 (1982) 551-559 J. Bates, J. C. Wang y Y. T. Chu. Solid State Ionics, 18-19 (1986) 1045-1049 A. Jonscher. Nature, 267 (1977) 673-679 49 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 5 5 RESULTADOS 5.1 ESTUDIO DE LA CONFIGURACIÓN ESTRUCTURAL: DIFRACCIÓN DE RAYOS X El crecimiento de policristales de AgI a través del método de evaporación lenta (con HI como solvente) es una técnica que en el pasado ha sido usada por nuestro grupo y por otros investigadores para obtener policristales de AgI, o para dopar a éste con yoduros alcalinos [1-5]. Medidas calorimétricas y de impedancia compleja con señales alternas han permitido determinar intuitivamente la configuración estructural de los policristales resultantes luego de la evaporación del HI. Se intuye que al dopar el AgI con LiI y NaI a través de éste método se obtiene un policristal bifásico donde las fase MI (M = Li ó Na) y AgI están completamente separadas. Para el caso del dopaje con RbI, por el contrario, se genera un nuevo compuesto policristalino: RbAg4I5 [6-8], aunque se ha reportado que es posible obtener RbAg2I3 en una solución acuosa saturada de RbI y AgI [9]. Casi todas las técnicas de crecimiento han mostrado que al final del proceso de cristalización una pequeña cantidad de AgI queda combinada con el policristal resultante. Con la intención de determinar la configuración estructural de los electrolitos cristalizados, se realizan medidas de difracción de rayos X a temperatura ambiente (20 ºC) y a 120 ºC, rango de temperatura en las cuales el AgI no sufre ninguna transición. Para determinar el tipo de policristal resultante, se realiza una comparación directa entre los picos representativos del difractograma y picos indexados en la base de datos ICDD PDF-2 correspondientes a las fases presentes más probables. Empleando el mismo método de crecimiento se obtuvieron policristales de AgI a partir de polvos de AgI de alta pureza (99.9%) Debido al carácter polimórfico del AgI a temperaturas por debajo de 420 K, era indispensable determinar el tipo de estructura que tomaría el AgI policristalino usando esta técnica de cristalización. Los difractogramas de rayos X para polvos de AgI, luego de ser crecido, se muestra en la figura 5.1. Vemos que el espectro en ambas isotermas prácticamente no varía. Para realizar una inspección directa del tipo de estructura presente en el polvo, se han situado los picos representativos indexados para las fases y del AgI. Se puede observar que los picos representativos de ambos espectros indexados encuentran una total correspondencia en los difractogramas. Picos con intensidades por debajo del 10 % 50 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González con relación al pico más intenso son difíciles de observar debido a que el “background” de la medida los apantalla. La comparación directa muestra que la fase -AgI está presente. Puesto que los picos indexados de la fase -AgI son muy próximos, o coinciden exactamente, con algunos picos indexados de la fase -AgI, analizamos las intensidades de los picos para (200) (311) (103) (110) (220) (102) (101) Intensidad (u.a.) (100) (002) (111) determinar si hay presencia, o no, de la fase -AgI. 120 °C 20 °C 0 -AgI -AgI 10 20 30 40 50 60 angulo [2] (grados) Figura 5.1. Difractogramas de rayos X para polvos de policristales de AgI luego de ser crecidos por evaporación lenta (HI como solvente) a 20 y 120 ºC. En la parte inferior de los difractogramas se encuentran los picos indexados de las fases y del AgI Tabla 5.1. Comparación de los porcentajes de intensidad relativa entre los picos del difractograma a 20 ºC y los picos indexados del -AgI y -AgI . Pos. Pico (2) 22.5 23.8 25.4 32.8 39.3 42.8 46.5 Intensidad Relativa (%) AgI Crecido -AgI -AgI 22 100 20 6 44 16 26 60 100 40 18 85 30 50 100 60 30 En la tabla 5.1 se registran las intensidades relativas “estimadas” de los picos más representativos del difractograma, a 20 ºC, y del patrón indexado de ambas fases. Vemos como las intensidades relativas de los picos del difractograma son muy inferiores a las intensidades 51 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González relativas del -AgI, además los tres picos más intensos en el difractograma (2 = 23.8, 39.3 y 46.5º) poseen ángulos de Bragg para planos cristalinos en -AgI y -AgI, simultáneamente. Por lo tanto, podemos afirmar que el crecimiento por evaporación lenta (HI como solvente) condujo a la formación de un sistema politipo /-AgI. Ahora analizaremos la composición estructural de los complejos policristalinos compuestos por MI y AgI (M = Li, Na, Rb y Cs), empezando por el sistema con contenido de Li. La figura 5.2 muestra los difractogramas a 20 ºC y 120 ºC para policristales crecidos usando como precursores el LiI y AgI, con relación 1:4, respectivamente. En la parte baja de los difractogramas se encuentran los picos indexados del -AgI y LiI. Se observa como existe una buena concordancia entre los picos representativos del difractograma y los picos indexados del -AgI. Para este caso, no hemos considerado los picos indexados del -AgI, y hasta no realizar un análisis más detallado de los espectros (por ejemplo, análisis por método Rietveld), consideramos posible la presencia de ésta fase basándonos en los resultados obtenidos en el estudio de los difractogramas del AgI. Puesto que el crecimiento de cristales se realizó bajo la relación 1(LiI):4(AgI), se puede esperar dos posibles resultados: 1) que se forme un nuevo compuesto conformado por Li, Ag e I, acompañado de pequeñas cantidades de LiI y AgI ó, 2) que se forme un policristal bifásico donde se encuentran las fases AgI y LiI, con un alto contenido de AgI. Una revisión bibliográfica y la inexistencia de patrones de difracción indexados para compuestos conformados de Li, Ag e I permiten descartar la primera posibilidad. Así pues, compararemos los difractogramas con patrones indexados para la fase -AgI y LiI. A excepción del pico en 2 = 36.3º, los picos representativos del difractograma tienen una gran correspondencia con los picos indexados del -AgI (ver figura 5.2). Dos espectros indexados del LiI son usados para determinar la existencia de ésta fase. Uno de los espectros fue determinado por Davey (lo llamaremos LiID), en 1923, y publicado en un trabajo sobre medidas de precisión para haluros alcalinos en los que se incluían el NaI, RbI, CsI, entre otros [10]. 15 años más tarde, Hanawalt et. al. lo cálculo nuevamente obteniendo los mismo parámetros de red calculados por Davey, pero con un espectro de difracción muy diferente [11]. Este último espectro (lo llamaremos LiIH) se convirtió en patrón, desestimando el calculado por Davey. Tanto el LiIH como el LiID poseen picos representativos que no encuentran correspondencia con los picos de los difractogramas. Para el caso de LiIH, el pico a 2 = 29.8 no aparece en el difractograma, mientras que el LiID posee un pico importante a 2 = 35.7º que no se asocia con ningún pico de los difractogramas. Pero, si desplazamos el espectro del LiID un valor D(2) = 0.7, encontramos una completa correspondencia entre los difractogramas y las fases indexadas -AgI – LiI. Por un lado, el pico que no aparece en el espectro indexado del AgI encuentra 52 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González correspondencia con la fase LiI. Además, cuatro picos (2 = 22.4º, 25.6, 43.1 y 59.0) son muy próximos a picos del AgI. La superposición de estos ángulos de Bragg justifica el aumento de las intensidades relativas para estos picos representativos en los difractogramas con respecto a la fase AgI. Estos dos resultados nos permiten concluir que la cristalización del LiI y AgI por evaporación lenta (HI como solvente) produce un policristal bifásico LiI-AgI; y por otra parte desestima el indexado de LiIH. Intensidad (u.a.) 120 °C 20 °C 0 -AgI LiI D(2) = 0.7º (Davey) LiI (Hanawalt) 10 20 30 40 50 60 angulo [2] (grados) Figura 5.2. Difractogramas de rayos X para polvos de policristales de LiI-AgI luego de ser crecidos por evaporación lenta (HI como solvente) a 20 y 120 ºC. En la parte inferior de los difractogramas se encuentran los picos indexados de las fases -AgI y del LiI indexados por Davey y Hanawalt. Las líneas rojas punteadas representan las posiciones de los picos del LiI al ser desplazados un valor de 2 = 0.7 La figura 5.3 muestra los difractogramas a 20 ºC y 120 ºC para policristales crecidos usando como precursores el NaI y AgI. En la parte baja de los difractogramas se grafican picos indexados del -AgI y NaI. Una inspección directa permite determinar que el policristal es una sal bifásica donde coexisten el AgI (en sus dos posibles estructuras cristalográficas - y -AgI) y NaI. La correspondencia de los picos representativos de los difractogramas con los picos indexados es total, además los difractogramas muestra picos estrechos lo que supone un alto grado de cristalinidad en los policristales. 53 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González ** ** Intensidad (u.a.) * ** 120 °C * * 20 °C 0 -AgI NaI 10 20 30 40 50 60 angulo [2] (grados) Figura 5.3. Difractogramas de rayos X para polvos de policristales de NaI-AgI luego de ser crecidos por evaporación lenta (HI como solvente) a 20 y 120 ºC. En la parte inferior de los difractogramas se encuentran los picos indexados de las fases -AgI y del NaI. Los picos marcados con un asterisco (*) corresponden a ángulos de Bragg para planos de difracción de la fase NaI, mientras que los picos marcados con dos asteriscos (**) corresponde a ángulos de Bragg para planos de difracción correspondiente a ambas fases. La figura 5.4 muestra los dos difractogramas para el policristal con contenido de Rb. Trabajos anteriores predicen que, por diferentes métodos, es posible obtener el compuesto RbAg4I5 cuando se combinan RbI y AgI. Por tal motivo, en la parte baja se ha puesto los picos indexados del RbAg4I5, junto con el AgI y RbI. El difractograma a 20 ºC muestra una total correspondencia con los picos indexados del RbAg4I5 y -AgI. Puesto que no existe una correspondencia clara entre picos del difractograma y picos indexados del RbI, se puede pensar que gran parte del policristal está compuesto de RbAg4I5 y un pequeño contenido de /-AgI. A 120 ºC, la cantidad de AgI presente en el sistema se reduce y se combina con residuos de RbI para formar más RbAg4I5. Esta suposición se basa en el hecho que algunos picos representativos del -AgI tiende a desaparecer, o sus intensidades se reducen si es el caso de picos de planos cristalinos del AgI y RbAg4I5 que poseen el mismo ángulo de Bragg. Los picos que varían con el cambio de temperatura son señalados con flechas en la figura 5.4. El análisis directo de los espectro muestra que la evaporación lenta (HI como solvente) cristaliza polvos de AgI y RbI en el compuesto RbAg4I5, con pequeñas cantidades de /-AgI. 54 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Intensidad (u.a.) Luis Alfredo Rodríguez González 120 °C 20 °C 0 -AgI RbI RbAg4I5 10 20 30 40 50 60 angulo [2] (grados) Figura 5.4. Difractogramas de rayos X para polvos de policristales de RbI-AgI luego de ser crecidos por evaporación lenta (HI como solvente) a 20 y 120 ºC. En la parte inferior de los difractogramas se encuentran los picos indexados de las fases -AgI, RbI y RbAg4I5. A diferencia de los dos sistemas anteriores, el difractograma confirma la aparición de un nuevo compuesto Por último, en la figura 5.5 se muestra los espectros de difracción para el cristal con contenido de Cs. Bradley et. al. [12] mostró que los sistemas binarios AgI-CsI tienden a cristalizar en Cs2AgI3 ó CsAg2I3. Partiendo de este hecho, los difractogramas son comparados con 4 posibles fases: -AgI, CsI, Cs2AgI3 y CsAg2I3. Una comparación directa nos muestra que todos los picos representativos del difractogramas pueden ser asociados a picos indexados de la fase -AgI y CsAg2I3. Es difícil determinar si hay o no presencia de algunas fases de CsI y Cs 2AgI3; pero si las hay, serían consideras impurezas del complejo cristalino por su cantidad tan efímera. Las intensidades de los picos nos permiten afirman que el policristal está compuesto por una gran cantidad de fases CsAg2I3 y una concentración considerable de /-AgI, que tiende a disminuir a medida que aumentamos la temperatura. A 120 ºC se ve como el espectro concuerda mejor con los picos e intensidades del indexado de CsAg2I3, excepto por un pico en particular situado a 2 = 35º, que resulta tener una intensidad relativa muy elevada. Esto puede estar relacionado con el hecho que, al momento de montar los polvos en el soporte del difractometro, algunos planos cristalográficos se haya orientado debido a presiones aplicadas sobre el polvo para fijarlos en el soporte. Los resultados obtenidos luego de analizar los difractogramas se encuentran resumidos en la tabla 5.2. El crecimiento de cristales a través del método de evaporación lenta (HI como solvente) genera dos configuraciones estructurales: la mezcla de MI y AgI cristaliza como un sistema bifásico donde las mezclas no reaccionan químicamente (para el caso de M = Na, Li) o 55 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González gran parte reacciona químicamente formando un nuevo compuesto (para el caso de M = Rb, Cs) acompañado de pequeñas cantidades de AgI en sus fases y . Como mencionamos anteriormente, consideramos posible la existencia de la fase -AgI. Más adelante, las medidas de impedancia justificarán la presencia de ésta fase y mostrarán su gran influencia en los procesos de conducción. Intensidad (u.a.) * * 20 °C * * * * -AgI CsI Cs2AgI3 CsAg2I3 Intensidad (u.a.) 10 20 30 40 50 angulo [2] (grados) 60 * 120 °C * * * * * -AgI CsI Cs2AgI3 CsAg2I3 10 20 30 40 angulo [2] (grados) 50 60 Figura 5.5. Difractogramas de rayos X para polvos de policristales de RbI-AgI luego de ser crecidos por evaporación lenta (HI como solvente) a 20 y 120 ºC. En la parte inferior de los difractogramas se encuentran los picos indexados de las fases-AgI, CsI, Cs2AgI3 y CsAg2I3. Los asteriscos (*) señalan picos representativos que varían su intensidad relativa. 56 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Tabla 5.2. Resumen de los sistemas cristalizado a través del método de evaporación lenta (HI como solvente). PRECURSORES AgI LiI NaI RbI CsI POLICRISTALES CRISTALIZADOS Fases politipo: Sistema bifásico: Sistema bifásico: Compuesto ternario: Compuesto ternario: / – AgI LiI – /-AgI NaI – /-AgI RbAg4I5 – /-AgI* CsAg2I3 – /-AgI 57 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 5.2 ANÁLISIS TÉRMICO: CALORIMETRÍA DE BARRIDO DIFERENCIAL En este capítulo estudiaremos los policristales obtenidos a través de medidas calorimétricas, específicamente con medidas de Calorimetría de Barrido Diferencial (DSC). Las medidas de DSC permitirán determinar transiciones de fase de primer orden o anomalías térmicas presentes. Los policristales fueron pulverizados manualmente antes de realizar las medidas. Los barridos térmicos se efectuaron bajo una atmósfera de N2, a una velocidad de 10 ºC/min y siguiendo un ciclo doble de calentamiento-enfriamiento (30 ºC 170 ºC 30 ºC 170 ºC 30 ºC). La figura 5.6.a. muestra curvas DSC de calentamiento en los 4 sistemas en estudio. Se han adicionado medidas de DSC para polvos de AgI puro (AgI de alta pureza al 99.9%) y para AgI cristalizado por el método de evaporación lenta (HI como solvente). El primer barrido de calentamiento muestra que alrededor de 149 ºC, todos los sistemas exhiben un pico endotérmico asociado a la transición de fase / del AgI. En la tabla 5.3 se encuentran listados valores más precisos de temperatura a la cual ocurre ésta transición. La temperatura de transición reportada en la tabla 5.3 corresponde a la temperatura en la cual la transición inicia (temperatura onset), y no a la temperatura de máximo flujo de calor. Puesto que el tamaño del pico asociado a la transición del AgI apantalla algunas anomalías térmicas, un zoom de la primera curva de calentamiento a temperaturas por debajo de la transición del AgI es mostrado en la figura 5.6.b. Los termogramas de DSC para el primer barrido de calentamiento permiten determinar que las propiedades térmicas del AgI prácticamente no cambian luego de ser cristalizado y los valores de entalpia de formación son muy parecidos en ambos casos (ver tabla 5.3). El valor de entalpia de formación en el AgI crecido es de aproximadamente 25.6 J/g = 6.02 kJ/mol; este valor es muy similar al encontrado por Mellander et. al. (DH = 6.06 kJ/mol) para la transición / del AgI a presión atmosférica [13]. Todos los termogramas muestran una ligera pendiente positiva (en los barridos de calentamiento) o negativa (en los barridos de enfriamiento) en la línea base causada por la velocidad del barrido, las diferencias de masa entre la muestra y la referencia o el modo diferencial en que se calientan la referencia y la muestra [14]. Es posible observar anomalías térmicas alrededor de 130 ºC, en el CsAg2I3-AgI, 45 ºC y 90 ºC, en el LiIAgI (ver figura 5.6.b). El primer barrido de enfriamiento muestra nuevamente picos, en este caso exotérmicos, de la transición del AgI, desplazados a temperaturas menores. Luego de la transición, solo se observa una pequeña anomalía cercana a 110 ºC en el sistema CsAg2I3-AgI. Un segundo ciclo de calentamiento-enfriamiento fue llevado a cabo en todas las muestras observando solamente la transición del AgI y la anomalía en el CsAg2I3-AgI. En la tabla 5.4 se 58 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González reportan las temperaturas de transición y la entalpia de formación para el segundo ciclo de a) Flujo de Calor / masa (u.a.) calentamiento-enfriamiento. AgI comercial AgI cristalizado LiI - AgI NaI - AgI RbAg4I5 - AgI CsAg2I3 - AgI 40 60 80 100 120 140 160 b) Flujo de Calor / masa (u.a.) Temperatura (ºC) AgI comercial AgI cristalizado LiI - AgI NaI - AgI RbAg4I5 - AgI CsAg2I3 - AgI 40 60 80 100 120 140 Temperatura (ºC) Figura 5.6. a) Curvas DSC de los policristales pulverizados y polvos de AgI comercial, en un barrido de calentamiento a 10 ºC/min. b) Zoom de las curvas a temperaturas por debajo de la transición del / AgI. Las anomalías térmicas en el LiI-AgI podrían estar asociadas a uno, o ambos, procesos: salida de agua ó a una pretransición del AgI. El carácter hidrófilo de los yoduros alcalinos permite que los sistemas recojan una pequeña cantidad de agua cuando son expuestos a la atmosfera, y según sea su capacidad de capturar agua o la humedad relativa del ambiente, algunos sistemas pueden recoger más agua que otros. Por otra parte, las medidas de difracción 59 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González de rayos X han mostrado que el AgI cristaliza como una mezcla polimórfica, en todos los sistemas. Según sea la concentración de cada fase en el sistema total, es posible que antes de superar la transición -AgI, su fase metastable -AgI transforme a la fase zincblende -AgI [1,15]. Algunos trabajos han mostrado que esta transición intermedia ocurre por encima de 120 ºC, pero se ha reportado que en nanohilos de AgI dopados con óxidos de aluminio anódicos puede ocurrir cercano a los 100 ºC [16] Las anomalías térmicas en el LiI-AgI ocurren por debajo de 100 ºC, por lo que una transición del AgI no es posible. Por tanto, anomalías a 45 ºC y 90 ºC son producidas por la salida de agua. Para apoyar aún más esta teoría, barridos subsecuentes bajo una atmosfera de N2 fueron realizados y no presentaron estas anomalías. Los picos del CsAg2I3-AgI a 130 ºC (en un barrido de calentamiento) y 110 ºC (en un barrido de enfriamiento) son debido a transiciones dentro de la estructura del CsAg2I3. Bradley y Green [17] atribuyen estos picos a la transición (o en el barrido de enfriamiento) del CsAg2I3. Estudios más recientes han observado la transición del CsAg2I3 [18,19] pero no la discuten en detalle. Los valores de entalpia para la transición / del AgI muestran una gran estabilidad, puesto que su valor prácticamente no cambia luego de someter al AgI a transformarse en 4 oportunidades: dos en barridos de calentamiento y dos en barridos de enfriamiento. Sistemas donde el proceso de crecimiento usado cristaliza un nuevo compuesto pueden llegar a mostrar valores 10 veces menor que el alcanzado por el LiI-AgI y NaI-AgI. Esto nos indica que la cantidad de AgI que acompaña al RbAg4I5 y CsAg2I3 es mucho más baja. Por tanto, En los sistemas LiI-AgI y NaI-AgI, el AgI representa un electrolito dopado donde sus propiedades físicas son modificadas por la presencia de otras fases. Caso contrario ocurre en los sistemas RbAg4I5-AgI y CsAg2I3-AgI, donde el contenido de AgI es tan bajo que su presencia en el electrolito podría ser catalogada como impureza. Debido a que las dos transiciones en el CsAg2I3-AgI son muy próximas, es difícil determinar la entalpia de formación para cada transición de forma individual. Por tal motivo, los valores de entalpia reportados en la tabla 5.3 y 5.4 para éste sistema corresponden a la suma de las entalpias. De esta manera podemos valorar la buena estabilidad que poseen las transiciones juntas. 60 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Flujo de Calor / masa (u.a.) Luis Alfredo Rodríguez González AgI comercial AgI cristalizado Li - AgI Na - AgI RbAg4I5 - AgI CsAg2I3 - AgI a 40 60 80 100 120 140 160 Flujo de Calor / masa (u.a.) Temperatura (ºC) AgI RbAg4I5 + AgI CsAg I 2 3 CsAg2I3 + AgI b 80 AgI 100 120 140 Temperatura (ºC) Figura 5.7. a) Curvas DSC de los policristales pulverizados y polvos de AgI comercial, en un barrido de enfriamiento a 10 ºC/min. b) Zoom de las curvas DSC para el RbAg 4I5-AgI y CsAg2I3-AgI alrededor de la transición del AgI y CsAg2I3 61 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Tabla 5.3. Valores de temperatura de transición y entalpia de formación para un primer ciclo de medida. Policristal AgI comercial AgI crecido LiI - AgI NaI - AgI RbIAg4I5 - AgI CsAg2I3 - AgI Temperatura de Transición (ºC) Subiendo Bajando 148.24 148.99 150.20 148.75 149.31 146.10 138.32 138.62 143.14 136.84 125.94 138.20 Entalpia (J/g) Subiendo Bajando 26.35 25.60 23.10 17.86 2.172 10.33 26.84 25.58 23.33 20.55 2.276 10.90 Tabla 5.4. Valores de temperatura de transición y entalpia de formación para un segundo ciclo de medida. Policristal AgI comercial AgI crecido LiI - AgI NaI - AgI RbIAg4I5 - AgI CsAg2I3 - AgI Temperatura de Transición (ºC) Subiendo Bajando 148.55 148.92 151.29 149.11 148.58 147.60 137.93 139.59 144.93 137.33 124.70 138.40 Entalpia (J/g) Subiendo Bajando 26.32 25.08 23.47 20.91 2.896 11.10 26.89 25.69 23.52 20.56 2.633 10.85 62 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 5.3 CARACTERIZACIÓN ELÉCTRICA A continuación, presentaremos y discutiremos el comportamiento eléctrico de los 4 sistemas en estudio a través de medidas de impedancia compleja. En todos los sistemas se realizaron medidas de impedancia compleja a diferentes isotermas y siempre por encima de la temperatura ambiente. El barrido en temperatura se realizó en dos direcciones: aumentado y disminuyendo la temperatura. Los sistemas son llevados desde la temperatura ambiente, pasando por la transición de la fase / del AgI, hasta valores de temperatura cercanos a 190 ºC; en este punto iniciamos el descenso de la temperatura hasta llevarlos nuevamente a temperatura ambiente. Todas las medidas de impedancia se realizaron bajo una atmósfera de N2. 5.3.1 Representación Cole-Cole. Curvas de Conductividad LiI – AgI Medidas de difracción de rayos X nos ha permitido determinar que los sistemas AgI y LiI cristalizan en un policristal bifásico. El resultado de la cristalización hace que el LiI entre a ser una fase dopante del AgI, formando fronteras de granos y agregando más defectos para que el Ag+ se mueva en la estructura. a) b) 3000 500000 80 400000 40 20 0 1500 560 580 600 620 640 660 Z'() 1000 35 ºC 500 0 0 500 1000 -Z'' () -Z'' () 2000 1500 Z' () 2000 2500 121 ºC 1000 60 3000 -Z'' () -Z'' () 2500 1200 128 ºC 300000 800 600 400 200 0 1800 2100 200000 2700 3000 Z' () 36 ºC 100000 0 2400 0 150000 300000 Z' () 450000 Figura 5.8. Curvas de impedancia -Z’’ vs Z’ para el sistema LiI-AgI. En ambos gráficas, puntos azules representan el espectro de impedancia para la más baja temperatura y el inset de puntos rojos representa el espectro de impedancia de la isoterma más cercana, y por debajo, de la transición del AgI para a) barridos de calentamiento y b) barridos de enfriamiento. Espectros de impedancia compleja (o representación Cole-Cole) para el sistema LiI-AgI son mostrados en la figura 5.8. Los espectros muestran el comportamiento típico de un conductor iónico. En las altas frecuencias se forma un segmento de curva perteneciente a un semicírculo, posiblemente achatado, asociado a la conducción del Ag+ en el volumen del electrolito y una “aparente” dependencia lineal entre Z’ y -Z’’, a las más bajas frecuencias, asociada a 63 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González mecanismos de difusión del ión Ag en los electrodos de plata. Este comportamiento es similar en todas las temperaturas donde la fase /-AgI está presente. Si comparamos dos espectros de impedancia a isotermas cercanas, pero uno de ellos tomado en el barrido de calentamiento y el otro tomado del barrido de enfriamiento luego de someter el sistema a la transición / del AgI, vemos como los valores de Z’ y -Z’’ han cambiado en casi dos órdenes de magnitud (ver figura 5.8), lo que supone un aumento de la resistencia iónica en el volumen del electrolito luego de someter el sistema a la transición del AgI. Es posible extraer más información de medidas de impedancia sí calculamos los valores de la parte real de la conductividad tal que '= Z' (Z ' ) (Z ' ' ) 2 2 l , A (5.3.1) y los representamos como función de la frecuencia y/o la temperatura. En la ecuación 5.3.1, l y A representan la longitud y el área transversal del electrolito, respectivamente. Las figuras 5.9.a y 5.9.c muestran una representación tridimensional de la conductividad como función de la frecuencia y el inverso de la temperatura (en realidad, 1000/T), y la típica curva de conductividad vs frecuencia, en escala logarítmica, para isotermas donde la fase /-AgI está presente. La representación tridimensional resultaría ser un tipo de gráfico Arrhenius 3D mientras que los gráficos bidimensionales representarían las proyecciones de estas curvas en el plano conductividad,frecuencia. A temperaturas por debajo de la transición de fase /, la conductividad incrementa linealmente con el inverso de la temperatura, siguiendo un comportamiento tipo Arrhenius. La transición del AgI produce un incremento súbito de la conductividad en casi dos órdenes de magnitud y se mantiene prácticamente constante con la temperatura. A temperaturas por debajo de la transición del AgI, la conductividad es prácticamente constante con la frecuencia del voltaje aplicado y se da en el volumen del electrolito sólido. A medida que nos acercamos a temperatura ambiente, el inicio de procesos de relajación es percibido a las altas frecuencias. Las curvas de conductividad a temperaturas por encima de la transición / del AgI ya no es lineal y constante. A medida que aumentamos la frecuencia, vemos como la conductividad incrementa, tiende a estabilizarse a frecuencias intermedias y luego sufre una fuerte caída. Esta “aparente” disminución de la conductividad está asociada a procesos inductivos generados en los cables que conectan la celda con el equipo de medida. Este comportamiento se repite en todos los espectros de los sistemas en estudio cuando la conductividad alcanza valores por encima de 10-4 -1cm-1. Valores de conductividad que sobrepasan ese límite, perciben los 64 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González efectos provocados por los electrones que llevan la información de la celda al equipo a través de los cables de plata. En el barrido de calentamiento vemos una pequeña anomalía en el comportamiento lineal de la conductividad alrededor de 100 ºC (ver figura 5.9.b). Esta anomalía, observada en los termogramas de DSC, está asociada a la salida de agua del electrolito. a) 10 b) -1 -4 4x10 -2 -4 3x10 -3 10 Conductividad (-1cm-1) -1 -1 ) Conductividad ( cm 10 -4 10 -5 10 -6 10 0 10 1 10 Fr 102 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 3,0 8 10 100 3,2 3,4 2,6 ( 0/T 2,4 -1 K 2,2 -4 2x10 100 ºC 90 ºC -4 10 2,0 0 1 10 2 10 3 10 4 10 5 10 6 10 10 Frecuencia (Hz) ) c)10 d) -1 -2 10 Conductividad (-1cm-1) -1 -1 ) Conductividad ( cm -4 10 -3 10 -4 10 -5 10 -6 10 0 10 1 10 Fr 102 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 3,0 8 10 3,2 3,4 100 2,6 ( 0/T 2,4 -1 K ) 2,2 -5 10 -6 10 2,0 0 10 1 10 2 10 3 10 4 10 5 10 6 7 10 10 Frecuencia (Hz) Figura 5.9.Curvas de conductividad para el LiI-AgI. (a) y (b) corresponden a medidas con un barrido de calentamiento, mientras que (c) y (d) corresponde a medidas con un barrido de enfriamiento. Las isotermas de color azul y rojo representan el límite de temperatura en la cual la fase - y/o -AgI está presente. NaI – AgI Similar al sistema anterior, el método de crecimiento usado permite que el NaI y AgI cristalicen de modo que las fases estén completamente separadas, formando una mezcla policristalina NaI – AgI. Los espectros de impedancia para este policristal muestran mecanismos de conducción tanto en el volumen del electrolito como en la interfaz electrodo-muestra (ver figura 5.10). A temperaturas mayores se observa como los efectos de la interfaz son más notorios. Si los 65 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González electrodos actuaran como barreras que bloquean el paso de los portadores de carga, se esperaría que la impedancia mostrara una tendencia lineal entre Z’ y -Z’’. Más adelante veremos como efectos de difusión en los electrodos alteran tal comportamiento. Comparando isotermas cercanas a 90 ºC (ver figura 5.10), vemos como la resistencia en el volumen del electrolito se ve ligeramente reducida luego de someter la fase AgI a la transición. Las curvas de conductividad nos permiten visualizar tres tipos de regímenes: los espectros inician con un leve crecimiento del valor de la conductividad como función de la temperatura, fenómeno asociado a procesos de “bloqueo” en la interfaz; luego se estabilizan un poco y parecen variar muy levemente con la frecuencia, esto debido a la conductividad del ión a largo alcance (conductividad dc), finalmente incrementa nuevamente el valor de conductividad de forma lineal. Este incremento “aparente” de la conducción es debido al movimiento de corto alcance de los iones (conductividad ac). A medida que aumentamos la temperatura, los efectos de los electrodos son favorecidos, mientras que la conducción ac se desfavorece. Las curvas 3D de la conductividad muestran un comportamiento no-Arrhenius cuando se barre calentando la muestra, y parece portarse de forma Arrhenius cuando se barre enfriando. Las curvas de conductividad muestran un salto de la conductividad luego de la transición / del AgI. Cuando se inicia el barrido de enfriamiento a 180 ºC, problemas de contactos aparecen. Esto genera espectros ruidosos, pero luego de superar la transición, la celda mejora el contacto con los electrodos y observamos nuevamente espectros bien definidos. Similar al LiI-AgI, si previamente sometemos la fase AgI a la transición /, la conductividad del policristal NaIAgI se ve desfavorecida a temperaturas por debajo de la transición. a) b) 50000 2000 -Z''() 500 0 500 1000 1500 2000 2500 Z' () 20000 26 ºC -Z''() -Z''() 40000 137 ºC 1000 40000 30000 0 20000 40000 Z' () 60000 80000 2000 1000 0 1000 2000 3000 4000 5000 Z'() 20000 10000 91 ºC 0 133 ºC 3000 1500 60000 4000 -Z''() 80000 0 93 ºC 0 10000 20000 30000 Z'() 40000 50000 Figura 5.10. Curvas de impedancia -Z’’ vs Z’ para el sistema NaI-AgI. En ambos gráficas, los puntos azules representan el espectro de impedancia a temperaturas próximas a 90 ºC, y el inset de puntos rojos representa el espectro de impedancia de la isoterma más cercana, y por debajo, de la transición del AgI para a) barridos de calentamiento y b) barridos de enfriamiento. 66 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González a)10 b) -1 -2 -3 10 -3 10 Conductividad (-1cm-1) -1 -1 ) Conductividad ( cm 10 -4 10 -5 10 -6 10 0 10 Fr -5 1 10 -4 10 2 10 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 3 2,8 3,0 8 10 3,2 3,4 2,4 2,6 -1 (K 0/T 100 2,2 10 2,0 0 10 1 10 2 10 ) 3 10 4 10 5 10 5 10 10 6 10 7 6 10 Frecuencia (Hz) c)10 d) -1 -2 -3 10 Conductividad (-1cm-1) -1 -1 ) Conductividad ( cm 10 -4 10 -5 10 -6 10 0 10 Fr 1 10 2 10 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 3,0 8 10 3,2 3,4 100 2,6 ( 0/T 2,4 -1 K 2,2 -4 10 -5 10 2,0 ) 0 10 1 10 2 10 3 10 4 10 10 7 Frecuencia (Hz) Figura 5.11. Curvas de conductividad para el LiI-AgI. (a) y (b) corresponden a medidas con un barrido de calentamiento, mientras que (c) y (d) corresponde a medidas con un barrido de enfriamiento. Las isotermas de color azul y rojo representan el límite de temperatura en la cual la fase /-AgI está presente. RbAg4I5 – AgI A diferencia de los dos sistemas anteriores, el RbI y AgI cristalizan en un nuevo compuesto: RbAg4I5. Este sistema ha despertado mucho interés en el pasado por sus propiedades eléctricas, ya que su conductividad iónica supera, y por mucho, a la conductividad del AgI puro en su fase conductora normal [6, 20-22]. El método de preparación usado en este trabajo no es la excepción, y permite que la mezcla de RbI y AgI favorezca el crecimiento de éste compuesto. La difracción de rayos X revela una gran concentración de RbAg4I5, combinado con una pequeña cantidad de AgI, al finalizar el crecimiento. 67 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González a) b) Efecto inductancias 4000 10 250 0 -10 10 300 0 10 20 30 Z'() 40 -Z''() -Z''() 6000 -Z'' () 350 134 ºC 20 -Z''() 30 8000 Efecto inductancias 200 125 ºC 0 -10 150 0 10 20 Z'() 100 35 ºC 2000 50 40 ºC 0 0 28 ºC 0 2000 4000 Z'() 6000 8000 0 50 100 150 200 250 300 350 400 Z'() Figura 5.12. Curvas de impedancia -Z’’ vs Z’ para el sistema RbAg4I5-4AgI. En ambas gráficas, los puntos azules representan el espectro de impedancia para la más baja temperatura y el inset de puntos rojos representa el espectro de impedancia de la isoterma más cercana, y por debajo, de la transición / del AgI para a) barridos de calentamiento y b) barridos de enfriamiento. Espectros de impedancia para éste policristal son mostrados en la Figura 5.12. La alta conductividad del Ag+ en la matriz del RbAg4I5 hace que los efectos inductivos de los cables sean apreciables a las más altas frecuencias. El efecto de las inductancias parásitas hacen que el semicírculo no vaya a cero sino que corte el eje Z’ en un valor positivo, de unos cuantos ohmios, y alcance valores negativos en el eje –Z’’. A frecuencias intermedias aparece un semicírculo, que a diferencia de los dos sistemas anteriores, se define muy poco, ya que los procesos de difusión en los electrodos son más predominantes. A medida que incrementamos la temperatura, las propiedades eléctricas del electrolito mejoran tanto que, a temperaturas justo por debajo de la transición /, los efectos de la conductividad del Ag+ a través de éste compite con el ruido producido por el campo magnético debido al flujo de electrones que van de los electrodos de la celda al analizador de impedancia (ver insets de la figura 5.12). Una comparación entre las curvas de impedancia a 35 y 40 ºC (la primera tomada iniciando el barrido de calentamiento y la segunda tomada en un barrido de enfriamiento luego de superar la transición de la fase AgI) muestran que la resistencia disminuye en un orden de magnitud. Parece ser que, a diferencia de los sistemas bifásicos LiI-AgI y NaI-AgI, el RbAg4I5 mejora sus propiedades eléctricas si previamente es sometido a un calentamiento por encima de la temperatura de transición / del AgI. Curvas de conductividad para el RbAg4I5-AgI son representadas en la figura 5.13. Tanto la difracción de rayos X como los termogramas de DSC evidencian un pequeño contenido de la fase AgI en el electrolito policristalino. Ambos barridos de temperatura muestran un pequeño salto en la conducción del Ag+ al pasar la temperatura de transición del AgI, siendo un poco más notorio en las curvas de calentamiento. Se puede percibir un ligero cambio en el 68 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González comportamiento de la conductividad de la figura 5.13.b entre las isotermas de 91 y 97 ºC. Esta ligera variación es provocada por la inductancia parásita, que se hace más predominante por encima de 91 ºC. El primer espectro de impedancia (T = 28 ºC) rompe la tendencia lineal creciente entre la conductividad y la temperatura. Agua superficial recogida por la pastilla justo antes de iniciar la medida es la causante de este aumento anormal en la conductividad. a)10 b) 0 -1 10 -1 10 -2 -1 -1 ) Conductividad ( cm 10 -3 Conductividad (-1cm-1) 10 -4 10 -5 10 -6 10 0 10 Fr 1 10 2 10 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 ( 0/T 3,0 8 10 100 3,2 3,4 2,4 2,6 -1 K 2,2 -2 10 97 ºC -3 10 91 ºC -4 10 2,0 0 10 1 10 2 10 ) 3 10 4 10 5 10 6 10 7 10 Frecuencia (Hz) c)10 d) 0 -1 10 -2 -1 10 -1 -1 ) Conductividad ( cm 10 -3 Conductividad (-1cm-1) 10 -4 10 -5 10 -6 10 8 10 Fr 7 10 6 10 5 ec 10 4 ue nc 10 103 ia 2 10 (H 1 z) 10 2,8 3,0 0 10 3,2 3,4 2,6 0/ 100 T( 2,4 -1 K ) 2,2 2,0 -2 10 -3 10 0 10 1 10 2 10 3 10 4 10 5 10 6 7 10 10 Frecuencia (Hz) Figura 5.13. Curvas de conductividad para el RbAg 4I5-AgI. (a) y (b) corresponden a medidas con un barrido de calentamiento, mientras que (c) y (d) corresponden a medidas con un barrido de enfriamiento. Las isotermas de color azul y rojo representan el límite de temperatura en la cual la fase /-AgI está presente. CsAg2I3 – AgI Finalizamos esta primera parte del análisis eléctrico con el sistema CsAg2I3-AgI. El método de crecimiento condujo a la formación de un nuevo compuesto, CsAg2I3, con pequeñas cantidades de AgI. El producto final del proceso de cristalización no es ninguna novedad ya que en trabajos anteriores el CsAg2I3-AgI ha sido el producto final [18,19,23,24]. Aunque esta no es la única 69 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González posibilidad pues otros métodos de crecimiento favorecen la formación de Cs 2AgI3 [19,24]. Los espectros de impedancia para este sistema siguen el comportamiento estándar de los demás sistemas, aunque la difusión de Ag+ en los electrodos parece generar otro semicírculo que se define más con el aumento de la temperatura, pero justo antes de la transición superiónica. a) b) 30000 4000 15000 2000 1000 15000 0 110 ºC 0 1000 10000 2000 Z' () 3000 4000 -Z'' () -Z'' () 20000 3000 -Z'' () 3000 25000 -Z'' () 20000 4000 2000 98 ºC 1000 10000 0 0 2000 Z' () 4000 5000 64 ºC 63 ºC 5000 35 ºC 0 0 0 5000 10000 15000 Z' () 20000 25000 30000 0 5000 10000 15000 20000 Z' () Figura 5.14. Curvas de impedancia -Z’’ vs Z’ para el sistema CsAg2I3-4AgI. En ambas gráficas, los puntos azules representan el espectro de impedancia para la más baja temperatura y el inset de puntos rojos representa el espectro de impedancia de la isoterma más cercana, y por debajo, a la transición / del AgI para a) barridos aumentando la temperatura y b) barridos disminuyendo la temperatura. Las curvas de conductividad mostradas en la figura 5.15 no difieren mucho de los otros sistemas, en su forma, además de estar térmicamente activado. No obstante, es de resaltar el salto súbito de conductividad alrededor de 125 ºC, en el barrido de calentamiento. Las curvas de DSC predicen una transición de fase en la estructura del CsAg2I3 a temperaturas cercanas. Si la comparamos con la transición / del AgI, ésta transición no requiere tanta energía para transformarse, pues invierte menos del 10 % de lo que invierte el AgI, pero el salto en la conductividad es tan comparable como la de éste. En un barrido de calentamiento, el salto en la conductividad es de aprox. 2 órdenes de magnitud. Entre 125 ºC y 145 ºC aprox., la conductividad parece aumentar linealmente, hasta que la transición del AgI se da y la conducción parece ser constante con la temperatura. En un barrido de enfriamiento, la conductividad se mantiene prácticamente constante con la temperatura hasta que decae, en 2 órdenes de magnitud aprox., y continúa con un decrecimiento lineal tipo Arrhenius. Aunque la temperatura de transición del CsAg2I3-AgI cambia con el tipo de barrido en temperatura al que se someta (T 125 ºC ó T 110 ºC), el valor de la conductividad parece no variar mucho en su fase conductora normal, es decir, a una misma temperatura se alcanza la misma conductividad no importa si el sistema viene aumentando en temperatura o si viene 70 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González disminuyéndola, luego de haber sido sometido a la transición superiónica. Este fenómeno no es fácilmente percibido en las curvas de conductividad de la figura 5.15, pero sí que lo notaremos, más adelante, en los gráficos Arrhenius de la conductividad dc. Para finalizar el análisis de estas curvas, alrededor de 180 ºC observamos un pequeño salto en la conductividad. Este salto se asocia a una transición de fase en el punto eutéctico en el diagrama de fase CsI-AgI [25]. a)10 b) 0 -1 10 -4 10 -2 -1 -1 ) Conductividad ( cm 10 -3 Conductividad (-1cm-1) 10 -4 10 -5 10 -6 10 0 10 Fr 1 10 2 10 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 3,0 8 10 100 3,2 3,4 2,4 2,6 ( 0/T -1 K 2,2 -5 10 2,0 -6 10 0 10 1 2 10 3 10 4 10 ) 5 10 6 10 10 7 8 10 10 6 10 Frecuencia (Hz) c)10 d) 0 -1 10 -2 -1 -1 ) Conductividad ( cm 10 -3 Conductividad (-1cm-1) 10 -4 10 -5 10 -6 10 0 10 Fr 1 10 2 10 3 ec 10 4 ue nc 10 105 ia 6 10 (H 7 z) 10 2,8 3,0 8 10 3,2 3,4 2,6 0/ 100 T( 2,4 -1 K 2,2 -4 10 2,0 ) -5 10 0 10 1 10 2 10 3 10 4 10 5 10 7 10 Frecuencia (Hz) Figura 5.15. Curvas de conductividad para el CsAg2I3-AgI. (a) y (b) corresponden a medidas con un barrido de calentamiento, mientras que (c) y (d) corresponden a medidas con un barrido de enfriamiento. Las isotermas de color azul y rojo representan el límite de temperatura en la cual la fase /-AgI está presente. 5.3.2 Conductividad dc. Energía de Activación Aunque son variados los procesos eléctricos presentes en un electrolito sólido (relajación dieléctrica, conducción, reacciones químicas o difusión en la interfaz electrodo-electrolito), mecanismos de conducción a largo alcanza –comúnmente llamado conductividad dc (DC) – son los procesos más importantes en nuestros sistemas para aplicaciones tecnológicas. 71 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González La conductividad dc ha sido estimada en todos los sistemas en estudio, y en cada isoterma donde un barrido de impedancia ha sido realizado. Para estimar la DC, se promedió un valor de conductividad en las regiones planas de las curvas de conductividad (valga la redundancia!) a frecuencias intermedias. La barra de error de DC recoge los valores de conductividad alcanzados en esta región. En algunos casos, donde los efectos parásitos de las inductancias predominan, el valor DC estimado corresponde al valor de conductividad para la más baja frecuencia, y el error cubre todos los valores de conductividad justo antes que la inductancia controle la curva (ver figura 5.16). Caso I log(’) DDC DC DDC Caso II DC log(f) Figura 5.16. Determinación de la conductividad dc. Caso I, los efectos inductivos son predominantes. Caso II, los efectos inductivos son despreciables. Dos gráficos tipo Arrhenius son mostrados en la figura 5.17, representando los valores de conductividad dc de todos los sistemas, en barridos de calentamiento y enfriamiento. Se ha adicionado la curva de conductividad del -AgI reportada por Urarov et. al. [26] para compararla con los demás sistemas. El sistema RbAg4I5-AgI exhibe la mayor conductividad a temperaturas por debajo de la transición / del AgI. Sólo a temperaturas cercanas al ambiente, el LiI-AgI parece igualarlo. Como se observó en las curvas de conductividad, los sistemas LiI-AgI y NaI-LiI disminuyen su conductividad cuando la fase AgI es sometida a la transición. En un primer barrido de calentamiento, el LiI-AgI posee una conductividad superior que la del NaI-AgI y CsI-AgI. Luego de someter los sistemas a la transición del AgI, la conductividad del NaI-AgI y LiI-AgI son muy parecidos, y superan ligeramente la conductividad del policristal de -AgI referencia. Aunque, el sistema CsAg2I3-AgI les supera en conductividad a ambos. En el estado superiónico, ninguno de los sistemas alcanza mejores prestaciones que el AgI puro. El rango de valores de DC para todos los sistemas permite 72 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González catalogarlos como Conductores de iones rápidos, según la clasificación esquematizada en la figura 1.1 del capítulo Conductividad Iónica. a) b) Temperatura(ºC) 1 200 160 80 Temperatura(ºC) 40 1 Aumentando T 0 -1 -2 -3 -4 -5 -6 -7 2,0 LiI-AgI NaI-AgI RbAg4I5-AgI AgI referente 2,8 1000/T (K -1 160 3,2 120 80 40 Disminuyendo T -1 -2 -3 -4 -5 -6 CsAg2I3-AgI 2,4 200 0 log (DC) [S/cm] log (DC) [S/cm] 120 -7 2,0 LiI-AgI NaI-AgI RbAg4I5-AgI CsAg2I3-AgI AgI referente ) 2,4 2,8 1000/T (K -1 3,2 ) Figura 5.17. Gráficos de log(DC) vs 1000/T para los sistemas en estudio en a) un barrido de calentamiento y b) enfriamiento. Los datos representados en círculos grises corresponden a policristales de -AgI tomados de la referencia [26] Ya que los procesos de conducción iónica a largas distancias están activados térmicamente, podemos hacer uso de la ecuación Arrhenius (ecuación 1.3.13) para calcular su energía de activación: = A exp Ea / kT T 1000k d log( ) Ea = log(e) d 1000 T Ea 1000 log(T ) = log(e) log( A) 1000k T (5.3.2) Así, la pendiente de la regresión lineal en gráficos log(DCT) vs 1000/T está relacionada con la energía de activación. La manera formal indica que la energía de activación es un parámetro lineal para la dependencia log(DCT) vs 1000/T. Sin embargo, muchos autores determinan, a través de regresiones lineales, la energía de activación en gráficos log(DC) vs 1000/T, siendo una aproximación valida. Sólo para ser formales!, representamos la dependencia (T) como log(DCT) vs 1000/T, para todos los sistemas, en los gráficos de la figura 5.18 y, a partir de éstas, calculamos las energías de activación. Estos gráficos de la figura 5.18 nos permite ver dos particularidades destacadas: el carácter no-Arrhenius del NaI-AgI en el barrido de calentamiento y el comportamiento histerético de DC en el CsAg2I3 – AgI. 73 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González a) b) Temperatura(ºC) Temperatura(ºC) 160 120 80 40 200 2 2 1 1 Aumentando T 0 -1 -2 -3 log (DCT) [KS/cm] log (DCT) [KS/cm] 200 2,4 120 80 40 0 -1 -2 -3 Disminuyendo T -4 2,0 160 2,8 1000/T (K -4 2,0 3,2 -1 2,4 ) 2,8 1000/T (K 3,2 -1 c) ) d) Temperatura(ºC) Temperatura(ºC) 160 120 80 40 3 2 2 1 1 log (T) [KS/cm] log (T) [KS/cm] 3 200 0 -1 -2 -3 -4 -5 -6 2,0 200 160 120 80 40 0 -1 -2 -3 -4 -5 2,4 2,8 1000/T (K -1 3,2 -6 2,0 ) 2,4 2,8 1000/T (K -1 3,2 ) Figura 5.18. Gráfico Arrhenius para a) LiI-AgI, b) NaI-AgI, c) RbAg4I5-AgI y d) CsAg2I3-AgI. Los representados con triángulos rojos ( ) son determinados de un barrido de calentamiento, mientras que los representados por triángulos azules ( ) son determinados de un barrido de enfriamiento. Tabla 5.5. 1. Valores de Energía de Activación Policristal AgI ref [27] LiI - AgI NaI - AgI RbIAg4I5 - AgI CsAg2I3 - AgI T < 110 C CsAg2I3 - AgI T > 120 C Energía de Activación (eV) Subiendo Bajando 0.35-0.38 0.155(5) 0.05 1.3 0.66(1) 0.465(4) 0.24(2) 0.56-0.58 0.61(1) 0.84(2) 0.311(4) 0.49(2) 0.233(1) En un trabajo pasado [28], mostramos que el sistema [1-x](NaI-4AgI) – x(Al2O3), para x = 0.1, 0.2 y 0.3, presenta un comportamiento no-Arrhenius, de tipo exponencial, en DC similar al que 74 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González presenta el NaI-AgI. Este comportamiento dispersivo de la conductividad mostró que seguía la siguiente ecuación: 1000 T k1 C log( ) = exp k2 (5.3.3) Siendo k1, k2 y C parámetros de ajuste, donde k1, k2 tienen unidades de inverso de temperatura [K-1]. El significado físico de estos tres parámetros todavía está en discusión, pero nos resultan muy útiles para determinar la energía de activación, tal que Ea = Ea(T). Si consideramos la dependencia no formal de DC con la temperatura (es decir, log(DC) vs 1000/T), la energía de activación en la expresión de Arrhenius estará asociada a la derivada entre la conductividad y la temperatura, tal que: 1000k 1 1000k d log( ) 1000 k T Ea = = exp k2 log(e) d 1000 T log(e) k2 (5.3.4) En la figura 5.19 mostramos el ajuste obtenido sobre la conductividad del NaI-AgI, en un barrido de calentamiento, y usando la representación no formal. La energía de activación dependiente de la temperatura muestra una variación importante en un rango de 100 ºC, aumentando a medida que nos acercamos a la transición. Los cambios que sufre la energía de activación con la temperatura hace que el NaI-AgI alcance los valores más bajos a temperatura ambiente y que sean los más altos a temperaturas cercanas a la transición. Los valores de energía de activación, por debajo de la transición del AgI, son reportados en la tabla 5.5. En el caso del AgI, los valores de Ea son extraídos de la literatura para policristales en bulk que, al calentarse, presenta una configuración politipo /-AgI y, al enfriarse luego de haber superado la transición / AgI, solo presenta la fase -AgI [27]. Para el NaI-AgI, se reporta el rango de valores que puede tomar Ea cuando la muestra es calentada. En todos los sistemas, el valor de Ea para temperaturas por debajo de la transición depende de sí el sistema es sometido previamente a la transición, o no; con excepción del sistema CsAg2I3-AgI. El carácter histerético mostrado en las curvas de DC(1000/T) reflejan una casi invariancia en los valores de Ea. 75 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Temperatura(ºC) -1 200 160 120 80 40 k1 = 2.582 (4) K k2 = 0.308 (6) K -2 log (DC) [S/cm] -1 -1 C = -5.05 (1) -3 Aumentando T -4 -5 2,0 2,4 2,8 1000/T (K -1 3,2 ) Figura 5.19. Ajuste del comportamiento no Arrhenius en el sistema NaI-AgI, usando la ecuación 5.3.3, a temperaturas por debajo de la transición 5.3.3 Mecanismos de conducción en sistemas binarios MI-AgI (M = Li, Na) Aunque resultan ser más las diferencias que las similitudes, tanto el LiI-AgI como el NaI-AgI tiene un comportamiento común: la conductividad iónica por debajo de la temperatura de transición presentan una menor conducción sí previamente el sistema es sometido a dicha transición. En este tipo de sistemas, el portador de carga (Ag+) se puede trasladar a través de la estructura del AgI o por los defectos en la frontera de los granos generados entre las dos fases. Energéticamente, al Ag+ le resulta más difícil moverse través de la estructura cristalina del MI, pues la cantidad de defectos Frenkel es muy inferior a la del AgI, ya que tanto el anión I- como el catión M+ permanecen prácticamente inmóviles en la estructura. Pero, ¿qué papel juega esta fase MI sí no permite conducción sobre su estructura?. La presencia de una fase extraña en la matriz de AgI policristalina incrementa la concentración de defectos en la estructura, permitiendo al Ag+ no solo moverse por posiciones intersticiales de la subred aniónica I- sino también a través de las fronteras de grano AgI|MI. Al Ag+ le resulta igualmente favorable moverse por ambos caminos, pues los gráficos de impedancia no distinguen la conducción de cada mecanismo. Si un camino resultara ser más favorable que otro, los espectros de impedancia mostrarían dos semicírculos, uno asociado a conducción a través de la estructura cristalina del AgI y otro a la conducción superficial a través de las fronteras de grano. La inclusión de NaI y LiI a la estructura del AgI favorece la conducción de Ag+, sobretodo la del LiI, pues permite incrementar la conductividad en más de un orden de magnitud. 76 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González El análisis en los difractogramas determinó que la fase AgI cristaliza como un sistema polimórfico, donde las fase -AgI y -AgI están presentes. En estado puro, se ha encontrado que la fase -AgI conduce mejor que la fase -AgI, además de tener una energía de activación mucho menor (-AgI alrededor de 0.2-0.3 eV, mientras que -AgI entre 0.5-0.6 eV [27]). En policristales donde las fases se encuentran combinadas, la conducción es favorecida con respecto a la conductividad alcanzada por la fase -AgI [29]. Pero, al incrementar la temperatura, la fase -AgI es “cocinada” y transformada en la fase -AgI. Burley et. al. mostraron como, en un sistema policristalino /-AgI, la fase -AgI se transforma progresivamente en -AgI a medida que aumentamos la temperatura. Cuando el sistema es sometido a la transición / del AgI, solo la fase -AgI estará presente en la estructura a temperaturas por debajo de la transición [1] (ver figura 5.20). a) b) Figura 5.20. a) Curva de porcentaje de fase -AgI (fase hexagonal) en el politipo de AgI como función de la temperatura. b) Diagrama esquemático que muestra los caminos de transición permitidos entre las fases de AgI a presión atmosférica y por encima de la temperatura ambiente, considerando que a partir de 135 ºC, la velocidad de conversión aumenta. Los gráficos fueron sacados de la referencia [1] Esta transformación progresiva de la fase cúbica (-AgI) a la fase hexagonal (-AgI) del AgI presenta mejores propiedades eléctricas que las ofrecidas por la fase hexagonal pura. Uvarov et. al. encontraron como la conducción del Ag+ se ve favorecida gracias a la mezcla de ambas fases en el electrolito, pero luego decae cuando solo la fase hexagonal está presente [29]. El mismo Uvarov y compañía ☺, luego de realizar estudios estructurales sobre éste politipo, concluyeron que su alta conductividad está influenciada por el arreglo de dominios separados por fronteras antifases; estas configuración es la más probable fuente de defectos Frenkel catiónicos en el 77 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González electrolito [30]. La presencia adicional de MI mejora la conducción en el politipo, ligeramente con NaI pero considerablemente con LiI (ver figura 5.21). Éste último permite que la conducción aumente en un orden de magnitud. Podemos concluir que la conductividad iónica en sistemas binarios MI-AgI está controlada por el tipo fase(s) presente(s) en el AgI. Además, las fronteras de granos entre MI/AgI ayudan a incrementar la conducción en éste tipo de electrolito. Temperatura (ºC) log (DC) [S/cm] -3 200 160 120 80 40 -4 /-AgI -5 -AgI -6 2,4 LiI-AgI NaI-AgI AgI 2,8 3,2 1000/T (K -1 ) Figura 5.21. Conductividad de los sistemas binarios MI-AgI (M = Li y Na) dependiente de las fases de AgI presentes. Las flechas indican el sentido de la variación en temperatura y los puntos grises son datos extraídos de la referencia [29] para policristales de AgI prensados. 5.3.4 Conductividad Superiónica del CsAg2I3. Los termogramas de DSC para el sistema CsAg2I3-AgI muestran una anomalía térmica alrededor de 130 ºC, en un barrido de calentamiento, y 110 ºC, en un barrido de enfriamiento, asociada a una transición de fase en la estructura del CsAg2I3. A través de medidas calorimétricas, varios trabajos sobre compuestos de CsI-AgI observan este pico endotérmico y lo asocian a una transición de fase en la estructura del CsAg2I3 [17-19]. Si comparamos la entalpia de formación requerida en esta transición, está muy por debajo de la requerida por el AgI para transformar su estructura politipo /-AgI a la altamente conductora -AgI (ver tabla 5.3 y 5.4). Pero el gráfico de Arrhenius muestra un salto abrupto de la conductividad dc en dos órdenes de magnitud. Además, un ciclo completo en temperatura muestra valores de conductividad altamente estables, con un comportamiento histerético en la transición de fase del CsAg2I3. El transporte del Ag+ a través de la estructura del CsAg2I3 es tan bueno, que la conducción a través de pequeñas cantidades de AgI en su fase superconductora no altera la 78 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González conducción. Solo se encuentra un pequeño aumento de la conducción por encima de 180 ºC, asociado un punto eutéctico en el diagrama de fase del xCsI-(1-x)AgI [25]. Intensidad (u.a.) 25 ºC 120 ºC 135 ºC 160 ºC 135 ºC 120 ºC 25 ºC 10 15 20 25 30 35 40 45 2 (grados) 50 (022) CsAg2I3 135 ºC 160 ºC 135 ºC 120 ºC Intensidad (u.a.) Intensidad (u.a.) 120 ºC 25 ºC 120 ºC 31,5 32,0 2 (grados) 32,5 * D 135 ºC 160 ºC 135 ºC 120 ºC 25 ºC 31,0 60 (312) CsAg2I3 25 ºC 30,5 55 25 ºC 37,0 37,5 38,0 38,5 39,0 2 (grados) Figura 5.22. Arriba, difractogramas del sistema CsAg2I3-AgI tomados a diferentes temperaturas. Abajo, ampliación de las zonas delimitadas con líneas grises discontinuas. Los picos etiquetados con corresponden a la fase -AgI, mientras que los etiquetados con * y D corresponden a picos de difracción correspondientes a la fase -CsAg2I3. Para comprender un poco los cambios estructurales que sufre el compuesto CsAg2I3, medidas de difracción de rayos X fueron realizadas sobre el sistema a diferentes temperaturas. La figura 5.22 muestra los difractogramas para 25, 120, 135, 160 (barrido de calentamiento), 135, 120 y 25 ºC (barrido de enfriamiento). A primera vista, los picos más representativos de los difractogramas no sufren cambios significativos. Algunos picos de menor intensidad aparecen y desaparecen entre 120 y 160 ºC, asociados a reflexiones producidas por la estructura del -AgI. Resulta difícil determinar un gran cambio en la estructura del CsAg2I3. Sólo se logran observar algunos cambios alrededor de 2 = 31.5 y 38.5º. Entre 2 = [31º,32º], un pico a 31.7 º desaparece a temperaturas por encima de la transición; mientras que entre 2 = [38º,39º], dos 79 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González picos alrededor de 38.3º se definen y un pico a 38.4 desaparece a temperaturas por encima de la transición. El patrón indexado en la base de datos PDF-2 para el CsAg2I3 nos permite determinar que cuando la transición -CsAg2I3 ocurre, la reflexiones correspondientes a los planos (022) y (312) desaparecen. Además, dos nuevos picos aparecen (etiquetados con los símbolos * y D en la figura 5.22) pero la información con la que disponemos no nos permite determinar a qué planos cristalográficos corresponden. Este aumento en la conductividad del CsAg2I3 resulta ser energéticamente muy favorable: i) requiere de temperaturas relativamente bajas (110 ºC < T < 130 ºC) para alcanzar conductividades comparables a la del RbAg4I5, ii) las barreras de potencial que debe vencer el Ag+ para trasladarse a través de la estructura son bajas (Ea = 0.23(1) eV) y, iii) Su transformación estructural consume poca energía (DH < 10 J/g), comparado a lo consumido por la transición superiónica del AgI. CsAg2I3 medido: 0 (UCM) (UNIVALLE) ref [18] ref [21] (UAB) (UAB) -1 log (DC) [S/cm] -2 -3 -4 -5 -6 -7 2,0 2,5 3,0 3,5 -1 1000/T (K ) Figura 5.23. Gráfico comparativo entre las medidas de conductividad dc en el CsAg2I3 crecido en este trabajo y medidas reportadas en la literatura (puntos grises reportados en la ref [18] y línea continua reportados en la referencia [21]). En el pasado, medidas de conductividad se han realizado en este tipo de compuesto, pero solo nosotros hemos logrado alcanzar un incremento súbito de la conductividad luego de que la transición , del CsAg2I3, ocurre. Para darle un valor agregado a la veracidad de éste resultado, tres medidas de impedancia fueron realizadas en tres pastillas diferentes, y en tres diferentes grupos de investigación con analizadores de impedancia – Grupo de Transiciones de Fase en Sistemas No Metálicos [Univalle], Grupo de Física de Materiales Complejos 80 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González [Universidad Complutense de Madrid], Centro de Investigación en Nanociencia Nanotecnología CIN2 [Universidad Autonoma de Barcelona] – observando siempre la transición superiónica (ver figura 5.23). El alcance de este trabajo permite observar el incremento en la conductividad iónica; el ¿por qué ocurre? requerirá un trabajo más específico sobre este sistema. 5.3.5 Circuito Equivalente en los Electrolitos Sólidos. Mientras describíamos las curvas de impedancia compleja, insinuamos un comportamiento común en todos los sistemas. Todos mostraban, de forma parcial o total, un semicírculo asociado a mecanismos de transporte en el volumen del electrolito (ya sea a través de los defectos puntuales en las fases cristalinas y/o por la superficie de las fronteras de grano). Dependiendo de la temperatura o la conductividad, algunos gráficos de impedancia mostraban efectos de inductancias parasitas a altas frecuencias y/o procesos de difusión en la interfaz electrolito-electrodo a bajas frecuencias. En la sección 4.3.2. se discutió el tipo de circuito equivalente más común en electrolitos sólidos. En ese circuito equivalente, consideramos que tanto la superficie del electrolito como la del electrodo que lo rodea no son homogéneas, lo que supone una dispersión en los procesos capacitivos. Además, también se consideró efectos de difusión en la interfaz con un electrodo de longitud semi-infinita (impedancia de Warburg). Esta última consideración produce una dependencia lineal entre Z’ y -Z’’, a las bajas frecuencias. Pero, experimentalmente, los gráficos de impedancia de los policristales en estudio muestran una dependencia no lineal, por el contrario, existe una curvatura que tiende a formar otro semicírculo. Este efecto se puede ver más pronunciadamente en la figura 5.14; el espectro de impedancia para el CsAg2I3 muestra el semicírculo típico de la conducción en el volumen del electrolito a frecuencias altas e intermedias, y a las bajas frecuencias aparece otro “semicírculo” con una depresión muy elevada, asociado a procesos de difusión que ocurren en la interfaz electrolito-electrodo. Este comportamiento anómalo en la difusión está estrechamente relacionado con el tipo de electrodo empleado en la celda versus el tipo de portador de carga móvil. En nuestro caso, recurrimos a la plata como electrodo, mientras que todos los electrolitos tienen al Ag+ como portador de carga móvil. La completa afinidad que posee el catión móvil con el electrodo genera un proceso de difusión completamente diferente al que generaría el uso de otro electrodo (por ejemplo: platino, oro, aluminio). Sí el electrodo y el portador de carga son átomos (iones) diferentes, se esperaría un proceso similar al descrito por Warburg para la difusión por irregularidades en la superficie. Pero si el electrodo y el portador de carga son átomos (iones) iguales, procesos de absorción reversible son posibles; electrodos que permitan éste proceso son 81 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González llamados electrodos reversibles [31]. En nuestro caso, sobre el electrodo reversible se sigue la reacción electroquímica: Ag e Ag (5.3.5) Este fenómeno de absorción reversible conlleva a que la conductividad del Ag+ sea un proceso a dos etapas: i) conducción del catión a través del volumen del electrolito, seguido de ii) intercambio de carga, y masa, en la superficie del electrodo [32, 33]. Procesos similares al descrito se llevan a cabo sobre electrodos recubiertos donde parte del electrolito penetra a través de los defectos o poros en el recubrimiento hasta alcanzar el metal [34]. En este caso, un circuito equivalente llamado Circuito Nested (ó Circuito Anidado) se usa para simular dicho comportamiento [33]. Comparado con el circuito equivalente mostrado en la figura 4.16, el circuito Nested reemplaza la impedancia Warburg por un paralelo entre una resistencia RA y un elemento de fase constante CPEA. En la figura 5.24.a se muestra el circuito equivalente propuesto para la conducción del Ag+ en la celda. Al circuito equivalente se le añade un circuito en serie RL que simula las inductancias parasitas propias de los cables que conectan la celda con el analizador de impedancias. En el circuito equivalente, L y RL representan el valor de inductancia parasita y su respectiva resistencia. RE y CPEE están asociados a la resistencia y los procesos capacitivos presentes en el volumen del electrolito. El gráfico -Z’’ vs Z’ simulado del circuito equivalente es mostrado en la figura 5.24.b. CPEE RL L CPEA RE RA Figura 5.24. a) Circuito equivalente para los policristales en estudio (Circuito Nested en serie con un RLL). b) Gráfico de –Z’’ vs Z’ para el circuito equivalente a). 82 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González Para realizar el ajuste del circuito equivalente sobre los datos experimentales se usó el poderoso software de simulación desarrollado por J. R. Macdonald y sus colaboradores [32] llamado LEVM. El LEVM es capaz de analizar una gran variedad de procesos electroquímicos (conducción, relajación, reacciones químicas en la interfaz, corrosión,…) haciendo uso de cálculos de mínimos cuadrados complejos no lineales. En la figura 5.25 se muestra dos espectros ajustados, correspondientes a los policristales NaI-AgI y CsAg2I3-AgI. Si los procesos inductivos del ruido parásito no son apreciables, podemos despreciar los elementos L y RL en el circuito equivalente. El ajuste muestra que la conducción en el volumen del electrolito puede ser bien ajustados si consideramos un paralelo entre la resistencia del electrolito y un capacitor ideal, pues los valores de nE para CPEE son muy cercanos a 1. Este resultado es un reflejo del buen acople en la interfaz electrolito-electrodo cuando se usa pintura metálica como electrodo, lo que reduce la perdida de contacto por inhomogeneidad entre las dos superficies. En la figura 5.26 se muestra el ajuste para un espectro con una fuerte influencia del ruido inductivo, en el caso del RbAg4I5-AgI. Las inductancias parasitas controlan un considerable rango de frecuencias. El ajuste nos permite calcular el valor de la inductancia en los cables, así como su respectiva resistencia. A diferencia de los dos espectros anteriores, cuando la señal se ve afectada por un ruido inductivo, sólo es posible observar procesos de conducción en el volumen de la muestra. Los procesos eléctricos debido a la absorción reversible del Ag+ son completamente apantallados. a) b) 40000 20000 4 3 RE = 2.5 (2) x 10 QE = 9.6 (5) x 10 -12 QE = 3.0 (3) x 10 nE = 1.00 (3) -3 QA = 5.9 (7) x 10 2 RE RA = 0.003 CPE E -1 CPEA 4 -3 QA = 1.1 (1) x 10 10000 0 RA = 1.60 (5) x 10 -1 nA = 0.36 (9) 20000 -11 nE = 0.953 (6) 15000 CPEA 4 RA = 1.96 (5) x 10 -Z'' () 30000 -Z'' () RE = 7.4 (2) x 10 CPE E -1 -1 RE nA = 0.25 (8) 10000 2 RA = 0.002 5000 0 10000 20000 30000 40000 0 0 5000 Z' () 10000 15000 20000 Z' () Figura 5.25. Espectros de Impedancia ajustados con el circuito equivalente propuesto para (a) NaI-AgI y (c) CsAg2I3-AgI. Ambos espectros fueron tomados a una isoterma de 70 ºC 83 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 60 RE = 39 (9) 50 -1 L nE = 0.44 (3) 40 CPEA RL = 1.7 (5) -7 L = 7.1 (2) x 10 H 30 2 -Z'' () CPEE -5 QE = 9 (4) x 10 20 RL RE = 0.0006 RA 10 0 -10 -20 0 10 20 30 40 50 60 70 80 Z' () Figura 5.26. Espectro de Impedancia para el RbAg4I5-AgI ajustado con el circuito equivalente propuesto. En este caso, el efecto de las inductancias controla gran parte de los procesos eléctricos, apantallando los mecanismos de absorción. El espectro fue tomado a una isoterma de 120 ºC Referencias [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] G. Burley., The Amercan Mineralogist, 48 (1963) 1266-1276. E. Lakatos y K.H. Lieser, Z. Phys. Chem. N.F., 48 (1966) 228. G. Cochrane y N. H. Fletcher. J. Phys. Chem. Solids, 32 (1971) 2557-2567. B. Vonnegut, H. Chessin y R. E. Passarelli Jr., United States Patent, Patente No. 3.877.642 (1975). J. –S. Lee, S. Adams y J. Maier. J. Phys. Chem. Solids, 61 (2000) 1607 – 1622. S. Hull, D. A. Keen, D. S. Sivia y P. Berastegui. J. Solid State Chem., 165 (2002) 363-371. T. N. Blanton, S. Jagannathan y M. E. Irving. United States Patent, Patente No 6.383.405 B1 (2002). R. Vargas, M. B. Salamon y C. P. Flyn. Phys. Rev. Lett., 37 23 (1976) 1550-1553. I. D. Brown, H. E. Howard-Lock y M. Natarajan., Can. J. Chem. 55 (1977) 1511-1514. W. H. Davey., Phys. Rev., 21 (1923) 143-161. J.D. Hanawalt, H. W. Rinn y L. K. Frevel, Anal. Chem. 10 9 (1938) 457-512. J. N. Bradley and P. D. Greene, Trans. Faraday Soc. 63 (530, part 2), 424 (1967). B. –E. Mellander, B. Baranowski y A. Lundén. Phys. Rev. B., 23 8 (1981) 3770-3773 84 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] P. Gabbot. Principles and Applications of Thermal Analysis, Backwell Publishing, Singapure (2008) pag 41. M. R. Vuckic, D. S. Veselinovic y V. G. Markovic, J. Serb. Chem. Soc., 72 (2007) 857-868 L. –F., S. –W. Lee, J. –B. Li. et. al. Nanotechnology 19 (2008) 495706 G.N. Bradley, P.D. Greene, Trans. Faraday Soc. 63 (1966) 424. Rafiuddin y M. Hassan. Solid State Communications, 144 (2007) 293–295 S. Hull y P. Berastegui. J. Solid State Chem. 177 (2004) 3156–3173 H. Mehrer. Diffusion in Solids. Fundamentals, Methods, Materials, Diffusión-Controlled Processes. Springer Series in Solid State Science 155, Springer-Verlag Berlin Heidelberg (2007) p. 479 S. Hull. Rep. Prog. Phys. 67 (2004) 1233-1314 S. Kasap y P. Capper. Springer Handbook of Electronic and Photonic Materials, Springer Science+Business Media (2006) p. 214 R. S. Pettigrosso, J. C. Bazán y M. E. F. de Rapp. Materials Letters, 29 (1996) 81-85 V. K. Miloslavskii, S. Tsya-Lin y O. N. Yunakova. Optics and Spectroscopy, 80 4 (1996) 577580 M. Hassan y Rafiuddin. Physica B, 403 (2008) 2097-2102 N. F. Uvarov, B. B. Bokhonov, A. A. Politov, P. Vanek y J. Petzelt. Journal of Materials Synthesis and Processing, 8 (2000) 327-332 T. Ida, K. Kimura, Solid State Ionics, 107 (1998) 313-318 L. A. Rodriguez, W. Buchelli, H. Correa, J. E. Diosa y R. A. Vargas. Journal of Materials Science and Engineering, 4 (2010) 72-76. N. F. Uvarov y E. F. Hairetdinov, Solid State Ionics, 96 (1997) 219-225 N. F. Uvarov, E. F. Hairetdinov, A. I. Rykov y Yu. T. Pavlyukhin. Solid State Ionics, 96 (1997) 233-237 N. G. Bukun y A. E. Ukshe. Russian Journal of Electrochemistry, 45 (2009) 11-24 E. Barsoukov y J. R. Macdonald. Impedance Spectroscopy Theory, Experiment, and Applications, Segunda Edición, John Wiley & SonNew Jersey (2005) pag 84 M. E. Orazem y B. Tribollet. Electrochemical Impedance Spectroscopy, John Wiley & Sons, New Jersey (2008) pag. 70 E. Cano, D. M. Bastidas, V. Argyropoulos y A. Siatou. International Conference on Strategies for Saving Indoor Metallic Collections, (2007) 121-126 85 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González CAPÍTULO 6 6 CONCLUSIONES Como conclusiones generales podemos decir que las tres técnicas experimentales nos ayudaron a determinar la configuración estructural y los mecanismos de transporte iónico en los diferentes policristales. Además se observó el carácter superiónico del CsAg2I3. Este sistema ha sido estudiado en el pasado pero nadie había reportado dicha transición superiónica. Conclusiones más específicas son listadas a continuación: 1. A través del método de evaporación lenta, usando como solvente HI acuoso al 57 %, se cristalizaron sales policristalinas basadas en AgI y MI (M = Li, Na, Rb y Cs). Apoyándonos en las tres técnicas de medida empleadas (XRD, DSC y Espectroscopia de Impedancia) se pudo determinar que: i) Cuando M = Na y Li, el sistema solidifica como un policristal bifásico, una mezcla heterogénea de las fases precursoras. La relación 4:1 de los precursores AgI y MI, respectivamente, permite que el policristal resultante tenga una alta concentración de la fase AgI. ii) Cuando M = Rb y Cs, el sistema cristaliza como un compuesto ternario policristalino, RbAg4I5 y CsAg2I3, respectivamente, acompañado de una pequeña concentración de AgI. 2. El método de crecimiento empleado permitió que el AgI creciera como una mezcla de sus dos fases y . Sí se supera la transición / del AgI, sólo es posible obtener la fase -AgI cuando es enfriado hasta temperatura ambiente. 3. Termogramas de barridos sucesivos de DSC sobre polvos de los policristales crecidos mostraron un pico alrededor de 149 ºC, típico de la transición / del AgI presente en cada sistema. Un primer barrido sobre el LiI-AgI mostró dos pequeñas anomalías térmicas a 45 y 90 ºC asociadas a la salida de pequeñas cantidades de agua contenidas en la estructura. Los termogramas para el CsAg2I3-AgI mostraron dos picos, uno asociado a transiciones en el AgI y el otro a una transición de fase del CsAg2I3. Esta última transición se manifiestó a T ~ 130 ºC (en un barrido de calentamiento) ó T ~110 ºC (en un barrido de enfriamiento). 86 ESTUDIO DE LAS PROPIEDADES ELÉCTRICAS DE ELECTROLITOS SÓLIDOS BASADOS EN AgI Y MI Luis Alfredo Rodríguez González 4. En los sistemas bifásicos LiI-AgI y NaI-AgI, la conductividad iónica es controlada por la fase AgI (siendo mayor cuando la fase AgI presenta ambas fases y ), y se ve favorecida por la presencia de las fases tipo MI. A temperaturas cercanas al ambiente, el LiI-AgI es el sistema bifásico que mejores prestaciones eléctricas presentó, alcanzado conductividades de aprox. 10-4 -1 cm-1, casi un orden de magnitud superior al alcanzado por la mezcla /-AgI. 5. Solo el sistema RbAg4I5-AgI logra mejorar sus propiedades eléctricas si previamente es sometido a temperaturas mayores que la transición / del AgI. 6. El sistema CsAg2I3-AgI se convierte en un conductor superiónico a temperaturas menores que la temperatura de transición superiónica del AgI. La conversión superiónica se da con un incremento súbito de la conductividad, alcanzando valores de ~ 0.02 -1cm-1, superior a la alcanzada por el RbAg4I5. Una de las ventajas de esta transición es que requiere poca energía comparada con la energía que requiere la transición / del AgI (< 10 J/g comparado con los 25 J/g del AgI). 7. El comportamiento eléctrico de la celda Ag/muestra/Ag puede ser simulado con el circuito equivalente (Circuito Anidado) de la figura 5.24.a. Éste circuito equivalente simula tres procesos: el efectos parásitos a las altas frecuencias, la conducción del ión móvil a través del volumen del electrolito y los mecanismos de transporte en la interfase electrolito-electrodo. En la interfaz, procesos de absorción reversibles son llevados a cabo debido a que tanto el electrodo como el ión móvil son de la misma clase. 87