Grupo 14
Anuncio

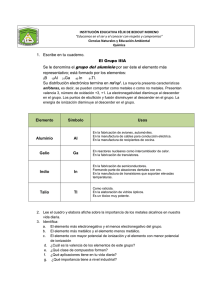
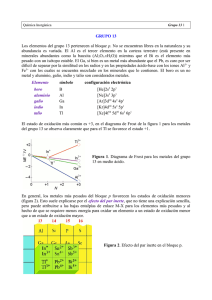
Química Inorgánica Grupo 14 1 GRUPO 14 Los elementos del grupo 14 son muy importantes, el carbono es la base de la vida en la Tierra y el silicio es un componente dominante de los minerales de la corteza terrestre, mientras que el germanio, estaño y el plomo tienen múltiples aplicaciones. Elemento símbolo configuración electrónica carbono C [He]2s2 2p2 silicio Si [Ne]3s2 3p2 germanio Ge [Ar]3d10 4s2 4p2 estaño Sn [Kr]4d10 5s2 5p2 plomo Pb [Xe]4f14 5d10 6s2 6p2 En sus compuestos presentan números de oxidación son +4 y +2 (figura 1), al descender en el grupo aumenta la estabilidad del estado de oxidación +2 (efecto del par inerte). Figura 1. Diagrama de Frost para los metales del grupo 14 en medio ácido. Obtención y usos El C se encuentra en su forma elemental en la corteza terrestre como coque, extrayéndose de minas y como diamante. Se lo emplea como combustible y como agente reductor, el grafito se emplea como lubricante y en lápices, el diamante se emplea en herramientas de corte. El Si se encuentra ampliamente distribuido en la naturaleza (arena, cuarzo, asbestos, feldespatos, arcillas, micas, etc.), se emplea la fabricación de vidrio y en electrónica. El Ge es menos abundante y se extrae de minerales de Zn, se emplea como semiconductor. El Sn y Pb se extraen de sus minerales (SnO2 y sulfuros de Pb). El Sn es resistente a la corrosión por lo cual se emplea para chapar hojalata, en aleaciones, en soldaduras. El Pb por ser fácil de obtener ha sido usado en muchos productos de gran consumo, por ejemplo baterías pero por su toxicidad presenta un problema ambiental. Propiedades El grupo 14 comprende no metales y metales, al descender en el grupo hay un cambio gradual desde el carácter no metálico al metálico. El aumento del radio iónico y la reducción de la energía de ionización pueden explicar el aumento de las propiedades metálicas al descender en el grupo 14. Química Inorgánica Grupo 14 2 ✔ el C es un sólido con distintas formas alotrópicas (figura 2). El grafito es un sólido blando, negro, conductor, usado como lubricante formado por láminas de C bidimensionales (enlaces σ entre vecinos a partir del traslape de orbitales híbridos sp2 y enlaces π deslocalizados sobre el plano formados por traslape de orbitales p perpendiculares). El diamante es un sólido duro (es la substancia natural más dura que se conoce), transparente, posee un alto índice de refracción y no conduce la corriente eléctrica (estructura rígida y covalente con uniones σ formadas por el traslape de orbitales híbridos sp3). También existe C amorfo y parcialmente cristalino de importancia comercial (negro de humo, carbono activado, fibras de carbono). ✔ Figura 2. Variedades alotrópicas del C: grafito (a), diamante (b) y un fulereno C60 (c). ✔ la conversión del diamante a grafito es espontánea (figura 3), pero no ocurre a una velocidad apreciable a P y T ambientes. Figura 3. Diagrama de fases del C. ✔ Si y Ge son sólidos blandos negros o grises, pueden ser considerados metaloides, poseen propiedades semiconductoras. ✔ Sn, β-Sn (blanco) y Pb son sólidos metálicos grisáceos, poco reactivos. ✔ todos los elementos del grupo, excepto el Pb, poseen al menos una fase sólida con la estructura tetraédrica del diamante. El estaño cúbico, α-Sn (Sn gris) no es estable a T ambiente. ✔ en general la reactividad aumenta con el número atómico. Química Inorgánica Grupo 14 3 Compuestos ✔ el C se caracteriza por su tendencia a la concatenación (tendencia a formar enlaces consigo mismo). ✔ hidruros: forman compuestos MH4, además C y Si forman hidruros moleculares (hidrocarburos y silanos) en forma de cadenas. La estabilidad térmica de los hidruros disminuye al descender en el grupo. ✔ óxidos: forman varios óxidos y compuestos oxigenados: ✔ CO (gas, agente reductor y ligante de metales d) y CO2 (gas involucrado en el efecto invernadero), óxido ácido. ✔ Si forma muchos compuestos con uniones Si-O-Si, como SiO2 (sílice), silicatos minerales (visitar http://web.visionlearning.com/silica_molecules.shtml), que contienen la unidad SiO4 (figura 4), vidrios y polímeros (siliconas). Figura 4. Estructura del ortosilicato [SiO4]4-. ✔ GeO es un agente reductor que se desproporciona, mientras que GeO2 se asemeja a la sílice. ✔ SnO se presenta en un par de estructuras polimórficas (azul, con una estructura similar a la de la figura 5 y roja) que se oxidan con facilidad a SnO2. ✔ los óxidos de Pb tienen distintas estructuras y aplicaciones, PbO (formas amarilla y roja, figura 5), PbO2 (marrón, material activo en la batería de Pb) y con estados de oxidación mezclados Pb3O4 (plomo rojo o minio), Pb2O3 (negro). Figura 5. Estructura de SnO (azul) y PbO (roja). ✔ PbO2 es el material activo en la batería de Pb, cuando produce corriente: PbO2 (s) + HSO4- (ac) + 3 H+ (ac) + 2 e- → PbSO4 (s) + 2 H2O (l) Pb (s) + SO42- (ac) → PbSO4 (s) + 2 e✔ halogenuros: reaccionan con todos los halógenos para formar MX4, y en el caso del Pb también PbX2. Los halogenuros de carbonilo, como el fosgeno (OCCl2) son útiles intermediarios químicos. ✔ sulfuros: CS y CS2 tienen estructuras similares a los análogos con oxígeno. Química Inorgánica Grupo 14 4 ✔ con nitrógeno el C forma cianuro de hidrógeno (HCN), usado en síntesis de muchos polímeros, y cianuros CN- (tóxicos), que forma complejos con metales d y son. El cianógeno (CN)2 es un gas tóxico e inflamable. El Si forma nitruro de silicio Si3N4, sustancia muy dura e inerte. ✔ carburos: son compuestos binarios de C con metales y metaloides, pueden ser salinos (como CaC2, que se hidrolizan en agua para dar hidrocarburos, contienen el ion C 22- o C4-), carburos metálicos (intersticiales), muy duros como WC, usado en herramientas de corte o Fe3C, constituyente del acero, metaloides sólidos covalentes duros formados por B y Si, SiC (abrasivo carborundum). ✔ compuestos oxigenados del C: carbonatos (CO32-) y bicarbonatos (HCO3-). El carbonato de sodio (sosa) tiene importancia comercial y se obtienen por el proceso Solvay: