Respuesta inmunitaria celular adaptativa frente a la infección por el
Anuncio

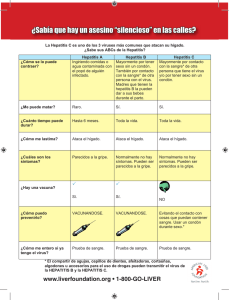
Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. REVISIÓN Respuesta inmunitaria celular adaptativa frente a la infección por el virus de la hepatitis C 190.576 Norma Ibón Rallón, Vicente Soriano y José Miguel Benito Laboratorio de Biología Molecular. Servicio de Enfermedades Infecciosas. Hospital Carlos III. Madrid. España. El virus de la hepatitis C (VHC) infecta alrededor de 175 millones de personas en el mundo y es una de las principales causas de enfermedad hepática crónica. Menos de una tercera parte de las personas expuestas controlan el virus espontáneamente después de la infección aguda, mientras que el resto evoluciona a la cronicidad. La resolución de la infección se ha asociado al componente celular de la respuesta inmunitaria del huésped. No se conoce bien qué distingue una respuesta inmunitaria celular exitosa frente al VHC. Una interpretación integral de los diversos hallazgos experimentales permite una mejor comprensión del porqué del fracaso inmunitario en la infección crónica por el VHC. Palabras clave: Hepatitis C. Hepatitis crónica. Respuesta inmunitaria. Células T. Adaptive cell immune response against the hepatitis C virus infection Hepatitis C virus (HCV) infects around 175 million people worldwide and is one of the leading causes of chronic liver disease. Less than one third of patients infected with HCV are able to spontaneously clear the virus during acute infection, while most patients evolve to chronic infection. Control of viral replication has been associated to the cellular component of the host immune response. It is not fully understood what distinguish a successful cellular immune response. An integral interpretation of the numerous experimental findings may allow a better understanding of the immune mechanisms involved in the inability of the immune system to successfully control chronic HCV infection. Key words: Hepatitis C. Chronic hepatitis. Immune response. T cells. En el repertorio de las enfermedades humanas, la infección por el virus de la hepatitis C (VHC) representa un importante reto sanitario1,2. La hepatitis C crónica es una de las principales causas de enfermedad hepática crónica en el mundo3,4 y el VHC se encuentra entre los patógenos humanos de mayor importancia5. Se estima que 175 millones de personas en el mundo están infectadas1,3,6. Sólo en España2, el número de infectados oscila entre 480.000 y 760.000. Sólo una minoría de las personas infectadas (aproximadamente el 30%) controla el virus de manera espontánea tras la infección aguda7, mientras que el resto evoluciona a la cronicidad. La resolución espontánea de la infección aguda Trabajo realizado con la ayuda de la Fundación Investigación y Educación en SIDA (IES), la Red de SIDA (RIS), VIRGIL y la Agencia Laín Entralgo. Correspondencia: Dr. J.M. Benito. Laboratorio de Biología Molecular. Hospital Carlos III. Sinesio Delgado, 10. 28029 Madrid. España. Correo electrónico: [email protected] Recibido el 15-1-2007; aceptado para su publicación el 16-2-2007. por el VHC se ha asociado al componente celular de la respuesta inmunitaria del huésped, en virtud de diversos hallazgos experimentales a partir de análisis detallados de las características fenotípicas y funcionales de la respuesta inmunitaria celular adaptativa en humanos y chimpancés durante el transcurso de la infección. En esta revisión se examinan los principales conocimientos sobre la respuesta inmunitaria celular anti-VHC y se plantea una visión integral de los posibles mecanismos que explican el fracaso inmunitario en pacientes que no controlan la infección. El virus de la hepatitis C El VHC es un virus hepatotrópico1,8,9 que pertenece al género Hepacivirus10,11, dentro de la familia Flaviviridae. Tiene un genoma ARN de cadena simple1,9,11, que codifica para una sola poliproteína de aproximadamente 3.000 aminoácidos, la cual es procesada en 10 proteínas estructurales y no estructurales o reguladoras3,10,11. Se han identificado 6 genotipos principales del VHC y más de 100 subtipos. Además, múltiples cuasi especies (secuencias distintas pero muy relacionadas) coexisten dentro de cada individuo infectado, lo que refleja la amplia variabilidad genética del VHC. Es el resultado de la incapacidad correctora de errores de la polimerasa viral3,12 y de la alta tasa de replicación viral12. Los modelos matemáticos de dinámica viral indican que cada día se producen más de 10 trillones de viriones13. El VHC se replica preferentemente en el citoplasma del hepatocito12,14, que es su diana celular principal. Parece haber un reservorio extrahepático14, que incluye células dendríticas15 y células B16. El virus inicia su replicación inmediatamente después de la infección y por lo general la viremia es detectable una o 2 semanas después de la inoculación en humanos17 y unos pocos días después de la inoculación en chimpancés18-20, que es el único modelo animal que puede ser infectado con este virus21-24 y, por tanto, se emplea para estudiar la respuesta inmunitaria en la infección por el VHC12. Historia natural de la hepatitis C crónica El VHC se transmite principalmente por vía parenteral4,25 y produce enfermedad hepática necroinflamatoria aguda, que por lo general evoluciona a la cronicidad4. Tras una infección aguda por el VHC hay 2 resultados posibles. Uno es la reducción y, eventualmente, la desaparición de la viremia26 como resultado de la disminución de la producción de partículas virales en las células infectadas, la disminución de la infección de células nuevas y el aumento de la destrucción de células infectadas14. Alternativamente, la persistencia viral, con grados variables de daño hepático26, puede conducir a cirrosis hepática y/o carcinoma hepatocelular1,7,27. De este modo, la hepatitis C crónica es actualmente la principal Med Clin (Barc). 2007;129(12):469-76 469 Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C MHC-II/péptido /TCR Expansión de células T CD4+ APC que endocita el péptido viral APC con péptido viral endocitado y fragmentado Células T CD4+ MHC II Célula infectada Respuesta Th1 MHC-I Péptido TCR Respuesta Th2 Citocinas Grancimas FasL Fas Porfirinas Células T CD8+ Muerte celular Respuesta citotóxica Expansión de células T CD8+ efectoras Expansión de células T CD8+ de memoria Citocinas y quimiocinas Respuesta no citotóxica Fig. 1. Representación esquemática de la respuesta inmunitaria adaptativa mediada por células. APC: células presentadoras de antígeno; MHC: complejo principal de histocompatibilidad; TCR: receptor de células T; Th: linfocitos T helper. causa de trasplante de hígado3. En general, menos de una tercera parte de las personas infectadas por el VHC logra la eliminación rápida y espontánea del virus después de la infección aguda17,28; el resto desarrolla una hepatitis crónica1,7,27. Aunque se han descrito casos de resolución espontánea de la infección crónica por el VHC asociados con una reconstitución del sistema inmunitario del huésped7,29-31 o con valores bajos de carga viral32, una vez que se establece la cronicidad, generalmente se produce un colapso progresivo de la respuesta inmunitaria frente al VHC. De manera progresiva disminuye la probabilidad de que el huésped recupere de forma espontánea la capacidad para controlar la replicación viral8 y el tratamiento anti-VHC es la única oportunidad de resolución de la infección. La combinación de interferón (IFN) alfa pegilado con ribavirina33 es el tratamiento antiVHC de elección en la actualidad. Desafortunadamente, poco más de la mitad de los pacientes obtienen una respuesta virológica sostenida33-35, con mejores respuestas en los genotipos 2 y 3 que en 1 y 436. La falta de respuesta al tratamiento antiviral constituye un problema de gran trascendencia sociosanitaria6. Es esencial desarrollar tratamientos alternativos a la medicación hoy disponible, dada la alta prevalencia de la hepatitis crónica C y, particularmente, del genotipo 1. 470 Med Clin (Barc). 2007;129(12):469-76 Respuesta inmunitaria celular antiviral La respuesta inmunitaria puede clasificarse en: a) innata, que es de acción inmediata e inespecífica, y b) adaptativa, que se desencadena más tarde y frente a un patógeno específico. En ambos tipos de respuesta participan tanto elementos celulares como humorales, que ejercen las funciones inmunitarias efectoras. La respuesta inmunitaria adaptativa mediada por células es la encargada de reaccionar contra patógenos intracelulares, como es el caso de los virus, que son parásitos intracelulares obligados. En esta respuesta intervienen principalmente células T CD4+, conocidas también como linfocitos T helper (Th), y células T CD8+ o linfocitos T citotóxicos, que reconocen pequeños péptidos virales derivados de proteínas estructurales y no estructurales asociados al complejo principal de histocompatibilidad (MHC, major histocompatibility complex) (fig. 1). Respuesta inmunitaria mediada por células T CD4+ Las proteínas virales exógenas presentan endocitosis y son fragmentadas en péptidos de aproximadamente 11-17 aminoácidos de longitud por las células presentadoras de antígeno (APC, antigen-presenting cells), que expresan en su superficie moléculas MHC de clase II (MHC-II), a las que se Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C unen los péptidos procesados. El complejo formado por el péptido y MHC-II es presentado por las APC a las células T CD4+, tras la interacción con el receptor de células T (TCR, T-cell receptor). La unión de TCR, péptido y MHC-II induce la activación, diferenciación y expansión de las células T CD4+. Las células T CD4+ activadas secretan un grupo de mediadores químicos, conocidos como citocinas, que coordinan la respuesta inmunitaria global contra patógenos. Dependiendo de las citocinas producidas, las células Th pueden promover el desarrollo de una respuesta celular con las células CD8+ como efectores principales (respuesta Th1), o una respuesta humoral mediada por anticuerpos producidos por los linfocitos B (respuesta Th2). Además, las células T CD4+ activan las APC, que son esenciales para la estimulación efectiva de la respuesta por células T CD8+37. En modelos animales las células T CD4+ específicas desempeñan un papel clave en la inducción de una respuesta inmunitaria antiviral efectiva, capaz de controlar la replicación de múltiples virus. En humanos se ha investigado el papel protector de las células T CD4+ contra el virus de la inmunodefieciencia humana (VIH), citomegalovirus y VHC, entre otros, aunque los mecanismos precisos por los cuales la respuesta inmunitaria controla la replicación viral de manera efectiva y detiene la progresión de la enfermedad no se conocen bien38-40. Respuesta inmunitaria mediada por células T CD8+ Las células infectadas por virus expresan en su superficie moléculas MHC de clase I (MHC-I) unidas a péptidos de 8 a 10 aminoácidos derivados de proteínas virales. El TCR de las células T CD8+ reconoce esta unión, formando el complejo TCR-péptido-MHC-I, que induce la activación, diferenciación y expansión de las células T CD8+. Las células T CD8+ activadas inhiben la replicación de los virus mediante 2 funciones efectoras41-43. La primera se conoce como respuesta citotóxica o citolítica, que consiste en la habilidad para inducir muerte celular a través de la secreción de grancimas y perforinas o de las interacciones Fas-FasL. La segunda es la respuesta no citotóxica, que consiste en la habilidad para controlar la replicación viral sin muerte celular por la secreción de citocinas como el IFN-γ, el factor de necrosis tumoral alfa y la interleucina 2, o bien quimiocinas como MIP-1-α (de macrophage inflamatory protein, proteína inflamatoria de los macrófagos), MIP-1B y RANTES37. Respuesta inmunitaria celular antivirus de la hepatitis C La relación entre el VHC y su huésped es dinámica: el virus trata de coexistir empleando diversas estrategias para escapar a la respuesta inmunitaria, mientras el sistema inmunitario del huésped intenta controlar y eliminar la infección sin dañarse a sí mismo. El resultado final de la confrontación entre estas 2 fuerzas biológicas depende de la cinética de replicación del VHC y de las características cuantitativas y cualitativas de la respuesta inmunitaria del huésped12. Al igual que otros virus, el VHC induce múltiples respuestas inmunitarias efectoras9. Sin embargo, existe consenso en atribuir a la respuesta inmunitaria celular adaptativa, a través de los linfocitos T CD4+ y CD8+, un papel determinante en el resultado final de la infección por este virus9,14,17,22-24,26,28,44. Los linfocitos del infiltrado hepático específicos contra el VHC reconocen los complejos MHC-péptido sobre los hepatocitos infectados y responden con funciones efectoras citotóxicas, destruyendo las células infectadas, y también con funciones efectoras no citotóxicas inducidas por células T CD8+ y mediadas por citocinas17,24,45,46 como el IFN-γ24,47. No está bien establecido si el IFN-γ ejerce efectos antivirales directos in vivo o si es sólo un marcador de otras funciones efectoras de las células T47. En cualquier caso, tiene un papel crucial en el control de la replicación del VHC48. En estudios in vitro el IFN-γ inhibe la replicación del ARN subgenómico y genómico del VHC47, y en estudios in vivo desarrollados en chimpancés con hepatitis C aguda la aparición de la respuesta de células T CD8+ y el incremento en la expresión de IFN-γ en el hígado coinciden precisamente con una disminución de la carga viral24,45,46. Respuesta inmunitaria celular en la hepatitis C aguda y crónica Los fenómenos virales e inmunológicos que ocurren en las primeras semanas después de la infección por el VHC determinan el resultado final de la infección8,17,24. Sin embargo, debido a que la hepatitis C aguda es generalmente asintomática y pasa inadvertida17,26,34, los estudios inmunológicos en el estadio más temprano de la infección son escasos. Durante las primeras semanas de la infección, la respuesta inmunitaria celular adaptativa17 hace caso omiso del VHC, ya que las células T específicas contra el virus no se detectan hasta uno o 2 meses después de la infección aguda17,24, a pesar de haber una carga viral elevada desde la primera o segunda semanas de la infección aguda17. En experimentos de reexposición al VHC en chimpancés, la respuesta inmunitaria celular específica contra el virus se detecta antes (a las 2 semanas) que tras la primera exposición (a las 8-10 semanas)19,21,49. La celeridad en la aparición de la respuesta inmunitaria adaptativa durante la reexposición, aunque insuficiente para prevenir una nueva infección, puede influir positivamente en el curso de la enfermedad hepática inducida por el VHC en chimpancés. Habitualmente estos animales presentan una viremia baja y hepatitis leve por el VHC, lo que indica que el largo intervalo de tiempo entre la exposición y la activación de la respuesta inmunitaria adaptativa específica contra el VHC es un factor clave en la tasa de cronicidad y en la gravedad de la enfermedad8. Además de la aparición tardía de la respuesta inmunitaria celular adaptativa, se han observado defectos cuantitativos y funcionales durante el estadio más temprano de la infección aguda por el VHC. Las células T CD8+ específicas del virus pueden detectarse, pero no producen IFN-γ ni proliferan in vitro17,26,28,50. Además, el contenido de perforina y la actividad lítica están disminuidos significativamente26,50-52. Sin embargo, estos defectos en la respuesta inmunitaria celular son transitorios en los pacientes que se recuperan de la infección espontáneamente17,26,28,50-52. En este caso, las células T CD8+ de memoria específicas contra el VHC se generan progresivamente unas pocas semanas después del comienzo clínico de la enfermedad y adquieren la capacidad para proliferar y secretar citocinas efectoras tras la exposición al antígeno, lo cual puede contribuir al control de la viremia28. Esta maduración fenotípica y funcional de las células T CD8+ parece estar asociada a una respuesta potente por parte de las células T CD4+17,26,28, las cuales muestran una fuerte capacidad de expansión tras la estimulación con péptidos del virus y presentan un perfil funcional de citocinas predominantemente Th1, con una producción de elevadas cantidades de IFN-γ e interleucina 228. La interleucina 2, en particular, parece tener un papel importante, ya que se requiere para la expansión sostenida de las células T CD8+ y está directamente asociada con la adquisición de un fenotipo de memoria53. Med Clin (Barc). 2007;129(12):469-76 471 Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C TABLA 1 Posibles estrategias del virus de la hepatitis C para escapar del sistema inmunitario Estrategias virales Escape del reconocimiento de células T por mutaciones en la secuencia viral4,12,23,66-76 Resistencia a las funciones efectoras inmunológicas12,66,79-80 Interferencia en la señalización celular12,15,23,66,67,81-84 Evidencias experimentales Retraso en la aparición de la respuesta inmunitaria celular17,19,21,24,49 Alteraciones cuantitativas en la respuesta inmunitaria celular (respuesta débil y dirigida a escasos epítopos)14,15,17,24,26,28,44 Alteraciones cualitativas en la respuesta inmunitaria celular (limitada capacidad de proliferación, de actividad citolítica y de producción de citocinas efectoras)17,26,28,50-52,56,59-62 El control o la recuperación espontánea de la infección por el VHC se asocia entonces a una respuesta intensa y multiespecífica de las células T CD4+ y CD8+ anti-VHC17,24,26,28,45,52,54-56, que evolucionan fenotípica y funcionalmente durante el curso de la infección17,24 y tienen un perfil característico de producción de citocinas Th126,54-56. La respuesta de células T específicas anti-VHC permanece detectable durante varios años después de la recuperación de la infección aguda26,45,48,52,54,55,57,58. En chimpancés esta respuesta persiste no sólo en la sangre periférica, sino también en el hígado22,46, confiriendo inmunidad protectora pero no inmunidad estéril4. Así, los chimpancés recuperados de la infección por el VHC y sometidos a reexposición con virus homólogos o heterólogos suelen reinfectarse, pero los síntomas son más leves y cortos, con un control más rápido y eficiente de la replicación viral19,21,22,49. Al contrario de lo que ocurre en los pacientes que consiguen eliminar el virus durante la infección aguda, la evolución a la cronicidad se asocia a una disfunción temprana y persistente en la respuesta inmunitaria de células T50-52. En estos pacientes la respuesta de las células T CD4+ y CD8+ es débil y está dirigida a muy escasos epítopos de las proteínas virales14,15,17,24,26,28,44. Las células T CD8+ específicas contra el VHC no proliferan significativamente después de la estimulación in vitro con el antígeno, no producen IFN-γ en respuesta a péptidos del VHC y despliegan baja citotoxicidad específica contra el virus in vitro52. Además, la respuesta de células T CD4+ apenas es detectable ex vivo, con una capacidad limitada de expansión28,56 y una producción defectuosa de citocinas Th1, como interleucina 2 y factor de necrosis tumoral alfa28,59,60. Hallazgos similares se han encontrado en células T intrahepáticas61,62. A pesar de lo débil y defectuosa que pueda ser la respuesta inmunitaria en la infección crónica por el VHC, se cree que puede ser un factor crucial en el desarrollo de fibrosis hepática y cirrosis61. La respuesta inmunitaria celular parece contribuir al control del virus en primera instancia y potencialmente a la inflamación hepática en la enfermedad crónica26. Se cree que, tras ejercer su función efectora, las células T específicas contra el VHC experimentan apoptosis (muerte celular programada)63. La muerte de células inflamatorias en el hígado, la lisis de algunos hepatocitos infectados y la secreción de citocinas inflamatorias61 de forma mantenida en el tiempo podrían activar las células estrelladas hepáticas, que son la fuente principal de la matriz extracelular en la fibrosis hepática12. Algunas observaciones, sin embargo, no apoyan esta hipótesis64. Es el caso de los pacientes inmunodeprimidos por el VIH o por tratamientos inmunodepresores, como ocurre tras trasplantes de órganos. Paradójicamente, estos pacientes experimentan una progresión más rápida de la fibrosis hepática por el VHC65. Persistencia del virus de la hepatitis C El sistema inmunitario de los pacientes infectados crónicamente por el VHC no posee la misma eficiencia funcional y 472 Med Clin (Barc). 2007;129(12):469-76 el repertorio celular que el de los pacientes que han sido capaces de controlar la infección aguda por el VHC8. Esto parece indicar que el virus ha desarrollado estrategias de evasión de la inmunidad. Aunque estos mecanismos de escape se han considerado muy diversos12 y complejos66, se han sistematizado en 3 grupos: a) escape del reconocimiento de células T; b) resistencia a las funciones efectoras inmunológicas, y c) interferencia en los mecanismos de señalización celular12,66. La evasión viral puede darse tanto frente a la respuesta inmunitaria innata como frente a la adaptativa14 (tabla 1). Desafortunadamente, los mecanismos precisos que explican la ineficiencia del sistema inmunitario para controlar con éxito la replicación viral en la fase crónica de la infección no se conocen bien9,17,26,28. Esta dificultad persiste a pesar de múltiples esfuerzos9,31 y de logros importantes obtenidos a partir de estudios en humanos y en el modelo animal, al igual que en estudios in vitro4. En cuanto a la primera estrategia de escape del VHC, las mutaciones en la secuencia viral4,67-69 y los cambios en las cuasi especies virales12 con variantes del VHC que son portadoras de mutaciones en epítopos helper (cooperadores)70 y en epítopos citotóxicos71,72,85 constituyen un mecanismo de escape importante para el virus, como indican diversos estudios en humanos68,70,72-74 y en chimpancés67,69 con hepatitis C crónica. En chimpancés infectados por el VHC, los virus mutantes que son capaces de escapar a la respuesta de células T CD8+ surgen en una etapa temprana de la infección67,75,76. Esto podría verse facilitado por la rápida diversificación de la población viral en ese período3, cuando todavía no ha aparecido la respuesta inmunitaria celular17,24. La aparición de dicha respuesta implica la selección de estos mutantes, que acaban fijándose en la población de cuasi especies4 en el contexto de una respuesta inmunitaria incapaz de adaptarse con suficiente rapidez a los cambios en las cuasi especies virales8, lo cual favorece la persistencia de la infección67. Las mutaciones de escape pueden afectar al procesamiento de epítopos73, la unión a MHC67-69 y la estimulación del TCR67,68,70,72. La supresión de la respuesta de células T frente a los péptidos salvajes ocurre incluso con pequeñas cantidades de los péptidos mutantes, ya que estos últimos pueden actuar como inhibidores competitivos e interferir con la unión de los péptidos salvajes al TCR. Esto último es necesario para superar el umbral de activación de las células T86. Estudios recientes indican que la ausencia de una respuesta de células T CD4+ adecuada en la fase aguda de la infección por el VHC puede favorecer la selección de mutaciones de escape viral en los epítopos restringidos por antígenos de histocompatibilidad de clase I y la incapacidad para resolver la infección por el VHC23. La persistencia viral no depende exclusivamente del escape mutacional, ya que otras estrategias virales que afectan a la eficiencia de la respuesta de células T son igualmente relevantes9. Es el caso de la resistencia del virus a las funciones Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C inmunitarias efectoras mediante la inmunodepresión por productos de genes virales77,78 y el agotamiento de las células T por la prolongada exposición a antígenos virales79,80. Las alteraciones funcionales de la respuesta inmunitaria de células T, a través de la interferencia en la señalización celular, constituyen otra estrategia importante de evasión viral, que no sólo alteraría la funcionalidad de las células T de forma directa, sino también indirectamente por sus efectos en la célula dendrítica, que es un elemento clave en la inducción de la respuesta inmunitaria celular12. Las células dendríticas tienen un papel crucial como moduladores de la respuesta inmunitaria antiviral por ser APC «profesionales»15, que desencadenan la respuesta inmunitaria específica contra el antígeno87. Así, una alteración en la función o maduración de las células dendríticas durante la infección primaria por el VHC podría contribuir al retraso en la aparición de las células T CD4+ y CD8+. Aunque no hay datos concluyentes acerca de la función de las células dendríticas durante la infección aguda y crónica por el VHC8, experimentos llevados a cabo con células dendríticas derivadas de monocitos indican que éstas muestran un proceso de maduración alterado en la infección crónica por el VHC15,67,81. En este sentido, es de interés conocer que algunas proteínas del VHC, principalmente core y E1, al provocar una maduración defectuosa en las células dendríticas, inhiben su capacidad para inducir las respuestas inmunitarias celulares82. Es más, la presencia de la proteína E2 del VHC puede inhibir directamente la función de los linfocitos citolíticos (natural killer)83,84, los cuales contribuyen a la maduración de las células dendríticas88. De este modo, se inhibiría indirectamente la función de las células dendríticas para desencadenar las respuestas inmunitarias adaptativas8. En la capacidad de las células dendríticas para inducir la respuesta inmunitaria por parte de las células T influyen su localización en el tejido, la dosis de antígeno y la interacción con las células T CD4+87, que a su vez están implicadas en el mantenimiento de las células T CD8+. Así, una respuesta fuerte y polivalente de los linfocitos CD4+ frente a las proteínas del VHC es clave para el control exitoso de la replicación viral14. Una estimulación pobre o defectuosa de las células T CD4+ produciría una maduración insuficiente de las células T CD8+6. La inactivación funcional temprana de las células T CD4+ y la ineficiencia para producir citocinas efectoras en la fase aguda de la infección por el VHC pueden afectar la eficiencia de la respuesta inmunitaria antiviral. En estas condiciones puede bloquearse el proceso de diferenciación de las células T CD8+ anti-VHC, lo que imposibilita el control de la replicación viral28. En chimpancés la eliminación in vivo de células T CD4+ antes de la reexposición al VHC ocasiona de forma uniforme una infección crónica23. En contraposición con la relevancia de la respuesta inmunitaria celular en sangre periférica, se ha propuesto que el control de la infección por el VHC estaría asociado a una respuesta intensa de las células T CD4+ y CD8+ intrahepáticas24. Estudios basados en el modelo animal apoyan esta hipótesis, ya que la eliminación in vivo de células T CD8+ tiene como resultado una viremia prolongada, que se controla únicamente cuando las células T CD8+ específicas contra el VHC reaparecen en el hígado22. La aparición de la respuesta de células T y la inducción de la expresión de IFN-γ en el hígado de chimpancés coinciden precisamente con una disminución de la carga viral del VHC24,45,46. Además, las células T activadas específicas contra el VHC se encuentran entre 10 y 30 veces más frecuentemente en el hígado que en la sangre periférica61,89. Sobre la base de estudios realizados en chimpancés2,28,90, algunos autores plan- tean que la existencia de compartimentalización de las células T específicas frente al VHC explica que sea de vital importancia realizar más estudios en tejido hepático para extraer conclusiones más claras acerca del papel de la respuesta de células T en el control de la infección por el VHC. Respuesta inmunitaria celular durante el tratamiento contra el virus de la hepatitis C La diferencia en intensidad y calidad de la inmunidad específica frente al VHC en la hepatitis resuelta respecto a la crónica indica que la restauración de la inmunidad antiviral podría llevar al control de la replicación viral con el tratamiento8. De hecho, tanto el IFN-α pegilado como la ribavirina pueden modular el sistema inmunitario. Lo que no está claro es cómo realizan esa acción y si esto es relevante en la respuesta al tratamiento91. Los mecanismos precisos causantes de la eliminación del VHC inducida por el tratamiento no se conocen bien92. Sobre la base de los hallazgos obtenidos en estudios con pacientes en tratamiento anti-VHC se han elaborado 2 hipótesis en relación con el mecanismo de acción del IFN-α y la ribavirina. En la primera, el tratamiento inhibiría la replicación del VHC a través de un efecto inmunomodulador4,93-97, mientras que en la segunda el tratamiento bloquearía la replicación del VHC a través de un efecto antiviral directo98-101. De hecho, se ha demostrado que la ribavirina posee un efecto antiviral mediado por una acción mutagénica que induciría el fenómeno de catástrofe de error por acumulación de múltiples mutaciones en el genoma viral102. Por otra parte, los resultados obtenidos en nuestro laboratorio, en los que se observa una relación significativa entre los valores plasmáticos de ribavirina y la tasa de respuesta virológica temprana, apoyan el mecanismo de acción antiviral directa103,104. Finalmente, en un estudio reciente en el que hemos evaluado la evolución de la respuesta de células T CD4+ y CD8+ frente al VHC durante el tratamiento con IFN-α pegilado y ribavirina, hemos observado una clara tendencia a la disminución de dicha respuesta durante el tratamiento105, lo que no apoya la hipótesis de una potenciación de la respuesta inmunitaria antiviral como mecanismo de acción de dichos fármacos. El efecto del tratamiento en la respuesta inmunitaria de células T específicas frente al VHC y, a su vez, el papel de dicha respuesta en el control de la replicación del VHC en pacientes tratados son actualmente objeto de debate. Se han obtenido resultados discrepantes al evaluar la respuesta inmunitaria de células T durante el tratamiento de la hepatitis C. Algunos autores han observado un aumento de dicha respuesta93,106-108, mientras que otros han reconocido una disminución92,109,110. Otros autores no han encontrado una tendencia clara111 o ésta ha sido temporal y sin asociación directa con el tratamiento antiviral112. Los distintos métodos empleados para evaluar la respuesta celular probablemente expliquen estas diferencias. Algunos estudios han usado ensayos funcionales107,108, mientras que otros han utilizado complejos tetraméricos y/o ensayos de producción de IFN-γ para detectar células T CD8+ específicas frente al VHC92,109,110. Los resultados obtenidos en nuestro laboratorio, en los que se demuestra una disminución o incluso desaparición de la respuesta de células T tras la supresión completa de la replicación viral inducida por el tratamiento anti-VHC105, apuntan a la necesidad de un nivel mínimo de estimulación antigénica para el mantenimiento de dicha respuesta, de forma similar a como se ha descrito para la infección por el VIH113. Med Clin (Barc). 2007;129(12):469-76 473 Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C Conclusiones La mayoría de los pacientes infectados por el VHC no consiguen controlar la replicación del virus y evolucionan a la cronicidad. En los pacientes que consiguen controlar espontáneamente la infección, la capacidad para generar una adecuada respuesta inmunitaria de células T parece ser el principal mecanismo responsable de dicho control. Aunque se requiere la respuesta inmunitaria de células T CD4+ y CD8+, la respuesta eficiente de las células T CD4+ parece ser el principal determinante del control de la replicación viral, al permitir que las células T CD8+ completen su proceso de maduración y puedan realizar su función efectora de forma eficiente. Además, el adecuado funcionamiento de las células dendríticas parece necesario para la inducción de la respuesta inmunitaria de las células T. La interpretación de los resultados de los estudios de inmunidad frente al VHC es difícil debido a la variabilidad metodológica y a la diversidad de antígenos utilizados. La estandarización de los procedimientos empleados podría permitir una mejor comparación de los resultados y facilitaría una mejor comprensión de los diversos hallazgos experimentales. Sólo así podrán extraerse conclusiones más rigurosas que permitan avanzar en la comprensión de los mecanismos de protección y cronificación de la infección por el VHC. El tratamiento con IFN-α pegilado y ribavirina sólo es eficaz en poco más de la mitad de los pacientes con hepatitis C crónica. Los resultados más recientes no indican que su mecanismo de acción suponga una restauración o activación del sistema inmunitario específicamente frente al VHC, de modo que es importante considerar el efecto antiviral directo de los fármacos empleados como responsable, al menos en parte, del control de la replicación viral. Agradecimientos Queremos agradecer al Dr. Javier García-Samaniego sus comentarios y ayuda. REFERENCIAS BIBLIOGRÁFICAS 1. Neumann-Haefelin C, Blum H, Chisari F, Thimme R. T cell response in hepatitis C virus infection. J Clin Virol. 2005;32:75-85. 2. Bruguera M, Forns X. Hepatitis C en España. Med Clin (Barc). 2006; 127:113-7. 3. Lauer G, Walker B. Hepatitis C virus infection. N Engl J Med. 2001; 345:41-52. 4. Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol. 2005;5:215-29. 5. Seeger C. Salient molecular features of hepatitis C virus revealed. Trends Microbiol. 2005;13:528-34. 6. Lucas M, Vargas-Cuero A, Lauer G, Barnes E, Willberg C, Semmo N, et al. Pervasive influence of hepatitis C virus on the phenotype of antiviral CD8+ T cells. J Immunol. 2004;172:1744-53. 7. Somsouk M, Lauer G, Casson D, Terella A, Day C, Walker B, et al. Spontaneous resolution of chronic hepatitis C virus disease after withdrawal of immunosuppression. Gastroenterology. 2003;124:1946-9. 8. Bertoletti A, Ferrari C. Kinetics of the immune response during HBV and HCV infection. Hepatology. 2003;38:4-13. 9. Ward S, Lauer G, Isba R, Walker B, Klenerman P. Cellular immune responses against hepatitis C virus: the evidence base 2002. Clin Exp Immunol. 2002;128:195-203. 10. Walewski J, Keller T, Stump D, Branch A. Evidence for a new hepatitis C virus antigen encoded in an overlapping reading frame. RNA. 2001;7:710-21. 11. Xu Z, Choi J, Yen T, Lu W, Strohecker A, Govindarajan S, et al. Synthesis of a novel hepatitis C virus protein by ribosomal frameshift. EMBO J. 2001;20:3840-8. 12. Racanelli V, Rehermann B. Hepatitis C virus infection: when silence is deception. Trends Immunol. 2003;24:456-64. 13. Neumann A, Lam N, Dahari H, Gretch D, Wiley T, Layden T, et al. Hepatitis C viral dynamics in vivo and the antiviral efficacy of interferon-α therapy. Science. 1998;282:103-7. 474 Med Clin (Barc). 2007;129(12):469-76 14. Gil-Guerrero L, Sarobe P, Prieto J. Nuevos tratamientos para la hepatitis C. Med Clin (Barc). 2006;127:104-12. 15. Bain C, Fatmi A, Zoulim F, Zarski J, Trepo C, Inchauspe G. Impaired allostimulatory function of dendritic cells in chronic hepatitis C infection. Gastroenterology. 2001;120:512-24. 16. Sung V, Shimodaira S, Doughty A, Picchio G, Can H, Yen T, et al. Establishment of B-cell lymphoma cell lines persistently infected with hepatitis C virus in vivo and in vitro: the apoptotic effects of virus infection. J Virol. 2003;77:2134-46. 17. Thimme R, Oldach D, Chang K, Steiger C, Ray S, Chisari F. Determinants of viral clearance and persistence during acute hepatitis C virus infection. J Exp Med. 2001;194:1395-406. 18. Major M, Mihalik K, Fernández J, Seidman J, Kleiner D, Kolykhalov A, et al. Long-term follow-up of chimpanzees inoculated with the first infectious clone for hepatitis C virus. J Virol. 1999;73:3317-25. 19. Bassett S, Guerra B, Brasky K, Miskovsky E, Houghton M, Klimpel G, et al. Protective immune response to hepatitis C virus in chimpanzees rechallenged following clearance of primary infection. Hepatology. 2001;33:1479-87. 20. Shimizu Y, Weiner A, Rosenblatt J, Wong D, Shapiro M, Popkin T, et al. Early events in hepatitis C virus infection of chimpanzees. Proc Natl Acad Sci U S A. 1990;87:6441-4. 21. Nascimbeni M, Mizukoshi E, Bosmann M, Major M, Mihalik K, Rice C, et al. Kinetics of CD4+ and CD8+ memory T-cell responses during hepatitis C virus rechallenge of previously recovered chimpanzees. J Virol. 2003;77:4781-93. 22. Shoukry N, Grakoui A, Houghton M, Chien D, Ghrayeb J, Reimann K, et al. Memory CD8+ T cells are required for protection from persistent hepatitis C virus infection. J Exp Med. 2003;197:1645-55. 23. Grakoui A, Shoukry N, Woollard D, Han J, Hanson H, Ghrayeb J, et al. HCV persistence and immune evasion in the absence of memory T cell help. Science. 2003;302:659-62. 24. Thimme R, Bukh J, Spangenberg H, Wieland S, Pemberton J, Steiger C, et al. Viral and immunological determinants of hepatitis C virus clearance, persistence, and disease. Proc Natl Acad Sci U S A. 2002; 99:15661-8. 25. Alter M, Margolis H, Krawczynski K, Judson F, Mares A, Alexander W, et al. The natural history of community-acquired hepatitis C in The United States. N Engl J Med. 1992;327:1899-905. 26. Lechner F, Wong D, Dunbar P, Chapman R, Chung R, Dohrenwend P, et al. Analysis of successful immune responses in person infected with hepatitis C virus. J Exp Med. 2000;191:1499-512. 27. Gremion C, Cerny A. Hepatitis C virus and the immune system: a concise review. Rev Medical Virol. 2005;15:235-68. 28. Urbani S, Amadei B, Fisicaro P, Tola D, Orlandini A, Sacchelli L, et al. Outcome of acute hepatitis C is related to virus-specific CD4 function and maturation of antiviral memory CD8 responses. Hepatology. 2006; 44:126-39. 29. Fialaire P, Payan C, Vitour D, Chennebault J, Loison J, Pichard E, et al. Sustained disappearance of hepatitis C viremia in patients receiving protease inhibitor treatment for human immunodeficiency virus infection. J Infect Dis. 1999;180:574-5. 30. Gruener N, Jung M, Ulsenheimer A, Gerlach T, Diepolder H, Schirren C, et al. Hepatitis C virus eradication associated with hepatitis B virus superinfection and development of a hepatitis B virus specific T cell response. J Hepatol. 2002;37:866-9. 31. Lauer G, Kim A. Spontaneous resolution of chronic hepatitis C virus infection: are we missing something? Clin Infect Dis. 2006;42:953-4. 32. Scott J, McMahon B, Bruden D, Sullivan D, Homan C, Christensen C, et al. High rate of spontaneous negativity for hepatitis C virus RNA after establishment of chronic infection in Alaska natives. Clin Infect Dis. 2006;42:945-52. 33. Fried M, Shiffman M, Reddy K, Smith C, Marinos G, Goncales F, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med. 2002;347:975-82. 34. Chander G, Sulkowski M, Jenckes M, Torbenson M, Herlong H, Bass E, et al. Treatment of chronic hepatitis C: a systematic review. Hepatology. 2002;36:S135-S44. 35. Manns M, McHutchison J, Gordon S, Rustgi V, Shiffman M, Reindollar R, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet. 2001;358:958-65. 36. Farci P, Muñoz S, Shimoda A, Govindarajan S, Wong D, Coiana A, et al. Experimental transmission of hepatitis C virus-associated fulminant hepatitis to a chimpanzee. J Infect Dis. 1999;179:1007-11. 37. López M, Soriano V, Benito J. Escape mutations in HIV infection and its impact on CD8+ T cell responses. Curr Mol Med. En prensa 2007. 38. Kaech S, Ahmed R. Immunology. CD8 T cells remember with a little help. Science. 2003;300:263-5. 39. Matloubian M, Concepcion R, Ahmed R. CD4+ T cells are required to sustain CD8+ cytotoxic T-cell responses during chronic viral infection. J Virol. 1994;68:8056-63. 40. Harari A, Petitpierre S, Vallelian F, Pantaleo G. Skewed representation of functionally distinct populations of virus-specific CD4 T cells in HIV1-infected subjects with progressive disease: changes after antiretroviral therapy. Blood. 2004;103:966-72. Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C 41. Nixon D, McMichael A. Cytotoxic T-cell recognition of HIV proteins and peptides. AIDS. 1991;5:1049-59. 42. Levy J, Mackewicz C, Barker E. Controlling HIV pathogenesis: the role of the noncytotoxic anti-HIV response of CD8+ T cells. Immunol Today. 1996;17:217-24. 43. Yang O, Walker B. CD8+ cells in human immunodeficiency virus type I pathogenesis: cytolytic and noncytolytic inhibition of viral replication. Adv Immunol. 1997;66:273-311. 44. Dutoit V, Ciuffreda D, Comte D, Gonvers J, Pantaleo G. Differences in HCV-specific T cell responses between chronic HCV infection and HIV/HCV co-infection. Eur J Immunol. 2005;35:3493-504. 45. Su A, Pezacki J, Wodicka L, Brideau A, Supekova L, Thimme R, et al. Genomic analysis of the host response to hepatitis C virus infection. Proc Natl Acad Sci U S A. 2002;99:15669-74. 46. Cooper S, Erickson A, Adams E, Kansopon J, Weiner A, Chien D, et al. Analysis of a successful immune response against hepatitis C virus. Immunity. 1999;10:439-49. 47. Cheney I, Lai V, Zhong W, Brodhag T, Dempsey S, Lim C, et al. Comparative analysis of anti-hepatitis C virus activity and gene expression mediated by alpha, beta, and gamma interferons. J Virol. 2002; 76:11148-54. 48. Guidotti L, Ishikawa T, Hobbs M, Matzke B, Schreiber R, Chisari F. Intracellular inactivation of the hepatitis B virus by cytotoxic T lymphocytes. Immunity. 1996;4:25-36. 49. Major M, Mihalik K, Puig M, Rehermann B, Nascimbeni M, Rice C, et al. Previously infected and recovered chimpanzees exhibit rapid responses that control hepatitis C virus replication upon rechallenge. J Virol. 2002;76:6586-95. 50. Urbani S, Boni C, Missale G, Elia G, Cavallo C, Massari M, et al. Virusspecific CD8+ lymphocytes share the same effectormemory phenotype but exhibit functional differences in acute hepatitis B and C. J Virol. 2002;76:12423-34. 51. Gruener N, Lechner F, Jung M, Diepolder H, Gerlach T, Lauer G, et al. Sustained dysfunction of antiviral CD8+ T lymphocytes after infection with hepatitis C virus. J Virol. 2001;75:5550-8. 52. Wedemeyer H, He X, Nascimbeni M, Davis A, Greenberg H, Hoofnagle J, et al. Impaired effector function of hepatitis C virus-specific CD8+ T cells in chronic hepatitis C virus infection. J Immunol. 2002;169:3447-58. 53. Fuller M, Hildeman D, Sabbaj S, Gaddis D, Tebo T, Shang L, et al. Cutting edge: emergence of CD127 high viral loads and inadequate T cell help. J Immunol. 2005;174:5926-30. 54. Ferrari C, Penna A, Bertoletti A, Valli A, Degli Antoni A, Giuberti T, et al. Cellular immune response to hepatitis B virus encoded antigens in acute and chronic hepatitis B virus infection. J Immunol. 1990;145:3442-9. 55. Rehermann B, Fowler P, Sidney J, Person J, Redeker A, Brown M, et al. The cytotoxic T lymphocyte response to multiple hepatitis B virus polymerase epitopes during and after acute viral hepatitis. J Exp Med. 1995;181:1047-58. 56. Diepolder H, Zachoval R, Hoffmann R, Wierenga E, Santantonio T, Jung M, et al. Possible mechanism involving T lymphocyte response to non-structural protein 3 in viral clearance in acute hepatitis C virus infection. Lancet. 1995;346:1006-7. 57. Takaki A, Wiese M, Maertens G, Depla E, Seifert U, Liebetrau A, et al. Cellular immune responses persist and humoral responses decrease two decades after recovery from a single-source outbreak of hepatitis C. Nat Med. 2000;6:578-82. 58. Rehermann B, Ferrari C, Pasquinelli C, Chisari F. The hepatitis B virus persists for decades after patients’ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med. 1996;2:1104-8. 59. Semmo N, Day C, Ward S, Lucas M, Harcourt G, Loughry A, et al. Preferential loss of IL-2-secreting CD4+ T helper cells in chronic HCV infection. Hepatology. 2005;41:1019-28. 60. Brooks D, Teyton L, Oldstone M, McGavern D. Intrinsic functional dysregulation of CD4 T cells occurs rapidly following persistent viral infection. J Virol. 2005;79:10514-27. 61. He X, Rehermann B, López-Labrador F, Boisvert J, Cheung R, Mumm J, et al. Quantitative analysis of hepatitis C virus-specific CD8(+) T cells in peripheral blood and liver using peptide-MHC tetramers. Proc Natl Acad Sci U S A. 1999;96:5692-7. 62. Rehermann B, Chang K, McHutchison J, Kokka R, Houghton M, Chisari F. Quantitative analysis of the peripheral blood cytotoxic T lymphocyte response in patients with chronic hepatitis C virus infection. J Clin Invest. 1996;98:1432-40. 63. Crispe I. Hepatic T cells and liver tolerance. Nat Rev Immunol. 2003; 3:51-62. 64. Koziel M. Influence of HIV co-infection on hepatitis C immunopathogenesis. J Hepatol. 2006;44:S14-S8. 65. Gane E, Portmann B, Naoumov N, Smith H, Underhill J, Donaldson P, et al. Long-term outcome of hepatitis C infection after liver transplantation. N Engl J Med. 1996;334:815-20. 66. Gale M, Foy EM. Evasion of intracellular host defence by hepatitis C virus. Nature. 2005;436:939-45. 67. Erickson A, Kimura Y, Igarashi S, Eichelberger J, Houghton M, Sidney J, et al. The outcome of hepatitis C virus infection is predicted by escape mutations in epitopes targeted by cytotoxic T lymphocytes. Immunity. 2001;15:883-95. 68. Chang K, Rehermann B, McHutchison J, Pasquinelli C, Southwood S, Sette A, et al. Immunological significance of cytotoxic T lymphocyte epitope variants in patients chronically infected by the hepatitis C virus. J Clin Invest. 1997;100:2376-85. 69. Shimizu Y, Hijikata M, Iwamoto A, Alter H, Purcell R, Yoshikura H. Neutralizing antibodies against hepatitis C virus and the emergence of neutraliziation escape mutant viruses. J Virol. 1994;68:1494-500. 70. Frasca L, Del Porto P, Tuosto L, Marinari B, Scotta C, Carbonari M, et al. Hypervariable region 1 variants act as TCR antagonists for hepatitis C virus-specific CD4+ T cells. J Immunol. 1999;163:650-8. 71. Rehermann B, Pasquinelli C, Mosier S, Chisari F. Hepatitis B virus (HBV) sequence variation of cytotoxic T lymphocyte epitopes is not common in patients with chronic HBV infection. J Clin Invest. 1995;96:1527-34. 72. Tsai S, Chen Y, Chen M, Huang C, Sheen I, Yeh C, et al. Hepatitis C virus variants circumventing cytotoxic T lymphocyte activity as a mechanism of chronicity. Gastroenterology. 1998;115:954-65. 73. Timm J, Lauer G, Kavanagh D, Sheridan I, Kim A, Lucas M, et al. CD8 epitope escape and reversion in acute HCV infection. J Exp Med. 2004; 200:1593-604. 74. Farci P, Shimoda A, Coiana A, Díaz G, Peddis G, Melpolder J, et al. The outcome of acute hepatitis C predicted by the evolution of the viral quasispecies. Science. 2000;288:339-44. 75. Weiner A, Erickson A, Kansopon J, Crawford K, Muchmore E, Hughes A, et al. Persistent hepatitis C virus infection in a chimpanzee is associated with emergence of a cytotoxic T lymphocyte escape variant. Proc Natl Acad Sci U S A. 1995;92:2755-9. 76. Thomson M, Nascimbeni M, Gonzales S, Murthy K, Rehermann B, Liang T. Emergence of a distinct pattern of viral mutations in chimpanzees infected with a homogeneous inoculum of hepatitis C virus. Gastroenterology. 2001;121:1226-33. 77. Large M, Kittlesen D, Hahn Y. Suppression of host immune response by the core protein of hepatitis C virus: possible implications for hepatitis C virus persistence. J Immunol. 1999;162:931-8. 78. Kittlesen D, Chianese-Bullock K, Yao Z, Braciale T, Hahn Y. Interaction between complement receptor gC1qR and hepatitis C virus core protein inhibits T-lymphocyte proliferation. J Clin Invest. 2000;106:1239-49. 79. Welsh R. Assessing CD8 T cell number and dysfunction in the presence of antigen. J Exp Med. 2001;193:F19-F22. 80. Barnaba V, Franco A, Alberti A, Benvenuto R, Balsano F. Selective killing of hepatitis B envelope antigen-specific B cells by class I-restricted, exogenous antigen-specific T lymphocytes. Nature. 1990;345:258-60. 81. Kanto T, Hayashi N, Takehara T, Tatsumi T, Kuzushita N, Ito A, et al. Impaired allostimulatory capacity of peripheral blood dendritic cells recovered from hepatitis C virus-infected individuals. J Immunol. 1999;162:5584-91. 82. Sarobe P, Lasarte J, Zabaleta A, Arribillaga L, Arina A, Melero I, et al. Hepatitis C virus structural proteins impair dendritic cell maturation and inhibit in vivo induction of cellular immune responses. J Virol. 2003;77:10862-71. 83. Tseng C, Klimpel G. Binding of the hepatitis C virus envelope protein E2 to CD81 inhibits natural killer cell functions. J Exp Med. 2002; 195:43-9. 84. Crotta S, Stilla A, Wack A, D’Andrea A, Nuti S, D’Oro U, et al. Inhibition of natural killer cells through engagement of CD81 by the major hepatitis C virus envelope protein. J Exp Med. 2002;195:35-41. 85. Bertoletti A, Costanzo A, Chisari F, Levrero M, Artini M, Sette A, et al. Cytotoxic T lymphocyte response to a wild type hepatitis B virus epitope in patients chronically infected by variant viruses carrying substitutions within the epitope. J Exp Med. 1994;180:933-43. 86. Valitutti S, Muller S, Cella M, Padovan E, Lanzavecchia A. Serial triggering of many T-cell receptors by a few peptide-MHC complexes. Nature. 1995;375:148-51. 87. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu Y, et al. Immunobiology of dendritic cells. Annu Rev Immunol. 2000;18:767-811. 88. Piccioli D, Sbrana S, Melandri E, Valiante N. Contact-dependent stimulation and inhibition of dendritic cells by natural killer cells. J Exp Med. 2002;195:335-41. 89. Koziel M, Dudley D, Afdhal N, Grakoui A, Rice C, Choo Q, et al. HLA class I-restricted cytotoxic T lymphocytes specific for hepatitis C virus. Identification of multiple epitopes and characterization of patterns of cytokine release. J Clin Invest. 1995;96:2311-21. 90. Crispe I, Dao T, Klugewitz K, Mehal W, Metz D. The liver as a site of Tcell apoptosis: graveyard, or killing field? Immunol Rev. 2000;174:47-62. 91. Feld J, Hoofnagle J. Mechanism of action of interferon and ribavirin in treatment of hepatitis C. Nature. 2005;436:967-72. 92. Rahman F, Heller T, Sobao Y, Mizukoshi E, Nascimbeni M, Alter H, et al. Effects of antiviral therapy on the cellular immune response in acute hepatitis C. Hepatology. 2004;40:87-97. 93. Kamal S, Fehr J, Roesler B, Peters T, Rasenack J. Peginterferon alone or with ribavirin enhances HCV-specific CD4+ T-helper 1 responses in patients with chronic hepatitis C. Gastroenterology. 2002;123:1070-83. 94. Tilg H. New insights into the mechanisms of interferon · an immunoregulatory and anti-inflammatory cytokine. Gastroenterology. 1997;112: 1017-21. 95. Kamal S, Ismail A, Graham C, He Q, Rasenack J, Peters T, et al. Pegylated interferon alpha therapy in acute hepatitis C: relation to hepatitis C virus-specific T cell response kinetics. Hepatology. 2004;39:1721-31. Med Clin (Barc). 2007;129(12):469-76 475 Documento descargado de http://www.elsevier.es el 02/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. RALLÓN NI ET AL. RESPUESTA INMUNITARIA CELULAR ADAPTATIVA FRENTE A LA INFECCIÓN POR EL VIRUS DE LA HEPATITIS C 96. Tam R, Pai B, Bard J, Lim C, Averett D, Phan U, et al. Ribavirin polarizes human T cell responses towards a type 1 cytokine profile. J Hepatol. 1999;30:376-82. 97. Layden-Almer J, Ribeiro R, Wiley T, Perelson A, Layden T. Viral dynamics and response differences in HCV-infected African American and white patients treated with IFN and ribavirin. Hepatology. 2003;37: 1343-50. 98. Bekisz J, Schmeisser H, Hernández J, Goldman N, Zoon K. Human interferons alpha, beta and omega. Growth Factors. 2004;22:243-51. 99. Sen G. Viruses and interferons. Annu Rev Microbiol. 2001;55:255-81. 100. Lau J, Tam R, Liang T, Hong Z. Mechanism of action of ribavirin in the combination treatment of chronic HCV infection. Hepatology. 2002; 35:1002-9. 101. Maag D, Castro C, Hong Z, Cameron C. Hepatitis C virus RNA-dependent RNA polymerase (NS5B) as a mediator of the antiviral activity of ribavirin. J Biol Chem. 2001;276:46094-8. 102. Graci JD, Cameron CE. Challenges for the development of ribonucleoside analogues as inducers of error catastrophe. Antivir Chem Chemother. 2004;15:1-13. 103. Rendón AL, Núñez M, Romero M, Barreiro P, Martín-Carbonero L, García-Samaniego J, et al. Early monitoring of ribavirin plasma concentrations may predict anemia and early virologic response in HIV/hepatitis C virus-coinfected patients. J Acquir Immune Defic Syndr. 2005;39:401-5. 104. Núñez M, Camino N, Ramos B, Berdun MA, Barreiro P, Losada E, et al. Impact of ribavirin exposure on early virological response to hepatitis C therapy in HIV-infected patients with chronic hepatitis C. Antivir Ther. 2005;10:657-62. 105. Capa L, Soriano V, García-Samaniego J, Núñez M, Romero M, De Mendoza C, et al. Evolution of T cell responses to hepatitis C virus (HCV) during pegylated interferon plus ribavirin treatment in HCV-monoinfected and HCV-HIV coinfected patients. Antivir Ther. En prensa 2007. 476 Med Clin (Barc). 2007;129(12):469-76 106. Sreenarasimhaiah J, Jaramillo A, Crippin J, Lisker-Melman M, Chapman W, Mohanakumar T. Concomitant augmentation of type 1 CD4+ and CD8+ T-cell responses during successful interferon-α and ribavirin treatment for chronic hepatitis C virus infection. Hum Immunol. 2003; 64:497-504. 107. Vertuani S, Bazzaro M, Gualandi G, Micheletti F, Marastoni M, Fortini C, et al. Effect of interferon-α therapy on epitope-specific cytotoxic T lymphocyte responses in hepatitis C virus-infected individuals. Eur J Immunol. 2002;32:144-54. 108. Lohr H, Schmitz D, Arenz M, Weyer S, Gerken G, Meyer zum Buschenfelde K. The viral clearance in interferon-treated chronic hepatitis C is associated with increased cytotoxic T cell frequencies. J Hepatol. 1999;31:407-15. 109. Lauer G, Lucas M, Timm J, Ouchi K, Kim A, Day C, et al. Full-breadth analysis of CD8+ T-cell responses in acute hepatitis C virus infection and early therapy. J Virol. 2005;79:12979-88. 110. Kaplan D, Sugimoto K, Ikeda F, Stadanlick J, Valiga M, Shetty K, et al. T-cell response relative to genotype and ethnicity during antiviral therapy for chronic hepatitis C. Hepatology. 2005;41:1365-75. 111. Barnes E, Harcourt G, Brown D, Lucas M, Phillips R, Dusheiko G, et al. The dynamics of T-lymphocyte responses during combination therapy for chronic hepatitis c virus infection. Hepatology. 2002;36:743-54. 112. Tang K, Hermann E, Cooksley H, Tatman N, Chokshi S, Williams R, et al. Relationship betwen early HCV kinetics and T-cell reactivity in chronic hepatitis C genotype 1 during peginterferon and ribavirin therapy. J Hepatol. 2005;43:776-82. 113. Benito JM, López M, Lozano S, Martínez P, Kuroda M, González-Lahoz J, et al. Phenotype and functional characteristics of HIV-specific cytotoxic CD8+ T cells in chronically infected patients: dual effects of highly active antiretroviral therapy. J Acquir Immune Defic Syndr. 2003;34: 255-66.