Estudios de caso
Anuncio

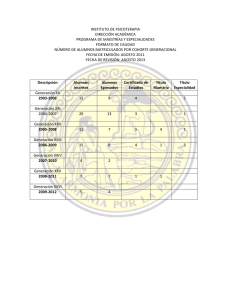
Farmacología Clínica/18-10-2005 Estudios epidemiológicos con medicamentos. Diseños de casos y controles y de cohortes i Dr. Jesús Frías Iniesta Farmacoepidemiología-Definición i i Farmacoepidemiología es la ciencia que estudia el impacto de los fármacos en poblaciones humanas utilizando para ello el método epidemiológico. Es la aplicación del conocimiento, método y razonamiento epidemiológicos al estudio de los efectos y usos de los fármacos en poblaciones humanas. Objetivo de la farmacoepidemiología i describir, explicar, controlar y predecir los efectos y usos de los tratamientos farmacológicos en un periodo de tiempo, espacio y población. ¿Como se evalúa la seguridad de un medicamento? EFICACIA Alta frecuencia > Placebo ++++ ++ SEGURIDAD Baja frecuencia > Placebo ENSAYO CLINICO ++ ESTUDIOS OBSERVACIONALES +++ NOTIFICACION ESPONTANEA ++++ Tipos de estudios en farmacoepidemiología i i Estudios observacionales: el investigador no introduce modificaciones en la población estudiada y observa las condiciones (¿reales?) del uso de los medicamentos. 8 Series de casos 8 Correlaciones ecológicas 8 Estudios transversales 8 Estudios analíticos de casos y controles 8 Estudios de cohortes Estudios experimentales: el investigador modifica alguna de las condiciones basales para permitir la comparación entre grupos 8 Ensayo clínico. INFORME DE CASOS i i i i i i i Menos de 10 casos 20-30% de artículos originales publicados Describen RAM raras Fuente de hipótesis No confirman asociaciones No dan frecuencias Muy susceptibles a sesgos SERIE DE CASOS i i i i i i >10 casos Permite evaluar el papel del azar Pruebas estadísticas No existe grupo de comparación Las causas se examinan retrospectivamente Valor limitado en el estudio del pronóstico y relaciones causa-efecto CONFIDENCIAL NOTIFICACION DE SOSPECHA DE REACCION ADVERSA A UN MEDICAMENTO 1. Por favor, notifique todas las reacciones a fármacos recientemente introducidos en el mercado y las reacciones graves o raras a otros fármacos (vacunas, productos estomatológicos y quirúrgicos, DIU, suturas, lentes de contacto y líquidos deben ser considerados medicamentos). 2. Notifique en la primera línea el fármaco que considere más sospechoso de haber producido la reacción, o bien ponga un asterisco junto al nombre de los medicamentos sospechosos, si cree que hay más de uno. 3. Notifique todos los demás fármacos, incluidos los de automedicación, tomados en los tres meses anteriores. Para malformaciones congénitas, notifique todos los fármacos tomados durante la gestación. 4. No deje de notificar por desconocer una parte de la información que le pedimos “Tarjeta Amarilla” NOMBRE DEL PACIENTE Sexo Edad Peso (Kg.) Masculino (Con la finalidad de saber si se ha repetido alguna reacción). (Indique también el número de historia para los pacientes hospitalizados). Femenino MEDICAMENTO (S)* Dosis diaria y vía admón. (Indique el nombre comercial) Fecha Motivo de la prescripción Comienzo Final (Vease nota 2) * Para ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... las vacunas, indique el número de lote. Fecha REACCIONES Desenlace Final Comienzo ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... ....../....../...... OBSERVACIONES ADICIONALES (P. Ej. recuperado, secuelas, mortal, etc.) Requirió ingreso SI NO (Emplee hojas adicionales si lo requiere) NOTIFICADOR Nombre .......................................................................... Profesión ........................................................................ Especialidad ................................................................... Centro de Trabajo .......................................................... Teléfono de contacto ..................................................... Pot favor, marque con una cruz si necesita más tarjetas, Marque con una cruz si quiere informe, ....../....../...... Fecha .................. Firma Secuencia temporal Efecto de la retirada Reexposición Causas alternativas Otras enfermedades Otros fármacos Gravedad Conocimiento previo Estudios analíticos observacionales i constituyen una alternativa para contrastar hipótesis causales en la que los investigadores siguen un determinado método que permite calcular un parámetro que mide la fuerza de la asociación entre efectos y factores causales respetando las condiciones habituales de la practica clínica. Estudios de cohorte Estudios de cohorte. Descripción (1) i Estudio observacional, no experimental. i Analítico, permite estudiar asociaciones. i Los grupos de comparación se seleccionan en base a la EXPOSICIÓN objeto de estudio i Dirección del estudio: de la Exposición a la Enfermedad Estudios de cohorte. Descripción (2) i i i i El objetivo es demostrar que un fármaco se asocia a la aparición de uno o más acontecimientos adversos Se identifican dos muestras que sólo se diferencian en estar o no expuestas al fármaco en estudio En términos estadísticos la variable tratamiento es la variable independiente Permite analizar la asociación de un fármaco con varios eventos adversos, los eventos adversos son en término estadístico las variables dependientes Estudios de cohorte. Ejemplo i i Objetivo: Estudiar si el uso de anticonceptivos orales se asocia con infarto de miocardio y embolismo pulmonar. Se eligen dos muestras de mujeres, unas usuarias de anticonceptivos orales, la otra de cualquier otro método anticonceptivo. Estudios de cohorte Exposición Enfermedad Sí Sí No Población Muestra Tiempo Sí No No Objetivo conceptual de un estudio de cohortes i i Obtener un parámetro de medida de la fuerza de la asociación entre un factor de riesgo (una exposición, un medicamento) y una enfermedad o efecto beneficioso determinado. Este parámetro en los estudios de cohorte se llama riesgo relativo Estudios de cohorte: Análisis de los datos- La asociación RAM Expuestos A B No expuestos C D Incidencia en expuestos RR= No RAM Incidencia en no expuestos A/(A+B) IC95%> 1 C/(C+D) RR≠1 p>0,05 = Estudios de cohorte . EXPUESTOS i i Debe definirse cómo se considera en cada paciente de forma individual si ha estado expuesto. 8 Depende del mecanismo por el cual se cree que el medicamento produce la enfermedad. 8 Depende de la patogenia de la enfermedad. 8 Se define entonces una ventana de tiempo de exposición. Analizar distintas ventanas de tiempo de exposición aporta información sobre el período de tiempo en el que el riesgo es mayor y cuánto tiempo después de retirar un medicamento el riesgo se normaliza. Estudios de cohorte. OBTENCION DE LA INFORMACION LA ENFERMEDAD 8 Certificados de defunción 8 Historias clínicas. 8 Bases de datos de salud informatizadas. LA EXPOSICION 8 Búsqueda de la exposición al fármaco. 8 Cuestionarios: No conocer la hipótesis que se está analizando. 8 Es preferible utilizar datos obtenidos antes de la aparición de la enfermedad o acontecimiento adverso objeto del estudio. Errores sistemáticos o sesgos DE SELECCIÓN 8 ERRORES EN LA FORMA DE INCLUIR LOS INDIVIDUOS EN EL ESTUDIO. 8 Grupo de Comparación Inadecuado 8 Introducción/Eliminación desigual de Casos latentes (Migración) 8 Interferencia de Factores pronósticos mal evaluados Errores sistemáticos o sesgos DE OBSERVACION i ERRORES EN LA OBTENCION DE LA INFORMACION UNA VEZ QUE LOS INDIVIDUOS HAN SIDO INCLUIDOS EN EL ESTUDIO. 8 Pérdidas Selectivas en el Seguimiento. 8 Mala Clasificación de la Enfermedad o de la Exposición. 8 Enfermedad Asociada a factores diferentes de la Exposición 8De Recuerdo 8De Detección EL PODER, EL TAMAÑO DE LA MUESTRA i i La incidencia es una variable con distribución de Poisson Los cuatro factores que determinan el tamaño muestral en un estudio de cohorte son: 8 El RR que se considera clínicamente relevante 8 El grado de certeza deseado para que una asociación detectada no se deba al azar (error α) 8 La probabilidad que se considera aceptable de que una asociación real no sea detectada (error β) 8 La incidencia esperada de la enfermedad o enfermedades a estudio en la población analizada. DEL RIESGO RELATIVO AL RIESGO ATRIBUIBLE i i i i La incidencia de una enfermedad en el grupo tratado es de 0,1 por 1000 personas año frente a una incidencia en el grupo control de 0,01 por 1000 personas año. El RR es de 10, lo que indica que existe una fuerte asociación entre la exposición al fármaco y la enfermedad El riesgo real atribuible al fármaco es la diferencia entre ambas incidencias e igual a 0,09 por 1000 personas año, es decir 9 de cada 100.000 tratados al año. Si el riesgo atribuible al fármaco se divide entre la incidencia entre los expuestos se obtiene la fracción etiológica o porcentaje del riesgo atribuible. Da una idea de la cantidad de enfermedad en una población que puede ser prevenida si se elimina el factor de exposición. En este ejemplo el 9% i Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52 705 women with breast cancer and 108 411 women without breast cancer. Lancet 1997; 350: 1047-1059. 8 Objetivo: Reanálisis de la evidencia epidemiológica existente, acerca de la relación entre el riesgo de cáncer de mama y el uso de la THS. 8 Métodos: Meta-análisis de 51 estudios epidemiológicos de 52 705 mujeres con cáncer de mama y 108 411 mujeres sin cáncer. El análisis principal estaba basado en 53 865 mujeres con menopausia a una edad conocida de las cuales el 33% había usado THS en algún momento. 8 Resultados: Estudios caso-control Estudios de caso-control. Descripción i i i i i Estudio observacional, no experimental. Analítico, permite estudiar asociaciones. Su razonamiento se basa en detectar el efecto (enfermedad) objeto de estudio e investigar los factores de riesgo asociados. Se selecciona una serie de pacientes que presentan la enfermedad a estudiar (CASOS) y se compara su exposición a determinados factores de riesgo con la que se detecta en otra serie de individuos que se diferencian de los casos por no presentar la enfermedad estudiada (CONTROLES). Se compara uno o más factores o características previas al momento en que se define el caso o el control. Estudios caso-control Exposición Enfermedad Sí Sí No Tiempo Población en riesgo Sí Investigación No No Estudios de casocontrol Exposición Enfermedad Sí Sí No Tiempo Población en riesgo Sí Investigación No No i i i i Búsqueda de múltiples causas Útiles en RAM raras La información se recoge retrospectivamente: Sesgos de memoria, énfasis en la entrevista, HC incompleta. Sesgos en la selección de los controles (grupos similares salvo la enfermedad) Estudios de casos y controles definición de CASOS i i i i i Se define, mediante estrictos criterios diagnósticos, la enfermedad. Es preferible que sea una entidad homogénea Se decide la fuente de obtención de los casos 8 HOSPITAL 8 MUESTRA RANDOMIZADA DE UNA POBLACION DEFINIDA Se seleccionan preferiblemente los nuevos casos diagnosticados en un periodo especificado. Los casos deben ser representativos de la población de enfermos, aunque la generalización de los resultados no debe comprometer la validez del estudio. Estudios de casos y controles definición de CONTROLES i i i i i Es el punto más critico del diseño, cada grupo particular de casos requiere consideraciones diferentes. Debe permitir obtener la información de forma similar que en el grupo de los casos. Debe proceder de la misma población y, si se aplican, tener las mismas restricciones o criterios de exclusión. No siempre la fuente más apropiada es la utilizada para elegir los casos. Debe evitarse incluir pacientes con enfermedades asociadas al factor de exposición que se quiere evaluar. Estudios de casos y controles definición de EXPUESTOS i i Debe definirse cómo se considera en cada paciente de forma individual si ha estado expuesto. 8 Depende del mecanismo por el cual se cree que el medicamento produce la enfermedad. 8 Depende de la patogenia de la enfermedad. 8 Se define entonces una ventana de tiempo de exposición. Analizar distintas ventanas de tiempo de exposición aporta información sobre el período de tiempo en el que el riesgo es mayor y cuánto tiempo después de retirar un medicamento el riesgo se normaliza. Estudios de casos y controles Obtención de la información LA ENFERMEDAD 8 las fuentes de obtención : revisión de certificados de defunción, registros de casos, historias clínicas, historias de servicios de admisión o altas hospitalarias y bases de datos de salud informatizadas. LA EXPOSICION 8 Debe ser idéntica en los casos que en los controles. 8 Si se evalúa mediante cuestionarios, el que los realiza debe desconocer si el paciente es caso o control, o ignorar la hipótesis que se está analizando. 8 Es preferible utilizar archivos que se hayan cumplimentado antes de la aparición de la enfermedad o evento objeto del estudio. Estudios de casos y controles. Errores sistemáticos, sesgos De selección 8 Errores en la forma de incluir los individuos en el estudio. De información 8 Errores en la obtención de la información una vez que los individuos han sido incluidos en el estudio. Factores de confusión Objetivo conceptual de un estudio de caso-control i i i Obtener un parámetro de medida de la fuerza de la asociación entre una enfermedad determinada y uno o varios factores de riesgo. Este parámetro en los estudios de caso-control se llama razón de ventaja ( en ingles Odds ratio) En enfermedades poco frecuentes esta OR es un buen estimador del riesgo relativo. Estudio caso-control Caso Control Expuestos A B No expuestos C D A/(A+C) Probabilidad de exposición en los casos Probabilidad de no exposición en los casos OR= Probabilidad de exposición en los controles C/(A+C) = Probabilidad de no exposición en los controles B/(B+D) D/(B+D) = AxD BxC Estudios de casos y controles. El poder, el tamaño de la muestra Los cuatro factores que determinan el tamaño de la muestra en un estudio de casos y controles son: 8 La mínima OR que se considera clínicamente relevante 8 El grado de certeza deseado para que una asociación detectada no se deba al azar (error α) 8 La probabilidad que se considera aceptable de que una asociación real pueda ser detectada (error β) 8 Prevalencia de la exposición al fármaco en el grupo control. 8 Tamaño relativo entre casos y controles CARACTERISTICAS DE LOS ESTUDIOS DE COHORTE VENTAJAS Unico método para establecer INCIDENCIA. Lógica Clínica. Posibilidad de Evaluación NO SESGADA de la Exposición. Evaluación de la relación entre Exposición y Varios Acontecimientos adversos Adversos. INCONVENIENTES Precisa tamaños muestrales muy elevados. Necesita periodos de observación prolongados. Coste elevado. Evalúa un limitado número de factores relacionados con la Exposición y el Acontecimiento Adverso. CARACTERISTICAS DE LOS ESTUDIOS DE CASO-CONTROL VENTAJAS En general de duración limitada. Puede ser el único método de estudiar reacciones adversas poco frecuentes. Permite recoger información especifica y detallada de cada sujeto participante en el estudio Puede no ser costoso. INCONVENIENTES SE limita a una sola reacción adversa Está expuesto a diferentes sesgos No permite registrar la evolución de las variables propias de la enfermedad en estudio. + - •El más robusto •Único que controla todas las variables desconocidas o de confusión •Coste elevado •Artificial •Dificultades logísticas •Dificultades éticas •Múltiples efectos •Exposiciones raras •Sesgo de selección bajo •Exposición no sesgada •Incidencias •Coste •Sesgo de datos de efecto •Duración Caso control •Múltiples exposiciones •Efectos raros •Rápidos y fáciles •Bajo coste •Coste •Sesgo de datos de efecto •Duración Serie de casos •Cuantificación rápida de incidencia aproximada •Ausencia de grupo control Informe de casos •Bajo coste •Método fácil de generar hipótesis Ensayo clínico Estudio de cohortes FUENTES DE INFORMACION UTILIZADAS EN FARMACOLOGIA CLINICA PARA ESTABLECER EL BALANCE BENEFICIO/RIESGO DE LOS MEDICAMENTOS--JERARQUIA METODOLOGICA DE LOS DIFERENTES TIPOS DE ESTUDIOS. i Ensayo clínico controlado aleatorizado. 8 CAUSALIDAD Estudio controlado de cohorte. 8 Estudios de tipo caso-control. ASOCIACIÓN 8Series de casos. MÉTODOS ADECUADOS DE DETECCIÓN TIPO A -E. Clínico (Fase III y IV) -Estudios de cohorte TIPO B -Notificación espontánea o anecdótica -PEM -PEM -Notificación espontánea o anecdótica -Estudios experimentales (animales) -Estudios Caso-Control o Vigilancia Caso-Control -Registros de diagnóstico -Fuentes de datos de morbilidad y uso de fármacos amplias TIPO C -Estudios Caso-Control -Estudios de Cohorte de larga duración -Fuentes de datos de morbilidad y uso de fármacos amplias -PEM de larga duración El futuro-Bases de datos de salud i i i i i i GPRD (VAMP) Medicaid y Compass Puget Sound Cooperative Health Group The Saskatchewan Database PPA ESPES y ECOM