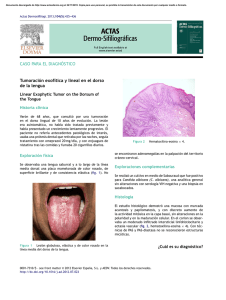
Mecanismos de regulación del represor Nrg1 en C. albicans
Anuncio

TESIS DOCTORAL Mecanismos de regulación del represor Nrg1 en C. albicans Departamento de Ciencias Biomédicas Guadalupe Bermejo Pulido Conformidad del director: Fdo: Jaime Correa Bordes DEPARTAMENTO DE CIENCIAS BIOMÉDICAS Unidad de Microbiología Facultad de Ciencias Avenida de Elvas s/n 06008- BADAJOZ ESPAÑA-SPAIN Jaime Correa Bordes, Profesor Titular de Microbiología, adscrito al Departamento de Ciencias Biomédicas de la Facultad de Ciencias de la Universidad de Extremadura, CERTIFICA: Que la presente Tesis Doctoral, titulada “Mecanismos de regulación del represor Nrg1 en C. albicans”, de la que es autora Dª. Guadalupe Bermejo Pulido, ha sido realizada bajo mi dirección en el Departamento de Ciencias Biomédicas de la Universidad de Extremadura. Que revisada la memoria presentada, el director del trabajo considera que posee las condiciones requeridas para se defendida como un trabajo de Tesis Doctoral. Por todo ello, AUTORIZA: Su presentación y defensa pública frente al tribunal designado al efecto de acuerdo con lo previsto en el Real Decreto 99/2011 de 28 de Enero. Y para que así conste y surta los efectos oportunos, expiden el presente certificado en Badajoz a 14 de octubre de 2015. Fdo: Jaime Correa Bordes Reconocimientos. Para la realización del presente trabajo de Tesis Doctoral hemos recibido la inestimable ayuda de otros investigadores. Por ello, expresamos nuestro agradecimiento: Al Dr. Carlos Vázquez de Aldana y Sara Orellana (IBFG) por su colaboración en los trabajos de microscopía de fluorescencia. Al Profesor Peter Sudbery (Sheffield University) por compartir resultados no publicados sobre la regulación de Nrg1. Al Profesor Alister Brown (Aberdeen University) por compartir reactivos utilizados en este trabajo. Financiación. Este trabajo ha sido financiado con proyectos del Ministerio de Economía y Competitividad (BFU2009-11251 y BFU2012-39910) y del Plan de Ayuda a grupos del Gobierno de Extremadura (GR10008). Toda la financiación recibida está cofinanciada por el programa FEDER de la Unión Europea. Guadalupe Bermejo Pulido ha sido PRE09147 del Gobierno de Extremadura. beneficiaria de la Beca Predoctoral INDICE ABREVIATURAS……………………………………………………………………………………………….. INTRODUCCIÓN 8 1. Epidemiología de C. albicans…………………….……………………………………………. 12 2. Biología de C. albicans…………………………………………………………………………… 13 3. Morfogénesis en C. albicans…………………………………………………………………... 15 4. Señales ambientales y ruta de traducción de señales implicadas en la transición levadura-hifa………………………………………………………………………. 16 4.1. Regulació positiva del crecimiento hifal………………………………………… 19 4.2. Regulación negativa del crecimiento hifal……………………………………... 20 4.2.1. Nrg1 en C. albicans………………………………………………………………. 22 4.2.2. Funciones de Nrg1 en C. albicans………………………………………. 23 4.2.3. Los niveles de Nrg1 disminuyen mediante dos mecanismos en el inicio del crecimiento hifal.………………………………………… 24 4.2.4. La remodelación de la cromatina de los promotores de los promotores de los HSG impide la unión de Nrg1……….. 25 5. Función de la Cdks en la morfogénesis en C. albicans………………………. 26 5.1. Cdks y morfogénesis en S. cerevisiae…………………………………………… 27 5.2. Cdks y morfogénesis en C. albicans……………………………………………... 28 6. NDR quinasas………………………………………………………………………………………… 30 7. La ruta RAM en levaduras….………………………………………………………………… 32 7.1. La ruta RAM en C. albicans……………………………………………………..… 34 MATERIALES Y MÉTODOS 1. Microorganismos utilizados…………………………………...………………………………… 37 2. Medios de cultivos y condiciones de crecimiento………………………………… 37 3. Construcción de cepas…………………………………………………………………………… 38 4. 3.1. Mutagénesis dirigida…………………………………………………………………… 38 3.2. Síntesis génica…………………………………………………………………………….. 39 3.3. Transformación en C. albicans……………………………………………...…… 41 3.4. Transformación de E. coli…………………………………………………………... 41 Técnicas de manipulación de ácidos nucleicos…………………………………… 42 5. 4.1. Obtención de DNA plasmídico…………………………………………………… 42 4.2. Reacciones de amplificación por PCR……………………………………… 4.3. Análisis de transformantes mediante Whole-PCR……………………… 43 4.4. Análisis de transformantes a partir de DNA genómico……………. 43 42 Extracción, detección y análisis de proteínas……………………………………….. 44 5.1. Extracción de proteínas………………………………………………………………... 44 5.2. Western-Blot………………………………………………………………………………….. 45 5.3. Inmunoprecipitación de proteínas…………………………………………………... 46 5.4. Precipitación de proteínas con TCA………………………………………………. 46 5.5. Wester-Blot con geles Phos-Tag……………………………………………………. 47 6. Microscopía……………………………………………………………………………………………. 48 TABLAS………………………………………………………………………………………………………... 49 OBJETIVO…………………………………………………………………………………………………… 54 RESULTADOS 1. Nrg1 se degrada al inicio del crecimiento hifal………………………………….... 56 2. Nrg1 se acumula en los núcleos subapicales de la hifa……………………... 59 3. Nrg1 es una fosfoproteína…………………………….……………………………………….. 60 4. Nrg1 se fosforila rápidamente al inicio del crecimiento hifal……………… 62 5. Quinasas que podrían estar implicadas en la regulación de Nrg1……... 63 6. Caracterización de los sitios SP presentes en Nrg1….……………………….… 64 6.1. El estado de fosforilación de Nrg1 depende de los sitios SP…….. 65 6.2. La degradación de Nrg1 en repuesta a suero depende de los sitios SP…………………………………………………………………...……………………… 67 6.3. El mutanten nrg1-7A responde normalmente a suero…………………. 68 6.4. La proteína Nrg1-7A-GFP se acumula en el núcleo apical de la hifa………………………………………………………………………………………......... 69 6.5. La proteína Nrg1-7A se fosforila en respuesta a suero…………….… 70 7. Caracterización de los sitios consenso de fosforilación por Cbk1……… 71 7.1. El mutante nrg1-2E tiene un fenotipo de pérdida de función…….. 72 7.2. El alelo fosfomimético nrg1-3E da lugar a diferentes fenotipos en los mutantes cbk1∆∆ y kic1∆∆ en presencia de suero……………….... 73 7.3. La degradación de Nrg1 en respuesta a suero depende de Cbk1 pero es independiente de Kic1………………………………………….… 75 7.4. Las células nrg1-3A crece en forma de pseufohifa…………………..…. 77 7.5. La T251 es esencial para garantizar la función represora de Nrg1………………………………………………………………………………………...…. 79 7.6. El fenotipo pseudohifal de nrg1-2A se suprime al eliminar los siete sitios SP…………………………………………………………………………. 81 7.7. La NDR quinas Cbk1 no regula la fosforilación de la T251 durante el crecimiento levaduriforme…………………………………………… 82 7.8. La degradación de Nrg1 en respuesta a suero no depende de la foforilación de los sitios S200, T251 y T281…………………… 83 7.9. La fosforilación de Nrg1 en respuesta a suero es independiente de la NDR quinasa Cbk1……………………..…………………. 84 7.10. La foforilación de Nrg1 en respuesta a suero no depende de los residuos T251 y T281……………………………………………………. 86 DISCUSIÓN 1. Generación de asimetría durante el crecimiento hifal………………………….. 90 2. La degradación de Nrg1 al inicio del crecimiento hifal se regula mediante dos mecanismos independientes…………………………...…… 94 3. Modelo espacial sobre la regulación de Nrg1……………………………………… 98 CONCLUSIONES………………………………………………………………………………………… 101 BIBLIOGRAFÍA…………………………………………………………………………………………………. 104 ABREVIATURAS: ∆ = Disrupción A = Alanina aa = Aminoácidos AcLi = Acetato de litio AcNa = Acetato de sodio Ala = Alanina ADN = Ácido desoxirribonucleico AMPc = Adenosín monofosfato cíclico ARN = Ácido ribonucleico ARNm = Ácido ribonucleico mensajero BSA = Albúmina de suero bovino CDK.= Quinasa dependiente de ciclina C-terminal = Carboxiterminal Cys = Cisteína CoIP = Co-inmunoprecipitación DO = Densidad óptica DTT = 1,4-Ditiotreitol EDTA = Ácido etilendiaminotetraacétio H = Histidina HSG = Hypha-specific genes (Genes específicos de hifas) K = Lisina LATs = Large tumor supressor LM = Low melting M = Molar MAPK = Mitogen-activated protein kinase WB = Western blot 8 MEN = Mitotic exit network Met = Metionina Min = Minutos MM = Medio mínimo MOR = Morphogenesis related NDR kinase NDR = Nuclear Dbf2-related family N-terminal = Amino terminal o/n = Overnight (cultivo nocturno) pb = Pares de bases PBS = Phosphate buffer saline (tampón fosfato salino) PKA = Protein kinase A PCR = Polymerase chain reaction (reacción en cadena de la polimerasa) PEG = Polietilenglicol PMSF = Phenylmethylsulfonyl fluoride PPasa = Fosfatasa R = Arginina RAM = Regulation of Ace2 activity and cellular Morphogenesis Rpm = Revoluciones por minuto RT-qPCR = PCR cuantitativa en tiempo real S = Serina SB = Suero bovino SDS = Sodium dodecyl sulphate (dodecil sulfato sódico) Seg = Segundo SIN = Septación initiation network ssADN = ADN de cadena sencilla T = Treonina TCA = Ácido tricloroacético Thr = Treonina 9 TOR = Target of rapamycin V = Voltios vol. = Volúmenes Wrts = Warts °C = Grado centígrados 10 INTRODUCCIÓN Introducción 1. Epidemiología de Candida albicans Candida albicans es un hongo polimórfico que forma parte de la microbiota del tracto gastrointestinal y urogenital de humanos y otros animales de sangre caliente. En individuos sanos, C. albicans puede proliferar causando infecciones localizadas en de la piel y las mucosas que son normalmente asintomáticas y no necesitan tratamiento. Sin embargo, en condiciones en las que la capacidad del sistema inmunitario se encuentra disminuida, este microorganismo es capaz de penetrar en el torrente sanguíneo y colonizar diferentes tejidos y órganos del hospedador, como riñones, corazón y cerebro. La tasa de mortalidad de las candidiasis sistémicas puede alcanzar el 40%, superior a numerosas infecciones bacterianas (Almirante et al., 2005; Klevay et al., 2008; Leroy et al., 2009) La incidencia de las infecciones de origen fúngico y, particularmente, de aquellas causadas por patógenos oportunistas, como es el caso de C. albicans, han aumentado significativamente en las poblaciones humanas desde la segunda mitad del siglo XX. La aplicación de terapias anti-inflamatorias e inmunosupresoras en pacientes trasplantados o enfermos de cáncer, el abuso de los tratamientos antibióticos, el desarrollo de nuevos dispositivos terapéuticos invasivos, como la implantación de prótesis o los cateterismos, y, más recientemente, la aparición de enfermedades como el SIDA son algunas de las causas del aumento en el número de pacientes inmunocomprometidos, los cuales muestran una elevada susceptibilidad a la invasión por estos microorganismos. Este aumento en los grupos de riesgo junto con la elevada morbilidad y mortalidad de este tipo de infecciones y el consecuente impacto que generan en la estancia media hospitalaria y el coste sanitario las convierten en un problema clínico en expansión (Munoz et al., 2000). En este contexto, las infecciones causadas por C. albicans se encuentran entre las micosis con mayor incidencia actual en las poblaciones europeas. De hecho, es uno de los siete patógenos más frecuentes aislados 12 Introducción en infecciones hospitalarias en pacientes pertenecientes a unidades coronarias y representa la cuarta causa de infecciones sanguíneas (Gudlaugsson et al., 2003). 2. Biología de C. albicans A pesar de su importancia médica, el desarrollo de la biología molecular de este hongo ha sido muy lento, comparado con el de otros microorganismos. Este hecho se debe, en parte, a la imposibilidad de utilizar técnicas de genética clásica, dado que este organismo diploide carece de un ciclo sexual completo. En este contexto, gran parte del conocimiento acerca de procesos básicos en la biología de C. albicans se ha fundamentado en los estudios desarrollados en Saccharomyces cerevisiae. Sin embargo, a pesar de sus similitudes, existen microorganismos. Mientras también que diferencias significativas entre ambos S. cerevisiae es un organismo saprófito característico de nichos con alta disponibilidad de azúcares, C. albicans es un organismo comensal de animales de sangre caliente. A lo largo de su historia evolutiva como comensal, C. albicans ha adquirido la capacidad de adaptarse eficientemente a las diferentes condiciones ambientales que existen en los distintos nichos del hospedador. Esta transición de saprofito a comensal han implicado la adquisición de nuevas organismo adaptarse la habilidad de características que les confieren al eficientemente a las cambiantes condiciones ambientales del huésped. Por ejemplo, C. albicans y otras especies de Candida tienen un código genético único debido al cambio en la identidad del codón de leucina CUG a serina (Santos and Tuite, 1995). Esta ambigüedad en el mecanismo de descodificación de codones afecta aproximadamente a mas de 30.000 codones CUG en más del 50% de los genes (Massey et al., 2003), lo cual favorece la repuesta a estrés y aumenta la tolerancia a altas temperaturas, a dosis letales de metales pesados y a drogas (Sarkany et al., 2014). De modo que la diversidad y versatilidad que presenta el genoma de C. 13 Introducción albicans constituye una de las principales herramienta de adaptación a una gran variedad de nichos de los cuales ha sido aislada. Otra cualidad muy importante de este microorganismo para adaptarse a los distintos nichos del hospedador es su habilidad de realizar transiciones fenotípicas en las que las células cambian su morfología y fisiología de forma reversible en respuesta a distintas señales ambientales. Concretamente, C. albicans puede experimentar cambios morfogenésicos reversibles entre tres formas diferentes: levaduras, pseudohifas e hifas (Odds, 1985), como se esquematiza en la figura 1. Figura 1. Cambios morfogénesicos reversibles en C. albicans. Las células levaduriformes (a) pueden dar lugar tanto a pseudohifas (b) como a hifas verdaderas (c). Las transiciones morfogenésicas entre estas dos últimas formas son mucho menos frecuentes. Tomado de (Berman, 2006) A pesar de que estudios recientes han demostrado que la transición levadura-hifa no siempre es necesaria para la virulencia en candidiasis sistémica (Noble et al., 2010), la morfogénesis aún es considerada un factor de virulencia importante, como lo demuestran evidencias como el hecho de que tanto mutantes deficientes en la formación de hifas (Lo et al., 1997; Zheng and Wang, 2004) como mutantes que forman hifas de forma constitutiva (Braun and Johnson, 1997; Braun et al., 2000) son avirulentos en modelo de ratón. A este respecto, se ha propuesto que las propiedades invasivas de las hifas favorezcan la penetración en los tejidos así como la supervivencia frente a la fagocitosis por células del sistema inmune del hospedador. Las células levaduriformes, por otra parte, serían más eficientes durante el proceso de dispersión por el torrente sanguíneo. observaciones ponen de manifiesto la En cualquier caso, todas estas importancia biomédica del estudio de los procesos morfogenésicos en C. albicans. 14 Introducción 3. Morfogénesis en C. albicans Como ya se ha comentado, C. albicans es un hongo polimórfico capaz de realizar transiciones morfogenésicas reversibles entre tres formas diferentes: células levaduriformes, pseudohifas e hifas. Las levaduras son formas redondeas unicelulares que se dividen por gemación y se separan al finalizar la citoquinesis. Las hifas son estructuras multicelurares que presentan un crecimiento hiperpolarizado e inhibición de la separación celular dando lugar a filamentos en los que las paredes laterales se mantienen paralelas a nivel del septo. Las pseudohifas se representan como una forma intermedia entre Representación esquemática de la morfogénesis en C. albicans. C. albicans puede crecer en tres formas morfológicas diferentes, levaduras Figura 2. pseudohifas e hifas verdaderas. Las células levaduriformes, que completan la separación celular después de la citocinesis, tienen un aspecto ovoideo puesto que el crecimiento polarizado se restringe a una pequeña ventana del ciclo celular durante la transición G1/S. En levaduras, la secreción de nuevos materiales a las zonas de crecimiento activo está facilitada por una estructura multiproteica denominada polarisoma. Las formas pseudohifales suelen presentar un patrón de crecimiento ramificado. Fenotípicamente, pueden definirse como células levaduriformes alargadas que permanecen unidas, mostrando constricciones en las zonas de formación del septo. Al igual que en levaduras, el crecimiento polarizado está facilitado por el polarisoma. Finalmente, las hifas son estructuras multicelulares en las que las células permanecen unidas tras la citocinesis, pero sin mostrar constricciones, como en el caso de las pseudohifas. En estas estructuras el crecimiento hiperpolarizado es continuo e independiente del ciclo celular lo que da lugar a una morfología típicamente tubular. Además, el polarisoma actúa en conjunción con otra estructura multiproteica, característica de hongos filamentosos denominada Spitzerkörper. Tomado de (Whiteway and Bachewich, 2007) 15 Introducción levaduras e hifas y se caracterizan por presentar constricciones en los planos de división de los diferentes compartimentos celulares y por crecer de forma ramificada. En cada uno de los tres tipos celulares se observa un núcleo por célula (Sudbery et al., 2004) (Fig.2) Las diferencias importantes entre levaduras, pseudohifas e hifas incluyen el grado de crecimiento polarizado, la posición del anillo de septina y del septo relativo a la célula madre, el movimiento de los núcleos con respecto a la célula madre y el grado en el cual las células madres son capaces de separarse. También existen diferencias con respecto a las estructuras que controlan el pseudohifas crecimiento el polarizado, crecimiento así, polarizado mientras está que dirigido en por levaduras un y complejo multiproteico que se localiza en el cortex celular denominado polarisoma; en hifas este crecimiento está dirigido por otra estructura denominada Spitzenkörper (Warenda and Konopka, 2002; Crampin et al., 2005). En todos los casos, el proceso de morfogénesis es consecuencia de la polaridad celular. Ésta puede definirse como la distribución asimétrica de proteínas y orgánulos en un lugar concreto, lo que permite a la célula aumentar su superficie de forma asimétrica. El establecimiento y mantenimiento de la polaridad es fundamental en el desarrollo y función de las células. En cualquier caso, la regulación temporal y espacial de la polaridad y la morfogénesis celular es un proceso altamente complejo que implica la integración de múltiples rutas de señalización, entre las que se encuentran aquellas implicadas en la regulación del tamaño y la separación celular. 4. Señales ambientales y rutas de transducción implicadas en la transición levadura-hifa e n C. albicans. C. albicans es un microorganismo perfectamente adaptado para crecer en su hospedador humano y es capaz de desarrollar hifas en respuesta a una amplia variedad de condiciones ambientales, la cuales reflejan la diversidad de microambientes presentes en el hospedador. Por ejemplo, las hifas se forman 16 Introducción en respuesta a la presencia de suero, pH neutro, CO2 al 5% (presión parcial de CO2 en el torrente sanguíneo), N-acetil-D-glucosamina (GlcNAc). Además, el crecimiento hifal es a menudo inducido en medios sintéticos, tales como medio Lee’s; medio Spider (un medio semi-sintético basado en manitol como fuente de carbono) y los medios de cultivo de tejidos de mamíferos como M199. En general, el crecimiento hifal requiere una temperatura de 37°C; a excepción de la filamentación en condiciones de hipóxia, que se produce a 25°C. La combinación de suero y un aumento de temperatura a 37°C es la condición más potente para la formación de tubo germinativo en células levaduriforme. Los medios líquidos se utilizan para inducir crecimiento hifal a tiempos cortos, mientras que los medios sólidos son utilizados para inducir filamentación a tiempos largos El ensayo de cultivo líquido ponen a prueba la capacidad inmediata del organismo para responder a señales ambientales e iniciar el crecimiento altamente polarizado característico de hifas. El ensayo de medio sólido pone a prueba la capacidad del organismo para mantener el crecimiento de hifas en los microambientes complejos y cambiantes, así como la capacidad de invadir sustratos sólidos (Sudbery, 2011) Los cambios morfológicos entre la levadura e hifas también están reguladados por la interacción con la microflora que C. albicans encuentra en su entorno. Por ello, se han descrito mecanismos sofisticados que resultan no sólo de la comunicación entre células de C. albicans sino también de la comunicación con células bacterianas (Shareck and Belhumeur, 2011). Las células de C. albicans detectan la densidad de la población de C. albicans circundante por un mecanismo de “quorum sensing” basado en el sesquiterpeno farnesol, que es secretado al medio e inhibe las formación de hifas (Hornby et al., 2001). Por el contrario, el alcohol aromático tirosol promueve la formación de tubo germinal y la formación de hifas en biofilms (Chen et al., 2004). El crecimiento hifal en C. albicans está sometido a regulaciones positivas a través de distintas ruta de traducción de señales que activan a sus respectivos factores de transcripción, Efg1, Cph1, Czf1, Tec1 y Rim101, 17 Introducción desencadenando la expresión de los denominados genes específicos de hifas (Hypha Specific Genes, HSGs). Además también está regulado negativamente por el represor Tup1 que actúa a través de proteínas de unión al DNA como Figura 3. Rutas de transducción que regulan la morfogénesis en C. albicans. Las rutas de señalización que traducen las señales ambientales que dirigen la transición levadura-hifa en C. albicans han sido estudiadas extensamente. Se ha descrito que al menos dos de estas rutas también actúan en S. cerevisiae con funciones en crecimiento pseudohifal. Una de estas rutas es la ruta AMPc-PKA dependiente, cuyo efector final es el factor de transcripción Efg1 y que tiene un papel esencial en la morfología hifal y la virulencia. La otra ruta es la ruta de MAP quinasas, cuyo efector final es el factor de transcripción Cph1. Ambas rutas están reguladas por Ras1. La respuesta a pH esta mediada por una ruta que activa al factor de transcripción Rim101 y la repuesta de inserción en una matriz embedded está mediada por una ruta que activa el factor de transcripción Czf1. Se ha propuesto que Rim101 y/o Czf1 deben funcionar a través de Efg1 o actuar en paralelo con él. Tup1 y Rbf1 son reguladores negativo del desarrollo hifal. La unión de Tup1 a los promotores de genes específicos de hifas depende de Rfg1, y Nrg1. Tomado de Sudbery 2011. 18 Introducción Nrg1 y Rfg1. En la figura 3 se muestra un esquema detallado la compleja regulación de la transición levadura-hifa a través de las distintas rutas de transducción de señales (Biswas et al., 2007). 4.1. Regulación positiva del crecimiento hifal En C. albicans existen dos rutas de señalización bien caracterizadas, las cuales también actúan en S. cerevisiae en la formación de pseudohifas. Estas rutas son la ruta del AMPc dependiente de la PKA y la ruta MAPK, cuyos efectores finales son Efg1 y Cph1 respectivamente, ambas rutas son a su vez activadas por la proteína Ras (Leberer et al., 1996; Feng et al., 1999) y tienen un papel esencial en la morfogénesis hifal y la virulencia (Hogan and Sundstrom, 2009). El factor de transcripción Efg1 es necesario para la formación de hifas en respuesta a estímulos como el suero, CO2, pH neutro o presencia de GlcNAc en medios líquidos y en medio sólido como el medio Spider (Lo et al., 1997; Stoldt et al., 1997). Por el contrario, Cph1 solo es necesaria para la formación de hifas en medio Spider pero no en medio líquido (Liu et al., 1994; Leberer et al., 1996), por lo cual Efg1 puede ser considerado el principal regulador de la formación de hifas en respuesta a múltiples condiciones (Stoldt et al., 1997). Éste controla la transcripción de muchos genes específicos de hifas (Hypha Specific Genes, HSGs), entre los que se encuentran HWP1 (Braun and Johnson, 1997; Sharkey et al., 1999; Braun et al., 2001), HYR1 (Bailey et al., 1996) y ALS3 (Fu et al., 2002), que codifican para proteínas de la pared celular implicada en adherencia, y ECE1, que codifica para proteínas de elongación celular. También es importante para la expresión de genes del metabolismo, induciendo genes glicolíticos y reprimiendo genes esenciales para el metabolismo oxidativo (Doedt et al., 2004). Por último, EFG1 disminuye la expresión de ERG3, un gen implicado en la resistencia a drogas, por ello mutantes efg1∆∆ son más resistentes a agentes antifúngicos (Lo et al., 2005). 19 Introducción La ruta del cAMP depende de la PKA, ésta tiene dos subunidades catalíticas, Tpk1 y Tpk2 (Bockmuhl et al., 2001; Cloutier et al., 2003), y una subunidad reguladora, Bcy1 (Toda et al., 1987). Tpk1 y Tpk2 tienen diferentes efectos sobre la morfogénesis hifal, así el mutante tpk1∆∆ muestra hifas defectuosas en medios sólidos, este defecto no es tan pronunciado en medios líquidos; por el contrario, el mutante tpk2∆∆, muestra pequeñas anomalías en las hifas en medios sólidos, pero bloquea completamente el crecimiento hifal en medios líquidos. Tpk1 y Tpk2 se diferencian principalmente sus dominios Nterminal (80-90 aminoácidos) (Sonneborn et al., 2000; Bockmuhl et al., 2001). La ruta de MAPK consiste en una cascada de quinasas que engloban a Cst20 (PAK), Hst7 (MAPKK) y Cek1 (MAPK) (Whiteway et al., 1992; Clark et al., 1995; Kohler and Fink, 1996; Leberer et al., 1996; Singh et al., 1997; Csank et al., 1998). Esta ruta se activa cuando la GTPasa Cdc42 se une a Cst20 y a la quinasa Cla4 (Leberer et al., 1997; Su et al., 2005). Mutantes nulos en cualquiera de los genes de la cascada MAPK (cst20∆∆, hst7∆∆, cek1∆∆) o en el factor de transcripción Cph1 muestran defectos en la formación de hifas en medios sólidos en respuesta a muchas condiciones de inducción hifal, pero no en respuesta a suero (Kohler and Fink, 1996; Leberer et al., 1996; Csank et al., 1998). Curiosamente, el mutante cek1∆∆ muestra pequeños defectos en el crecimiento hifal en medios que contienen suero, lo que puede ser la causa de sus defectos en la virulencia. Estos resultados sugieren que Cek1 podría estar funcionando en más de una vía y que su supresión de lugar a un entrecruzamiento anormal entre cascadas MAPK (Biswas et al., 2007). 4.2. Regulación negativa del crecimiento hifal Además de las rutas activadoras, la expresión de los HSGs se encuentra regulada negativamente a través del represor transcripcional Tup1. Este no se une directamente al DNA sino que necesita asociarse a proteínas de unión al DNA, como como Nrg1 o Rfg1 para realizar su función represora (Braun and Johnson, 1997; Braun et al., 2001; Kadosh and Johnson, 2001, 2005). 20 Introducción Aproximadamente la mitad de la represión de Tup1 en C. albicans se lleva a cabo a través de Nrg1 y/o Rfg1 (Kadosh and Johnson, 2005) (Fig. 4) Tup1 se asocia a estas proteínas de unión al DNA para unirse a los promotores de los HSGs y mantener reprimida la expresión de los mismos durante el crecimiento levaduriforme. Consecuentemente con su función, mutantes defectivos en NRG1 o TUP1 activan el crecimiento hifal de forma constitutiva (Braun et al., 2000; Murad et al., 2001), mientras que la sobreexpresión de ambos bloquea la formación de hifas en cualquier tipo de condiciones (Park and Morschhauser, Figura 4. Modelo de control de genes inducidos durante la transición levadurahifas por Nrg1, Rfg1 y Tup1. Nrg1, Rfg1 y, al menos, una proteína más de unión al DNA (X) se unen a los promotores de los genes implicados en la formación de hifas y virulencia y los reprimen a través del co-represor Tup1. Estos represores regulan la expresión de aproximadamente la mitad de estos genes, la otra mitad está regulada por otros mecanismos, posiblemente por activadores transcipcionales. Tomado de (Kadosh and Johnson, 2005). 21 Introducción 2005; Saville et al., 2006). Las proteínas Tup1, Nrg1 y Rfg1 tienen un papel clave en la regulación de los HSGs, reprimiendo aproximadamente la mitad de los genes activados en respuesta a suero y temperatura, pero la otra mitad está regulada de forma independiente a estos represores (Kadosh and Johnson, 2005). Los HSGs regulados por estos represores están vinculados al crecimiento filamentoso y la virulencia de C. albicans, estos incluyen a genes que codifican para las aspartil proteasas (SAP4, SAP5 y SAP6), proteínas de la pared celular (HWP1), adhesinas (ALS3 y ALS8), proteínas de crecimiento invasivo (RBT1, ECE1 y HYR1) (Murad et al., 2001) y para una ciclina de G1 específica de hifas (HGC1) (Zheng and Wang, 2004). 4.2.1. Nrg1 en C. albicans El represor Nrg1 de C. albicans es una proteína de 34kDa, posee una secuencia de exportación nuclear, denominada NES, en el extremo N-terminal y dos dominios de unión al DNA en el extremo C-terminal que consiste en dos Zinc finger (Fig. 5), los cuales presentan alta similitud con la secuencia de unión al DNA de Nrg1 de S. cerevisiae (Braun et al., 2001). Estos dominios hacen que esta proteína pueda unirse a los promotores de sus genes dianas, incluidos los HSGs. Figura 5. Esquema del gen NRG1 de C.albicans, en el que se representa la secuencia de exportación nuclear (NES) y los dos dominios Zn finger, por los que la proteína se une al DNA (ZN) 22 Introducción 4.2.2. Funciones de Nrg1 en C. albicans Nrg1 desempeña diversos papeles en C. albicans (Fig. 6), como hemos mencionado anteriormente, es una de las principales proteínas de unión a ADN que en combinación con Tup1 actúa como un represor de los HSGs (Kadosh and Johnson, 2005), por ello tiene un papel importante en el desarrollo hifal. Muchas condiciones que promueven la transición morfológica provocan estrés en C. albicans (Brown and Gow, 1999) y se sabe que un mutante nrg1∆∆ presenta mayor sensibilidad al estrés oxidativo, tratamiento con etanol y la limitación de carbono. Con lo cual, Nrg1 también desempeña funciones adicionales en algunas de las respuestas a estrés. (Murad et al., 2001). Figura 6. Esquema de las funciones de Nrg1 en C. albicans Además, se ha publicado que tanto la delección como la sobreexpresión de NRG1 causan una reducción de la virulencia en modelos de ratón (Braun et al., 2001; Murad et al., 2001), por tanto, se puede decir que Nrg1 desempeña un papel importante en el desarrollo de la virulencia en C. albicans. Por último, recientemente se ha descrito la importancia de Nrg1 en el proceso de formación y dispersión de biofilms en C. albicans (Uppuluri et al., 2010). Los biofilms son comunidades de microorganismos que se desarrollan sobre diferentes superficies y que están directamente relacionadas con la 23 Introducción patogenicidad, al mostrar una mayor resistencia al tratamiento con antifúngicos y mayor tasa de supervivencia frente al sistema inmune del hospedador. 4.2.3. Los niveles de Nrg1 disminuyen mediante dos mecanismos diferentes en el inicio del crecimiento hifal El inicio de la respuesta requiere la desaparición temporal de Nrg1 a través de dos rutas independientes que regulan tanto la expresión de NRG1 como la estabilidad de la proteína Nrg1. La ruta del AMPc-PKA inhibe rápidamente la transcripción de NRG1 al inicio del crecimiento hifal a través de los factores Efg1 y Flo8 (Bockmuhl and Ernst, 2001; Cao et al., 2006; Lu et al., 2014). Adicionalmente, Nrg1 se degrada mediante un mecanismo dependiente de Sok1, proteína de función desconocida cuya expresión se activa al inicio del programa hifal de forma independiente de PKA (Lu et al., 2014). son Los mutantes sok1∆∆ incapaces de degradar Nrg1 al inicio de la respuesta impidiendo la formación del tubo germinativo. cerevisiae, SOK1 S. En (Supressor Of Kinase) está implicado en la señalización por PKA, y la sobreexpresión suprime el termosensible Figura 7. Los niveles de Nrg1 se reducen al inicio del crecimiento hifal mediante dos rutas paralelas. La represión de la transcripción de NRG1 requiere la activación de la ruta AMPc-PKA, mientras que la degradación de la proteína Nrg1 requiere la liberación de la inhibición por farnesol. Tomado de (Lu et al., 2014). de Sok1 fenotipo de mutantes deficientes en PKA (Ward and Garrett, 1994). Sin embargo, en C. interviene albicans, en esta Sok1 no ruta de señalización durante el inicio 24 Introducción del crecimiento hifal sino que forma parte de la señalización mediada por farnesol, molécula de quorum sensing. Esta molécula inhibe la degradación de Nrg1 porque impide la expresión de SOK1 a través de la estabilización del represor Cup9. La eliminación del farnesol, que experimentalmente se realiza mediante la dilución del cultivo en presencia de suero a 37ºC, activa la degradación de Cup9 mediada por la E3 ubiquitin ligasa Urb1 y, consecuentemente, la transcripción de SOK1 (Lu et al., 2014) (Fig7). 4.2.4. La remodelación de la cromatina de los promotores de los HSG impide la unión de Nrg1 Estudios recientes han puesto de manifiesto que el programa de desarrollo hifal está compuesto por dos fases, inicio y mantenimiento, en las que se produce un reordenamiento de la cromatina en los promotores de los genes específicos de hifas (HSGs) (Lu et al., 2011). Esta reducción en los niveles de Nrg1, descrita en la sección anterior, es esencial para garantizar el éxito del mantenimiento del crecimiento hifal. Esta segunda fase se lleva a cabo gracias al reclutamiento de la histona deacetilasa Hda1 a los promotores de los HSGs, la cual sólo se puede unir al DNA si previamente se ha destruido Nrg1. La interacción de Hda1 con los promotores provoca una remodelación de la cromatina e impide la unión de nuevas moléculas represoras de Nrg1 (Lu et al., 2011) (Fig. 8A). Esta segunda fase del desarrollo hifal está regulada por la ruta de la quinasa sensible a rapamicina TOR, quinasa esencial en regular el crecimiento celular en función de las condiciones nutricionales del medio (Wullschleger et al., 2006; Bastidas et al., 2009). Para el mantenimiento del crecimiento hifal es necesario que se produzca una reducción de la señal Tor1, lo que hace que se activen las tirosin-fosfatasas de Hog1 Ptp2 y Ptp3, las cuales disminuyen la actividad basal de esta quinasa. Esta reducción en la actividad de Hog1 elimina el efector represor de Sko1 sobre la expresión de BRG1 8B). (Su et al., 2013) (Fig. El factor de transcripción Brg1 desempeña un papel esencial en la 25 Introducción remodelación de la cromatina ya que es el responsable de reclutar a la HDAC Hda1 a los promotores de los HSGs (Fig. 8A) (Lu et al., 2012). Figura 8. A. Iniciación y mantenimiento del programa de desarrollo hifal. La activación del programa de desarrollo hifal tiene lugar mediante dos mecanismos secuenciales que modifican la posición de los nucleosomas en las regiones promotoras de los HSGs. La iniciación requiere la desaparición de Nrg1 de los promotores, lo que permite el reclutamiento de la HDAC Hda1, a través de Brg1 (no representado. Ver figura D1), que modifica la cromatina y oculta los sitios de unión de Nrg1 (verde) (Tomado de Lu et al., 2011). B. La ruta TOR participa en el mantenimiento hifal. La reducción de TOR da lugar a la activación de las fosfatasas de Hog1, Ptp2 y Ptp3, que a su vez, disminuyen la actividad basal de Hog1. La reducción de la actividad basal de Hog1 impide la función represora de Sko1 sobre BRG1. La expresión de Brg1 es necesaria durante el mantenimiento hifal ya que es el responsable de reclutar a HdaI (Tomado de Su et al., 2013). En ambos gráficos, las líneas negras representan las regulaciones activas; las líneas grises representan las regulaciones que están inactivas. Los círculos de líneas discontinuas representan las proteínas que se degradan. 5. Función de las Cdks en la morfogénesis de C. albicans La plasticidad morfológica de C. albicans es consecuencia de su capacidad de cambiar el patrón de crecimiento en función de las señales ambientales. Durante el crecimiento levauriforme, las células son redondeadas porque durante la mayor parte del ciclo celular la secreción de nuevos materiales se realiza en toda la superficie de la yema (crecimiento isotrópico) 26 Introducción quedando el crecimiento apical restringido al nacimiento de la yema durante una pequeña ventana de la transición G1/S del ciclo celular. Sin embargo, durante el crecimiento miceliar el crecimiento polarizado es independiente del ciclo celular y la secreción se concentra en una pequeña superficie del ápice de la hifa dando lugar a células de aspecto tubular (Hazan et al., 2002; Sudbery, 2011). 5.1. Cdks y morfogénesis en S. cerevisiae Trabajos pioneros en S. cerevisiae pusieron de manifiesto que la quinasa dependiente de ciclina Cdc28 (Cdk1) asociada a diferentes ciclinas determina el tipo de crecimiento y por tanto la morfología de la yema (Lew and Reed, 1993). Los complejos Cdk1 asociados a las ciclinas de G1 (CdkG1) activan el crecimiento polarizado estimulado la actividad de la GTPasa Cdc42, regulador principal de la polaridad celular en hongos. Una vez activado, Cdc42 orquesta numerosas actividades celulares incluyendo la polarización del citoesqueleto de actina y la fusión de vesículas secretoras al sitio de crecimiento (Park and Bi, 2007). La regulación de la CdkG1 sobre Cdc42 se realiza mediante dos mecanismos indirectos. Por un lado regula positivamente al módulo de Cdc24, GEF de Cdc42 (McCusker et al., 2007), y por otro regula negativamente a las GAPs de Cdc42 Bem3 y Rga2 (Knaus et al., 2007; Sopko et al., 2007). También se ha descrito que la CdkG1 regula a la GTPasa Rho1, necesaria para la síntesis de pared celular, a través de la fosforilación de su GEF Tus1 (Kono et al., 2008). Por último, aunque en los últimos años se han identificado numerosos sustratos de Cdks con funciones en el establecimiento de polaridad no se conoce el impacto de estas fosforilaciones en la maquinaria implicada en el crecimiento polarizado (Howell and Lew, 2012). Respecto a la función de la CdkG2 (Cdc28/Clb2) en el crecimiento isotrópico, se desconocen los posibles sustratos cuya fosforilación distribuya de forma homogénea los componentes que se encontraban focalizados en el crecimiento apical. Aunque el efecto pudiera ser indirecto, ya que la 27 Introducción Cdk1/Clb2 inhibe la transcripción de las Clns (Amon et al., 1993), también se ha sugerido un papel más activo a través de la activación de flipasas de fosfolípidos que son importantes para el crecimiento isotrópico (Saito et al., 2007). En los últimos años se ha implicado a las Cdks en la regulación de la secreción. La quitín-sintasa Chs2 es una proteína de membrana responsable de la síntesis del septo primario que se deposita en el plano de división tras la mitosis. Dicha proteína es retenida en el retículo endoplásmico (RE) gracias a la fosforilación de su dominio citoplasmático N-terminal por Cdk1-Clb2 que interfiere la interacción del cargo con las vesículas COPII (Teh et al., 2009; Jakobsen et al., 2013). Durante la citoquinesis, la fosfatasa Cdc14 defosforila el extremo N-terminal de Chs2 y permite su translocación al Golgi y la entrega de las vesículas secretoras al plano de división mediante un mecanismo dependiente de las septinas (Roh et al., 2002; Zhang et al., 2006). También se ha demostrado que la Cdk regula el exocisto, complejo multiproteíco implicado en la fusión de las vesículas secretoras con la membrana plasmática en los sitios de crecimiento polarizado. Cdk1-Clb2 fosforila a la subunidad Exo84 bloqueando la formación del exocisto lo que da lugar a la inhibición de crecimiento durante la mitosis (Luo et al., 2013). 5.2. Cdks y morfogénesis en C. albicans Como ya se ha comentado anteriormente, las hifas de C. albicans son capaces de mantener el crecimiento polarizado en el ápice de la hifa de forma permanente e independiente del ciclo celular (Hazan et al., 2002). Durante este patrón de crecimiento, numerosas estructuras celulares importantes para el crecimiento polarizado, se concentran en el extremo de la hifa, como el Aparato de Golgi (Rida et al., 2006), el Spitzenkörper (Crampin et al., 2005), el exocisto (Li et al., 2007; Jones and Sudbery, 2010; Caballero-Lima et al., 2013), el polarisoma (Zheng et al., 2003; Jones and Sudbery, 2010) y las septinas (Warenda and Konopka, 2002; Huang et al., 2014). 28 Introducción Aunque el crecimiento hifal de C. albicans se regula de forma independiente del ciclo celular, la Cdk1 juega un papel esencial en la transición levadura-micelio ya que la inhibición de Cdc28-as1 con el análogo del ATP 1NM-PP1 da lugar a defectos importantes en el desarrollo hifal (Bishop et al., 2010). En los últimos años, se han identificado diferentes sustratos, componentes clave de la maquinaria de polaridad, cuya fosforilación es importante para la transición dimórfica en C. albicans (Wang, 2009). En C. albicans existen tres ciclinas de G1 (Ccn1, Cln3 y Hgc1) que regulan diferentes aspectos del desarrollo hifal (Loeb et al., 1999; Bachewich and Whiteway, 2005; Chapa y Lazo et al., 2005; Zheng et al., 2007). De estas tres ciclinas, Cln3 es la única que es esencial para la viabilidad celular en C. albicans. El complejo Cdc28/Cln3 es necesario tanto en la morfogénesis de las formas levaduriformes como hifales. Mientras que la represión de CLN3 en levaduras da lugar a células sin yema que generan un fenotipo terminal con estructuras tubulares similares a hifas; su represión en hifas genera un crecimiento isotrópico del ápice hifal (Chapa y Lazo et al., 2005). Recientemente, se ha observado que Cdc28/Cln3 regula la dinámica de la actina localizada en las regiones de endocitosis mediante la fosforilación de Sla1, proteína que interacciona con el citoesqueleto de actina y que es necesaria en endocitosis (Zeng et al., 2012). La ciclina Hgc1 es la única subunidad reguladora de Cdc28 que se ha descrito como específica de las formas miceliares. Esta proteína desempeña un papel muy importante en el mantenimiento del crecimiento hifal y es necesaria para la virulencia en modelos murinos (Zheng and Wang, 2004). La expresión de HGC1 se encuentra reprimida por el complejo Tup1/Nrg1 en levaduras mientras que su transcripción se activa en hifas de forma dependiente de la ruta de señalización cAMP/PKA (Zheng and Wang, 2004; Garcia-Sanchez et al., 2005). Debido a su importancia en la morfogénesis hifal, en los últimos años se han descrito numerosos sustratos del complejo Cdc28/Hgc1. Esta Cdk inhibe a Rga2, una GAP de Cdc42 (Zheng et al., 2007). Esta fosforilación excluye a Rga2 del ápice de la hifa lo que permite la acumulación de Cdc42 29 Introducción activo en el ápice permitiendo el crecimiento del tubo germinativo. El complejo Cdc28/Hgc1 también regula el estado de fosforilación de las septinas Cdc11 y Sep7, modificaciones necesarias para mantener el crecimiento hifal (Sinha et al., 2007; González-Novo et al., 2008) y del factor de transcripción Efg1 para inhibir la separación celular en hifas (Wang et al., 2009). La secreción de vesículas al ápice de la hifa también se encuentra regulada por Cdc28/Hgc1 mediante la fosforilación de Sec2 y Exo84 (Bishop et al., 2010; Caballero-Lima and Sudbery, 2014). Por último, se ha descrito que HGC1 es necesario para inhibir la localización de la fosfatasa Cdc14, activador de la separación celular, en la región del septo hifal (Clemente-Blanco et al., 2006). Durante el desarrollo hifal los complejos Cdks pueden actuar de forma secuencial en la regulación de ciertos sustratos. Por ejemplo, el complejo Cdc28/Ccn1 fosforila Cdc11 y Sec2 al inicio de la respuesta hifal para que luego dichos sustratos puedan ser modificados por Cdc28/Hgc1 (Bishop et al., 2010; Sinha et al., 2007). También se ha descrito que la Cdk Cdc28 es capaz integrar información en la via de transducción de señales RAM (ver más adelante) mediante la fosforilación del complejo Ndr quinasa Cbk1/Mob2, principal efector de la ruta. Esta modificación post-traduccional del complejo Cbk1/Mob2 es esencial para mantener el crecimiento polarizado durante el crecimiento hifal (Gutierrez-Escribano et al., 2011; Patricia Rojo-Domínguez comunicación personal). 6. NDR quinasas Las rutas de señalización “Hippo” controlan diversos aspectos de la proliferación celular, supervivencia y morfogénesis en eucariotas (Pan, 2010; Avruch et al., 2012; Hergovich and Hemmings, 2012). Los principales efectores de estas rutas son las NDR quinasas (Nuclear Dbf2 Related), familia de proteín-quinasas altamente conservadas desde levaduras a humanos (Hergovich et al., 2006). Una característica común en la arquitectura de estas rutas de señalización es la presencia de un grupo de proteínas que interactúan física y 30 Introducción funcionalmente, y que juntas constituyen el núcleo quinasa de la ruta (Sudol and Harvey, 2010). Este núcleo de señalización está formado por una NDR quinasa y su coactivador Mob, una proteína quinasa de la familia de Ste20 implicada en la activación de la NDR quinasa y un scaffolding o Figura 9. Organización del núcleo central de rutas de señalización en las que las NDR quinasas actúan como efectores. proteína de anclaje, que facilita la interacción de los reguladores de la ruta (Fig. 9). En animales (Fig. 10) , la ruta Hippo es una ruta supresora de tumores que inhibe la proliferación celular y controla el tamaño de los tejidos (Zhao et al., 2011). En Drosophila y humanos, la quinasas hippo/MST (Ste20-like) son necesarias para la activación de las NDR/LATS (large tumor suppressor) junto con la unión de sus coactivadores Mob. Una vez activado, el complejo NDR/Mob controla los outputs de la ruta mediante la fosforilación de proteínas efectoras. La diana mejor conocida de esta ruta es la familia de coactivadores YAP/Yki/TAZ, los cuales promueven la proliferación celular y la inhibición de la apoptosis. La fosforilación de YAP/Yki/TAZ, secuestra al coactivador en el citoplasma impidiendo que realice su función transcripcional en el núcleo (Huang et al., 2005). También se ha descrito otra ruta en Drosophila en la que las NDR quinasas forman complejos con diferentes coactivadores Mob y regulan la morfogénesis de dendritas neuronales (Emoto et al., 2004), resaltando la importancia de estas quinasas en el crecimiento hiperpolarizado. En S. cerevisiae, las rutas Hippo también regulan proliferación celular y morfogénesis a través de dos ramas diferentes. La ruta MEN (Mitotic Exit Network) regula la salida de mitosis y citocinesis a través del complejo Dbf2/Mob1, mientras que la ruta RAM controla la morfogénesis mediante la el 31 Introducción complejo Cbk1/Mob2 que fosforila componentes necesarios para la síntesis de pared celular (Hergovich and Hemmings, 2012). En Schizosaccharomyces pombe, también existen dos rutas de señalización, SIN y MOR, mediadas por los complejos Sid2/Mob1 y Orb6/Mob2, implicadas en citoquinesis y morfogénesis (Fig. 11) respectivamente (Maerz and Seiler, 2010; Hergovich and Hemmings, 2012). En resumen, aunque las señales que integren las rutas hippo en animales y levaduras sean diferentes, ambas mantienen semejanzas importantes en la organización de los componentes de estas rutas de señalización, así como los procesos que regulan (morfogénesis y ciclo celular). Figura 10. Función del complejo NDR/LATS-Mob en las rutas Hippo de animales y levaduras. En metazoos (izquierda), La quinasa Ste20 MST/hippo activa al complejo LATS-Mob1 que inhibe al coactivador transcripcional Yki/YAP. En levaduras (derecha) existen dos rutas hippo: la ruta MEN (Mitotic Exit Network), en la cual la quinasa LATS Dbf2/20 en complejo con Mob1 regulan la salida de mitosis y la citocinesis; y la ruta RAM en la que la NDR quinasa Cbk1 en complejo con Mob2 controlan la separación celular y morfogénesis. Tomado de (Gogl et al., 2015) 7. La Ruta RAM en levaduras Tras finalizar la mitosis, las células de S. cerevisiae tienen que degradar el septo que separa la célula madre de la hija mediante la acción localizada de hidrolasas de pared celular que son sintetizadas en la célula hija. El control de este proceso, altamente regulado en el espacio (región del septo) y tiempo (M/G1), depende de la ruta RAM (Regulation of Ace2 and 32 Introducción Morphogenesis). Además de esta función en separación, la ruta RAM es necesaria para mantener el crecimiento polarizado durante el ciclo celular. Los mutantes RAM dan lugar a grumos de células muy redondeadas consecuencia de la alteración de estos dos procesos (ver Fig. 12). Hasta la fecha, esta ruta de transducción de señales está formada por un grupo de proteínas (Fig. 11) agrupadas en dos módulos funcionales que interaccionan gracias a Tao3, una proteína de alto peso molecular (350 kDa) que actúa de anclaje (Racki et al., 2000; Bidlingmaier et al., 2001; ColmanLerner et al., 2001; Weiss et al., 2002; Nelson et al., 2003). El módulo efector de esta ruta está formado por la NDR quinasa Cbk1 y su co-activador Mob2 (Weiss et al., 2002). El segundo módulo regula la actividad de Cbk1 y está formado por la Mst/hippo quinasa Kic1 y su coactivador Hym1 y probablemente Sog2. Todas las proteínas de esta ruta, salvo Sog2, se encuentran conservadas en metazoos (Hergovich et al., 2006). Respecto a su localización subcelular, todos los componentes de la ruta se encuentran en las zonas de crecimiento polarizado (cortex de la célula hija y en la región del cuello de la yema), salvo el módulo efector que también se concentra de forma asimétrica en el núcleo de la célula hija (Colman-Lerner et al., 2001; Weiss et al., 2002; Nelson et al., 2003). Además del módulo de Kic1, se ha descrito a Lre1 como un inhibidor directo de la actividad de Cbk1 en Figura 11. Esquema de la ruta RAM en S. cerevisiae el plano de división (Mancini Lombardi et al.). En S. cerevisiae, los mutantes deficientes en Cbk1 son sensibles a agentes que dañan la pared celular y muestran defectos en la N-glicosilación de manoproteínas (Jansen et al., 2009), subrayando la importancia de esta quinasa en la regulación de la composición de la pared celular. Hasta la fecha 33 Introducción se han descrito únicamente dos sustratos de Cbk1 que regulan la síntesis de enzimas relacionadas con la pared celular. En la transición M/G1, la quinasa Cbk1 es responsable de la acumulación nuclear y activación del factor de transcripción Ace2 que controla la expresión de genes de hidrolasas necesarias para la disolución del septo primario que separa la célula madre e hija (Racki et al., 2000; Colman-Lerner et al., 2001; Weiss et al., 2002). El segundo sustrato es Ssd1, una proteína de unión a mRNAs que juega un papel muy importante en la remodelación y organización de la pared celular en los sitios de crecimiento. Esta proteína regula la localización y traducción de los mRNAs a los que se encuentra asociada, entre los que existen mRNAs que codifican proteínas de pared. La fosforilación de Ssd1 por Cbk1 permite la acumulación asimétrica y traducción de estos mRNAs en el cortex celular, mientras que la inhibición de Cbk1 o el estrés celular produce la defosforilación de Ssd1 y su asociación con P-bodies y gránulos de estrés, reprimiendo la traducción de los mRNAs asociados (Hogan et al., 2008; Jansen et al., 2009; Kurischko et al., 2011). Por tanto, Cbk1 regula indirectamente la traducción de estas proteínas de pared mediante la fosforilación de Ssd1. Por último, se ha propuesto que Cbk1 podría regular la N-glicosilación de manoproteínas de forma indirecta mediante la activación de algún factor de transcripción desconocido que activara la expresión de enzimas relacionadas con el metabolismo de los carbohidratos como manosil-transferasas, glicosidasas etc (Kurischko et al., 2008). 7.1. La ruta RAM en C. albicans En C. albicans, los componentes de la ruta RAM están conservados. Células deficientes en cualquiera de sus componentes muestra fenotipos similares a los de S. cerevisiae como son la formación de grumos, lisis celular y carencia de crecimiento polarizado (McNemar and Fonzi, 2002; Song et al., 2008; Gutierrez-Escribano et al., 2011). Este defecto es más evidente cuando 34 Introducción los mutantes se crecen en condiciones de crecimiento hifal ya que son incapaces de formar hifas (Fig 12). Aunque no se ha demostrado formalmente, probablemente la ruta RAM regule la separación celular a través de la fosforilación directa del factor de transcripción Ace2, ya que éste posee sitios de fosforilación por Cbk1, se acumula asimétricamente en la célula hija y regula la transcripción de hidrolasas necesarias para la separación celular (Kelly et al., 2004). Recientemente, se ha demostrado que la NDR quinasa Cbk1 regula la actividad de otros factores de transcripción importantes en los diferentes programas de desarrollos de este patógeno oportunista como Bcr1 y Fhk2, factores de transcripción necesarios para la formación de biofilms y la expresión de genes de patogenicidad (Gutierrez-Escribano et al., 2012; Greig et al., 2015). Figura 12. Fenotipo de los mutantes RAM de C. albicans en condiciones de crecimiento levaduriforme e hifal. La deleción de los genes de la ruta RAM en C.albicans da lugar a fenotipos similares a los descritos en S. cerevisiae en condiciones de crecimiento levaduriforme (YF). Como puede observarse, la deleción de MOB2, KIC1 y TAO3 provocó la aparición de grumos de células con una morfología redondeada, resultado de los defectos en separación y polaridad celular. Adicionalmente, estos mutantes son incapaces de hiperpolarizar el crecimiento en respuesta a las señales que inducen la miceliación (HF). La deleción de CBK1 da lugar los mismos fenotipos descritos para el resto de mutantes RAM (datos no mostrados). (GutierrezEscribano et al., 2011) 35 MATERIALES Y MÉTODOS Materiales y Métodos 1. Microorganismos utilizados Las cepas de C. albicans utilizadas para este estudio aparecen en la tabla 1, donde se detallan las características genéticas y la procedencia de las mismas. La bacteria Escherichia coli se utilizó para los experimentos rutinarios de clonación molecular y como hospedador de los plásmidos utilizados, los cuales se muestran en la tabla 2. 2. Medios de cultivo y condiciones de crecimiento C. albicans se creció rutinariamente a 30°C en YPD (2% de Pectona Bacteriológica, 2% de dextrosa, 1% de extracto de levadura) o medio mínimo (MM) (2% de dextrosa, 6,7% base nitrogenada sin aminóacidos) suplementado con aminoácidos si era necesario a una concentración final de 40mg/l para histidina y arginina, y 80mg/l para uridina. La inducción del crecimiento hifal se realizo a partir de preinóculos del día anterior que se diluyeron en medio liquido YPD o MM con el 10% de suero bovino (Sigma, St. Louis, MO) a una D.O.600 de 0.7, manteniendo el cultivo en agitación a 37°C. Para la inducción del crecimiento hifal en placas se utilizó medio Spider (Nutrientes 1%, Manitol 1%, Sulfato Postásico Dibásico, Agar 2% pH=7,2). La represión de la expresión de los genes bajo el promotor MET3 se realizó en MM suplementado con 5mM metionina y 1mM de cisteína. Los cultivos de Escherichia coli se crecieron a 37°C en medio LB (Sigma), suplementado para la selección de transformantes con ampicilina a una concentración final de 100μg/ml. En todos los casos se añadió agar al 2% para los medios sólidos. Todos los medios de cultivo se esterilizaron durante 20 minutos a 120°C en el autoclave. El mantenimiento a largo plazo de las cepas se realizó en glicerol al 20%, a una temperatura de -80º C. 37 Materiales y Métodos 3. Construcción de cepas La delección de genes de C. albicans, así como la adición en fase de GFP y epítopos myc o HA, se realizó mediante PCR usando los módulos pFA et al., 2003; Schaub et al., 2006). La selección inicial de los (Gola transformantes se realizó en placas de MM suplementado con los diferentes aminoácidos en función de los marcadores auxotróficos empleados en los cassettes de integración, o en YPD con clonNAT a una concentración final de 200 mg/ml (Werner BioAgents, Jena, Germany) para seleccionar cepas SAT1. Todas las cepas fueron confirmadas por PCR usando oligonucleótidos obtenidos de la casa comercial Biomers.net (Ulm. Germany) y se encuentran recogidos en la Tabla 3. La fusión en fase de los diferentes epítopos también se comprobó por Western-Blot. La funcionalidad de las fusiones se comprobó analizando el comportamiento de cepas heterocigóticas en el que la única fuente de proteína correspondía al alelo con el epítopo. Aquellas que mostraban un comportamiento silvestre se consideraron funcionales. A la hora de introducir alelos con mutaciones puntuales obtenidos por mutagénesis dirigida, las cepas se construyeron utilizando fragmentos de DNA linearizados con enzimas de restricción, a partir de plásmidos en los que el marcador de selección se encontraba flanqueado por el alelo mutado y una región 3’UTR del locus al que se quería dirigir la integración. 3.1. Mutagénesis dirigida La mutagénesis dirigida de los sitios consenso de fosforilación por Cbk1 de NRG1 se realizó mediante PCR, a partir de ADN genómico de la cepa JC1075 (ver tabla 1). Mediante este método se obtuvieron diferentes productos incluían de PCR nrg1S200A/T251A/T281A, que nrg1T251E/T281E y las mutaciones nrg1S200E/T251E/T281E nrg1S200A, nrg1T251A/T281A, respectivamente. Dichos fragmentos se clonaron en vectores pSC-A (StrataClone Blunt PCR Cloning Kit, Stratagene) para su secuenciación. Una vez confirmadas las mutaciones deseadas en los fragmentos amplificados, se digirieron los distintos pSC-A 38 Materiales y Métodos con las enzimas de restricción SalI y BamHI, purificando mediante geles de agarosa LM al 1% la banda de 1000pb que contenía la mutación e integrándola en un plásmido pFA-ARG4-31UTR-NRG1. Dicho plásmido, contiene la región 3’UTR de NRG1 (+316 a la +937 desde el codón de parada), clonada como SacI/EcoRV. La ligación de los distintos fragmentos en los plásmidos pFA-ARG4 y pFA-ARG4-3’UTR se llevó a cabo usando el Kit de ligación Rapid DNA Dephos & Ligatión kit (Roche) y transformando el producto de la ligación en células competentes E. coli XL1-Blue (Agilent), siguiendo el protocolo recomendado por el fabricante. Las construcciones obtenidas se analizaron mediante digestión con SalI/BamHI. Una vez confirmadas, los distintos plásmidos resultantes se linearizaron con SalI y EcoRV y se transformaron en una cepa nrg1::URA3/NRG1 (JC1075). La estrategia de mutagénesis se esquematiza en la figura 13. Con el fin de confirmar que los mutantes obtenidos eran portadores de las mutaciones deseadas, el ORF de NRG1 se amplificó mediante PCR y se secuenció. Finalmente las cepas portadoras de los alelos fosfodeficientes y fosfomiméticos de NRG1 se marcaron con GFP o HA en el extremo carboxilo siguiendo la estrategia descrita en el apartado.2. 3.2. Síntesis génica El alelo nrg1-7A-HA se realizó mediante síntesis génica de un fragmento de 1208 bp portador de la secuencia de NRG1, en el que las siete serinas se sustituyeron por alaninas en fase con tres copias del epítopo HA y 164 bp de la región 3’ UTR de NRG1 despúes del codón de parada, flanqueados por las secuencias de corte para las enzimas de restricción SalI y BamHI. Una vez sintetizado, el alelo nrg1-7A-HA se clonó en los sitios SalI y BamHI del pFA-ARG4-3UTR-NRG1. Con el fin de sustituir un alelo silvestre de NRG1 por el alelo nrg1-7A-HA, el plasmido pFA-nrg1-7A-HA-ARG4-3’UTR-NRG1 se linearizó mediante una doble digestión con las enzimas SalI y XbaI. El plásmido digerido se utilizó para transformar la cepa heterocigótica JC1075 39 Materiales y Métodos (nrg1/NRG1). Los transformantes obtenidos se confirmaron por PCR y secuenciación posterior. Figura 13 Esquema de la estrategia de mutagénesis 40 Materiales y Métodos 3.3. Transformación de C. albicans El protocolo de transformación por acetato de litio utilizado en este trabajo fue el descrito por Walther y colaboradores (Walther and Wendland, 2003) con pequeñas modificaciones que mejoraron la eficiencia de transformación. Se diluyeron cultivos nocturnos de las células en 25 ml de medio YPD con uridina a una DO600=0.3 y se dejaron crecer hasta alcanzar una DO600=1,4-1,8. Tras recuperar las células mediante centrifugación se lavaron en agua estéril fría y se resuspendieron en 1.5ml de Acli-sol 2X (200mM AcLi, 20mM Tris-HCl, 2mM EDTA). De esta mezcla, se tomaron 100μl para cada transformación, a los cuales se añadieron 50μg de ss-DNA (2mg/ml) desnaturalizado y 1-5μg de ADN transformante, previamente mezclados en hielo durante 5 min. Lo dejamos incubar 5 minutos en hielo y por último se añadieron 600μl de PEG/LiAc-sol 2X (50% PEG 4000 en LiAc-sol 2X) filtrada. En estas condiciones, se incubaron las células durante toda la noche a 28ºC en agitación, para, a continuación, someterlas durante 15 min a un choque térmico a 44º C. Finalmente, las células fueron lavadas, incubadas en MM durante 5 min y sembradas en un medio selectivo. Para las transformaciones en las que usamos el marcador SAT1, las células se incubaron en 1 ml de YPD a 30ºC en agitación con el fin de permitir su recuperación antes de sembrarlas en el medio selectivo con nousotricina. 3.4. Transformación de E. coli La transformación de la cepa bacteriana DH5α con plásmidos purificados se realizo siguiendo el protocolo de transformación del minuto descrito por Golub (Golub, 1988). 41 Materiales y Métodos Cuando los producto de transformación fueron mezclas de ligación se usaron células competentes E. coli XL1-Blue (Agilent), las cuales se transformaron siguiendo las instrucciones del fabricante. Las células competentes SoloPack Strataclone se usaron para clonar productos de PCR y el protocolo utilizado para ello fue el indicado por el fabricante. 4. Técnicas de manipulación de ácidos nucleicos 4.1. Obtención de DNA plamídico Para la obtención de DNA plasmídicos de E. coli se usó el kit de purificación de plásmidos NucleoSpin® (Macherey-Nagel, Düren, Germany) siguiendo las indicaciones del fabricante. 4.2. Reacciones de amplificación (PCR) Las reacciones de amplificación se realizaron en un termociclador PCR Sping de la casa comercial Hybond. Las condiciones de programación fueron diferentes para cada reacción de amplificación. La enzima empleada para las amplificaciones varió en función de la finalidad con la que se iba a utilizar el producto de PCR. Así, para reacciones de amplificación rutinarias se empleo la Go-Taq polimerasa (Promega) mientras que para aquellas en las que se precisaba una mayor fidelidad de copia se recurrió a la enzima Kappa HiFi, siguiéndose en cualquier caso las de las recomendaciones marcadas por el fabricante. Las condiciones programadas se ajustaron en función características particulares de los oligonucleótidos y la enzima empleados, así como de los productos a amplificar. En cualquier caso, para amplificaciones estándar se programaron un ciclo de 94º C, 3min, seguido de 25-35 ciclos de 94°C, 30 seg.; 55°C, 30 seg., 72°C, 1-3min según los tamaños de los 42 Materiales y Métodos fragmentos a amplificar. Finalmente, se programó un último ciclo de 72°C, 10 minutos. Los productos de PCR se mantuvieron en el termociclador a una temperatura constante de 16°C hasta su análisis. Tanto los fragmentos amplificados con la Go-Taq polimerasa (Promega) como el DNA recuperado directamente a partir del gel de agarosa (LM 1%) fueron purificados con el Kit NucleoSpin Extract II (MACHEREY-NAGEL). Tanto los productos de PCR como los resultados de su purificación se verificaron mediante electroforesis en gel de agarosa 0.7%, utilizando 1xTAE (Tris-acetato 40mM, EDTA 1mM) como tampón de carrera. 4.3. Análisis de transformantes mediante Whole-PCR La correcta construcción de las cepas se verificó inicialmente mediante PCR a partir de colonias individuales. Para ello se cogió con una punta estéril una parte de las colonias a analizar para cada transformación y se depositó en el fondo de tubos de 200μl. Las muestras se hirvieron en el microondas durante 2 min a máxima potencia. A continuación, se añadieron a cada tubo 25μl de la mezcla de PCR, procediendo inmediatamente a la reacción de amplificación en el termociclador. Para ello, se utilizo el programa estándar anteriormente explicado, considerando en todos los casos las características particulares de los oligonucleótidos empleados, así como la longitud del fragmento a amplificar. El producto resultante se corrió en un gel de agarosa para comprobar la idoneidad del fragmento amplificado. 4.4. Análisis de transformantes a partir de ADN genómico En los casos en los que no se conseguía amplificación mediante la técnica de Whole-PCR anteriormente descrita, la comprobación de los transformantes por PCR se realizaba extrayendo el ADN genómico de los mismos para utilizarlos como ADN molde en las reacciones de PCR.. La extracción del mismo se realizó a partir de cultivos saturados de los distintos 43 Materiales y Métodos transformantes crecidos a 30º en YPD y usando el kit de purificación de ADN genómico de EPICENTRE. Esta técnica también se utilizó cuando los productos de PCR tenían que ser secuenciados. 5. Extracción, detección y análisis de proteínas 5.1. Extracción de proteínas. Los extractos proteicos de comprobación se prepararon a partir de cultivos saturados de las distintas cepas. Para el análisis del patrón de fosforilación y la estabilidad proteica, los extractos se realizaron a partir de cultivos celulares en fase exponencial, mediante la dilución de cultivos nocturnos a una D.O.600nm de 0,6-0,7 y se crecieron en las condiciones que exigiera el experimento. Las células se recogieron mediante centrifugación y, tras lavarlas en agua fría, se pasaron a tubos eppendorf y se resuspendieron en 50μl de tampón de lisis RIPA (150mM NaCl, 50mM Tris pH 7.5, 1%Nonidet, 0.5%Sodium deoxycholate y 0.1%SDS), para extractos comunes y en tampón de lisis λ-PPasa (150mM NaCl, 50mM Tris pH 7.5, 2mM EGTA pH 8, 1% 100x, 10% Tritón glicerol, 1mM PMSF, inhibidores de proteasa complete Mini EDTA- free Roche) para extractos que posteriormente fueron tratados con fosfatasa. A continuación, se añadieron 200μl de bolas de vidrio (0.4mm, Sigma-Aldrich) y se procedió a la rotura de las células mediante dos pulsos de 25 segundos en un equipo Ribolyser (Hybaid Inc.) a una velocidad de 5.5. Después de cada pulso, las muestras de incubaban en hielo durante 1 min. El extracto crudo se recuperó mediante lavado de las bolas con 300-500μl de tampón/lavado dependiendo de la cantidad de células recogidas. Las proteínas solubles fueron recuperadas mediante centrifugación a 12000 r.p.m. a 4ºC. La determinación de la concentración de proteínas se realizó mediante el uso del kit BSA Protein Assay, Pierce®, utilizando BSA (Sigma-Aldrich) elaboración de la para la recta patrón. 44 Materiales y Métodos La medida de la absorbancia a una longitud de onda de 562nm, se realizó en un espectofotómetro Ultrospec 1100pro (Amersham Bioscience) que también se utilizó para la medida de la absorbancia de los cultivos celulares a una longitud de onda de 600nm. El tratamiento con fosfatasa se llevó a cabo mediante la incubación de los extractos proteicos con λ-PPasa (New England BioLabs) a 30ºC durante 1 hora. 5.2. Western-blot Para el análisis mediante Western Blot se cargaron 15-20μg de extracto total desnaturalizadas y se corrieron en un gel SDS-poliacrilamida al 8% a un voltaje de 100V/gel. El sistema de electroforesis utilizado fue el MiniProteanII (BioRad) siguiendo las recomendaciones de la casa comercial y utilizando como tampón de electroforesis Tris-Glicina (Tris base 3g/l, Glicina 14.4g/l y SDS 1g/l). La transferencia a una membrana Hybond-P (Amershan Biosciences), previamente activada en metanol, se realizó utilizando el sistema Mini-Trans- Blot (BioRad) durante 45min a voltaje constante (50 V/membrana) en tampón CAPS-Metanol (CAPS 0.01M pH 11, metanol 10%). Tras el bloqueo de la membrana con PBS-leche (10% leche desnatada en polvo Sveltesse Plus, Nestlé en PBS con 0,05%Tween®20 Applichmen) durante 45 minutos a temperatura ambiente en agitación suave, ésta se incubó con el anticuerpo primario a la concentración deseada (1:20000 para anti-HA 3F10, 1:10000 para anti-myc y 1:5000 para anti PSTAIRE) durante toda la noche a 4ºC en la misma solución de bloqueo. Tras 6 lavados de 5 minutos a temperatura ambiente con PBS 0,05%Tween®20, se incubó durante una hora con el anticuerpo secundario-HRP (Anti-rat para el 3F10 y Anti-Mouse para el PSTAIRE), a una dilución 1:20000, procediendo posteriormente a otros seis lavados en las mismas condiciones que los anteriores. La detección de los complejos antígeno-anticuerpo se realizó mediante la detección de la actividad 45 Materiales y Métodos peroxidasa por quimioluminiscencia, mediante el kit Supersignal® West Femto Trial Kit (Pierce Biotechnology, Inc.). 5.3. Inmunoprecipitación de proteínas La preparación de extractos celulares para la inmunoprecipitación se llevó a cabo siguiendo el protocolo de extracción anteriormente descrito, pero usando el siguiente buffer de rotura: NaH2PO4/Na2HPO4 pH=7.4 25mM, NaAc 200mM, 12% glicerol, 0.1% Tween®20, Inhibidores de fosfatasas y proteasas. Seguidamente los lisados se incubaron con bolas magnéticas que llevaban unido el anticuerpo correspondiente (μMACS® HA, myc, o GFP Tagged Protein Isolation Kit, Miltenyi Biotec), durante 30 min a 4°C. Esta mezcla se cargó a continuación en columnas MACS® Separation Colums, Miltenyi Biotec. Una vez que toda la muestra ha pasado por las columnas, éstas se lavaron 4 veces con 200μl del tampón de lisis y 2 veces con 200μl con un tampón igual pero con la concentración de NaAc aumentada a 300mM. Las proteínas retenidas en las columnas fueron eluidas con el tampón de elución proporcionado por el “kit”. La electroforesis y posterior transferencia del Western se realizó como se describe en el apartado anterior. 5.4. Precipitación de proteínas con TCA La extracción de células se realizó de la misma forma que en el apartado anterior, una vez que las células fueron lavadas con agua fría se procedió a la precipitación de proteínas con TCA. Para ello se lavaron con 1 ml de TCA al 20% y se trasfirieron a tubos con tapón de rosca, los cuales anteriormente había sido numerado y pesado. Se centrifugaron 1 min, se eliminó el todo sobrenadante y se volvió a pesar el tubo. La diferencia entre ambos pesos nos dio los gramos de células que se recogieron de cada muestra. Los datos de los pesos se copiaron en una tabla de Excel normalizada que nos dio los volúmenes de Sample Buffer y Tris 2M que había que añadir a cada muestra para que todas queden a la misma concentración. 46 Materiales y Métodos Después de pesar los tubos, las células se resuspendieron en 100μl de TCA al 20% y se dejaron al menos una hora a -80°C. A continuación, se añadieron 500μl de bolas de vidrio (0.4mm, Sigma-Aldrich) y se procedió a la rotura de las células mediante 3 pulsos de 15 segundos en un equipo Ribolyser (Hybaid Inc.) a una velocidad de 5.0, dejando los tubos 1 min en hielos entre pulso y pulso. Posteriormente se realizaron agujeros en la base de los tubos, se colocaron sobre ependorf nuevos y se centrifugaron 1 min a 2000 rpm. Luego se lavaron las bolas con 200μl de TCA al 5% y se volvieron a centrifugar 5 min a 3000 rpm, se eliminó el sobrenadante y las proteínas precipitadas se resuspendieron en los correspondientes volúmenes de Sample Buffer y Tris 2M. Para finalizar, las muestras se hirvieron durante 5 min y seguidamente se centrifugaron a 13200 rpm durante 5 min. El sobrenadante se transfirió a ependorf nuevos y de aquí se cogieron 10μl para cargar en el gel. 5.5. Western-blot con geles Phos-Tag Para el análisis mediante Western Blot se cargaron 10μl de los extractos desnaturalizados y se corrieron en un gel SDS-poliacrilamida al 8% con Phos-tag a una concentración de 25μM. Se corrieron a un voltaje constante de 100V/gel durante 5 horas. El sistema de electroforesis utilizado fue el mismo que mencionamos anteriormente pero utilizando otro tampón electroforesis (Tris base 25mM, Glicina 192mM de y SDS 0,1%). Después de la electroforesis el gel se incubó con buffer de transferencia (25mM Tris Base, Glicina 192mM y metanos 20%) más 1mM de EDTA durante 10 min en agitación. Seguidamente, se lavó otros 10 min con tampón de transferencia si EDTA. La transferencia a una membrana Hybond-P (Amershan Biosciences), previamente activada en metanol, se realizó utilizando el sistema Mini-Trans- Blot (BioRad) durante 1 hora a 100 voltios en tampón de transferencia. El resto del procedimiento fue el mismo que se ha mencionado en el apartado 5.2. 47 Materiales y Métodos 6. Microscopía Las células se observaron y fotografiaron en un microscopio Leica DM 6000B dotado con lentes para óptica Nomarski. Las fotografías se tomaron mediante el uso de una cámara digital Cool-Snap HQ2 (Photometric). La observación de cepas que contenían proteínas fluorescentes (GFP) se realizó por dos métodos diferentes: 1) Se tomaron muestras de cultivos en fase exponencial crecidos en medio líquido en condiciones de levaduras o hifas. 2) Time-lapse de células 48 Materiales y Métodos TABLA 1 ESTIRPE GENOTIPO PROCEDENCIA BWP17 ura3∆::imm434/ura3∆::imm434::hisG/his::hisG arg4::hisG/arg4::hisG (Wilson et al., 1999) JC263 BWP17 RP10::pRSC4b-pHWP1 Tesis Caballero Lima JC1075 BWP17 nrg1∆::URA3/NRG1 Este trabajo JC1049 BWP17 cbk1∆::ARG4/cbk1∆::HIS1 Este trabajo JC1139 BWP17 nrg1∆::URA3/NRG1-HA::HIS1 Este trabajo C. albicans JC1161 JC1186 BWP17 mob2∆::ARG4/mob2∆::URA3; NRG1HA::HIS1 BWP17 NRG1/NRG1-HA::HIS1 Este trabajo Este trabajo JC1188 BWP17 nrg1Δ::URA3/ NRG1T281A –HA::HIS1 Este trabajo JC1194 BWP17 hgc1∆; NRG1-HA::HIS1 Este trabajo JC1196 BWP17 ccn1∆; NRG1-HA::HIS1 Este trabajo JC1211 BWP17 NRG1/ARG4-pMET-NRG1-HA::HIS1 Este trabajo JC1218 BWP17 nrg1∆::URA3/NRG1T251A-T281A –HA::HIS1 Este trabajo JC1272 Este trabajo JC1295 BWP17 mob2∆::ARG4/mob2∆::URA3; ARG4-pMETNRG1-HA::HIS1 BWP17 nrg1∆::URA3/NRG1S200A –HA::HIS1 JC1308 BWP17 kic1∆∆; nrg1∆::SAT1/NRG1S200E-T251E-T281E Este trabajo JC1336 BWP17 kic1∆::ARG4/kic1Δ::HIS1; NRG1-HA::HIS1 Este trabajo JC1347 BWP17 cbk1∆∆; nrg1∆::SAT1/NRG1S200E-T251E-T281E Este trabajo JC1355 Este trabajo JC1359 BWP17 kic1∆::ARG4/kic1∆::HIS1; nrg1∆::URA3/nrg1∆::SAT1 BWP17 nrg1∆::URA3/nrg17A-HA::ARG4 JC1370 BWP17 nrg1∆::URA3/NRG1-GFP::ARG4 Este trabajo JC1373 BWP17 cbk1∆::ARG4/cbk1∆::HIS1 nrg1∆::URA3/ Este trabajo JC1391 cbk1∆::SAT1 BWP17 nrg1∆::URA3/NRG1T251E-T281E -HA::HIS1 Este trabajo JC1393 BWP17 nrg1∆::URA3/NRG1 T251A -HA::HIS1 Este trabajo Este trabajo Este trabajo JC1395 BWP17 nrg1∆::URA3/NRG1S200A-T251A-T281A -HA::HIS1 Este trabajo JC1398 BWP17 nrg1∆::URA3/nrg1 -GFP::HIS1 Este trabajo JC1408 BWP17 nrg1∆::URA3/nrg17A-T251A-T281A -HA::HIS1 Este trabajo JC1565 BWP17 nrg1∆::URA3/nrg17A-T251E-T281E -HA::HIS1 Este trabajo JC1578 BWP17 nrg1∆::URA3/NRG1-HA::ARG4 cbk1∆::HIS1/cbk1∆::SAT1 Este trabajo 7A 49 Materiales y Métodos TABLA 2 PLASMIDO TIPO REFERENCIA pFA-URA3 Disrupción génica (Gola et al., 2003) pFA-HIS1 Disrupción génica Gola et al., 2003 pFA-ARG4 Disrupción génica Gola et al., 2003 pFA-SAT1 Disrupción génica (Schaub et al., 2006) pFA-ARG4-pMET3 Promotor reprimible Gola et al., 2003 pFA-HA::URA3 Marcaje con epítopo HA (Lavoie, 2008 #1) pFA-HA::HIS1 Marcaje con epítopo HA Lavoie et al, 2008 pFA-HA::ARG4 Marcaje con epítopo HA Lavoie et al, 2008 pFA-GFP::HIS1 Marcaje con epítopo GFP Gola et al., 2003 pFA-GFP::ARG4 Marcaje con epítopo GFP Gola et al., 2003 pFA-ARG4-3’UTR(NRG1) Mutagénesis dirigida Este trabajo pFA-nrg1S200A-ARG43’UTR(NRG1) pFA-nrg1T251A T281A-ARG43’UTR(NRG1) pFA-nrg1S200A-T251A T281AARG4-3’UTR(NRG1 pFA-nrg1T251E T281E-ARG43’UTR(NRG1) pFA-nrg1S200E-T251E T281EARG4-3’UTR(NRG1) pFA-nrg17A-ARG43’UTR(NRG1) Mutagénesis dirigida Este trabajo Mutagénesis dirigida Este trabajo Mutagénesis dirigida Este trabajo Mutagénesis dirigida Este trabajo Mutagénesis dirigida Este trabajo Síntesis génica TABLA 3 Oligos delección SECUENCIA S1NRG1 AGAATCTGAAACAGGTATTATATAAATAACAATAAAACATCGTTATCCTGTTTCTCATCTCAA AATTTTTCCCTGCTAGTTTCATTAAGAATCAAACAATGAAGCTTCGTACGCTGCAGGTC S2NRG1 TTTGGAGGTAAAAGTATATTAGAAAAAGAACCTATACATGAACCAGTAACCATAACAAAAAAA AACTAAACCCAAGCAATTAACCATCCAAATTTAACCCTCTGATATCATCGATGAATTCGAG S1MOB2 GGAAAAGAGAAAGAAGAGGAAAGAAAAAATATAACAGGAATTGACAGAACAGGTGTTATAGA TTCAGCCTTTTTTCATTAACCAACTATATTAATTAGCGAAGCTTCGTACGCTGCAGGTC S2MOB2 ATACACGTACTATACTATACTATTCAATATATACACTAAACTCAACAATTCAAGGCACTAAAG ATCAATCTCGTAGTCTTGGCAACATATAGCTTGTCTGATATCATCGATGAATTCGAG 50 Materiales y Métodos Oligos marcaje SECUENCIA S1-NRG1-HA AAGACTCATACCAATGGGAAAAACAAACGCAACAGACAACAACACAGGACTTTAGAAGCTTC ACATGTTGGAACAAAATACAACACCAAGAGCCTAGTACCCGGGTACCCATACGATGTTCC S2-NRG1-HA ACTTCAAATTCGTGTACTTTGCTTATGCCAGATACTTAGCACTGGGAAATTGTTACAACCCCA TTTCTGGAAATGTAACGTCACCTGAAACCATCTTATGTCATCGATGAATTCGAGCTCGTT S1-NRG1-GFP CAAGACTCATACCAATGGGAAAAACAAACGCAACAGACAACAACACAGGACTTTAGAAGCTT CACATGTTGGAACAAAATACAACACCAAGAGCCTAGTAGGTGCTGGCGCAGGTGCTTC S2-NRG1-HA-GFP TTTTGATATTTATAATAATAGGTCACCTGTTTTGAGTATCTACAGGGACTTTTATTTTCATAAG GTGGATATGCTATCACTTGGTCTGATATCATCGATGAATTCGAG NRG1T281A-HA GAAGCCCGTTTTGCTCGTCAAGATAATTGTAATCAACATTACAAGACTCATGCCAATGGGAA AAACAAACGCAACAGACAACAACACAGGACTTTAGAAGCTTCACATGTTGGAACAAAATACA ACACCAAGAGCCTAGTACCCGGGTACCCATACGATGTTCCTGAC NRG1T281E-HA GAAGCCCGTTTTGCTCGTCAAGATAATTGTAATCAACATTACAAGACTCATGAAAATGGGAAA AACAAACGCAACAGACAACAACACAGGACTTTAGAAGCTTCACATGTTGGAACAAAATACAA CACCAAGAGCCTAGTACCCGGGTACCCATACGATGTTCCDGAC Sustitución promotores SECUENCIA S1-pMET3-NRG1 AAAATATCAAAAATAATCCTATTATCAGTTATTATATACTAGGATTTGTTATTACAATTTGCTT TACAAGAGAACCTCATTGTTCAAGTATCTTCCAGAAGAAGCTTCGTACGCTGCAGGTC S2-pMET3-NRG1 ACAACGTGCAACCACCGTCAATTATAGAAGCTGTGGATGTACTACCGCAGCACTAGCATTTA ATAACTTATTTGTTATTGGATATGATTGTTGATAAAGCATGTTTTCTGGGGAGGGTATTTAC Mutagénesis dirigida M1-NRG1(SalI) M2-NRG1(BamHI) SECUENCIA GCTAGTCGACACAGCTTCTATAATTGACGGTGGTTGCAC GCTAGGATCCCCCAAGCAATTAACCATCCAAATTTAACCC M6(A)-NRG1 AGTAAATCACCAGTAGAGTTCGCCCGTATTTTGGCATGATCAA M5(A)-NRG1 TTGATCATGCCAAAATACGGGCGAACTCTACTGGTGATTTACT M3(A)-NRG1 CTAGACACAATCGTATCCATGCGGGAGAGAGAAAACACCAATGTCCATGGCCAACATGTGAA GCCCGTTTTGCTCGTCAAGATAATTGTAATCAACATTACAAGACTCATGCGAATGGGAAAAA CAAACGCAA M4(A)-NRG1 TTGCGTTTGTTTTTCCCATTCGCATGAGTCTTGTAATGTTGATTACAATTATCTTGACGAGCA AAACGGGCTTCACATGTCGGCCATGGACATTGGTGTTTTCTCTCTCCCGCATGGATACGATT GTGTCTAG M6(E)-NRG1 AGTAAATCACCAGTAGAGTTCTCCCGTATTTTGGCATGATCAA M5(E)-NRG1 TTGATCATGCCAAAATACGGGAGAACTCTACTGGTGATTTACT M3(E)-NRG1 CTAGACACAATCGTATCCATGAGGGAGAGAGAAAACACCAATGTCCATGGCCAACATGTGAA GCCCGTTTTGCTCGTCAAGATAATTGTAATCAACATTACAAGACTCATGAGAATGGGAAAAAC AAACGCAA M4(A2)-NRG1 TTGCGTTTGTTTTTCCCATTCTCATGAGTCTTGTAATGTTGATTACAATTATCTTGACGAGCA AAACGGGCTTCACATGTTGGCCATGGACATTGGTGTTTTCTCTCTCCTCATGGATACGATTGT GTCTAG 3’UTR-NRG1 5’- GCTAGAGCTCCCCTGCCGCCTTTGTATTAAGACAACCCCG 51 Materiales y Métodos SacI 3’UTR-NRG1 3’SacI GCTAGATATCGGGGGGAAGTTGCCAATAATAAATGAGCAG Comprobación por PCR SECUENCIA G1-NRG1 CCCCTCCTTGCTTTCATCTTGTTTGTCAC G2-NRG1 GGCCCTGGAATATAATACTTCCTGTAG G4-NRG1 CCACGATGGCCAAAAGAAATACTAAAGTTGGC NRG1-S1 GCAACCCCAACAAACACTAC NRG1-S2 CCCAAGAAGAAAACACG G1B-MOB2 CATGACGTAATGGGGCCAACATTATCCAG X2CaARG4 AATGGATCAGTGGCACCGGTG X3CaARG4 GCTCTTGGTGGTACTGCTAAAAGTGCCG X2CaHIS1 CAACGAAATGGCCTCCCCTACCACAG X3CaHIS1 GACGAATTGAAGAAAGCTGGTGCAACCG X2CaURA3 GTGTTACGAATCAATGGCACTACAGC X3CaURA3 GGAGTTGGATTAGATGATAAAGGTGATGG X2SAT1 GCACACACTACTTAATATACACAG X3SAT1 GTGAAGTGTAAGGGGGAG P3MET3 TCAAGTATACGTAATCTCCCC G2-MET-NRG1 GCTGTTGCTGCTGCTCGCTTGGTTGG 52 OBJETIVO Objetivo Dada la importancia de C. albicans como patógeno oportunista en humanos, es importante comprender la biología de su interacción con el hospedador. Un factor importante de esta interacción es su capacidad de crecer como levadura o hifa dependiendo de las condiciones ambientales del nicho que conloniza en el hospedador. Se ha postulado que la transici´ón levadura-micelio de este hongo es un factor de virulencia importante. La activación del programa de desarrollo hifal implica la inactivación del represor Nrg1 que se une a los promotores de los génes específicos de hifas (HSGs) durante el crecimiento levaduriforme. El objetivo de este estudio ha sido profundizar en la regulación negativa de Nrg1 tras la adición de suero, inductor del crecimiento hifal. Para lograr dicho objetivo se han construido cepas que permitieron el análisis de la proteína en diferentes fondos genéticos. Los resultados obtenidos se han validado mediante estudios de mutagénesis dirigida de NRG1 que nos han permitido identificar que residuos de su secuencia proteíca son importantes en dicha regulación. 54 RESULTADOS Resultados 1. Nrg1 se degrada al inicio del crecimiento hifal Como primera aproximación al estudio del represor hifal Nrg1 se analizó su comportamiento electroforético mediante Western-Blot durante la transición levadura-hifa. Para ello, se añadieron tres copias del epítopo HA al extremo 3’ del gen NRG1 utilizando los plásmidos pFA descritos en materiales y métodos. La cepa NRG1/NRG1-HA (JC1186), tras crecer toda la noche a 30°C, se diluyó en un medio inductor del crecimiento hifal (37°C en YPD suplementado con 10% de suero) y se recogieron muestras a 0, 0.5, 2, 4 y 6 horas para su posterior análisis mediante western-blot (WB). Como puede observarse en la figura 14, los niveles de Nrg1 disminuyeron drásticamente en los primeros 30 minutos de inducción volviendo a hifal, acumularse progresivamente a partir de las dos horas. Como control de carga se Figura 14. Los niveles de Nrg1 disminuyen durante el inicio del crecimiento hifal. Células levaduriformes de la cepa JC1186 (NRG1-HA) se incubaron en condiciones de crecimiento hifal (YPD+10% suero a 37ºC) y se recogieron muestras a los tiempos indicados para analizar los niveles de Nrg1 mediante Western-Blot con anticuerpos anti-HA. Anticuerpos anti-PSTAIRE se utilizó como control de carga. utilizó PSTAIRE que subunidades Cdks, el anticuerpo reconoce catalíticas cuyos niveles antia las de las son constantes a lo largo del ciclo celular. Se sabe que al inicio del crecimiento hifal existe una disminución en los niveles de transcripción de NRG1 (Lu et al., 2011) que depende de la señalización mediada por la PKA Tpk2 (Fig. 15), por lo que la disminución en los niveles de la proteína observados pudiera deberse a una disminución en la tasa de transcripción del gen. Sin embargo, nos preguntamos si además de esta regulación transcripcional pudiera existir algún mecanismo post- transcipcional adicional que contribuyese a esta caída tan brusca en los niveles de Nrg1. 56 Resultados Con el fin de determinar si la estabilidad de la proteína Nrg1 se modificaba en respuesta a suero se construyó una cepa que nos permitiera estudiar la vida media de dicha proteína. Para Figura 15. Los niveles de RNAm de disminuyen al inicio del crecimiento Tomado de Liu et al., 2011 Nrg1 hifal. ello, promotor delante insertamos regulable del alelo el pMET3 NRG1-HA dando lugar a la cepa pMET3- NRG1-HA/NRG1 (JC1211). En esta cepa, la transcripción del ARNm de NRG1-HA depende del promotor pMET3. Este promotor se transcribe cuando las células crecen en un medio carente de metionina y cisteína (condiciones que denominaremos ON) y se reprime con la adición de dichos aminoácidos (OFF) (Care et al., 1999). Por tanto, los niveles de Nrg1 en condiciones de represión (OFF) dependerán de la estabilidad de la proteína y no de la tasa de transcripción del gen. Una vez construida la cepa pMET3-NRG1HA/NRG1, se realizaron experimentos de represión del promotor pMET3 en condiciones de crecimiento levaduriforme e hifal (Fig. 16A). Para ello, células levaduriformes crecidas en ausencia de metionina (ON) se inocularon en medios suplementados con metionina y cisteína (OFF) en condiciones de crecimiento levaduriforme (30°C) y miceliar (37°C+ 10% suero). Posteriormente, se recogieron muestras durante 40 min, a intervalos de 10 min, para analizar los niveles de Nrg1-HA. Como puede observarse en la figura 16B, estos experimentos pusieron de manifiesto que la proteína Nrg1 es más estable en levaduras que en hifas ya que mientras que existían niveles detectables de Nrg1 en extractos de células levaduriformes 40 min después de la adición de metionina y cisteína, no se detectó Nrg1 tras 10 min de apagado en condiciones de crecimiento hifal. 57 Resultados Para determinar con más precisión la vida media de la proteína durante el crecimiento hifal, se realizó el mismo experimento durante los primeros 10 min después de la represión del promotor, tomando muestras cada 2 minutos. Como puede observarse en la figura 16C, la vida media de Nrg1 en levaduras fue superior a 30 min mientras que en hifas inferior a 2 min. En resumen, los resultados expuestos en este apartado indican claramente que la estabilidad de Nrg1 se regula de forma diferente dependiendo del tipo del crecimiento y que existe una regulación post-transcripcional que induce la degradación del represor Nrg1 al inicio del crecimiento hifal. Figura 16. La proteína Nrg1 es inestable al inicio del crecimiento hifal. Células de la cepa JC1211 (pMET3-NRG1-HA/NRG1) crecidas en MM a 30ºC (Levaduras, promotor ON) se inocularon en MM suplementado con 5mM de Met y 1mM de Cys (promotor OFF) a 30ºC (levadura) o a 37ºC suplementado con suero (hifas). Se recogieron células a los tiempos indicados y posteriormente se procesaron y analizaron por western Blot con anticuerpo anti-HA. Anticuerpos anti-PSAIRE se utilizaron para el control de carga. 58 Resultados 2. Nrg1 se acumula en los núcleos subapicales de la hifa Dado que Nrg1 es un represor de HSGs, sorprende que se acumule tras 4 horas de crecimiento hifal (Fig. 14) ya que los genes diana que reprime se expresan en hifas (Lu et al., 2011). Esta paradoja podría explicarse si Nrg1 se encontrara excluida del núcleo. Con el fin de comprobar esta hipótesis, se estudió la localización de Nrg1 en células de la cepa NRG1-GFP/nrg1∆ (JC1370) tras 4 horas en condiciones inductoras de crecimiento hifal. Este análisis puso de manifiesto que la localización nuclear de Nrg1 encontraba regulada espacialmente a lo largo de la hifa ya que intensa en los núcleos de las células subapicales, 1,874±0.769 (n=37) respecto a las se era más con una ratio de células apicales (Fig 17A). Dada la función represora de Nrg1, esta distribución nuclear asimétrica sugeriría una expresión diferencial de los HSG en la célula apical de la hifa. Con el fin de comprobar utilizamos esta la hipótesis, cepa JC263 construida en nuestro laboratorio por el Dr. David (Caballero-Lima, Caballero-Lima 2009). En esta cepa, la expresión de la GFP se encuentra bajo las órdenes de 1 Kb de la región promotora del gen Figura 17. A. Nrg1 se acumula en los núcleos subapicales de la hifa. Microscopía de fluorescencia de la cepa NRG1-GFP/nrg1∆ (JC1370) tras 4 horas en YPD + 10% de suero a 37. CW: Calcofluor-White. B. Estudio espacial de la expresión de HWP1 en hifas mediante la construcción pHWP1-GFP::RP10 (JC263) HWP1, específico de hifas expresión se reprime por cuya Nrg1 (Braun et al., 2001; Kadosh and Johnson, 2005), y que posee todos los elementos en cis necesarios para su regulación ya que la GFP 59 Resultados no se expresa en levaduras (datos no mostrados). Si la localización nuclear de Nrg1 en los compartimentos subapicales se correlacionara con su función represora, cabría esperar que la construcción pHWP1-GFP expresara la GFP principalmente en la célula apical, lo que daría lugar a un incremento de la fluorescencia en el extremo de la hifa. Para comprobar esta idea, se incubó la cepa pHWP1-GFP::RP10 en YPD suplementado con 10% de suero a 37ºC el tiempo suficiente (3h) para completar el proceso de septación y generar compartimentos apicales y subapicales en la hifa. Transcurrido ese tiempo se analizaron las células mediante microscopía de fluorescencia. Con el fin de visualizar los septos, las células se tiñeron con CW. Aunque la señal de fluorescencia de la GFP se distribuía con igual intensidad a lo largo de toda su estructura en la mayoría de las hifas, también se observaron patrones de expresión claramente asimétricos como los que se muestran en la figura 17B. Estos resultados son similares a los obtenidos por el Dr. David Caballero-Lima al analizar la expresión de GFP bajo las órdenes de los promotores HWP1 y ECE1 (Caballero-Lima, 2009). En conjunto, las observaciones realizadas en este apartado sugieren que durante el mantenimiento del crecimiento hifal existe una regulación diferente de Nrg1 en las células apicales y subapicales que podría ser necesaria para que los HSGs se expresaran únicamente en la célula apical de la hifa que es la que mantiene un crecimiento activo, ya que las células subapicales se encuentran bloqueadas en G1 (Hazan et al., 2002). 3. Nrg1 es una fosfoproteína Hasta ahora se ha demostrado que los niveles de Nrg1 disminuyen al inicio del crecimiento hifal y que debe de existir algún mecanismo posttranscripcional fosforilación es que contribuya un mecanismo a esa celular drástica muy reducción. común de Dado que regulación la post- transcipcional, se procedió a estudiar si Nrg1 era una fosfoproteína. Para ello se construyó una cepa en la que se fusionaron 3 copias del epítopo HA al extremo carboxilo de una copia de NRG1 mediante PCR y la otra copia fue 60 Resultados delecionada, dando lugar a una nrg1∆/NRG1-HA cepa (JC1139). La funcionalidad de la construcción se comprobó analizando el comportamiento de los transformantes obtenidos. Teniendo en cuenta que Nrg1 es un represor del crecimiento hifal, si la construcción afectara a la funcionalidad de la proteína dichos transformantes deberían crecer en forma de hifas en condiciones de crecimiento levaduri-forme, algo que no sucedió (datos no mostrados). Una vez confirmado que el epítopo HA no afectaba a la función de Nrg1, se procedió comportamiento extractos Figura 18. Nrg1 es una fosfoproteína. A. SDS-PAGE de extractos de una cepa NRG1HA/nrg1∆ (JC1139), crecidos en condiciones de levadura, se incubaron en presencia (+) o ausencia (-) de λ-fosfatasa. Posterior-mente, dichos extractos se analizaron mediante Western-Blot con anticuerpos anti-HA. B. SDS-PAGE con 25 M de PhosTag de Nrg1-HA en presencia (+) o ausencia (-) de λ-fosfatasa. fosfoproteína (Fig. 18A). a estudiar electroforético procedentes de su en cultivos levaduriformes. La migración de Nrg1 en los geles de acrilamida dio lugar a un patrón difuso con varias bandas de distinta dicho movilidad. El extracto con tratamiento de λ-fosfatasa (λ- PPtasa) eliminó las formas de menor movilidad indicando que Nrg1 es una Con el fin de mejorar la resolución de las diferentes isoformas de Nrg1 se utilizaron geles con Phostag. Estos geles contienen un reactivo denominado Phos-Tag que se unen a los fosfatos de las proteínas durante la electroforesis retardando su migración de forma proporcional al número de fosfatos que posean. Por tanto, este tipo de geles aumenta la resolución a la hora de analizar las diferentes isoformas fosfariladas de una proteína presente en extractos celulares (Fig. 19). Tras varias pruebas preliminares, se determinó que las condiciones óptimas de resolución para separar las diferentes isoformas de Nrg1 presente en extractos de cultivos levaduriformes eran geles de acrilamida al 8% con 25 M de Phos-Tag. En estas condiciones, la proteína silvestre Nrg1 se resolvió en 61 Resultados numerosas bandas que desaparecían al tratar los extractos con λ-fosfatasa (Fig. 18B). Por tanto, estos resultados indican que Nrg1 se encuentra fosforilada durante el crecimiento levaduriforme. Figura 19. Esquema del funcionamiento de los geles Phos-Tag. Tomado de Wako Ltd. 4. Nrg1 se fosforila rápidamente al inicio del crecimiento hifal Sabiendo que Nrg1 es una fosfoproteína que se degrada al inicio de la transición levadura-hifa, el siguiente paso fue estudiar si la proteína se fosforilaba en respuesta a suero. Para ello se realizó un experimento en el que se recogieron muestras de una cepa silvestre NRG1-HA (JC1186) a tiempos cortos después de la inducción hifal. Los resultados se muestran en la figura 20 y como puede apreciarse, el ratio de formas fosforiladas versus no fosforiladas aumentó tras la exposición a suero. Además esta modificación fue rápida ya que se detectó a los pocos minutos de la inducción hifal (comparar tiempos 0 y 4 min). Por tanto, estos resultados sugieren que Nrg1 se fosforila rápidamente en respuesta a suero y que dicha fosforilación precede en el tiempo a la degradación de Nrg1. Figura 20. Nrg1 se fosforila rápidamente al inicio del crecimiento hifal. Células levaduriformes de la cepa JC1186 (NRG1-HA) se incubaron en condiciones de crecimiento hifal (YPD+10% suero a 37ºC) y se recogieron muestras a los tiempos indicados para analizar los niveles de Nrg1 mediante Western-Blot con anticuerpos anti-HA. Anticuerpos antiPSTAIRE se utilizaron como control de carga. 62 Resultados 5. Quinasas que podrían estar implicadas en la regulación de Nrg1 Hasta el momento hemos demostrado que Nrg1 es una fosfoproteína sometida una regulación post-transcripcional por fosforilación al inicio de la respuesta a suero que podría inducir la degradación de Nrg1. Pero, ¿Qué quinasas podrían ser las responsables de esta fosforilación al inicio de la repuesta hifal? Para responder a esta pregunta se realizó una búsqueda de posibles sitios de fosforilación por quinasas en la secuencia de aminoácidos codificada en el gen NRG1. Este análisis puso de manifiesto que, además de los tres sitios consenso de fosforilación por Cbk1 mencionados anteriormente, existían 7 sitios SP agrupados en el extremo amino-terminal de la proteína, los cuales podrían ser posibles sitios de fosforilación de diferentes quinasas entre las que se encuentran las Cdks (Fig. 21). Con el objetivo de determinar si estas quinasas son las responsables de dicha fosforilación, se estudio la estabilidad de Nrg1 durante la transición levadura-hifa en mutantes Figura 21. Nrg1 tiene siete sitios SP y tres sitios Cbk1. Círculos azules: sitios SP. Círculos verdes; sitios consenso de la NDR quinasa Cbk1. Rectángulos azules: Dominios con dedos de Zn. deficientes en actividad de estas quinasas importantes en la morfogénesis de C. albicans. Los mutantes empleados fueron los deficientes en la actividad Cdk asociada a las ciclinas Ccn1 y Hgc1 (ccn1∆∆ y hgc1∆∆) y el mutante mob2∆∆ deficiente en la actividad de la NDR quinasa Cbk1. Para estudiar la estabilidad de Nrg1 en estos mutantes se construyeron las cepas mutantes NRG1-HA ccn1∆∆ (JC1196), NRG1-HA hgc1∆∆ (JC1194) y NRG1-HA mob2∆∆ (JC1161). Una vez construidas, se procedió a comprobar la estabilidad de la proteína durante la transición levadura-hifa. Para ello, cultivos levaduriformes de las tres cepas mutantes y de un control silvestre se 63 Resultados pusieron en condiciones de miceliación recogiéndose muestras a tiempos 0, 30 y 120 min tras la adición de suero. Como puede observarse en la figura 22, la cinética de los niveles de Nrg1 en un mutante hgc1∆∆ fue similar al control silvestre ya que se observó una reducción en los niveles de Nrg1 a los 30 min para luego acumularse tras 120 min de exposición a suero. Sin embargo, en los mutantes ccn1∆∆ y mob2∆∆ no se observó dicha disminución al inicio de la transición levadura-hifa. Por tanto, estos resultados sugieren que los complejos quinasa Cbk1/Mob2 y Cdc28/Ccn1 son necesarios para inducir la degradación de Nrg1 al inicio del crecimiento hifal. Figura 22. Estabilidad de Nrg1 en distintos mutantes quinasas. Muestras de una cepa silvestre JC1186 (NRG1-HA) y de los mutantes mob2∆∆ (JC1161), ccn1∆∆ (JC1196) y hgc1∆∆ (JC1194) recogidas durante las dos primeras horas de crecimiento hifal se analizaron mediante Western-Blot y se incubaron con anti-HA para determinar los niveles de Nrg1 durante la transición levadura-hifa. Como control de carga se utilizó anti-PSTAIRE. 6. Caracterización de los sitios SP presentes en Nrg1 Para estudiar con más detalle la importancia de los siete sitios SP de Nrg1, se construyó por síntesis génica un alelo de Nrg1 fosfodeficiente en el que se sustituyeron las posibles serinas fosfoaceptoras de los 7 sitios SP por 64 Resultados alanina (Fig. 23A). A este alelo fosfodeficiente se le fusionó el epítopo HA en el extremo C-terminal. El alelo mutante se utilizó para reemplazar la copia silvestre de la cepa heterocigótica NRG1/nrg1∆ (JC1075), quedando éste como única fuente de Nrg1 en la célula. Una vez construida la cepa nrg1-7AHA/nrg1∆ (JC1359), a la que denominaremos nrg1-7A, se procedió a realizar los experimentos pertinentes para estudiar la importancia de estos siete sitios SP en la regulación del represor Nrg1 al inicio de la respuesta a suero. 6.1. El estado de fosforilación de Nrg1 depende de los sitios SP Como primera aproximación al estudio de los mutantes nrg1-7A se analizó la morfología de sus células a 30ºC. Como puede observarse en la figura 24A, la expresión del alelo nrg1-7A dio no lugar a ningún fenotipo relevante indicando que este grupo de SP no es importante para Figura 23. A. Esquema de la proteína Nrg1-7A. Círculos rojos: sitios SP mutados a AP. Círculos verdes: sitios Cbk1. B. SDS-PAGE de Nrg1-HA y Nrg1-7A-HA procedentes de células levaduriformes. C. SDS-PAGE con 25 uM Phostag de los mismos extractos descritos en B. mantener la función represora de Nrg1. Sin embargo, el análisis de extractos celulares levaduriformes puso de de cultivos manifiesto que la proteína Nrg1-7A-HA migraba como una única banda que presentaba una mayor movilidad electroforética que la proteína silvestre Nrg1-HA (Fig. 23B). Por tanto, esta observación indica que el estado de fosforilación de Nrg1 depende de los sitios SP presentes en el extremo amino-terminal de Nrg1. Con el fin de determinar si existían otros residuos fosforilados en la proteína Nrg1-7A se utilizaron geles con Phostag. En estas condiciones, la proteína Nrg1-7A se separó en dos isoformas de parecido peso molecular que migraban próximas a la altura de las formas no fosforiladas presentes en 65 Resultados extractos de cultivos silvestres (Fig. 23C), lo que podría sugerir la existencia de otros sitios fosforilados en Nrg1, independientes de los sitios SP, durante el crecimiento levaduriforme. A continuación, nos preguntamos si esta fosforilación deficiente de Nrg1 podía modificar su distribución subcelular. Para ello, se construyeron las cepas NRG1-GFP GFP/nrg1∆) (JC1370: y se NRG1-GFP/nrg1∆) analizaron mediante y nrg1-7A-GFP microscopía de (JC1398: nrg1-7A- fluorescencia. La eliminación de los sitios SP no afectó la localización nuclear de Nrg1 en Figura 24. A. Los sitios SP regulan el transporte núcleo-citoplasma de Nrg1 durante el crecimiento levaduriforme. Microscopía de fluorescencia y cuantificación de la señal GFP nuclear en células silvestres Nrg1-GFP y mutantes Nrg1-7A-GFP. B. La exclusión nuclear de Nrg1 en respuesta a suero es independiente de los sitios SP. Microscopía a lo largo del tiempo de las cepas NRG1-GFP y nrg1-7A-GFP crecidas en un soporte sólido de MM suplementado con 10% de suero a 37ºC. Las flechas señalan células que responden a suero en el mutante nrg1-7A. 66 Resultados células levaduriformes, como cabía esperar por la ausencia de fenotipo (Fig. 24A). Sin embargo, la intensidad de la señal en el núcleo fue significativamente mayor en el mutante respecto al control silvestre Nrg1-GFP. Dado que la estabilidad de la proteína no se vio afectada por la introducción de las mutaciones (Fig. 23B), este resultado sugiere que la fosforilación dependiente de los sitios SP regula el transporte núcleo-citoplasma de Nrg1 durante el crecimiento levaduriforme. Se ha descrito que Nrg1 se excluye rápidamente del núcleo al inicio del crecimiento hifal (Alaalm, 2012). Con el objeto de analizar si los sitios SP eran necesarios para esta regulación espacial, se analizó la localización de Nrg1-7A en células crecidas en un soporte sólido en condiciones inductoras del crecimiento hifal mediante microscopía de fluorescencia a lo largo del tiempo (Fig. 24B). Este análisis puso de manifiesto que Nrg1-7A era excluido del núcleo en respuesta a suero (Flechas en figura 24B) como el control silvestre aunque la señal citoplasmática de GFP persistía por más tiempo, sugiriendo que la proteína es más estable. Por tanto, estos resultados indican que la exclusión nuclear de Nrg1 en respuesta a suero es independiente de los sitios SP. 6.2. La degradación de Nrg1 en respuesta a suero depende de los sitos SP Tras descartar una función de los sitios SP en la regulación espacial de Nrg1 en la transición levadura-hifa, se procedió a estudiar su papel en la disminución de los niveles de Nrg1 en respuesta a suero. Para ello, se obtuvieron extractos proteicos de muestras recogidas a 0, 30 y 120 minutos tras la adición de suero, de una cepa silvestre y un mutante nrg1-7A, las cuales se procesaron y analizaron mediante western-blot. 67 Resultados A diferencia del control silvestre, cuyos niveles de Nrg1 fueron prácticamente indetectables a los 30 min de adición de suero, las células que expresaban Nrg1-7A fueron incapaces de reducir los niveles del represor (Fig. 25A). Por tanto, estos resultados sugieren que la fosforilación de los sitios SP es necesaria para degradar al represor Nrg1 durante la transición levadurahifa. Figura 25 A. La degradación de Nrg1 en respuesta a suero depende los sitios SP. Una cepa silvestre y un mutante nrg1-7A se pusieron en condiciones de crecimiento hifal (37°+10%suero) y se recogieron muestras a los tiempos indicados en la figura que se analizaron por WesternBlot con anticuerpos anti-HA. Para el control de carga se utilizó anticuerpos anti-PSTAIRE. B El crecimiento levaduriforme y miceliar es independiente de los sitios SP. Morfología de las células del mutante nrg1-7A crecidas a 30°C y a 37°C suplementado con 10% de suero. 6.3. El mutante nrg1-7A responde normalmente al suero Si el único mecanismo de inactivación de la función represora de Nrg1 fuera la drástica disminución de sus niveles, cabría esperar que el mutante nrg1-7A fuera incapaz de formar hifas ya que la proteína no se degrada. Para comprobar esta hipótesis, se estudió la respuesta a suero del mutante nrg1-7A mediante microscopía óptica. Como puede observarse en la figura 25B, las células que expresaban el alelo fosfodeficiente nrg1-7A fueron capaces de generar hifas normales en respuesta a suero. El hecho de que el mutante nrg1-7A se comporte como el control silvestre, tanto en condiciones de 68 Resultados crecimiento levaduriforme como hifal, tiene varias implicaciones. En primer lugar, sugiere que la fosforilación de estos sitios no es importante para garantizar su función represora en levaduras, ya que las células son levaduriformes a 30ºC. En segundo lugar, indica que la degradación de Nrg1 dependiente de los sitios SP no es esencial para inactivar a Nrg1 durante el desarrollo hifal. Por tanto, debe de existir otro mecanismo de inactivación adicional que sea capaz de interferir con la unión de Nrg1 a los promotores de los HSGs, liberando a éstos de su función represora y permitiendo el acceso de los factores de transcripción Efg1 y Cph1. 6.4. La proteína nrg1-7A-GFP se acumula en el núcleo apical de la hifa Dado que Nrg1 es estable en los mutantes ccn1∆∆ (Fig 22) y nrg1-7A (Fig. 25), la fosforilación de los 7 SP por Cdc28/Ccn1 podría ser la señal que activara su degradación. Esta hipótesis es consistente con la observación de que Nrg1 se acumula en las células subapicales (Fig. 17), las cuales se encuentran paradas en G1 y por tanto poseen poca actividad Cdk. Si el complejo Cdc28/Ccn1 desempeñara alguna función en la regulación de Nrg1 en la célula apical, la expresión del alelo fosfodeficiente nrg1-7A daría lugar a la acumulación del represor en el núcleo apical de la hifa a pesar de la existencia del complejo Cdc28/Ccn1. Con el fin de comprobar esta idea, se analizó la fluorescencia de GFP en hifas de la cepa nrg1-7A-GFP/nrg1∆ (JC1398) tras 4h en YPD suplementado con 10% de suero a 37ºC. Como puede observarse en la figura 26, la expresión del alelo fosfodeficiente nrg1-7A dio lugar a una acumulación nuclear en todos los compartimentos de la hifa (Fig. 26). Mientras que en las hifas silvestres, como ya se ha comentado, la ratio de la señal subapical/apical fue de 1.874±0.769 (n=37), en el mutante nrg1-7A fue de 1.067±0.26 (n=45). Por tanto, estos resultados indican que la fosforilación dependiente de los 7 SP es responsable de la exclusión de Nrg1 en la célula apical de la hifa. 69 Resultados Figura 26. La exclusión nuclear de Nrg1 en la célula apical de la hifa depende de los sitios SP. Localización de Nrg1-GFP en hifas de las cepas NRG1-GFP (JC1370) y nrg1-7A-GFP (JC1398) tras 4 horas en condiciones de crecimiento hifal (YPD+ 10% suero 37ºC). La gráfica de la derecha representa la cuantificación de la fluorescencia GFP en los núcleos de la hifas de las cepas indicadas y representados como ratio subapical/apical. 6.5. La proteína Nrg1-7A se fosforila en respuesta a suero A continuación, decidimos analizar si la proteína Nrg1-7A se fosforilaba durante la transición levadura-hifa, ya que nuestros resultados sugerían la existencia de un mecanismo adicional a la degradación que debe inactivar la función represora de Nrg1. Este mecanismo debe encontrarse operativo en el mutante nrg1-7A ya que responde normalmente a suero. Dado que Nrg1 se fosforila rápidamente en respuesta a suero (Fig. 20), decidimos hacer el estudio a tiempos 0, 5 y 10 min después de la inducción hifal en células nrg1-7A. Una vez obtenidos los extractos proteicos se analizaron en geles acrilamida al 8% con 25 μM de Phos-Tag. Como puede observarse en la figura 27 se detectó una nueva isoforma de Nrg1-7A que tenía menor movilidad electroforética tras 5 min en suero, lo que sugiere que Nrg1 se fosforila rápidamente en respuesta a suero en residuos diferentes a los sitios SP presentes en el extremo amino terminal. 70 Resultados Figura 27. El mutante nrg1-7A se fosforila al inicio del crecimiento hifal. Células de la cepa nrg1-7A-HA/nrg1∆ (JC1359) se incubaron en YPD suplementado con 10% de suero a 37ºC y se recogieron muestras a los tiempos indicados para su análisis por western-Blot utilizando un gel con 25 M Phos-Tag. 7. Caracterización de los sitios consenso de fosforilación por Cbk1 Puesto que la proteína Nrg1-7A se fosforila en respuesta a suero, tratamos de identificar la quinasa responsable y el efecto de dicha modificación sobre la función represora de Nrg1. En una primera aproximación, nos centramos en la NDR quinasa Cbk1 por los siguientes Figura 28. Hipótesis: Cbk1 inhibe a Nrg1 en respuesta a las señales que inducen crecimiento hifal. Esfera: Nrg1, rectángulo azul: HSG motivos. Primero, los mutantes cbk1∆∆ son incapaces de formar hifas (McNemar and Fonzi, 2002; Song et al., 2008; Gutierrez- Escribano et al., 2011). Segundo, las células deficientes en Mob2 expresan los HSGs a niveles mucho más bajos que las células silvestres en presencia de suero (Song et al., 2008), lo que sugiere defectos en la inactivación de Nrg1 durante la transición levadura-hifa. Tercero, la proteína Nrg1 tiene 3 sitios consensos de fosforilación por Cbk1 (Fig. 21), dos de ellos en los dedos de zinc que interaccionan con el ADN. Basándonos en estas observaciones, nos planteamos la hipótesis de que Cbk1 inhibiera a Nrg1 en respuesta a suero 71 Resultados mediante la fosforilación de los residuos presentes en los dedos de Zn, lo que daría lugar a la pérdida de interacción de Nrg1 con los promotores de los HSGs (Fig. 28). 7.1. El mutante nrg1-2E tiene un fenotipo de pérdida de función Una predicción de esta hipótesis sería que un mutante fosfomimético de Nrg1 de los sitios Cbk1 debería comportarse como un mutante de pérdida de función, lo que daría lugar a un crecimiento hifal constitutivo. Con el fin de analizar esta posibilidad, se realizó una mutagénesis dirigida de los sitios consenso de fosforilación por Cbk1 presentes en Nrg1. Primero, se generó el alelo fosfomimético nrg1T251E/T281E en el que se sustituyeron las putativas Thr fosfoaceptoras, que se encuentran en la zona de unión al DNA, por Glu. Este alelo mutante se utilizó para reemplazar la copia silvestre de la cepa heterocigótica NRG1/nrg1∆ (JC1075) quedando éste como única fuente de Nrg1 en la célula. A partir de ahora, a esta cepa se le denominará nrg1-2E (JC1391). Figura 29. El mutante fosfomimético en los sitios consenso de fosforilación por Cbk1 T251 y T281 hiperpolariza su crecimiento en YPD a 30ºC, condiciones que inducen el crecimiento levaduriforme. Como puede observarse en la figura 29, la mutación nrg1-2E dio lugar a un fenotipo de pérdida de función ya que las células del mutante fosfomimético crecieron como hifas en condiciones de crecimiento 72 Resultados levaduriforme (YPD, 30ºC). Por tanto, estos resultados sugieren que la adición de fosfatos a las T251 y/o T281 de Nrg1 podrían interferir con la interacción de Nrg1 con los promotores de los HSGs. Esta idea se confirmó mediante experimentos de inmunoprecipitación de cromatina (ChIP) en el que se analizó la unión de Nrg1 a los promotores de los genes diana ALS3 y HWP1. Estos experimentos fueron realizados por nuestros colaboradores de la Universidad de Sheffield, los Drs. Linna Alaalm y Peter Sudbery. Como se puede observar en la figura 30 mientras que Nrg1 es capaz de unirse a los promotores de dichos genes en una cepa silvestre, en células del mutante nrg1-3E no se detectó interacción alguna. Por tanto, estos resultados sugieren que la fosforilación de los sitios Cbk1 presentes en Nrg1 impediría su interacción con los promotores de sus genes diana, inactivando por tanto su función represora. Figura 30. Nrg1 no se une a los promotores de HSGs en un mutante nrg1-3E. Unión relativa de Nrg1-5xmyc a los promotores de los genes específicos de hifas, ALS3 y HWP1, en células silvestre y células mutantes nrg1-3E (3E) durante el crecimiento levaduriforme en YPD a 30°C. La PCR cuantitativa se realizó usando cebadores de las regiones promotoras de los HSGs ALS3 y HWP1. Experimento realizado por la Dra Linna Alaalm en el laboratorio del profesor Peter Sudbery (Universidad de Sheffield, UK) 7.2. El alelo fosfomimético nrg1-3E da lugar a diferentes fenotipos en los mutantes cbk1 y kic1 en presencia de suero Dado que los mutantes RAM no polarizan su crecimiento en respuesta a suero y que el mutante fosfomimético nrg1-2E se comporta como un mutante de pérdida de función, nos preguntamos si la incapacidad de miceliar de los 73 Resultados Figura 31. La eliminación del gen NRG1 no rescata la incapacidad de los mutantes RAM de polarizar el crecimiento en respuesta a suero. Morfología de células de las cepas indicadas crecidas en YPD a 30ºC o 3 horas en condiciones inductoras del crecimiento hifal (37ºC y 10% de suero). mutantes RAM se debía a la imposibilidad de inactivar a Nrg1. Si esta hipótesis fuera cierta, la eliminación del gen NRG1 en un fondo cbk1∆∆ debería suprimir el fenotipo del mutante RAM en presencia de suero. Sin embargo, como puede observarse en la figura 31, el doble mutante nrg1∆∆ cbk1∆∆ (JC1373) fenocopió al mutante cbk1∆∆ JC1049). Idéntico resultado se obtuvo al comparar el comportamiento de otro mutante RAM como kic1∆∆ nrg1∆∆ (JC1355). Como el alelo fosfomimético de NRG1 dio lugar a un fenotipo similar a la deleción de NRG1, cabría esperar que su expresión en los mutantes RAM no suprimiera la incapacidad de éstos para desarrollar hifas. Con el fin comprobar único Figura 32. La expresión del alelo nrg1-3E rescata parcialmente el crecimiento hifal en suero en un mutante kic1ΔΔ Morfología de células de las cepas indicadas crecidas en YPD a 30ºC o 3 horas en condiciones inductoras del crecimiento hifal (37ºC y 10% de suero). esta alelo predicción, silvestre el NRG1 presente en los mutantes cbk1∆∆ NRG1/nrg1∆ y kic1∆∆ NRG1/nrg1∆ se sustituyó fosfomimético por el alelo nrg1S200E/T251E/T281E 74 Resultados (nrg1-3E) (JC1347: cbk1∆∆ nrg1∆/nrg1-3E; JC1308: kic1∆∆; nrg1∆/nrg1-3E). Sorprendentemente, la respuesta a suero en ambas cepas fue diferente. Mientras que la expresión de nrg1-3E en células carentes de Cbk1 no tuvo ningún efecto, en concordancia con el fenotipo observado en el doble mutante nrg1∆∆ cbk1∆∆, su expresión en un fondo kic1∆∆ restauró parcialmente la capacidad de estas células de polarizar su crecimiento en respuesta a suero. Esta supresión era específica del alelo nrg1-3E ya que como comentamos anterior-mente, la deleción de NRG1 en un fondo kic1∆∆ no rescató la capacidad de responder a suero (Figura 32). 7.2. La degradación de Nrg1 en respuesta a suero depende de Cbk1 pero es independiente de Kic1 Aunque las quinasas Kic1 y Cbk1 forman parte del módulo central de la ruta RAM, el hecho de que la expresión del alelo nrg1-3E diera lugar a fenotipos diferentes en los fondos cbk1∆∆ y kic1∆∆ sugería que ambas quinasas pudieran tener funciones diferentes en la regulación de Nrg1. Dado que los resultados anteriores mostraban que el complejo Cbk1/Mob2 podría regular los niveles de Nrg1 en la transición levadura-hifa (Fig. 22), decidimos evaluar la función de la quinasa Kic1 en este proceso. Para ello, se analizaron los niveles de Nrg1 en células deficientes en KIC1 (kic1∆∆, NRG1-HA) durante un periodo de 6 horas en presencia de suero a 37ºC. Como puede observarse en la figura 33, la quinasa Kic1 no es necesaria para reducir los niveles de Nrg1 ya las células del mutante kic1∆∆ mostraron una cinética similar al control silvestre al inicio de la respuesta. Sin embargo, en ausencia de Kic1, la proteína Nrg1 se acumulaba hiperfosforilada tras 6 horas de crecimiento hifal. 75 Resultados Figura 33. La degradación de Nrg1 es independiente de Kic1. . Niveles de Nrg1 en una cepa silvestre JC1186 (NRG1-HA) y mutante kic1∆∆ (JC1336) presente en extractos celulares de muestras recogidas a los tiempos indicados. Los anticuerpos utilizados fuero anti-HA para Nrg1 y anti-PSAIRE para el control de carga. Dada las diferencias entre los mutantes mob2∆∆ y kic1∆∆ en lo referente a los niveles de Nrg1, decidimos confirmar el papel de Cbk1/Mob2 en la degradación de Nrg1 mediante la determinación de la vida media de Nrg1 en células deficientes en Mob2 (JC1272: mob2∆∆, pMET3-NRG1HA/NRG1). Como puede observarse en la figura 34, la ausencia de Mob2 dio lugar a un incremento significativo de la estabilidad de la proteína Nrg1 en presencia de suero. Por tanto, estos resultados indican que la degradación de Nrg1 en la Figura 34. Nrg1 es más estable en hifas deficientes en Mob2. Para determinar la estabilidad de Nrg1 en un mutante mob2∆∆, células de una cepa silvestre (JC1211) y una cepa mob2∆∆ (JC1272), en ambas NRG1 está regulado por pMET3, fueron crecidas en MM a 30ºC (Levaduras, promotor ON) se inocularon en MM suplementado con 5mM de Met y 1mM de Cys (promotor OFF) a 37ºC suplementado con suero (hifas). Posteriormente, se recogieron muestras cada 10 minutos durante un periodo de 40 minutos. Extractos de dichas muestras se analizaron por western blot con anticuerpo anti-HA para detectar Nrg1. Anticuerpos antiPSAIRE se usaron para el control de carga. 76 Resultados transición levadura-micelio es un proceso dependiente de Cbk1/Mob2 e independiente de Kic1. 7.4. Las células nrg1S200A/T251A/T281A crecen en forma de pseudohifas Dado que nuestros resultados señalaban a Cbk1 como un elemento regulador de la estabilidad de Nrg1 se procedió a determinar si los sitios consensos de Cbk1 presentes en Nrg1 se encontraban fosforilados in vivo. Para ello se construyó un mutante fosfodeficiente de NRG1 en el que los que los tres supuestos aminoácidos fosfoaceptores se sustituyeron por alanina (Fig. 35A). Tras generar el alelo fosfodeficiente nrg1S200A/T251A/T281A mediante mutagénesis dirigida, se utilizó dicho alelo para reemplazar la copia silvestre de la cepa heterocigótica NRG1/nrg1∆ (JC1075), generando la cepa Figura 35 A. Esquema de Nrg1 con las mutaciones en los sitios consenso de fosfsforilación por Cbk1. B. El alelo nrg1-3A da lugar a pseudohifas. Microscopía de fluorescencia de las cepas indicadas crecidas en YPD a 30ºC. C El patrón electroforético de nrg1-3A es diferente a un silvestre (WT) en geles con Phos-Tag. Werstern-Blot de extractos levaduriformes de un silvestre y un nrg1-3A en geles de acrilamida sin y con Phos-Tag. Ambos western se revelaron con anti-HA y como control de carga se utilizo tinción de membrana con Ponceau. 77 Resultados nrg1∆/nrg1S200A/T251A/T281A (en lo sucesivo denominada nrg1-3A) (JC1395) a la que se le añadieron tres copias del epítopo HA en el extremo carboxilo para poder analizar su comportamiento electroforético mediante western-blot. La expresión del alelo nrg1-3A dio lugar a células con un crecimiento pseudohifal a 30ºC en YPD (Fig. 35B). Este fenotipo no se debió a cambios en la localización subcelular de Nrg1 (Fig. 35B) ni a una disminución en los niveles de proteína electroforético (Fig. 35C, panel izquierdo). Dado que el perfil de la proteína Nrg1-3A fue similar al de los extractos control en geles SDS-PAGE convencionales, se procedió al análisis de las mismas muestras en geles con Phos-Tag. Como puede observarse en la figura 35C, la banda de mayor retardo presente en extractos de células control disminuyó considerablemente en el mutante nrg1-3A. Por tanto, estos resultados sugieren que Nrg1 podría estar fosforilado en alguno de los sitios consenso de Cbk1 durante el crecimiento levaduriforme. Figura 36. Unión relativa de Nrg15xmyc a los promotores de los genes específicos de hifas, ALS3 y HWP1, en células silvestres y células mutantes nrg1-3A crecidas a 30°C. La PCR cuantitativa se realizó usando cebadores de las regiones promotoras de los HSGs ALS3 y HWP1. Experimento realizado por la Dra Linna Alaalm en el laboratorio del profesor Peter Sudbery (Universidad de Sheffield, UK) Por último, se realizaron experimentos de inmunoprecipitación de cromatina (ChIP) para evaluar la capacidad de unión de la proteína Nrg1-3A a los promotores de los genes diana ALS3 y HWP1 en células crecidas a 30ºC (Fig. 36). Estos experimentos pusieron de manifiesto que, a diferencia de Nrg1- 78 Resultados 3E, la proteína Nrg1-3A mantiene cierta capacidad de unión a los promotores lo que explicaría su crecimiento pseudohifal. 7.5. La T251 es esencial para garantizar la función represora de Nrg1 Con el fin de estudiar en mayor detalle la importancia de los tres posibles sitios de fosforilación por Cbk1 en la regulación de la función de Nrg1 se procedió a la construcción de los mutantes fosfodeficientes simples para los aminoácidos S200, T251 y T281 (Fig. 37A). Dado que las posibles Thr fosfoaceptoras se encuentran en los dedos de Zinc, también se construyó un mutante doble fosfodeficiente T251A y T281A (nrg1-2A, JC1218) con el fin de determinar si existían fenotipos aditivos. Figura 37. A. Esquema de la proteína Nrg1 con la distribución de las SP (círculos azules) y los sitios Cbk1 (círculos verdes). B. Morfología de las células en fase exponencial de los diferentes mutantes fosfodeficientes de Nrg1 en la S200, T251 y T281 crecidos en medio mínimo (MM) y medio rico YPD. 79 Resultados Lo primero que se estudió fue la morfología de los distintos mutantes durante el crecimiento levaduriforme mediante microscopía óptica (Fig. 37B). Mientras que los mutantes nrg1S200A-HA (JC1295) y nrg1T281A-HA (JC1188) mostraron un fenotipo silvestre, las células que expresaban nrg1T251A-HA (JC1393) crecieron como pseudohifas en medio YPD. Este fenotipo no se debía a cambios en la estabilidad de la proteína ya que los niveles de expresión de las diferentes formas mutantes eran similares al control silvestre (Fig. 38A). Además, no se observó ningún fenotipo aditivo porque las células de los mutantes fosfodeficientes dobles (nrg1-2A) y triples (nrg1-3A) se comportaron como el mutante nrg1T251A-HA. Este fenotipo pseudohifal era sensible a nutrientes ya que no se observó cuando las células se crecieron en medio mínimo (MM). Por tanto, estos resultados sugieren que la T251 es importante en la función represora de Nrg1 durante el crecimiento levadiriforme en YPD. Figura 38. A. SDS-PAGE de extractos procedentes de células crecidas en YPD a 30ºC que expresan diferentes alelos fosfodeficientes de Nrg1. B. SDS-PAGE suplementado con 25 M de Phostag de los mismos extractos utilizados en A. C. Hipótesis sobre la función de la supuesta fosforilación de la T251. Con el fin de determinar si la T251 se encontraba fosforilada in vivo, se estudió el comportamiento electroforético de la proteína Nrg1T251A-HA en geles con Phos-Tag. Como puede observarse en la figura 38B, mientras los 80 Resultados mutantes nrg1S200A-HA y nrg1T281A-HA mostraron el mismo patrón que la proteína silvestre, los mutantes nrg1-3A y nrg1T251A-HA presentaron un patrón diferente ya que la intensidad de la banda de menor movilidad disminuyó. Estas observaciones se correlacionan con los datos fenotípicos anteriormente mostrados que señalaban a la Thr 251 como único residuo esencial. En su conjunto, los resultados obtenidos sugieren que la Thr 251 podría estar fosforilada in vivo y ser necesaria para mantener la función represora de Nrg1 durante el crecimiento levaduriforme (Fig 38C). 7.6. El fenotipo pseudohifal de nrg1-2A se suprime al eliminar los siete sitios SP Aunque los datos de ChIPs sugieren diferencias en la capacidad de unión a los promotores diana entre Nrg1-3A y Nrg1-3E (Figs. 30 y 36), la variabilidad de los resultados obtenidos en el mutante nrg1-3A (ver barra de error) no permiten ser concluyentes. Si el fenotipo observado en los mutantes fosfodeficientes en la T251 se debiera a una disminución en su afinidad por los promotores diana, cabría esperar que el fenotipo pseudohifal se corrigiese al aumentar su concentración nuclear. Para comprobar esta hipótesis construimos el mutante nrg1-7A-2A (JC1408) ya que, como hemos demostrado, la eliminación de la fosforilación dependiente de las siete SP aumenta la concentración nuclear del represor (Fig. 24A). Como control del experimento se construyó el mutante nrg1-7A-2E (JC1565) porque las mutaciones fosfomiméticas en las treoninas presentes al final de los dedos de Zn impiden su unión a los promotores de HWP1 y ALS3 (Fig. 30). Para construir las cepas mencionadas se amplificó el fragmento de ADN que contenía las mutaciones T251A-T281A y T251E-T281E, a partir de los genómicos de las cepas nrg1-2A (JC1218) y nrg1-2E (JC1391) respectivamente. Posteriormente, los productos de PCR se usaron para trasformar la cepa nrg1-7A (JC1359) dando lugar a las cepas nrg1Δ/nrg17A/T251A/T281A-HA (nrg1-7A-2A, JC1408) y nrg1Δ/nrg17A/T251E/T281EHA (nrg1-7A-2E, JC1565). 81 Resultados Una vez construidas las cepas y confirmadas mediante secuenciación, se procedió a analizar la morfología de las células crecidas en YPD líquido a 30ºC. Como puede observarse en la figura 39, el mutante nrg1-7A-2A rescató el fenotipo nrg1-2A dando pseudohifal del lugar a células levaduriformes mientras que la adición de las 7A a un mutante fosfomimetico T251E T281E consiguió Figura 39. La mutación 7A suprime el fenotipo pseudohifal del mutante nrg1-2A. Morfología de células de las cepas nrg1-7A (JC1359), nrg1-2A (JC1218), nrg1-7A-2A (JC1408) y nrg17A-2E (JC1565) crecidas en YPD a 30ºC. nrg1-7A-2A y nrg1-7A-2E apoyarían (nrg1-7A-2E) mejorar la no función represora de Nrg1 ya que las células mantenían su crecimiento hiperpolarizado a 30ºC. Por tanto, los fenotipos observados en las cepas las conclusiones derivadas de los experimentos de ChIP (Figs. 30 y 36). 7.7. La NDR quinasa Cbk1 no regula la fosforilación de la T251 durante el crecimiento levaduriforme Dado que los datos anteriores sugieren que la T251 podría estar fosforilada in vivo, nos preguntamos si la NDR quinasa Cbk1 regulaba este proceso. En caso afirmativo, cabría esperar que el patrón de migración de Nrg1 en geles con Phos-Tag de células carentes de actividad Cbk1 fuera similar al obtenido del mutante nrg1-3A. Sin embargo, el análisis de los extractos procedentes de los mutantes mob2∆∆ y kic1∆∆ puso de manifiesto un patrón de migración similar al control silvestre ya que se detectó la banda de menor movilidad cuyos niveles se encuentran reducidos en el mutante nrg1-3A (Fig 40). Por tanto, estos resultados indican que el estado de 82 Resultados fosforilación de la T251 no depende de la NDR quinasa Cbk1 durante el crecimiento levaduriforme. Figura 40. Patrón electroforético de Nrg1-HA en geles con 25 M Phos-Tag de extractos de células crecidas en YPD a 30ºC de las cepas indicadas. JC1139: NRG1-HA; JC1161: NRG1-HA mob2∆∆; JC1136: NRG1HA kic1; JC1395: nrg1-3A; JC1359: nrg1-7A. 7.8. La degradación de Nrg1 en respuesta a suero no depende de la fosforilación de los sitios S200, T251 y T281 Una vez descrito la importancia de los sitios consenso de fosforilación por Cbk1/Mob2 de Nrg1 en la regulación del mismo durante el crecimiento levaduriforme, se procedió a estudiar la importancia de dichos sitios en la regulación del represor durante el crecimiento hifal. Como se ha visto en el apartado 5, la estabilidad de Nrg1 aumenta en células deficientes en Mob2 durante la transición levadura-micelio. Si el control de la estabilidad de Nrg1 por el complejo Cbk1/Mob2 dependiera de la fosforilación directa de alguno de los tres sitios descritos (S200, T251, T281), cabría esperar un aumento en la estabilidad de la proteína en alguno de los mutantes fosfodeficientes al inicio de la respuesta hifal. Con el fin de comprobar esta hipótesis, se compararon los niveles de Nrg1 a los 30 min de la adición de suero en extractos procedentes de los mutantes nrg1S200A-HA, nrg1T251A-HA, nrg1T281A-HA, nrg1-2A y nrg1-3A respecto a un control silvertre NRG1-HA. Como puede verse en la figura 41, la cinética de degradación de Nrg1 fue similar a la del control en todos los mutantes analizados lo que indica que la estabilidad de Nrg1 durante la transición levadura-hifa no depende de la fosforilación de los residuos S200, T251 y T281. En concordancia con estas observaciones, los 83 Resultados mutantes fosfodeficientes en los sitios Cbk1 fueron capaces de polarizar su crecimiento en respuesta a suero ya que las pseudohifas dieron lugar a tubos germinativos que formaron estructuras tubulares de aspecto similar a las hifas verdaderas. (Datos no mostrados). Figura 41. Nrg1 se degrada en los mutantes fosfodeficientes para los sitios Cbk1. Cultivos saturados de las cepas indicadas se diluyeron e incubaron en condiciones que inducen filamentación. Las muestras de estos cultivos recogidas a tiempo 0 y 30 min después de la inducción hifal se procesaron y analizaron por western-blot utilizando anticuerpos antiHA para detectar la proteína. 7.9. La fosforilación de Nrg1 en respuesta a suero es independiente de de la NDR quinasa Cbk1 Los estudios de la estabilidad de Nrg1 en el mutante mob2∆∆ (Fig. 34) nos han permitido identificar a la quinasa Cbk1 como un nuevo elemento necesario para degradar a Nrg1 en respuesta a suero. Sin embargo, el hecho de que los mutantes fosfodeficientes en los sitios consenso S200, T251 y T281 sean capaces de degradar a Nrg1 en respuesta a suero (Fig. 41) plantea dos posibilidades. La quinasa Cbk1 podría controlar la estabilidad de forma indirecta mediante la fosforilación de alguna proteína no identificada que a su vez controlara los niveles de Nrg1 en la transición levadura-hifa, o podría ejercer un control directo sobre Nrg1 mediante la fosforilación de otros residuos diferentes a los sitios consenso S200, T251 y T281. Si esta segunda hipótesis fuera cierta, la cinética de forforilación de Nrg1 en respuesta a las señales inductoras del crecimiento hifal en un mutante cbk1∆∆ debería ser 84 Resultados diferente a la de una cepa control. posibilidad, analizamos el patrón Con el fin de explorar esta segunda de migración de Nrg1 en geles suplementados con Phostag procedente de extractos de células carentes de Cbk1 creciendo en presencia de suero a 37ºC. Para facilitar el análisis, realizamos los experimentos en un fondo nrg1-7A debido a la menor fosforilación basal de este alelo que nos permitía detectar fácilmente la isoforma específica del inicio de la respuesta a suero en geles con phos-tag (Fig 27). Por tanto, comparamos el patrón electroforético de Nrg1-7A en células CBK1 nrg1-7A-HA (JC1359) y cbk1 nrg1-7A-HA (JC1578) durante los 10 primeros minutos de inducción con suero. Como puede observarse en la figura 42, la isoforma de Nrg1 que aparece en respuesta a suero se detecta en el mutante cbk1∆∆ con la misma cinética que en los extractos de las células control. Por tanto, estos resultados indican que la NDR quinasa Cbk1 no es responsable de la aparición de las nuevas isoformas de Nrg1 en respuesta a suero. En resumen, el conjunto de estas observaciones descartan una acción directa de Cbk1 y sugieren que la NDR quinasa controlaría la estabilidad de Nrg1 al inicio de la respuesta hifal de forma indirecta. Figura 42. La fosforilación de Nrg1 dependiente de suero no requiere actividad quinasa Cbk1. Análisis de Nrg1-7A-HA en geles con 25 M Phostag procedente de extractos celulares de células de las cepas CBK1 nrg1-7A-HA (JC1359) y cbk1∆∆ nrg1-7A-HA (JC1578) incubadas en YPD con 10% de suero. 85 Resultados 7.10. La fosforilación de Nrg1 en respuesta a suero no depende de los residuos T251 y T281. Dado que el mutante nrg1-2E tenía un fenotipo de pérdida de función (Fig. 29), nos planteamos la hipótesis de que la fosforilación habíamos Figura 43. Los residuos T251 y T281 no se fosforilan en respuesta a suero. Análisis de Nrg1 en geles con 25 M Phostag procedente de extractos celulares de células de las cepas nrg1-7A-HA (JC1359) y nrg1-7A-2A-HA (JC1408) incubadas en YPD con 10% de suero a 37ºC. de Nrg1 detectado que en respuesta a suero (Figs. 20 y 27) fuera modificación debido de los a la residuos T251 y/o T281 con el fin de inactivar al represor. Con el fin de estudiar esta posibilidad, analizamos el patrón electroforé-tico de Nrg1 en geles con 25 M Phostag de extractos de células nrg1-7A-HA (JC1359) y nrg1- 7A-2A-HA (JC1408) en presencia de 10% de suero a 37ºC. Como puede observarse en la figura 43, el análisis de estos extractos puso de manifiesto que la proteína Nrg1-7A-2A se modificaba en respuesta a suero con la misma cinética que los extractos de la cepa control nrg1-7A-HA. Por tanto, estos resultados indican que los sitios consenso de fosforilación por NDR quinasas presentes en los dominios de los dedos de Zn no se fosforilan en respuesta a suero. 86 DISCUSIÓN Discusión DISCUSIÓN Como se ha comentado en la introducción, la expresión de los genes específicos de hifas (HSGs) se encuentra regulada negativamente por el complejo represor Tup1/Nrg1 (Braun and Johnson, 1997; Braun et al., 2001; Murad et al., 2001; Kadosh and Johnson, 2005). Existen numerosas evidencias que avalan la importancia de la inactivación de Nrg1 en la inducción del crecimiento hifal y virulencia. Los mutantes deficientes en Nrg1 crecen constitutivamente en forma de micelio y la expresión ectópica de NRG1 inhibe el desarrollo hifal, tanto in vitro como in vivo, reduciendo la virulencia en modelos de infección sistémica (Park and Morschhauser, 2005; Saville et al., 2006). Por último, su papel primordial en la represión del crecimiento hifal queda de manifiesto al observar que los mutantes nrg1∆∆ y tup1∆∆ son los únicos de una colección de 143 mutantes de factores de transcripción que forman filamentos en todas las condiciones ensayadas (Homann et al., 2009). En esta memoria nos hemos centrado en el estudio de la regulación de Nrg1 durante la transición levadura-hifa. A pesar de la importancia de Nrg1, poco se conocía sobre su regulación cuando iniciamos los estudios. Sin embargo, en los últimos 4 años, el grupo de Haoping Liu (Universidad de California, Irvine) ha contribuido enormemente a entender los mecanismos moleculares que regulan la expresión de los HSGs durante el crecimiento hifal (Lu et al., 2011; Lu et al., 2012; Su et al., 2013; Lu et al., 2014). Sus trabajos han puesto de manifiesto que durante la transición levadura-hifa se produce una modificación en la arquitectura de la cromatina que dificulta la unión de Nrg1 a los promotores de los HSGs. Sus resultados indican que la activación del programa de desarrollo hifal tiene lugar mediante dos mecanismos secuenciales que modifican la posición de los nucleosomas en las regiones promotoras de los HSGs (Lu et al., 2011). El inicio requiere una rápida degradación transitoria de Nrg1 dependiente de la ruta cAMP-PKA. La desaparición de Nrg1 de los promotores permite el reclutamiento de la histona 88 Discusión deacetilasa (HDAC) HdaI que modifica la cromatina y oculta los sitios de unión de Nrg1. Los mutantes hdal∆∆ responden inicialmente a suero pero son incapaces de mantener el crecimiento polarizado. El reclutamiento de HdaI los promotores de los HSGs está regulado por la ruta TOR ya que sólo tiene lugar a 37ºC con concentraciones sub-letales de rapamicina (Lu et al., 2011). Recientemente, el mismo grupo ha identificado al factor de transcripción Brg1 como el responsable de reclutar a la HDAC HdaI a los promotores de los HSGs (Lu et al., 2012). La expresión de Figura 44. Modelo de la regulación de expresión de los HSGs según Liu colaboradores (ref). Ver texto. la y BRG1 requiere Nrg1 y la la destrucción activación mecanismo que rapamicina. Mientras de depende que de un de la expresión de BRG1 está regulada por la ruta TOR, la unión de Brg1 a los promotores de los HSGs es independiente de rapamicina. Por tanto, la función de Tor1 en el crecimiento hifal es regular únicamente la expresión de BRG1 (Lu et al., 2012). ¿Cómo regula la ruta TOR la expresión de BRG1? Con el fin de responder a esta pregunta, el grupo de Haoping Liu buscó mutantes capaces de mantener el crecimiento hifal en medio rico sin rapamicina (Su et al., 2013) entre una colección de 674 mutantes viables (Noble et al., 2010). Este trabajo ha puesto de manifiesto que la rapamicina activa la expresión de BRG1 mediante la disminución de la actividad basal de la MAPK Hog1 a través de las tirosina-fosfatasas Ptp2 y Ptp3. Esta reducción en la actividad de Hog1 sería responsable de la disociación del represor Sko1 del promotor de BRG1 lo que permitiría su expresión. Dado que numerosos promotores de HSGs (HWP1, ALS3, ECE1, HGC1, UME6 y BRG1) tienen sitios de unión a Nrg1 y Brg1 (Lu et al., 2012), Lu y 89 Discusión colaboradores proponen un modelo en el que la cromatina de los promotores de los HSGs pasaría por tres estados diferentes durante la transición levadurahifa que modificaría la accesibilidad de los sitios de unión a Nrg1 y Brg1. En el estado de levadura, los sitios de unión a Nrg1 estarían accesibles al encontrarse en regiones libres de nucleosomas (NRFs, Nucleosome Region Free). Durante dependiente de el inicio la ruta del crecimiento cAMP-PKA daría hifal, lugar la degradación al desmontaje de de Nrg1 los nucleosomas exponiendo los sitios de Nrg1 y Brg1 (estado transitorio). En esta etapa, la duración de la degradación de Nrg1 determinaría la siguiente fase. Durante este tiempo se genera una ventana que permite la expresión, acumulación y unión de Brg1 a los promotores de los HSGs antes de que vuelva a acumularse Nrg1. Por último, en el estado hifal se ensamblarían nuevos nucleosomas mediante el reclutamiento de la HDAC HdaI por parte de Brg1. Esta remodelación de la cromatina, específica de hifas, ocultaría los sitios de unión de Nrg1 impidiendo que el represor que se acumule durante esta fase inhiba la expresión de los HSGs. Por tanto, en este modelo, la degradación de Nrg1 al inicio de la respuesta es esencial para garantizar las modificaciones de cromatina posteriores necesarias durante el mantenimiento del crecimiento hifal (Fig. 44) 1. Generación de asimetría durante el crecimiento hifal Los experimentos que hemos realizado para determinar la vida media de Nrg1 han puesto de manifiesto la existencia de un mecanismo posttranscripcional que degrada al represor Nrg1 al inicio de la transición levadura-hifa (Figs 14 y 16). Como cabía esperar, esta destrucción se correlaciona con la inducción de los HSGs que alcanzan su máxima expresión durante esta ventana en la que no existe Nrg1 (Lu et al., 2011). Sin embargo, este mecanismo de degradación debe inactivarse posteriormente ya que la proteína vuelve a acumularse durante el mantenimiento del crecimiento hifal. Actualmente, se desconoce el mecanismo responsable de dicha estabilización. 90 Discusión Esta cinética de acumulación de Nrg1 durante el crecimiento miceliar que hemos descrito es similar a la observada por Lu y col (Lu et al., 2011). Dado que Nrg1 es un represor de HSGs, sorprende que se produzca dicha acumulación una vez establecido el crecimiento hifal. Tal vez, esta acumulación tenga cierta relevancia funcional a pesar de que los sitios de unión a Nrg1 no se encuentren accesibles en los promotores de los HSGs según el modelo propuesto por el grupo de Haoping Liu (Lu et al., 2011). Esta hipótesis se basa en las siguientes evidencias. Primero, la expresión de los HSGs ALS3 y ECE1 disminuye significativamente tras 2-3h de crecimiento hifal, disminución que se correlaciona con un incremento en la unión de Nrg1 a los promotores de dichos genes (Fig S2 de (Lu et al., 2011)). Segundo, la proteína Hgc1 se acumula asimétricamente en el compartimento apical de la hifa cuando la expresión del gen HGC1 se encuentra bajo el control de su propio promotor mientras que se distribuye homogéneamente a lo largo de toda la hifa cuando se expresa ectópicamente bajo el control del promotor de MAL2 (Wang et al., 2007). Estas observaciones sugieren que la expresión de HGC1, gen regulado negativamente por Nrg1, tiene lugar únicamente en la célula apical de la hifa. Resultados similares hemos obtenido al analizar el patrón de expresión de la GFP bajo el promotor de HWP1 (Fig 17B), aunque la baja frecuencia observada en los cultivos analizados nos impide sacar conclusiones. En nuestro interpretación caso, de la los estabilidad resultados de ya la que GFP dificulta aunque la enormemente transcripción la fuera específica de la célula apical dicha estabilidad podría dar lugar a hifas con una fluorescencia homogénea en todos sus compartimentos celulares como consecuencia de dicha estabilidad. Si los sitios de unión a Nrg1 fueran inaccesibles durante el mantenimiento del crecimiento hifal como proponen Liu y col., la expresión de HGC1 debería ser homogénea a lo largo de toda la hifa y no asimétrica. Por tanto, esta expresión apical de HGC1 parece no ajustarse al modelo propuesto. Esta aparente contradicción podría explicarse si Nrg1 se regulara de forma 91 Discusión diferente en los núcleos apicales y subapicales. Nuestros resultados apoyan esta hipótesis ya que hemos observado que la concentración nuclear de Nrg1 en los núcleos subapicales es prácticamente el doble que en los núcleos apicales durante el mantenimiento del crecimiento hifal (Fig 17A). Este incremento en la concentración de Nrg1 podría favorecer su función represora en los núcleos subapicales mientras que el estado hifal de la cromatina junto a la baja concentración de Nrg1 favorecería la expresión de los HSGs en los núcleos apicales. Esta interpretación explicaría el incremento en la unión de Nrg1 a los promotores a partir de las 2h, alcanzando un 50% de unión respecto a la situación inicial en levaduras tras 3h de crecimiento hifal, en el que claramente existen compartimentos apicales y subapicales (Ver Fig1 de (Lu et al., 2011)). Por tanto, la cinética de acumulación de Nrg1 durante el desarrollo hifal y su posterior distribución asimétrica en la hifa podría ser necesaria para favorecer la expresión de los genes HSGs en la célula apical de la hifa. La distribución asimétrica de proteínas es fundamental en la generación de diversidad celular durante el desarrollo (Hawkins and Garriga, 1998). En C. albicans, el programa de desarrollo hifal genera células apicales y subapicales con características diferentes ya que únicamente las primeras son capaces de dividirse mientras que las segundas se encuentran bloqueadas en G1 con SPBs no duplicados (Hazan et al., 2002; Barelle et al., 2003). En concordancia con esta observación, proteínas importantes para la progresión del ciclo celular se localizan únicamente en la célula apical (Clemente-Blanco et al., 2006; Wang et al., 2007). Además, la secreción celular se encuentra polarizada en el extremo de la hifa por lo el crecimiento activo tiene lugar sólo en la célula apical (Sudbery, 2012). Dado que gran número de HSGs codifican proteínas de pared, parece lógico pensar que el sistema haya evolucionado hacia un mecanismo que concentre la expresión de estos genes en aquella célula que presenta un crecimiento activo. 92 Discusión ¿Cómo se genera la asimetría en las células? Un mecanismo muy común consiste en la localización de mRNAs en sitios concretos de la célula (Johnstone and Lasko, 2001; King et al., 2005). En C. albicans, se ha descrito un sistema de transporte de mRNAs dependiente de She3 que concentra de forma específica un grupo de 40 mRNAs en la yema de la levadura y en la célula apical de la hifa (Elson et al., 2009). El mutante she3∆∆ muestra defectos en crecimiento invasivo en placa y una capacidad reducida de dañar monocapas de células epiteliales. Probablemente, este sistema no esté implicado en la regulación de Nrg1 ya que ninguno de los mRNAs asociados a She3 muestra ninguna relación funcional con este represor. Otro mecanismo responsable de generar diversidad celular consiste en acumular asimétricamente factores de unión a DNA durante la división celular. En S. cerevisiae, la célula hija activa la transcripción de un grupo de genes implicados en la separación celular gracias a la acumulación y activación del factor de transcripción Ace2, mediante un mecanismo dependiente de la NDR quinasa Cbk1 al final de la mitosis (Colman-Lerner et al., 2001; Jorgensen et al., 2002). En C. albicans, Ace2 también se acumula asimétricamente en la célula hija durante el crecimiento levaduriforme aunque se distribuye por igual en los núcleos apicales y subapicales de la hifa (Kelly et al., 2004), por lo que probablemente no contribuya a la activación de programas de transcripción específicos en los diferentes compartimentos hifales. Sin embargo, debe de existir un mecanismo molecular asimétrico implicado en la degradación de Nrg1 que determine una estabilidad diferente del represor a lo largo de la hifa. Este mecanismo, que se discutirá en el siguiente apartado, podría contribuir a generar patrones de expresión génica específicos en la célula apical respecto a las subapicales dado el papel esencial de Nrg1 en la represión de los HSGs. 93 Discusión 2. La degradación de Nrg1 al inicio del crecimiento hifal se regula mediante dos mecanismos independientes En nuestro trabajo hemos puesto de manifiesto que Nrg1 es una fosfoproteína que se degrada al inicio del desarrollo hifal de C. albicans mediante un mecanismo que depende de la actividad quinasa de los complejos Cdc28/Cnn1 y Cbk1/Mob2 (Figs 22 y 34). Si estas quinasas ejercieran su función a través de la fosforilación directa de Nrg1 cabría esperar que los mutantes de Nrg1 carentes de los residuos fosfoaceptores para Cdks y Cbk1 fueran estables en respuesta a suero. Sin embargo, mientras que Nrg1 es estable en la cepa nrg1-7A (sitios Cdks, Fig 25), la proteína se degrada en una cepa nrg1-3A (sitios Cbk1, Fig 41) lo que sugiere que el complejo Cbk1/Mob2 controla la estabilidad de Nrg1 de forma indirecta. En concordancia con esta conclusión, nuestros análisis de geles con Phostag sugieren que la T251 y/o T281 no se fosforilan al inicio del crecimiento hifal (Figs 27 y 38). ¿Cuál puede ser la función de Cbk1 en la degradación de Nrg1? Resultados recientes sugieren que dicho control se ejecutaría a través de Ssd1, proteína de unión a mRNAs que posee 9 sitios consenso de fosforilación por Cbk1 (Lee et al., 2015). La deleción de SSD1, o la expresión del alelo fosfomimético ssd1-9E, restaura la capacidad de degradar a Nrg1 en el mutante cbk1∆∆ que se correlaciona con un incremento en su capacidad de polarizar el crecimiento en respuesta a suero. Dado que Ssd1 es una proteína que se une a mRNAs (Hogan et al., 2008; Jansen et al., 2009; Kurischko et al., 2011), estos resultados sugerirían que la fosforilación directa de Ssd1 por Cbk1 permitiría la traducción de algún mRNA que codificara una proteína implicada en la degradación de Nrg1. Con el fin de identificar posibles candidatos, hemos realizado una búsqueda, mediante el software RSAT (Regulatory Sequence Analysis Tool, http://www.rsat.eu/) (Medina-Rivera et al., 2015), de la supuesta secuencia consenso de unión a Ssd1 (Hogan et al., 2008) en la región 5’-UTR de aquellos mRNAs de C. 94 Discusión albicans cuyos inicios de transcripción han sido mapeados (Bruno et al., 2010). Tras este análisis, identificamos la secuencia ATCCATTCAAT-93 en la -103 región 5’-UTR del gen SOK1 (Suppresor Of Kinase) que codifica para una proteína de función desconocida que se requiere para degradar Nrg1 durante la formación del tubo germinativo (Lu et al., 2014). El mutante sok1∆∆ generado en el laboratorio de H. Liu no responde a suero y es incapaz de degradar a Nrg1, mientras que el doble mutante sok1∆∆ nrg1∆∆ es similar a nrg1∆∆. Por tanto, estos análisis de epistasis indican que la principal función de Sok1 consiste en eliminar a Nrg1. Tomando en cuenta estas observaciones, nuestra hipótesis actual de trabajo propondría que Cbk1 fosforilaría a Ssd1 para permitir la traducción del mRNA de SOK1 al que se encontraría asociado. Para comprobar esta idea, se determinará la existencia de mRNAs de SOK1 en inmunoprecipitados de Ssd1. En caso afirmativo, se mutagenizará el sitio de unión a Ssd1 en el promotor de SOK1 en un fondo cbk1∆∆ con el fin de comprobar si muestra un fenotipo similar al descrito para cbk1∆∆ ssd1-9E. La actividad Cdk asociada a Ccn1 es importante para el mantenimiento del crecimiento hifal (Loeb et al., 1999; Sinha et al., 2007). Como se ha comentado anteriormente, el mutante ccn1∆∆ es incapaz de reducir los niveles de Nrg1 durante la formación del tubo germinativo. Aunque no hemos comprobado si Nrg1 es sustrato del complejo Cdc28/Ccn1, la adición de 1NM-PP1 a células cdc28-as1 bloquea la degradación de Nrg1 en respuesta a suero (Alaalm, 2012). Además, el mutante nrg1-7A que carece de las SP susceptibles de ser fosforiladas por Cdks es incapaz de degradar a Nrg1 al inicio de la respuesta hifal (Fig 25). Por tanto, estas observaciones sugieren que la fosforilación de Nrg1 por Cdc28/Ccn1 es importante para activar su degradación durante la formación del tubo germinativo. Dado que la fosforilación de Nrg1 y Sok1 están implicados en la degradación del represor, nos preguntamos si ambos se encontraban en la misma ruta de regulación. En caso afirmativo, la expresión de nrg1-7A en un 95 Discusión fondo sok1∆∆ no debería tener efectos aditivos sobre el fenotipo de sok1∆∆ Para responder a esta pregunta, en el trabajo de Fin de Master realizado por Javier Rocha, se construyeron las cepas sok1 nrg1-7A-HA y sok1 nrg1-7E- HA a partir de un mutante sok1∆∆ generado en el laboratorio de Yue Wang (Singapore). Una vez construidas, se compararon tanto sus capacidades de responder a suero (Fig. 45A) respecto a los controles SOK1 NRG1-HA y sok1∆∆ NRG1-HA como los niveles de Nrg1 mediante WB (Fig. 45B). Mientras la expresión del alelo nrg1-7E suprimió el fenotipo del mutante sok1∆∆, el alelo nrg1-7A incrementó los defectos de respuesta a suero de células carentes de SOK1. Por tanto, estos resultados preliminares sugieren que la degradación de Nrg1 tiene lugar mediante dos rutas paralelas, una dependiente de SOK1 y otra de la fosforilación de Nrg1. Si la degradación de Nrg1 fuera esencial para generar una ventana temporal que permitiera remodelar la cromatina de los promotores de los HSGs como propone Liu y col (Fig 44), el mutante sok1∆∆ nrg1-7A debería ser incapaz de polarizar el crecimiento en respuesta a suero, cosa que no ocurre. Por tanto, debe de existir otro mecanismo de inactivación de Nrg1 independiente de degradación que destruya la interacción represor-DNA. En un principio pensamos que la fosforilación de los sitios Cbk1 presentes en los dedos de Zn de Nrg1 (T251 y T281) podrían ser responsables de la pérdida de unión Nrg1-DNA debido al fenotipo de pérdida de función del mutante nrg1-3E. Sin embargo, nuestros resultados apuntan a que los residuos T251 y T281 no se fosforilan en respuesta a suero (Fig 43). Nuestro modelo actual sugiere que el mecanismo que disminuiría la afinidad de Nrg1 por los promotores en respuesta a suero implicaría la activación de una fosfatasa que eliminara el fosfato de la T251. Esta hipótesis se basa en las siguientes observaciones: 1) La sustitución T251A genera un fenotipo pseudohifal que se suprime al aumentar su concentración nuclear (nrg1-7A- 2A), sugiriendo que la fosforilación de este residuo es importante para que Nrg1 se una a los promotores con alta afinidad. 2) El análisis de los 96 Discusión mutantes nrg1-3A y nrg1-T251A en geles de phostag sugieren que la T251 se encontraría fosforilada en células levaduriformes (Fig 38). De acuerdo con estas observaciones, el análisis de espectrometría de masas de fosfopéptidos de Nrg1 procedente de células levaduriformes ha puesto de manifiesto que la T251 se encuentra fosforilada in vivo (Pete Sudbery, comunicación personal). 3) La proporción de péptidos fosforilados de Nrg1 es mayor en levaduras que al inicio de la respuesta a suero (t0 vs t10 min, Yue Wang, comunicación personal), lo que sugiere la existencia de una fosfatasa de Nrg1 que se activaría en respuesta a suero. En el marco de esta hipótesis, la expresión de Nrg1-7A en un mutante carente de la hipotética fosfatasa de la T251 debería inactivar las dos vías principales de regulación negativa de Nrg1 en respuesta a suero. Con el fin de probar esta hipótesis, estamos introduciendo el alelo nrg1-7A en una pequeña colección de mutantes de deleción de fosfatasas cedida por Yue Wang. Tras un primer análisis de la respuesta a suero de estos mutantes, Figura 45. Respuesta a suero (A) y niveles de Nrg1 (B) de las cepas SOK1 NRG1-HA (JC1139); sok1∆∆ NRG1-HA (JC1890); sok1∆∆ nrg1-7A-HA (JC1878) y sok1∆∆ nrg1-7E-HA (JC1879). La respuesta a suero se analizó determinando el porcentaje de tubos germinativos y longitud de hifas a los tiempos indicados (n=200). Tomado de (Rocha-Pimienta, 2015). 97 Discusión hemos empezado el análisis en aquellos mutantes que generan tubos germinativos más cortos que el control silvestre. Si alguno de estos mutantes estuvieran afectados en la supuesta fosfatasa, la introducción del alelo nrg1- 7A reduciría su capacidad para responder a suero. 3. Modelo espacial sobre la regulación de Nrg1. Como apartado final de la discusión, proponemos un modelo en el que se integran todas las observaciones discutidas anteriormente y que pretende explicar la razón por la cual Nrg1 se acumula en los núcleos subapicales. Al inicio de la respuesta a suero, se activarían dos mecanismos complementarios de inactivación del represor Nrg1. Un mecanismo de degradación, dependiente de Sok1 y de los sitios SP de Nrg1 y otro independiente de la degradación que implicaría la pérdida de unión de Nrg1 con el DNA. Para este segundo mecanismo proponemos una defosforilación de la T251 dependiente de las condiciones inductoras del crecimiento hifal. Durante el mantenimiento de la hifa, Nrg1 vuelve a acumularse de forma asimétrica en los núcleos subapicales. Teniendo en cuenta de que Cbk1 y Ssd1 se acumulan en el ápice de la hifa (Gutierrez-Escribano et al., 2011; Lee et al., 2015) y que interaccionan in vivo (Lee et al., 2015), proponemos que una de las funciones de los nodos apicales de Ssd1 consistiría en acumular el mRNA no traducido de SOK1 en la periferia del ápice de la hifa. El contacto de nodos de Cbk1 y SSd1 en esta región de la hifa favorecería, mediante la fosforilación de Ssd1 por Cbk1, la traducción del mRNA de SOK1 (Fig 46), lo que generaría un gradiente de Sok1 desde el extremo de la hifa. Dado que los niveles de expresión de Sok1 son bajos (Lu et al., 2014), este gradiente sería responsable de una mayor concentración nuclear de Sok1 en el núcleo proximal al cortex respecto al distal en el compartimento apical de la hifa después de la mitosis y antes de la septación (Fig 46). Adicionalmente, el complejo Cdc28/Ccn1 presente en el núcleo proximal 98 Discusión fosforilaría el cluster de SP presente en el extremo N-terminal de Nrg1. La activación de estas dos rutas sería responsable de disminuir los niveles del represor en la célula apical durante el mantenimiento del crecimiento hifal permitiendo la expresión de los HSGs. Por tanto, la acumulación de Nrg1 se debería a que estos mecanismos no se encontrarían operativos en los núcleos subapicales. Figura 46. Modelo especulativo sobre la regulación espacial de Nrg1 en los compartimentos apicales y subapicales de la hifa. A. Ssd1 acumularía mRNAs de SOK1 en el ápice de la hifa e impediría su traducción. Cbk1 regularía la traducción de Sok1 mediante la fosforilación de Ssd1. B. La interacción de Cbk1 y Ssd1 en el ápice de la hifa generaría un gradiente de Sok1 que favorecería la degradación de Nrg1 en el núcleo apical. La mayor concentración de Sok1 junto a la presencia de Cdc28/Ccn1 en el núcleo apical activarían las dos vías de destrucción de Nrg1. 99 CONCLUSIONES Conclusión CONCLUSIONES 1) El represor Nrg1 es una fosfoproteína que se degrada al inicio del desarrollo hifal de C. albicans mediante un mecanismo que depende de la actividad quinasa de los complejos Cbk1/Mob2 y Cdc28/Cnn1. 2) Durante el mantenimiento del crecimiento hifal, Nrg1 se estabiliza y acumula en los núcleos subapicales mientras se excluye en el núcleo apical por un mecanismo que depende del grupo de siete SP que se localiza en su extremo amino-terminal. 3) La degradación de Nrg1 no es esencial en el desarrollo miceliar. La caracterización del mutante nrg1-7A nos permite concluir que debe de existir un mecanismo independiente de degradación que inactive la función represora de Nrg1. 4) El estado de fosforilación de Nrg1 depende mayoritariamente de los sitios SP. 5) Los resultados presentados en esta memoria sugieren que la regulación de Cbk1/Mob2 sobre Nrg1 es probablemente indirecta. 6) Aunque no existe ninguna evidencia directa, los estudios realizados con los mutantes fosfodeficientes en los supuestos sitios de fosforilación por NDR quinasas sugieren que la fosforilación de la T251 podría ser necesaria para mantener la capacidad represora de Nrg1 durante el crecimiento levaduriforme. 7) La inactivación de Nrg1 durante la transición levadura-micelio no requiere fosforilación de los aminoácidos T251 y T281 presentes en los dedos de Zn. 101 Conclusión 8) Los estudios de epistasis realizados entre diferentes mutantes de NRG1 y mutantes RAM sugieren que la quinasa Kic1 regula a Nrg1 de forma independiente de Cbk1. 102 BIBLIOGRAFÍA Bibliografía Alaalm, L.M. (2012). Phospho-regulation of the Candida albicans hyphal repressor Nrg1 by the action of multiple kinases. Thesis. The University of Sheffield (UK). Almirante, B., Rodriguez, D., Park, B.J., Cuenca-Estrella, M., Planes, A.M., Almela, M., Mensa, J., Sanchez, F., Ayats, J., Gimenez, M., Saballs, P., Fridkin, S.K., Morgan, J., Rodriguez-Tudela, J.L., Warnock, D.W., and Pahissa, A. (2005). Epidemiology and predictors of mortality in cases of Candida bloodstream infection: results from population-based surveillance, barcelona, Spain, from 2002 to 2003. Journal of clinical microbiology 43, 1829-1835. Amon, A., Tyers, M., Futcher, B., and Nasmyth, K. (1993). Mechanisms that help the yeast cell cycle clock tick: G2 cyclins transcriptionally activate G2 cyclins and repress G1 cyclins. Cell 74, 993-1007. Avruch, J., Zhou, D., Fitamant, J., Bardeesy, N., Mou, F., and Barrufet, L.R. (2012). Protein kinases of the Hippo pathway: regulation and substrates. Seminars in cell & developmental biology 23, 770-784. Bachewich, C., and Whiteway, M. (2005). Cyclin Cln3p links G1 progression to hyphal and pseudohyphal development in Candida albicans. Eukaryotic cell 4, 95-102. Bailey, D.A., Feldmann, P.J., Bovey, M., Gow, N.A., and Brown, A.J. (1996). The Candida albicans HYR1 gene, which is activated in response to hyphal development, belongs to a gene family encoding yeast cell wall proteins. Journal of bacteriology 178, 5353-5360. Barelle, C.J., Bohula, E.A., Kron, S.J., Wessels, D., Soll, D.R., Schafer, A., Brown, A.J., and Gow, N.A. (2003). Asynchronous cell cycle and asymmetric vacuolar inheritance in true hyphae of Candida albicans. Eukaryotic cell 2, 398-410. Bastidas, R.J., Heitman, J., and Cardenas, M.E. (2009). The protein kinase Tor1 regulates adhesin gene expression in Candida albicans. PLoS pathogens 5, e1000294. Berman, J. (2006). Morphogenesis and cell cycle progression in Candida albicans. Current opinion in microbiology 9, 595-601. Bidlingmaier, S., Weiss, E.L., Seidel, C., Drubin, D.G., and Snyder, M. (2001). The Cbk1p pathway is important for polarized cell growth and cell separation in Saccharomyces cerevisiae. Molecular and cellular biology 21, 2449-2462. Bishop, A., Lane, R., Beniston, R., Chapa-y-Lazo, B., Smythe, C., and Sudbery, P. (2010). Hyphal growth in Candida albicans requires the phosphorylation of Sec2 by the Cdc28-Ccn1/Hgc1 kinase. The EMBO journal 29, 2930-2942. Biswas, S., Van Dijck, P., and Datta, A. (2007). Environmental sensing and signal transduction pathways regulating morphopathogenic determinants of Candida albicans. Microbiol Mol Biol Rev 71, 348-376. Bockmuhl, D.P., and Ernst, J.F. (2001). A potential phosphorylation site for an A-type kinase in the Efg1 regulator protein contributes to hyphal morphogenesis of Candida albicans. Genetics 157, 1523-1530. Bockmuhl, D.P., Krishnamurthy, S., Gerads, M., Sonneborn, A., and Ernst, J.F. (2001). Distinct and redundant roles of the two protein kinase A isoforms Tpk1p and Tpk2p in morphogenesis and growth of Candida albicans. Molecular microbiology 42, 1243-1257. 104 Bibliografía Braun, B.R., Head, W.S., Wang, M.X., and Johnson, A.D. (2000). Identification and characterization of TUP1-regulated genes in Candida albicans. Genetics 156, 31-44. Braun, B.R., and Johnson, A.D. (1997). Control of filament formation in Candida albicans by the transcriptional repressor TUP1. Science 277, 105-109. Braun, B.R., Kadosh, D., and Johnson, A.D. (2001). NRG1, a repressor of filamentous growth in C.albicans, is down-regulated during filament induction. The EMBO journal 20, 4753-4761. Brown, A.J., and Gow, N.A. (1999). Regulatory networks controlling Candida albicans morphogenesis. Trends in microbiology 7, 333-338. Bruno, V.M., Wang, Z., Marjani, S.L., Euskirchen, G.M., Martin, J., Sherlock, G., and Snyder, M. (2010). Comprehensive annotation of the transcriptome of the human fungal pathogen Candida albicans using RNA-seq. Genome research 20, 1451-1458. Caballero-Lima, D. (2009). Mecanismos moleculares que regulan la asimetría y la citocinesis durante el desarrollo hifal de Candida albicans. Tesis Doctoral. Universidad de Extremadura. Caballero-Lima, D., Kaneva, I.N., Watton, S.P., Sudbery, P.E., and Craven, C.J. (2013). The spatial distribution of the exocyst and actin cortical patches is sufficient to organize hyphal tip growth. Eukaryotic cell 12, 998-1008. Caballero-Lima, D., and Sudbery, P.E. (2014). In Candida albicans, phosphorylation of Exo84 by Cdk1-Hgc1 is necessary for efficient hyphal extension. Molecular biology of the cell 25, 10971110. Cao, F., Lane, S., Raniga, P.P., Lu, Y., Zhou, Z., Ramon, K., Chen, J., and Liu, H. (2006). The Flo8 transcription factor is essential for hyphal development and virulence in Candida albicans. Molecular biology of the cell 17, 295-307. Care, R.S., Trevethick, J., Binley, K.M., and Sudbery, P.E. (1999). The MET3 promoter: a new tool for Candida albicans molecular genetics. Molecular microbiology 34, 792-798. Clark, K.L., Feldmann, P.J., Dignard, D., Larocque, R., Brown, A.J., Lee, M.G., Thomas, D.Y., and Whiteway, M. (1995). Constitutive activation of the Saccharomyces cerevisiae mating response pathway by a MAP kinase kinase from Candida albicans. Mol Gen Genet 249, 609-621. Clemente-Blanco, A., Gonzalez-Novo, A., Machin, F., Caballero-Lima, D., Aragon, L., Sanchez, M., de Aldana, C.R., Jimenez, J., and Correa-Bordes, J. (2006). The Cdc14p phosphatase affects late cell-cycle events and morphogenesis in Candida albicans. Journal of cell science 119, 11301143. Cloutier, M., Castilla, R., Bolduc, N., Zelada, A., Martineau, P., Bouillon, M., Magee, B.B., Passeron, S., Giasson, L., and Cantore, M.L. (2003). The two isoforms of the cAMP-dependent protein kinase catalytic subunit are involved in the control of dimorphism in the human fungal pathogen Candida albicans. Fungal Genet Biol 38, 133-141. Colman-Lerner, A., Chin, T.E., and Brent, R. (2001). Yeast Cbk1 and Mob2 activate daughterspecific genetic programs to induce asymmetric cell fates. Cell 107, 739-750. 105 Bibliografía Crampin, H., Finley, K., Gerami-Nejad, M., Court, H., Gale, C., Berman, J., and Sudbery, P. (2005). Candida albicans hyphae have a Spitzenkorper that is distinct from the polarisome found in yeast and pseudohyphae. Journal of cell science 118, 2935-2947. Csank, C., Schroppel, K., Leberer, E., Harcus, D., Mohamed, O., Meloche, S., Thomas, D.Y., and Whiteway, M. (1998). Roles of the Candida albicans mitogen-activated protein kinase homolog, Cek1p, in hyphal development and systemic candidiasis. Infection and immunity 66, 2713-2721. Chapa y Lazo, B., Bates, S., and Sudbery, P. (2005). The G1 cyclin Cln3 regulates morphogenesis in Candida albicans. Eukaryotic cell 4, 90-94. Chen, H., Fujita, M., Feng, Q., Clardy, J., and Fink, G.R. (2004). Tyrosol is a quorum-sensing molecule in Candida albicans. Proceedings of the National Academy of Sciences of the United States of America 101, 5048-5052. Doedt, T., Krishnamurthy, S., Bockmuhl, D.P., Tebarth, B., Stempel, C., Russell, C.L., Brown, A.J., and Ernst, J.F. (2004). APSES proteins regulate morphogenesis and metabolism in Candida albicans. Molecular biology of the cell 15, 3167-3180. Elson, S.L., Noble, S.M., Solis, N.V., Filler, S.G., and Johnson, A.D. (2009). An RNA transport system in Candida albicans regulates hyphal morphology and invasive growth. PLoS Genet 5, e1000664. Emoto, K., He, Y., Ye, B., Grueber, W.B., Adler, P.N., Jan, L.Y., and Jan, Y.N. (2004). Control of dendritic branching and tiling by the Tricornered-kinase/Furry signaling pathway in Drosophila sensory neurons. Cell 119, 245-256. Feng, Q., Summers, E., Guo, B., and Fink, G. (1999). Ras signaling is required for serum-induced hyphal differentiation in Candida albicans. Journal of bacteriology 181, 6339-6346. Fu, Y., Ibrahim, A.S., Sheppard, D.C., Chen, Y.C., French, S.W., Cutler, J.E., Filler, S.G., and Edwards, J.E., Jr. (2002). Candida albicans Als1p: an adhesin that is a downstream effector of the EFG1 filamentation pathway. Molecular microbiology 44, 61-72. Garcia-Sanchez, S., Mavor, A.L., Russell, C.L., Argimon, S., Dennison, P., Enjalbert, B., and Brown, A.J. (2005). Global roles of Ssn6 in Tup1- and Nrg1-dependent gene regulation in the fungal pathogen, Candida albicans. Molecular biology of the cell 16, 2913-2925. Gogl, G., Schneider, K.D., Yeh, B.J., Alam, N., Nguyen Ba, A.N., Moses, A.M., Hetenyi, C., Remenyi, A., and Weiss, E.L. (2015). The Structure of an NDR/LATS Kinase-Mob Complex Reveals a Novel Kinase-Coactivator System and Substrate Docking Mechanism. PLoS biology 13, e1002146. Gola, S., Martin, R., Walther, A., Dunkler, A., and Wendland, J. (2003). New modules for PCRbased gene targeting in Candida albicans: rapid and efficient gene targeting using 100 bp of flanking homology region. Yeast 20, 1339-1347. Golub, E.I. (1988). 'One minute' transformation of competent E. coli by plasmid DNA. Nucleic acids research 16, 1641. 106 Bibliografía González-Novo, A., Correa-Bordes, J., Labrador, L., Sánchez, M., Vázquez de Aldana, C.R., and Jiménez, J. (2008). Sep7 is essential to modify septin ring dynamics and inhibit cell separation during Candida albicans hyphal growth. Molecular biology of the cell 19, 1509-1518. Greig, J.A., Sudbery, I.M., Richardson, J.P., Naglik, J.R., Wang, Y., and Sudbery, P.E. (2015). Cell cycle-independent phospho-regulation of Fkh2 during hyphal growth regulates Candida albicans pathogenesis. PLoS pathogens 11, e1004630. Gudlaugsson, O., Gillespie, S., Lee, K., Vande Berg, J., Hu, J., Messer, S., Herwaldt, L., Pfaller, M., and Diekema, D. (2003). Attributable mortality of nosocomial candidemia, revisited. Clin Infect Dis 37, 1172-1177. Gutierrez-Escribano, P., Gonzalez-Novo, A., Suarez, M.B., Li, C.R., Wang, Y., de Aldana, C.R., and Correa-Bordes, J. (2011). CDK-dependent phosphorylation of Mob2 is essential for hyphal development in Candida albicans. Molecular biology of the cell 22, 2458-2469. Gutierrez-Escribano, P., Zeidler, U., Suarez, M.B., Bachellier-Bassi, S., Clemente-Blanco, A., Bonhomme, J., Vazquez de Aldana, C.R., d'Enfert, C., and Correa-Bordes, J. (2012). The NDR/LATS Kinase Cbk1 Controls the Activity of the Transcriptional Regulator Bcr1 during Biofilm Formation in Candida albicans. PLoS pathogens 8, e1002683. Hawkins, N., and Garriga, G. (1998). Asymmetric cell division: from A to Z. Genes & development 12, 3625-3638. Hazan, I., Sepulveda-Becerra, M., and Liu, H. (2002). Hyphal elongation is regulated independently of cell cycle in Candida albicans. Molecular biology of the cell 13, 134-145. Hergovich, A., and Hemmings, B.A. (2012). Hippo signalling in the G2/M cell cycle phase: lessons learned from the yeast MEN and SIN pathways. Seminars in cell & developmental biology 23, 794-802. Hergovich, A., Stegert, M.R., Schmitz, D., and Hemmings, B.A. (2006). NDR kinases regulate essential cell processes from yeast to humans. Nat Rev Mol Cell Biol 7, 253-264. Hogan, D.A., and Sundstrom, P. (2009). The Ras/cAMP/PKA signaling pathway and virulence in Candida albicans. Future microbiology 4, 1263-1270. Hogan, D.J., Riordan, D.P., Gerber, A.P., Herschlag, D., and Brown, P.O. (2008). Diverse RNAbinding proteins interact with functionally related sets of RNAs, suggesting an extensive regulatory system. PLoS biology 6, e255. Homann, O.R., Dea, J., Noble, S.M., and Johnson, A.D. (2009). A phenotypic profile of the Candida albicans regulatory network. PLoS Genet 5, e1000783. Hornby, J.M., Jensen, E.C., Lisec, A.D., Tasto, J.J., Jahnke, B., Shoemaker, R., Dussault, P., and Nickerson, K.W. (2001). Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol. Applied and environmental microbiology 67, 2982-2992. Howell, A.S., and Lew, D.J. (2012). Morphogenesis and the cell cycle. Genetics 190, 51-77. Huang, J., Wu, S., Barrera, J., Matthews, K., and Pan, D. (2005). The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP. Cell 122, 421-434. 107 Bibliografía Huang, Z.X., Zhao, P., Zeng, G.S., Wang, Y.M., Sudbery, I., and Wang, Y. (2014). Phosphoregulation of Nap1 plays a role in septin ring dynamics and morphogenesis in Candida albicans. mBio 5, e00915-00913. Jakobsen, M.K., Cheng, Z., Lam, S.K., Roth-Johnson, E., Barfield, R.M., and Schekman, R. (2013). Phosphorylation of Chs2p regulates interaction with COPII. Journal of cell science 126, 21512156. Jansen, J.M., Wanless, A.G., Seidel, C.W., and Weiss, E.L. (2009). Cbk1 regulation of the RNAbinding protein Ssd1 integrates cell fate with translational control. Curr Biol 19, 2114-2120. Johnstone, O., and Lasko, P. (2001). Translational regulation and RNA localization in Drosophila oocytes and embryos. Annu Rev Genet 35, 365-406. Jones, L.A., and Sudbery, P.E. (2010). Spitzenkorper, exocyst, and polarisome components in Candida albicans hyphae show different patterns of localization and have distinct dynamic properties. Eukaryotic cell 9, 1455-1465. Jorgensen, P., Nelson, B., Robinson, M.D., Chen, Y., Andrews, B., Tyers, M., and Boone, C. (2002). High-resolution genetic mapping with ordered arrays of Saccharomyces cerevisiae deletion mutants. Genetics 162, 1091-1099. Kadosh, D., and Johnson, A.D. (2001). Rfg1, a protein related to the Saccharomyces cerevisiae hypoxic regulator Rox1, controls filamentous growth and virulence in Candida albicans. Molecular and cellular biology 21, 2496-2505. Kadosh, D., and Johnson, A.D. (2005). Induction of the Candida albicans filamentous growth program by relief of transcriptional repression: a genome-wide analysis. Molecular biology of the cell 16, 2903-2912. Kelly, M.T., MacCallum, D.M., Clancy, S.D., Odds, F.C., Brown, A.J., and Butler, G. (2004). The Candida albicans CaACE2 gene affects morphogenesis, adherence and virulence. Molecular microbiology 53, 969-983. King, M.L., Messitt, T.J., and Mowry, K.L. (2005). Putting RNAs in the right place at the right time: RNA localization in the frog oocyte. Biol Cell 97, 19-33. Klevay, M.J., Ernst, E.J., Hollanbaugh, J.L., Miller, J.G., Pfaller, M.A., and Diekema, D.J. (2008). Therapy and outcome of Candida glabrata versus Candida albicans bloodstream infection. Diagnostic microbiology and infectious disease 60, 273-277. Knaus, M., Pelli-Gulli, M.P., van Drogen, F., Springer, S., Jaquenoud, M., and Peter, M. (2007). Phosphorylation of Bem2p and Bem3p may contribute to local activation of Cdc42p at bud emergence. The EMBO journal 26, 4501-4513. Kohler, J.R., and Fink, G.R. (1996). Candida albicans strains heterozygous and homozygous for mutations in mitogen-activated protein kinase signaling components have defects in hyphal development. Proceedings of the National Academy of Sciences of the United States of America 93, 13223-13228. Kono, K., Nogami, S., Abe, M., Nishizawa, M., Morishita, S., Pellman, D., and Ohya, Y. (2008). G1/S cyclin-dependent kinase regulates small GTPase Rho1p through phosphorylation of RhoGEF Tus1p in Saccharomyces cerevisiae. Molecular biology of the cell 19, 1763-1771. 108 Bibliografía Kurischko, C., Kim, H.K., Kuravi, V.K., Pratzka, J., and Luca, F.C. (2011). The yeast Cbk1 kinase regulates mRNA localization via the mRNA-binding protein Ssd1. J Cell Biol 192, 583-598. Kurischko, C., Kuravi, V.K., Wannissorn, N., Nazarov, P.A., Husain, M., Zhang, C., Shokat, K.M., McCaffery, J.M., and Luca, F.C. (2008). The yeast LATS/Ndr kinase Cbk1 regulates growth via Golgi-dependent glycosylation and secretion. Molecular biology of the cell 19, 5559-5578. Leberer, E., Harcus, D., Broadbent, I.D., Clark, K.L., Dignard, D., Ziegelbauer, K., Schmidt, A., Gow, N.A., Brown, A.J., and Thomas, D.Y. (1996). Signal transduction through homologs of the Ste20p and Ste7p protein kinases can trigger hyphal formation in the pathogenic fungus Candida albicans. Proceedings of the National Academy of Sciences of the United States of America 93, 13217-13222. Leberer, E., Ziegelbauer, K., Schmidt, A., Harcus, D., Dignard, D., Ash, J., Johnson, L., and Thomas, D.Y. (1997). Virulence and hyphal formation of Candida albicans require the Ste20plike protein kinase CaCla4p. Curr Biol 7, 539-546. Lee, H.J., Kim, J.M., Kang, W.K., Yang, H., and Kim, J.Y. (2015). The Ndr kinase Cbk1 downregulates the transcriptional repressor Nrg1 through the mRNA-binding protein Ssd1 in Candida albicans. Eukaryotic cell. Leroy, O., Gangneux, J.P., Montravers, P., Mira, J.P., Gouin, F., Sollet, J.P., Carlet, J., Reynes, J., Rosenheim, M., Regnier, B., and Lortholary, O. (2009). Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006). Critical care medicine 37, 1612-1618. Lew, D.J., and Reed, S.I. (1993). Morphogenesis in the yeast cell cycle: regulation by Cdc28 and cyclins. J Cell Biol 120, 1305-1320. Li, C.R., Lee, R.T., Wang, Y.M., Zheng, X.D., and Wang, Y. (2007). Candida albicans hyphal morphogenesis occurs in Sec3p-independent and Sec3p-dependent phases separated by septin ring formation. Journal of cell science 120, 1898-1907. Liu, H., Kohler, J., and Fink, G.R. (1994). Suppression of hyphal formation in Candida albicans by mutation of a STE12 homolog. Science 266, 1723-1726. Lo, H.J., Kohler, J.R., DiDomenico, B., Loebenberg, D., Cacciapuoti, A., and Fink, G.R. (1997). Nonfilamentous C. albicans mutants are avirulent. Cell 90, 939-949. Lo, H.J., Wang, J.S., Lin, C.Y., Chen, C.G., Hsiao, T.Y., Hsu, C.T., Su, C.L., Fann, M.J., Ching, Y.T., and Yang, Y.L. (2005). Efg1 involved in drug resistance by regulating the expression of ERG3 in Candida albicans. Antimicrobial agents and chemotherapy 49, 1213-1215. Loeb, J.D., Sepulveda-Becerra, M., Hazan, I., and Liu, H. (1999). A G1 cyclin is necessary for maintenance of filamentous growth in Candida albicans. Molecular and cellular biology 19, 4019-4027. Lu, Y., Su, C., and Liu, H. (2012). A GATA transcription factor recruits Hda1 in response to reduced Tor1 signaling to establish a hyphal chromatin state in Candida albicans. PLoS pathogens 8, e1002663. 109 Bibliografía Lu, Y., Su, C., Unoje, O., and Liu, H. (2014). Quorum sensing controls hyphal initiation in Candida albicans through Ubr1-mediated protein degradation. Proceedings of the National Academy of Sciences of the United States of America 111, 1975-1980. Lu, Y., Su, C., Wang, A., and Liu, H. (2011). Hyphal development in Candida albicans requires two temporally linked changes in promoter chromatin for initiation and maintenance. PLoS biology 9, e1001105. Luo, G., Zhang, J., Luca, F.C., and Guo, W. (2013). Mitotic phosphorylation of Exo84 disrupts exocyst assembly and arrests cell growth. The Journal of cell biology 202, 97-111. Maerz, S., and Seiler, S. (2010). Tales of RAM and MOR: NDR kinase signaling in fungal morphogenesis. Current opinion in microbiology 13, 663-671. Mancini Lombardi, I., Palani, S., Meitinger, F., Darieva, Z., Hofmann, A., Sharrocks, A.D., and Pereira, G. (2013). Lre1 directly inhibits the NDR/Lats kinase Cbk1 at the cell division site in a phosphorylation-dependent manner. Curr Biol 23, 1736-1745. Massey, S.E., Moura, G., Beltrao, P., Almeida, R., Garey, J.R., Tuite, M.F., and Santos, M.A. (2003). Comparative evolutionary genomics unveils the molecular mechanism of reassignment of the CTG codon in Candida spp. Genome research 13, 544-557. McCusker, D., Denison, C., Anderson, S., Egelhofer, T.A., Yates, J.R., 3rd, Gygi, S.P., and Kellogg, D.R. (2007). Cdk1 coordinates cell-surface growth with the cell cycle. Nature cell biology 9, 506-515. McNemar, M.D., and Fonzi, W.A. (2002). Conserved serine/threonine kinase encoded by CBK1 regulates expression of several hypha-associated transcripts and genes encoding cell wall proteins in Candida albicans. Journal of bacteriology 184, 2058-2061. Medina-Rivera, A., Defrance, M., Sand, O., Herrmann, C., Castro-Mondragon, J.A., Delerce, J., Jaeger, S., Blanchet, C., Vincens, P., Caron, C., Staines, D.M., Contreras-Moreira, B., Artufel, M., Charbonnier-Khamvongsa, L., Hernandez, C., Thieffry, D., Thomas-Chollier, M., and van Helden, J. (2015). RSAT 2015: Regulatory Sequence Analysis Tools. Nucleic acids research. Munoz, P., Burillo, A., and Bouza, E. (2000). Criteria used when initiating antifungal therapy against Candida spp. in the intensive care unit. International journal of antimicrobial agents 15, 83-90. Murad, A.M., Leng, P., Straffon, M., Wishart, J., Macaskill, S., MacCallum, D., Schnell, N., Talibi, D., Marechal, D., Tekaia, F., d'Enfert, C., Gaillardin, C., Odds, F.C., and Brown, A.J. (2001). NRG1 represses yeast-hypha morphogenesis and hypha-specific gene expression in Candida albicans. The EMBO journal 20, 4742-4752. Nelson, B., Kurischko, C., Horecka, J., Mody, M., Nair, P., Pratt, L., Zougman, A., McBroom, L.D., Hughes, T.R., Boone, C., and Luca, F.C. (2003). RAM: a conserved signaling network that regulates Ace2p transcriptional activity and polarized morphogenesis. Molecular biology of the cell 14, 3782-3803. Noble, S.M., French, S., Kohn, L.A., Chen, V., and Johnson, A.D. (2010). Systematic screens of a Candida albicans homozygous deletion library decouple morphogenetic switching and pathogenicity. Nat Genet 42, 590-598. 110 Bibliografía Odds, F.C. (1985). Morphogenesis in Candida albicans. Critical reviews in microbiology 12, 4593. Pan, D. (2010). The hippo signaling pathway in development and cancer. Developmental cell 19, 491-505. Park, H.O., and Bi, E. (2007). Central roles of small GTPases in the development of cell polarity in yeast and beyond. Microbiol Mol Biol Rev 71, 48-96. Park, Y.N., and Morschhauser, J. (2005). Tetracycline-inducible gene expression and gene deletion in Candida albicans. Eukaryotic cell 4, 1328-1342. Racki, W.J., Becam, A.M., Nasr, F., and Herbert, C.J. (2000). Cbk1p, a protein similar to the human myotonic dystrophy kinase, is essential for normal morphogenesis in Saccharomyces cerevisiae. The EMBO journal 19, 4524-4532. Rida, P.C., Nishikawa, A., Won, G.Y., and Dean, N. (2006). Yeast-to-hyphal transition triggers formin-dependent Golgi localization to the growing tip in Candida albicans. Molecular biology of the cell 17, 4364-4378. Rocha-Pimienta, J. (2015). Relación entre la ruta RAM y represores del crecimiento hifal de Candida albicans. Trabajo de Fin de Master. Universidad de Extremadura. Roh, D.H., Bowers, B., Schmidt, M., and Cabib, E. (2002). The septation apparatus, an autonomous system in budding yeast. Molecular biology of the cell 13, 2747-2759. Saito, K., Fujimura-Kamada, K., Hanamatsu, H., Kato, U., Umeda, M., Kozminski, K.G., and Tanaka, K. (2007). Transbilayer phospholipid flipping regulates Cdc42p signaling during polarized cell growth via Rga GTPase-activating proteins. Developmental cell 13, 743-751. Santos, M.A., and Tuite, M.F. (1995). The CUG codon is decoded in vivo as serine and not leucine in Candida albicans. Nucleic acids research 23, 1481-1486. Sarkany, Z., Silva, A., Pereira, P.J., and Macedo-Ribeiro, S. (2014). Ser or Leu: structural snapshots of mistranslation in Candida albicans. Frontiers in molecular biosciences 1, 27. Saville, S.P., Lazzell, A.L., Bryant, A.P., Fretzen, A., Monreal, A., Solberg, E.O., Monteagudo, C., Lopez-Ribot, J.L., and Milne, G.T. (2006). Inhibition of filamentation can be used to treat disseminated candidiasis. Antimicrobial agents and chemotherapy 50, 3312-3316. Schaub, Y., Dunkler, A., Walther, A., and Wendland, J. (2006). New pFA-cassettes for PCRbased gene manipulation in Candida albicans. J Basic Microbiol 46, 416-429. Shareck, J., and Belhumeur, P. (2011). Modulation of morphogenesis in Candida albicans by various small molecules. Eukaryotic cell 10, 1004-1012. Sharkey, L.L., McNemar, M.D., Saporito-Irwin, S.M., Sypherd, P.S., and Fonzi, W.A. (1999). HWP1 functions in the morphological development of Candida albicans downstream of EFG1, TUP1, and RBF1. Journal of bacteriology 181, 5273-5279. Singh, P., Ghosh, S., and Datta, A. (1997). A novel MAP-kinase kinase from Candida albicans. Gene 190, 99-104. 111 Bibliografía Sinha, I., Wang, Y.M., Philp, R., Li, C.R., Yap, W.H., and Wang, Y. (2007). Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental cell 13, 421-432. Song, Y., Cheon, S.A., Lee, K.E., Lee, S.Y., Lee, B.K., Oh, D.B., Kang, H.A., and Kim, J.Y. (2008). Role of the RAM network in cell polarity and hyphal morphogenesis in Candida albicans. Molecular biology of the cell 19, 5456-5477. Sonneborn, A., Bockmuhl, D.P., Gerads, M., Kurpanek, K., Sanglard, D., and Ernst, J.F. (2000). Protein kinase A encoded by TPK2 regulates dimorphism of Candida albicans. Molecular microbiology 35, 386-396. Sopko, R., Huang, D., Smith, J.C., Figeys, D., and Andrews, B.J. (2007). Activation of the Cdc42p GTPase by cyclin-dependent protein kinases in budding yeast. The EMBO journal 26, 44874500. Stoldt, V.R., Sonneborn, A., Leuker, C.E., and Ernst, J.F. (1997). Efg1p, an essential regulator of morphogenesis of the human pathogen Candida albicans, is a member of a conserved class of bHLH proteins regulating morphogenetic processes in fungi. The EMBO journal 16, 1982-1991. Su, C., Lu, Y., and Liu, H. (2013). Reduced TOR signaling sustains hyphal development in Candida albicans by lowering Hog1 basal activity. Molecular biology of the cell 24, 385-397. Su, Z., Osborne, M.J., Xu, P., Xu, X., Li, Y., and Ni, F. (2005). A bivalent dissectional analysis of the high-affinity interactions between Cdc42 and the Cdc42/Rac interactive binding domains of signaling kinases in Candida albicans. Biochemistry 44, 16461-16474. Sudbery, P., Gow, N., and Berman, J. (2004). The distinct morphogenic states of Candida albicans. Trends in microbiology 12, 317-324. Sudbery, P.E. (2011). Growth of Candida albicans hyphae. Nature reviews 9, 737-748. Sudbery, P.E. (2012). Growth of Candida albicans hyphae. Nat Rev Microbiol 9, 737-748. Sudol, M., and Harvey, K.F. (2010). Modularity in the Hippo signaling pathway. Trends Biochem Sci 35, 627-633. Teh, E.M., Chai, C.C., and Yeong, F.M. (2009). Retention of Chs2p in the ER requires N-terminal CDK1-phosphorylation sites. Cell cycle (Georgetown, Tex 8, 2964-2974. Toda, T., Cameron, S., Sass, P., Zoller, M., Scott, J.D., McMullen, B., Hurwitz, M., Krebs, E.G., and Wigler, M. (1987). Cloning and characterization of BCY1, a locus encoding a regulatory subunit of the cyclic AMP-dependent protein kinase in Saccharomyces cerevisiae. Molecular and cellular biology 7, 1371-1377. Uppuluri, P., Pierce, C.G., Thomas, D.P., Bubeck, S.S., Saville, S.P., and Lopez-Ribot, J.L. (2010). The transcriptional regulator Nrg1p controls Candida albicans biofilm formation and dispersion. Eukaryotic cell 9, 1531-1537. Walther, A., and Wendland, J. (2003). An improved transformation protocol for the human fungal pathogen Candida albicans. Curr Genet 42, 339-343. 112 Bibliografía Wang, A., Lane, S., Tian, Z., Sharon, A., Hazan, I., and Liu, H. (2007). Temporal and spatial control of HGC1 expression results in Hgc1 localization to the apical cells of hyphae in Candida albicans. Eukaryotic cell 6, 253-261. Wang, A., Raniga, P.P., Lane, S., Lu, Y., and Liu, H. (2009). Hyphal chain formation in Candida albicans: Cdc28-Hgc1 phosphorylation of Efg1 represses cell separation genes. Molecular and cellular biology 29, 4406-4416. Wang, Y. (2009). CDKs and the yeast-hyphal decision. Current opinion in microbiology 12, 644649. Ward, M.P., and Garrett, S. (1994). Suppression of a yeast cyclic AMP-dependent protein kinase defect by overexpression of SOK1, a yeast gene exhibiting sequence similarity to a developmentally regulated mouse gene. Molecular and cellular biology 14, 5619-5627. Warenda, A.J., and Konopka, J.B. (2002). Septin function in Candida albicans morphogenesis. Molecular biology of the cell 13, 2732-2746. Weiss, E.L., Kurischko, C., Zhang, C., Shokat, K., Drubin, D.G., and Luca, F.C. (2002). The Saccharomyces cerevisiae Mob2p-Cbk1p kinase complex promotes polarized growth and acts with the mitotic exit network to facilitate daughter cell-specific localization of Ace2p transcription factor. J Cell Biol 158, 885-900. Whiteway, M., and Bachewich, C. (2007). Morphogenesis in Candida albicans. Annu Rev Microbiol 61, 529-553. Whiteway, M., Dignard, D., and Thomas, D.Y. (1992). Dominant negative selection of heterologous genes: isolation of Candida albicans genes that interfere with Saccharomyces cerevisiae mating factor-induced cell cycle arrest. Proceedings of the National Academy of Sciences of the United States of America 89, 9410-9414. Wilson, R.B., Davis, D., and Mitchell, A.P. (1999). Rapid hypothesis testing with Candida albicans through gene disruption with short homology regions. Journal of bacteriology 181, 1868-1874. Wullschleger, S., Loewith, R., and Hall, M.N. (2006). TOR signaling in growth and metabolism. Cell 124, 471-484. Zeng, G., Wang, Y.M., and Wang, Y. (2012). Cdc28-Cln3 phosphorylation of Sla1 regulates actin patch dynamics in different modes of fungal growth. Molecular biology of the cell 23, 34853497. Zhang, G., Kashimshetty, R., Ng, K.E., Tan, H.B., and Yeong, F.M. (2006). Exit from mitosis triggers Chs2p transport from the endoplasmic reticulum to mother-daughter neck via the secretory pathway in budding yeast. The Journal of cell biology 174, 207-220. Zhao, B., Tumaneng, K., and Guan, K.L. (2011). The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nature cell biology 13, 877-883. Zheng, X., and Wang, Y. (2004). Hgc1, a novel hypha-specific G1 cyclin-related protein regulates Candida albicans hyphal morphogenesis. The EMBO journal 23, 1845-1856. 113 Bibliografía Zheng, X.D., Lee, R.T., Wang, Y.M., Lin, Q.S., and Wang, Y. (2007). Phosphorylation of Rga2, a Cdc42 GAP, by CDK/Hgc1 is crucial for Candida albicans hyphal growth. The EMBO journal 26, 3760-3769. Zheng, X.D., Wang, Y.M., and Wang, Y. (2003). CaSPA2 is important for polarity establishment and maintenance in Candida albicans. Molecular microbiology 49, 1391-1405. 114