FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO
Anuncio

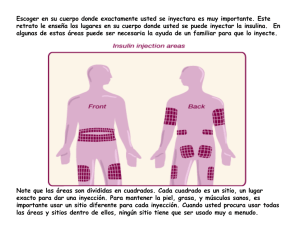
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO CAVERJECTR 20 mcg CAVERJECTR 10 mcg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Alprostadil Cantidad por ml de solución reconstituida* Cantidad por vial Caverject 20 mcg 20 mcg 10 mcg 23,2 mcg 11,9 mcg Caverject 10 mcg 20 mcg 10 mcg * El producto se reconstituye con 1 ml de agua para inyección (alcohol bencílico 0,945%) para obtener una solución que contenga 20 mcg/ml ó 10 mcg/ml de alprostadil. El contenido del vial después de la reconstitución es de 1,13 ml, que permite un volumen extraíble de 1 ml. 3. FORMA FARMACÉUTICA Polvo liofilizado estéril para inyección intracavernosa (IC). 4. DATOS CLÍNICOS a) Indicaciones terapéuticas Caverject está indicado en el tratamiento de la disfunción eréctil. También puede ser útil, junto con otras pruebas diagnósticas, en el diagnóstico de la disfunción eréctil. b) Posología y forma de administración Formulación y diluciones: Caverject se envasa en viales de 5 ml de capacidad. Para su reconstitución debe utilizarse el disolvente (agua estéril para inyección con alcohol bencílico 0,945%) contenido en la jeringa precargada adjunta. Tras la reconstitución por adición de 1 ml de disolvente, la solución resultante contiene 20 mcg ó 10 mcg de alprostadil por ml, 172 mg/ml de lactosa y 47 mg/ml de citrato sódico. Una vez reconstituido, no deben introducirse en el vial otros materiales. Dosificación y administración: Caverject se administra por inyección intracavernosa directa. Se recomienda una aguja de calibre 27 a 30 y 1/2 pulgada de longitud. La dosis de Caverject debe ser individualizada para cada paciente. No se recomiendan dosis superiores a 60 mcg. La frecuencia de inyección recomendada es de no más de una vez al día y no más de tres veces a la semana. Ajuste de dosis: Disfunción eréctil de etiología vasculogénica, psicogénica o mixta: El ajuste de dosis debe iniciarse con 2,5 mcg de Caverject. Si la respuesta es parcial, la dosis puede aumentarse en 2,5 mcg, hasta 5 mcg, y después con incrementos de 5 a 10 mcg, dependiendo de la respuesta eréctil, hasta que la dosis produzca una erección adecuada para mantener relaciones sexuales, no excediendo de 60 minutos de duración. Si no existe respuesta con la primera dosis de 2,5 mcg, la segunda dosis puede aumentarse hasta 7,5 mcg, seguidos de incrementos de 5 a 10 mcg. El paciente debe permanecer en la consulta del médico hasta que se produzca detumescencia completa. Si no existe respuesta, la dosis superior siguiente puede administrarse a la hora. Si existe respuesta, debe existir por lo menos el intervalo de 1 día antes de administrar la dosis siguiente. Disfunción eréctil de etiología neurogénica: El ajuste de dosis debe iniciarse con 1,25 mcg de Caverject. La dosis puede aumentarse en 1,25 mcg, hasta 2,5 mcg, y después con un incremento de 2,5 mcg hasta una dosis de 5 mcg, y después, incrementos de 5 mcg hasta que la dosis produzca una erección adecuada para mantener relaciones sexuales, no excediendo de 60 minutos de duración. El paciente debe permanecer en la consulta del médico hasta que se produzca detumescencia completa. Si no existe respuesta, la dosis superior siguiente puede administrarse a la hora. Si existe respuesta, debe existir por lo menos el intervalo de 1 día antes de administrar la dosis siguiente. Terapia de mantenimiento: Las primeras inyecciones de Caverject deben realizarse en la consulta del médico por parte de personal sanitario. Una vez ajustada la dosis y después de recibir las instrucciones y el entrenamiento adecuados, la administración puede realizarse en casa. El médico debe analizar la habilidad y competencia del paciente para la autoadministración. La dosis seleccionada para el tratamiento con autoadministración debe proporcionar al paciente una erección satisfactoria para mantener relaciones sexuales, mantenida no más de 60 minutos. Si la duración de la erección es mayor de los 60 minutos, la dosis de Caverject debe reducirse. La terapia de mantenimiento para administración en casa debe iniciarse a la dosis determinada por el médico en la consulta; sin embargo, si se necesita un ajuste adicional de la dosis, este debe realizarse tras consultar con el médico y siguiendo las directrices 2 anteriormente indicadas. Se recomienda que el paciente acuda a la consulta del médico cada tres meses, para hacer un seguimiento de la terapia de autoadministración. La dosis media de Caverject es 20,7 mcg. El vial reconstituido, la jeringa y las agujas están destinados para un sólo uso y deben desecharse después de utilizarlos. Caverject en el diagnóstico de la Disfunción Eréctil: En la prueba diagnóstica más sencilla para la disfunción eréctil, los pacientes se monitorizan en cuanto a la aparición de una erección tras la inyección intracavernosa de Caverject (con un escalonamiento de la dosis a partir de 2,5 mcg, con incrementos de 2,5 mcg). También puede utilizarse conjuntamente con otras pruebas, administrando una dosis de Caverject que induzca una erección con firme rigidez. Estas pruebas son: el Doppler (dosis única de 10 a 40 mcg), penograma con radioisótopos (dosis única de 10 mcg), arteriografía del pene (una o dos dosis de 10 mcg de PGE1) o lavado con 133Xenón (dosis única de 20 mcg). c) Contraindicaciones Caverject no debe utilizarse en pacientes con hipersensibilidad conocida al fármaco; o en pacientes con condiciones de predisposición al priapismo (erección prolongada de más de cuatro horas), como anemia falciforme, mieloma múltiple o leucemia; o en pacientes con deformación anatómica del pene, como angulación, fibrosis cavernosa o enfermedad de Peyronie. Los pacientes con implantes de pene no deben ser tratados con Caverject. No debe ser utilizado en aquellas personas para las cuales la actividad sexual está desaconsejada o contraindicada. d) Advertencias y precauciones especiales de empleo - Se sabe que puede aparecer priapismo tras la administración intracavernosa de cualquier sustancia vasoactiva, incluyendo Caverject. Se debe instruir a los pacientes para que comuniquen a su médico cualquier erección que persista más de 4 horas. - Con poca frecuencia puede aparecer fibrosis, incluyendo enfermedad de Peyronie. Se recomienda realizar un seguimiento regular de los pacientes, con examen cuidadoso del pene, para detectar signos de fibrosis. El tratamiento con Caverject debe suprimirse en aquellos pacientes que desarrollen angulación del pene, fibrosis cavernosa o enfermedad de Peyronie. - Los pacientes tratados con anticoagulantes, tales como warfarina o heparina, pueden tener mayor predisposición a sufrir hemorragias tras la inyección intracavernosa. 3 - e) La inyección de Caverject puede inducir pequeñas hemorragias en el lugar de inyección. En aquellos pacientes infectados con enfermedades de transmisión sanguínea, este hecho podría aumentar la transmisión de dichas enfermedades a su pareja. La utilización de Caverject por vía IC no ofrece ninguna protección frente a las enfermedades de transmisión sexual. Los pacientes que utilicen Caverject deben ser informados de las medidas necesarias para evitar el contagio de las enfermedades transmitidas por vía sexual, incluyendo el virus de la inmunodeficiencia humana. Interacción con otros medicamentos y otras formas de interacción No se conoce ninguna interacción. Caverject no está destinado a la administración conjunta con cualquier otro agente indicado en el tratamiento de la disfunción eréctil. f) Embarazo y lactancia Caverject no debe ser utilizado en mujeres. g) Efectos sobre la capacidad para conducir y utilizar maquinaria Ninguno. h) Reacciones adversas La reacción adversa más frecuente tras la inyección intracavernosa de Caverject es dolor del pene, en la mayoría de los casos de intensidad media o moderada. Menos frecuentemente se ha comunicado la aparición hematoma en el lugar de la inyección, lo que se ha relacionado con la técnica de inyección más que con el efecto de Caverject. También con poca frecuencia se ha comunicado la aparición de una erección prolongada y priapismo. En la mayoría de los casos se produjo una detumescencia espontánea. Otras reacciones adversas locales que pueden aparecer son: equimosis en el lugar de inyección, exantema, edema y fibrosis. Menos frecuentemente pueden aparecer: balanitis, hemorragia en el lugar de inyección, inflamación en el lugar de inyección, tumefacción en el lugar de inyección, sangrado de la uretra, sensación de calor en el pene, entumecimiento, infección por levaduras, irritación, sensibilidad, fimosis, prurito, eritema, escape venoso, erección dolorosa y eyaculación anormal. En términos de efectos sistémicos, los que a continuación se exponen se comunicaron por parte de <1% de los pacientes participantes de los ensayos clínicos y se juzgaron como posiblemente relacionados con la utilización de Caverject: dolor o tumefacción testicular, tirantez, dolor o eritema del escroto, aumento de la frecuencia urinaria, urgencia urinaria, hipotensión, vasodilatación, hipertensión, extrasístole supraventricular, trastorno vascular 4 periférico, mareo, hipestesia, debilidad de las nalgas, dolor localizado (nalgas, piernas, genitales, abdominal), cefalea, dolor pélvico, dolor de espalda y síndrome gripal. Se observaron ciertos cambios hemodinámicos, manifestados como descenso de la presión sanguínea y aumento de la velocidad del pulso, en los ensayos clínicos, más frecuentes a dosis de 20 mcg o superiores, que parecieron ser dosis-dependientes. Caverject no modifica los parámetros habituales determinados en los análisis de sangre y orina. i) Sobredosificación Los signos farmacotóxicos de la PGE1 son similares en todas las especies animales e incluyen depresión, deposiciones blandas o diarrea, y respiración acelerada. En el hombre puede aparecer una erección prolongada y/o priapismo tras la administración intracavernosa de sustancias vasoactivas, incluyendo alprostadil. El tratamiento del priapismo debe estar acorde con la buena práctica clínica e incluye diferentes propuestas, como aspiración, inyección IC de aminas simpaticomiméticas o cirugía. 5. PROPIEDADES FARMACOLÓGICAS a) Propiedades farmacodinámicas PGE1 está presente en varios tejidos y fluidos de los mamíferos. Tiene un perfil farmacológico diverso, entre el cual se encuentran sus efectos más importantes, como vasodilatación, inhibición de la agregación plaquetaria, inhibición de la secreción gástrica y estimulación del músculo liso intestinal y uterino. El efecto farmacológico de alprostadil en el tratamiento de la disfunción eréctil está mediado por una inhibición de la actividad alfa-1adrenérgica sobre el tejido del pene y por su efecto relajante sobre el músculo liso cavernoso. b) Propiedades farmacocinéticas Las propiedades farmacocinéticas de PGE1 administrada por vía IV se han estudiado extensamente. Cuando se administra intravenosamente a humanos, se transforma rápidamente en metabolitos relativamente inactivos. En varones sanos, de un 70% a un 90% de alprostadil se metaboliza en un único paso por los pulmones, dando como resultado una semivida metabólica de menos de un minuto. Tras la administración intracavernosa, los niveles de alprostadil y su metabolito principal, 15-oxo-13,14-dihidro-PGE1, están elevados en el cuerpo cavernoso. No se ha detectado alprostadil intacto en circulación periférica, y 5 los niveles encontrados del metabolito antes mencionado no están significativamente elevados. c) Datos preclínicos sobre seguridad Estudios de irritación local del pene realizados en monos a los que se les administraron dosis múltiples semanales hasta 180 días demostraron que no se producen lesiones histológicas o macroscópicas en el pene o tejidos sistémicos relacionadas con el fármaco. Ocasionalmente, se han observado lesiones transitorias asociadas al procedimiento de inyección, tanto en los grupos control como en los grupos tratados con el fármaco de estudio. Estos efectos consistieron en puntos pequeños ligeramente abultados en el lugar de la inyección, los cuales desaparecieron durante el estudio. También se produjeron algunos hematomas y hemorragias subcutáneas. Las lesiones asociadas al procedimiento de inyección fueron reversibles y se resolvieron espontáneamente. 6. DATOS FARMACÉUTICOS a) Relación de excipientes Cada ml de Caverject reconstituido contiene los siguientes excipientes: EXCIPIENTES DEL POLVO ESTÉRIL: Lactosa (diluyente) F.E. 2, 187; NFXVII p.1942 Citrato sódico (tampón pH) F.E. 2, 412; USPXXII p. 1258 Sol. de HCl 10% (ajuste de pH) F.E. 2,3; NFXVII p. 1937 Sol. de NaOH 10% (ajuste de pH) F.E. 2,677; NFXVII p. 1980 172 mg 47 mcg c.s. c.s. DISOLVENTE: Alcohol bencílico (solvente) Agua para inyección (solvente) F.E. 2, 169; USPXXII p. 1456 b) 8,4 mg c.s. Incompatibilidades 6 Caverject no está propuesto para ser administrado conjuntamente con otros productos indicados en el tratamiento de la disfunción eréctil. 7 La presencia de alcohol bencílico en el vehículo de reconstitución disminuye el grado de unión a las superficies del envase. Por ello, cuando se utiliza como reconstituyente agua bacteriostática para inyección, que contiene alcohol bencílico, el producto obtenido es más consistente. c) Período de validez Caverject 10 mcg, almacenado en el envase original y a temperatura no superior de 25ºC, caduca a los 24 meses. Caverject 20 mcg, almacenado en el envase original y a temperatura no superior de 25ºC, caduca a los 15 meses. En ambos casos la solución reconstituida debe utilizarse inmediatamente. No utilizar la solución resultante si ésta presenta turbidez, coloración o contiene partículas. d) Precauciones especiales de conservación Ver apartado de "Período de validez". e) Naturaleza y contenido del recipiente Caverject se presenta en forma de polvo liofilizado estéril envasado en un vial de 5 ml de capacidad. Se acompaña de una jeringa precargada de 2,5 ml de capacidad que contiene 1 ml de diluyente: agua bacteriostática para inyección. VIAL CON EL POLVO ESTÉRIL: Vial: Tapón: Cápsula: Vidrio Tipo I de 5 ml de capacidad que cumple los requerimientos de la Ph. Eur. para los contenedores de vidrio para preparaciones inyectables. Caucho de 13 mm con fluororrecubrimiento en superficies inferior y superior (no en la pestaña) que cumple los requerimientos de la Ph. Eur. De aluminio, con cierre flip-off. JERINGA CON EL DISOLVENTE: Cilindro de la jeringa: Vidrio sílex Tipo I que cumple los requerimientos de la Ph. Eur., en cuanto a vidrio hidrolítico de clase I. 8 Tapón del émbolo de la jeringa: Caucho butílico que cumple los requerimientos de la Ph. Eur. Varilla del émbolo de la jeringa (parte que no se encuentra en contacto con el producto): Poliestireno Protector de la boquilla de la jeringa: Caucho butílico que cumple los requerimientos de la Ph. Eur. Cierre inviolable con testigo de apertura (parte que no se encuentra en contacto con el producto): Polipropileno Luer Lock (parte que no se encuentra en contacto con el producto): Resina de copolicarbonatos. COMPONENTES ADJUNTOS: Aguja Becton Dickinson MICROLANCE 3, 27G x 1/2. Aguja Becton Dickinson MICROLANCE 3, 22G x 1 1/2. 2 toallitas impregnadas en alcohol. f) Instrucciones de uso/manipulación Procedimiento de autoinyección Dilución 1. Lave sus manos con agua y jabón. 2. Quitar el tapón de plástico del vial. 3. Limpiar el tapón de caucho del vial, utilizando una de las toallitas de alcohol adjuntas (la otra se necesitará más tarde). 4. Desenvolver la aguja de mayor tamaño (rotulada con 22G1½) manteniendo en su sitio la funda de plástico. Hacer girar la parte superior del cierre inviolable blanco mediante la rotura del sello. Retirar el tapón de goma. Colocar la aguja en la jeringa, haciéndola girar hacia el cuello de la jeringa. 5. Pinchar la aguja a través de la porción central del tapón de caucho del vial e introducir en él la totalidad del disolvente. 9 6. Manipular cuidadosamente la jeringa y el vial como unidad, agitar hasta que el polvo se disuelva completamente. Extracción de la medicación 7. Para extraer la medicación, poner el vial con la jeringa pinchada en posición invertida. Extraer lentamente el émbolo de la jeringa hasta que la solución alcance el nivel recomendado por su médico. 8. Si existen burbujas en la jeringa, darle unos golpecitos, o inyectar de nuevo la solución en el vial y extraerla otra vez lentamente. 9. Quitar la aguja y la jeringa del vial. 10. Sustituir la aguja por la de menor tamaño para realizar la autoinyección. Auto-inyección La solución se inyectará en cualquiera de las dos zonas del pene denominadas cuerpos cavernosos. Como se observa en el diagrama adjunto, los cuerpos cavernosos se encuentran a lo largo de tallo (diáfisis) del pene, uno a cada lado. Siga estas instrucciones cuidadosamente para garantizar que la medicación es inyectada correctamente. 11. Realice el procedimiento de auto-inyección sentado en posición recta o ligeramente reclinado. 12. Utilice sólo los lugares de inyección indicados en el diagrama. Cada vez que utilice Caverject, alterne las zonas de inyección: elija un lado para esta inyección y el otro lado para la próxima vez. Dentro de cada zona, el punto de inyección actual deberá cambiarse cada vez. 10 13. 14. g) Agarre la cabeza de su pene con su pulgar y su índice. Estírelo y sujételo firmemente contra su muslo de manera que no se deslice durante el procedimiento. En varones no circuncidados, el prepucio debe retirarse para garantizar la adecuada localización de la inyección. Limpie el lugar de inyección con la toallita de alcohol no utilizada. Coloque la toallita en el otro lado. 15. Sujete la jeringa con el pulgar y el índice. No ponga el pulgar sobre el émbolo. Con un movimiento continuo, introduzca la jeringa con un ángulo de 90º en el lugar de inyección según le ha indicado su médico. Evite los vasos sanguíneos visibles. 16. Ponga el pulgar sobre el émbolo y presione. Inyecte el contenido completo de la jeringa lenta y continuamente. 17. Retire la aguja de su pene y vuelva a taparla. Apriete ambos lados del pene y aplique presión con la toallita de alcohol en el lugar de inyección durante 3 minutos. Si aparece hemorragia, mantener la presión hasta que desaparezca. 18. Deseche la jeringa y la aguja apropiadamente. 19. Si tiene alguna pregunta, consulte a su médico. Nombre o razón social y domicilio permanente o sede social del titular de la autorización Pharmacia Spain, S.A. 11 Ctra. de Rubí, 90-100 08190 Sant Cugat del Vallés (Barcelona) 12 8. FECHA DE LA APROBACIÓN/REVISIÓN DE LA FICHA TÉCNICA Marzo 1998 13