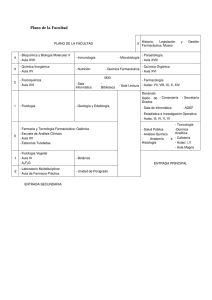
Descarga - Revista Farmespaña Industrial
Anuncio

ESPECIAL CPHI CALIDAD SALAS BLANCAS INGENIERÍA FARMACÉUTICA GUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA lifescienceslab ESPECIAL BIOSPAIN DIAGNÓSTICO POR IMAGEN INGENIERÍA DE BIOPROCESOS Estimado lector, SUMARIO Este número que tiene en sus manos es un número muy especial, ya que se trata del número con el que Farmespaña Industrial estará presente en la feria CPhI Internacional, que este año tendrá como sede a Madrid, y en Biospain, que se celebrará en Bilbao. Son, éstas, dos de las citas más importantes en sus respectivos sectores, por lo que desde Farmespaña Industrial, en calidad de media partner de ambos eventos, hemos preparado, con la dedicación habitual, contenidos específicos para ellas. Además de la cobertura de estos eventos, este número incluye la Guía de Proveedores de la Industria Farmacéutica; un listado de las empresas más relevantes del sector que, año a año crece en cantidad y en calidad, resultando su publicación uno de los eventos más esperados del año. Como es habitual, contamos también con las últimas noticias del sector, así como con las secciones dedicadas a AEPIMIFA y a ISPE España, en las que damos cobertura a las últimas jornadas y eventos organizados por las asociaciones. En el apartado de artículos técnicos tocaremos temas relacionados con calidad, salas blancas, ingeniería farmacéutica. El suplemento Life Sciences Lab, lo hemos dedicado a Biospain, Reunión Internacional de Biotecnología, que celebra en Bilbao su 6ª edición, demostrando la fortaleza del sector. Además, hemos incluido dos artículos relacionados con el área de la biotecnología; uno sobre ingeniería de bioprocesos y otro sobre diagnóstico por imagen que, seguro resultarán de interés para el lector. Esperamos, convencidos, que los contenidos de esta edición resulten de su agrado y nos ponemos en marcha, ya mismo, para la preparación de la próxima. Bienvenidos a Farmespaña Industrial EN PORTADA GRIFOLS ENGINEERING Can Guasch, 2 08150 Parets del Vallés, Barcelona Tel: + 34 935 710 868 Fax: + 34 935 710 393 www.grifolsengineering.com EMPRESAS, EQUIPAMIENTOS Y SERVICIOS AEPIMIFA CALIDAD ISPE SALAS BLANCAS INGENIERÍA FARMACÉUTICA ESPECIAL CPHI lifescienceslab SECTOR ESPECIAL BIOSPAIN INGENIERÍA DE BIOPROCESOS DIAGNÓSTICO POR IMAGEN GUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA GUÍA DE SERVICIOS FARMESPAÑA INDUSTRIAL no se hace responsable de las opiniones emitidas por los autores, colaboradores y anunciantes, cuyos trabajos publicamos, sin que esto implique necesariamente compartir sus opiniones. Queda prohibida la reproducción parcial o total de los originales publicados sin autorización expresa por escrito. ISSN-1699-4205 DL: M-15766-2005 Editor: Eugenio Pérez de Lema Departamento Internacional: Andrew Callaway · [email protected] Coordinación: Gisela Bühl Representación en EEUU y Canadá: Leslie Hallanan · Avani Media, Inc. 80 Liberty Ship Way, Suite 25 Sausalito, CA 94965 - USA Director Financiero: Carlos Fernández Redacción: Dr. Alejandro Gesteira Tel. + 34 986 19 04 88 [email protected] Consejo Asesor: D. Rafael Gª Gutiérrez, Director General de ANEFP (Asoc. Nacional de Especialidades Farmacéuticas Publicitarias). Director Comercial: Marcos Muiños Tel. + 34 986 19 12 93 [email protected] D. Antonio de la Sotilla, Director Gral. Vestilab S.A. Publicidad: Fernanda Docampo Tel: + 34 916308591 [email protected] Mª Teresa Martín Tel: + 34 91 302 53 00. [email protected] Diseño y maquetación: Pablo Bañeres 6 10 14 18 20 24 28 29 30 32 34 38 43 114 D. Sergi Roura, Director Gral. Grifols. D. Rogelio Pardo, Director Gerente Madrid NETWORK BIOCLUSTER. D. Ferrán Raboso, Director Gral. F. Raboso Consulting. D. Eduardo Gaspar, Director ADF Tecnogen. y Circagen y miembro de BioMadrid. D. Eduardo Sanz, Senior Advisor. D. Aser Alonso Responsable de Ingeniería de Proceso de Alcon España. Edita: OMNIMEDIA S.L. · C/ Rosa de Lima 1 bis. Edificio Alba, oficina 104 28290 Las Matas (Madrid) · Tel: 902 36 46 99 · Fax: 91 630 85 95 [email protected] · www.grupo-omnimedia.com Farmespaña Industrial es miembro de la Asociación Española de Editoriales de Publicaciones Periódicas, que a su vez es miembro de FIPP. NOTICIASEMPRESASEQUIPAMIENTOSSERVICIOS SX-200-PP, Monobloc compacto para el llenado y cerrado de viales La máquina que le presentamos es una combinación de llenadora y/o cerradora de sobremesa, para trabajar viales cilíndricos en vidrio, plástico o bien metal, para el acondicionado automático de todo tipo de productos líquidos, semi-líquidos o en polvo, en zona estéril o sala limpia. Para producciones de hasta 3.600 unidades por hora. Volúmenes de dosificación desde 0,1 hasta 250 mL. Su diseño ha sido realizado conforme a las normas GMP y de la US-FDA en especial correspondencia con las exigencias de la industria farmacéutica, biotecnológica, cosmética, química e industrias afines. La estación de llenado está equipada con una bomba peristáltica SpeedFill para productos líquidos o con un dosificador volumétrico para productos semi-líquidos o en polvo. Los programas de llenado son almacenados y pueden ser llamados de nuevo desde el panel de mandos. Parámetros como el volumen a dosificar o la cinemática del proceso de llenado son almacenados en la memoria del sistema. El usuario puede crear nuevos programas de llenado de forma rápida y sencilla. La estación de pick & place coloca el obturador a su justa altura sobre el vial, según sea obturador para inyectable o para liofilizado. La manipulación de los obturadores se realiza por vacío. La estación de cerrado está equipada con un cabezal de crimpado neumático, con el cual se consigue la mínima generación de partículas durante el proceso de cerrado. Todos los cierres de uso corriente pueden ser tratados sin problemas, tales como: UÊ Obturadores de goma. UÊ Obturadores para liofilizado. UÊ Cápsulas de aluminio / Flip-off. Para productos que se deban liofilizar, existe la posibilidad de dividir en dos máquinas independientes los procesos de: UÊ Llenado y pre-colocación de obturadores de goma para liofilizado, en zona estéril. UÊ Colocación de cápsulas de aluminio y cerrado de viales, en sala limpia. La alimentación de los diferentes tipos de cierres se lleva a cabo automáticamente mediante alimentadores vibradores, construidos en acero inoxidable AISI-316L. El cambio de formato se realiza de manera sencilla, rápida y sin herramientas mediante el cambio del juego de piezas de formato al completo. La adaptación a las diferentes alturas de viales se efectúa por estaciones mediante indicadores de posición digitales. La máquina es adecuada tanto para lotes de ensayos clínicos como para extensos lotes de producción. Equipamientos opcionales: UÊ Sistema de boquilla sumergida. UÊ Sistema de llenado por peso, mediante balanza. UÊ Gaseado antes, durante o después del proceso de llenado. UÊ Expulsión de viales con defectos de proceso. UÊ Software para la documentación de todos los datos relevantes de la producción. UÊ Flujo laminar / RABs / Equipo aislador. UÊ Validación IQ / OQ. UÊ Impresión / Codificación. EMTE Cleanroom Technology finaliza las instalaciones de la nueva planta de B.Braun en Rubí EMTE Cleanroom Technolog ha finalizado las obras de la nueva planta LIFT (Lean Infusion Factory Technology) de sueros de B.Braun ubicada en Rubí (Barcelona). 6 JULIO/AGOSTO12 El proyecto comprende la instalación de tratamiento de aire en clase C y D con 20 climatizadores, producción de frío 5 Mw, redes de tuberías, instalación de control automático BMS, refrigeración de proceso 13 Mw (torres de agua) y arquitectura de salas limpias (paneles, puertas, SAS, falso techo). El nuevo edificio tiene una superficie total edificada de 40.370 m² y representa un aumento sustancial de la capacidad productiva de soluciones parenterales, así como la implementación de un alto nivel de automatización. EMTE Cleanroom Technology es especialista en ingeniería e instalación de salas limpias desde hace 30 años y cuenta con más de 200 referencias. Pertenece a la unidad de negocio de instalaciones mecánicas del grupo COMSA EMTE presente en 18 países, con una facturación de más de 2.000 millones de euros y una plantilla de 12.000 profesionales. FARMESPAÑA INDUSTRIAL Merck Millipore presenta un nuevo software exclusivo para sus sistemas de purificación de agua: Millitrack® Compliance Merck Millipore, la división de Ciencias de la vida de Merck, ha anunciado hoy la introducción de Millitrack® Compliance, una nueva solución electrónica diseñada para permitir el cumplimiento normativo de los usuarios de sistemas de purificación de agua de laboratorio. Este exclusivo software, completamente integrado en el sistema de purificación de agua, ha sido desarrollado especialmente para los laboratorios farmacéuticos y biotecnológicos que sigan las normativas GxP (GLP, GCP ó cGMP - regulaciones de la Food and Drug Administration [FDA] norteamericana) y a los que se exija el cumplimiento de las directrices de la FDA, Título 21 CFR Parte 11, o requisitos similares establecidos por otras organizaciones normativas mundiales. “La activación de Millitrack® Compliance permitirá el cumplimiento completo de las directrices de la norma 21 CFR Parte 11 sobre la conservación de los registros, la firma electrónica y los criterios de auditoría de la purificación de agua MilliQ®,” explica el director de producto de servicio y validación, Eric Beguec. “El software tiene una interfaz gráfica fácil de usar que proporciona al personal del laboratorio información clave del sistema de purificación de agua, ya sea a través de una conexión punto a punto entre ordenadores o una conexión directa a la red utilizando el protocolo TCP/IP de Ethernet. Para una flexibilidad incluso mayor, los usuarios pueden también controlar las operaciones del sistema de purificación de agua en cualquier momento a través de cualquier navegador de Internet”, añade. Según indica Jean-François FARMESPAÑA INDUSTRIAL Pilette, director de producto, “La unidad de negocio Lab Water ya había reconocido desde antes la exigencia de nuestros clientes de tener acceso a una plataforma de gestión de datos electrónicos que cumpla la norma 21 CFR Parte 11”. Y, añade, “diseñamos Millitrack® Compliance para facilitar el cumplimiento de los sistemas de purificación de agua para laboratorio a aquellos de nuestros clientes que trabajan en entornos regulados.” Millitrack® Compliance ofrece a los usuarios cuatro beneficios clave importantes: UÊ Control completo del sistema - El panel de control dinámico, en tiempo real, exhibe información esencial de un vistazo - Componentes del sistema y datos esenciales visibles con un solo clic. UÊ Pista de auditoría - Pista de auditoría con fecha y hora marcadas para una trazabilidad completa de los acontecimientos diarios del sistema de purificación de agua - Conservación de los registros de hasta un año; proceso de archivado protegido UÊ Firma electrónica - Los registros de calidad de agua se guardan y firman electrónicamente - Firma y registro permanentemente ligados para evitar falsificaciones UÊ Gestión de cuentas - Un administrador supervisa el uso del sistema, protegiendo información crucial - Los papeles de director, operario y servicio técnico vienen determinados por las necesidades de acceso JULIO/AGOSTO12 7 NOTICIASEMPRESASEQUIPAMIENTOSSERVICIOS Vestilab Clean Room Control presenta ScrubCLEAN®, una esponja abrasiva especialmente diseñada para la limpieza de los residuos endurecidos en superficies susceptibles de rayarse A diferencia de los raspadores habituales que se basan en fibras recubiertas o polvos abrasivos revestidos, las esponjas abrasivas ScrubCLEAN® se construyen a partir de partículas de plástico que se adhieren a la esponja mediante un polímero de poliuretano. Son ideales para aplicaciones donde resulta crítico reducir las partículas y fibras generadas por los productos de limpieza industriales. Aplicaciones y ventajas: UÊ Revestimiento exclusivo que permite fregar y reducir al mínimo la generación de partículas de la superficie abrasiva por lo que es la elección óptima para jaraberas, bioreacto- res, liofilizadores, reactores, estufas, mezcladoras, líneas de llenado, etc... UÊ Totalmente autoclavable para la limpieza de equipamiento de zona estéril. UÊ La superficie abrasiva de plástico resulta ideal para la limpieza de superficies sensibles a los arañazos tales como vidrio, plástico, aluminio anodizado, aceros pulido espejo y electropulidos, reactores recubiertos de vidrio, lexan, etc. UÊ Bajo contenido de metales, sodio y sales. UÊ Tamaño 62.5 x 87.5 x 18 mm. Disponible en dos texturas: UÊ Reutilizables y altamente resistentes al desgaste. VESTILAB CRC cerró su participación en Achema 2012, Frankfurt con gran éxito Vestilab CRC participó el mes pasado en la Feria Internacional ACHEMA 2012, el evento del Sector Farmacéutico y Químico más importante a nivel mundial. Gracias a una excelente ubicación de nuestro stand en el Hall dedicado al equipamiento para procesos estériles se presentó un flujo de visitantes constante, diverso y de gran calidad Achema supone una oportunidad excelente para que nuestros clientes a nivel global conozcan los avances y mejoras en nuestro programa de productos. Igualmente han podido contrastar la excelente calidad del Vestuario de Sala Blanca confeccionado por Vestilab en nuestros talleres de Sant Quirze del Vallès. Como parte de su proceso de internacionalización, Vestilab CRC presentó por primera vez en Achema el rango completo de productos para “Control Total de La Contaminación” dirigidos al sector Biofarmacéutico y Electrónico. El gran interés mostrado por las empresas del sector a nivel europeo nos permite tener unas perspectivas muy optimistas. Con más de 30 años de experiencia aportando una solución global al Control de la Contaminación en Salas Blancas y Estériles, Vestilab CRC presentó su programa de productos: Vestuario de Sala Blanca y Laboral, Ultralimpieza y Desinfección, Mobiliario de Acero Inoxidable, Equipamiento de Salas Blancas, etc. De especial interés ha resultado el Kit para tratamiento 8 JULIO/AGOSTO12 anticorrosión del Acero Inoxidable. Personal técnico del fabricante Foamtec (USA) realizó demostraciones sobre el uso del “Sahara Corrosion Kit” y formación a personal técnicos de varios laboratorios. Se confirmó que el equipo para control de partículas en el Vestuario de Sala Blanca Helmke Drum exhibido resulta de gran interés en los planes de validación de procesos de lavado y descontaminación de Vestuario de Sala Blanca reutilizable y para el control del Vestuario de un solo uso. Una vez más el aparato dosificador de desinfectante de manos Handy Clean constituyó uno de los elementos de mayor interés para los clientes. En Achema se presentó el nuevo sistema de control de nivel mediante sensores ópticos que permite trabajar con un amplio rango soluciones desinfectantes. Siguiendo la filosofía de comportamiento habitual de Vestilab CRC, el equipo Técnico Comercial dedicó una total atención a los visitantes con una exposición técnica clara de los productos, añadiendo un espíritu didáctico. Gracias a nuestra filosofía de servicio, hemos logrado consolidar una base de clientes muy fieles alrededor del mundo. Nuestra actividad actual comprende además de Europa, América del Sur, Norte de África, India y el resto de Asia. La presencia en el stand de los distribuidores de varios países ayudó a reforzar el contacto con nuestros clientes internacionales. FARMESPAÑA INDUSTRIAL Premio ICIL a la Excelencia para el almacén de Fedefarma, automatizado por SSI SCHAEFER La Fundación ICIL entregó el jueves 24 de mayo en Barcelona los Premios ICIL a la Excelencia y galardonó a Fedefarma por la logística de distribución de su instalación con un nivel de automatización especialmente elevado. Los premios ICIL constituyen un reconocimiento a las empresas, entidades y profesionales que innovan en el ámbito logístico e implantan soluciones de mejora en las organizaciones. Fedefarma recibió el premio por haber invertido 25 millones de Euros, 11 de los cuales en robotización, para implantar un almacén especialmente orientado al futuro que marca un hito y constituye un referente para el sector, gracias a la incorporación de las últimas tecnologías de SSI SCHAEFER. La instalación, dotada de transelevadores miniload para la entrada y reposición automática de mercancía, así como de la más moderna técnica de transporte y los robots y sistemas de preparación de pedidos de alto rendimiento más avanzados, se completa con la integración de un sistema de gestión de almacén desarrollado y suministrado por SSI SCHAEFER que controla desde la recepción de mercancía de laboratorio, la entrada de mercancía de almacén al stock, la reposición automática con control de seguimiento de lote, la completa preparación de pedidos, hasta la clasificación por rutas de envío a clientes, incluyendo un control de calidad exhaustivo, garantizando todo ello procesos optimizados en toda la cadena logística. Además de la planificación, montaje y puesta en marcha del sistema automático de preparación de pedidos y del SGA, SSI SCHAEFER ha equipado el almacén con las estanterías miniload, estanterías de paletización, estanterías dinámicas, de paneles así como todas las cajas del almacén miniload y del Schaefer Carousel System (SCS). La nueva logística de distribución de la instalación de Fedefarma, de casi 8.000 m2, es capaz de almacenar 40.000 referencias y atender 125.000 líneas diarias con sólo 55 operarios, además de suministrar a su red farmacéutica 4 veces por día. FARMESPAÑA INDUSTRIAL JULIO/AGOSTO12 9 AEPIMIFA Jornada de puertas abiertas: Visita a Sika E l pasado 12 de Julio, Sika realizó en coordinación con AEPIMIFA, a la que pertenece como socio protector, una jornada de puertas abiertas, incluyendo en el programa una visión global de la compañía desde el punto de vista de la investigación y desarrollo, así como un análisis de las propuestas técnicas con materiales con un claro enfoque a los revestimientos interiores de las salas limpias o blancas y en cubiertas , mostrando ejemplos en las propias instalaciones de cubiertas frías como solución a la sostenibilidad de las naves industriales. La construcción de edificios en el sector farmacéutico o, en general, el sector de las Ciencias de la Vida, es una de las más exigentes, tanto desde el punto de vista de los controles y requisitos de calidad en la producción y del producto final como desde el p unto de vista de la protección y la seguridad del consumidor. La técnica ha evolucionado, acompaña a los cambios y Sika está a la vanguardia. Sika, como fabricante de productos para revestimientos interiores de salas limpias o blancas, ofrece una gama adaptada al sector; innovando permanentemente. Los certificados (CSM) disponibles y de aplicación en salas limpias/ blancas acompañan a los requerimientos solicitados por los técnicos/ingenieros, ayudando a definir las soluciones en función de la criticidad del proceso industrial. Asimismo, pensando en las personas tanto de las empresas aplicadoras como de los usuarios de las instalaciones, se incorporan otros sellos o certificaciones como el AgBB , en los que se determinan todas las emisiones posibles de los productos aplicados en cualquier trabajo , sirviendo como referencia para el objetivo de fabricar materiales para la construcción con emisiones “cero”. Como colofón a una jornada eminentemente técnica, se incluyó en el programa una visita a la factoría donde se mostraron las últimas modificaciones en los procesos de la planta, que incluyeron los nuevos sistemas robotizados. Luis Carlos González Garrudo 10 JULIO/AGOSTO12 FARMESPAÑA INDUSTRIAL Gestión de costes El pasado día 21 de Junio y organizado por AEPIMIFA ha tenido lugar el seminario "Cálculo del Coste Industrial en las Empresas Farmacéuticas", impartido por el consultor experto en la materia Gonzalo Viloria. Cada vez más, se pide a los responsables o técnicos del sector farmacéutico que trabajan en fabricas, almacenes…, conocimientos o nociones de control de gestión. Es por este motivo, y para dar un mejor servicio a sus asociados, que AEPIMIFA El conocimiento de los costes de producción, ya se trate de productos o servicios o de cualquier otra forma de actividad (proyectos, sistemas, etc…), ha sido siempre una necesidad de la gestión empresarial, por diversas razones: UÊ Definición de la estrategia empresarial, a partir de las condiciones competitivas del sector UÊ Toma de decisiones relacionadas con la producción, como, por ejemplo, producir o subcontratar; aceptar o no un pedido; dejar o no de fabricar un producto UÊ Conocimiento de los márgenes de cada producto/servicio UÊ Fijación de la política de precios dentro del plan de marketing UÊ Conocimiento de índices de productividad y rendimiento de los factores productivos, mano de obra y materias primas especialmente. Esta necesidad de conocimiento de los costes se acentúa en tiempos como los actuales, de crisis y de incertidumbre, en que las ventas caen, se reducen los márgenes, baja la rentabilidad, etc. En estas circunstancias, el control de gastos y el manejo de los costes se convierten en herramientas imprescindibles para alcanzar unos resultados mínimamente satisfactorios e, incluso, para la supervivencia de la empresa. Para afrontar esta situación, las empresas deben conocer las distintas posibilidades y técnicas de cálculo y gestión de costes: UÊ Coste directos versus coste total UÊ Coste histórico versus coste estándar UÊ Coste basado en volumen versus coste basado en actividades Con este conocimiento se podrá elegir, de acuerdo con su estrategia competitiva y las características económicas y productivas de su modelo de negocio, el sistema más conveniente de gestión de costes. Obviamente, a esta situación general no escapa la industria farmacéutica, razón por la cual, AEPIMIFA ha considerado interesante desarrollar un ciclo de formación dedicado a la gestión de costes y al control de gestión. Con el Seminario de Cálculo del Coste Industrial, enmarcado en el ciclo de Control de Gestión, AEPIMIFA ha pretendido dotar a directivos y profesionales relacionados con el sector farmacéutico, FARMESPAÑA INDUSTRIAL con un enfoque sencillo y práctico, de los conocimientos básicos sobre costes y, sobre todo, de una herramienta para el cálculo del coste industrial de un producto. El contenido del Seminario ha sido el siguiente: UÊ Nociones elementales de costes UÊ Concepto de coste y diferencia con el gasto UÊ Clases de costes UÊ Costes y estrategia competitiva UÊ Costes relevantes para la toma de decisión UÊ Análisis coste-volumen-beneficio (punto muerto) UÊ Metodología para el cálculo de los costes UÊ Proceso de cálculo de los costes UÊ Sistemas de coste total y coste directo UÊ Sistemas de costes históricos y costes estándar UÊ Sistemas de costes basados en volumen (VBC) y basados en actividad (ABC) UÊ Una aplicación en Excel, basada en un caso real del sector farmacéutico, para el cálculo del coste industrial de un producto El seminario, celebrado en las aulas de FARMACLUSTER-AICA (División Farmacéutica de la Asociación de Empresarios de Alcobendas), ha contado con la participación de un nutrido grupo de profesionales del sector y con representantes de numerosas empresas del mismo, y se ha desarrollado con un notable éxito, enmarcándose dentro del programa formativo de AEPIMIFA en la citada materia, que tendrá continuidad con futuras formaciones para mejorar los conocimientos y habilidades en temas de control de gestión en el sector farmacéutico y afines. Para AEPIMIFA, su misión consiste en el fomento del progreso de las ciencias y tecnologías relacionadas con el diseño, fabricación, suministro y uso de los equipos, sistemas y procedimientos relacionados con esta actividad; la difusión de su conocimiento y el intercambio de informaciones de interés para los profesionales del sector. JULIO/AGOSTO12 11 AEPIMIFA Jornada de AEPIMIFA en Laboratorios Ferrer y Sanofi Es hoy aún el día que recordamos con satisfacción las visitas al Centro logístico de Ferrer y a la planta de producción de Sanofi. Los bienaventurados socios que pudieron disfrutar de este evento provenían desde la producción farmacéutica como es el caso de Lilly, Abbott, MSD, Menarini, Sincrofarm, Grifols, Lacer, AC Marca, hasta los proveedores farmacéuticos como OCS Checkweighers, Quilinox, Scheneider Electric, Sika, Steris, TCM, Tecniseco y Tiselab. La jornada estuvo organizada por Susana Morales (Responsable de Packaging de Producción de Ferrer) y presentada y guiada por Manuel Poza (Jefe del Centro logístico de Ferrer). Todos compartimos las interesantes explicaciones del Sr. Manuel Poza y Sr. Joaquín Sánchez (Responsable Ingeniería de Producción de Sanofi) Una vez más AEPIMIFA establece la comunicación entre los usuarios de las plantas farmacéuticas, creando un networking de alto nivel y compartiendo las actividades cotidianas de cada uno de los asistentes. El centro logístico de los laboratorios Ferrer está situado en Sant Feliu de Buixalleu, en la comarca de La Selva (Girona). Ferrer ha invertido 20,5 millones de euros en las instalaciones, de 13.800 metros cuadrados. Esta novedosa infraestructura, inaugurada en Abril de 2011, cuenta, además, con la certificación ambiental “Leed Gold”. El grupo está centrado en la fabricación de productos farmacéuticos para las áreas terapéuticas de cardiovascular (31%), Sistema Nervioso Central (32%), dermatología (9%) y gastrointestinal (6%), entre las más destacadas, además de una línea de OTC y dermofarmacia. AEPIMIFA tuvo la oportunidad de visitar el almacén cáotico robotizado de 12.000 paletas (silo automático), las dinámicas de palets de alta reposición y un sistema de preparación de pedidos mediante picking inverso con un Miniload asociado. Este edificio centraliza las mercancías de las 4 plantas de producción que dispone el Grupo Ferrer. Y claro está que nos entró el gusanillo del hambre. Un marco incomparable nos esperaba para compartir experiencias cotidianas y debatir lo expuesto por la mañana. El restaurante la Fortaleza en Hostalric nos permitió que, durante el vermouth, los debates se hicieran eco de la actualidad farmacéutica, la situación económica nacional, las actividades cotidianas en planta y, como siempre cabe esperar, del buen sentido del humor de los presentes. El centro in12 JULIO/AGOSTO12 dustrial de Riells i Viabrea (Girona), pertenece a la división Pharma Solids -Industrial Affairs del grupo y lo integran en la actualidad más de 250 personas, con una superficie construida de 20.000 m2. Está especializado en la fabricación de formas sólidas (comprimidos y cápsulas). En 2011 se produjeron 100 millones de unidades, equivalentes a 2.879 millones de comprimidos recubiertos y cápsulas. El 78% de la producción se exporta. En 2012 se cumplen 40 años desde la inauguración de las instalaciones. Ya con el uniforme adecuado para entrar a las salas de producción, y bajo las explicaciones de Joaquín Sánchez y su equipo, los participantes disfrutaron del nuevo edificio de Fabricación (Edificio MIRA) con parada en los nuevos equipos adquiridos en los últimos 3 años: 2 recubridoras BOHLE, 1 LAF de GEA y una comprimidora F2090. Las zonas de alta producción siempre causan cierta perplejidad, como ocurrió con la visita a las nuevas salas de packaging, donde se explicaron las prestaciones técnicas tanto de las líneas IMA C90 como de las 2 líneas Uhlmann 1040. Resultó de especial interés la organización de las líneas de packaging y el trabajo realizado a nivel de Smeds para reducir los tiempos de cambio de formato y cambio de lote. Con el tiempo sobrepasado y la excitación de lo que se había aprendido llegó la hora de la despedida y citarnos para el encuentro en el próximo evento. Desde AEPIMIFA nos sentimos orgullosos de compartir las experiencias que nos hacen sentir mejores en el ámbito profesional, agradecemos a los asistentes su participación y damos la enhorabuena a los ponentes. Hasta pronto. David Alujas Vocal de la Junta de Aepimifa AEPIMIFA es una asociación con más de 170 miembros que agrupa a profesionales relacionados con la Ingeniería y el Mantenimiento de la Industria Farmacéutica, Alimentaria y Afines. En torno a AEPIMIFA se reúnen personas que hablan el mismo lenguaje y comparten opiniones e ideas. Los miembros aprenden lo que otras empresas están desarrollando en su sector y cuales son las novedades técnicas que merecen atención. AEPIMIFA quiere ser además, centro de formación donde pueden incluso, surgir oportunidades de trabajo o desarrollo profesional. FARMESPAÑA INDUSTRIAL CALIDAD Jesús Beneyto Technology Expert. Telstar Toni Manzano, Head of R+D En el inicio de este milenio, una multitud de teorías, guías y metodologías han dado lugar a una oleada de acciones que han motivado una evolución indiscutible en la industria farmacéutica. Las ICH Q8, Q9, Q10 y Q11: el hilo conductor de la Nueva Industrialización F actores como la globalización, la competitividad y las nuevas tecnologías han provocado una auténtica revolución en el seno de la industria en general y de la farmacéutica en particular. Las teorías y métodos que han guiado a la nueva concepción en la fabricación de medicamentos han establecido una serie de patrones de trabajo en las diferentes fases que intervienen. Desde la investigación hasta la distribución del fármaco, se aplican en la actualidad un sinfín de técnicas que tienden a asegurar la calidad en proceso de forma metodológica. Las ya famosas 3 ICH, acompañadas desde el año pasado por la ICH Q11, han establecido las bases para iniciar el camino que marcó la iniciativa de la FDA para revolucionar las prácticas de manufacturing. Cronología de las guías emitidas por la FDA Las directrices proporcionadas por estas guías tienen como leitmotiv el alcanzar la excelencia en la fabricación minimizando el coste. Desde un punto de vista conceptual, la clave de esta fórmula se basa en la creación y divulgación de conocimiento. A modo de resumen, las aportaciones provistas por cada una de las ICH pueden describirse de la siguiente forma: UÊ ICH Q8: El objetivo de esta guía que entró en vigor en Europa en mayo de 2006 es controlar, en tiempo real, los riesgos derivados de la variabilidad en la fabrica14 JULIO/AGOSTO12 ción desde las etapas de desarrollo. De este modo, la calidad del medicamento es verificada a lo largo de todo el proceso. La vía para su implementación pasa por incrementar el conocimiento del producto y de los procesos aplicados. Las principales herramientas conceptuales derivadas de esta ICH son el QbD (Quality by Design), la definición de Espacios de Diseño y la implementación de PAT (Process Analytical Technologies). UÊ ICH Q9: El título de esta guía es Quality Risk Management y su finalidad consiste en establecer una metodología científica para la evaluación objetiva de los riesgos de calidad asociados a las fases de desarrollo y fabricación de medicamentos. Además de proporcionar herramientas y métodos para el análisis de riesgos, también describe cómo gestionar el riesgo a través de cuatro fases: valorar, controlar, comunicar y revisar el riesgo. Herramientas como la FMEA, FMECA, FTA, y RRF entre otras, se aplican en la actualidad en multitud de entornos productivos con gran éxito. UÊ ICH Q10: Publicada en julio de 2008, esta guía define cómo implementar el sistema de calidad farmacéutica adaptándolo según las indicaciones descritas en la ISO 9001 y en las NCF. El modelo de calidad previsto por la Q10 contempla todas las fases por las que debe pasar el medicamento, incluyendo el desarrollo y la discontinuidad de éste, integrando en el Sistema de gestión de la Calidad, la gestión de riesgos y la mejora continua durante todo el ciclo de vida del producto. UÊ ICH Q11: La última de las ICH publicada en junio de 2011 centra su atención en el desarrollo y producción de principios activos, aunque la misma guía cita explícitamente que puede ser apropiada también para otros procesos, llevando a cabo las consultas apropiadas con las autoridades sanitarias competentes. Una lectura más profunda de esta guía la dota de la potencia necesaria para aplicar la Q8 y la Q9 sobre el propio sistema de calidad descrito por la Q10. De este modo, se convierte esta guía en una metodología para las propias 3 ICH. El escenario dibujado por estas guías conforma la hoja de ruta ideal para que cualquier planta farmacéutica diseñe sus procesos de forma robusta y enfocada a la mejora continua y a la excelencia operacional. Es importante resaltar que existen metodologías que permiten conducir el éxito de estas implementaciones, tanto en la gestión de procesos de nuevos medicamentos como en medicamentos ya existentes. Sin embargo, a finales del año 2009 la FDA se extrañaba de que la implementación de la QbD fuese más lenta de lo que se esperaba y llevó a cabo una serie de consultas sobre las causas de ello entre las principales Big Pharmas así como entre los mismos técnicos y científicos pertenecientes a la FDA. El informe de esta consulta se publicó en diciembre del 2009 (Understanding Challenges to Quality by Design, Final deliverable for FDA Understanding Challenges to QbD Project, December 18, 2009), con la conclusión de que existían 10 retos principales que debían superarse: 6 de ellos eran responsabilidad de la propia FDA y 4 de la industria. El cambio de concepción que impone la QbD es de tal envergadura que lógicamente requiere un esfuerzo de comprensión, empezando por los propios revisores de la Administración, recorriendo un camino junto con los técnicos y científicos de la industria. Sin embargo, los 4 retos que el informe señalaba que debían superar las industrias tienen más que ver con los clásicos temores al cambio: FARMESPAÑA INDUSTRIAL UÊ La desalineación interna (por ejemplo, la desconexión transversal entre áreas funcionales como podría ser R+D y Fabricación, o Calidad y Regulatory). UÊ Falta de creencia en el caso de negocio (oímos a menudo justificaciones como “Hay mucha incertidumbre sobre el timing y las exigencias de la inversión para la puesta en práctica QbD”). UÊ Falta de tecnología para ejecutar procesos (por ejemplo, se detecta una dificultad real en la gestión de datos y su explotación o una comprensión limitada de las implicaciones de los Atributos de Calidad Críticos). UÊ La alineación con terceros (¿cómo poner en práctica QbD con la creciente dependencia de los proveedores y fabricantes contratados) La FDA y la industria farmacéutica norteamericanas llevan una gran ventaja a las equivalentes europeas en el desarrollo e implementación de las 3 ICH + Q11 en sus productos. De hecho en España, no tenemos noticias de que la Administración haya recibido aún ningún dossier en el que se presente un proceso de PAT, aunque se están realizando muchos esfuerzos por diferentes compañías nacionales para llevar a cabo su implantación. Esta situación, aunque podría considerarse una desventaja frente a la farmacéutica americana, establece un punto de partida muy interesante para nuestra industria, puesto que se inicia desde las experiencias llevadas a cabo por empresas pioneras que ya han adquirido y publicado sus logros. De este modo, el tejido industrial farmacéutico internacional que está aplicando y utilizando las directrices dibujadas en las ICH Q8, Q9, Q10 y Q11 como reforma integral de sus procesos, está originando un referente elitista para el resto de empresas. Las sites donde se ha aplicado esta filosofía, no solamente han obtenido beneficios económicos tras su implantación, además han alcanzado un grado de excelencia que les otorga un status especial en la comunidad farmacéutica. Objetivos como lograr el Right First Time (cero defectos) y alcanzar un grado de segu- ridad absoluto del paciente sólo se consigue a través de nuevas formas de trabajo como la validación en continuo, una metodológica toma de decisiones y un sistema de calidad robusto que base su revisión en el método científico para la mejora continua. Cuando las 3 ICH son consideradas como roadmap de la actividad empresarial y se utiliza la Q11 como técnica de aseguramiento del propio sistema de calidad se obtiene la fórmula del éxito en la fabricación farmacéutica: la denominada Nueva Industrialización. Ante esta nueva realidad emergen una serie de dudas a pequeñas y medianas empresas locales que cuestionan sus propios sistemas de calidad. Aparecen dos preguntas necesarias ante este nuevo escenario: UÊ ¿Es necesario desarrollar en nuestra planta farmacéutica la avalancha de siglas (QbD, DoE, PAT, FMEA, FMECA, OPEX, PDCA, …) que han desembarcado en este nuevo milenio? La respuesta es sí. Del mismo modo que en la actualidad no se concibe la gestión de la información CALIDAD relacionada con la fabricación sin herramientas informáticas que permitan su administración, se está generalizando la idea de que para obtener éxito en la fabricación de medicamentos es condición indispensable adaptar los procesos a la nueva tecnología de operaciones enmarcada por la Nueva Industrialización. De la misma manera que la Quality by Design (QbD) podríamos designarla también como la Quality for Future, el Sistema de Calidad que diseña la Q10 ya es denominado en algunos ámbitos como la Calidad Sostenible en el mundo occidental. UÊ ¿Debe realizarse una gran inversión para la implementación en toda su extensión de las pautas deducidas a través de la Nueva Industrialización? La respuesta es no. Una óptima ejecución permite adaptar toda la potencia de esta nueva filosofía según la capacidad de cada empresa y el tipo de producción realizada. Cuando una organización decide implementar las pautas establecidas por las 3 ICH y la Q11, modifica radicalmente su idiosincrasia, derrumbándose así ideas preconcebidas que anquilosan los diferentes procedimientos bajo los que se rige. Los proyectos que introducen esta nueva concepción en un proceso de producción, siempre evita los artificios en la implantación. Precisamente la Nueva Industrialización promociona la austeridad eliminando aquellos procesos gratuitos que no aportan valor o substituyendo funciones cargadas de ineficiencia por procesos robustos donde el conocimiento se hace extensivo a lo largo de todos y cada uno de los trabajadores. Bajo este nuevo enfoque, todos los operarios se ven involucrados en tareas de contorno que circunvalan las operaciones que realizaban anteriormente. Se aporta un valor añadido que hace crecer el potencial individual y a la vez, el conocimiento global de la compañía. Por lo general, un proyecto de estas características requiere una empresa consultora externa que permita presentar los cambios necesarios a la dirección de forma objetiva. No se plantean objetivos locales como la implantación de PAT en un determinado proceso o el desarrollo de QbD para un producto específico. Un proyecto que invite a una empresa farmacéutica a participar de la Nueva Industrialización contempla de forma global la evolución que han de experimentar todos los procesos de la compañía. En la mayoría de las ocasiones, esta implementación implica un cambio estructural, el enfoque departamental 16 JULIO/AGOSTO12 queda sustituido por el enfoque a los procesos y a la eficiencia de ellos, cuyo beneficio económico cualitativo y humano queda analizado y establecido en la etapa inicial del proyecto. De esta forma, se describe un plan con todas las opciones practicables según el layout de la compañía. Sobre este mapa de opciones, se consensúan aquéllas que permiten obtener un beneficio tal que conceda la oportunidad de desplegar el resto de opciones de forma secuencial. Los objetivos son reevaluados tras el éxito de cada ejecución y el plan se adapta según el grado de avance en el proyecto. La industria farmacéutica ha anunciado una nueva revolución industrial que le permitirá ser más competitiva, más segura, más rigurosa, más ágil y más científica. No obstante no puede abordarse un cambio estratégico de toda la compañía de forma parcial o, por el contrario, aplicando cambios parciales sin considerar el objetivo global. Implementar PAT en un proceso determinado, establecer QbD en el desarrollo de un medicamento o crear un grupo OPEX, sin duda puede mejorar el funcionamiento de procesos de fabricación, pero no aportar todos los beneficios derivados de la Nueva Industrialización. En ocasiones una implementación parcial puede llegar a entrar en contradicción con una visión más estratégica de las 3 ICH, implicando un coste adicional en su reconducción tras establecer el plan global de la compañía. La implementación real de las guías ICH Q8, Q9, Q10 y Q11 requieren de la aceptación y el compromiso por parte de la dirección. Tras establecerse el plan estratégico de la compañía, deben asignarse los objetivos por fases. Las metas planteadas en cada etapa deben estar diseñadas y designadas científicamente, así como la medición de resultados. La consecución de estos dará lugar a la revisión de los objetivos planteados inicialmente. Tecnificación y Nueva Industrialización La tecnología envuelve inevitablemente todas las actividades en las que deben intervenir dispositivos que administran el material a lo largo de los diferentes procesos de fabricación. En la actualidad resulta difícil adquirir un nuevo equipo que no disponga de salida electrónica o tratamiento de datos computerizado. No obstante, el hecho de dotar a nuestra planta, línea, cabina o célula de proceso con dispositivos que dispongan de los más avanzados sistemas tecnológicos no implica necesariamente que nos encontremos en ventaja competitiva. Para que la implantación de la tecnología (prácticamente obligada por su inmersión en el mercado) revierta en un beneficio para la empresa, debe trazarse un diseño integrador que no aísle el proceso en el que se incorpora. En la mayoría de casos donde se instala un equipo con elevada capacidad tecnológica, no se contempla la interacción de la información emitida por el equipo y los subprocesos que directa o indirectamente dependen de él. Cuando no se realiza un diseño unificado de procesos donde se contemple el alcance y las posibilidades de integración e intercambio de información entre las diferentes tecnologías utilizadas, se están asumiendo dos costes inmediatos: UÊ El coste asociado a la falta de explotación de la información inter-procesos. La experiencia en el tratamiento de procesos de fabricación conduce a la necesidad de estudiar la frontera entre éstos para obtener un conocimiento añadido del material fabricado. UÊ El coste que supone en un futuro, modificar la infraestructura implementada para desarrollar el diseño que debiera haberse realizado. De aquí se deduce que es completamente necesario establecer un diseño previo, donde las posibilidades tecnológicas de los dispositivos que se incorporen en las líneas de fabricación provean todo el beneficio que son capaces de generar. La ICH Q8 describe perfectamente cómo debe procederse para que la adquisición de nuevos dispositivos o la utilización de los equipos actuales contemplen el máximo beneficio para la planta. Un diseño adecuado (tal y como se describe en la ICH Q8), un análisis de riesgo acertado para asegurar el alcance de la integración y un buen plan de mejora continua determinará el éxito del proyecto, implementándose una célula eficiente de producción. Bibliografia UÊÊStatus and Implementation of ICH Q8, Q9, and Q10 Quality Guidelines. Pharmaceutical Science and Clinical Pharmacology Advisory Committee Meeting. August 2009 UÊÊRevised Draft Guidance, Department of Health and Human Services, US Food and Drug Administration, December 2004 UÊÊUS FDA, “Pharmaceutical cGMPs for the 21st Century: A Risk-based approach. Final report”. September 2004. UÊÊICH Q8, “Pharmaceutical Development”. November 2005. UÊÊICH Q9, “Risk Management”. November 2005. UÊÊICH Q10, “Pharmaceutical Quality Systems”, Step 3. May 2007. UÊÊFDA, Guidance for Industry PAT – A Framework for Innovative Pharmaceutical Development, Manufacturing and Quality Assurance (FDA, Rockville, MD, September 2004). FARMESPAÑA INDUSTRIAL ISPE Celebradas las Jornadas Técnicas de Calidad ISPE España El evento se desarrolló con notable éxito a nivel de contenidos y asistentes tanto en la edición de Barcelona como en la de Madrid, con lo que se subraya el interés que despierta este tema entre los socios de ISPE España. L os días 10 y 12 de Julio se celebraron, en Barcelona y Madrid respectivamente, las Jornadas técnicas que ha organizado ISPE España, enfocadas a la gestión y control de calidad para la industria farmacéutica. El evento resultó un éxito en ambas ediciones; la de Barcelona contó con 47 asistentes y la de Madrid con 43. El programa fue dividido en dos partes. En la primera, tras el acto de apertura de la Jornada y una breve introducción sobre ISPE, sus funciones y actividades, tuvo lugar la ponencia a cargo de Alicia Tébar de dTC, titulada “Proyecto colaborativo de ISPE España para la aplicación de Sistemas de Calidad por Diseño”. En ella se definió el objetivo de este proyecto, estimular a la industria farmacéutica en la aplicación de QbD para el desarrollo de nuevos productos, así como en la actualización de los ya existentes, a través de la colaboración con la industria y la administración sanitaria. Durante la ponencia, se establecieron los beneficios de la aplicación del QbD para los fabricantes, se analizó el papel de las agencias reguladoras y las asociaciones profesionales con especial hincapié en la Iniciativa ISPE España en QbD. La segunda ponencia, “QbD & PAT A view from the playing field”, a cargo de Prof. Dr. Jose C. Menezes QbD & PAT Key Researcher en RCPE (Graz, Austria) y CEO de 4tune Engineering. Experto en quimiometría, análisis multivariable de datos MVDA y control estadístico multivariable de procesos MSPC. El Dr. Menezes profundizó de un modo didáctico y apto para no 18 JULIO/AGOSTO12 iniciados, en el área de la quimiometría. En su ponencia se relató el estado actual del contexto regulatorio, la situación de la industria analizando y destacando cuales son los pasos y las aplicaciones a tener en cuenta en desarrollo y en producción farmacéutica. El Dr. Menezes puso especial énfasis en las aplicaciones en “la vida real” de los conceptos expuestos. Tras esta ponencia, Doña Carmen Mª Capón - Jefe de Sistemas de Calidad de la planta de Pfizer en San Sebastián de los Reyes (Madrid) expuso un interesante caso práctico de aplicación de la verificación en continuo a la cualificación de una planta de agua, dónde explicó la experiencia de Pfizer durante la ejecución de un proyecto piloto de cualificación de una planta de agua en San Sebastián de los Reyes. Se dio una visión amplia la estrategia de verificación de calidad empleada y se explicó en qué consistieron los cambios del tradicional comisionado y cualificación al nuevo esquema, cómo se estableció el equipo de trabajo, qué implicaciones tuvo la aplicación de las GEP (Good Engineering Practices) a nivel de la aprobación de los documentos, qué impacto tuvo en el volumen de la información generada y como se valoró para este proyecto y para los futuros y cómo influye esto en la validación del proceso. Tras la pausa para el café, comenzó la segunda parte de la jornada, con el segundo caso práctico: Implantación de QbD y PAT en la producción real, ponencia a cargo del Dr. Antonio Peinado Senior Process Analytics Expert en Novartis Basilea. En ella se dieron ejemplos del uso de tecnología de proceso PAT en diferentes operaciones básicas durante el proceso de fabricación de substancias activas y preparados farmacéuticos, resultando de gran interés la parte dedicada a los obstáculos que han debido sortearse para su adecuada implementación y en los beneficios actuales que la planta ha obtenido de su uso. Finalizado este caso práctico, se dio comienzo a una mesa redonda moderada por Alicia Tébar de dTC y Francesc Garrido de CSV Experts. Tras esta puesta en común para compartir información e intercambiar opiniones se finalizó la jornada y se despidió a los asistentes emplazándolos a próximas convocatorias aún por confirmar. FARMESPAÑA INDUSTRIAL SALAS BLANCAS José Luis Jiménez Álvarez Gerente TCI, S.L.L. En el siguiente artículo se repasan los parámetros críticos a controlar durante las etapas de diseño de instalaciones HVAC para zonas estériles, con especial hincapié en los sistemas de filtración y gestión de flujo de aire Criterios de diseño de instalaciones HVAC para zonas estériles Fuentes de contaminación de partículas y requerimientos de limpieza del aire Cuando hablamos de contaminación en el entorno de una sala limpia, ésta puede ser debida a partículas, microorganismos y endotoxinas. Podemos diferenciar dos diferentes tipos de fuentes de entrada de contaminación a la instalación: fuentes internas y fuentes externas. Las fuentes internas son aquellas que se originan dentro de la propia instalación. Las posibles fuentes internas son las siguientes: UÊ El sistema HVAC UÊ El proceso y las operaciones de fabricación UÊ Los operadores (normalmente la mayor fuente de contaminación) UÊ La introducción de materiales y equipos UÊ La introducción de la materia prima y el material en proceso UÊ Las áreas adyacentes de menor clasificación Las fuentes externas son debidas a la introducción de aire fresco desde el exterior de la instalación. Las concentraciones de partículas en el aire exterior varían con la ubicación geográfica de la instalación. El sistema HVAC, acompañado siempre por un adecuado mantenimiento de la instalación, es el encargado de eliminar esta fuente de contaminación. Es decir, mediante un correcto diseño de los caudales de aire y de las etapas de filtración. En la tabla 1, se muestran los requerimientos de concentración de partículas en 20 JULIO/AGOSTO12 Tabla 1. Requerimientos concentración partículas en el aire el aire para las normas EU GMP Mar. 2009 y EN ISO 14644-1. Parámetros críticos medioambientales Los siguientes parámetros medioambientales, usualmente son considerados como críticos en instalaciones de fabricación estériles: UÊ Parámetros específicos de cada producto UÊ Condiciones medioambientales (tabla 1) UÊ Flujos unidireccionales y su velocidad en áreas críticas UÊ Patrones de flujo del aire adecuados UÊ Temperatura UÊ Humedad UÊ Presión diferencial entre locales UÊ Recirculaciones del aire en sala por hora UÊ Tiempo de recuperación de la clasificación UÊ Niveles de ruido excesivos Los valores adecuados de temperatura y humedad pueden ser determinados, bien por requerimientos específicos del producto, o bien por la necesidad de aumentar el grado de confort del operario, ya que en caso contrario, esto nos puede llevar a aumentar la carga microbiológica y de partículas producida por los operarios. Cascadas de presiones y presión diferencial entre locales La primera fase del proceso de diseño de la instalación es identificar las áreas críticas. Por ejemplo, estas pueden ser: UÊ Zonas de llenado UÊ Entrada de viales en salas de llenado UÊ Zonas de acceso a autoclaves, liofilizadores,… UÊ Zonas de conexión a reactores de fabricación y almacenamiento UÊ Zonas de conexión a filtros esterilizantes Una vez que se han identificados estas zonas, las cascadas de presiones deben implementarse para cumplir el siguiente criterio: ZONA CRITICA AFONDO SALA ESTERIL A ZONAS PRODUCCION NO ESTERILES A EXTERIOR Es decir, la integridad medioambiental de los diferentes entornos, se mantiene mediante una cascada de presiones desde clasificaciones de salas más restrictivas a menos, o dicho de otra manera, el aire “sucio” FARMESPAÑA INDUSTRIAL no debe contaminar el aire “más limpio”. En la industria se suelen aceptar como valores de la diferencia de presión entre salas el entorno de 10 a 15Pa. Siendo un valor óptimo de diseño 12,5Pa y pudiéndose reducir a 10Pa el valor de la diferencia de presión para salas de igual clasificación. Es necesario contar con herramientas que nos permitan evaluar el caudal de aire que fuga desde las zonas más limpias a las áreas adyacentes. Estas fugas se producen fundamentalmente a través de las puertas entre los diferentes locales. Para ello, aplicando la ecuación de Bernouilli entre dos salas a diferente presión, conectadas por una o varias puertas, tenemos: Donde: P0: es la presión de la sala más limpia P1: es la presión en la sala adyacente l: es la densidad del aire v: es la velocidad del aire en el área de fugas A partir de la velocidad del aire en el área de fugas, A, podemos obtener el caudal de aire de fuga, Q, a partir de la siguiente expresión: FARMESPAÑA INDUSTRIAL Es decir, LA INTEGRIDAD MEDIOAMBIENTAL DE LOS DIFERENTES ENTORNOS, SE MANTIENE MEDIANTE UNA CASCADA DE PRESIONES DESDE CLASIFICACIONES DE SALAS MÁS En la expresión anterior no hemos tenido en cuenta la disminución de la velocidad de las fugas debida a las perdidas por fricción y por la contracción de la vena fluida a la salida. Esto se tiene en cuenta mediante los coeficientes de viscosidad Cv y de contracción Cc. Estos dos coeficientes se agrupan en el coeficiente de descarga Cd = CvCc, este coeficiente tiene un valor de 0,62 para salida con borde afilado, 1 para salida con borde redondeado y 0,81 para tramo corto de separación entre salas (el caso más usual). Entonces podemos expresar el caudal como: Ecuación que nos permite obtener el caudal de aire de fuga entre salas conocida la diferencia de presión y el área por el que se RESTRICTIVAS A MENOS. EL AIRE “SUCIO” NO DEBE CONTAMINAR EL AIRE “LIMPIO” producen las fugas. Por ejemplo, para una puerta simple de 800x2000mm de luz, con una diferencia de presiones de 15Pa, obtenemos un caudal de fuga de unos 150m3/h. Etapas de filtración de aire Es una práctica común en instalaciones de producción estériles recircular aire procedente de las salas. Se trata de una buena práctica, siempre y cuando la zonificación de los climatizadores en la instalación se realice correctamente, es decir, cuando existan climatizadores independientes para cada zona de uso, grado de limpieza y que fabriquen simultáneamente diferentes productos. Por ejemplo, no se debe incluir en el mismo climatizador la zona de llenado estéril y la zona de pesadas. JULIO/AGOSTO12 21 SALAS BLANCAS En las instalaciones HVAC para zonas estériles se recomienda instalar las siguientes etapas de filtración: UÊ Filtro HEPA H-14 terminal en la sala estéril UÊ Filtro de bolsas F-9 (opcionalmente con una etapa posterior H-10 para aumentar la vida de los filtros terminales) a la salida del climatizador UÊ Filtro grueso G-4 (opcionalmente con una segunda etapa F-5 para aumentar la vida del filtro de bolsas) en la entrada del aire exterior UÊ Opcionalmente filtro HEPA H-14 en el retorno si el producto es de alta actividad o el mismo climatizador alimenta a dos zonas estériles que fabrican productos diferentes Patrones de flujo de aire, cálculo de caudales de aire El flujo de aire en una sala limpia se puede describir por el tipo de modelo empleado. La selección de una configuración de flujo de aire debe basarse en los requisitos de limpieza y en la disposición de los equipos del proceso. La configuración del flujo de aire en una sala limpia puede ser unidireccional, no unidireccional o mixta. La configuración del flujo de aire en una sala limpia grado A, o más limpia (por ejemplo salas de microelectrónica ISO 3) es típicamente unidireccional, en tanto que en salas limpias grado B, o menos limpias se utiliza un flujo de aire no unidireccional o mixto. En salas estériles con flujo no unidireccional, teniendo en cuenta que es necesario que la filtración HEPA sea terminal, es muy importante ubicar correctamente las impulsiones y retornos de aire en sala, siendo imprescindible que los retornos de aire se realicen a baja cota. En la figura 1 se muestran diferentes criterios de ubicación de retornos en sala. En caso de que se conozca la proporción de contaminantes generada en la sala limpia, para aire bien mezclado y en el supuesto de que no existan infiltraciones, ya que la sala está presurizada, la concentración de partículas sigue la ecuación de conservación de la masa 22 JULIO/AGOSTO12 TEMPERATURA Y HUMEDAD PUEDEN SER DETERMINADOS, BIEN POR REQUERIMIENTOS ESPECÍFICOS DEL PRODUCTO, O BIEN POR LA NECESIDAD DE AUMENTAR EL GRADO DE CONFORT DEL OPERARIO, YA QUE EN CASO CONTRARIO, ESTO NOS PUEDE LLEVAR A AUMENTAR LA CARGA MICROBIOLÓGICA Y DE Dónde: C: es la concentración de partículas por m3 G: es la generación de partículas por m3 y por hora R: es el número de recirculaciones del volumen de la cámara por hora S: es la concentración de partículas por m3 en la impulsión del aire CO: es la concentración inicial de partículas por m3 en la cámara Despreciando la variación de G con el tiempo la ecuación anterior se puede resolver para dar: PARTÍCULAS PRODUCIDA POR LOS OPERARIOS restrictiva sea su clasificación. A continuación se muestra la recomendación de número de recirculaciones por hora, en función del grado de limpieza de la sala. Tabla 2. Recomendación recirculaciones/hora en sala Aplicando la ecuación anterior a nuestro caso (S despreciable debido al filtro HEPA), obtenemos: Las ecuaciones anteriores nos proporcionan por un lado el tiempo de recuperación (tiempo necesario para pasar de una clasificación a otra más limpia), y por otro la clasificación de la sala en condiciones estacionarias, es decir, Figura 1. Criterios de ubicación de rejillas de retorno en salas estériles En el flujo de aire unidireccional, la velocidad de éste es 0,45m/s ±20%; en el no unidireccional, es necesario contar con herramientas que nos permitan calcular la cantidad de flujo de aire necesaria para obtener una clasificación determinada. Establecida la clase de limpieza requerida, deben definirse los cambios de aire teniendo en cuenta las fuentes de contaminación. LOS VALORES ADECUADOS DE Las formulas anteriores se refieren a mezcla de aire perfecta, para el caso real hay que aplicar un factor corrector, que depende de la posición de las impulsiones y retornos en sala, y que varía entre 0,85 y 6. Del desarrollo anterior, se desprende, que para conseguir una determinada clasificación en sala, es necesario recircular el aire a través de un filtro HEPA un número de veces, que será tanto mayor, cuanto más Mediante los valores de la tabla 2, y diseñando los caudales de tal manera que sean capaces de combatir la carga térmica en sala, podemos calcular el caudal de aire en sala mediante la siguiente expresión: Dónde: V: es el volumen de la sala q: es la carga térmica total (sensible + latente) 6h: es la variación de entalpía entre las condiciones de impulsión del aire y las condiciones deseadas en sala. Conclusiones Después de esta presentación técnica, se hace evidente la importancia que tiene no sólo la utilización de materiales de muy buena calidad para la construcción salas estériles, sino la utilización de correctas herramientas de cálculo y diseño que garanticen la idoneidad de los parámetros críticos: limpieza del aire, presión, caudales de aire, tiempo de recuperación,… Referencias: EU GMP, Mar. 2009 EN ISO 14644, May. 1999 ISPE Baseline, SterileManufacturingFacilities, Ene. 1999 ISPE GoodPractice Guide, HVAC, 2009 FARMESPAÑA INDUSTRIAL INGENIERÍA FARMACÉUTICA Juan Dux-Santoy, Joh. Heinr. Bornemann GMBH y Sònia López Grifols Engineering, S.A.® Los sistemas de filtración de flujo tangencial (TFF) en aplicaciones sanitarias tienen cada día más cabida en una infinidad de procesos productivos, ya sea en separación, concentración, clarificación o purificación de soluciones Bombas en sistemas de filtración de flujo tangencial: un cambio en aplicaciones sanitarias. Introducción a los sistemas de filtración de flujo tangencial S e trata de una aplicación sanitaria cuando los requisitos de higiene o contaminación deben cumplir unas especificaciones muy estrictas, bien por requerimientos legales, bien por calidad o pureza final del producto. Se conoce como TFF, al método de filtración basado en vehicular un fluido a través de una tubería y a lo largo de la superficie de una membrana, donde la fuerza motriz es el perfil de presiones diferenciales que se dan en ambos lados de la misma y que se consigue mediante la ayuda de un equipo de bombeo. De esta forma se facilita el proceso de transporte del producto sobre la membrana en forma de flujo tangencial y a través de la misma, produciéndose las corrientes de filtrado y retenido que darán como resultado la separación de la parte deseada. Para obtener un mayor rendimiento del sistema de TFF se deben tener en cuenta varios factores a la hora del diseño del equipo: UÊ Producto: Valor del fluido a procesar ($/ m³, €/litro, £/cc, ¥/ml); propiedades físico-químicas (viscosidad, densidad, temperatura); Tipo de producto: (Newtoniano, dilatante, tixotrópico, sensible al corte). UÊ Proceso: Separación, concentración, diálisis, clarificación, purificación, etc. UÊ Diseño del equipo: tipo de bomba (cen24 JULIO/AGOSTO12 trífuga, desplazamiento positivo, doble tornillo helicoidal); tipo de membrana (cerámica, polietersulfona, celulosa regenerada), tuberías (pulido interior, materiales, conexiones, accesorios, etc.) El diseño del sistema TFF supone para el ingeniero una valoración de dos factores básicos que son el producto y el proceso, siendo ambos, la base para seleccionar el tipo de bomba, los materiales de construcción y las membranas a utilizar. Por ejemplo, no es comparable estabilizar un vino que purificar una solución de albúmina humana, o no se puede valorar de la misma forma concentrar un lacto-suero que clarificar una cerveza, caldo o zumo. Está claro que en los procesos sanitarios existe una “ley de mínimos” a la hora de diseñar el sistema de filtración de flujo tangencial, es decir, las membranas por ejemplo deben ser las adecuadas para el proceso en cuanto al tamaño de partícula se refiere. Por ejemplo la microfiltración se aplica para la retención de partículas de 0,1 a 10 micras, siendo la ultrafiltración un método aplicado en un rango de tamaño de molécula entre (1-1000 kD). Por otro lado, las membranas utilizadas en un sistema TFF deben seleccionarse en función de las características de colmatación y la compatibilidad química de las mismas con el propio producto a filtrar y con los productos químicos para su limpieza. En un sistema TFF, el producto se vehicula mediante presión produciéndose un barrido tangencial a lo largo de la superficie de la membrana (ver figura). Este es el hecho diferencial del mecanismo de separación de la filtración de flujo tangencial, cuya fuerza motriz es la presión transmembrana (TMP) y se define como la presión media aplicada desde la entrada en el filtro hasta el lado del filtrado del mismo. TMP = [(PE + PR)/2] – PF De donde: PE = Presión de entrada PR= Presión de retenido PF= Presión de filtrado Las partículas pequeñas que puedan pasar a través del poro de la membrana es lo que se llama el permeado o filtrado, mientras que las de mayor tamaño que no pasan a través de las membranas se conoce como retenido. Se entiende que el proceso de separación es ambivalente, es decir, el producto deseado puede obtenerse en ambos FARMESPAÑA INDUSTRIAL lados, tanto por la parte del retenido como por la parte del filtrado, dependiendo del producto final. Durante el proceso de filtración tangencial, el flujo de filtrado se incrementa a medida que se aumenta la presión transmembrana. Esto es así hasta alcanzar un cierto valor en dicha presión, ya que después se mantiene constante debido a la obturación de las membranas por un elevado flujo a través de las mismas. Este fenómeno se denomina colmatación de la membrana, siendo conveniente, llegar a un equilibrio entre el aumento de la presión y la reducción en tiempo del proceso de filtración por el aumento del flujo normal. En la filtración común también llamada filtración directa, el producto es conducido de forma normal a la superficie de la membrana, produciéndose una colmatación rápida. Por el contrario, en la filtración tangencial, el barrido de la corriente de retenido minimiza el efecto de colmatación de la superficie de filtración provocado por el propio producto, permitiendo realizar separaciones altamente eficaces, con productos de alto peso molecular, de impurezas agregadas a los mismos, aumentando el rendimiento del proceso productivo. Bombas en los sistemas de filtración de flujo tangencial Para proceder a la separación del producto que tratamos, es necesario impulsar a la membrana un cierto caudal obtenido a través de una bomba. El caudal de la bomba vendrá dado en función de las membranas instaladas y de lo que se conoce como el flujo normal a través de las mismas. Este parámetro, el más importante de la membrana, dará mayor o menor valor a la misma siendo su ecuación la siguiente: Flujo = [Volumen/(área x tiempo)] = [litros/(m² x min)] Membranas con un alto valor del flujo conllevan un buen proceso de separación, y por tanto, un alto rendimiento en el sistema de filtración de flujo tangencial. Pero este valor puede estar influenciado también por otros factores como la TMP, la temperatura, el pH del producto, la fuerza iónica de las moléculas o el ratio de la filtración tangencial. Es por ello que resulta muy conveniente, diseñar el sistema de filtración tangencial con elementos de campo (bombas, válvulas de control, controladores de presión o caudal, etc.) que permitan la regulación de la presión apliFARMESPAÑA INDUSTRIAL cada a las membranas, el caudal de flujo cruzado y el caudal de filtrado en cada etapa del proceso. Hasta la fecha, las bombas que se han instalado en sistemas de filtración de flujo tangencial han sido dotadas en sus ejes de rotación de una velocidad baja. Nunca se han superado las 300-360 rpm de velocidad de giro y ello se debe a varios factores: alta viscosidad del producto, productos sensibles a la cortadura (efecto cizalla) o alto caudal de recirculación en las bombas. Esto ha conllevado al sobredimensionado de los equipos de bombeo, y por tanto a un encarecimiento en la construcción del equipo de TFF debido a tuberías de conducción y elementos de control con mayor diámetro. La tecnología de bombeo utilizada hasta hoy, está basada en el sistema lobular y de pistón rotativo, pero a finales de la década de los noventa se empezó a comercializar el modelo sanitario de las bombas de doble tornillo helicoidal, siendo este modelo el que está desplazando por su alta eficiencia, versatilidad y robustez a los modelos de bomba de lóbulos y de pistón rotativo. Las razones de este cambio se deben a una serie de factores, cuyo valor principal radica en el hecho de su diferencia en el bombeo. Mientas que en el modelo lobular y de pistón rotativo el bombeo se produce de forma radial, en el modelo de doble tornillo helicoidal el desplazamiento positivo es axial. (Figura 2) Este cambio en el modelo de bombeo tiene como resultado un bombeo sin agitación radial, es decir, sin riesgo de centrifugado, permitiendo que el efecto de cizalla en productos sensibles al mismo desaparezca casi por completo. De esta manera se puede aumentar la velocidad en la bomba y por tanto, disminuir el tamaño de la misma comparándola con una bomba lobular o de pistón rotativo. Esta disminución de tamaño va asociada a un menor RESULTA MUY CONVENIENTE, DISEÑAR EL SISTEMA DE FILTRACIÓN TANGENCIAL CON ELEMENTOS DE CAMPO QUE PERMITAN LA REGULACIÓN DE LA PRESIÓN APLICADA A LAS MEMBRANAS, EL CAUDAL DE FLUJO CRUZADO Y EL CAUDAL DE FILTRADO EN CADA ETAPA DEL PROCESO volumen muerto del equipo, reduciendo la cantidad de solución de post-lavado para la recuperación del producto, evitando así diluciones del mismo y aumentando su rendimiento final. La inversión en la instalación será por tanto menor, reduciendo costes y amortizando el equipo en menor tiempo. Por otro lado, la recirculación de caudal interno de la bomba es mucho menor que en los equipos de bombeo radial, permitiendo así que durante la etapa de limpieza (CIP) se puedan alcanzar velocidades de valores entre 3000 a 3600 rpm. Esto origina que el caudal a través de las conducciones muestre menor pulsación, es decir menor variación del volumen circulante por unidad de tiempo, consiguiendo de esta manera realizar la limpieza con mayor efectividad en el interior de las tuberías. El caudal máximo admisible en las membranas es una característica dada por el fabricante de las mismas, tanto en ciclos de proceso como limpieza (CIP) y por tanto nunca puede ser excedido por el ofrecido de la bomba. Por último, su pulsación baja alarga la vida útil de las membranas utilizadas en el proceso de filtración (se están obteniendo buenos resultados en procesos de concentración de proteínas). Una pulsación baja mitiga la rotura de las membranas permitiendo un flujo constante a través de ellas, ayudando así a que no se produzca la colmatación de Figura 2. Bombeo Axial (izq.) y Bombeo Radial (dcha.) JULIO/AGOSTO12 25 INGENIERÍA FARMACÉUTICA NO CABE DUDA QUE LOS INGENIEROS DE PROCESOS TENDRÁN EN CUENTA, A PARTIR DE AHORA, LA APLICACIÓN DE BOMBAS DE DOBLE TORNILLO HELICOIDAL EN AQUELLAS APLICACIONES DONDE LOS PARÁMETROS DE CALIDAD E HIGIENE SON CRÍTICOS Figura 3. Sección interior de la bomba SLH (izq.) y sección interior bomba SLH 4 G (dcha.). Imágenes por cortesía de Joh. Heinr. Bornemann GmbH las mismas. Esto hecho disminuye los costes de explotación del equipo, permitiendo la amortización más rápida del mismo, al sustituir las membranas en un periodo de tiempo más largo. La recuperación de la inversión inicial está asegurada. Su diseño es la base de su baja pulsación. La distancia entre el apoyo de sus ejes permite un pandeo mínimo y una mejor repartición de cargas axiales y radiales durante la rotación a altas velocidades de sus tornillos (ver sección de la bomba, figura 3). La combinación de diferentes tipos de rodamientos (doble de bolas, rodillos, agujas) y el sobredimensionado de los ejes en su diámetro consigue una gran versatilidad en rango de presiones, caudales y viscosidades de producto, especialmente en bombas de diseño más avanzados. Nuevos horizontes en aplicaciones Una de las desventajas relativas de esta nueva tecnología es la inversión en inicio que debe realizarse, comparándola con otras bombas de desplazamiento positivo. Su dimensionado robusto tiene como consecuencia un incremento en los costes de producción, ya que las tolerancias y ajustes mecánicos que existen entre sus tornillos sincronizados y la carcasa de cierre son de alta calidad. A pesar de este elevado coste inicial, su rentabilidad es inmejorable al conseguir una amortización en un corto plazo de tiempo debido en gran parte a sus bajos cotes de mantenimiento, su alta fiabilidad en servicio continuo y su reducción en tiempos de producción. Respecto a este último factor, hay que hacer especial mención a la reducción de los ciclos de limpieza en los sistemas de filtración de flujo tangencial, cuyos cartuchos filtrantes, estaban sometidos con el paso del tiempo a incrementos de pulsación, bien por desgaste de los elementos rotativos de las bombas, bien por envejecimiento de los materiales de las membranas. Utilizando las bombas de doble 26 JULIO/AGOSTO12 tornillo helicoidal y acelerando la bomba a velocidades mucho más altas (hasta 3600 rpm), se consiguen unos caudales y presiones más constantes que permiten reducir los tiempos de aclarado post ataque químico con soluciones básicas o ácidas, ya que el desgaste mecánico en las bombas de doble tornillo helicoidal es mucho menor que en las bombas lobulares o pistón rotativo. Figura 4. Sistema de ultrafiltración tangencial con depósito CIP. Cortesía de GRIFOLS Con esta nueva perspectiva en estos equipos, aparecen nuevas aplicaciones farmacéuticas en campos como la purificación de polisacáridos. Por ejemplo, durante el proceso de obtención del polisacárido Vi de Salmonella typhi se empleaba en el proceso de diálisis para la eliminación del fenol residual, un sistema de ultrafiltración con fibra hueca, no cumpliendo dicho método con las actuales regulaciones farmacéuticas. Por otra parte la cepa de Salmonella typhi expresa poco polisacárido, y es necesario optimizar cada una de las etapas del proceso de purificación, para evitar las pérdidas de dicho antígeno. Con estas dificultades, se puede mejorar la ultrafiltración tangencial, en la eliminación del fenol residual, permitiendo reducir el tiempo de proceso y la cantidad de buffer consumido. El cambio de fibra hueca por fibra plana y la utilización de bombas de doble tornillo por la viscosidad del producto, consiguen aumentar el rendimiento del proceso de purificación hasta un 30%. La unión de los procesos después de la etapa de ultrafiltración y antes de la etapa de precipitación alcohólica hace posible este hecho. La introducción de estos cambios tecnológicos permiten obtener un proceso de purificación más eficiente, cumpliendo las exigencias de las actuales Buenas Prácticas de Producción (GMP), con lo que se mejora no sólo la calidad del producto, sino también los márgenes económicos al reducirse los costes de producción. Concluyendo, con la implantación de las bombas de doble tornillo helicoidal en sistemas de filtración de flujo tangencial se han conseguido las siguientes mejoras: UÊ Menor pulsación durante el bombeo y por consiguiente menor daño en las membranas de polietersulfona. UÊ Baja cizalladura en productos sensibles al corte y por tanto un trato del producto respetando sus propiedades organolépticas, físicas y químicas. UÊ Reducción del tamaño de la bomba al aumentar la velocidad de salida del eje, y por tanto reducción en espacio y diámetros de tubería para vehicular el producto. UÊ Menor coste de mantenimiento debido a su robustez en el diseño. Reducción de mantenimiento productivo y mejora sustancial en mantenimiento preventivo y predictivo como consecuencia de su gran fiabilidad durante el bombeo en condiciones extremas UÊ Reducción en tiempo de proceso y limpieza debido en gran parte a sus altas velocidades de bombeo y gran rango de caudales y mantenimiento constante en la presión de salida. Asegura una limpieza interior (CIP y SIP) cumpliendo los requisitos más exigentes. FARMESPAÑA INDUSTRIAL UÊ Aumento de la aspiración (NPSH) con productos viscosos evitando presurización en la entrada del producto y modificación de su estructura o su homogenización. No cabe duda que los ingenieros de procesos en la industria alimentaria y farmacéutica tendrán en cuenta, a partir de ahora, la aplicación de bombas de doble tornillo helicoidal especialmente en aquellas aplicaciones donde los parámetros de calidad e higiene son críticos en el producto procesado. La investigación continúa en este tipo de bombas, dando como resultado final la aparición de modelos más avanzados como los mostrados anteriormente, que permiten mayores presiones de bombeo, un rango más diverso en viscosidades y un diseño optimizado en cuanto a requerimientos de higiene se refiere, cumpliendo con certificaciones EHEDG y 3A. Juan Dux-Santoy Ingeniero Técnico Mecánico. Máster CIME. (JOH.HEINR. BORNEMANN GmbH) Su carrera profesional ha estado ligada a la industria farmacéutica desde el año 1998, inicialmente en áreas de ingeniería, especializándose en diseño y cálculo de maquinaria farmacéutica. Desde el año 2005 coopera en proyectos biotecnológicos en el área de I+D y validaciones. Tiene una dilatada experiencia en gestión de proyectos. Sonia López Ingeniero Técnico Químico (Grifols Engineering S.A.) Su carrera profesional ha estado ligada a la industria farmacéutica desde el año 1999, inicialmente en áreas de Producción y desde 2004 en el área de Ingeniería, desarrollando la gestión y diseño de proyectos. Tiene una dilatada experiencia en gestión de proyectos y está especializada en procesos de purificación Downstream. FARMESPAÑA INDUSTRIAL Bibliografia UÊAplicación de la Filtración Tangencial en Procesos de Purificación. Sònia López. Grifols Engineering SA. Noviembre/ Diciembre 2007. UÊConcentración de Pectinasas por Ultrafiltración con Membranas de polisulfonas. Carlos da Silva, Mauricio M. Silveira, Raul Riveros y Mára Zeni1 1) Instituto de Biotecnología Universidad de Caxias do Sul, 95001-970 CAXIAS do SUL-Rs. Brasil2) Departamento de Física y de Química. Universidad de Caxias do Sul, 95001-970CAXIAS do SUL-Rs. Brasil. Noviembre 2004. UÊControl Avanzado de Procesos Industriales de Microfiltración y Ultrafiltración Tangencial. Jorge Francisco Romero Gonzalez. Universidad Politécnica de Valencia. Julio 2010. UÊEficiencia de un Sistema de Ultrafiltración/Nanofiltración tangencial para el fraccionamiento y concentración de lactosuero. Angel Muñí, Gisela Páez, José Faria, Eduardo Ramones, José Ferrer. Revista Científica. Universidad Autónoma de México. Agosto 2005. UÊProtein Fractionation Using Ultrafiltration System for Different Modules Configurations. Emy Syafinas Binti Hamid. Faculty of Chemical and Natural Resources Engineering Technology. University of College and Technology of Malaysia. November 2006. UÊProcess Biochemistry. Industrial applications of pectic enzymes: a review. Itziar Alkorta, Carlos Garbisu, María J. Llama,Juan L. Serra. Departamento de Bioquímica y Biología Molecular, Facultad de Ciencias, Universidad del País Vasco. Abril 1998 UÊSimposio 20 años del inicio de la aplicación de VA-MENGOC-BC® Vacuna antimeningocócica cubana BC. Primera efectiva contra el meningococo B. Tomás Verdura, Virginia Betancourt, Orlando Gutiérrez. Finlay Ediciones. Ciudad de La Habana. Cuba. Noviembre de 2005 UÊUltrafiltración Tangencial en el Tratamiento de Vinos. Margarita Vilavella Araujo. Escola Tècnica Superior d’Enginyeria Agrària. Universitat de Lleida. Diciembre 1997. JULIO/AGOSTO12 27 ESPECIAL CPHI © FOTOTECA-IFEMA The CPhI Worldwide portfolio of leading pharmaceutical events are returning once again, offering pharma executives an opportunity to source new suppliers, network and learn. Are you ready for business? C PhI and co-located events are being held at Feria de Madrid, Spain, from 9–11 October 2012. In addition to CPhI, which focuses on Pharma Ingredients, there is ICSE for Pharma Contract Services, InnoPack for Pharma Packaging and P-MEC Europe for Pharma Technology. Together, the shows cover every stage of the pharma value chain, with exhibitors in every area from pharma ingredients, CMOs, CROs and (pre-) clinical trials through to excipients and formulation, finished dosage, technology and packaging. The event has a genuinely global focus, attracting visitors and exhibitors from all over the world. Last year’s event, held in Frankfurt, Germany, attracted over 30,000 attendees and more than 2,200 exhibitors from over 140 countries. All four shows are subdivided into zones, each dedicated to a different area of expertise within the sector and designed to showcase its distinct qualities. Zoning has been warmly received by attendees because it makes the event easier to navigate and enables quick movement between areas. CPhI and co-located events are renowned within the pharma industry for the audience they attract, even in comparison to other pharma-specific events. Time and again, exhibitors report that having a stand at the event puts them in front of senior 28 JULIO/AGOSTO12 CPHI WORLDWIDE 2012, ALONG WITH CO-LOCATED EVENTS ICSE (CONTRACT SERVICES) AND P-MEC EUROPE (PHARMACEUTICAL MACHINERY, EQUIPMENT AND TECHNOLOGY) AND INNOPACK (INNOVATIVE PACKAGING SOLUTIONS), WILL BE THE WORLD’S LEADING PHARMACEUTICAL NETWORKING EVENT, WITH OVER 29,500 ATTENDEES FROM OVER 130 COUNTRIES AND 2,200 EXHIBITORS commercial decision-makers, allowing them to forge highly productive, longlasting business relationships face to face. For the last few years, CPhI and co-located events have hosted the Innovation Awards, which recognize outstanding innovation among the event’s exhibitors. This year, the scope of the awards has been broadened, and they’ve been renamed accordingly, becoming the CPhI Pharma Awards. The CPhI Pharma Awards feature three categories: Best Innovation, Best Sustainable Packaging and Best Sustainable Stand Design. Best Innovation recognizes outstanding achievement in pharmaceutical R&D, highlighting pioneers in new, commercially scalable technologies. Entry for the CPhI Pharma Awards is open to exhibitors at CPhI Worldwide, ICSE, P-MEC Europe and InnoPack. The deadline for Best Innovation and Best Sustainable Packaging is 10 August 2012, while Sustainable Stand Design is open until 31 August. The shortlist will be announced on 7 September, with presentations being held by shortlisted exhibitors at the CPhI Speakers Corner on 9 October. Details of how to enter can be found at http://www. cphi.com/pharma-awards. Other new and returning features include CPhI Global Meetings, a newly launched ‘Match and Meet’ service for exhibitors and visitors, as well as the Pre-Connect conference on October 8th, Lunchtime Education sessions during the show days and the popular Speakers Corners in the InnoPack, CPhI and ICSE areas. A custom-built Mobile App is in development that will offer quick and easy access to key information about the event. More details will be published on the CPhI website (www.cphi.com) and via the various social media channels in due course. Interested in visiting? Choose one of our 4 visitor packages: www.cphi.com/register. Prefer to exhibit? Email for options and availability: [email protected] FARMESPAÑA INDUSTRIAL Suplemento de Investigación, Analítica, Diagnóstico y Control en el Laboratorio JUL-AGO22 sss3%#4/2 SX-60 Syringe DARA PHARMACEUTICAL PACKAGING completa su gama de equipos para el llenado y tapado de jeringas con la pequeña SX-60 Syringe. Sus reducidas dimensiones permiten su fácil integración en cabinas de flujo laminar o aisladores para realizar desarrollo de productos o pequeños lotes para ensayos clínicos. Como es habitual en DARA, a pesar de ser un equipo compacto, el diseño del mismo se ha realizado para que a nivel técnico presente similares características a equipos de mayor producción facilitando su escalado a futuro. Dispone de un sistema de colocación del émbolo por “vacío compensado” que permite la inserción del émbolo en una posición determinada sin la deformación del mismo durante el proceso. Gracias a ello se puede trabajar con todo tipo de émbolos (deformables y no deformables). Se puede controlar el nivel de vacío, la posición final del émbolo y la velocidad de ciclo. Una pequeña estrella de dos posiciones permite introducir y sustraer las jeringas procesadas sin riesgo alguno para el operario. Todas las partes en contacto con jeringa y émbolo son fácilmente desmontables y esterilizables en autoclave. En resumen: un equipo compacto pero con la máxima versatilidad. WOSLAB* 2012, pondrá en valor la sostenibilidad en el mundo del laboratorio La primera edición WOSLAB*2012, “The World of Sustainable Laboratory”, se convertirá en un punto de encuentro internacional dedicado al conocimiento y divulgación de novedades, mejores prácticas y nuevas dimensiones sobre el mundo del laboratorio sostenible. Este espacio organizado por la Fundación MAITE y la Universidad del País Vasco/Euskal Herriko Unibertsitatea (UPV/EHU) reunirá, del 5 al 8 de Noviembre de 2012, a expertos y profesionales multidisciplinares de primer nivel. Durante esos días, en el Bizkaia Aretoa (el nuevo Paraninfo de la UPV/EHU) se abordarán aspectos esenciales como el diseño, construcción, equipamiento, mantenimiento y gestión de los laboratorios, como ejes estratégicos para la mejora de las instalaciones científicas. Además se profundizará en otras dimensiones del mundo del laboratorio y su vínculo con conceptos innovadores, Arte, Sociedad, Ciencia y Tecnología, de la mano de reputados especialistas. El evento contará con un nutrido grupo de expertos como Itay Talgam, afamado Director de Orquesta que se ha reinventando a si mismo propagando una nueva forma de liderazgo empresarial, o el Premio Príncipe de Asturias de Investigación Científica y Técnica, el doctor en física Pedro Miguel Echenique, que reivindica el 30 JULIO/AGOSTO12 carácter cognitivo de la ciencia. Se podrá disfrutar de la sensibilidad y naturalidad de la visión gastronómica de la estrella Michelin Josean Alija, Chef del restaurante Nerua (Museo Guggenheim Bilbao). José Luis de Vicente, Investigador cultural, comisario y periodista retará a los participantes con nuevos proyectos sobre cultura, tecnología, nuevos medios e innovación. Y se podrán descubrir revolucionarios modelos económicos de la mano de Guter Pauli, Emprendedor, economista y escritor, aportando una visión distinta e innovadora de la economía del mundo empresarial. Un atractivo y variado programa de actividades, charlas magistrales, talleres especializados, conferencias técnicas, mesas redondas, presentaciones de comunicaciones que podrán disfrutar todos los grupos de interés relacionados con el ámbito de los laboratorios: entidades que poseen o gestionan laboratorios (universidades, parques científicos-tecnológico, centros tecnológicos, hospitales, colegios profesionales, centros de educación secundaria y de formación profesional…). Empresas nacionales e internacionales multisectoriales (industria agroalimentaria, farmacéutica, química y petroquímica, ingeniería y construcción etc.), proveedores de productos o servicios a las instalaciones científicas, entidades relacionadas con la seguridad y la salud laboral, el medio ambiente y la integración de las personas discapacitadas, entidades certificadoras y reguladoras, expertos en ma- teria de seguridad y prevención de riesgos laborales, ingeniería, arquitectura, diseño de herramientas de gestión y control, instalaciones y equipamiento, así como usuarios directos de las instalaciones científicas. Las áreas temáticas de la cumbre giran en torno a: tSeguridad y Salud Laboral, Bienestar y Satisfacción de los usuarios tDiseño y construcción de laboratorios/ edificios de laboratorios tEficiencia del Laboratorio: Simulación, Medida y Operación tLaboratorios específicos y servicios de apoyo tIngeniería de instalaciones tBuenas practicas medioambientales tInnovación en laboratorios de docencia tDiseño del emplazamiento tCampus de Excelencia International tAlternativas a la obra de nueva construcción Importante recordar que la presentación de comunicaciones finaliza el próximo 10 de septiembre de 2012 Esta completa oferta convertirá WOSLAB* en un punto de encuentro internacional donde continuamente habrá cosas que ver y que hacer, donde se desvelarán los últimos avances y tendencias mundiales, creará oportunidades, desmontarán mitos y, lo más importante, construirá futuro sostenible. Más información e inscripción en www. woslab.org &!2-%30!»!).$5342)!, La FDA autoriza la prueba de vitamina D de Roche para laboratorios Roche ha comunicado hoy que la FDA (organismo estadounidense de regulación sanitaria) ha autorizado una prueba totalmente automatizada de la vitamina D para plataformas modulares cobas, con lo que se amplía el menú analítico de la empresa en el campo del metabolismo óseo. La vitamina D es un elemento importante para la salud humana, que se sintetiza fundamentalmente en la piel por exposición a la luz solar. La deficiencia de vitamina D desempeña un papel destacado en los trastornos del metabolismo óseo. Estudios de los últimos años han relacionado dicha deficiencia con muchos otros estados patológicos, como el cáncer, las enfermedades cardiovasculares y la diabetes. «La demanda de pruebas de vitamina D está aumentando rápidamente en los Estados Unidos. Disponer de una amplia base de analizadores cobas instalados permitirá a los laboratorios responder fácilmente a dicha demanda e integrar la prueba de Roche en su flujo de trabajo –señala Daniel O’Day, director operativo (COO) de Roche Diagnostics–. Con la adición de este test podrán ofrecer resultados precisos y exactos para ayudar a los médicos a determinar si sus pacientes adultos tienen niveles suficientes de vitamina D y adoptar las medidas adecuadas». Se estima que en todo el mundo hay mil millones de personas con insuficiencia de vitamina D. El test Elecsys Vitamin D mide tanto la vitamina D2 como la D3, algo importante para médicos cuyos pacientes toman formas distintas de suplementos de vitamina D. Los resultados se obtienen mediante la tecnología patentada de detección por electroquimioluminiscencia (EQL) de Roche, que ofrece un amplio intervalo de medición y una alta precisión en el extremo bajo de la detección para facilitar la valoración de los pacientes con una deficiencia grave de vitamina D. Este test podrá realizarse en todas las plataformas modulares cobas de Roche. Roche también tiene una prueba de la vitamina D en Europa y otras regiones que aceptan la certificación CE. GENETRIX licencia a QIAGEN su polimerasa “Qualiphi” El holding biotecnológico español, Genetrix, ha firmado a través de su filial X-Pol Biotech un acuerdo exclusivo y global de licencia de su producto “Qualiphi” con Qiagen, empresa global de procesamiento de muestras y ensayos de biología molecular. Qualiphi es una polimerasa de ADN licenciada del Consejo Superior de Investigaciones Científicas (CSIC) en el año 2010. Debido a sus características únicas, los primeros estudios sugieren que tiene potencial para mejorar las amplificaciones de genomas completos y largas secuencias de ADN. Las polimerasas son los principales instrumentos utilizados en la amplificación de grandes fragmentos de ADN y genomas completos y son una herramienta esencial para cualquier investigación que analice o modifique ADN de cualquier especie. Debido al significativo crecimiento en el campo de secuenciación del ADN y de la medicina personalizada, el crecimiento del mercado de las polimerasas para la amplificación del genoma completo se espera que sea del 25% anual en los próximos años. Las estimaciones actuales estiman que, solo el mercado de la amplificación isotérmica de ADN a nivel mundial, será de unos 70 millones de euros. &!2-%30!»!).$5342)!, JULIO/AGOSTO12 31 sss%30%#)!,")/30!). BioSpain 2012 aspira a convertirse en el cuarto evento mundial de desarrollo de negocio La Asociación Española de Bioempresas (ASEBIO) y SPRI (Sociedad para la Transformación Competitiva), dependiente del Departamento de Industria, Innovación, Comercio y Turismo del Gobierno Vasco, firmaron el mes de noviembre un acuerdo por el que quedaba elegida la Villa de Bilbao como sede para la celebración de la sexta edición del evento bienal BioSpain. Así, entre los días 19 y 21 de septiembre de este año, se celebrará en el Bilbao Exhibition Centre de Barakaldo (Bilbao) la 6ª Reunión Internacional de Biotecnología Biospain 2012 (www.biospain2012.org), un evento bienal organizado por la Asociación Española de Bioempresas (ASEBIO) y en esta edición también por el Gobierno de Vasco a través de la Sociedad para la Transformación Competitiva (SPRI), con el objetivo de impulsar el 32 JULIO/AGOSTO12 conocimiento de la biotecnología en España. La anterior edición, BioSpain 2010, se celebró en Pamplona. Contó con la presencia de 641 empresas, de las que el 23% (un 55% más que la edición anterior) procedían de fuera de España. Además, participaron 134 stands, un 15% más que en la edición anterior, BioSpain 2008, y con 168 expositores, de los que 29 eran internacionales frente a los cuatro registrados BioSpain 2008. La asistencia alcanzó las 1.300 personas procedentes de empresas de biotecnología, inversores, instituciones, investigadores, etcétera. Los principales países representados en BioSpain 2010, según el número total de empresas, fueron España, con el 77%, seguida de Francia (5%), Reino Unido (3.5%), Estados Unidos (3%) y Alemania (2%). En total, acudieron representantes de 25 países. Teniendo en cuenta el éxito de la edición anterior, BioSpain 2012 aspira a convertirse en el cuarto evento mundial de desarrollo de negocio o partnering (encuentros one-to-one) por número de reuniones. Como novedad, este año se ha duplicado el espacio destinado a tal fin, por lo que se podrían alcanzar hasta 4.000 reuniones Biospain 2012 podría situarse por detrás de la BIO convention (21.000 reuniones). BioEurope (14.700 reuniones) y BioEurope Spring (11.172 reuniones) y por delante de la Biopartenering Europe, Biopharm America y Biopartnering North America. Otro de los puntos destacados de BioSpain 2012 es su internacionalización, que en la pasada edición alcanzó hitos destacables. Ya está confirmada la participación de empresas de EE.UU., Reino Unido, Canadá, Francia, Alemania y Suiza, en- tre otros, siendo Gran Bretaña el país invitado a este evento. Este evento refuerza los contenidos de biotecnología industrial que hasta ahora se habían tratado en BioSpain de forma tradicional, ya que es un área emergente en España y con un amplio potencial. Así, en esta edición se realizará por primera vez un foro de inversión (investment forum) de biotecnología industrial cuyo objetivo es presentar ante una audiencia de inversores internacionales especializados en este segmento en concreto proyectos de start-up o PYMES en fase inicial de desarrollo que estén buscando financiación para continuar con su actividad. Se trata del proyecto europeo BIOCHEM, respaldado por la Comisión Europea y organizado por un consorcio de entidades europeas en el que participan las entidades españolas Feique y Madrid Biocluster. Este proyecto pertenece al Programa Marco de Innovación y Competitividad (CIP). Los encargados de organizar BIOCHEM Accelerator Forum en el seno de BioSpain 2012 son Feique y Madrid Biocluster, que organizan esta edición el 20 y 21 de septiembre en el palacio de congresos bilbaíno BEC. El objetivo último de BIOCHEM es favorecer el acceso a la innovación y apoyar la financiación de las PYMES con proyectos en el área de los productos químicos de origen biológico. &!2-%30!»!).$5342)!, BioSpain 2012 incluirá por primera vez un Foro de Formación y Empleo en Biotecnología, con el patrocinio oficial de Repsol y la colaboración de la Agencia de Desarrollo Local de Barakaldo, Inguralde. Los últimos datos publicados (INE) revelan que el sector biotecnológico español sigue creando empleo a pesar de la crisis. Esta circunstancia, unida a la creciente oferta académica de grados y master en el área de la biotecnología y la capacidad de estos estudios para atraer talento en las universidades españolas, ha motivado la creación de este Foro, que se celebrará el día 21 de septiembre en el marco de BIOSPAIN (Bilbao). Este espacio, de acceso gratuito –aunque limitado- para estu- diantes y buscadores de empleo permitirá a éstos interactuar con las empresas biotecnológicas para explorar oportunidades de empleo y con centros de formación (universidades y escuelas profesionales) para conocer su oferta formativa especializada en biotecnología. El Foro contará con un espacio para expositores, sesiones informativas (charlas) de las empresas y un punto de encuentro y reunión entre empresas y candidatos, donde podrán llevarse a cabo entrevistas de trabajo. Los demandantes de empleo (doctores, licenciados o titulados superiores no universitarios) tienen acceso gratuito al foro, aunque existen plazas limitadas. Además, podrán vi- sitar la feria comercial Biospain ese día. Si una empresa biotecnológica está interesada en entrevistarse con candidatos, puede hacerlo previa inscripción en la feria. El software desarrollado para este foro permitirá a las empresas aceptar candidaturas espontáneas de los buscadores de empleo o identificar perfiles concretos entre los inscritos y solicitar reuniones a los candidatos de interés. Las instituciones académicas podrán presentar sus programas de formación (máster, licenciatura, postgrado, etc.). También está abierta la participación a Head-hunters, consultoras de recursos humanos especializadas etc. Gran Bretaña será el país invitado a este evento, lo que facilitará la asistencia de una nutrida delegación de empresas británicas. Otros países que han confirmado asistencia son Estados Unidos, Canadá, Francia, Alemania o Suiza. Como novedad, esta edición puede seguirse en Twitter, Youtube y Linkedin. Los organizadores de este evento biotecnológico, que aspira a convertirse en el cuarto evento mundial de desarrollo de negocio o partnering, apuestan por la comunicación en redes sociales con el objetivo de ampliar las posibilidades de empleo y de negocio en el sector de la biotecnología. El programa puede consultarse en: http://www.biospain2012. org/en/programme.cfm sss).'%.)%2·!$%")/02/#%3/3 Tecnologías de un solo uso: Enfoque de las nuevas tendencias sss!LOLARGODELOSÞLTIMOSA×OSLASSOLUCIONESDEUNSOLOUSOHANADQUIRIDO UNA IMPORTANCIA SIGNIlCATIVA EN EL CAMPO DE LA FABRICACIØN FARMACÏUTICAMODERNAENESPECIALENLAGESTIØNDEmUIDOSYENBIORREACTORESSONMUYACEPTADASPORSERALTERNATIVASlABLESYECONØMICASALASSOLUCIONESDEACEROINOXIDABLE%STASTECNOLOGÓASHANCRECIDONOSOLOENTÏRMINOSDEMADUREZSINOTAMBIÏNPORLAmEXIBILIDAD QUEOFRECEUNASOLUCIØNDEUNSOLOUSOPARACADAPASODELPROCESO Davy de Wilde Director de Marketing. Fermentation Technologies. Sartorius Stedim Biotech Thorsten Adams Jefe de Producto. Fermentation Technologies. Sartorius Stedim Biotech Javier Lobo Especialista de Aplicaciones. Fermentation Technologies. Sartorius Stedim Biotech Jean-Marc Cappia Vicepresidente de Marketing. Figura 1. BIOSTAT® RM Basic 20 Fluid Management Technologies. Sartorius Stedim Biotech Biorreactores Los biorreactores de movimiento basculante o denominados “Wave rocking motion”, como el BIOSTAT® RM con bolsas en forma de almohadilla desde 100mL hasta 300L, se han implementado con éxito en una variedad de aplicaciones, incluidos cultivos de células de mamíferos, insectos y de plantas. Los sistemas se caracterizan por una aireación eficiente y mezcla con bajo cizallamiento. Recientemente, Sartorius Stedim Biotech presentó una nueva generación de biorreactores 34 JULIO/AGOSTO12 de movimiento basculante que permiten una flexibilidad, seguridad y control mejorados. Estas características mejoradas establecen aún más esta tecnología como una de las soluciones preferidas para siembra y propagación celular en la fabricación a escala comercial. Otras aplicaciones, como producción de vacunas en entorno GMP, pequeños lotes de producción de proteínas, así como ciertas aplicaciones de I+D. son candidatas ideales para esta tecnología. En un mundo donde el espacio es fundamental, es esencial la necesidad de soluciones alternativas de reducido tamaño. El BIOSTAT® ORB es un nuevo tipo de biorreactor a gran escala de un solo uso basado en el probado principio de agitación Figura 2. BIOSTAT® ORB 200 orbital. Actualmente disponible en 200L, pronto se añadirán otros tamaños como los de 50L y 2.500L. Como no se requiere un dispositivo agitador o burbujeo interno, ofrece una alternativa económica a otras soluciones de biorreactores. Mientras un BIOSTAT® RM de pequeña escala se utiliza normalmente como el primer paso en la línea de siembra, el BIOSTAT® ORB 200L más grande es la elección perfecta como biorreactor de siembra antes de la inoculación en el biorreactor de producción final. Además, en caso de que no se requiera escalado desde recipientes de vidrio más pequeños utilizando parámetros de ingeniería, BIOSTAT® ORB ofrece una solución excelente para operaciones GMP y no GMP. Si fuera necesario el escalado con biorreactores convencionales, los sistemas de diseño clásico como el UniVessel® SU y BIOSTAT® STR son las elecciones preferidas por la industria. Al estar enteramente diseñados conforme a los sistemas estándar tradicionales, pueden mantenerse criterios esenciales de escalado como entrada de potencia, geometría del recipiente y otros. Esto convierte a los biorreactores de un solo uso y agitación clásica en la referencia para el desarrollo de procesos y fabricación comercial final. Bolsas de un solo uso Los procesos de biofabricación implican múltiples pasos de retención de fluidos aguas arriba y abajo del biorreactor para la manipulación y almacenamiento sea de agua, medios, &!2-%30!»!).$5342)!, Figura 3. UniVessel® SU 2L Figura 4. BIOSTAT® STR 200 tampones o productos finales. Estos pasos se tratan cada vez más utilizando bolsas de un solo uso que van de un volumen de 100mL a 3.000L. Las bolsas de pequeño volumen se almacenan habitualmente en bandejas y pueden interconectarse durante el llenado para dosificar cualquier volumen líquido grande. Las bolsas de retención pequeñas producen inconvenientes cuando, por ejemplo, es necesario dividir volúmenes grandes de tampones o medios en volúmenes más pequeños para alimentación en sistemas de biorreactor (medios) o procesos de lavado y elución (tampones). Las bolsas de gran volumen se instalan en contenedores plásticos o en sistemas Palletank más fiables diseñados para evitar el rozamiento o puntos de presión o el plegado de bolsas para evitar cualquier daño a estas. Puesto que las bolsas de retención también se utilizan para almacenar y transportar medicamentos a granel, el diseño y construcción de dichas bolsas es crucial. Las soldaduras, medidas, espesor de película de la bolsa y capas tienen que estar bien desarrolladas para conseguir la mejor robustez mecánica. La película de la bolsa es a menudo multicapa de diferentes polímeros para obtener niveles bajos de extraíbles por el contacto de la película con el producto, la estabilidad mecánica y la barrera a los gases por las diferentes capas que soportan la película interior. La película interior es muy frecuentemente una película de polietileno de baja densidad, donde la poliamida crea la resistencia mecánica y el etilo vinilo una barrera a los gases. &!2-%30!»!).$5342)!, Mezcladores de un solo uso La mezcla es un paso esencial en las operaciones de procesos múltiples de la industria biofarmacéutica. Por ejemplo, la mezcla de tampones y medios es una operación unitaria muy frecuente. Sin embargo, la limpieza del sistema de mezcla de acero inoxidable es tediosa y requiere atención adecuada para evitar cualquier residuo contaminante. Por este motivo, ahora se utilizan con mucha frecuencia sistemas de mezcla de un solo uso. Estos sistemas pueden interconectarse con sistemas de filtración o bolsas de retención. Los sistemas de mezcla de un solo uso están disponibles de 50 a 2.500 L y muy frecuentemente se utilizan para la preparación de tampones y medios, ajustes de pH, UF/DF de intercambio de tampones, purificación de proteínas, composición de productos o procesos de formulación final. Las aplicaciones más recientes son la inactivación viral por el cambio de pH. Dichas bolsas de mezcla utilizan sensores potenciométricos de pH de un solo uso para determinar los niveles de pH necesarios duJULIO/AGOSTO12 35 sss).'%.)%2·!$%")/02/#%3/3 Figura 5. Bolsas Flexboy® rante el período de inactivación. La solución de cambio de pH puede alimentarse al sistema de mezcla utilizando bolsas de retención desechables. Los métodos de mezcla más habitualmente utilizados implican impulsores magnéticos y mezclador de levitación. Este último no entra en contacto con el material de la bolsa y flota en un campo magnético. Esto evita cualquier rozamiento del material de la bolsa, al tiempo que muestra unos resultados de mezcla rápidos y completos. Las diferentes opciones de tecnología de mezcla son útiles ya que las aplicaciones y complejidad de la muestra varían. Los líquidos o mezclas líquidas pertenecen a los requisitos de mezcla más fáciles, en el que la mezcla de líquido o polvo puede ser difícil y requerir un diseño cuidadoso y la observación del modo de mezcla. Los mezcladores levitados van de 50L a 1000L y se utilizan muy frecuentemente para inactivación de virus de pH bajo, purificación de proteínas, agrupación de fracciones por cromatografía y líquido o formulación líquida. Su velocidad máxima de rotación alcanza 180 RPM y puede mezclar producto hasta una viscosidad de 800 cp. Los mezcladores magnéticos ofrecen una potencia de mezclado más fuerte con una velocidad máxima de impulsor de 300 RPM y pueden mezclar productos hasta una viscosidad de 1200 36 JULIO/AGOSTO12 Figura 6. Palletank® cp para volúmenes de mezcla que van de 50 a 2.500L. Se utilizan muy frecuentemente para la preparación de tampones y medios y la homogeneización de la cosecha celular aguas abajo de los biorreactores. Importancia de las tecnologías de un solo uso La industria biofarmacéutica se enfrenta a una diversidad de desafíos, que incluyen la optimización de capacidad de producción, la pérdida de protecciones de patentes, la presión del coste Figura 8. Palletank® for Mixer Figura 7. Bolsas Flexel® 3D de las autoridades de la salud pública y la lucha contra la competencia. Por ejemplo, para procesos mAb (anticuerpos monoclonales) existentes, el aumento de títulos de proteínas de <1g/l a >5g/l y la mejora de las producciones de purificación hasta el 90 por ciento permiten pasar de plantas tradicionales de acero inoxidable a gran escala a instalaciones de un solo uso de escalas entre 1000 y 2000L. Los enfoques recientes de curación de enfermedades de amplia difusión como el cáncer o la artritis reumatoide mediante medicamentos biológicos son prometedores. Sin embargo, puede observarse una clara tendencia alejada de los grandes superventas y hacia medicamentos específicos para el paciente o medicina personalizada. Las tecnologías de un solo uso encajan idealmente en estas dos tendencias y ofrecen numerosas ventajas frente a los equipos multiuso convencionales. La inversión de capital para un conjunto de un solo uso se reduce significativamente. Los sistemas ofrecen el mismo nivel de control del bioproceso que sus equivalentes de inoxidable, aunque eliminan la necesidad de limpieza o esterilización por vapor in situ, haciendo la configuración global menos compleja y más económica. Además, se reducen igualmente servicios como energía, vapor y agua para inyección. Ya que los recipientes de un solo uso están en contacto con los medios de cultivo, después de cada tanda se desechan las células y API, no se requiere validación de la limpieza, mejorando adicionalmente el proceso global. Con su amplia cartera de biorreactores agitados, órbitales y basculantes de un solo uso, Sartorius Stedim Biotech ofrece soluciones para cada cliente y cada aplicación desde la producción simple no GMP hasta la producción GMP comercial de cultivo de semillas. &!2-%30!»!).$5342)!, sss$)!'.¼34)#/0/2)-!'%. Plataforma de Bioimagen del CIBER-BBN sss)NTEGRADAENEL#)"%2"".LA0LATAFORMADE"IOIMAGENOFRECESO PORTE AL DESARROLLO PRECLÓNICO DE PROYECTOS DE INVESTIGACIØN OFRECE SOPORTETANTOANIVELNACIONALCOMOINTERNACIONALYSEPOSTULACOMO UNAHERRAMIENTAQUEPOSIBILITAELACCESOALASTECNOLOGÓASMÉSPUN TERASENIMAGEN CIBER-BBN www.ciber-bbn.es Plataforma de Biomedicina del CIBER-BBN: servicios de primer nivel para incrementar las capacidades de investigación nacional e internacional. El CIBER-BBN es el centro de investigación Biomédica en Red (CIBER) de Bioingeniería, Biomateriales y Nanomedicina; promovido desde el Instituto de Salud Carlos III. En sus cinco años de trayectoria, se ha posicionado como un centro referente dentro de las disciplinas de investigación que aborda, favoreciendo las sinergias entre sus 47 grupos de investigación (seleccionados en base a su excelencia científica) y un aprovechamiento mayor de los recursos. Existen nueve consorcios CIBER en nuestro país, orientados a diferentes patologías. Sin embargo, CIBER-BBN pretende cubrir una serie de necesidades tecnológicas que ayudarán al tratamiento y diagnóstico de múltiples enfermedades: aplicación de células madre para terapia en diversas patologías, nuevos materiales 38 JULIO/AGOSTO12 para regeneración de tejidos, sistemas de liberación dirigida de fármacos, tecnologías para mejora del diagnóstico de enfermedades, etc. Es este carácter fuertemente tecnológico el que le convierte en un colaborador estratégico para el desarrollo de proyectos que requieran de los últimos avances en el uso de biomateriales, aplicaciones de bioingeniería y terapias en Nanomedicina. Su cartera de patentes, algunas de las cuales son susceptibles de explotación, algunas ya licenciadas, se encuentra a disposición de empresas y organizaciones interesadas. Además del programa científico, el CIBER-BBN ofrece recursos tecnológicos de elevado nivel tanto a los grupos de investigación del centro como a empresas y grupos de otras instituciones. En concreto, la Plataforma de Biomedicina del CIBER-BBN está constituida por 19 unidades agrupadas en cinco clústers de equipamientos científico técnicos de alta singularidad. Estas 19 unidades, complementarias entre sí por su funcionalidad y propósitos, se encuentran ubicadas en algunas de las instituciones más relevantes en materia de investigación biomédica a nivel nacional. Este equipamiento, difícilmente accesible fuera del en- torno público de investigación, puede resultar de gran interés para la industria, no sólo por el aprovechamiento de los equipos, sino también por la garantía de ser respaldados por un grupo de investigadores con demostrada experiencia en la utilización de los mismos. Tecnologías de imagen y RMN para aplicación biomédica. Una de las cinco plataformas que incluyen los 19 Servicios de Investigación del CIBER-BBN es la Plataforma de Bioimagen, formada por tres unidades que ofrecen soporte al desarrollo Figura 1. Bioluminiscence Imaging (BLI).Ventral and dorsal images of a mouse with metastatic dissemination of luciferase expressing HT-29 human colorrectal cancer cells. BLI imaging allows localization and longitudinal monitoring of metastatic lesions without the need of sacrificing the animal. Molecular probes for in vivo fluorescencen Imaging (FLI). Subcutaneous tumors with accmulation of Integrisense 680 for in vivo detection of _v`3 expresión and Niraware™ for in vivo visualization of tumor vasculature. This type of molecular probes give real-time information on the functional and molecular status of target tissues. In vivo biodistribution and tumor accumulation of fluorochrome labeled nanoparticles. Images of the same animal at the time of administration, 6 h, 3 days and 11 days post-administration, showing renal clearance and tumor accumulation of tested nanoparticles. Drug delivery and targeting Group, Hospital Universitario Vall d´Hebron - GDLF-HUVH. &!2-%30!»!).$5342)!, sss$)!'.¼34)#/0/2)-!'%. La Plataforma de Biomedicina del CIBER-BBN está constituida por 19 unidades con cinco clústers de equipamientos científico técnicos y complementarias entre sí por su funcionalidad y propósitos preclínico de proyectos de investigación: identificación de nuevos compuestos terapéuticos, estudios de validación de nuevas dianas terapéuticas y/o nanoterapias, tecnologías de imagen ópticas y RMN. La unidad de Experimentación In Vivo, en el CIBBIMNanomedicina del Hospital Universitario Vall d’Hebron de Barcelona, tiene como misión el desarrollo preclínico de proyectos de investigación, enfocados hacia la validación de nuevos compuestos terapéuticos o de biomarcadores, para su futura aplicación clínica. Está coordinada por el Dr. Simó Schwartz, del grupo de Liberación Dirigida de Fármacos del mencionado hospital, y desarrolla estudios para la evaluación de nuevas dianas terapéuticas y/o nanoterapias en el campo de la oncología y de las enfermedades raras. Para ello, realiza estudios preclínicos básicos (toxicología, histopatología y eficacia de tratamientos), complementados con tecnologías de imagen óptica no invasiva, que permiten acelerar el 40 JULIO/AGOSTO12 Figura 2. Dynamic MRSI in an allograft model of high-grade glioma – a mouse with a GL261 tumor – during induced acute hyperglycemia. In the graph, the changes in intensity detectable at 3.43 ppm (apparent variations in glucose levels visible using MRS, MR-glc; spectra in the box with the white background) are seen in the transient kinetics for different regions of the tumor (center and edge) vs. normal/peritumoral parenchyma. The spatial distribution of the MR-gcl changes, at 80 min after induction of hyperglycemia in the animal, can be seen in the color map on the left superimposed on the T2-weighted reference image. See Simoes et al. 2010 for further details. Research Group for Biomedical Applications of Nuclear Magnetic Resonance at the UAB, GABRMN-UAB proceso de desarrollo de nuevos fármacos. Apoyada científicamente por el equipo del Prof. Carles Arús, del Grupo de Aplicaciones Biomédicas de la Resonancia Magnética Nuclear (GABRMN) de la Universidad Autónoma de Barcelona, la unidad de RMN: Aplicaciones Biomédicas I tiene como objetivo la adquisición, procesamiento y/o interpretación de datos de RMN para aplicaciones biomédicas: identificación de biomarcadores, desarrollo de protocolos para el diagnóstico precoz de diversas patologías, sobre todo a nivel cerebral, seguimiento de la evolución de enfermedades o evaluación de respuestas farmacológicas durante el desarrollo de nuevos fármacos, validación de agentes de contraste o desarrollo de protocolos de MRSI en modelos preclínicos de la patología cerebral. Está equipada con 8 espectrómetros que operan a campos magnéticos entre 5,8 y 14,1 Teslas (T), incluyendo un BioSpec equipado con imán horizontal de 7T para estudios preclínicos in vivo. Existen protocolos para la obtención de imágenes de rata y ratón de cerebro, oído, rodilla, codo, hombro, cadera, abdomen, laringe, hocico, ojo, médula espinal y genitales. La segunda unidad de Resonancia Magnética Nuclear, RMN: Aplicaciones Biomédicas II, está ubicada en la Universidad de Valencia, en el Grupo de Investigación de Aplicaciones Biomédicas y Biofísicas de la RMN dirigido por el Dr. Bernardo Celda. Entre sus equipos, cuenta con un equipo RMN de 14T, que dispone de un equipamiento singular para la adquisición automática y termostatizada a bajas temperaturas de perfiles metabólicos de un grupo de muestras (hasta 4 x 96 muestras de biofluidos, líneas celulares y tejidos), fundamental para el desarrollo de aplicaciones clínicas metabonómicas con utilidad, por ejemplo, en estudios de farmacología en distintas fases. Solo durante 2011, la tres unidades han trabajado, además de con 11 grupos del CIBER-BBN, con 13 grupos de las propias instituciones donde se encuentran ubicados los servicios y con más de 10 grupos de investigación externos, tanto de centros públicos de investigación, como hospitales y empresas. El proyecto POLYSPHERA representa claramente las posibilidades de colaboración público-privada a través de los Servicios del CIBER-BBN. El proyecto trata de aunar esfuerzos en la búsqueda de tratamientos más efectivos contra el cáncer, segunda causa de muerte en los países desarrollados. Este proyecto aprovecha la experiencia acumulada de PharmaMar (grupo Zeltia), coordinador del proyecto, en la búsqueda de nuevos tratamientos para cáncer con estrategias novedosas de vehiculización de moléculas, con el soporte de &!2-%30!»!).$5342)!, sss$)!'.¼34)#/0/2)-!'%. CIBERBBN mantiene su compromiso con la industria y plantea la realización de proyectos de desarrollo en biomedicina, mediante la colaboración entre empresas y sus plataformas Figura 3. Aneurism model, Research Group for Computational Imaging and Simulation Technologies in Biomedicine - CISTIB-UPF research group EcoPol en la encapsulación de dichas moléculas. El proyecto es apoyado, asimismo, por los Servicios de Investigación del CIBER-BBN, en concreto por la unidad de Síntesis de Péptidos, del Parc Científic de Barcelona, y por la unidad de Experimentación In Vivo, comentada anteriormente. Un equipamiento que ofrece soporte a nivel internacional Una de las plataformas que ejemplifican la complementariedad de los servicios de investigación del CIBER-BBN es la Plataforma de Cómputo de Altas Prestaciones. Su equipamiento está ubicado en la Universidad Pompeu Fabra de Barcelona, dentro del grupo de Imagen Computacional y Tecnologías de Simulación en Biomedicina, liderado por el Dr. Alejandro Frangi. 42 JULIO/AGOSTO12 Mediante acceso remoto, la plataforma da servicio para la ejecución de proyectos relacionados con la necesidad de ejecutar simulaciones de modelos numéricos que requieren cálculo intensivo: procesado de mallas, segmentación de imagen, registro de datos e imágenes o simulación de modelos, simulación de elementos finitos, modelado en 3D,... El equipamiento está integrado por un Software grid cuyo funcionamiento facilita el desarrollo y la investigación de aplicaciones innovadoras en el marco de la iniciativa internacional “Virtual Physiological Human”. Favoreciendo la colaboración público - privada En la actualidad, el CIBERBBN mantiene su compromiso de colaboración con la industria y plantea la realización de proyectos de desarrollo en biomedicina, mediante la colaboración entre empresas y sus plataformas de equipamiento, apoyando dicha colaboración con fondos propios (3.000€ por proyecto). El objetivo de las colaboraciones es el de favorecer la generación de conocimiento transferible a la sociedad y, en especial, al sector productivo, así como generar confianza y resultados que permitan engendrar posteriores proyectos colaborativos más ambiciosos. Para obtener la financiación de estos proyectos, a través del CIBER-BBN, se requiere la implicación de, al menos, una unidad del Programa de Plataformas del CIBER-BBN, aunque se considera de especial interés la participación de más de una unidad en el mismo proyecto. Por otra parte, se ofrece la coordinación de sus servicios bajo un modelo de ventanilla única, lo que permite la participación de varias unidades, con sus correspondientes grupos, en convocatorias competitivas nacionales y europeas como un solo socio, bajo el paraguas del CIBER-BBN. Asimismo, desde 2010, este centro organiza encuentros con el entorno industrial y grupos de investigación, denominados Foros CIBER-BBN – empresa, con el propósito de presentar e intercambiar puntos de vista sobre líneas de investigación, intereses y posibilidades de colaboración entre el sector público y el industrial. Los foros se han enfocado desde diferentes temáticas o líneas estratégicas del CIBER: medicina regenerativa, terapia ocular, liberación de fármacos, diagnóstico clínico, imagen médica, etc. Estos encuentros con la industria ofrecen ya resultados positivos: una patente licenciada; 8 colaboraciones entre grupos CIBER con empresas; y 18 contactos con previsión de colaboración. &!2-%30!»!).$5342)!, FI FARMESPAÑA + INDUSTRIAL Revista profesional de Proveedores de la Industria Farmacéutica y Tecnología de Laboratorio FARMESPAÑA INDUSTRIAL es la revista órgano difusor de AEPIMIFA, Asociación española de profesionales de la ingeniería y mantenimiento de la industria farmacéutica, alimentaria y afines. ¿A QUIÉN VA DIRIGIDA? Farmespaña industrial, con una tirada de 6.000 ejemplares, (versión digital 9.000 especialmente enfocado hacia América Latina) es distribuida de forma nominal y gratuita entre directores técnicos, departamento y responsables de compras, responsable y departamento de calidad, responsable y departamento de envase y embalaje, departamento y responsables de logística, responsables y departamento de producción, responsable y departamento de ingeniería, investigadores y demás cargos importantes con capacidad de decisión en la industria farmacéutica, veterinaria, cosmética y biotecnológica. Así como los miembros de las principales asociaciones relacionadas con la industria farmacéutica. INGENIERÍA FARMACÉUTICA E, MEDIO AMBIENT SEGURIDAD E HIGIENE TO MIEN TRATA AS AGU GUÍA DE RES PROVEEDO DE LA RIA UST IND TICA FARMACÉU DE lifesciencesODE ACIÓN CARACTERIZ S DE COMPUESTO CING UR UTSO O D ALIDA MICROBIOLO ÍA NIER INGE TICA ACÉU FARM ULA CULTIVO CEL GÍA C R ESPECTROCOPÍA RTAJE REPO I+D S EVISTA ENTR TO MIEN GÍA OLO ECN BIOT 2012 DE TRATA DOS SÓLI AUTOMATIZACI ÓN DE PROCESOS TECNOLOGÍA DE LABORATORIOS HIGIENE, SEG URIDAD Y MEDIO AMBIENT E Características técnicas Tipo de inserción: offset positivo Tamaño de corte: 210 mm ancho x 297 mm alto Encuadernación: fresada BIOTECNOLOG ÍA GANO DIFUSOR DE w.aepimifa.org Tarifas publicitarias Portada Desplegable portada Interior portada Contraportada Encarte Página completa ½ página ¼ página Doble página 2.995€ 2.800€ 1.890€ 2.495€ 1.900€ 1.395€ 975€ 695€ 2.095€ Publicidad online Promocione la imagen de su empresa en nuestra página web y en el newsletter semanal. Para conocer toda la actualidad del sector visítenos en wwww.farmaindustrial.com Tarifas web 1 mes 3 meses 6 meses 1 año 350€ 700€ 900€ 1.500€ Tarifas boletín (quincenal) 1 mes 3 meses 6 meses 1 año 350€ 700€ 900€ 1.500€ Programa editorial 2012 INGENIERÍA FARMACÉUTICA MEDIO AMBIENTE, SEGURIDAD E HIGIENE GUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA lifesciencesODE CARACTERIZACIÓN DE COMPUESTOS MICROBIOLOGÍA CULTIVO CELULAR ESPECTROCOPÍA ENERO- FEBRERO JULIO-AGOSTO Cierre 17-02-2012 tEspecial PACKAGING INNOVATIONS tEnvase y embalaje I tAutomatización de procesos tRobótica tSoftware para laboratorios tIngeniería Farmacéutica y Mantenimiento I tClimatización tEsterilización I tSuplemento Life Sciences Lab Cierre 18-07-2012 tEspecial BIOSPAIN 2012 tEspecial CPHI MADRID tEspecial biotecnología tDrug Delivery systems tAPIS tTecnología de laboratorios I tContratación a terceros tEficiencia energética en los laboratorios tGUÍA DE PROVEEDORES DE LA INDUSTRIA FARMACÉUTICA tSuplemento Life Sciences Lab MARZO- ABRIL Cierre 20-04-2012 tEspecial HISPACK tEspecial FERIA SIL tEspecial ACHEMA tTecnología cosmética tLogística y distribución tEnvase y embalaje II tEtiquetado y codificación tAutomatización de almacenes tHigiene, seguridad y medio ambiente tSuplemento Life Sciences Lab MAYO-JUNIO Cierre 15-06-2012 tValidaciones, certificaciones I tSalas blancas I tNormativa, registros y legislación tTratamiento de aguas tTratamiento de gases tEsterilización II tFiltración tEspecial parques tecnológicos tSuplemento Life Sciences Lab SEPTIEMBRE-OCTUBRE Cierre 5-10-2012 tEspecial EXPOSÓLIDOS tTratamiento de sólidos tIngeniería farmacéutica y Mantenimiento II tEquipamiento para salas blancas tMobiliario para laboratorio tEspecial FERIA EMPACK tEnvase y embalaje III tEtiquetado y codificación II tLogística y distribución II tSuplemento Life Sciences Lab NOVIEMBRE- DICIEMBRE Cierre 07-12-2012 tSalas Blancas II tFiltración II tValidaciones y certificaciones II tConsultoría y formación tTecnología de laboratorios II tTratamiento de Aguas II tEnsayos clínicos tSuplemento Life Sciences Lab + información Editor EUGENIO PÉREZ DE LEMA Director comercial MARCOS MUIÑOS DOCAMPO [email protected] Responsable editorial ALEJANDRO GESTEIRA PONCE [email protected] www.farmaindustrial.com OMNIMEDIA S.L. C/ Rosa de Lima 1 bis. Edificio Alba, ofic. 104. 28290 Las Matas (Madrid). Tel: +34 902 36 46 99 Fax +34 91 630 85 95 E-mail: [email protected]. Web: www.grupo-omnimedia.com DELEGACIÓN GALICIA Praza da Constitución 19 1º Dcha. 36800 Redondela, Pontevedra. Tlf 986 191 293. Fax. 916 308 595 GUÍA DE SERVICIOS FARMESPAÑA INDUSTRIAL pone a su disposición la forma más práctica de localizar a sus proveedores organizados por sectores de actividad. Las páginas de servicio más completas con empresas fabricantes de equipos, productos y de servicios para la industria farmacéutica y sectores afines. Infórmese en el teléfono 986 19 04 88 y en nuestra web www.farmaindustrial.com Tarifas 2012 inserción anual Módulo sencillo (55 x 65 mm) Módulo doble (55 x 150 mm) Módulo doble (117,5 x 65 mm) Módulo triple (180 x 65 mm) Datos a cumplimentar en los módulos Razón social Teléfono y fax Domicilio www Distrito/Población mail ASESORÍA Y VALIDACIONES 114 JULIO/AGOSTO12 CONSULTORÍA 550 800 800 1200 euros euros euros euros DESINFECCIÓN FARMESPAÑA INDUSTRIAL ASESORÍA Y VALIDACIONES CONSULTORÍA, INGENIERÍA Y VALIDACIÓN FARMESPAÑA INDUSTRIAL CONSULTORÍA Y VALIDACIONES INGENIERÍA EQUIPAMIENTO PARA LABORATORIO JULIO/AGOSTO12 115 GUÍA DE SERVICIOS CUALIFICACIÓN, VALIDACIÓN Y CALIBRACIÓN ENVASE Y EMBALAJE FILTRACIÓN HIGIENE INDUSTRIAL ETIQUETADO Y CODIFICACIÓN 116 JULIO/AGOSTO12 FARMESPAÑA INDUSTRIAL CONSULTORÍA INSTRUMENTACIÓN DE CONTROL Y MEDIDA FARMESPAÑA INDUSTRIAL INGENIERÍA, SALAS Y EQUIPOS FARMACÉUTICOS LAVADORAS MAQUINARIA JULIO/AGOSTO12 117 GUÍA DE SERVICIOS SALAS LIMPIAS MAQUINARIA DE ENVASADO Y PROCESO 118 JULIO/AGOSTO12 MATERIAL DE LABORATORIO ROBÓTICA FARMESPAÑA INDUSTRIAL SALAS LIMPIAS SALAS LIMPIAS FARMESPAÑA INDUSTRIAL SEGURIDAD INDUSTRIAL JULIO/AGOSTO12 119 GUÍA DE SERVICIOS SALAS LIMPIAS SERVICIOS SUMINISTROS INDUSTRIALES AQUÍ SU PUBLICIDAD POR 800 € / AÑO 120 JULIO/AGOSTO12 FARMESPAÑA INDUSTRIAL VALIDACIONES AQUÍ SU PUBLICIDAD POR 550 € / AÑO SUMINISTROS INDUSTRIALES VALIDACIONES AQUÍ SU PUBLICIDAD POR 800 € / AÑO FARMESPAÑA INDUSTRIAL JULIO/AGOSTO12 121 BOLETÍN ANUNCIANTES SUSCRIPCIÓN DE Cumplimente este Boletín y envíelo por Fax o Correo a OMNIMEDIA S.L. ✓Sí, AD.TECH . . . . . . . . . . . . . . . . .60, 62, 95, 99, 101, 103, 107, Guía de Servicios deseo suscribirme a Farmespaña Industrial, revista profesional de proveedores de la industria farmacéutica y tecnología de laboratorio. AIRFARM . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59 ARAGOGAMMA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 79 ASESORÍA Y VALIDACIÓN, S.L.. . . . . . . .46, 51, 52, 77, 110, Guía de Servicios ✁ Por favor, cumplimente estos datos (EMPRESA o PARTICULAR): EMPRESA Apellidos: Nombre: Cargo: Nombre empresa: CIF: Teléfono: Fax: e-mail: web: Dirección: AZIERTA CONTRACT SCIENTIFIC SUPPORT CONSULTING SL . . . . . . . 52, 78 BEKO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67 BELIMED SAUTER AG . . . . . . . . . . . . . . . . . . . . . . . .96, 103, Guía de Servicios BINDER. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 95 BIOSPAIN . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 BIOTOOLS B&M LABS, S.A. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73 BORNEMANN . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23 CAMPAK. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios CELER SOLUCIONES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 106, 107 CHARLES RIVER . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41 CLEAN CONCEPT . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70, 85, 88 COMPLIANCE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios C.P.: Provincia: CONFECCIONES ANADE . . . . . . . . . . . . . . . . . . . . . . 5, 53, 60, 64, 84, 85, 92 Localidad: CORA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 DARA PHARMACEUTICAL PACKAGING . . . . . Int. Portada, 17, 56, G. Servicios PARTICULAR Apellidos: Nombre: Teléfono: Fax: e-mail: web: Dirección: DB SCHENKER SPAIN-TIR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48, 49, 50 DOMINO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65 NIF: DTC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios ECOFRED . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios ELIS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .69, 92, Guía de Servicios ELUR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Contraportada EMPACK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 EMTE CLEANROOM TECHNOLOGY . . . . . . . . . . . . . . 27, 70, 84, 86, 89, 110 C.P.: Provincia: EXPOSÓLIDOS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 109 Localidad: FIKE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios FILTROS CARTÉS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7, 99, Guía de Servicios PRECIOS SUSCRIPCIÓN 2012 GRIFOLS ENGINEERING S.A . . . . . . . . Portada, 19, 51, 56, 70, 82, 86, 89, 107 Anual 6 números IMAR PACKAGING, S.L. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58 60 Euros (España) 96 Euros (Europa) 160 Euros (Resto del Mundo) INGECLIMA . . . . . . . . . .54, 55, 61, 70, 82, 86, 89, 108, 110, Guía de Servicios Bianual 12 números INGENIERÍA TÉCNICA DE MANTENIMIENTO, S.A. . . . . . . . . . . . . . 72, 84, 89 110 Euros (España) 180 Euros (Europa) 300 Euros (Resto del Mundo) INSTRUMENTACIÓN ANALÍTICA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61 IVA INCLUIDO EN ESPAÑA. GASTOS DE ENVÍO INCLUIDOS. INSTRUMENTOS TESTO . . .49, 56, 58, 67, 91, 96, 102, 111, Guía de Servicios FORMA DE PAGO LLEAL, S.A. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 94, 98, 100, 101, 103, 104, 106 IONISOS IBÉRICA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 79, 81 Talón adjunto: pagadero a OMNIMEDIA S.L. MERCK – MILLIPORE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios Domiciliación Bancaria: Muy Sres. Míos, les ruego que hasta nuevo aviso, atiendan con cargo a mi cuenta/libreta los recibos que presentará OMNIMEDIA S.L. Titular Cuenta/Libreta: Nombre Banco/Caja: Dirección bancaria: C. P.: Localidad: Provincia: CÓDIGO CUENTA CLIENTE · C.C.C. Entidad Oficina DC Número de cuenta METALGAR PLÁSTICOS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48, 57, 76, 78 MOBELMOL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31, Guía de Servicios MONTAJES IGUÑA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios OMNIMEDIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 112, 113 OPERON, S.A. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35, 74, 76, 80 OXOID . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 PANALPINA WORLD TRANSPORT & LOGISTICS . . . . . . . . . . . . 46, 47, 48, 50 PANREAC QUÍMICA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74, 75, 80 PDA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63 PHAMABIOSERV . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53,77 PHARMAINDUSTRIAL INDIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44 PHARMAQUALITY EUROPE. . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios PQE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios Firma Titular: QTI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios QUALIPHARMA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios x Fecha / QUILINOX . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios / ROCHE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33 Transferencia a OMNIMEDIA S.L.: Núm. de cuenta: 0075 1214 81 0600075793 Tarjeta: VISA 4B SARTORIUS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 SCHUNK. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios AMEX Caduca fin de / SERVICIO DE DESARROLLO DEL MEDICAMENTO . . . . . . . . . . . . . . . . . . . 39 STÄUBLI ESPAÑOLA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios Nombre titular: STX . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Interior de Contraportada Nº de tarjeta: TCI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios TDV SL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios Firma Titular: TECHNIP IBERIA, S.A. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71, 72 TECNICA DE FLUIDOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios x Fecha / / TECNICOS EN CALIBRACIÓN Y MONTAJE . . . . . . . . . . . . . .Guía de Servicios TECNOSERVEI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios TISELAB . . . . . . . . . 65, 68, 83, 85, 88, 91, 93, 94, 99, 102, 103, 106, 108, 111 TRADELABOR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . GUIA DE SERVICIOS TREBOL GROUP. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Guía de Servicios OMNIMEDIA S.L. C/ Rosa de Lima, 1 bis · Edif. Alba, of. 104. @28290 Las Matas - Madrid T+1@'= /3,4-7:54423/2+*/')42@<<<,'72'/3*:897/'1)42 VALIDATEC. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .54, 111, Guía de Servicios VESTILAB CLEAN ROOM CONTROL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54, 62, 66, 68, 81, 82, 85, 87, 88, 90, 91, 92, 93, 94, Guía de Servicios WEILER ENGINEERING . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60