Exámenes - IES Rey Pastor
Anuncio

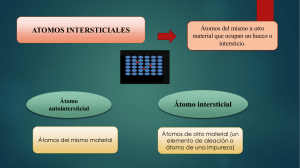
Examen de Física y Química Octubre de 2010 Nombre: Grupo: 4ºB 1.- Completa la tabla con los elementos de los grupos 1, 2, 13, 14, 15, 16, 17 y 18. H Sc Y La* Ac* * Ti Zr Hf Rf V Nb Ta Db Cr Mo W Sg Mn Tc Re Bh Fe Ru Os Hs Co Rh Ir Mt Ni Pd Pt Ds Cu Ag Au Rg Zn Cd Hg Uub X Uuq X Uuh X X 2.- Contesta a las siguientes preguntas: a) Escribe la estructura electrónica de los átomos de los elementos cuyos números atómicos son 15, 20 y 34. b) ¿En qué grupo y período del sistema periódico está situado cada elemento? ¿Por qué?¿Podrías identificarlos? (2 puntos) 3. Indica si son ciertas o falsas las siguientes afirmaciones y por qué: a) b) c) d) El CO2 tiene un punto de ebullición más alto que el KBr. ElCl2 sólido es más frágil que el grafito. Las sustancias covalentes y las iónicas son igualmente solubles en agua. Los metales y las sustancias covalentes tienen altos puntos de fusión. 4.- Uno de los iones del átomo de Selenio tiene como identificación: la distribución de sus electrones por capas. 75 33 As 3+ . Escribe 5.- Los átomos de Bromo y de Berilio forman un determinado tipo de enlace. Indica cuál es, dibuja la formación del enlace y escribe su fórmula. 6.- Los átomos de Carbono y de Azufre forman un determinado tipo de enlace. Indica cuál es, dibuja la formación del enlace y su fórmula. 7.- El átomo de un determinado elemento X tiene Z=29 y la siguiente configuración electrónica: 1s2 2s2 2p6 3s2 3p6, 4s2, 3d7. ¿De qué elemento se trata?¿Es un átomo neutro o está ionizado? 8.- Indica qué tipo de enlace forman las siguientes sustancias: H2, Sr, AlCl3, Kr y CH4 9.- Indica si las siguientes sustancias se encuentran formando átomos aislados, moléculas o cristales: H2, Sr, AlCl3, Kr y CH4