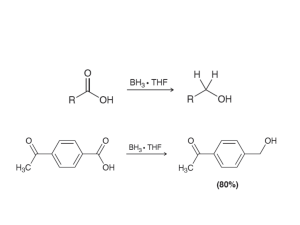
formulación química inorgánica
Anuncio

FORMULACIÓN QUÍMICA INORGÁNICA 1. VALENCIAS DE LOS ELEMENTOS QUÍMICOS MÁS CONOCIDOS Se entiende que las valencias con signo negativo se dan frente a elementos electropositivos y las valencias con signo positivo se dan frente a elementos electronegativos. 1.1. NO METALES O -2 H -1, +1 HALÓGENOS F -1 Cl, Br, I -1, +1, +3, +5, +7 ANFÍGENOS S, Se, Te -2, +2, +4, +6 NITROGENOIDEOS N -3, +1, +2, +3, +4, +5 P, As, Sb -3, +1, +3, +5 Bi, B -3, +3, +5 Cu, Hg +1, +2 Cr +2, +3, +6 Au +1, +3 Mn +2, +3, +4, +6, +7 CARBONOIDEOS C, Si -4, +2, +4 1.2. METALES Li, Na, K, Rb, Cs, Fr, Ag +1 Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd +2 Fe, Co, Ni +2, +3 Al +3 Sn, Pb, Pt +2, +4 2. COMPUESTOS BINARIOS 2.1. FÓRMULA En primer lugar se coloca el elemento electropositivo (catión) y en segundo lugar el elemento electronegativo (anión). 2.2. NOMBRE El elemento más electronegativo o no metal se nombra primero y terminado en –URO, por tanto los compuestos binarios se nombran en orden inverso a como aparecen en la fórmula. El nombre debe indicar de forma precisa y sin ambigüedades el número de átomos de cada elemento que hay en la molécula. HCl Cloruro de hidrógeno MgCl₂ Cloruro de magnesio (no es necesario indicar que hay dos átomos de cloro puesto que la única valencia del magnesio es +2 y, la única valencia negativa del Cl es -1) FeCl₃ Tricloruro de hierro (el hierro tiene valencias +2 y +3 así que hay que indicar los cloros que hay en la molécula) Actualmente hay tres métodos diferentes para nombrar las moléculas: Nomenclatura sistemática: (la nomenclatura más usual según la IUPAC) se usan los prefijos mono-, di-, tri-, tetra-, penta-, hexa-, hepta-… según el número de átomos que tenga la molécula. El prefijo mono- no se usa casi nunca para el segundo elemento. CO Monóxido de carbono Fe₂O₃ Trióxido de dihierro Nomenclatura de Stock: se expresa el número de oxidación del elemento más electropositivo en números romanos entre paréntesis. Si la valencia es única no se expresa. CO Óxido de carbono (II) Fe₂O₃ Óxido de hierro (III) Nomenclatura tradicional: consiste en añadir los prefijos PER- e HIPO- y los sufijos –ICO y – OSO según la valencia del elemento. Su uso sólo es admitido en ácidos oxoácidos y en algunas excepciones por tanto apenas vamos a formular con ella, sólo en las excepciones en que su uso se permita. 2.3. COMPUESTOS BINARIOS ÓXIDOS: Es la combinación de cualquier elemento metálico y no metálico con oxígeno. Se formulan poniendo primero el elemento del que se desea formular y, después el oxígeno, con los sufijos pertinentes. Para nombrarlos: Nomenclatura sistemática: Cl₂O₇ Heptaóxido de dicloro FeO Monóxido de hierro Nomenclatura de Stock: Cl₂O₇ Óxido de cloro (VII) FeO Óxido de hierro (II) El H₂O es una excepción, siempre se va a nombrar como agua. 2.4. PERÓXIDOS Es la combinación de un metal y el O combinado de la forma . Para nombrarlos: Nomenclatura sistemática: Igual que los óxidos. Nomenclatura tradicional: Na₂O₂ Peróxido de sodio H₂O₂ Agua oxigenada Nomenclatura de Stock: Na₂O₂ Peróxido de sodio H₂O₂ Agua oxigenada 2.5. HIDRUROS METÁLICOS: Compuestos por uno o más hidrógenos con valencia negativa y uno o más átomos de un elemento metálico. El H siempre se pone al final de la fórmula. Nomenclatura sistemática: AgH Hidruro de plata FeH₃ Trihidruro de hierro Nomenclatura de Stock: AgH Hidruro de plata FeH₃ Hidruro de hierro (III) 2.6. HIDRUROS NO METÁLICOS Compuestos por uno o más hidrógenos y uno o más átomos de un elemento no metálico. Halógenos y anfígenos: (hidrácidos) El H lleva valencia positiva, por tanto se escribe primero en la fórmula y el no metal lleva valencia negativa. Nomenclatura tradicional: HF Ácido fluorhídrico HCl Ácido clorhídrico H₂S Ácido sulfhídrico Nomenclatura sistemática HF Fluoruro de hidrógeno HCl Cloruro de hidrógeno H₂S Sulfuro de hidrógeno Carbonoideos y nitrogenoideos: El H lleva valencia positiva, pero se escribe detrás. Nomenclatura tradicional: CH₄ Metano NH₃ Amoníaco SiH₄ Silano Nomenclatura sistemática: CH₄ Metano NH₃ Amoníaco SiH₄ Silano 2.7. SALES BINARIAS Es la combinación de átomos metálicos y no metálicos. El no metal se combina con valencia negativa y se escribe detrás. Para nombrarlos: Nomenclatura sistemática: FeS Sulfuro de hierro FeCl₃ Tricloruro de hierro NaF Fluoruro de sodio Nomenclatura de Stock FeS Sulfuro de hierro (II) FeCl₃ Cloruro de hierro (III) NaF Fluoruro de sodio 3. COMPUESTOS TERNARIOS 3.1. HIDRÓXIDOS O BASES Compuestos formados por un metal y un OH⁻¹. Nomenclatura sistemática: NaOH Hidróxido de sodio Fe(OH)₃ Trihidróxido de hierro Nomenclatura de Stock: NaOH Hidróxido de sodio Fe(OH)₃ Hidróxido de hierro (III) 3.2. ÁCIDOS OXOÁCIDOS Se componen de: H⁺ + (no metal)⁺ + . Para estos compuestos la nomenclatura más utilizada es la nomenclatura tradicional, esta utiliza los prefijos y sufijos ‘’hipo- -oso’’, ‘’-oso’’, ‘’-ico’’ y ‘’per- -ico’’ para indicar la valencia del elemento no metálico. HALÓGENOS: HClO Ácido hipocloroso (Valencia cloro = +1) HClO₂ Ácido cloroso (V cloro = +3) HClO₃ Ácido clórico (V cloro = +5) HClO₄ Ácido perclórico (V cloro = +7) Los elementos Br y I tienen las mismas fórmulas de ácidos que el Cl. ANFÍGENOS: H₂SO₂ Ácido hiposulfuroso (V azufre = 2) H₂SO₃ Ácido sulfuroso (V azufre = 4) H₂SO₄ Ácido sulfúrico (V azufre = 6) Los elementos Se y Te tienen las mismas fórmulas de ácidos que el S. NITROGENOIDEOS: H₃BO₃ Ácido bórico (V boro = 3) HNO₂ Ácido nitroso (V nitrógeno = 3) HNO₃ Ácido nítrico (V nitrógeno = 5) HPO₂ Ácido metafosforoso (V fósforo = 3) H₄PO₅ Ácido pirofosforoso (V fósforo = 3) H₃PO₃ Ácido (orto)fosforoso (V fósforo = 3) HPO₃ (V fósforo = 5 Ácido metafosforoso H₄P₂O₇ Ácido pirofosfórico H₃PO₄ Ácido (orto)fosfórico (V fósforo = 5) (V fósforo = 5) Los elementos As, Sb tienen las mismas fórmulas de ácidos que el P. CARBONOIDEOS: H₂CO₃ Ácido carbónico (V carbono = 4) H₄SiO₄ Ácido silícico (V silicio = 4) EXCEPCIONES DE METALES: H₂Cr₂O₇ Ácido pirocrómico H₂CrO₄ Ácido crómico (V cromo = 6) (V cromo = 6) HMnO₄ Ácido permangánico H₂MnO₄ Ácido mangánico (V manganeso = 7) (V manganeso =7) Esta es una lista de los ácidos oxoácidos más comunes. Para nombrarlos con las otras dos nomenclaturas se haría de la siguiente manera: Nomenclatura sistemática: H₂Cr₂O₇ Heptaoxodicromato (VI) de hidrógeno H₃PO₄ Tetraoxofosfato (V) de hidrógeno HNO₂ Dioxonitrato (III) de hidrógeno Nomenclatura de Stock: H₂Cr₂O₇ Ácido heptaoxodicrómico (VI) H₃PO₄ Ácido tetraoxofosfórico (V) HNO₂ Ácido dioxonítrico (III) 3.3. SALES OXISALES Se sustituye el H por un metal, para nombrarlo se hace el cambio de sufijos OSO por ITO e ICO por ATO en el no metal: OSO -> ITO ICO -> ATO Existe la regla nemotécnica para ayudar con estos sufijos ‘’cuando el OSO toca el pITO perICO toca el silbATO’’. Para estos compuestos, al contrario que para los oxoácidos de los que vienen, la nomenclatura tradicional no está aceptada por la IUPAC. Nomenclatura de Stock: Fe(SO₄) Sulfato de hierro (II) Fe₃(SO₄)₂ Sulfato de hierro (III) AgNO₃ Nitrato de plata Nomenclatura sistemática: Fe(SO₄) Tetraoxosulfato de hierro Fe₃(SO₄)₂ Tetraoxosulfato de dihierro AgNO₃ Trioxinitrato de plata 4. IONES POLIATÓMICOS 4.1. ANIONES Se trata de átomos o moléculas con carga negativa, suelen ser sales oxisales que han perdido algún hidrógeno. La carga negativa que tienen la tomaremos como la valencia del compuesto. 4.2. CATIONES Son moléculas o átomos con carga positiva. Consideraremos la carga de estos como su valencia. H₃O⁺ Ión hidronio NH₄⁺ Ión amonio