Problemas de hemostasia en anestesiología. (Segunda parte)
Anuncio

Problemas de hemostasia en
anestesiología (segunda parte)
Rev. Arg. Anest (2001), 59, 1: 67-76
Artículo de educación continua
Dirección: Dr. Jaime Wikinski
Problemas de hemostasia en
anestesiología. (Segunda parte)
Dres. Daniel DAgostino
Héctor Papagni
Fernando Cacheiro
Hernán Allegrotti
Problemas de coagulación en obstetricia
s
Cambios protrombóticos que
ocurren durante el embarazo
normal
Durante el embarazo, parto y puerperio, puede ocurrir que el anestesiólogo
deba enfrentarse a una serie de cuadros que tienen un denominador común:
hemorragia y coagulopatía. Estos cuadros pueden adoptar formas clínicas leves, moderadas o graves, y según persistan o no las causas desencadenantes
podrán desarrollar un cuadro de gravedad como lo es la coagulación
intravascular diseminada (CID). Son complejos los mecanismos que mantienen
el equilibrio de la hemostasia, cuya alteración no siempre tiene una clara expresión sintomática. El anestesiólogo clínico debe estar atento a la aparición
solapada de signos que puedan revelar la evolución desfavorable de la hemorragia del parto y el desarrollo insidioso de CID. Es sabido que los cambios en
favor de la trombosis generados durante el embarazo tienen por objeto prevenir y neutralizar las condiciones que precipitan la hemorragia del período parto-puerperio, y de su resolución dependerá la tendencia posterior del sistema
hemostático. El denominado estado de hipercoagulación prepara a la gestante
para el momento de la separación placentaria. La disminución de plaquetas,
fibrinógeno, factor VIII e hiperfibrinolisis observada durante el período postparto
representa una coagulación intravascular, caracterizada como un fenómeno
local, inestable y fácilmente vulnerable. Las condiciones que perpetúan este
fenómeno explicarían de por sí las complicaciones obstétricas asociadas a la
CID.
s
Causas que pueden desequilibrar
el sistema hemostático durante el
período embarazo-parto-puerperio
s
- El - de los factores de la coagulación, en especial del fibrinógeno
- Disminución de la actividad del sistema fibrinolítico (¯ de la actividad del
plasminógeno)
- Descenso de la proteína C y cofactores
Ver Figura 1
Introducción
DDP
Muerte fetal
intrauterina
Pre-eclampsia
V. extrínsica
V. intrínsica
Embolia liquido
amniótico
Endotoxinas
Trombina
Fibrinógeno
Fibrina
Fig. 1. Mecanismos de Activación de la Coagulación en los diferentes procesos obstétricos
asociados a CID
Revista Argentina de Anestesiología 2001
| 67
Artículo de educación continua
- Desprendimiento prematuro de placenta (DPP). Hematoma retroplacentario.
Placenta previa. - Restos placentarios
- Embolia de líquido amniótico
- Muerte fetal intrauterina
- Aborto séptico
- Preeclampsia-eclampsia
- Trastornos congénitos: Hipo y disfibrinogenemia
Hemofilias
Trombopatías congénitas
Embolia del líquido amniótico
Uno de los cuadros más dramáticos de la anestesia obstétrica relacionado a
síndromes hemorrágicos es la embolia de líquido amniótico (ELA). Su incidencia oscila entre 1/50.000 y 1/80.000 partos. Representa una de las cinco causas más frecuentes de muerte materna. Se produce por el paso de líquido
amniótico a la circulación materna (venas uterinas ® vena cava).
68 |
Volumen 59 / Número 1
s
Diagnóstico
s
Lugares de presentación del
síndrome hemorrágico
- Insuficiencia ventricular izquierda con edema pulmonar y posterior desarrollo de CID.
Los leucotrienos, sustancias que se encuentran en el líquido amniótico, junto a la intensa hipoxemia, parecen ser los responsables de la depresión
miocárdica.
El edema pulmonar podría deberse a una lesión endotelial con aumento de
la permeabilidad capilar (provocada por los leucotrienos, plaquetas y leucocitos)
y a la disminución de la presión oncótica propia del embarazo. La CID, en este
caso, es secundaria al síndrome de shock y a la liberación de sustancias
tromboplásticas contenidas en el líquido amniótico.
s
Manifestaciones clínicas
- Paso del líquido amniótico a la circulación sistémica provocando una severa
hipertensión pulmonar que da lugar a insuficiencia ventricular derecha, cor
pulmonare, falla ventricular izquierda y shock.
La vasoconstricción pulmonar altera la ventilación-perfusión (V/Q) provocando
marcada hipoxemia y acidosis, contribuyendo así al mantenimiento del
vasoespasmo pulmonar.
s
Segunda fase del desarrollo
Existen varios factores que favorecen el desarrollo de la ELA, entre ellos la
edad, gestación múltiple, hipertonía uterina y desprendimiento de placenta.
Este síndrome se desarrolla en dos fases, a saber:
s
Primera fase del desarrollo
- rotura de membranas
- apertura de las venas uterinas
- gradiente de presión entre la cavidad y las venas uterinas
s
Factores que favorecen su
desarrollo
s
Circunstancias concurrentes
necesarias
51%
27%
12%
12%
se asocia a insuficiencia respiratoria severa
en forma de shock
como síndrome hematológico
con alteraciones neurológicas
Se presenta a nivel de sitios de punción, mucosas, zona operatoria, nivel
uterino (durante el parto).
ECG: S1, Q3, T3. P pulmonar
Catéter Swan-Ganz: PP y PW -
Problemas de hemostasia en
anestesiología (segunda parte)
pO2 ¯ de 80 mmHg
Perfil de coagulación normal al inicio y CID posterior
El sangrado uterino tras el nacimiento se controlará mediante masaje uterino, administración de ocitócicos, administración de ergotamínicos.
Las prostaglandinas están contraindicadas por su acción broncoconstrictora y
por ser desencadenantes de hipertensión pulmonar. Ante un cuadro de CID debe
tenerse en cuenta la existencia de una marcada actividad fibrinolítica como respuesta secundaria. El tratamiento consistirá en restaurar el equilibrio hemostático
mediante la administración de factores de la coagulación, plasma fresco,
crioprecipitados y plaquetas, según establezcan las pruebas de coagulación.
Debido al intervalo libre entre el comienzo del cuadro y el inicio de la
coagulopatía, se ha planteado la posibilidad del tratamiento profiláctico con
heparina EV. Si hay evidencia de sangrado activo, se normalizará primero la
coagulación con tratamiento sustitutivo y posteriormente se suministrará
heparina. Los agentes fibrinolíticos como el ácido epsilon amino caproico (EACA)
estarían indicados solo si no hay respuesta a la terapia sustitutiva. Ni el EACA
ni la aprotinina presentan evidencias claras de su utilidad en el tratamiento de
la embolia de líquido amniótico.
s
Consideraciones anestésicas
s
Tratamiento del sangrado
Si ocurre una inexplicable cianosis y un desencadenamiento de shock durante el parto, deberá considerarse la embolia de líquido amniótico. Frente a esta
presunción deberán implementarse rápidamente las medidas de soporte y reanimación, reemplazo de volumen y tratamiento de la coagulopatía.
Está contraindicada la anestesia locoregional. La anestesia general debe administrarse con suma cautela en caso de cesárea. El tipo y dosis de los agentes
anestésicos dependerá de la condición de la paciente y su estado hemodinámico.
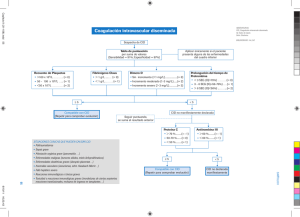
Coagulación intravascular diseminada (CID)
El síndrome de CID es un estado de activación de la coagulación que da a
lugar a un cuadro severo de hipercoagulabilidad asociado a hiperfibrinolisis.
Es característico el rápido consumo de plaquetas y factores de la coagulación
que paralelamente se van depositando en la microcirculación provocando alteraciones del flujo.
- Activación de la vía intrínseca por vía endotelial. En este grupo se encuadran
la preeclampsia-eclampsia.
- Activación de la vía extrínseca por lesión tisular (tromboplastina). En este
grupo se encuadran el desprendimiento prematuro de placenta y la muerte
fetal intraparto.
- Activación de la vía final común por el factor X. En algunas ocasiones la activación de la coagulación puede iniciarse a más de un nivel, como ocurre
en el embolismo de líquido amniótico.
s
Generación de trombina
La CID está causada siempre por un proceso o enfermedad subyacente que
es el que activa el mecanismo de la coagulación. (Figura 2)
s
Mecanismos de activación de la
CID en obstetricia
s
Fisiopatología
La activación de la coagulación tendrá como consecuencia la generación de
trombina, la cual:
- rompe las moléculas de fibrinógeno, dando lugar a monómeros de fibrina.
Estos pueden ser extraidos de la microcirculación por el sistema reticuloendotelial, y polimerizar ocluyendo pequeños vasos de la microcirculación.
Revista Argentina de Anestesiología 2001
| 69
Artículo de educación continua
Activadores
Formación IV
Fibrina
Hemorragia aguda
CID
Consumo
PDF
Fibrinolisis
Oclusión vascular
Trombocitopenia
Inhibición de la
Coagulación
Déficit F.
Plasmáticos
Coagulopatía
Shock
Hipovolémico
Fig. 2.- Fisiopatologia de la coagulación intravascular diseminada (CID)
- desencadena la activación de los factores V, VIII y XIII, consumiéndo los mismos y facilitando la hemorragia.
- induce una rápida agregación plaquetaria, provocando trombocitopenia.
70 |
Volumen 59 / Número 1
Se produce en el desprendimiento de placenta, embolismo de líquido
amniótico y aborto séptico. Al instalarse el cuadro, se presenta:
- Sangrado activo: hematuria, melena, puntos de punción, etc.
- Shock secundario: debido a hemorragia y vasodilatación
- Insuficiencia renal aguda: causado por microtrombos
- Sindrome de dificultad respiratoria del adulto: por microtrombos
- Disminución de los factores de la coagulación y plaquetas
- Activación del sistema fibrinolítico
s
Crónica
La forma de presentación de la CID variará según cuál sea el proceso que
desencadene el cuadro.
s
Aguda
Es el mecanismo de protección contra la lesión isquémica de los órganos
afectados. La producción de plasmina en la CID producirá mayor liberación de
plasminógeno activado por el endotelio vascular donde se deposita la fibrina.
La tendencia a la hemorragia en la CID se produce por:
- degradación del fibrinógeno y fibrina por la plasmina
- consumo de factores y plaquetas
- efecto anticoagulante de los PDF
s
Evolución de la CID
Los trombos se depositan a nivel de la microcirculación. La distribución y
severidad de la trombosis no es homogénea, siendo el pulmón y los riñones
los órganos más afectados. Otros factores que van a tener un papel importante en la severidad y formación de trombos son:
- bloqueo del SRE
- disminución de inhibidores de la coagulación
- alteración del tono vasomotor
- hepatopatías
- inhibición de la fibrinolisis
s
Fibrinolisis secundaria
s
Formación de microtrombos en la
circulación
Se produce en la eclampsia y en la retención del feto muerto. En esta forma
de CID la generación de trombina es más lenta por lo que el consumo de fac-
Problemas de hemostasia en
anestesiología (segunda parte)
tores se contrarresta con una mayor producción. En la CID crónica las manifestaciones hemorrágicas no serán muy evidentes. El diagnóstico se basará en:
- Pruebas de laboratorio
- Sospecha clínica
- Evidencia de fibrinolisis (PDF)
- Aumento de la actividad trombínica y el complejo trombina-antitrombina
s
Pruebas de laboratorio en la CID
Tiempo de protrombina
Tiempo parcial de tromboplastina
Tiempo de trombina
Fibrinógeno
Plaquetas
PDF
Fibrinopéptido A
Complejo trombina-antitrombina III
s
Tratamiento de la CID en
obstetricia
Aguda
Crónica
---¯¯
¯¯
----
N¯oN¯oN¯oN¯oN¯o-
La CID es siempre secundaria a un proceso patológico que es al que debe
dirigirse inicialmente el tratamiento. En la CID desencadenada por procesos
obstétricos, la evacuación del contenido uterino será prioritaria. Ante una
coagulopatía será preferible la vía vaginal a la abdominal, ya que ésta significa
un mayor riesgo de sangrado.
Restablecimiento de la volemia: deberá hacerse bajo control de parámetros
hemodinámicos, mediante concentrados de hematíes y soluciones coloidales
evitando la dilución.
Tratamiento sustitutivo: se corregirán los déficit de factores mediante:
- PFC a razón de 20 ml/kg
- Crioprecipitados 1 unidad/10 kg
- Plaquetas 1 unidad /10 kg
- Antitrombina III si el Quick es inferior a 30%
Son necesarias las siguientes correcciones:
- Fibrinógeno, cuando sea inferior a 100 mg%
- Plaquetas, cuando su valor sea inferior a 60.000
La mayoría de las CID de causa obstétrica se solucionan con la adopción de
estas medidas. En caso de que esta terapia no sea eficaz se administrará heparina
(5-15 UI/kg/hora) con el fin de disminuir la actividad trombínica. En caso de
persistir una fibrinolisis residual, se administrarán antifibrinolíticos como la
aprotinina.
Problemas de coagulación en cirugía cardiovascular
Está ampliamente demostrado que los factores que aumentan el sangrado
perioperatorio prolongan la estadía en la sala de recuperación y el tiempo
hospitalario total, incrementando la morbilidad de esta población. Son bien
conocidos, además, los riesgos infecciosos e inmunológicos a los cuales se
someten los pacientes transfundidos con sangre alogénica. Por ello es fácil
entender la preocupación por detectar precozmente aquellos factores que
incrementan el riesgo de sangrado perioperatorio. Si bien numerosos estudios
se han focalizado en el análisis de las variables relacionadas con el sangrado y
reposición de glóbulos rojos, no hay demasiados trabajos que se ocupen del
Revista Argentina de Anestesiología 2001
| 71
Artículo de educación continua
déficit clínico de la hemostasia. Existe razonable consenso en que más del 50%
de los casos de sangrado postoperatorio obedece a un causal quirúrgico. No
obstante, son empíricamente tratados con componentes de banco. Es frecuente
que se trate la hemorragia sin profundizar en el diagnóstico etiológico.
En cirugía cardiovascular, la circulación extracorpórea (CEC) afecta
significativamente el natural equilibrio entre los componentes de la hemostasia,
comenzando a mostrarse desde la finalización misma del by pass y durante el
período postoperatorio. Es de relevancia terapéutica conocer los factores
etiológicos que causan el sangrado en cirugía cardiovascular (CCV).
s
Etiología del sangrado
microvascular post by-pass
-
Alteraciones cualitativas de las plaquetas
Trombocitopenia
Deficiencia de los factores de la coagulación
Rebrote de heparina
Heparina residual
Exceso de potamina
Hipotermia
Fibrinolisis
Coagulación intavascular diseminada
Estas causas con frecuencia están combinadas entre sí y coexisten con otros
procesos fisiopatológicos responsables de favorecer el sangrado.
s
Fisiopatología del sangrado
Con fines didácticos podemos clasificar el sangrado desde un punto de vista
fisiopatológico, como sigue:
Hemodilución
Activación
Consumo
s
Alteración de las plaquetas
{
{
{
Cebado del by pass
Volumen excesivo de cardioplejía
Uso excesivo del cell saver
Por contacto con el circuito
Por el pericardio
Por el mecanismo fibrinolítico
Mediado por trombina
Mediado por plasmina
Activación mecánica por los componentes del circuito
La utilización del by pass resulta en una disfunción plaquetaria reversible,
objetivable por la prolongación del tiempo de coagulación y por una reducción en la producción en vivo en la síntesis de tromboxan. La prolongación
en el tiempo de coagulación es reversible dentro de las 24 a 72 horas del
postoperatorio y guarda relación con la duración de la CEC y el nivel de hipotermia utilizado. El tiempo de coagulación a las 3 horas de la salida de la CEC
puede ser predictivo de sangrado postoperatorio.
El mecanismo de disfunción plaquetaria durante y después de la CEC no ha
sido todavía enteramente comprendido, y sigue generando controversia. Está
claro que el contacto de la plaqueta con el circuito extracorpóreo incentiva su
estimulación, degranulación y la disminución del número dentro de la circulación. Este concepto ha llevado a especular sobre el efecto que el by pass ejerce
sobre la membrana plaquetaria, y en especial, sobre la pérdida de sus receptores responsables de la adhesión y agregación. Recientes estudios realizados con
técnicas sofisticadas (citometría de flujo), revelan que los receptores plaquetarios
72 |
Volumen 59 / Número 1
Problemas de hemostasia en
anestesiología (segunda parte)
durante la circulación extracorpórea estarían intactos. Estos hallazgos llevarían
a pensar que la disfunción podría atribuirse a otros factores, como la hipotermia o la heparina, o al aumento de la actividad fibrinolítica.
En la actualidad, la estrategia para reducir el sangrado por disfunción plaquetaria está dirigida a evitar la hipotermia, el exceso de heparina y el uso de drogas
antifibrinolíticas.
En la Figura 3 están relacionados los mecanismos enzimáticos de disfunción
plaquetaria durante el by pass.
Es bien conocido que la circulación extracorpórea afecta el delicado mecanismo de la hemostasia al estimular una muy compleja respuesta enzimática que
guarda estrecha relación con el tiempo de circulación. Estas respuestas son:
- coagulación
- hiperfibrinolisis
- inflamación
Algunas reacciones enzimáticas se repiten y participan en los tres mecanismos,
pero desde un punto de vista didáctico conviene separarlos.
La Figura 4 muestra la activación de la coagulación.
La Figura 5 muestra el estímulo de la fibrinolisis.
La Figura 6 muestra la respuesta de inflamación.
s
Anticoagulación en cirugía
cardiovascular
s
Incidencia de la CEC sobre la
hemostasia
La anticoagulación es primordial en cirugías con circulación extracorpórea. Esto
pudo lograrse con el descubrimiento de la heparina en 1916. En 1953 se realizó
CEC
XII
Kallicreína
Plasmina
Trombina
Desgranula plaq
Desdobla GP 1B
Fig. 3.- En By Pass
■
■
■
■
■
Activ de XII , XI , HMWKinin , Precalicreína
Hipotermia (cardioplejía)
F Tisular VIIa (más reciente)
F Procoag durante la hemólisis del GR
Tromboplastina Tisular (pulmón y pericardio)
Fig. 4.- Activación de la Coagulación en By Pass
Revista Argentina de Anestesiología 2001
| 73
Artículo de educación continua
F Contacto , XII , Trombina
■ Hipotermia
■ tPA
■ Heparina - Protamina
■ Elastasa (leucocitos)
■ C5a C3a (activado x contacto)
■
Fig. 5.- Hiperfibrinolisis en By Pass
F contacto
By Pass
Protamina
Kalicreína
Leucocitos (polimorfo)
Plaquetas
C5a C3a
Fig. 6.- Respuesta Inflamatoria en By Pass
la primera cirugía cardíaca con CEC utilizando heparina para la anticoagulación.
La heparina es un polisacárido residente en pulmones, hígado y mucosa intestinal de mamíferos, de fuerte composición ácida y cuyo efecto anticoagulante se
debe a su afinidad con la antitrombina III, potenciando el bloqueo de la trombina.
Si bien las heparinas extraídas del intestino del cerdo y pulmón de vaca han sido
ampliamente utilizadas, se reconoce que la segunda fuente (pulmón) tendría
ciertas ventajas al provocar menor incidencia de sangrado postoperatorio. Debe
tenerse presente que las distintas preparaciones de heparina tienen variable actividad anticoagulante a pesar de que su peso en miligramos sea el mismo. La
referencia en unidades internacionales tampoco se correlaciona exactamente con
los efectos clínicos.
Uno de los efectos adversos de mayor relevancia clínica de la heparina es la
inducción de Trombocitopenia mediada por mecanismos inmunológicos.
74 |
Volumen 59 / Número 1
s
Resistencia a la heparina
También denominada taquifilaxia, suele definirse como la necesidad de suministrar dosis crecientes para obtener una anticoagulación adecuada durante el
by pass. La causa más frecuente es el déficit cuantitativo o cualitativo de
antitrombina III. Otras causas son:
- Deficiencia congénita de ATT III
- Terapia con heparina
- Trombocitosis >700.000/mm3
- Síndrome de hipereosinofilia
- Aneurisma ventricular
- Autotransfusión
Problemas de hemostasia en
anestesiología (segunda parte)
En los raros casos en que la heparina esté contraindicada puede utilizarse:
- Ancrod: es un veneno que lisa el fibrinógeno. Requiere una preparación previa mínima de 12 horas. Para revertir sus efectos requiere suministrar
crioprecipitados. Eleva el riesgo de sangrado PO.
- Hirudin: inhibe la Trombina sin requerir ATT III. Tiene una vida media de 1 hora.
El KPTT correlaciona bien con el nivel de anticoagulación. Droga promisoria,
de síntesis genética. Puede convertirse en alternativa en el corto plazo.
- Heparinas de bajo peso molecular (LMWH). Comparada con las heparinas corrientes tienen:
molécula de cadena corta, inhibición directa de F Xa y escaso efecto sobre el
F II, menor afinidad por las plaquetas, vida media más prolongada que la heparina estándar, menor incidencia de sangrado
Este fenómeno puede presentarse varias horas después de la reversión de la
heparina con protamina una vez finalizado el by pass. Se explica por la retardada liberación de heparina previamente secuestrada en el sistema reticuloendotelial de los tejidos y que se diagnostica por la prolongación del tiempo de
coagulación activado (TCA). Se trata con dosis adicionales de protamina calculadas en base al TCA. No olvidar que el exceso de protamina tiene efectos
anticoagulantes.
s
Hemostasia en el recién nacido
s
Rebrote de heparina
El recién nacido tiene mayor facilidad para el sangrado en el período perioperatorio por los motivos siguientes:
- déficit de vitamina K
- plaquetas anormales (inmaduras)
- fragilidad vascular
El paciente cianótico, prematuro y de bajo peso que va a ser sometido a la
corrección de un defecto cardíaco congénito, está especialmente expuesto al
sangrado. En esta población las plaquetas son muy sensibles a la hipotermia y a
la disfunción causada por heparina. También es mayor la incidencia de rebrote
y reacciones alérgicas. Los factores de la coagulación tienen diferentes valores
comparados con los de los adultos, y no es infrecuente que los Factores K dependientes desciendan al 50% de los valores normales. El fibrinógeno del recién
nacido tiene la mitad de la vida media que el del adulto, factor que lo condiciona negativamente frente a cualquier proceso que acelere la fibrinolisis. Los valores de ATT III suelen ser bajos, lo cual debe tenerse presente en casos de resistencia a la heparina. La ATT III suele descender en caso de hiperbilirubinemia. En
oposición a lo anterior, el descenso de las paraproteínas (C y S) favorecen la actividad procoagulante.
En los períodos prolongados de la CEC, en el RN, es donde se expresan los
mayores desequilibrios de la hemostasia; fácil de explicar por los mecanismos
inflamatorios y fibrinolíticos ya mencionados.
s
Conclusiones
- Los trastornos de la hemostasia en la cirugía cardiovascular tienen su causal
primario en la CEC.
- Los mecanismos fisiopatológicos involucrados son: inflamación, hiperfibrinolisis
y estímulo de la cascada de la coagulación.
- No está claro el mecanismo por el cual las plaquetas sufren trastornos
disfuncionales reversibles durante la CEC.
- La hipotermia y la heparina afectan la plaqueta y predisponen al sangrado.
- El rebrote de heparina y la taquifilaxia aumentan la incidencia de sangrado.
- El déficit de los factores vitamina K dependientes y la inmadurez de la plaqueta
justifican con frecuencia los trastornos en la hemostasia del recién nacido.
Revista Argentina de Anestesiología 2001
| 75
Artículo de educación continua
- Las drogas antifibrinolíticas son probadamente efectivas en disminuir el sangrado, pero solo cuando el trastorno primario es la hiperfibrinolisis.
- No es recomendable la corrección empírica con hemoderivados sin el diagnóstico previo de la coagulopatía en curso.
- La aprotinina resulta ligeramente superior en disminuir el sangrado si se la
compara con el EACA, pero para su indicación debe tomarse en cuenta su costo/
beneficio y la posibilidad latente de generar reacciones de hipersensibilidad.
La tercera parte de este artículo (Hemostasia en cirugía por especialidades)
aparecerá en el volumen 59, nº 2. Este trabajo se completará con un test de
múltiple choice que otorgará puntaje para la certificación/recertificación.
Dirección Postal: Dr. Daniel DAgostino.
E-mail: [email protected]
76 |
Volumen 59 / Número 1