Información del Documento Original
Anuncio

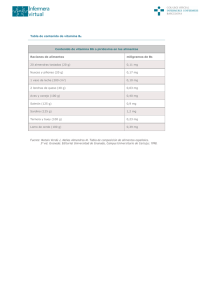
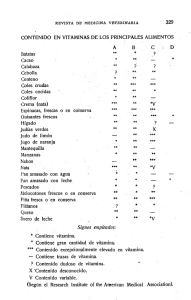
Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2014015771 DE 29 de Mayo de 2014 Por la cual se concede un Registro Sanitario El Asesor de la Dirección General con asignación de funciones de la Dirección de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, en ejercicio de las facultades legales conferidas en el Decreto 2078 de 2012, Decreto 3249 de 2006, Decreto 3863 de 2008 y Ley 1437 de 2011. ANTECEDENTES oc um en to Que mediante escrito número 2014021481 de fecha 27/02/2014, el SEÑOR VICTOR HUGO OTERO COBO, actuando en calidad de representante legal , solicita concesión del Registro Sanitario para el producto SUPLEMENTO DIETARIO EN JARABE CON BITAMINA B1,B2,B6, VITAMINA C, NIACINA, VITAMINA A, VITAMINA E, HIERRO, ZINC, OMEGA 3, EXTRACTO DE MALTA, ACIDO FOLICO, BIOTINA, BITAMINA B12 Y MACA , en la modalidad de FABRICAR Y VENDER a favor de C.I. MEDINAL LTDA. CONSIDERACIONES DEL DESPACHO Que a pesar de no ser un requisito documental para el otorgamiento del registro sanitario en la normatividad que trata estos productos, este despacho asume que el laboratorio fabricante realizará los estudios de estabilidad correspondiente a cada uno de los materiales de envase autorizados y que soporten el tiempo de vida concedido. Que con base en lo consagrado en los Decretos 3249 de 2006, 3863 de 2008, 272 de 2009 y la documentación allegada por el interesado previo estudio técnico y legal de dicha documentación, el Asesor de la Dirección General con asignación de funciones de la Dirección de Medicamentos y Productos Biológicos, RESUELVE Inf orm ac ión de lD ARTICULO PRIMERO.- Conceder REGISTRO SANITARIO por el término de DIEZ (10) años al producto que se describe a continuación: PRODUCTO: SUPLEMENTO DIETARIO EN JARABE CON VITAMINA B1, B2, B6, VITAMINA C, NIACINA, VITAMINA A, VITAMINA E, HIERRO, ZINC, OMEGA 3, EXTRACTO DE MALTA, ACIDO FOLICO, BIOTINA, VITAMINA B12 Y MACA MARCAS: APETIKIDS, CI MEDINAL CEFALVIT; CI MEDINAL KINDER KIDS REGISTRO SANITARIO No.: SD2014-0003194 VIGENTE HASTA: MODALIDAD: FABRICAR Y VENDER TITULAR: C.I. MEDINAL LTDA., con domicilio en CALI, VALLE DEL CAUCA FABRICANTE: LABORATORIO FITOCOL SAS., con domicilio en CALI, VALLE DEL CAUCA FORMA DE PRESENTACIÓN: SUSPENSION ORAL COMPOSICIÓN: CADA 10 mL de suspensión contiene: VITAMINA C (ÁCIDO ASCÓRBICO) 20,00000mg, NIACINA - 6,66660mg, VITAMINA B1 (TIAMINA CLORHIDRATO) - 0,50000mg, VITAMINA B2 (RIBOFLAVINA 5 FOSFATO-EQUIVALENTE A RIBOFLAVINA BASE 0,5666 mg - 0,77460mg, VITAMINA B6 (PIRIDOXINA CLORHIDRATO - 0,66600mg, VITAMINA A PALMITATO-EQUIVALENTE A 1666,66UI - 0,50000mg, VITAMINA E COMO ACETATO DE DL ALFATOCOFEROL EQUIVALENTE A 10UI DE VITAMINA E - 6,66000mg, SULFATO FERROSO HEPTAHIDRATO EQUIVALENTE A HIERRO ELEMENTAL 6 mg - 29,87000mg, SULFATO DE ZINC MONOHIDRATO EQUIVALENTE A ZINC ELEMENTAL 5,00 mg - 13,72000mg, ACEITE DE BACALAO -GADUS MORRUS EQUIVALENTE A OMEGA 3 (7,5 mg DE EPA Y 2,5 mg DHA)- 10 mg - 16,70000mg, EXTRACTO DE MALTA - 200,00000mg, ÁCIDO FÓLICO - 133,33000mcg, BIOTINA - 100,00000mcg, VITAMINA B12(CIANOCOBALAMINA) - 2,00000mcg, POLVO SECO DE RAÍZ DE MACA (Lepidium meyenii L) - 5,00000mg VIDA UTIL: DOS (2) AÑOS CONTADOS A PARTIR DE LA FECHA DE FABRICACIÓN. CONSERVAR EN UN LUGAR FRESCO Y SECO, A UNA TEMPERATURA NO MAYOR DE 30ºC. PRESENTACIONES COMERCIALES: ESTUCHE DE CARTÓN CON FRASCO DE VIDRIO TRANSPARENTE, ÁMBAR CON TAPA DE SEGURIDAD DE PP BLANCO O ROJO, O AZUL O VERDE O AMARILLA O DORADA O PLATEADA POR:10,20,30,60,120,240,360,500 mL, ESTUCHE DE CARTÓN CON FRASCO DE VIDRIO TRANSPARENTE ,ÁMBAR CON TAPÓN DE CAUCHO Y AGRAFE DE ALUMINIO BLANCO O ROJO, O AZUL O VERDE O AMARILLA O DORADA O PLATEADA POR:10, 20 mL., ESTUCHE DE CARTÓN CON 10,15,16,20,22,25,30 FRASCOS DE VIDRIO AMBAR, TRANSPARENTE POR 10,20 mL., ESTUCHE DE CARTÓN CON Página 1 de 2 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2014015771 DE 29 de Mayo de 2014 Por la cual se concede un Registro Sanitario El Asesor de la Dirección General con asignación de funciones de la Dirección de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, en ejercicio de las facultades legales conferidas en el Decreto 2078 de 2012, Decreto 3249 de 2006, Decreto 3863 de 2008 y Ley 1437 de 2011. FRASCO DE PET BLANCO O ÁMBAR O AZUL CON TAPA DE SEGURIDAD DE PP BLANCO O ROJO, O AZUL O VERDE O AMARILLA O DORADA O PLATEADA POR: 10, 20, 30, 60, 120, 240, 360, 500 mL, ESTUCHE DE CARTÓN CON FRASCO DE PVC BLANCO O ÁMBAR O AZUL CON TAPA DE SEGURIDAD DE PP BLANCO O ROJO, O AZUL O VERDE O AMARILLA O DORADA O PLATEADA POR: 10, 20, 30, 60, 120, 240, 360, 500 mL, ESTUCHE DE CARTON CON 10, 15, 16, 20, 22, 25, 30, FRASCOS EN PVC BLANCO, ÁMBAR, AZUL POR: 10 Y 20 Ml, ESTUCHE DE CARTON CON 10, 15, 16, 20, 22, 25, 30, FRASCOS EN PET BLANCO, ÁMBAR, AZUL POR: 10 Y 20 mL OBSERVACION: ESTE PRODUCTO ES UN SUPLEMENTO DIETARIO, NO E SUN MEDICAMENTO Y NO SUPLE UNA ALIMENTACION EQUILIBRADA. PROCLAMA O DECLARACIÓN ACEPTADA: NINGUNA EXPEDIENTE: 20073520 RADICACIÓN: 2014021481 ARTICULO SEGUNDO.- APROBAR las etiquetas allegadas con la solicitud de Registro Sanitario mediante escrito número 2014021481 de fecha 27/02/2014, las cuales deberán ajustar sus textos de acuerdo a lo dispuesto en la presente Resolución. ARTICULO TERCERO.- Contra la presente resolución procede únicamente el Recurso de Reposición, que deberá interponerse ante el ASESOR DE LA DIRECCIÓN GENERAL CON ASIGNACIÓN DE FUNCIONES DE LA DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS DEL INSTITUTO NACIONAL DE VIGILANCIA DE MEDICAMENTOS Y ALIMENTOS - INVIMA, dentro de los DIEZ (10) días siguientes su notificación, de conformidad con lo señalado en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo. lD ARTICULO CUARTO:-La presente resolución rige a partir de la fecha de su ejecutoria. de COMUNIQUESE, NOTIFIQUESE Y CUMPLASE Dada en Bogotá D.C. el 29 de Mayo de 2014 ac ión Este espacio, hasta la firma se considera en blanco. ____________________________________________________________________________ ALVARO MUÑOZ ESCOBAR ASESOR DE LA DIRECCIÓN GENERAL CON ASIGNACIÓN DE FUNCIONES DE LA DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS Inf orm Proyectó Técnico: R. Marín. _____ Legal: A. Celis. _____ Revisó: D. Lievano. _____ Página 2 de 2