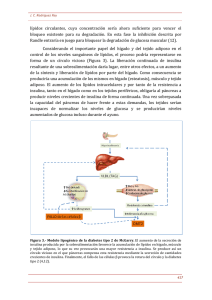
Síndrome Metabólico. Fisiopatología
Anuncio

Síndrome Metabólico. Fisiopatología Dr. José Esteban Costa Gil Doctor en Medicina. Médico Especialista Consultor en Nutrición y Endocrinología. Presidente de la Federación Argentina de Sociedades de Endocrinología 1999-2002. Presidente de la Sociedad Argentina de Diabetes 2007-2008. Facultad de Ciencias Médicas de la Universidad de La Plata. Postgrado de Endocrinología, Universidad Nacional de Tucumán. Postgrado de Nutrición, Universidad Favaloro. Objetivos Comprender la fisiopatología del síndrome metabólico. Jerarquizar la distribución del tejido adiposo. Articular los procesos que conducen a la insulinorresistencia y sus consecuencias. Contenidos Etiopatogenia y fisiopatología del síndrome metabólico Limitación de la adipogénesis (fallo en la respuesta de crecimiento del tejido adiposo) Adipocito lleno (hipertrófico) Adipocito “ausente”. Lipoatrofias Alteración en la oxidación grasa La mitocondria alterada en su estructura y en su función Lípido-peróxidos Proteínas desacoplantes (UCPs) Respuesta adipocitaria anómala a la insulina Ubicación o topografía del tejido adiposo Grasa visceral (obesidad “central”) Depósito ectópico de grasas Modificaciones en la elaboración de sustancias por el adipocito Leptina Adiponectina Inmunidad y metabolismo: respuesta inflamatoria asociada a la insulinorresistencia Insulinorresistencia a nivel hepático. Hígado graso Músculo y síndrome metabólico Tejido adiposo perivascular disfuncional 29 Introducción Con el correr de los años se han realizado investigaciones y publicado trabajos que fueron delineando los conceptos sobre las afecciones que integran al síndrome metabólico (SM), el fenómeno de insulinorresistencia (IR) y el vínculo con la diabetes mellitus tipo 2 (DM2) y con las enfermedades cardiovasculares. Para algunos autores fue el médico sueco Kyling en 1920 quien por primera vez desde la clínica mencionó un grupo de condiciones que se presentaban en forma conjunta: hiperglucemia, hipertensión y gota. Por otro lado, habría sido Himsworth quien en 1936 en forma indirecta hizo referencia a la resistencia a la insulina en la diabetes mellitus (DM) cuando describió que “habría 2 tipos de diabetes: insulinosensible e insulinoinsensible”. Jean Vague en sus publicaciones consideró que existían diferentes formas de obesidades con distinta repercusión particularmente en cuanto a la posibilidad de asociarse con diabetes y otros trastornos metabólicos (aterosclerosis, gota y enfermedad calculosa). Señaló a la obesidad “androide” (central) como el tipo de “obesidad diabetogénica”. A principios de los años 50, J. Bornstein, a través del bioensayo, se asombró cuando observó en algunos estadios de la DM2 que la insulinemia parecía elevada, e incluso planteó si este fenómeno no era consecuencia de una “resistencia a la insulina”. En pocos años R. Yallow y S. Berson a través del desarrollo del método del radioinmunoanálisis, determinaron la insulinemia con notable precisión en personas con y sin DM y propusieron un concepto más claro sobre IR, a la que consideraron como un estado (de células, tejidos, sistemas o cuerpo) en el que se requieren cantidades de insulina mayores que lo normal, para provocar una respuesta cuantitativamente normal. A partir de estas investigaciones, se comenzó a demostrar que existían otras condiciones en las que también la insulina se encontraba alterada, como era el caso de la hipertensión arterial, e incluso J.P. Camus ya en 1966 denominó Trisíndrome Metabólico al cuadro que reunía a la diabetes, la gota y la dislipemia. 30 En 1967, Bagdade, Bierman y Daniel Porte Jr., demostraron en sujetos diabéticos y no diabéticos con peso normal u obesos, que las respuestas de la insulina a la carga de glucosa eran más elevadas en obesos no diabéticos (la más alta) y obesos diabéticos, que en delgados no diabéticos. Más aún, los diabéticos delgados, presentaron niveles de insulina por debajo de los que se consideraron normales. Desde mediados de los 70’ fue creciente el interés por el fenómeno de IR en la DM. Sería engorroso nombrar los numerosos autores que se dedicaron a investigar, pero fueron quizás Ralph DeFronzo y Gerald Reaven quienes marcaron hitos en la historia de los estudios sobre la insulinorresistencia (Tabla 1). A principio de los 80’ DeFronzo, gracias al desarrollo del método de estudio del clamp o pinza euglucémica hiperinsulinémica (que se constituyó en el estándar de oro para determinar la IR), describió que la IR se observaba en la DM y que la insulina en diabéticos tipo 2 se podía encontrar normal, elevada o descendida. Investigó también qué sucedía con este fenómeno en la uremia, con el envejecimiento y en otras situaciones y afecciones. Luego de numerosas publicaciones reunió sus datos y en 1987 dictó la Conferencia Lilly a la que denominó con un título notable: “El Triunvirato: célula beta, músculo e hígado: Una confabulación responsable de la diabetes no insulinodependiente“. En su revisión ubicó a la célula beta, al músculo y al hígado en el centro de la escena de la fisiopatología de la DM2. Obtuvo evidencias sobre las modificaciones en los valores de glucemia y de insulinemia frente a distintas situaciones que iban desde el no diabético con normopeso, seguía en el obeso, el obeso con tolerancia alterada a la glucosa, obeso con DM2 y diabético tipo 2 con insulina disminuida. En este trabajo señala que mientras la media de la glucemia ascendía cuando pasaba desde el no diabético al diabético, la captación de glucosa por tejidos periféricos mediada por insulina hacía una curva inversa. En cambio la insulina tenía un período de aumento de secreción pero comenzaba a descender simultáneamente con el deterioro de la tolerancia a la glucosa. Concluyó entonces que “El Triunvirato” era (Figura 1 en la siguiente página): la alteración en la secreción de insulina por la célula beta la IR muscular la IR hepática con una participación central en el desarrollo y progresión de la ruptura de la homeostasis glucídica En estado basal e interprandial sobresale la IR en el hígado y se manifiesta por aumento de la producción hepática de glucosa; si la célula ß responde en forma normal, se compensará la situación con hiperinsulinemia en ayunas. En el estado prandial estimulado por insulina, serían los tejidos periféricos, especialmente el músculo, los responsables de la IR. TABLA 1 CRONOLOGÍA DE HECHOS DESTACADOS EN EL DESARROLLO CONCEPTUAL DE LA INSULINORRESISTENCIA Y DEL SÍNDROME METABÓLICO 1920 Kyling Describió por primera vez la presentación conjunta de un grupo de condiciones hiperglucemia, hipertensión y gota 1936 Himsworth Se refirió a la resistencia a la insulina en la DM y estimó que “habría una diabetes insulinosensible y otra insulinoinsensible” 1947 Jean Vague Clasificó en tipos a las obesidades y señaló que la forma “androide” (central) predisponía a enfermedades metabólicas 1950 J. Bornstein Observó en algunos estadios de la DM2 que la insulinemia parecía elevada “resistencia a la insulina” 1960 R. Yallow y S. Berson Propusieron a la IR como un estado en el que se requieren cantidades de insulina mayores que lo normal, para provocar una respuesta cuantitativamente normal 1966 Camus Trisíndrome Metabólico al cuadro que reunía a la diabetes, la gota y a una dislipemia 1967 Bagade, Bierman y Daniel Porte (Jr.) Observaron que las respuestas de la insulinemia a la carga de glucosa eran más elevadas en obesos no diabéticos 1980 DeFronzo Dictó la Conferencia Lilly a la que denominó con un título notable: “El Triunvirato: célula beta, músculo e hígado. Una confabulación responsable de la diabetes no insulionodependiente” 1988 Gerald Reaven 13er Congreso de la Federación Internacional de Diabetes en Sydney, cuando describió al “Síndrome X”. Banting Lecture FIGURA 1 COMPONENTES DEL TRIUNVIRATO DE DEFRONZO 31 Gerald Reaven trabajó mucho tiempo antes de hacer su relato sobre el “Síndrome X” en 1988 y diseñó investigaciones que se destacaron por su sencillez y contundencia. En un estudio por clamp determinó que la captación periférica de glucosa que depende de la insulina fue menor en individuos con tolerancia alterada a la glucosa (TGA) y con DM2, respecto de lo que se halló en sujetos controles no diabéticos. En cambio, no hubo diferencia entre los sujetos diabéticos y con TGA. En otra parte de su trabajo investigó porqué sujetos con diferente sensibilidad a la insulina tienen niveles similares de glucosa en sangre, ya que no halló diferencia entre las curvas de glucemia, pero si en las insulinemias de cada grupo, según el cuartilo de insulinosensibilidad. Entonces afirmó que “la capacidad que tiene la célula β de modificar la secreción de insulina permite que individuos con distinta intensidad de insulinorresistencia, tengan grados similares de tolerancia a la glucosa”. Incluso administró 2 comidas y analizó las glucemias e insulinemias en diabéticos y no diabéticos. Como resultado, los diabéticos con hiperglucemias leves tuvieron las insulinemias más altas. En la medida que se elevaron los niveles de glucosa disminuyeron los de insulina e incluso los sujetos con DM2 leve tuvieron insulina más elevada que los no diabéticos. Esto explicó una primera fase de hiperinsulinemia relativa, aunque ya incapaz de mantener la glucemia normal y en la medida que el déficit de insulina se acentuaba las glucemias se elevaban, es decir, la diabetes se hacía más severa. Quizás Reaven logró el punto de mayor altura en la Conferencia Banting del 13er Congreso de la Federación Internacional de Diabetes en Sydney, cuando describió lo que denominó “El Síndrome X”, que en su opinión se debía a la resistencia celular a la captación de glucosa que depende de la insulina. El síndrome estaba constituido por las siguientes condiciones: diversos grados de intolerancia a la glucosa (TAG o DM), elevación de triglicéridos transportados por VLDL, niveles reducidos de colesterol-HDL (c-HDL), hipertensión arterial e hiperinsulinemia. Estimó que está presente en la mayoría de los pacientes con trastornos de la glucosa e incluso en alrededor del 25% de individuos no diabéticos ni obesos (Tabla 2). TABLA 2 COMPONENTES DEL SÍNDROME X 32 SÍNDROME X Está constituido por las siguientes condiciones Diversos grados de Intolerancia a la glucosa Elevación de triglicéridos transportados por VLDL Niveles reducidos de c-HDL Hipertensión Arterial Hiperinsulinemia Presente en la mayoría de los pacientes con trastornos de la glucosa e incluso en alrededor del 25% de individuos no-diabéticos ni obesos En dicha conferencia, Reaven también expresó: “el deterioro de la tolerancia a la glucosa solo se puede evitar si la célula β es capaz de incrementar su respuesta secretoria de insulina y mantener un estado de hiperinsulinemia crónica. Cuando no se puede lograr este objetivo aparece la descompensación de la homeostasis de la glucosa”. Si bien no se tuvo en cuenta en aquella descripción de Reaven del Síndrome X, en la actualidad se reconoce que la obesidad abdominal o central es un rasgo cardinal del síndrome metabólico, con insulinorresistencia como el nexo entre la grasa abdominal y el riesgo de enfermedades crónicas (no transmisibles) prevalentes. Pero es motivo de controversia el concepto que el depósito de grasa abdominal visceral portal es el único factor causal y se lo reconoce más bien como uno de los “mecanismos potenciales”. En la medida que se discute sobre la “hipótesis portal” surgen otras propuestas que intentan dar respuesta al complejo mecanismo fisiopatológico de la IR y de su relación con la DM. En el centro de la polémica se encuentran los conceptos de ectopia o asiento de grasa en tejido magro que acompaña a la incapacidad del tejido adiposo para atesorar grasas y por otro lado, las nuevas consideraciones sobre la actividad endócrina del adipocito, con la producción de sustancias que tendrían fundamental influencia sobre los mecanismos productores de IR (leptina, adiponectina, factor de necrosis tumoral alfa o FNT-α, resistina, etc.). Todo esto en el devenir de nuevos aspectos sobre la disminución de la capacidad oxidativa en la cadena respiratoria mitocondrial y el renacer del concepto de lipogénesis de novo que favorecerían el atesoramiento de grasas intracelular (uno por fallos en la eliminación y otros por producción de grasas desde carbohidratos y proteínas). Roger Unger argumentó con originalidad que en tejidos magros existen pequeñas reservas de grasa intracelular que mantienen una severa regulación de funciones esenciales para mantener estructuras de membrana y fluidez en las señales intracelulares entre otras, pero si aparece una sobrecarga grasa, el fenómeno provocaría en el islote una disfunción betacelular (lipotoxicidad) y la muerte celular (lipoapoptosis). A estos, se suman nuevos aspectos que lejos de permitir una explicación consolidada de los mecanismos íntimos de la insulinorresistencia, le agregan una apasionante cuota de incertidumbre al rompecabezas que resulta tratar de explicar uno de los fenómenos metabólicos más trascendentes, por su influencia directa sobre la salud de las personas. Actividades 1. Según R. DeFronzo, en los estados Interprandial (entre comidas) y Prandial (hasta 2 horas post ingesta) la insulinorresistencia es predominante en los siguientes órganos: Órganos Cerebro Hígado Tejido adiposo Célula ß pancreática Músculo Interprandial Prandial 2. El Síndrome X definido por Reaven está constituído por las siguientes condiciones: (A: De Acuerdo; D: Desacuerdo) 33 Condición Hipertrigliceridemia Hipertensión Insulinorresistencia Perímetro de cintura aumentado Hipercolesterolemia Microalbuminuria Diversos grados de tolerancia a la glucosa IMC > 30 Kg/m2 Hiperinsulinemia Colesterol HDL bajo Etipatogenia y fisiopatología del síndrome metabólico Luego que Ralph DeFronzo en 1987 presentó “El Triunvirato” (alteraciones del hígado, el músculo y la célula beta), comenzó a hablar de “El Cuarteto Disarmónico” (y Reaven hizo alusión “de Dumas a Bernard: Los Mosqueteros”) y los adipocitos pasaron a formar parte de la “confabulación” que conduce a la DM2. Hoy plantea además, la participación del péptido similar al Glucagon o GLP1, que es una incretina secretada por las células L del intestino delgado (“El Quinteto Quintesencial”). No se debería olvidar el papel que desempeñarían las hormonas contrainsulares, como el glucagon, que suele hallarse elevado en ayunas y acelera aún más la producción hepática de glucosa (“El sexteto cetáceo”). En el Anual Meeting de la American Diabetes Association en 2008, consideró la posibilidad que en la diabetes (aún no probada en el tipo 2) aumente la reabsorción de glucosa en los túbulos renales, lo cual interfiere en el escape de glucosa por orina y acentúa la hiperglucemia (“El Septeto Septisémico”). Finalmente, consideró el octavo componente en las actividades cerebrales (núcleos ventromediano y paraventricular) que influyen en el apetito y en la producción de obesidad, que luego favorece la diabetes de tipo 2 (“El Octeto Ominoso”). En la actualidad, ya no sólo se reconocen las funciones de reserva de energía del tejido adiposo en forma de triglicéridos (TG) y ácidos grasos (AG), sino también como colaborador en la regulación de la homeostasis de la energía, que incluye la ingesta de alimentos, el control eficaz del metabolismo y el gasto energético e incluso también la posibilidad de producir y secretar numerosas sustancias que influyen sobre el metabolismo en forma local y sistémica. En la obesidad que se vincula a la IR, no sólo existe un exceso de tejido graso, sino que además es disfuncional (“adiposopatía”). El cúmulo adiposo se enlaza a este fenómeno (y desde allí a la DM2), por diversas situaciones: 1. Limitación en la adipogénesis: fallo en la diferenciación y en la capacidad de respuesta del crecimiento adipocitario (con dificultad para atesorar triglicéridos) 2. Alteración oxidativa de las grasas 3. Respuesta adipocitaria anómala a la insulina (de marcada lipólisis) 4. Ubicación particular de la adiposidad a. Grasa perivisceral con gran dinámica metabólica b. Asiento de grasas por fuera del tejido adiposo o ectopia grasa c. Grasa perivascular y epicárdica 5. Modificaciones en la elaboración de sustancias por el adipocito 6. Cambios inmunológicos: respuesta inflamatoria leve Estas alteraciones en el tejido adiposo se consideran un fenómeno temprano en la patogénesis de la DM2 y se han hallado en individuos con predisposición genética, insulinorresistencia pero tolerancia normal a la glucosa, en sujetos con tolerancia alterada a la glucosa (TAG) y en obesos con IR y tolerancia normal a la glucosa. Es tan importante el vínculo patogenético entre el tejido adiposo disfuncional y la diabetes, que hay quienes sugieren los términos de diabetes adipogénica o de diabetes de comienzo en la obesidad. 34 Actividades 3. El término “grasa ectópica” se refiere a: a. Aumento del depósito de grasa en tejido de ubicación central b. Hiperplasia de adipocito maduro c. Aumento del depósito de grasa en hígado, músculo y célula ß d. Estimulación del pasaje de preadipocito a adipocito lleno Limitación de la adipogénesis (fallo en la respuesta de crecimiento del tejido adiposo) Formación de nuevos adipocitos En ciertos períodos críticos de aumento fisiológico de la masa grasa, diversas señales impactan sobre células madre mesenquimatosas indiferenciadas pluripotentes para que se inicie una línea hacia el preadipocito, que culmina en nuevos adipocitos pequeños adultos. El aumento del número de los adipocitos en el tejido blanco es parte del interjuego de proliferación y diferenciación de preadipocitos bajo el control por factores de transcripción claves en la cascada de adipogénesis (SREBP-1 o Sterol response element binding protein, el C/EBP-α, -ß y -δ o CCAAT/ enhancer binding protein y el PPAR-γ). Además interesan los efectores extracelulares y las vías de señales intracelulares que regulan la transformación celular de la grasa. En la obesidad humana de tipo hipertrófico se asiste al fenómeno del fallo en ciertos casos, tanto de la incorporación de ácidos grasos libres (AGL) al adipocito aumentado de tamaño (“adipocito lleno”), como de la formación de nuevos adipocitos adultos (“adipocitos pequeños”). En el otro extremo, también se observan consecuencias similares en los cuadros de lipoatrofia generalizada (“adipocito ausente”) (Figura 2). FIGURA 2 PROLIFERACIÓN DE ADIPOCITOS El adipocito lleno (hipertrófico) Ninguna célula del organismo tiene la capacidad para aumentar su volumen como posee potencialmente la célula grasa (puede expandirse hasta ocho veces). Sin embargo, se especula que cuando el tejido adiposo llega al límite de su capacidad para hipertrofiarse (y/o hiperplasiarse), fracasa para guardar grasas, y el exceso de lípidos que resta influye sobre procesos fisiológicos y patológicos que incluyen al metabolismo glúcido y graso, el balance de energía, la producción de obesidad, IR, DM y dislipemias. En 1968 J. Hirsch concluyó que la respuesta del tejido adiposo a la insulina dependió del tamaño de las células adiposas: en la medida que el adipocito es más grande, tiene menos sensibilidad a la insulina. También demostró que “después de la pérdida de peso y la reducción en el tamaño de la célula adiposa, la sensibilidad del tejido adiposo a la insulina en pacientes obesos, podía restaurarse hasta lo normal”. Poco tiempo después el grupo sueco de Björntorp amplió estos conceptos. La capacidad para hipertrofiarse demarcaría la aptitud de la célula para compensar el aumento del exceso de sustratos de energía. Cuando el tamaño celular llega a su límite (¿diámetro de 100-150 μm?) no le quedaría al adipocito posibilidad de atesorar grasa. Quizás sea éste uno de los primeros pasos a partir del cual se desencadenan eventos de los que deriva el asiento de grasas en tejidos no preparados para ello. Adipocito “ausente”: lipoatrofias Las lipodistrofias constituyen un grupo heterogéneo de afecciones caracterizadas por la falta o por la pérdida selectiva, parcial o generalizada de tejido adiposo, que es de observación infrecuente (aunque no excepcional) en humanos (por enfermedades genéticas, inmunológicas o adquiridas) y que se ha obtenido en modelos de roedores lipoatróficos. Se han considerado como enfermedades en espejo en relación con la obesidad y al igual que ella determinan con alta frecuencia la presencia de IR, de DM2 y de otras alteraciones metabólicas (hígado graso, dislipemia e hiperglucemia con IR incluso con cardiomiopatía, etc.). Si bien parece un hecho paradojal que la ausencia de grasa corporal provoque IR (y sus consecuencias), el hecho básico es que la falta de tejido adiposo forzaría al depósito ectópico de 35 grasas. Los grupos de Reitman, Gavrilova y Moitra y de Shulman obtuvieron y estudiaron un roedor A-ZIP/F-1 como modelo de la lipodistrofia humana severa y confirmaron la importancia del tejido adiposo blanco en la fisiopatología de la IR y la DM2. Hallaron defectos en la acción de la insulina en el músculo y en el hígado asociados a trastornos en la activación de los Sustratos de Receptor de Insulina 1 y 2 o IRS-1 y 2, vinculados a la actividad de la fosfatidilinositol 3kinasa (PI3K) y un aumento al doble en el contenido de TG en el músculo y el hígado. El ratón es diabético con una reducción de 20 veces de leptina, pero con una elevación de 3 veces de la glucemia, 50 a 400 veces de la insulina, de 3 a 5 veces de los triglicéridos y el doble de AGL. De manera notable el trasplante de grasa de tipo natural-salvaje revierte la mayor parte del cuadro presumiblemente a través de 2 vías: una metabólica y otra endócrina. La primera permite la toma de TG, de AG y de glucosa por el tejido adiposo blanco pero también mejoraría la captación de glucosa por el músculo y disminuiría la producción hepática de glucosa. En el sentido endócrino, si bien existen algunas diferencias de resultados, se logran efectos beneficiosos por la administración de leptina y adiponectina (aunque hay en estudio otras adipoquinas). Se puede inferir que existe una delicada interacción y que se necesitan cantidades óptimas de cada uno de ellos para mantener la homeostasis sistémica de lípidos y de glúcidos. Alteración en la oxidación grasa La alteración en la oxidación de las grasas podría también promover el depósito de grasas en tejidos no adiposos. Aunque aún no se ha podido dilucidar cuál es la secuencia, se podría producir un círculo vicioso en el que la disfunción mitocondrial, la elevación de los lípidos intramiocelulares, la perturbación de la oxidación lipídica y la IR se perpetúen o se amplifiquen uno con otro. Los conocimientos progresan, cambian y se amplían rápidamente, por eso pareciera que la cadena de eventos podría comenzar con la disfunción mitocondrial en la IR genética o con el aumento de los lípidos intramiocelulares en el estado de IR adquirida por tóxicos ambientales. 36 La mitocondria alterada en su estructura y en su función El concepto central sería que en la DM2 existiría un fenotipo con una disfunción mitocondrial que alteraría la capacidad oxidativa del músculo. Kelley observó que en el músculo esquelético de diabéticos tipo 1 y en obesos las mitocondrias eran más pequeñas y con dificultades bioenergéticas (reducción de la capacidad en la cadena de transporte de electrones y de la actividad de citratosintasa). Para Shulman el defecto más temprano responsable de la DM2 podría ser la reducción en el contenido mitocondrial. Por otro lado, también el cúmulo de lípidos intramiocelulares podría alterar la capacidad oxidativa de las mitocondrias por daño inducido por lípido-peroxidación. Asimismo, la reducción de la capacidad oxidativa de las mitocondrias, provocaría una exacerbación posterior de la guarda de lípidos dentro de la célula muscular. Lípido-peróxidos En las mitocondrias se produce energía, pero al mismo tiempo es una fuente de especies reactivas de oxígeno (ROS), de corta vida media y veloz capacidad de reacción con DNA, proteínas y lípidos, lo cual conduce al daño oxidativo. Los AG tienen una particular tendencia a provocar daño oxidativo por la formación de lípido-peróxidos, que son citotóxicos y con alta reactividad y producción de lesión de radical libre a proteínas y ADN. Por ello, la acumulación de AG en la vecindad de la mitocondria donde se realiza el proceso oxidativo, las puede dañar a través de peroxidación de las proteínas mitocondriales y reducción de su capacidad oxidativa. Así finalmente, los AG no se oxidarían, se acumularían en la célula muscular y la carga de AG en la membrana mitocondrial provocaría la entrada de AG neutros dentro de la matriz que tenderían a peroxidarse y a dañar a la mitocondria. Es decir, el músculo de los obesos con IR no sólo tiene más cantidad de lípidos, sino que habría mayor grado de peroxidación lipídica. El ATP se resintetiza continuamente en la mitocondria. Los protones se transportan por gradiente desde la membrana mitocondrial interna al citosol y se restituyen a través del denominado complejo F0-F1, energía que la ATPasa usa para generar ATP desde el ADP, pero que también aumenta la formación de superóxidos, hidrógenoperóxidos y ROS. Más aún, si el gradiente de protones se eleva demasiado, el transporte de electrones se retarda y la formación de superóxidos y ROS aumenta. Una forma de evitar la producción excesiva de ROS sería por disminución del gradiente de protones de la mitocondria por desacoplamiento de la oxidación de sustrato desde la producción de ATP. Recientemente Echtay sugirió que existe un circuito de contrarregulación en el que adquieren importancia las proteínas desacoplantes. Proteínas desacoplantes (UCPs) Las proteínas desacoplantes (UCP1, UCP2, UCP3L y UCP3S ) actúan en la cadena respiratoria de la fosforilación oxidativa, conforman un corto circuito en el recorrido de protones y disipan así la energía en forma de calor sin que se produzca ATP. Las UCPs responden a distintos estímulos y se ha observado su mayor actividad cuando se requiere de un aumento del gasto energético. En un estudio en sujetos no diabéticos se indicó que UCP3 podría ser un determinante del gasto energético y de la eficiencia metabólica. Ello supondría que cuando existen niveles deprimidos de UCP3 habría un bajo consumo energético en reposo y aumento del peso. Los AG que no se oxidan (por ejemplo cuando no se convierten a AG-AcilCoA), forman ROS y lípido-peróxidos que conducen al daño oxidativo de DNA, RNA y enzimas dentro de la matriz. La activación de UCP3 por los lípido-peróxidos facilitaría la exportación de aniones/peróxidos de AG, lo que resulta en un feedback negativo para evitar el daño mitocondrial. En el estado de IR disminuirían los niveles de UCP3 y aumentaría la cantidad de lípido peróxidos. Esto podría finalmente conducir al daño mitocondrial. El corolario de estos fenómenos de limitaciones en la adipogénesis al que se suma el exceso calórico (más ingesta y menos movimiento) y los trastornos oxidativos, es el depósito de grasa extra adipocitario, llamado también ectópico o “síndrome de grasa metastático” (E. Danforth Jr.), de los AGL, en particular en músculo, hígado y páncreas. Se ha demostrado que este depósito ectópico de la grasa es una causa muy importante de IR. Respuesta adipocitaria anómala a la insulina La insulina regula gran parte de las actividades del tejido adiposo y los adipocitos constituyen un tipo celular con sensible respuesta a la hormona. La insulina facilita el depósito de TG, incluso promueve la diferenciación que se inicia en preadipocito y finaliza como adipocito maduro. Estimula el transporte de glucosa y la lipogénesis, pero también inhibe la lipólisis. La insulina aumenta la captación de AG que derivan de las lipoproteínas circulantes por estímulo de lipoproteinlipasa en el tejido adiposo. La sensibilidad a la acción metabólica de la insulina difiere según sus niveles, tal es así que el efecto antilipolítico requiere de una concentración notablemente menor que la que se necesita para estimular el transporte de glucosa. Inclusive aún en estados de IR en los que se altera el transporte de glucosa, se suele preservar el efecto antilipolítico que mantiene o incluso expande las reservas de grasas (Tabla 3). TABLA 3 FUNCIONES DE LA INSULINA Regula gran parte de las actividades del tejido adiposo Facilita el almacenamiento de TG Promueve la diferenciación que se inicia en preadipocito y finaliza como adipocito maduro Estimula el transporte de glucosa y la lipogénesis Inhibe la lipólisis Aumenta la captación de AG que derivan de las lipoproteínas circulantes por estímulo de Lipoproteinlipasa en el tejido adiposo 37 Los efectos metabólicos de la insulina se ejercen a través de acciones específicas de tejidos que incluyen cambios en la función y la fosforilación de proteínas y en la expresión de genes. La señal molecular inicial de la acción de la insulina incluye la activación del receptor de tirosina kinasa y también estimula la cascada de señal de la proteina-kinasa Ras Mitógena activada (Ras-MAPK) importante en los efectos mitogénicos de la hormona. Asimismo suele tener efectos que modifican la transcripción genética (factor de transcripción ADD-1/SREBP-1c: adipocyte determination and differentiation factor-1/sterol regulatory element–binding protein-1c) por inducción de genes involucrados en la lipogénesis y en la oxidación de los AG. Actividades 4. En la regulación de la actividad del tejido adiposo la insulina: (señale la opción incorrecta) a. Facilita el almacenamiento de triglicéridos b. Inhibe la lipogénesis c. Estimula el transporte de glucosa d. Promueve la diferenciación del preadipocito en adipocito Ubicación o topografía del tejido adiposo El patrón de distribución de la grasa es un fuerte predictor de insulinorresistencia. Grasa visceral (obesidad “central”) Se destaca la “Hipótesis Portal” en la que el tejido adiposo con gran actividad metabólica, por su lipólisis libera AGL primariamente a la circulación portal, con producción de IR hepática y también a la circulación general con IR muscular. 38 La obesidad a menudo asociada con DM2 es predominantemente central lo cual es el resultado de una carga de TG en los adipocitos viscerales y una reducción en la capacidad de depósito para proteger a tejidos no adiposos con respecto al uso de grandes proporciones de grasa dietaria. En contraste a los adipocitos subcutáneos las células periviscerales muestran una alta capacidad de lipólisis y son muy sensibles a las hormonas que movilizan grasas, pero responden escasamente a la actividad antilipolítica de la insulina. Los adipocitos viscerales agrandados inundan a la circulación portal con AGL en momentos metabólicamente inapropiados, cuando en realidad los AGL deberían ser oxidados. Exponen así a los tejidos no adiposos a un exceso de grasas. Esto conduce a la acumulación ectópica de TG en músculo e hígado, lo que provoca IR, y sobre la célula β a la que altera funcionalmente. Depósito ectópico de grasas Si el tejido adiposo no es capaz de expandirse, su depósito y actividad se desviará hacia otros sitios no preparados para su acopio ni ubicación (ectópicos), lo que provoca disfunción en los órganos afectados. El acumulo de grasas en el músculo y en el hígado es un predictor de IR. En la “hipótesis del sobreflujo”, la llegada intensa de grasas a tejidos no adiposos en los que se depositan interfiere con la señal de insulina. Por un lado alteran la fosforilación, el transporte de glucosa y la síntesis de glucógeno muscular y por otro, también favorecen la neoglucogénesis y la producción de glucosa hepática. Los efectos nocivos de las grasas se incluyen bajo el nombre de lipotoxicidad, un término acuñado por los infatigables Roger Unger y Daniel McGarry. El aumento del contenido intramiocelular de TG se vincula estrechamente con la IR muscular y para algunos autores manifiesta mejor el fenómeno que la adiposidad visceral, incluso la disminución de la deposición ectópica muscular de grasa por adelgazamiento mejora la sensibilidad a la insulina. Quizás sea más especulativo el efecto directo de las grasas sobre la disfunción beta celular, que se ha realizado en base a modelos en roedores, en la que un aumento de la formación de ceramidas estimularía la sintasa de óxido nítrico inducible y elevaría el óxido nítrico con mayores niveles de citoquinas inflamatorias (FNTα, IL-6, etc.) que favorecerían la apoptosis de la célula ß. Sin embargo, también hay otras posibles explicaciones sobre los mecanismos de producción de la ectopia grasa. Unger propuso que el estado de IR refleja el fracaso de un sistema intracelular liporregulador representado por la leptina. Esta hormona ejercería su acción antiesteatósica al estimular la oxidación lipídica y bloquear la lipogénesis, permitiendo que el depósito de grasa corporal ocurra sin dañar a los tejidos no adiposos. Modificaciones en la elaboración de sustancias por el adipocito El tejido adiposo además de sus funciones como reserva energética, es un activo órgano endócrino, parácrino y autacoide, pues produce y secreta una variedad de proteínas que incluyen citoquinas, quemoquinas y factores símil hormonales, que tienen funciones críticas muchas veces duales o múltiples en la regulación del ingreso y del gasto de energía, en el metabolismo de hidratos de carbono y de lípidos, influyen sobre la homeostasis vascular e incluso en actividades reproductivas e inmunológicas. Se ha denominado adipoquinas a toda proteína que sintetice y segregue el adipocito y se excluye de esta denominación a las sustancias que se producen en otros sitios del tejido adiposo, por ejemplo los macrófagos. Hay proteínas en comunicación (cross-talk) con otros sistemas integradores como el sistema nervioso central, el endocrino (hipotálamo-hipófiso-adrenal), inmune, etc. Por otro lado, la producción local de quemoquinas aterogénicas por el tejido adiposo perivascular podría significar un mecanismo más que justifique la asociación entre obesidad y enfermedad cardiovascular. Asimismo, se han reconocido citoquinas aumentadas en la obesidad vinculadas con la inflamación (FNT-α, IL-1b, IL-6, IL-8, factor de crecimiento neuronal) y con la respuesta de fase aguda (Inhibidor del Activador del Plasminógeno-1 o PAI-1, haptoglobulinas). Esto ha llevado a que algunos investigadores caractericen a la obesidad como un estado crónico de inflamación de grado leve y ligado con la IR. Leptina Es una hormona proteica de cadena simple de 167 aminoácidos, que se produce en los adipocitos 39 maduros, pero también se ha detectado en el fondo gástrico, en el músculo esquelético, el hígado y la placenta. Se consideró que la leptina actuaba como un sensor de la cantidad de grasa corporal particularmente sobre el hipotálamo por supresión de la ingesta de alimentos y aumento del gasto energético. Sin embargo, la principal función estaría dirigida a la adaptación a la baja disponibilidad de energía más que a la prevención de la obesidad (Figura 3). FIGURA 3 GENERALIDADES DE LA LEPTINA LEPTINA Hormona producida en los adipocitos maduros Obesos inicialmente protección, cuando aparece leptinorresistencia promueve depósito de grasa en tejidos no adiposos Principal función adaptación a la baja disponibilidad de energía Además de las ya reconocidas consecuencias de la leptinodeficiencia absoluta en los ratones, en general en la obesidad humana el rasgo esencial es la hiperleptinemia. Por otro lado el tratamiento con leptina mejora la IR y la dislipemia en pacientes con deficiencia relativa de leptina por lipoatrofia. La hipótesis sobre la acción antiesteatósica de leptina, considera que regularía en tejidos no adiposos la homeostasis intracelular de los AG y TG con el objeto de mantener un aporte apropiado para la función celular (membranas, energía, etc.) y evitar la sobrecarga lipídica. Por la llegada de TG los adipocitos envían una señal que no permite la acumulación de las grasas en otros tejidos sino que produce el monopolio de grasas por los adipocitos. Confina los TG en tejidos no adiposos a límites estrechos sin relación con la ingesta de alimentos con vías metabólicas dirigidas a la oxidación de AG y no a la lipogénesis. La leptina al comienzo de la obesidad protegería a través de la carga de TG a los adipocitos, pero cuando se desarrolla una leptinorresistencia (aún no se conocen sus mecanismos moleculares) aparece el depósito de grasas en tejidos no adiposos (esteatosis). El metabolismo no oxidativo de los productos de los AG de cadena larga provoca el cúmulo de triacilglicerol y ceramidas (para Unger incluso en la célula ß y causaría primero lipotoxicidad mediada por óxido nítrico y luego muerte celular o lipoapoptosis. Adiponectina Es una proteína monomérica con 244 aminácidos y 30 kDa que se sintetiza exclusivamente en el tejido adiposo (los adipocitos omentales secretan más adiponectina que los subcutáneos) y se vincula con la sensibilidad sistémica a la insulina y con el metabolismo de la glucosa y las grasas (el “eslabón” entre lípidos y glúcidos). Se encuentra en altas concentraciones en sangre (50030000 ug/l) y circula en 2 isoformas: como dímero – trímero de bajo PM o como molécula compleja de alto PM. Actúa a través de la estimulación de la protein-kinasa activada por AMPc (AMPK) por efectos que no se asocian con el aumento de secreción de insulina. Sus niveles se relacionan con la insulinosensibilidad, la aterosclerosis y la enfermedad cardiovascular y tiene acción antiinflamatoria (con analogía estructural con FNT-α). La secreción desciende en la obesidad, la insulinorresistencia y en la DM2, pero desciende más aún si esas condiciones se acompañan de enfermedad cardiovascular. 40 La adiponectina se eleva cuando los obesos adelgazan, porque los adipocitos plenos de TG producirían menos hormona que los pequeños y maduros (mas insulinosensibles). Las tiazolidinedionas (TZD) agonistas del PPAR-γ mejoran la expresión y los niveles de adiponectina en roedores y en diabéticos tipo 2 y se ha propuesto que constituye uno de los mecanismos más importantes por el que las TZD inducen la mejoría de la insulinorresistencia vinculada a la obesidad. Para DeFronzo la disminución de la adiponectina reflejaría “el síndrome de la célula grasa disfuncional”. Otras hormonas Hoy se investigan otras sustancias como la resistina, la proteína acetiladora, la adipsina, la visfatina e incluso la angiotensina II, para determinar el vínculo con la IR. Actividades 5. ¿Cuál de las siguientes afirmaciones respecto a la leptina es correcta? a. Tiene funciones de adaptación a la alta disponibilidad de energía b. Aumenta el depósito de grasa en leptinorresistencia c. Disminuye la carga de triglicéridos a los adipocitos d. Es producida por el preadipocito, entre otros e. Actúa como sensor de la cantidad de grasa corporal aumentando la ingesta y el gasto energético 6. ¿Cuál de las siguientes adipoquinas está disminuida en el obeso? a. Leptina b. TNFα c. PAI 1 d. Adiponectina Inmunidad y metabolismo: respuesta inflamatoria asociada a la insulinorresistencia Energía y defensas son elementales para la vida, por eso los sistemas metabólico e inmunológico si bien son independientes, tienen funciones que se interrelacionan. Muchas hormonas, citoquinas, proteínas de señal, factores de transcripción y lípidos bioactivos pueden cumplir funciones tanto metabólicas como inmunológicas. Además, los sistemas metabólico e inmune se regulan uno con el otro. Se reconoce ampliamente el vínculo entre la desnutrición y la inmunodeficiencia, pero la epidemia de obesidad alertó sobre la unión de estados inflamatorios con el sobrepeso, la DM, la enfermedad grasa del hígado y la aterosclerosis. En estas afecciones se asocian como fenómeno causal a una respuesta inflamatoria crónica con una producción anormal de citoquinas, con el aumento de reactantes de fase aguda y la activación de vías de señal inflamatoria, al menos en modelos animales. Se especula que la respuesta inflamatoria amplia y de grado leve que se observa en la obesidad, se inicia en los propios adipocitos disfuncionales o potencialmente en sus estructuras vecinas perturbadas por el crecimiento adipocitario, como células reticuloendoteliales y precursores adipocitarios. También hay macrófagos que infiltran el tejido adiposo en expansión. Se considera que hay una superposición biológica y funcional entre macrófagos y adipocitos. Existe un repertorio de genes inflamatorios en el tejido adiposo y a su vez, los macrófagos pueden expresar la mayoría de los productos génicos adipocitarios, como las Proteínas de Unión de Acidos Grasos (FABPs) y PPAR-γ y a su vez los adipocitos expresan proteínas macrofágicas como el FNT-α, IL-6 y MMPs. Los macrófagos pueden guardar lípidos y transformarse en células espumosas del proceso aterosclerótico y se conoce que los preadipocitos tienen potentes propiedades fagocíticas y antimicrobianas e incluso suelen transformarse en macrófagos si se los coloca en el medio apropiado. Ambos se localizan en el tejido adiposo de la obesidad y es probable que las células conectivas y los macrófagos produzcan mediadores inflamatorios solos o en coacción con los adipocitos. 41 Muchos de los mediadores de inflamación que se observan en la respuesta inflamatoria de la obesidad y en el tejido adiposo disfuncional, que incluyen al FNT-α, la IL-6, las Sustancias Supresoras de la Señal de Citoquinas (SOCS) y las especies de óxido nítrico (iNOS), exhiben patrones de expresión o influyen en la actividad de la insulina. Asimismo, moléculas de adipoquinas con funciones metabólicas bien establecidas, parecen que intervienen en la regulación de la función inmune. Por ejemplo en los déficit de leptina en animales y hombres, aparece una inmunodeficiencia. También se propone algo similar con adiponectina, visfatina y resistina. Las SOCS además de estar involucradas en la inhibición de la señal de insulina por citoquinas, interfieren con la fosforilación de los sustratos de receptor de insulina o favorecen la degradación proteosomal del IRS-1 e IRS-2. Asimismo se postula la posibilidad de polimorfismos no sólo de FNT-α o de IL-6, sino de PPAR-γ que afectaría su actividad antiinflamatoria que se estima se ejerce sobre el FNT-α. Los lípidos también participan en la regulación coordinada de inflamación y de metabolismo. En estados con infección o inflamación se elevan los lípidos y así como son beneficiosos en la fase aguda o en el corto plazo, resultan perjudiciales cuando aquellas condiciones se mantienen crónicamente. Aún en ausencia de obesidad, en animales la infusión de lípidos o de citoquinas proinflamatorias provocan inflamación. Pareciera que uno de los lugares sensibles de influencia de la respuesta inflamatoria sobre la actividad de insulina, es la inhibición de la señal desde el receptor de insulina. Tanto el FNT-α como los AGL estimulan la fosforilación de residuos serina del IRS-1, se inhibe la fosforilación de tirosina y la capacidad del IRS-1 para asociarse al receptor. También la vía de señal inflamatoria podría precipitarse por estrés metabólico del retículo endoplásmico ya que en el adipocito disfuncional hay cambios en la arquitectura, se modifican la síntesis de proteínas y de lípidos y se perturba la producción de energía. Wellens y Hostamisligil plantean incluso, la posibilidad de considerar a la inflamación como un rasgo favorable en el curso de la obesidad en la medida que de hecho pone un límite a la expansión grasa. Actividades 7. Los estados de inflamación producen: a. Disminución del ingreso de lípidos a los macrófagos b. Aumento de los lípidos plasmáticos c. Aumento del colesterol HDL d. Disminución de la lipogénesis Insulinorresistencia a nivel hepático. Hígado graso La insulinorresistencia hepática afecta tanto al metabolismo de los glúcidos como al de los lípidos. La insulinorresistencia a nivel del músculo esquelético y del tejido adiposo se caracteriza por una menor captación y utilización de la glucosa que depende de la insulina. En cambio la resistencia del hígado a las actividad de la hormona se pone de manifiesto por un incremento en la producción hepática de glucosa, que conduce a la hiperglucemia en ayunas y también prandial. Existe aceleración de la gluconeogénesis, descenso del aclaramiento hepático de la insulina (que contribuye a la hiperinsulinemia), falta de respuesta a la acción inhibidora de la insulina sobre la glucogenolisis y gran producción de VLDL (Tabla 4). Tabla 4 Insulinorresistencia Músculo Músculoesqueléctico esquelético yytejido tejidoadiposo adiposo 42 Se caracterizan por una menor captación y utilización de la glucosa que depende de la insulina. Hígado Incremento en la producción hepática de glucosa, que conduce a la hiperglucemia en ayunas y también prandial. Aceleración de la gluconeogénesis, descenso del aclaramiento hepático de la insulina (que contribuye a la hiperinsulinemia). Falta de respuesta a la acción inhibidora de la insulina sobre la glucogenolisis y gran producción de VLDL. La IR hepática se originaría primariamente en una alteración en la propagación de su señal dentro de la célula por compromiso a nivel del sustrato del receptor de la Insulina (IRS). De las dos isoformas que se conocen, el IRS-1 intervendría fundamentalmente en la homeostasis de la glucosa y el IRS-2 en la regulación del metabolismo lipídico. La esteato hepatitis no alcohólica (EHNA), que une a la esteatosis con la cirrosis en el espectro de la hepatopatía grasa no alcohólica, se considera particularmente frecuente en sujetos con SM y en la DM2. La edad, la actividad de la esteatohepatitis y la fibrosis predisponen a la cirrosis que en término de 10 años podría conducir a la muerte del 12 al 25% de los sujetos afectados. La EHNA se caracteriza por esteatosis con hepatocitos abalonados y cuerpos de Mallory, fibrosis pericelular y perivenular con o sin fibrosis e infiltración celular inflamatoria lobular. Es una afección en general oligosintomática y para su diagnóstico requiere que se descarten la hepatopatía alcohólica y las hepatitis virales (aunque podrían existir cuadros mixtos). Suele observarse aumento de enzimas transaminasas hepáticas (2 a 4 veces); el estudio ecográfico, aunque depende del sonógrafo que se utilice, es de gran importancia (alrededor de 80% de sensibilidad y de 90% de especificidad) y es de menor costo que la RMN o la TC. Si bien la biopsia hepática confirma el diagnóstico, se aconseja utilizarla en casos de duda, evolutivos o severos. Los conceptos patogenéticos se apoyan en el conjunto de lipotoxicidad, estrés oxidativo, citoquinas y mediadores proinflamatorios que serían los responsables de la evolución de esteatosis a EHNA. A través de la hipótesis lipotóxica se intenta explicar el mecanismo por el que la grasa infiltra al hígado (ectopia grasa) a través de AG (que tienen un ingreso no regulado): a) no esterificados desde la lipólisis del tejido adiposo (60% de las grasas intrahepáticas) b) de la dieta c) de la lipogénesis de novo dentro del hepatocito bajo estímulo de factores de trascripción inducidos por Insulina y glucosa (25% del contenido hepático de grasas) Los AG son estímulos naturales de la secreción de insulina, pero la llegada masiva, crónica, persistente y no controlada de AGL al hepatocito, superaría el efecto inhibitorio de la insulina sobre la oxidación de los lípidos intracelulares y genera mayor resistencia celular. Los AG producen múltiples alteraciones cuando interfieren en la unión de la insulina a su receptor y además afectan la propagación intracelular de la señal de la hormona (porque induce fosforilación en serina del IRS-1). Se postulan otros múltiples mecanismos que favorecerían la IR, al facilitar la expresión de proteínas vinculadas a la trascripción y expresión de genes en relación con la síntesis de TG e incluso para la producción de una respuesta inflamatoria. Las nuevas hipótesis afirman que en la IR aumenta la producción hepática de glucosa porque se altera la habilidad de la insulina para suprimir la expresión/actividad de las enzimas gluconeogenéticas. Esta anomalía coexiste con un aumento de la síntesis de TG y reducción de la oxidación de AG. El control del metabolismo de la glucosa y de los lípidos por la insulina se conducen por dos caminos diferentes, con el IRS-2 que actúa sobre la producción de glucosa por vía del FoxO1 y el IRS-1 con actividad sobre los lípidos por vía del factor que une los elementos regulatorios de esteroles o Srebf1 y FoxO2. La subfamilia FoxO o Forkhead Box “Other” son proteínas de trascripción de vías que tienen un importante papel para mediar efectos de la insulina y de factores de crecimiento sobre diversas funciones fisiológicas, que incluyen la diferenciación, la proliferación, la apoptosis y el metabolismo celular. Su producción transcripcional se controla por un doble mecanismo de fosforilación y acetilación. Ejercen efectos positivos y negativos sobre la expresión de genes a través de su unión directa al DNA, sitios específicos e interacciones de proteína a proteína con otros factores y coactivadores de transcripción. Las alteraciones moderadas en su balance pueden provocar profundos efectos. Se ha mostrado que el implante adenoviral del FoxO1 en el hígado de rata provoca una esteatosis con cúmulo de TG y disminución de la oxidación de AG. Actividades 8. La insulinorresistencia hepática: (A: Acuerdo; D: Desacuerdo) 43 Se origina en una alteración en la propagación de su señal dentro de la célula Produce disminución de la gluconeogénesis Disminuye la producción de VLDL Aumenta la producción hepática de glucosa Produce aumento de la glucemia principalmente postprandial Aumenta la aclaración hepática de insulina 9. En la EHNA los factores que predisponen a cirrosis son: (A: Acuerdo; D: Desacuerdo) Edad Género masculino Actividad de la esteatohepatitis Etnia Grado de fibrosis 10. Para confirmar el diagnóstico de EHNA se debe realizar: a. Resonancia Nuclear Magnética b. Tomografía Axial Computada c. Ecografía d. Punción Biopsia Hepática e. Enzimas hepáticas Músculo y síndrome metabólico Bajo la acción de la insulina, el músculo esquelético es el sitio más amplio para el depósito de glucosa. Por eso, los defectos en la captación, guarda o utilización de la glucosa muscular tienen una importante influencia en la fisiopatología de la IR y la DM2. Randle en 1963 planteó un modelo que pareció el más consistente hasta hace corto tiempo, cuando describió el ciclo glucosa-ácidos grasos, en el cual básicamente señalaba que la excesiva lipólisis originada en la obesidad determinaba una entrada masiva de AGL al músculo, con aumento de la oxidación por grasas que restringía la oxidación de glucosa al alterar el potencial redox de la célula e inhibir las enzimas clave glucolíticas. Como consecuencia se produciría un bloqueo en la entrada de glucosa a la célula que junto a las modificaciones de su oxidación, determinaría a su vez la IR. Este modelo explicativo de competencia de sustratos, se proclamó durante cerca de cuatro décadas pero tuvo sólo base experimental en músculo aislado de diafragma y corazón y muchos investigadores no pudieron demostrar los mismos resultados que Randle. Precisamente, aunque el aumento de los AGL y la oxidación de grasas disminuyen la oxidación de glucosa y están acoplados, como describió originalmente Randle, el mecanismo sería otro. La explicación hoy se encuentra en la inhibición de los pasos tempranos del metabolismo de glucosa muscular: el transporte de glucosa por GLUT-4, la fosforilación por hexoquinasa y el depósito de glucógeno. En humanos hay una relación negativa entre el metabolismo de la glucosa estimulado por la insulina y el cúmulo de lípidos intramusculares que incluye triglicéridos, diacilglicerol, CoA de ácidos grasos de cadena larga (o FA-CoA) y ceramidas. 44 El grupo de Gerald Shulman con Gianluca Perseghin y muchos colaboradores, han investigado en una secuencia de estudios mediante técnicas muy refinadas de espectroscopia de resonancia magnética con C13/P31 (que permite medir entre otras cosas, la incorporación de glucosa en el glucógeno) y han demostrado que el defecto estaba en la actividad del transporte de glucosa muscular estimulado por insulina. Observaron que bajo condiciones de hiperglucemia e hiperinsulinemia, la síntesis de glucógeno muscular es la vía mayor para el metabolismo de la glucosa y que el defecto en la síntesis de glucógeno tiene una importancia primordial en la producción de IR. Primero hallaron que la glucosa-6-fosfato, que es un metabolito intermediario entre el transporte de glucosa/hexoquinasa y la síntesis de glucógeno, se hallaba disminuida (si el fallo fuese a nivel de síntesis de glucógeno se elevaría) con lo que se infirió que la alteración se hallaba a nivel del transporte de glusosa/hexoquinasa y debilitó así, en parte, el modelo de competencia de sustratos. Posteriormente determinaron que el defecto se encontraba en las actividades de transporte/ fosforilación. Hallaron la concentración de glucosa libre en el músculo francamente descendida (si el fallo fuese de hexoquinasa II estaría elevada) lo que confirmó que el primordial defecto en la síntesis de glucógeno muscular estimulado por insulina se encuentra a nivel del transportador de glucosa (principalmente GLUT-4). También determinaron que los AGL causan insulinorresistencia en humanos debido a la disminución de actividad de transporte de glucosa muscular dependiente de insulina que podría atribuirse a la reducción del sustrato del IRS-1 asociado a la actividad de la fosfatidilinositol 3 kinasa (PI-3 kinasa), que se trata de un paso fundamental en el transporte de la glucosa estimulado por insulina en el músculo. Por último, han propuesto que este defecto se podría deber a la activación de una cascada de serina quinasa que involucra a la proteina quinasa 0 y a IKK-beta (que además son mediadores claves también en procesos inflamatorios) y que provocan un aumento de fosforilación de serina de IRS-1, una posición crítica en la que interfiere y bloquea en los sitios de fosforilación de tirosina en IRS-1 que son necesarios para unir y activar la PI 3kinasa. Estiman además que cualquier proceso que conduzca al aumento intramiocelular de lípidos por el metabolismo de los AGL, sean estos trastornos heredados o adquiridos, tales como los defectos en la oxidación mitocondrial de los AGL, las anormalidades en el metabolismo de las grasas o simplemente por la sobreoferta, terminará en insulinorresistencia por esta vía común. Además, se ha propuesto una regulación recíproca entre tejido adiposo y músculo esquelético. Los estudios sobre el papel de PPAR-γ en el músculo esquelético, lo ubicaría también como un órgano capaz de producir sustancias endocrinas, algo similar a lo que sucedió con el adipocito y el endotelio hace corto tiempo atrás. La importancia de los adipocitos locales: tejido perivascular disfuncional El corazón y las arterias (excepto las del cerebro) están rodeadas por tejido adiposo (epicardio y tejido adiposo perivascular o TAPV). El TAPV y el epicárdico aportan AGL como fuente de energía y constituyen un órgano endoparacrino que libera adipoquinas. Tiene tejido adiposo blanco y marrón y una matriz con origen embriológico común con la grasa mesentérica y omental. En la obesidad, al igual que la grasa abdominal, aumenta el espesor de la TAPV y la grasa del epicárdio. Se ha observado incluso que los macrófagos son más numerosos y densos en la grasa periadventicial de las arterias ateroscleróticas humanas con cores de lípidos. El TAPV y epicárdico influirían en la aterogénesis y en la función del miocardio (no hay una capa fibrosa que impida la difusión de AGL y adipoquinas). Conclusiones El fenómeno de insulinorresistencia tiene en la diabetes de tipo 2 y en la enfermedad cardiovascular sus consecuencias más relevantes. Lo que demarca la aparición de diabetes ante la insulinorresistencia es el fallo de la célula beta. Si bien tiene una influencia primordial, en la actualidad se considera que la IR no es el único fenómeno que conduce o agrava a la diabetes tipo 2. 45 La asociación entre el SM y la aterosclerosis mantiene un sinnúmero de interrogantes. Entre ellos se mantiene la pregunta sobre si los cambios vasculares responden a una alteración molecular común en relación a las señales del receptor de insulina o si la enfermedad vascular es secundaria a las anormalidades que provoca la IR (dislipemia, hipertensión arterial, trastornos reológicos, diabetes, etc.). Es lógico de pensar, que ambas situaciones influyen en el vínculo entre síndrome metabólico y enfermedad vascular. El enfoque terapéutico debe tener siempre fundamentos fisiopatológicos. Actividades Clave de respuestas 1. Órganos Cerebro Hígado Tejido adiposo Célula ß pancreática Músculo Interprandial No Sí No No No Prandial No No No No Sí 2. Condición Hipertrigliceridemia Hipertensión Insulinorresistencia Perímetro de cintura aumentado Hipercolesterolemia Microalbuminuria Diversos grados de tolerancia a la glucosa IMC > 30 Kg/m2 Hiperinsulinemia Colesterol HDL bajo A A D D D D D D A A 3. c 4. b 5. b 6. d 7. d 8. 46 Se origina en una alteración en la propagación de su señal dentro de la célula Produce disminución de la gluconeogénesis Disminuye la producción de VLDL Aumenta la producción hepática de glucosa Produce aumento de la glucemia principalmente postprandial Aumenta la aclaración hepática de insulina D D A D D Edad Género masculino Actividad de la esteatohepatitis Etnia Grado de fibrosis A D A D A A 9. 10. d Bibliografía Alberti KG, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet Med 1998; 15: 539-553. Alberti KG, Zimmet P, Shaw J. Metabolic syndrome—a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med 2006; 23: 469-480. Bayard M, Holt J, Boroughs E. Nonalcoholic Fatty Liver Disease. Am Fam Physician 2006; 73: 1961-1968. Beck-Nielsen H. General characteristics of the insulin resistance syndrome: prevalence and heritability. European Group for the study of Insulin Resistance (EGIR). Drugs 1999; 58 (Suppl 1): 7-10. Braguinsky J. Síndrome metabólico... ¿o enfermedad metabólica? Una mirada desde la clínica. Jorge Braguinsky Ed. ACINDES. Buenos Aires, Argentina. 2006. Camus JP. Gout, diabetes e hiperlipidemie: tri-sindrome metabolique. Rev Rhum Mal Osteoartic 1966; 33: 10-14. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979; 237: E214-223. DeFronzo RA. Lilly lecture 1987. The triumvirate: beta-cell, muscle, liver. A collusion responsible for NIDDM. Diabetes 1988; 37: 667-687. Eckel RH, Grundy S, Zimmet PZ. The metabolic syndrome. Lancet 2005; 365: 1415-1428. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-2497. Ford ES, Giles WH, Mokdad AH. Increasing prevalence of the metabolic syndrome among U.S. Adults. Diabetes Care 2004; 27: 2444-2449. Lakka HM, Laaksonen DE, Lakka TA, Niskanen LK, Kumpusalo E, Tuomilehto J, Salonen JT. The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA 2002; 288: 2709-2716. Malik S, Wong ND, Franklin SS, Kamath TV, L’Italien GJ, Pio JR, Williams GR. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation 2004; 110: 1245-1250. Neuschwander-Tetri BA. Nonalcoholic steatohepatitis and the metabolic syndrome. Am J Med Sci 2005; 330: 326-335. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988; 37: 1595-1607. Sanisoglu SY, Oktenli C, Hasimi A, Yokusoglu M, Ugurlu M. Prevalence of metabolic syndromerelated disorders in a large adult population in Turkey. BMC Public Health 2006; 10; 6:92. Vague J. La diferénciation sexuelle, facteur déterminant des formes de l´obésité. Presse Médical 1947; 55: 339-340. 47