+ H
Anuncio
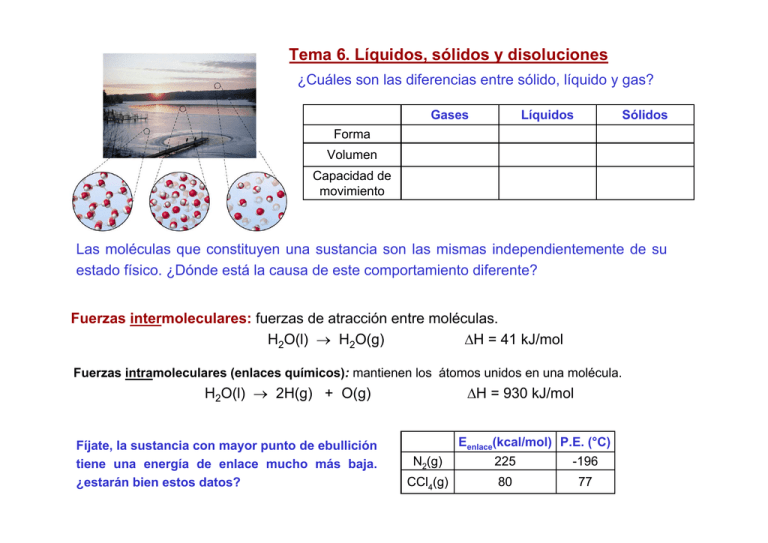
Tema 6. Líquidos, sólidos y disoluciones ¿Cuáles son las diferencias entre sólido, líquido y gas? Gases Líquidos Sólidos Forma Volumen Capacidad de movimiento Las moléculas que constituyen una sustancia son las mismas independientemente de su estado físico. ¿Dónde está la causa de este comportamiento diferente? Fuerzas intermoleculares: fuerzas de atracción entre moléculas. H2O(l) → H2O(g) ∆H = 41 kJ/mol Fuerzas intramoleculares (enlaces químicos): mantienen los átomos unidos en una molécula. H2O(l) → 2H(g) + O(g) Fíjate, la sustancia con mayor punto de ebullición tiene una energía de enlace mucho más baja. ¿estarán bien estos datos? ∆H = 930 kJ/mol Eenlace(kcal/mol) P.E. (°C) N2(g) 225 -196 CCl4(g) 80 77 Fuerza intermoleculares o fuerzas de Van der Waals Interacciones dipolo-dipolo. Se establecen entre moléculas polares (µ→ ≠ 0). Etípica ≈ 2 – 4 kJ/mol Metanol CH3OH Cloroformo CHCl3 Interacciones ion-dipolo. Se establecen entre iones y moléculas polares. E≈ 15 kJ/mol - + Sales iónicas acuosas: interacción entre los iones de un soluto y las moléculas de agua. Interacciones de London o fuerzas de dispersión. Se establecen entre moléculas apolares (µ→ = 0). Etípica ≈ 2 kJ/mol. Distribución electrónica asimétrica momentánea provoca dipolos temporales: Cl→ µ=0 → µ instantáneo ≠ 0 → → µιnstantáneo ↔ µinducido Octano C8H18 Hexano C6H14 agua Hexano C6H14 Polarizabilidad facilidad para la distribución asimétrica de la densidad electrónica. ¿Qué sustancia será más polarizables, el nitrógeno o el tetracloruro de carbono? Xenón Explica los valores del punto de fusión que aparecen en la tabla. Disminución del punto de ebullición ¿Por qué no siguen la secuencia de valores de los hidruros de homólogos? Enlace de hidrógeno: Interacción dipolo-dipolo entre el átomo de hidrógeno en un enlace N-H, O-H, F-H, y un átomo electronegativo (O, N, o F) con pares de e- solitarios en moléculas vecinas. Etípica ≈ 20 kJ/mol. δ+……. δB H enlace químico •• δA N H enlace hidrógeno O H δ+ N H H δ- H δ+ H δO H H Metanol agua H H Indica las fuerzas de mayor intensidad es necesario vencer para: a) fundir hielo, b) sublimar iodo, c) disociar flúor y d) hervir amoníaco. Escribe la ecuación química correspondiente a cada uno de los procesos. AGUA Estructura de doble hélice del ADN Estructura 3D del hielo Enlaces de hidrógeno Estado líquido Una misma cantidad de líquido puede “ser” un vaso, una botella, una gota, etc. Algunos líquidos presentan una gran resistencia a que un cuerpo “rompa su superficie”. Algunos líquidos “mojan” las superficies y otros no. Los líquidos se comportan así debido al equilibrio entre las fuerzas intermoleculares (cohesión de las partículas) y la energía cinética (libertad de movimiento) de las partículas que los constituyen. Tensión superficial: Energía necesaria para modificar la superficie de un líquido por unidad de superficie. Fuerza intermoleculares altas ⇒ ? tensión superficial ¿Por qué las gotas son esféricas? Elige entre agua y pentano (C5H12). CH3-CH2-CH2-CH2-CH3 Cambio de estado líquido ↔ gas: Evaporación o Ebullición ¿Qué pasa si abro el recipiente? % de moléculas con velocidad v Presión de vapor de los líquidos (P°v): Presión que ejerce un gas en equilibrio con su líquido. Los líquidos volátiles con fuerzas intermoleculares débiles poseen P°v altas. A Elige: H2O, CH3-O-CH3 , CH3-CH2OH C B ¿Por qué los charcos de lluvia se secan a temperatura ambiente? Si el charco es de alcohol etílico ¿tardará más o menos en secar? Calcular la pureza de una muestra de carburo cálcico, sabiendo que cuando se tratan 2,056 g de carburo con agua se obtienen 656 cm3 de acetileno medidos sobre agua a 22 °C y 748 mmHg. Pv0(H2O, 22°C)=19,8 mmHg. Gas formado en la reacción CaC2 (s) + H2O(l) → C2H2(g) + CaO(s) Estado sólido Sólido cristalino posee sus partículas constituyentes en una organización interna regularmente ordenada. Sólido amorfo sus partículas constituyentes no poseen una organización interna ordenada. Sólido cristalino Cuarzo (SiO2) Sólido amorfo Vidrio (SiO2) Celda unidad o unitaria unidad mínima de volumen que contiene todas las características del cristal. Su repetición tridimensional da lugar al sólido macroscópico. Siete tipos de Celda Unidad: Tres tipos de celda cúbica A) Moleculares Tipos de sólidos B) Macromoleculares: Covalentes o atómicos, Iónicos, Metálicos. A) Moleculares. Constituidos por moléculas unidas por fuerzas intermoleculares. Blandos, bajos puntos de fusión. Malos conductores del calor y la electricidad. Ej: H2O(s), I2(s), C6H12O6(s), S8(s), etc. B) Macroleculares. Constituidos por partículas unidas por enlaces químicos. S8 CH4(s) Covalentes o atómicos. Constituidos por átomos unidos por enlace covalente. Duros, altos puntos de fusión, malos conductores del calor y la electricidad. C(s) diamante C(s) grafito Iónicos. Constituidos por iones unidos por enlace iónico. Duros, altos puntos de fusión, malos conductores del calor y la electricidad. Fluorita: CaF2 Blenda: ZnS Metálicos. Constituidos por átomos unidos por enlace metálico. Buenos conductores del calor y la electricidad. Enlace metálico: Teoría de bandas electrónicas, extensión del modelo de OM deslocalizado. Banda electrónica: conjunto de O.M. de energías muy próximas que se deslocalizan en todo el metal. Banda electrónica 2p vacía Banda electrónica 2s semillena Conducción eléctrica es consecuencia de presencia o posibilidad de bandas electrónicas disponibles Elige: conductor, semiconductor o aislante. Cada rectángulo representa una banda electrónica. Cambios de estado y diagramas de fase. Punto de fusión: temperatura a la que existe equilibrio entre la fase sólida y la líquida. Punto de ebullición: temperatura a la que existe equilibrio entre la fase líquida y la fase gas (P°v(líquido) =Pat). Se llama normal cuando la P=1 atm. Diagrama de fase: resumen gráfico de las condiciones de P y T en las que una sustancia existe como sólido, líquido o gas. Calor ¿Qué le pasa en estas condiciones? Observa el diagrama de fases del carbono sólido, ¿puede sublimar el diamante por cambios de presión? ¿puedes fundir grafito a presión atmosférica? ¿se puede transformar grafito en diamante a presión atmosférica? Disoluciones Mezcla homogénea de dos o más sustancias. Soluto/s: sustancia/s presente/s en cantidad/es minoritaria/s Disolvente: sustancia presente en cantidad mayoritaria Mecanismo de la disolución: • Interacciones disolvente-disolvente • Interacciones soluto-soluto • Interacciones disolvente-soluto Electrólito fuerte Electrólito débil No electrólito Sustancias con fuerzas intermoleculares similares serán solubles entre sí. “Igual disuelve a igual”. Solvatación El µ(CH3CH2OH)=1,7 D y µ(CH3CH2Cl)=2,5 D, sin embargo el etanol es mucho más soluble en agua ¿por qué? agua metanol agua +metanol Propiedades coligativas de las disoluciones ¿Por qué le añades anticongelante al circuito del agua del coche? ¿Por qué los deportistas prefieren bebidas isotónicas? ¿Qué son? Descenso de la presión de vapor: La presión de vapor de una sustancia disminuye cuando forma parte de una disolución. Ley de Raoult P1 = X1 P10 0 P 1 : presión de vapor de componente 1 de la Disol. X1 : fracción molar del componente 1 en la Disol. P(mmHg) Las presiones de vapor del benceno y tolueno a 25°C son 75,1 y 28,4 mmHg, respectivamente. Se prepara una disolución con el mismo número de moles de ambos. ¿Cuál es la composición del vapor en equilibrio con esta disolución? 60 40 20 Humedad Relativa (H.R.): relación porcentual entre la presión parcial del vapor de agua presente en la mezcla gaseosa (Dalton) y la Pv° del agua líquida (Raoult). La presión parcial del vapor de agua en la atmósfera a 25°C es 12,2 mmHg ¿Cúal es la HR? ¿Necesitas saber algo más? Aumento del punto de ebullición Descenso del punto de congelación Ambos son consecuencia de la disminución de la presión de vapor. ∆Te = Ke m ∆Tc = Kc m m: molalidad de la disolución. Ke y Kc: cte ebulloscópica y crioscópica del disolvente. NaCl(ac) para eliminar hielo en carreteras Tf (hielo) ≈ -21°C. Disolución de propilenglicol (CH3CHOHCH2OH) caliente y a presión para eliminar hielo. Presión osmótica de las disoluciones: Ósmosis proceso espontáneo de difusión de líquidos a través de membranas semipermeables. Presión osmótica (π) presión necesaria para detener la ósmosis. M: molaridad de la disolución π = MRT R: cte de los gases T: temperatura absoluta Ósmosis inversa. Proceso forzado agua salina La disolución externa a la célula es ¿isotónica, hipotónica o hipertónica?