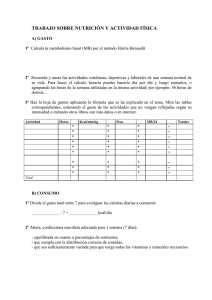
1. 5 gramos de Na2SO4se disuelve en agua hasta completar 180
Anuncio

COLEGIO LOS PRÓCERES “Al rescate de los valores perdidos para vivir dignamente y convivir pacíficamente” Lic. Biología y química Diana Florez centeno PLAN DE NIVELACIÓN 3º PERIODO GRADO: 9° ASIGNATURA: BIOLOGÍA DOCENTE DIANA FLOREZ CENTENO LOGROS Identifica las propiedades de las soluciones y su composición relacionando sus ideas previas con la percepción del medio que le rodea desarrollando competencias que facilite el trabajo en clase Relaciona y diferencia el concepto de soluto y solvente, a través del análisis de la composición de soluciones comunes reconociendo de forma autónoma la aplicabilidad de la química en su vida Realiza diferenciación de los métodos de separación de sustancias y aplica conceptos propios, relacionado con sustancias puras y mezclas Desarrolla ejercicios de cálculo matemático para determinar la concentración de varias soluciones y aplica de forma eficaz fórmulas tanto físicas como químicas NOMBRE CONTRERAS RAMIREZ MICHAEL ALBERTO DIAZ BOHORQUEZ JULIAN ANDRES DURAN BUSTOS CESAR ENRIQUE ESPEJO AMAYA MONICA ALEANDRA GACHARNA PINTO JUANA HERNANDEZ AGUILAR ALEJANDRO IBARRA ARIZA CARLOS ALEJANDRO JIMENEZ MONSALVE ANGIE NATALY LAGUADO SERRANO MELISSA DANIELA ACTIVIDADES A REALIZAR LOPEZ CONTRERAS DIEGO SEBASTIAN LUQUE VILLAMIZAR NEFFER STEVEN MACHUCA GARCIA JULIO JESUS MORENO PUERTO JEFFERSON HUMBERTO MORENO VALENCIA FRANCISCO ANDRES OSORIO ALMEIDA KAREN ELIANA SANCHEZ DIAZ JEISSON EDUARDO VARGAS CARDENAS SHEKINAH LARA CORREA JAVIER ALEJANDRO RECOMENDACIÓN 1. 2. 3. 4. 5. PRESENTAR EN ADSOLUTO ORDEN, CON BUENA LETRA Y CON CARPETA LAS ACTIVIDADES ANTERIORES ESTUDIANTE QUE NO REALICE LAS ACTIVIDADES CON TIEMPO, NO PODRÁ PRESENTAR LA RESPECTIVA EVALUACIÓN TODO DEBE SER REALIZADO A MANO Y POR EL ESTUDIANTE, SE TENDRÁ PRESENTE PARA CALIFICAR: ORDEN, LA LETRA, ORTOGRAFÍA Y QUE ESTÉ COMPLETO (PORTADA, CONTRAPORTADA, TABLA DE CONTENIDO Y ANEXOS AGREGADOS) DEBEN TRAER $600 SENCILLOS PUEDEN AYUDARSE DEL CUESTIONARIO BIMESTRAL PARA DAR SOLUCION A LAS ACTIVIDADES PROPUESTAS NOTA: NO OLVIDAR QUE DEBEN ESTUDIAR MUY BIEN EL CUESTIONARIO BIMESTRAL, DE LO CONTRARIO NO ALCANZARÁN EL LOGRO EN LA NIVELACIÓN; DADO QUE LA EVALUACIÓN POSEE UN VALOR DEL 70% Y QUIEN NO ELABORE LAS ACTIVIDADES PERDERÁ EL DERECHO A DICHA EVALUACIÓN LOS ESTUDIANTES QUE APARECEN EN AMARILLO NO TENDRÁN QUE ASISTIR A LA JORNADA DE NIVELACIÓN, SIN EMBARGO SI PRESENTARÁN EVALUACIÓN DEL ´PROCESO, ADEMÁS PARA TODOS, LA PRESENTACIÓN DE ESTE TRABAJO JUNTO A SU EVALUACIÓN ES VALIDO COMO NOTA PARA EL CUARTO PERIODO…. USTEDES VAN PARA DÉCIMO… Y TIENEN QUE TOMARLO EN SERIO… NO PIERDAN EL TIEMPO ACTIVIDADES 1. 5 gramos de Na2SO4se disuelve en agua hasta completar 180 gramos de solución.¿Cuál es el % p/p de la solución resultante? ¿Cuál es el nombre del soluto? 2.78% p/p 2. Una solución de NaCl contiene 36 gramos de la sal en 100 gramos de agua. ¿Cuáles su concentración expresada en % p/p? 26.47% p/p 3. Calcular la masa de NaOH y el volumen de agua necesario para preparar 1500gramos de solución al 40% en p/p? Escriba la fórmula del soluto. 600 g NaOH y 900 mL H2O 4. Se adicionan 8 gramos de NaBr a 80 gramos de solución al 15 % p/p de la mismasal. Calcule el % p/p de la solución resultante. 22.73% p/p 5. Una solución está preparada al 15% p/p en NaCl. ¿Qué masa de NaCl seencontrará en 450 gramos de disolución? 67.5 g 6. ¿En qué masa de disolución de azúcar, preparada al 40% p/p, encontraremos 250 gramos de azúcar? 625 g 7. Para preparar una disolución, se disolvieron 30 gramos de glucosa en suficiente agua como para completar 500 gramos de disolución. ¿Qué concentración % p/p tendrá la solución? 6% p/p 8. Se disolvieron 45 gramos de KCl en 455 gramos de agua. ¿Cuál es la concentración% p/p de a disolución? 9% p/p 9. En 300 gramos de agua se disolvieron 100 gramos de CuSO4. ¿Qué concentración %p/p tendrá la disolución? 25% p/p 10. Una muestra de 60 gramos de KI, se disolvió en suficiente agua como para completar 500 mL de disolución. Determine la concentración % p/v de la disolución. 12% p/v 11. ¿Cuál será la concentración % p/v de una disolución, si en su preparación se disolvieron 250 gramos de NaOH en agua suficiente para completar 1 L de disolución? 25% p/v 12. ¿Qué volumen de disolución acuosa de KOH 20% p/p, habría que medir para obtener 50 gramos de KOH, una vez evaporado el agua? 250 mL Relaciona cada uno de los términos con la definición correspondiente. D. E. Solo I y II Solo II y III 9. A partir de la regla básica en la cual se basa la solubilidad: “lo semejante, disuelve lo semejante”, se puede deducir que: A. el agua es capaz de disolver todo tipo de solutos. B. un disolvente polar disuelve compuestos polares. C. un disolvente apolar disuelve compuestos iónicos. D. un disolvente polar disuelve compuestos apolares. E. un disolvente apolar disuelve compuestos polares. 10. De las siguientes sustancias, ¿cuál es insoluble en medio acuoso? A. Bicarbonato de sodio. B. Sulfato de cobre (II). C. Cloruro de sodio. D. Margarina. E. Sacarosa (azúcar común). 2. Según su composición química, la materia se clasifica en sustancias puras y mezclas. Son ejemplos de sustancias puras: I. cobre. II. aire. III. oxígeno. IV. sal A. Solo I y II. B. Solo I y III. C. Solo II y III. D. Solo I, III y IV. E. I, II, III y IV 3. En la naturaleza, la materia se presenta mayoritariamente en forma de mezclas. Son ejemplos de mezclas homogéneas: I. agua potable. II. suelo. III. suero fisiológico. IV. bebida gaseosa. A. Solo I y II B. D. Solo I, II y III C. Solo I y III D. E. I, II, III y IV E. Solo I, III y IV 4. ¿A qué tipo de disoluciones corresponden las siguientes mezclas, respectivamente? I. Aire. II. Bebida gaseosa. III. Bebida alcohólica. A. I: gas-gas; II: gas-líquido; III: líquido-líquido. B. I: gas-líquido; II: gas-líquido; III: líquido-líquido. C. I: gas-gas; II: gas-líquido; III: gas-líquido. D. I: gas-gas; II: líquido-líquido; III: gas-líquido. E. I: gas-gas; II: líquido-líquido; III: líquido-líquido. 5. ¿Cuál de las siguientes aseveraciones es falsa? A. Las disoluciones son mezclas homogéneas. B. El disolvente es el componente mayoritario en una disolución. C. El soluto es el único participante en una disolución. D. Las disoluciones son las mezclas más abundantes en la naturaleza. E. Los componentes que conforman una disolución no siempre están en el mismo estado físico. 6. Con relación al componente definido como disolvente en una disolución, se puede afirmar que: 11. ¿Cuál de los siguientes enunciados es correcto con respecto a la solubilidad? A. La temperatura facilita el proceso de disolución de todos los solutos. B. La presión afecta la solubilidad de los solutos sólidos y líquidos. C. La solubilidad de los gases disminuye al aumentar la temperatura. D. La sacarosa es solo soluble en agua caliente. E. La gasolina forma una mezcla miscible con el agua. 12. ¿Qué se debe realizar para aumentar la solubilidad de un gas en agua? A. Disminuir la presión. B. Aumentar la temperatura. C. Disminuir la temperatura y la presión. D. Aumentar la presión y la temperatura. E. Aumentar la presión y disminuir la temperatura. 13. ¿En cuál de las siguientes mezclas componentes pueden separarse por destilación? A. Agua–arena. B. NaCl–agua. C. Alcohol–agua. D. Sacarosa–agua. E. Harina–agua. sus 14. El tamizado es una técnica indicada para la separación de: A. sustancias sólidas que se encuentran dispersas en un líquido. B. sólidos mezclados con líquidos. C. sustancias sólidas de diferentes tamaños. D. líquidos con diferentes puntos de ebullición. E. líquidos con distintas densidades. CONTESTE LAS PREGUNTAS 15 A 19 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN I. corresponde a la fase dispersante de la disolución. II. es el componente mayoritario dentro de la disolución. III. siempre se encontrará en estado líquido. A. Solo I B. Solo II C. Solo III D. Solo I y II E. Solo II y III 7. Con respecto a la conductividad eléctrica, ¿cuál o cuáles de las siguientes afirmaciones es o son falsas? I. La conductividad eléctrica no depende de la cantidad de electrolito. II. La presencia de iones permite la conductividad eléctrica. III. Un soluto que no permite la conductividad eléctrica se denomina no electrolito. A. Solo I B. Solo II C. Solo III 15. forman una muestra heterogénea con 3 fases A. B. C. D. Agua + alcohol + NaCl Agua + arena + NaCl Agua + alcohol + piedras Agua + arena + aceite 16. forman una mezcla homogénea A. Agua + alcohol B. Agua + piedras C. Agua + aceite D. Alcohol + arena 17. Para lograr la separación de los componentes de la mezcla formada por arena + NaCl se deben seguir los siguientes pasos en el orden adecuado A. Agregar agua para solubilizar la arena, filtrar y cristalizar B. Agregar agua para solubilizar la sal, filtrar y cristalizar C. Agregar alcohol para solubilizar la arena, cristalizar y filtrar D. Agregar agua para solubilizar la sal, cristalizar y filtrar 18. para separar y recuperar todos los materiales de la mezcla formada por NaCl + I2 se debe realizar el siguiente proceso 19. los siguientes esquemas representan métodos para separar diferentes tipos de mezclas. Para separar la mezcla formada por agua, piedras aceite, alcohol y NaCl, el proceso correcto es 22. de los materiales representados es válido afirmar que A. I es un material homogéneo porque esta formado por una sola clase de sustancia B. II es un material heterogéneo porque contiene una sola fase C. III es un material homogéneo porque es una sustancia pura D. IV es un material Heterogéneo con dos fases Los métodos más comunes para separar los componentes de una mezcla son A. B. C. D. 1,3,4 y 5 4,1,3 y 5 2,4,3 y 5 3,5,4 y 2 RESPONDE LAS PREGUNTAS 20 Y 21 DE ACUERDO A LA SIGUIENTE INFORMACIÓN 23. para separar las sustancias contenidas en los recipientes 2, 3, y 4 se deben emplear los procesos A. 1, 2 y 3 B. 3, 2 y 1 C. 3, 4 y 1 D. 2, 3 y 1 Teniendo en cuenta el siguiente diagrama de flujo, y que el NaCl es soluble en el agua, pero el I2 es insoluble y que el I2 se sublima con poco calor A continuación se ilustra cuatro métodos de separación de mezclas 20. se hizo una mezcla de sal, piedras y arena. Se emplea un método de separación y se observa que las piedras se separan de las otros dos componentes. A los componentes que aún no se separaron, se les agregó agua y nuevamente se aplicaron dos métodos de separación. Los tres métodos más apropiados para recuperar por separado las piedras, la arena y la sal, deben ser en su orden A. B. C. D. Tamizado, decantación, evaporación Decantación, tamizado, filtración Tamizado, evaporación, decantación Decantación, filtrado, tamizado 21. cuando se lleva a cabo alguno de los cuatro métodos de separación A. Cambia la dureza y la densidad de los componentes de las mezclas B. Cambia la masa y el volumen de los componentes de las mezclas C. Cambia el estado físico de los componentes de las mezclas D. Permanece constante la composición y estructura de los componentes de las mezclas 24. el filtrado está compuesto por A. Las sustancias insolubles en el agua B. Agua + arena C. Las sustancias solubles en el agua D. Agua + I2 25. el residuo 1 está conformada por A. Las sustancias solubles en el agua B. 1 y 2 porque son solubles en agua C. 1,2 y 3 porque son insolubles en el agua D. 1 y 3 porque son insolubles en agua 26. el gas 1 corresponde a A. Arena porque al aplicarle calor podemos lograr la transformación del gas B. Yodo porque es insoluble en el agua y tiene la propiedad de sublimarse con un poco de calor C. NaCl porque es soluble en el agua y tiene la propiedad de sublimarse con un poco de calor D. Cl2 porque el NaCl se disocia en Na Y Cl y los átomos del Cl forman Cl2 27. el gas 2 corresponde a A. Yodo porque de los sólidos es el único que se sublima B. Agua porque se está realizando una filtración y posteriormente una destilación C. NaCl porque es lo que se encuentra en el filtrado y esta en la parte líquida D. Agua porque al calentar el filtrado hasta 100°C a un poco más 28. el sólido es A. Arena porque contiene sustancias químicas insolubles en agua y al calentarse el filtrado y evaporarse el agua, la arena se solidifica B. NaCl porque es una sustancia química insoluble en el agua y al evaporar el agua queda sólo el NaCl C. NaCl porque al quitarle el agua por evaporación, queda el sólido que estaba disuelto en el agua D. Yodo porque es una sustancia insoluble y al calentar se escapa el agua quedando el yodo en el fondo 29. El removedor es una mezcla líquida de varios compuestos solubles entre sí. Si se desea separar tres de estos compuestos X, Y, Z, se debe tener en cuenta el punto de ebullición de cada uno, a 1 atmósfera de presión, de acuerdo con la siguiente tabla. íquido X Y Z +} Punto de ebullición °C 40 53.1 82.3 De acuerdo con esto, el montaje más adecuado para la separación es Se encuentran 117 g de cloruro de sodio en 2.5 litros de la solución 33. La molaridad de la solución es A. 0.8 M Na = 23 glmol B. 0.4 M Cl = 35.5 glmol C. 1 M D. 2 M 34. La normalidad de la solución cuando disolvemos 294 g de K2Cr2O7 en 500 ml de solución es A. 1 N. K = 39 glmol B. 4 N. Cr = 52 glmol C. 1.5 N. O= 16 g/mol D. 2 N. 35. La molalidad de la solución cuando se disuelven 79 g de KmnO4 en 1000 mL de agua es A. 2m K = 39 glmol B. 3m Mn = 55 glmol C. 1 m O= 16 glmol D. 0.5 m TENIENDO EN CUENTA LAS SIGUIENTES FORMULAS DE SOLUCIONES FÍSICAS RESUELVE LOS EJERCICIOS (g) de soluto % P/P = ------------------- x 100 (g) de solución (g) de soluto % P/V = ------------------- x 100 (ml) de solución (ml) de soluto % V/V = ------------------- x 100 (ml) de solución 30. a una mezcla de líquidos A , inmisicibles entre sí, se agrega una sal que es soluble en los dos líquidos. Luego se separa la muestra por decantación en dos recipientes. El líquido A se evapora por completo quedando en el recipiente la sal como sólido. De acuerdo con esta información, si se evapora por completo la mezcla inicial (A, B y sal) es posible A. Quede menor cantidad de sal en el recipiente B. Quede en el recipiente el líquido B y la sal disuelta C. El recipiente quede vacio D. Quede una mayor cantidad de sal en el recipiente (mg) de soluto ppm = ------------------- x 100 (kg) de solución TENIENDO EN CUENTA LA SIGUIENTE INFORMACIÓN CONTESTA LAS PREGUNTAS 31 Y 32 40. cuál es el porcentaje en volumen de alcohol etílico para una cerveza que contiene 13,33 ml de alcohol en un volumen total de 333,33 ml (una botella de cerveza) 39. cuál es el porcentaje en peso de una solución preparada disolviendo 5 gramos de AgNO3 (nitrato de plata) en 95 gramos de agua Cuando se calienta la sustancia A quedan 2 nuevos materiales sólidos B y C. cuando B y C se someten por separado al calentamiento, no se producen materiales más sencillos que ellos. Después de varios análisis, se determina que el sólido B es muy soluble en agua, mientras que C es insoluble 31. de acuerdo con lo anterior, el material A probablemente es A. Una solución B. Un elemento C. Un compuesto D. Una mezcla homogénea 32. después de descomponer la sustancia A se requiere por separado obtener el material B para ello es necesario A. Destilar B. Disolver el agua C. Decantar D. Evaporar RECORDEMOS LOS CONCEPTOS DEL SEGUNDO PERIODO 41. si en 150 ml de una solución existen 15 gramos de yoduro de potasio. Cuál es el porcentaje en volumen 42. cuántos gramos de agua serán necesarios para disolver 230 gramos de bromuro de litio y producir una solución al 25% 43. halle la cantidad de solución necesaria para preparar una sustancia que este al 89% de p/v al combinarla con 11 gramos de oxido de zinc 44. A. si una muestra de 2,5 mg de iones -1 floruro (F ) EN 500 ml de disolución. Calcule las partes por millón del ión floruro en la muestra. LA CONCENTRACIÓN DEL IÓN FLORURO EN EL ORGANÍSMO NO DEBERIA SER MAYOR A 1PPM B. INDICA SI LA CONCENTRACIÓN DEL IÓN ES ADECUADA PARA LA SALUD hasta completar un volumen de 100 ml. Solución 3: se toma 1 mol de NaCI y se prepara un litro de solución. 48. Se extraen dos muestras de la solución 11: una de 1 ml (muestra P) y otra de 3 ml (muestra Q). De acuerdo con esto, la molaridad es A. tres veces mayor Q que en P, porque el volumen de Q es tres veces el de P. B. menor en P con respecto a la solución 11, porque el volumen de P es menor. C. igual en P y Q, aunque los volúmenes de las muestras sean diferentes. D. mayor en Q con respecto a la solución 11, porque se extrajeron 3 Mi DETERMINE LA CONCENTRACION PARA CADA UNA DE LAS SOLUCIONES QUE SE MUESTRAN EN LAS TABLAS. DEBES COLOCAR LOS PROCESOS REALIZADOS Concentración es la cantidad de soluto disuelto en una cantidad de solvente a una temperatura determinada. Una forma de expresar la concentración es la molaridad 45. D e acuerdo con la formula química del sulfato de aluminio Al2(SO4)3 es valido afirmar que A. Tiene dos moléculas de aluminio B. Esta compuesto por tres clases de moléculas C. Tiene cuatro átomos de óxigeno D. Esta compuesto por tres clases de átomos 46. de acuerdo con la ecuación Zn + 2HCl ZnCl2 + H2 es correcto afirmar que A. 2 moles de HCl producen dos moles de ZnCl2 y 2 moles de H B. 1 mol de Zn produce 2 moles de ZnCl2 y un mol de H C. 72 gramos de HCl producen 135 gramos de ZnCl2 y 1 mol de H2 D. 135 gramos de ZnCl2 reaccionan con 1 mol de H2 DETERMINE LA MOLARIDAD DE LAS SOLUCIONES I Y II QUE SE MUESTRAN EN LA TABLA, DESPUES ESPECIFICA QUIEN TIENE MAYOR CONCENTRACION Y CUAL TIENE MENOR CANTIDAD DE MOLES 47. La siguiente tabla muestra información sobre las soluciones I y II En el laboratorio se preparan las siguientes soluciones de cloruro de sodio, NaCl Solución 1: 250 ml de solución 0,15 M Solución 2: se extraen 10 ml de solución I y se añade agua 49. A 20°C se preparan las siguientes soluciones de hidróxido de sodio (NaOH) en agua (H20) PRIMER PERIODO 1. fórmula del carbonato de zinc es: A. Zn2CO2 B. Zn2CO3 C. Zn(CO3)2 D. ZnCO3 2. La fórmula del sulfuro de plata es: A. Pt2S B. Ag2S C. PtS D. AgS 3. ¿Cuál es la fórmula del permanganato de potasio? A. KMnO4 B. KMnO2 C. KMnO3 D. K2MnO3 4. ¿Cuál es la fórmula química del fosfato de estroncio? A. Sr3(PO4)3 B. Sr2(PO3)3 C. Sr3(PO3)2 D. Sr3(PO4)2 ¿Cuál es la fórmula química del clorato de litio? 5. A. Li2ClO3 B. LiClO C. LiClO2 D. LiClO3 6. ¿La fórmula del perclorato de amonio es: NH4ClO4? A. Verdadero B. Falso 7. ¿La fórmula del cromato de platino (IV) es: Pt(CrO 3)4? A. Verdadero B. Falso 8. ¿Cuál es la fórmula del hipoclorito de plata? A. Ag2ClO B. Ag2ClO2 C. AgClO3 D. AgClO 9. ¿Cuál es la fórmula química del sulfato de cromo (III)? A. Cr(SO3)3 B. CrSO4 C. Cr2(SO3)3 D. Cr2(SO4)3 10. ¿La fórmula del nitrito de calcio es: Ca 2NO3? A. Verdadero B. Falso 11. ¿Cuál es la fórmula química del ión permanganato? 2 A. MnO ¯ 3 B. MnO ¯ 4 C. MnO ¯ 32D. MnO + 12. ¿La fórmula del ión hidronio es: H2O ? A. Verdadero B. Falso 13. ¿Cuál es la fórmula química del ión amonio? + A. NH3 + B. NH4 + C. NH2 2+ D. NH3 214. La fórmula del ion nitrato es: NO3 A. Verdadero B. Falso 15. ¿Cuál es la fórmula química del ión dihidrógeno fosfato? A. HPO4¯ B. HPO3¯ C. H2PO4¯ D. H2PO3¯ 16. ¿La fórmula química del ión perclorato es: ClO4¯? A. Verdadero B. Falso 17. ¿La fórmula del ión hidrógeno sulfuro es: HS¯ ? A. Verdadero B. Falso 18. ¿Cuál es la fórmula química del ión hidrógeno carbonato? A. HCO2¯ B. HCO3¯ C. H2CO2¯ D. H2CO3 19. ¿La fórmula del hidróxido de sodio es: Na(OH) 2? A. Verdadero B. Falso 20. ¿Cuál es la fórmula química del hidróxido de potasio? A. P2OH B. P(OH)3 C. KOH D. POH 21. ¿La fórmula del hidróxido de estroncio es: Es(OH) 2? A. Verdadero B. Falso 22. ¿Cuál es la fórmula química del hidróxido de amonio? A. NH4OH B. NH3OH C. NH4(OH)2 D. (NH4)2 OH 23. ¿La fórmula del hidróxido de plata es: Ag(OH)? A. Verdadero B. Falso 24. ¿Cuál es la fórmula química del hidróxido de aluminio? A. Al(OH)3 B. Al(OH)2 C. Al(OH)4 D. AlOH 25. ¿Cuál es la fórmula química del hidróxido de helio(II)? A. He2OH B. He(OH)2 C. HeOH D. Ninguna de las anteriores 26. ¿Cuál es la fórmula química del hidróxido de antimonio (III)? A. An3OH B. An(OH)3 C. An(OH)2 D. Sb(OH)3 27. ¿Cuál es la fórmula química del hidróxido de berilio? A. Be(OH)3 B. Be2 (OH) C. Be(OH)2 D. Be2(OH)3 28. ¿Cuál es la fórmula química del hidróxido de mercurio(II)? A. Hg2OH B. Hg3OH C. Hg(OH)2 D. HgOH 29. ¿La fórmula del ácido brómico es: HBrO2? A. Verdadero B. Falso 30. ¿Cuál es la fórmula química del ion cloruro? 3 A. ClO 2 B. ClO C. ClOD. Cl31. ¿Cuál es la fórmula química del ión sulfato? 2A. SO4 2B. SO3 -1 C. SO4 -1 D. SO3