Cetoacido´sis con inesperado Alcohol
Anuncio

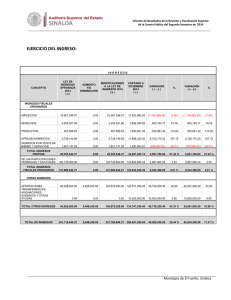
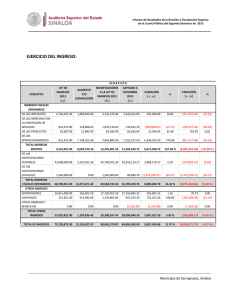
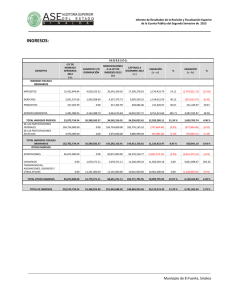
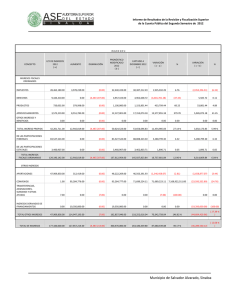
Clinical Chemistry 57:10 1361–1365 (2011) Estudio de Caso Clı́nico Cetoacidósis con inesperado Alcohol isopropı́lico en suero Peter L. Platteborze,1 Petrie M. Rainey,1 and Geoffrey S. Baird1* CASO Una mujer de 34 años de edad se presentó al departamento de emergencia con una queja de fuerte dolor abdominal agudo que empeoraba. La paciente informó del dolor abdominal localizado en el cuadrante inferior izquierdo y de varios meses de duración, pero señaló que habı́a empeorado sustancialmente durante los últimos 10 dı́as. También informó de dolor muscular difuso y náuseas sin vómito, sin ingesta de alimentos durante las últimas 72 h y sólo limitada ingesta reciente de lı́quidos que constó de ginger-ale, agua, Gatorade y licor casero. Su último perı́odo menstrual fue 2 semanas antes de la admisión. Su historia médica remarcaba trastorno de estrés postraumático, trastorno bipolar, diabetes gestacional, una cirugı́a de bypass gástrico anterior y una historia ambigua de “lesiones en el hı́gado y el páncreas”. Ella negó especı́ficamente estar tomando algún medicamento u otras drogas ilı́citas, y haber bebido “desenfrenadamente”, pero recientemente habı́a recibido un tatuaje de un artista del tatuaje sin licencia. Estaba sin hogar y residı́a en un albergue con su marido. Los únicos notables hallazgos del examen fı́sico fueron taquicardia y un hı́gado ligeramente crecido, no sensible. Ella parecı́a enferma y olı́a a fogata pero por lo contrario, estaba despierta, alerta y cooperativa. Los resultados de laboratorio seleccionados se muestran en la tabla 1. Las concentraciones de albúmina y nitrógeno ureico bajos sugieren probable desnutrición. La hipocalcemia observada de 7.4 mg/dL puede atribuirse parcialmente a la concentración de albúmina baja, porque la concentración de Ca total corregido por la albúmina, que es igual al total medido [Ca] ⫹ 0,8 mg/dL x (⫺ 4.0 [Albúmina]), donde [Ca] es la concentración de calcio en miligramos por decilitro y [Albúmina] es la concentración de albúmina en gramos por decilitro (1 ) — fue 8.8 mg/dL, menos del lı́mite inferior de referencia institucional. Los opiáceos y antidepresivos tricı́clicos fueron identificados en la orina del paciente. La presencia de 1 Departamento de Medicina de Laboratorio, Centro Médico de la Universidad de Washington, Seattle, WA. * Dirigir correspondencia al autor a: Department of Laboratory Medicine, NW120, 1959 NE Pacific, Seattle, WA 98195. Fax 206-598-6189; e-mail [email protected]. Recibido para publicación 22 de octubre de 2010. Aceptado para su publicación 17 de enero de 2011. PREGUNTAS A CONSIDERAR 1. ¿Cuáles son las causas comunes de una alta combinación de la brecha aniónica y una osmolalidad aumentada? 2. ¿Qué puede provocar cetoacidósis? 3. ¿Cuál es el enfoque adecuado para este paciente con un resultado de alcohol isopropı́lico aumentado en suero? opiáceos no fue comentada en el historial médico, y si el equipo clı́nico conocı́a de este hallazgo no fue comentado. Los registros del sistema del hospital no tenı́a ninguna receta de antidepresivos tricı́clicos para el paciente, por lo que el resultado positivo de este analito podrı́a ser debido a la utilización de un antidepresivo tricı́clico obtenido ilı́citamente o con una prescripción de fuera; alternativamente, podrı́a ser debido a una sustancia de reacción cruzada. El médico tratante en el departamento de emergencias solicitó asistencia para interpretar el gran aumento de la concentración de -hidroxibutirato. Además, el equipo clı́nico quiso saber si detectar alcohol isopropı́lico en el monitoreo de alcohol implicaba que el licor casero ingerido por la paciente contenı́a alcohol isopropı́lico. DISCUSIÓN Los resultados de gases arteriales en sangre iniciales mostraban un patrón consistente con acidosis metabólica (pH ⫽ 7,28) que habı́a sido compensada en parte por hiperventilación, según lo sugerido por los resultados de gases en sangre. Además, la concentración de -hidroxibutirato aumentado era indicativo de cetoacidosis; sin embargo, ya que el plasma de esta paciente fue ligeramente hipoglicemiante y no tenia historia de diabetes tipo I, no podrı́a ser corroborada la cetoacidosis del diabético (DKA)2 y se considero altamente improbable (2 ). Por el contrario, su historial médico enfatizaba que la cetoacidósis era debida al consumo de alcohol junto con poca o ninguna ingesta nutricional, una condición conocida como cetoacidó- 2 Abreviaciones no estandar: DKA, cetoácidosis del diabético; AKA, cetoácidosis alcohólica. 1361 Estudio de Caso Clı́nico Tabla 1. Datos de laboratorio.1 Resultado Intervalo de referencia Sangre arterial pH Pco2,2 mmHg Po2, mmHg Bicarbonato calculado, mEq/L 7.28 7.35–7.45 14 33–48 124 80–104 6 24–31 Deficit de Bases, mEq/L 19.2 0.0–2.0 Lactato, mg/dL 32 3.6–9.0 133 136–145 Plasma venoso Sodio, mEq/L Potasio, mEq/L Cloro, mEq/L Dioxido de Carbono (total), mEq/L 3.9 3.7–5.2 98 98–108 8 22–32 Glucosa, mg/dL 69 75–105 Intervalo Aniónico, mEq/L 27 3–11 urea nitrogenada, mg/dL 6 8–21 Creatinina, mg/dL 1.1 0.2–1.1 Calcio, mg/dL 7.4 8.9–10.2 Albumina, g/dL -Hidroxibutirato, mg/dL 2.3 130.2 3.5–5.2 0.00–2.08 Suero Osmolalidad, mOsm/kg Intervalo Osmolal (calculado3), mOsm/kg 322 280–300 56 ⫺10 a 10 128 Negativo 37 Negativo Monitoreo de alcohol en suero (cromatografı́a de gases) Etanol, mg/dL Acetona, mg/dL Alcohol isopropı́lico, mg/L 140 Negativo Metanol, mg/L Negativo Negativo Etilen glicol, mg/dL Negativo Negativo Positivo Negativo Monitoreo de drogas en orina (inmunoensayo enzimático, Olympus AU400 EMIT) Opiáceos Antidepresivos tricı́clicos Positivo Negativo Etanol Positivo Negativo Factores de conversión en unidades convencionales de medición para unidades SI: bicarbonato, mEq/L ⫻ 1 ⫽ mmol/L; Lactato, mg/dL ⫻ 0.1110 ⫽ mmol/L; sodio, mEq/L ⫻ 1 ⫽ mmol/L; potasio, mEq/L ⫻ 1 ⫽ mmol/L; cloruro, mEq/L ⫻ 1 ⫽ mmol/L; dióxido de carbono, mEq/L ⫻ 1 ⫽ mmol/L; glucosa, mg/dL ⫻ 0.05551 ⫽ mmol/L; intervalo aniónico, mEq/L ⫻ 1 ⫽ mmol/L; urea nitrogenada, mg/dL ⫻ 0.357 ⫽ mmol/L; creatinina, mg/dL ⫻ 88.4 ⫽ mol/L; calcio, mg/dL ⫻ 0.25 ⫽ mmol/L; albúmina, g/dL ⫻ 10 ⫽ g/L; hidroxibutirato, mg/dL ⫻ 96.05 ⫽ mol/L; osmolalidad, mOsm/kg ⫻ 1 ⫽ mmol/kg; intervalo osmolal, mOsm/kg ⫻ 1 ⫽ mmol/kg; etanol, mg/dL ⫻ 0.2171 ⫽ mmol/L; acetona, mg/dL ⫻ 0.172 ⫽ mmol/L; alcohol isopropı́lico, mg/L ⫻ 0.0166 ⫽ mmol/L; metanol, mg/L ⫻ 0.0312 ⫽ mmol/L; etilen glicol, mg/dL ⫻ 0.1611 ⫽ mmol/L. 2 PCO2, presión parcial de CO2; PO2, presión parcial de O2. 3 Intervalo osmolal ⫽ Osmolalidad Medida - Osmolalidad Calculada. Osmolalidad Calculada ⫽ (1.86 ⫻ [Sodio]) ⫹ ([Glucosa]/18) ⫹ ([Urea Nitrogenada]/2.8) ⫹ 9, en donde la concentración de sodio se expresa en miliequivalentes por litro y las concentraciones de glucosa y urea nitrogenada se expresan en miligramos por decilitro [Glasser (11 )]. 1 sis alcohólica (AKA) (3 ). Aunque es comúnmente observado, La AKA a menudo no es diagnosticada en los servicios de emergencia que reciben a los pacientes que son adictos crónicos al alcohol. Se estima que 20% de 1362 Clinical Chemistry 57:10 (2011) los pacientes con cetoacidósis tienen AKA (4 ). Los factores claves que conducen a AKA incluyen (a) malnutrición con disminución de glucógeno, (b) un aumento intracelular de la relación NADH/NAD⫹ secundaria al Estudio de Caso Clı́nico metabolismo del alcohol y la reducción del volumen de lı́quido (c) extracelular (3 ). La mayorı́a de los casos con AKA se presentan con dolor abdominal, náuseas y vómitos, que son causados en los pacientes por dejar repentinamente de comer y reducir su consumo de lı́quidos. Hallazgos fı́sicos comunes que se presentan incluyen taquicardia, taquipnea y dolor abdominal. AKA se caracteriza en el laboratorio clı́nico por un aumento en suero de las cetonas y un alta brecha aniónica. En su inicio, es un estado causal de hambre que provoca disminución del glucógeno hepático, deficiencia de insulina y aumento de las hormonas reguladoras (glucagón, cortisol, la hormona de crecimiento y las catecolaminas) (5 ). Este desequilibrio hormonal lleva a la mayor movilización de ácidos grasos libres desde el tejido adiposo y a un cambio metabólico hepático de lipogénesis a lipolisis y mayor gluconeogénesis. La mayorı́a de los ácidos grasos libres que entran en el hı́gado se metabolizan a los llamados cuerpos cetónicos: acetoacetato, -hidroxibutirato y acetona. Es importante señalar que “cuerpo cetonico” es en parte incorrecto, porque -hidroxibutirato, es generalmente el más frecuente “cuerpo cetonico,” y no es una cetona. AKA es particularmente desafiante a la fisiologı́a del paciente porque tiene caracterı́sticas positivas de retroalimentación continua. Por ejemplo, los pacientes con AKA normalmente presentan un volumen sanguı́neo disminuido debido al aumento prolongado vómito o diuresis por etanol. Esta contracción de volumen limita la excreción de cuerpos cetónicos y ácidos orgánicos, ası́ como aumenta las concentraciones de hormonas lipolı́tica y cetogénica. Aunque este paciente parecı́a haber tenido una acidosis metabólica alta de brecha aniónica con alcalosis respiratoria, pueden producirse otros desequilibrios ácido-base en AKA. En un estudio, el 30% de los pacientes con AKA tuvieron una doble alcalosis metabólica debido al prolongado vómito (5 ). AKA también puede asociarse con otras anormalidades de laboratorio, tales como el aumento de lactato en suero y de la brecha osmolal, ası́ como reducidas las concentraciones de electrolitos. Ambas concentraciones de urea nitrogenada y de creatinina están usualmente aumentadas, como los marcadores de la lesión hepática o pancreática (por ejemplo, enzimas, bilirrubina). Estos últimos hallazgos son más comúnmente debidos a enfermedades mórbidas, como la hepatitis inducida por el alcohol y la pancreatitis. Esta paciente presentaba todas estas alteraciones de laboratorio, excepto el de tener un valor muy bajo de nitrógeno ureico, que probablemente estaba reducido debido a la malnutrición. En la fisiopatologı́a de AKA, el metabolismo oxidativo del etanol a acetaldehı́do y acetato se produce en el hı́gado, causando un gran aumento de la proporción NADH/NAD⫹. Esta proporción anormal NADH/ NAD⫹ tiene ramificaciones metabólicas importantes, porque el regenerar NAD⫹ requiere del piruvato producido por la gluconeogénesis y otras vı́as, y que convertido a lactato, o en otro acetoacetato, se debe convertir a -hidroxibutirato. Por lo tanto, la alteración potencial de oxido reducción intracelular inducida por etanol es fundamental para explicar porque los pacientes con AKA presentan aumento de las concentraciones de lactato y de -hidroxibutirato. Los pacientes diagnosticados con AKA deben tratarse inmediatamente con glucosa 50 g/L en solución salina normal para abordar el estado de inanición y la falta de glucosa. En consecuencia aumentarán las concentraciones de insulina y glucagón y disminuirán otras hormonas reguladoras. Finalmente, este tratamiento estimula la oxidación de NADH para reactivar el metabolismo oxidativo normal de hidratos de carbono, reduciendo simultáneamente la relación NADH/NAD⫹ y deteniendo la cetogénesis. La terapia de insulina no se recomienda a menos que la DKA subyacente esté presente. La tiamina se da a menudo con glucosa para garantizar concentraciones de cofactor adecuados para las enzimas que participan en el metabolismo aeróbico de carbohidratos, como la deshidrogenasa piruvato. Un beneficio adicional es que la tiamina puede prevenir la encefalopatı́a de Wernicke (4 ). Por último, la hidratación intravenosa es uno de los pilares de la terapia para AKA. Reponer el fluido extracelular promueve la función renal normal, la eliminación del exceso de ácidos y las concentraciones de bicarbonato regresan a la normalidad. El aumento de la brecha osmolal observada en este caso no podı́a explicarse por el etanol solamente. En tales casos, resulta útil analizar directamente otras moléculas pequeñas comúnmente ingeridas, con actividad osmótica, tales como los pequeños alcoholes orgánicos. Además, la sospecha de una ingestión tóxica con una etiologı́a garantiza la investigación de la materia ingerida, como el consultar con el centro local de veneno sobre el contenido de los productos comerciales, o incluso solicitar una muestra del material desconocido para el análisis. El “licor casero” en cuestión no estaba disponible para análisis en este caso, pero en un análisis de cromatografı́a de gases del suero de la paciente se identificaron acetona (37 mg/dL) y alcohol isopropı́lico (14 mg/dL). La brecha osmolal calculada de 56 mOsm/kg fue por encima del lı́mite superior del intervalo de referencia en aproximadamente 46 mOsm/kg, una diferencia que podrı́a explicarse al aproximar las contribuciones aditivas de etanol (34 mOsm/kg, usando [etanol] ⫼ 3,8 ⫽ 1 mOsm/kg de mg/dL (6 )), acetona (6 mOsm/kg, usando [acetona] en mg/dL ⫼ 5,8 ⫽ 1 mOsm/kg)y alcohol isopropı́lico (2 Clinical Chemistry 57:10 (2011) 1363 Estudio de Caso Clı́nico mOsm/kg, ó usando [Alcohol isopropı́lico] en mg/ dL ⫼ 6 ⫽ 1 mOsm/kg). Aunque es posible que el licor casero consumido por esta paciente haya contenido alcohol isopropı́lico, existe otra posible explicación de su presencia. Estudios anteriores con pacientes diabéticos acetonemicos y vacas y ratas acetonemicas demuestran que en un entorno intracelular muy reducido podrı́a ser causa de que algunas acetonas se biotransformaran en alcohol isopropı́lico y concomitantemente regeneraran NAD⫹ (7,8 ). Ninguno de los individuos descritos en estos estudios fueron expuesto al alcohol isopropı́lico, pero todos tenı́an evidencia de alcohol isopropı́lico en suero. Estos hallazgos corroboran los informes anteriores del alcohol isopropı́lico presente en la sangre de los pacientes de autopsias no previamente expuestos al alcohol isopropı́lico, ası́ como estudios enzimáticos in vitro con alcohol deshidrogenasa (9 ). En resumen, AKA es una condición a menudo poco diagnosticada en los Estados Unidos. Aunque su fisiopatologı́a puede ser compleja, la condición puede resolverse rápidamente con terapia, resultando en una baja mortalidad (10 ). Aunque los resultados clı́nicos de AKA son muy similares a los de DKA, la diferenciación al admitirse se basa en la historia del paciente con diabetes o el alcoholismo y la concentración de glucosa plasmática. Pacientes con AKA normalmente presentan concentraciones de glucosa normal o baja y un historial de uso sustancial de alcohol. SEGUIMIENTO Aproximadamente 1 mes después de la salida del hospital, la paciente fue readmitida por múltiples abscesos subcutáneos consistentes con las secuelas del uso de drogas inyectables. Ella desarrolló sépsis y neumonı́a tras drenaje quirúrgico de estos abscesos, que se complicaron por un derrame cerebral y murió una semana más tarde. Contribuciones de autor: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han reunido los siguientes 3 requisitos: (a) contribuciones significativas a la concepción y diseño, adquisición de datos, o análisis e interpretación de datos; (b) redacción o revisión del contenido intelectual del artı́culo; y (c) la aprobación final del artı́culo publicado. Divulgaciones o posibles conflictos de intereses de los autores: Ninguno de los autores declararon un potencial conflicto de interés. Sección de Referencias Previas 1. Burtis CA, Ashwood ER, Bruns DEEndres DB, Rude RK. Mineral and bone metabolism. In: Burtis CA, Ashwood ER, Bruns DE, eds. Tietz textbook of clinical chemistry and molecular diagnostics (Manual Tietz de quı́mica clı́nica 1364 Clinical Chemistry 57:10 (2011) PUNTOS PARA RECORDAR • AKA se presenta en alcohólicos que beben desenfrenadamente y tienen poca o ninguna ingesta de cualquier otra calorı́a no alcohólica. Esto lleva al agotamiento del glucógeno, a cetosis, y a una mayor relación NADH/ NAD⫹ y deshidratación severa. • El tratamiento del AKA implica una simple reposición de lı́quidos con lı́quidos que contengan glucosa, electrolitos y tiamina. • Los pacientes con AKA se presentan con una brecha aniónica en combinación con un aumento mayor de la brecha osmolal. Los diagnósticos diferenciales cruciales del aumento de ambos aniones y brechas osmóticas son DKA, acidosis láctica o ingestión de metanol o etilenglicol. • Aunque tanto AKA como DKA comparten una sintomatologı́a común, un paciente con historia de uso sustancial de alcohol junto con una concentración de glucosa plasmática normal o por debajo de lo normal indicará AKA. y disgnóstico molecular). St. Louis: Elsevier Saunders; 2006. p 1896. 2. McGuire LC, Cruickshank AM, Munro PT. Alcoholic ketoacidosis. Emerg Med J 2006;23:417–20. 3. Flomenbaum NE, Goldfrank LR, Hoffman RS, Howland MA, Lewin NA, Nelson LSYip L. Ethanol. In: Flomenbaum NE, Goldfrank LR, Hoffman RS, Howland MA, Lewin NA, Nelson LS, eds. Goldfrank’s toxicologic emergencies. 8th ed. New York: McGraw-Hill; 2006. p 1154 – 8. 4. Tanaka M, Miyazaki Y, Ishikawa S, Matsuyama K. Alcoholic ketoacidosis associated with multiple complications: report of 3 cases (Ketoacidosis alcoholic asociada con complicaciones multiples: reporte de 3 casos). Intern Med 2004;43:955–9. 5. Umpierrez GE, DiGirolamo M, Tuvlin JA, Isaacs SD, Bhoola SM, Kokko JP. Differences in metabolic and hormonal milieu in diabetic- and alcoholinduced ketoacidosis (Diferencias en milieu hormonal y metabolic en ketoacidosisdiabética e inducida por alcohol). J Crit Care 2000;15:52–9. 6. Geller RJ, Spyker DA, Herold DA, Bruns DE. Serum osmolal gap and ethanol concentration: a simple and accurate formula (Osmolalidad ensuero y concentración de etanol: una simple y precisa fórmula). J Toxicol Clin Toxicol 1986;24:77– 84. 7. Bailey DN. Detection of isopropanol in acetonemic patients not exposed to isopropanol (Detección de isopropanol en pacientes acetonémicos no expuestos a isopropanol). Clin Toxicol 1990;28:459 – 66. 8. Jones AE, Summers RL. Detection of isopropyl alcohol in a patient with diabetic ketoacidosis (Detección de alcohol isopropyl en un paciene con ketoacidosis diabetica). J Emerg Med 2000;19:165– 8. 9. Davis PL, Dal Cortivo LA, Maturo J. Endogenous isopropanol: forensic and biochemical implications (Isopropanol endógeno: implicaciones forenses y bioquı́micas). J Anal Toxicol 1984;8:209 –12. 10. Wrenn KD, Slovis CM, Minion GE, Rutkowski R. The syndrome of alcoholic ketoacidosis (El sı́ndrome de ketoacidosis alcoholica). Am J Med 1991;91:119 –28. 11. Glasser DS. Utility of the serum osmol gap in the diagnosis of methanol or ethylene glycol ingestion (Utilidad de la osmolalidad en el diagnostic de ingestion de methanol o etilen glycol). Ann Emerg Med 1996;27:343– 6. Estudio de Caso Clı́nico Comentario Jeffrey A. Kraut1,2,3,4* La alta brecha aniónica en la acidosis metabólica puede ser una brecha osmolal mayor en el suero de los pacientes con antecedentes de alcoholismo debido a la intoxicación por metanol o etilenglicol y acidosis láctica, cetoacidosis diabética o alcohólicas. La intoxicación de alcohol isopropı́lico que se produce en este contexto también se asocia con una brecha osmolal, pero la acidosis es infrecuente en ausencia de hipoperfusion lo suficiente para producir acidosis láctica. Es importante poder identificar correctamente la causa e iniciar el tratamiento adecuado. Por desgracia, una historia de exposición a estas sustancias no se consigue siempre, y tales indicios clı́nicos como son la ceguera por intoxicación de metanol o los cristales urinarios en intoxicación por etilenglicol, no siempre están presentes. La acidosis metabólica y el aumento en suero de la brecha osmolal tampoco están presentes siempre juntas. Por ejemplo, con la intoxicación de metanol y etilenglicol, una osmolalidad en suero será mayor si se presenta tempranamente después de la exposición, pero la acidosis metabólica está ausente. Como el alcohol primario es metabolizado, disminuye la osmolalidad del suero, y se hace evidente una acidosis metabólica con una alta brecha aniónica. Cuando todo el alcohol primario ha sido metabolizado, solo estará presente una alta acidosis metabólica por brecha anionica (1 ). Por otra parte, en la cetoacidosis diabética o alcohólica, en suero la brecha osmolal puede estar normal o aumentada, dependiendo no sólo de la concen- 1 Medical and Research Services, Veterans Health Administration Greater Los Angeles (VHAGLA) Healthcare System, 2 UCLA Membrane Biology Laboratory, 3 Division of Nephrology, VHAGLA Healthcare System, and 4 David Geffen School of Medicine, Los Angeles, CA. * Dirigir correspondencia al autor a: Division of Nephrology, VHAGLA Heathcare System, 11301 Wilshire Blvd., Los Angeles, CA 90073. E-mail [email protected]. Recibido para publicación Febrero 16 de 2011. Aceptado para publicación Febrero 24 de 2011. tración de etanol en la sangre (en cetoacidosis alcohólica) sino también de la concentración de otros metabolitos osmóticamente activos surgidos en el curso de estos trastornos, como la acetona (o alcohol isopropı́lico, como en este caso) (2 ). Teniendo en cuenta las consecuencias potencialmente graves de una intoxicación por metanol y etilenglicol, o acidosis láctica y cetoacidosis alcohólica, estos trastornos deben ser reconocidos muy tempranamente en su curso. Hay una necesidad de contar con pruebas sencillas y rápidas para excluir estos trastornos, y varios laboratorios están trabajando hacia esa meta (3 ). El caso presentado subraya los retos que enfrenta el médico al investigar a los pacientes con trastornos graves de ácido-base y el valor de la comprensión de su fisiopatologı́a al efectuar un diagnóstico adecuado. Contribuciones de autor: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han reunido los siguientes 3 requisitos: (a) contribuciones significativas a la concepción y diseño, adquisición de datos, o análisis e interpretación de datos; (b) redacción o revisión del contenido intelectual del artı́culo; y (c) la aprobación final del artı́culo publicado. Divulgaciones o posibles conflictos de intereses de los autores: Ninguno de los autores declararon un potencial conflicto de interés. Referencias 1. Kraut JA, Kurtz I. Toxic alcohol ingestions: clinical features, diagnosis, and management (Ingestiones tóxicas de alcohol: caracterı́sticas clı́nicas, diagnóstico y manejo). Clin J Am Soc Nephrol 2008;3:208 –25. 2. Davidson DF. Excess osmolal gap in diabetic ketoacidosis explained (Exceso de osmolalidad en quetoacidosis diabética explicada). Clin Chem 1992;38: 755–7. 3. Shin J, Sachs G, Kraut JA. Simple diagnostic tests to detect toxic alcohol intoxications (Pruebas de diagnóstico simple para detector intoxicaciones tóxicas de alcohol)|. Transl Res 2008;152:194 –201. Comentario Nikola A. Baumann* Los hallazgos bioquı́micos tı́picos en pacientes con cetoacidosis alcohólica (AKA) incluyen aumento de la Departamento de Medicina de Laboratorio y Patologı́a, Mayo Clinic, Rochester, MN. * Dirigir correspondencia al autor a: Mayo Clinic, 200 First St. SW, Hilton 3-70, Rochester, MN 55905. E-mail [email protected]. brecha aniónica en la acidosis metabólica, aumento de cetonas en suero, una concentración de glucosa plasmática normal o baja, una concentración de lactato Recibido para publicación Marzo 15 de 2011. Aceptado para publicación Marzo 21 de 2011. Clinical Chemistry 57:10 (2011) 1365 Estudio de Caso Clı́nico en plasma aumentada y valores normales o aumentados de creatinina en suero y urea nitrogenada en sangre. Hay algunas advertencias a los hallazgos de laboratorio descritos en este estudio de caso clı́nico que son importantes para discutir. Como se mencionó en el informe del caso, los desequilibrios mixtos acido-base pueden ocurrir en pacientes con AKA debido a los procesos de enfermedad concurrente. Por lo tanto, el pH del suero reflejará el balance final de estos factores y no necesariamente puede estar bajo. Un aumento en suero de “cetonas” es una marca registrada para AKA; sin embargo, la proporción de -hidroxibutirato a acetoacetato es notablemente mayor en los pacientes con AKA que en aquellos con cetoacidosis diabética. Muchos laboratorios utilizan ensayos semicuantitativos basado en nitroprusiato para medir rápidamente las cetonas (por ejemplo, Acetest). Los ensayos basado en nitroprusiato son las pruebas más sensibles para detectar acetoacetato y no detectan al -hidroxibutirato. Estas pruebas pueden producir un resultado bajo a moderado en pacientes con AKA incluso cuando la concentración de -hidroxibutirato se incrementa notablemente. Anormalidades en los electrolitos, incluyen hiponatremia e hipopotasemia, y suelen estar presentes en pacientes con AKA, y la hipokalemia es un fuerte indicador de hipomagnesemia. La sustitución de 1366 Clinical Chemistry 57:10 (2011) potasio y magnesio pueden requerirse como parte del tratamiento, y debe vigilarse el potasio en suero. Finalmente, el etanol puede estar bajo o indetectable en el suero de pacientes con AKA debido a un menor consumo en los dı́as anteriores a la presentación. Además, la evidencia de hepatitis alcohólica es común en estos pacientes, y la actividad en suero de la bilirrubina y las transaminasas frecuentemente están aumentadas. El caso clı́nico descrito por Platteborze y sus colegas es un caso de enseñanza excelente que discute los hallazgos de la clı́nica y del laboratorio en un paciente presentándose al departamento de urgencias con AKA. Los laboratorios y los médicos deben poder reconocer a los pacientes con AKA y ser conscientes de la complejidad de estos casos y del impacto de condiciones coexistentes en los resultados de laboratorio. Contribuciones de autor: Todos los autores confirmaron que han contribuido al contenido intelectual de este documento y han reunido los siguientes 3 requisitos: (a) contribuciones significativas a la concepción y diseño, adquisición de datos, o análisis e interpretación de datos; (b) redacción o revisión del contenido intelectual del artı́culo; y (c) la aprobación final del artı́culo publicado. Divulgaciones o posibles conflictos de intereses de los autores: Ninguno de los autores declararon un potencial conflicto de interés.