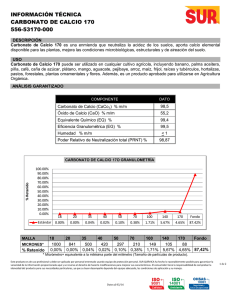
REPBLICA DE VENEZUELA
Anuncio

REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD RAFAEL URDANETA FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA QUIMICA O D A V R E S E ECHOS R DER S DESARROLLO DE MODELOS FISICO-QUIMICOS PARA LA CARACTERIZACION DE AGUAS DE FORMACION/INYECCION DEL FLANCO OESTE DE LA U.E LAGOMEDIO TRABAJO ESPECIAL DE GRADO PARA OPTAR AL TÍTULO DE INGENIERO QUÍMICO PRESENTADO POR: BR.HALINA, NAVA N C.I. V-15.009.352 ASESORADO POR: TUTOR ACADÉMICO ING. LENIN HERRERA TUTOR INDUSTRIAL ING. YOANNA SICILIANO MARACAIBO, SEPTIEMBRE DE 2006 O D A V R E S E ECHOS R DER S DESARROLLO DE MODELOS FISICO-QUIMICOS PARA LA CARACTERIZACION DE AGUAS DE FORMACION/INYECCION DEL FLANCO OESTE DE LA U.E LAGOMEDIO S O D A V R E S S RE O H C E R E D Dedicatoria A mis amados Padres, Hermanas y a mis queridos sobrinos. III AGRADECIMIENTOS A mi tutora Industrial, Ing. Yoanna Siciliano por impartirme sus conocimientos y guiarme en la elaboración de este trabajo especial de grado, además por apoyarme, aconsejarme, fortalecer mi paciencia y por ser ejemplo de dedicación en el trabajo, profesionalismo y creatividad. S O D A V R E S S RE O H C E R E DIng. Evelis Perdomo, por formar parte fundamental para llevar a cabo especial a la A todo el personal de desarrollo de Yacimientos de la U.E Lagomedio en esta investigación. A todo el personal de la U.E Lagomedio en especial a la Ing. Isberia Ochoa, Ing. Antonio Lopez, Ing. Amado Navarro por apoyarme en la aprobación del laboratorio para los análisis físico-químicos, los cuales significan la base fundamental del presente trabajo y para la unidad. A todo el personal del Laboratorio de Corrosión y Tratamiento Químico, por compartir conmigo esos meses en el laboratorio y transmitirme todos sus conocimientos y experiencias profesionales. A mi tutor Academico, Ing. Lenin Herrera por sus valiosos conocimientos y por guiarme a través de la elaboración del presente trabajo. A mi tutora Lic. Betilia Ramos, por sus consejos y apoyo para la aplicación de una metodología correcta y sencilla. En general a todas las personas que de una y otra forma han sido mi apoyo, me han brindado ánimo mientras he decaído, y a todos los que me han ayudado en el transcurso de esta investigación ardua e interesante la cual he llevado a cabo gracias a la ayuda de todos ustedes. IV NAVA, NAVA Halina C. DESARROLLO DE MODELOS FISICO-QUIMICOS PARA LA CARACTERIZACIÓN DE AGUAS DE FORMACIÓN/INYECCIÓN DEL FLANCO OESTE DE LA U.E LAGOMEDIO. Trabajo Especial de Grado para optar al título de Ingeniero Químico. Universidad Rafael Urdaneta. Facultad de Ingeniería. Escuela de Química. Maracaibo. República Bolivariana de Venezuela. 2006.p Resumen S O D A V R E S S RE O H C E R E D Los yacimientos primarios pertenecientes a la edad eoceno, formación misoa, arenas C, forman parte de los yacimientos del flanco oeste de la U.E Lagomedio. A través del tiempo estos yacimientos han presentado una alta producción de agua y a su vez no presentan patrones definidos para identificar este fluido. Con la siguiente problemática se lleva a cabo este trabajo que tiene como finalidad caracterizar las aguas asociadas al crudo. Para ello se siguió una metodología para caracterizar el fluido y así clasificar el agua según su composición química, y su comportamiento determinado a través de gráficos, tendencia de formación de incrustaciones por medio del índice de stiff y davis y cálculos de resistividad. Se concluyo que el agua de los yacimientos primarios del flanco oeste es de origen meteórica del tipo bicarbonato de sodio, con tendencia a la formación de incrustaciones de carbonato de calcio y con niveles de resistividad adecuados con la salinidad del agua. Se definió un patrón representativo para cada uno de los yacimientos predominando el sodio para los cationes y el bicarbonato para los aniones. Se establecieron parámetros para la toma de muestras representativas así como criterios de validación y descarte de para la data de análisis físicoquímicos, los cuales permitieron elaborar un patrón que significa un aporte fundamental para los ingenieros de desarrollo de yacimientos de la U.E Lagomedio. Palabras claves: agua de formación, patrones, caracterización, meteórica, bicarbonato de sodio, muestras representativas, análisis físico-químicos, resistividad, formación de incrustaciones, yacimientos, clasificación del agua. E-mail: [email protected] V DEDICATORIA……………………………………………………………………….III AGRADECIMIENTOS………………………………………………………………..IV RESUMEN.............................................................................................................V ÍNDICE GENERAL............................................................................................…VI ÍNDICE DE GRÁFICOS………………………………………………………………..XI S O D A V R E S S RE O H C E R E D LISTA DE ANEXOS.............................................................................................XIII ÍNDICE DE TABLAS.................……………………………………………………...XII INTRODUCCIÓN……………………………………………………………………XIV CAPÍTULO I. EL PROBLEMA. 1.1- Planteamiento y Formulación del Problema…………………………...........1 1.2- Objetivos de la Investigación………………………………………………….2 1.2.1- Objetivo General………………………………………. ……………....2 1.2.2- Objetivos Específicos……………………….......................................2 1.3- Justificación e Importancia de la Investigación……………………………....2 1.4- Delimitación de la Investigación………………………..................................3 1.4.1- Delimitación Espacial……………………………. …………………......3 1.4.2- Delimitación Temporal………………………. ……………………….....3 CAPÍTULO II. MARCO TEÓRICO. 2.1- Antecedentes de la Investigación...................................................................4 2.2- Fundamentación Teórica……...……….........................................................8 2.2.1- Aguas de Formación......................................................................8 2.2.2- Composición Química………………………………………………. 9 2.2.3- Unidades………………………………………………………………10 2.2.- Caracterización.............................................................................12 2.2.3- Clasificación de las Aguas de Formación………………………….16 2.2.3.1- Clasificación Genética……………………………………. 16 2.2.4- Clasificación propuesta por Sulin……………………………….…. 18 2.2.5- Clasificación propuesta por Bojarski………………………………..21 2.2.6- Clasificación propuesta por Schoeller………………………………23 2.2.7- Clasificación propuesta por Chebotarev………….…………………27 2.2.8- Métodos de Identificación Gráfica usados en la Caracterización de las Aguas de Formación…….…………………………...……..29 S O D A V R E S S RE O H C E R E D 2.2.11-Diagrama de Sulin…………………………………….…………….33 2.2.9- Gráfico de Reistle……………………………………………………29 2.2.10- Método Gráfico de Stiff………………………………….…………30 2.2.12- Diagrama Ternario......................................................................33 2.2.13- Mezclas de aguas. Método de McKinnell…………………………36 2.2.14- Diagrama de Piper…………………………………………………..39 2.2.15- Diagrama de Schoeller………………………………………………40 2.2.16- Diagrama de Barras de Collins……………………………………..40 2.2.17- Predicción de la Tendencia a depositar Carbonato de Calcio y Sulfato de Calcio………………………………………………........….41 2.2.17.1- Tendencia a depositar Carbonato de Calcio…..………....43 2.2.17.2-Escamas de Carbonato de Calcio……..............................43 2.2.17.2.1- Método de Langelier……………………………53 2.2.17.2.2- Método de Larson y Buswell…………………..53 2.2.17.2.3- Método de Ryznar……………………………...54 2.2.17.2.4- Método de Stiff y Davis………………………...55 2.2.18.Sulfato de Calcio…………………………………………….………..58 2.2.18.1- Métodos para diagnosticar la Tendencia de Depósitos de Sulfato de Calcio……………………………………………………………………......62 2.2.19-Resistividad del Agua de Formación………………………….…..60 2.2.19.1 Métodos para determinar la resistividad del agua de formación…………………………………....................................................66 CAPÍTULO III. MARCO METODOLÓGICO 3.1-Tipo de Investigación.......................................................................71 3.2-Selección de la Población y Muestra de Estudio…………………….72 3.2.1.- Población o Universo…………………………………………..72 3.2.2.- Muestra…….…………………………………………………....73 3.3 Técnica de Recopilación de la Información………………………….73 S O D A V R E S S RE datos…………………………………………………………………………….74. O H C E R E D 3.3.1.2 Trabajo de Campo………………………………………………75 3.3.1 Técnicas e Instrumentos realizados para la recopilación de los 3.3.1.3 Requerimiento para la toma de muestras representativas…..76 3.3.2. Calidad del Dato y Control de Calidad……………………….....78 3.3.3 Parámetros para la Toma de Muestras………………………….79 3.3.4 Información para el descarte de las muestras…………………..82 3.4.1 Balance Iónico……………………………………………………………83 3.5.- Criterios de Validación de las muestras……………………………….83 3.6.- Caracterización de las aguas de formación……………………….....87 3.7.- Definición del Patrón de agua de formación…………………………..87 3.8.- Obtención del Patrón de agua de formación………………………….88 3.9.- Realización de Histogramas de Frecuencia por componente………89 3.10 Clasificación de las aguas de formación………………………………90 3.11 Cálculo de la resistividad del agua de formación…………………….90 3.12 Predicción de Tendencia que tienen las aguas a precipitar carbonato de calcio………………………………………………………………………....92 3.13 Determinación de Mezclas………………………………………………93 CAPÍTULO IV. RESULTADOS Y ANALISIS DE RESULTADOS 4.1 Caracterización del Yacimiento C6S/M-SVS0013……………………94 4.2 Caracterización del Yacimiento C6I-SVS0012……………………….97 4.3 Caracterización del Yacimiento C5-SVS0014………………………100 4.4 Caracterización del Yacimiento C7-SVS0005………………………103 4.5 Caracterización de la Planta PIA 69………………………………….106 CONCLUSIONES………………………………………………………………….108 RECOMENDACIONES……………………………………………………………110 BIBLIOGRAFíA……………………………………………………………………..111 ANEXOS. S O D A V R E S S RE O H C E R E D INDICE DE GRAFICOS Fig # Pág. CAPITULO II. MARCO TEÓRICO 2.1. Grafico de Reistle……………………………………………….29 S O D A V R E S E S RLogarítmica…………………………….31 2.3 Grafico deH Stiff Escala O C E R E D 2.2 Gráfico de Stiff escala Lineal……………………………………31 2.4. Gráfico de Sulin………………………………………………….33 2.5. Diagrama Ternario Agua Meteórica………………………….. 35 2.6 Diagrama Ternario Agua Connata……………………………..35 2.7 Gráfico Semi-logaritmico de McKinell………………………… 38 2.8 Diagrama de Piper………………………………………………39 2.9. Diagrama de Schoeller………………………………………….40 2.10. Diagrama de Barras de Collins……………………………….41 2.11. Gráfico de la influencia de la presión del CO2 en la solución del CaCO3……………………………………………………46 2.12. Gráfico del Efecto de la Temperatura en la solubilidad del CaCO3………………………………………………………….48 2.13. Gráfico del Efecto de la Temperatura en la Solubilidad del CaSO4……………………………………..............................60 CAPITULO III. MARCO METODOLÓGICO 3.1 Histograma de Frecuencia………………………………………89 3.2. Gráfico del Método de Stiff……………………………………..90 3.3. Gráfico de la Concentración Total de Sólidos vs Factores multiplicadores para determinar Rw a partir de análisis físicoquímicos………………………………………………………….91 CAPITULO IV. RESULTADOS Y ANALISIS DE RESULTADOS 4.1 Diagrama de Schoeller. Patrón C6S/M-SVS0013………………….95 4.2 Diagrama de Piper Patrón C6S/M-SVS0013………………………. 96 4.3 Diagrama de Stiff Patrón C6S/M-SVS0013…………………………97 4.4 Diagrama de Schoeller Patrón C6I-SVS0012………………………99 S O D A V R E S RE SC6i-SVS0012……………………………100 4.5 Diagrama E de C StiffH Patron O R E D 4.6 Diagrama de Schoeller Patrón C5-SVS0014…..………………….102 4.4 Diagrama de Piper Patrón C6I-SVS0012……………………………99 4.7 Diagrama de Piper Patrón C5-SVS0014……………………………102 4.8 Diagrama de Stiff Patrón C5-SVS0014………………………………103 4.9 Diagrama de Schoeller Patrón C7-SVS0005……………………….105 4.10 Diagrama de Piper Patrón C7-SVS0005…………………………105 4.11 Diagrama de Stiff Patrón C7-SVS0005……………………………106 4.12 Diagrama de Schoeller Patron PlA-69……………………………108 4.13 Diagrama de Piper Patrón PIA-69…………………………………108 4.14 Diagrama de Stiff Patrón PIA-69…………………………………109 INDICE DE TABLAS CAPITULO II. MARCO TEÓRICO 2.1. Sistemas de Clasificación de aguas de Sulin………………………19 S O D A V R E S S RE yacimientos petrolíferos……………………………………………… 26 O H C E R E D 2.2. Sistema de Schoeller para la clasificación de las aguas asociadas a 2.3 Tipos y Clases de aguas según Chebotarev………………………..29 2.4 Incrustaciones comunes en los campos petroleros…………………42 2.5 Índice de Saturación de Carbonato de Calcio……………………….52 2.6 Interpretación del Índice de Stiff & Davis………………………… …..56 2.7 Factores de conversión para el cálculo del esfuerzo iónico………..56 CAPITULO III. MARCO METODOLOGICO 3.1 Pozos seleccionados como muestras representativas para análisis físico-químicos…………………………………………………………73 3.2 Requerimiento especial para manipulación y toma de muestras de agua de formación/inyección…………………………………………77 3.3 Factores de Conductividad para iones comúnmente encontrados en aguas @25ºC …………………………………………………………84 3.4 Equilibrio entre aniones y cationes……………………………………85 CAPITULO IV. RESULTADOS Y ANALISIS DE RESULTADOS 4.1 Muestras para Patrón C6S/M-SVS0013………………………………94 4.2 Muestras para Patrón C6I-SVS00012…………………………………97 4.3 Muestras para Patrón C5-SVS0014…………………………………...99 4.4 Muestras para Patrón C7-SVS0005………………………………….101 4.5 Muestras para Patrón Planta de Inyección de Agua PIA-69………103 LISTA DE ANEXOS ANEXO A. Nuevos Análisis Físico-Quimicos, Muestras Representativas. ANEXO B Requerimientos para la Toma de Muestras Representativas. S O D A V R E S S RE O H C E R E D ANEXO C Descripción de los Análisis mas comunes efectuados al agua de campos petroleros. ANEXO D Graficos, Columnas y Tablas para el Calculo de Rw INTRODUCCION Se entiende por yacimiento a una unidad geológica de volumen limitado, porosa y permeable, capaz de contener hidrocarburos líquidos y/o gaseosos. Este concepto implica la correlación de dos aspectos fundamentales para la industria petrolera, como lo es las consideraciones geológicas y las S O D A V R E S S RE O H C E R E D siempre está presente en los yacimientos de hidrocarburos. Así, El agua propiedades de los fluidos contenidos en los yacimientos. un conocimiento de las propiedades físicas y químicas de la misma es de suma importancia para el estudio de yacimientos. En un yacimiento el espacio poroso está ocupado por un fluido que puede ser agua, gas o petróleo, o una combinación de éstos. La mayoría de los yacimientos contienen agua de formación aun en condiciones de humectabilidad por petróleo. El agua de formación se define como aquella que se encuentra naturalmente en las rocas y está presente antes de la perforación de un pozo, su composición y salinidad es variable; depende del origen del agua y de la modificación que puede ocurrir una vez que entra en el ambiente del subsuelo. Algunas aguas del subsuelo encontradas en sedimentos profundos, son atrapadas durante la sedimentación, mientras que otras se han infiltrado desde la superficie a través de afloramientos. Esto implica que el agua de formación puede ser una mezcla entre el agua infiltrada y al agua atrapada entre mares antiguos. Las rocas que las contienen frecuentemente poseen constituyentes solubles que se disuelven en el agua, o contienen elementos químicos los cuales se intercambian con los del agua, determinando cambios en los constituyentes disueltos. Toda agua de formación contiene sales disueltas. La cantidad y relación de estas sales depende principalmente, del origen del agua y de lo que ha ocurrido a ésta una vez que entra en el ambiente del subsuelo. El contenido de sólidos totales disueltos está VI representado principalmente por cationes y aniones, cuya cantidad y relaciones Inter-iónicas son la base de un gran número de sistemas de clasificación. Para efectuar la caracterización del agua de formación, se revisaron los análisis físico-químicos de 220 muestras pertenecientes a 5 yacimientos del flanco oeste de la segregación Lagomedio , las cuales serán validadas para S O D A V R E S S RE O H C E R E formación D tales como: métodos de clasificación genética, según establecer los patrones característicos del agua, a partir de los cuales podrán aplicarse los diferentes métodos de clasificación y caracterización del agua de Sulin, Bojarski y Schoeller, métodos gráficos tales como diagrama de Stiff, ternario, McKinell, Collins y Piper. La determinación de la tendencia incrustante en el agua de formación, ayuda a identificar problemas de formación de escamas que pueden disminuir la producción de fluidos, y proporciona una orientación para aplicar tratamientos de inyección de química específicos, que permitan recuperar el potencial perdido en el pozo. El índice de Stiff y Davis es actualmente reconocido como un modelo matemático adecuado para la estimación del potencial incrustante del agua en condiciones de equilibrio con CO2, especialmente a fondo de pozos donde existen las condiciones más críticas para formar escamas ya que la tendencia incrustante es modificada por cambios de presión estática en el yacimiento, de fondo fluyente en el pozo y cambios en la composición del agua de formación. La metodología será aplicada en varios yacimientos del Flanco Oeste de dicha Segregación, cuya producción de agua se ha incrementado significativamente. En vista de la necesidad actual de tener control sobre las aguas producidas de los yacimientos, surge la importancia de caracterizar el agua de formación e inyección, lo cual permitiría una mejor definición del tipo VII de trabajo a realizar en pozos con problemas de alta producción de agua, con el fin de corregirla. Para el estudio serán necesarios análisis físico-químicos realizados a muestras de aguas representativas provenientes de los pozos, lo que permitirá definir mediante el Diagrama de Stiff el patrón característico del agua de formación, proyectado en un gráfico basado en la composición química de las S O D A V R E S S RE O H C E R E D estratigráficos. aguas provenientes de los distintos yacimientos, permitiendo identificar visualmente el agua, su comportamiento y tendencia en los distintos niveles Se estudiará además, la metodología para el análisis de mezclas de agua mediante el Método de McKinnell y para la clasificación de las aguas según su origen, meteórica o connata, utilizando el Método de Sulin, Bojarski y Schoeller. Con los resultados de la aplicación de estos métodos a los análisis de muestras de agua, se busca sentar una metodología de fácil interpretación que permita utilizar la caracterización de las aguas de formación como un medio para la identificación de fuentes productoras de agua y para la corrección de problemas de producción de agua en los pozos. VIII CAPITULO I. EL PROBLEMA 1.1 PLANTEAMIENTO Y FORMULACION DEL PROBLEMA En las últimas décadas la industria petrolera ha desarrollado varias investigaciones dirigidas a determinar los modelos físico-químicos requeridos para la caracterización de las aguas asociadas a acumulaciones S O D A V R E S S RE O H C E R E Dasí como también determinar la compatibilidad de las aguas de del agua, de hidrocarburos, con el objetivo de tener un mayor conocimiento de los yacimientos y definir la fuente productora sobre la base de la composición inyección usadas en los proyectos de recuperación secundaria, optimizando de esta manera el control y seguimiento de la misma. De lo anterior se desprende la importancia del análisis físico-químico del agua ya que si las muestras son recolectadas y analizadas cuidadosamente, ellas constituyen una valiosa fuente de información en el campo petrolero, ya que éstas establecen patrones definidos para caracterizar las aguas de formación e inyección. El Flanco Oeste de la Unidad de Explotación Lagomedio, actualmente no cuenta con los patrones definidos para la identificación de las aguas de formación e inyección de los yacimientos principales, razón por la cual se considera necesario desarrollar diferentes modelos físico-químicos de caracterización para analizar los componentes del agua a través de diferentes métodos de clasificación para cada pozo, para luego establecer los patrones de las aguas de formación e inyección de los diferentes yacimientos de dicho flanco. 1 CAPITULO I. EL PROBLEMA 1.2 OBJETIVOS DE LA INVESTIGACION 1.2.1 OBJETIVO GENERAL Desarrollar Modelos Físico-Químicos para la caracterización de Aguas de Formación/Inyección del Flanco Oeste de la U.E Lagomedio. S O D A V R E S RE Físico-Químicos de muestras de Recopilar la Información de los S Análisis O H C E R E D 1.2.2 OBJETIVOS ESPECIFICOS • aguas de formación/inyección pertenecientes al Flanco Oeste. • Establecer criterios de Validación y Descarte de los Análisis FísicoQuímicos en muestras de agua. • Recolectar nuevas muestras de agua en los pozos y planta de inyección para posterior análisis Físico-Químico. • Validar los Análisis Físico-Químicos de acuerdo a los criterios establecidos. • Determinar los Modelos químicos para la caracterización de las aguas de formación/inyección. • Definir los patrones de los yacimientos seleccionados y de la planta de inyección a través de métodos estadísticos. • Caracterizar el agua de formación/inyección de las muestras recolectadas. 1.3 JUSTIFICACION E IMPORTANCIA DE LA INVESTIGACION Una vez definidos los modelos de las aguas de formación correspondientes al Flanco Oeste de la Unidad de Explotación Lagomedio, se demostró que la caracterización de las aguas de formación e inyección es una herramienta útil, para ubicar en un pozo productor de hidrocarburos el horizonte que la aporta, La ubicación de esta fuente extraña o infiltración en el pozo permite optimizar el control y seguimiento del comportamiento, de producción / inyección en los pozos, con la finalidad de diagnosticar con mayor 2 CAPITULO I. EL PROBLEMA certeza el origen del agua producida y con ello definir el tipo de trabajo más acorde que logre controlar la producción excesiva de agua, hacer los trabajos de reparación, cambios de zona y detección de comunicación mecánica entre dos yacimientos. Adicionalmente la caracterización del agua de formación da un diagnostico S O D A V R E S S RE O H C E R E D acerca de la tendencia a la formación de incrustaciones, corrosión, cálculos de resistividad, así como también detectar y resolver problemas de producción. 1.4 DELIMITACION DE LA INVESTIGACION 1.4.1 DELIMITACION ESPACIAL El desarrollo de los modelos físico-químicos para la caracterización de aguas de formación e inyección se llevó a cabo en él Flanco Oeste de la Unidad de Explotación Lagomedio, Bloque IX y XIV del Lago de Maracaibo. Dicho estudio representa una estrategia clave para el departamento de desarrollo de yacimientos de la U.E Lagomedio. 1.4.2 DELIMITACION TEMPORAL El período de duración del presente trabajo de investigación fue de ocho (8) meses, iniciando el 25 de Noviembre de 2.005 y culminando el 25 de Julio de 2.006. 3 CAPITULO II. MARCO TEORICO 2. MARCO TEORICO 2.1 ANTECEDENTES La gran importancia de caracterizar las aguas de formación para aclarar el origen, proceso de migración, régimen hidrogeológico de S O D A V R E S que estudian estos E R S O H C E en Venezuela se han hecho pocos trabajos en DENoRobstante, aspectos. entrampamiento y acumulación de hidrocarburos, queda demostrada por el gran número de publicaciones internacionales esta área. Los trabajos existentes se concentran en la Cuenca del Lago de Maracaibo, y en menor proporción en la Cuenca Oriental de Venezuela, teniéndose un conocimiento escaso de las otras regiones del país. Se realizó una revisión sobre la base de investigaciones anteriores, con la intención de encontrar soportes que ayudaran al mejor desarrollo del presente estudio. A continuación se presenta una breve descripción de los trabajos de investigación revisados para iniciar este estudio: ESTUDIOS EN LA CUENCA DEL LAGO DE MARACAIBO Dikkers y Richardson, realizaron los primeros estudios de aguas de formación en Venezuela se llevaron a cabo en la Cuenca del Lago de Maracaibo, estudiaron muestras de aguas de formación obtenidas de las calizas del Cretáceo. Soto C, estudia el origen del agua de formación en el área del Proyecto M-6 al este del campo Tía Juana, determinó un origen meteórico y postula como área de recarga los sedimentos del Eoceno que afloran al este del área estudiada. 4 CAPITULO II. MARCO TEORICO Soto, realizó un estudio sobre la composición química de los sólidos disueltos en las aguas de formación del Campo La Paz, ubicado a unos 45 Km. al oeste de la ciudad de Maracaibo y a unos 20 Km al noreste del Campo La Concepción. Estas aguas han sido consideradas como remanentes de mares antiguos que variaron posteriormente su composición química. Se encuentra que la concentración de sólidos S O D A V R E S S RE O H C E R E D disueltos incrementa con la profundidad, aunque ocasionalmente se encuentran aguas de mucha menor salinidad. El análisis químico de las aguas producidas de yacimientos de edad Precretáceo hasta Eoceno en el Campo La Paz, permitió su clasificación de acuerdo con la clasificación de Sulin y a los diagramas de Stiff; estableciendo que el agua obtenida del Paleoceno es meteórica perteneciente a la clase bicarbonato de sodio, y el agua obtenida en los estratos productores del Cretáceo y del Basamento presentan características de agua connata de clase cloruro de calcio. Soto y Puche, en MARAVEN, S.A., realizaron un estudio importante en la Cuenca del Lago de Maracaibo clasificaron un total de 571 muestras de agua de los campos de tierra y lago, a partir de datos obtenidos de diferentes fuentes, incluyen al Departamento de Química de producción y Petrofísica de MARAVEN, S.A., reporte internos, archivos de pozos y datos de otras compañías. La información recaudada fue ordenada por campos y períodos geológicos, para luego ser llevada a tablas construidas para tal efecto y clasificada de acuerdo a los métodos de Sulin y Stiff. 5 CAPITULO II. MARCO TEORICO Álvarez Ninoska y Ferrer Liliana., 1995, elaboraron un estudio titulado “Caracterización de las aguas de formación de las áreas VLA11/12, VLA-62 del Bloque I del Lago de Maracaibo”. En éste aplican una metodología que incluye criterios de rechazo de muestras para la generación de los patrones del agua de formación en la caracterización de éstas, así como también los métodos de clasificación de Sulin, Stiff, S O D A V R E S S RE O H C E R E D Arzola Emir y Zambrano Adriana., 1996, realizaron diagramas ternarios y Mckinnell. la caracterización de aguas de formación del Eoceno C-Inferior, Bloque III perteneciente al Lago de Maracaibo. En este estudio aplicaron el método del diagrama de Stiff, y establecen una metodología para identificar los volúmenes de producción de agua por arena y/o yacimiento, cuando existen hasta dos de ellos abiertos a producción. Bello L. Ana M., 1995, elaboró un trabajo titulado “Caracterización de las aguas de formación de los yacimientos Laguna y Lagunillas, VLC52/VLD-192”. En éste se aplicaron los métodos de Sulin y Stiff para la caracterización, además de estudiar la compatibilidad de las aguas. Martínez Mirna, 1989, realizó la caracterización de aguas de formación en el Bloque III del Lago de Maracaibo. Aplicó los métodos de Sulin, Stiff y diagramas ternarios para la clasificación, además de pronosticar la tendencia de depósitos de carbonato de calcio (CaCO3). Vásquez geoquímica de C. Yaneth E., 1998, realizó la caracterización aguas de formación del Domo Sur, Campo Motatán. Utilizó los sistemas de clasificación de Sulin, Piper y Stiff para la caracterización y determinación del patrón de agua. 6 CAPITULO II. MARCO TEORICO Heredia M. y Padilla M. (1990), efectúan la caracterización del agua de formación del Campo Ceuta, basándose en la comparación de los diagramas de Stiff, diagramas ternarios y la clasificación de Sulín. Establecieron la tendencia incrustante del agua con el índice de Stiff y Davis, y determinaron la relación de mezcla de aguas mediante McKinnell. S O D A V R E S S RE O H C E R E D representativos para caracterizar el agua de formación en el Bloque V- Toan N. y Taborda L. (1998), indican la existencia de análisis no Centro Lago por problemas en la toma de muestra, y sugieren algunas metodologías para caracterización y muestreo que minimizan los errores en estos procesos. Gallego, Marisela, caracterizó las aguas de formación asociadas a las 8 sub-unidades que conforman el yacimiento Eoceno c Inferior en el Bloque III del Lago de Maracaibo. Además propuso una metodología para caracterizar aguas de formación puras. Castellano y Colina. (1990), presentan una base de datos de caracterización de aguas de formación denominado “CARAGUA”, el cual permite almacenar toda la información de las muestras y patrones de agua recolectadas de los pozos, y a la vez permite obtener el gráfico, resultante del análisis efectuado con opción a obtener una impresión del mismo. Verdier, realizó la caracterización de las aguas de formación presentes en los yacimientos Eoceno C Superior e Inferior y Cretáceo, sectorizándolas por área, dentro de los campos en explotación del Bloque V en el Lago de Maracaibo. Para ello, utilizó los métodos de representación gráfica de Stiff y diagrama Ternario. 7 CAPITULO II. MARCO TEORICO Rivas, caracterizó las aguas de formación asociados a los yacimientos del área VLA-6/8 del Bloque I del Lago de Maracaibo. 2.2 FUNDAMENTACION TEORICA 2.2.1 AGUAS DE FORMACION. S O D A V R E S S RE O H C E R E D conocer un poco acerca de todo lo relacionado con la misma importancia Para la caracterización de las aguas de formación es de gran (definición, orígenes, clasificación etc). A continuación se presenta una terminología relacionada con dichas aguas. El agua de formación se define como el agua que se encuentra naturalmente en las rocas. Esta agua ha podido tener diferentes orígenes y ser clasificadas como aguas marinas, interticiales y diagenéticas, etc. Las aguas de formación son el producto de un proceso geológico ocurrido durante muchos años de deposición de sedimentos quedando entrampadas entre los mismos. Una vez que el agua entre en el ambiente del subsuelo existirán diferencias y razones de mezclas en sus constituyentes. Las características del agua de formación, entrampada originalmente en los espacios porosos de la roca, dependerán del ambiente sedimentario de deposición, la era geológica, la profundidad, el gradiente hidráulico, los elementos solubles de la roca asociada, la movilidad de los elementos químicos disueltos y la magnitud del intercambio iónico ó reacción química de los constituyentes. 8 CAPITULO II. MARCO TEORICO El agua de formación de un horizonte productor, es químicamente diferente al de otro, por lo tanto si en un pozo productor de hidrocarburo el agua irrumpe abruptamente, un análisis físico-químico del agua producida, podría utilizarse como elemento de juicio adicional para identificar la fuente de producción de éste fluido. Además permite detectar comunicación vertical entre yacimiento, identificar acuíferos, optimizar S O D A V R E S S RE O H C E R E D COMPOSICION QUIMICA programas de reparación de pozos, entre otros. (Ostroff, A.G; 1965) El Instituto Americano del Petróleo, presentan los métodos analíticos en donde recomiendan que se obtengan siete constituyentes principales del agua de formación: Sodio (Na+), Calcio (Ca++), Magnesio (Mg++), Cloruro (Cl-), Sulfato (SO4=), Bicarbonatos (HCO3-) y Carbonatos (CO3=). Usualmente se asume que los iones de Cl-, SO4=, HCO3- y CO, conforman prácticamente el 99% ó más de los radicales ácidos, ya que los aniones (I-), Bromuro (Br-), Fluoruro (F-), entre otros, se presentan en pequeñas cantidades en las aguas de formación. También, se supone que los iones positivos son Na+, Ca++ y Mg++, pero esto no es totalmente cierto, porque los iones de potasio (K+), Hierro (Fe++), Estroncio (Sr++) y Bario (Ba++) pueden presentarse en cantidades considerables en el agua; cuando esto ocurre hay que determinarlos analíticamente en los laboratorios de análisis físico-químicos. En la composición química del agua de formación la suma de los pesos equivalentes de los iones positivos (cationes) debe ser igual a la suma de los pesos equivalentes de los iones negativos (aniones), esto se debe a que los elementos se combinan entre sí en relaciones exactas a sus pesos equivalentes. (Patton, Charles;1995) 9 CAPITULO II. MARCO TEORICO UNIDADES Los resultados de los análisis físico-químicos de las aguas de formación vienen expresados en miligramos por litro (mg/L), por lo tanto, para aplicar los diferentes métodos de clasificación [Sulin (1946), Stiff (1951) y Piper (1944)], es necesario transformar las unidades a miliequivalentes por litro (meq/L); para ello es necesario considerar las S O D A V R E S RE S O p. p.m = H C E R E Dρ siguientes ecuaciones: mg / L meq / L = mg / L Peq Peq = PM V Peq = PA V 1 = CR Peq %meq / L = Ec. A1 Ec. A2 , para moléculas , para átomos Ec. A3 Ec. A4 Ec. A5 meq / L(ion) ⊗ 100 meq / L(totales ) Ec. A6 Sustituyendo la ecuación (A5) en la ecuación (A2) se tiene: meq / L = mg / L ∗ CR donde: mg/L: miligramos por litros del constituyente. ρ: densidad de la muestra meq/L: miliequivalentes por litros del ión. Peq: peso equivalente del constituyente. Pm: peso molecular del constituyente, cuando éste es un solo elemento. V: valencia de reacción del constituyente o ión. CR: coeficiente de reacción %meq/lts: porcentaje de miliequivalentes por litros. 10 CAPITULO II. MARCO TEORICO En la tabla 2.1 se muestran los pesos atómicos, pesos moleculares, valencia, pesos equivalentes y multiplicadores de los aniones y cationes que componen el agua de formación. mg/L a meq/L IÓN PESO MOLECULAR O ATÓMICO VALENCIA meq/L a mg/L SODIO 0.0434839 22.997 1 22.99 POTASIO 0.0255754 39.100 1 39.10 MAGNESIO 0.0822368 0.0499002 HOS C HIERRO DERE 0.0358102 CALCIO +2 S O D A V R 40.080 2 E S RE 24.320 2 12.15 20.04 55.850 2 27.92 BARIO 0.0145306 137.360 2 68.67 ALUMINIO 0.1111935 26.980 3 8.994 CLORURO 0.0282032 35.457 1 35.45 SULFATO 0.0208190 96.066 2 48.03 CARBONATO 0.0333278 60.010 2 30.00 BICARBONA TO 0.0163886 60.018 1 61.02 FLUOR 0.0526316 19.000 1 19.00 BROMO 0.0125131 79.916 1 79.90 BORO YODO 0.1848429 10.820 2 79.90 0.0078796 126.910 1 126.9 Tabla 2.1. Multiplicadores, Pesos Atómicos, Moleculares y Equivalentes (Standard Guide for Reporting Results of Analysis of water ASTM, 2001) Es de hacer notar que cuando la cantidad total de sólidos disueltos en el agua, la concentración de cationes, más la concentración de aniones, es menor de 20.000 partes por millón, la densidad del agua tiende a ser igual a uno, por lo tanto la ecuación A1 queda: mg / L = p. p.m 1 Lo que quiere decir, que para un agua de formación de 20.000 p.p.m de sólidos disueltos o menos, los mg/L es igual a los p.p.m. 11 CAPITULO II. MARCO TEORICO 2.2.2 CARACTERIZACION. Término utilizado cuando se trata de identificar y determinar la composición química del agua de formación proveniente de un intervalo productor de un yacimiento; y se logra siguiendo una metodología apropiada para dicha caracterización, luego, una vez seleccionada la S O D A V R E S de E R S O H C E utilizados para la caracterización de las aguas de DERgráfica identificación muestra representativa generar un patrón de las aguas provenientes de un intervalo productor, mediante cualquiera de los métodos formación. (Collins, A.G; 1975) Además de la composición química, también se determinan algunas propiedades físicas del agua de formación tales como: pH, dureza, resistividad, alcalinidad, salinidad, sólidos totales disueltos, índice de Stiff y Davis, entre otros. De este modo se amplía la caracterización de las aguas de formación provenientes de cualquier horizonte productor de un yacimiento. A continuación se explican las propiedades mencionadas anteriormente. • pH: El pH representa el logaritmo natural del inverso de la concentración de iones hidrógeno, expresados en moles por litros. El pH es un número entre 0 y 14 que índica el grado de acidez o alcalinidad de una solución, de tal forma que un pH igual a 7 es neutro, por debajo de 7 es ácido y por encima de éste valor es alcalino. • Resistividad: Es la medida de la resistencia que ofrece el agua de formación al paso de la corriente eléctrica, con la cual se mueven los diferentes iones constituyentes del agua. Hay que tener en cuenta que la temperatura de 12 CAPITULO II. MARCO TEORICO la muestra afecta la velocidad iónica y consecuentemente la resistividad del agua, por lo tanto la medida de ésta propiedad debe ser reportada a la temperatura de la muestra. • Alcalinidad: Se define como la presencia de minerales alcalinos en el agua y es S O D A V R E S (CO ) e hidróxilos (OH ), los REson minerales alcalinos que pueden Scuales O H C E R E D ser neutralizados por ácidos. medida por la presencia de los iones de bicarbonato (HCO3-), Carbonatos 3 = - La alcalinidad total también llamada alcalinidad “M” es la que se produce u origina a un pH sobre el punto final del anaranjado de metilo de aproximadamente 4.2 a 4.4 y miden todos los iones hidróxilos, carbonatos y bicarbonatos. • Sólidos totales disueltos: La cantidad total de sólidos disueltos representa la suma de la concentración de aniones y cationes, constituyentes del agua de formación. • Temperatura: La temperatura en el agua afecta en la tendencia de formación de incrustaciones, el pH y la solubilidad de los gases en el agua. La gravedad específica en el agua está en función de la temperatura. • Gravedad Específica: Es la relación existente entre la densidad de la muestra de agua y la densidad del agua pura. Densidad es simplemente masa por unidad de volumen m/V. La densidad del agua es 1g/mL o 1000Kg/m3. Gravedades específicas mayores de 1.0 significan que la muestra de agua es más densa o pesa más que el volumen equivalente del agua pura. Las aguas 13 CAPITULO II. MARCO TEORICO de formación contienen sólidos disueltos por lo tanto la gravedad específica siempre es mayor que 1.0. La gravedad específica es muy útil para evaluar la exactitud de los análisis de laboratorio. • Oxigeno Disuelto: Contribuye notoriamente en la corrosividad del agua, también si hay S O D A V R E S precipitación de óxidos férricos S RlosEcuales son insolubles y producen O H C E R E D taponamientos, también facilita el crecimiento de las bacterias aeróbicas. presencia de hierro la entrada de oxígeno al sistema puede ocasionar la • Dióxido de Carbono Disuelto: Influye en el pH, corrosión y tendencia de formación de escamas de CaCO3. • Sulfuro como Sulfuro de Hidrógeno H2S: La presencia de H2S en el agua incrementa la corrosión. Puede estar presente naturalmente en el agua o puede generarse por las bacterias sulfato-reductoras. Si en la muestras de agua se observan trazas de H2S esto indica que las bacterias sulfato-reductoras esten presentes en el sistema causando hoyos corrosivos, el sulfuro de hierro también se genera como producto de corrosión y actúa eficientemente como agente taponador. • Indice de Stiff y Davis (SI): Este parámetro permite predecir la formación de depósitos de carbonatos de calcio en las aguas que se producen asociadas al crudo. Este valor se calcula usando el índice de estabilidad iónica el cual permite establecer la tendencia que posee el agua a ser corrosiva o formar incrustaciones. 14 CAPITULO II. MARCO TEORICO Cuando el índice de Stiff y Davis (SI) es positivo el agua es sobresaturada con CaCO3 y la formación de escamas es bastante probable. Cuando SI es negativo el agua no es saturada con CaCO3, entonces su tendencia es ser corrosiva y las posibilidades de formar escamas son escasas. S O D A V R E S S RE O H C E R E D es decir está saturado con CaCO , caso de las mayorías de las equilibrio, Por último si el SI es igual a cero, el agua está en condiciones de 3 aguas de formación en condiciones estáticas. • Incrustaciones: Se entiende por incrustaciones como capas pedregosas que se forman alrededor de ciertos cuerpos que permanecen en un agua calcárea. Existen dos condiciones que guían a la formación de incrustaciones. La primera es que el agua este sobresaturada del mineral incrustante. Sobresaturación significa que existe más cantidad del mineral presente en el agua que normalmente puede mantenerse disuelto y que no precipita. La segunda razón que produce precipitación son los cambios en algunas condiciones del agua; estos pueden ser físicos y químicos. Los minerales incrustantes comúnmente encontrados en los campos petroleros incluyen el carbonato de calcio, sulfato de calcio, sulfato de bario, sulfato de estroncio y componentes de hierro. El carbonato de calcio es la incrustación mineral más común. Ca++ + 2 HCO3- CaCO3 + CO2 + H2O La ecuación anterior describe la precipitación del carbonato de calcio del agua. Esta es una reacción de equilibrio pero esta muy fuertemente a 15 CAPITULO II. MARCO TEORICO favor de la formación del carbonato de calcio con muy poco retorno del ion calcio y bicarbonato. Se nota en la ecuación que el CO2 esta presente como gas en el lado derecho de la ecuación. Si por alguna razón el CO2 es liberado o se escapa del agua, esto desestabiliza el equilibrio empujando la reacción S O D A V R E S S RE O H C E R E DCLASIFICACION DE LAS AGUAS DE FORMACION. 2.2.3 hacia la derecha, aumentando la precipitación de CaCO3. Las aguas de formación se encuentran clasificadas de la siguiente manera: 2.2.3.1 CLASIFICACION GENETICA. La influencia de los factores externos sobre las aguas de formación hacen que esta sea inestable en el tiempo. Basado en su historia, las aguas del subsuelo se pueden clasificar en tres (3) clases: meteóricas, connatas y juveniles. • Aguas meteóricas: Geológicamente, las aguas meteóricas son aquellas que en la actualidad forman parte del ciclo hidrológico o formaron parte de él en el pasado. Aquí se incluye el agua de los océanos, el agua evaporada en la atmósfera, agua de lluvia y de nieve, aguas superficiales y aguas de subsuelo en movimiento. Las aguas subterráneas, bajo ciertas circunstancias geológicas circulan a través de estratos permeables a grandes profundidades (3000 metros o más). Químicamente las aguas meteóricas se caracterizan por presentar bajas concentraciones de sólidos disueltos por lo general menores de 10.000 16 CAPITULO II. MARCO TEORICO mgrs/lts; Normalmente estas aguas contienen cantidades considerables del ion bicarbonato. • Aguas Connatas: Las aguas connatas se han depositado en sistemas hidráulicos cerrados, y no forman parte del ciclo hidrológico. S O D A V R E S explicar que esta agua son RE del mar original en el cual se S restos O H C E R E D los sedimentos. Esto puede considerarse cierto si se toma en depositaron La palabra “connata” significa “lavada con”; se introdujo con la idea de cuenta que el grado de compactación de la roca implica la expulsión del agua de la roca de los poros y alguna migración lateral. Las aguas connatas son altamente saladas, contienen de 20.000 mgrs/lts a 250.000 mgrs/lts de sólidos totales disueltos. Se caracterizan por presentar altas concentraciones de cloruros y baja concentraciones de sulfatos y bicarbonatos. Cuando los sedimentos son muy profundos, ocurre una recristalización de los minerales por efecto del incremento de la presión y la temperatura. Este proceso químico da como resultado la perdida del agua que originalmente formaba parte de la estructura de los silicatos hidratados (hidrosilicato). El proceso de recristalización trae como consecuencia secundaria una perdida de porosidad. Esta agua desprendida debe encontrar su salida o ruta hacia la superficie, debido a que el metamorfismo de los sedimentos hace que estos pierdan permeabilidad. Conforme se mueve hacia zonas de temperaturas y presiones más bajas, la sílica y otros minerales se precipitan, formando venas o vetas de cuarzo. El agua que se encuentra en estas venas de cuarzo normalmente es salada. Es probable que la 17 CAPITULO II. MARCO TEORICO mayoría de estas venas hidrotermales sean formada por aguas connatas que han sido expulsadas de sedimentos durante el proceso de metamorfismo. • Aguas Juveniles: S O D A V R E S formado parte del ciclo hidrológico, S RE son difíciles de identificar. (Collins, O H C E R E D a.G;1975) Estas son aguas que ascienden del manto de la tierra y nunca han 2.2.4 Clasificación propuesta por Sulin: Sulin propuso un sistema de clasificación basado en las diversas combinaciones de los constituyentes disueltos en el agua de formación. Sulin presenta cuatro tipos de ambientes básicos para la distribución de las aguas naturales: • Ambientes de condición continental que permiten la formación de aguas con promedio del ion sulfato (SO4=), tales condiciones les suministra al agua constituyentes solubles de sulfatos. Sulin les asigno el tipo genético sulfatosodio (sulfato de sodio). • Ambientes de condición continental que favorecen la formación de aguas con predominio del ion bicarbonato. El tipo genético de tal agua es bicarbonato-sodica (bicarbonato de sodio). • Ambientes de condición marina que favorecen la formación de aguas del tipo genético cloruro-magnesio (Cloruro de magnesio). • Ambientes de condición subterránea que favorece la formación de aguas del tipo genético cloruro-calcio (cloruro de calcio). 18 CAPITULO II. MARCO TEORICO • La siguiente tabla muestra los parámetros tomados en cuenta por Sulin para la clasificación de las aguas de formación. Tabla 2.1. Sistema de clasificación de aguas de Sulin. (Collins, A.G;1975) S O D A V R E S S RE O H C E R E D Tipo de agua Cloruro-calcio Connata Cloruro-magnesio Bicarbonato-Sodio Meteórica Sulfato-Sodio % meq / lts Na+/Cl- Na – Cl/SO4 Cl- – Na+/Mg++ <1 <0 >1 <1 <0 <1 >1 >1 <0 >1 <1 <0 Se considera que los ambientes de tipo continental son característicos de aguas meteóricas y los ambientes marinos y subterráneos profundos caracterizan a aguas connatas o aguas en condiciones estáticas profundas. La concentración iónica de cada componente viene expresada en términos de miliequivalentes por litro. En los casos en que la relación Na+/Cl- sea menor que la unidad, el agua se considera connata, en caso contrario en que Na+/Cl- sea mayor que la unidad, entonces se considera como meteórica. La clasificación de Sulin esta basada sobre la generalización de que las aguas meteóricas contienen sulfato (SO4=) y bicarbonato (HCO3-) pero cantidades muy pequeñas de calcio y magnesio. Sin embargo casi todos los cationes son sodio y el porcentaje de miliequivalente del Na+ debe ser cercanamente igual a la suma del porcentaje de miliequivalentes de los aniones; es decir: Na+ = Cl- + SO4= aproximadamente Na+ - Cl- = + HCO3- aproximadamente 19 CAPITULO II. MARCO TEORICO Si (Na+ - Cl-) / SO4= es menor que la unidad, las aguas son del tipo sulfato de sodio y si esta misma relación es mayor que la unidad entonces las aguas son de tipo bicarbonato de sodio. Ambas clases caracterizan zonas geológicas de gran intercambio. Las aguas connatas se caracterizan por presentar mayores S O D A V R E S S RE O H C E R E D concentraciones del anión cloruro considerando el sulfato y el bicarbonato casi ausente. Como consecuencia se debe cumplir que: Cl- = Na+ + Ca++ + Mg++ aproximadamente. Si la razón de (Cl- - Na+)/Mg++ es menor que la unidad, el agua pertenece al tipo cloruro de magnesio. Si por el contrario es mayor que la unidad, entonces es del tipo cloruro de calcio. Este grupo de agua es favorable a las acumulaciones de hidrocarburos y provienen de aguas marinas y ambientes transicionales. En forma general el autor determina que las acumulaciones de hidrocarburos están relacionadas con los tipos químicos de agua mencionados, y para ello propone el siguiente orden de prioridad: clorurocalcio, bicarbonato-sodio, cloruro-magnesio y sulfato-sodio. (Collins, A.G;1975) 2.2.5 Clasificación propuesta por Bojarski. (Sulin modificado). El sistema propuesto por Sulin fue puesto en practica por Bojarski en un estudio de 400 muestras de aguas analizadas físico-químicamente, todas pertenecientes a una misma cuenca petrolífera. En este estudio el 20 CAPITULO II. MARCO TEORICO autor estableció una relación entre los tipos de combinación química propuestos por Sulin y las zonas hidro-geoquímicas establecidas por él previamente. También determinó diferenciaciones adicionales entre las aguas cuya relación Na+/Cl- indique un origen connata y el tipo químico sea cloruro-calcio. Estas diferenciaciones constituyen las modificaciones más importantes propuestas al sistema de Sulin. S O D A V R E S S RE O H C E R E D A continuación se presenta la interpretación que Bojarski dio a cada clasificación: 1. Aguas del tipo Bicarbonato-sodio: Esta agua ocurre en las partes superiores de una cuenca de sedimentación basal, tiene una situación hidrodinámica, en donde las aguas son movidas a una rápida razón de tiempo geológico. Esto índica que durante ese tiempo la roca tuvo pocas posibilidades de preservar hidrocarburos. 2. Aguas del tipo Sulfato-sodio: este tipo de agua se relaciona con situaciones altamente hidrodinámicas. 3. Aguas de tipo Cloruro-Magnesio: tales aguas son características de zonas transitorias en un área hidrodinámicamente activa que pasa a ser más hidrostática con la profundidad. 4. Aguas del tipo Cloruro-calcio: Este tipo de agua se asocia a zonas profundas que quedaron aisladas de la influencia de las aguas infiltradas y las zonas hidrodinámicas. Bojarski observó una gran variación en la composición química de las aguas tipo cloruro-calcio, y para ello presentó la siguiente subdivisión: • Cloruro-calcio (I), con Na+/ Cl- > 0.85: es característica de una zona hidrodinámicamente más activa. 21 CAPITULO II. MARCO TEORICO • Cloruro-calcio (II), con Na+ / Cl- entre 0.85 y 0.75: caracteriza zonas de transición entre la zona hidrodinámicamente activa y otra estable (hidrostática) en una cuenca de sedimentación. Esta zona es pobre para la acumulación de hidrocarburos. • Cloruro-calcio (III), con la relación Na+/ Cl- entre 0.85 y 0.65: por su carácter hidrostático puede asociarse a condiciones favorables para la S O D A V R E S Cloruro-calcio (IV), con Na Cl E entre 0.65 y 0.50: Índica la presencia S /R O H C E R E deD agua residuales. Caracteriza zonas de acumulación en completo acumulación de hidrocarburos. • + - aislamiento. • Cloruro-calcio (V) con Na+ / Cl- < 0.50: esta clase índica la presencia de aguas antiguas de mar que han sido altamente alteradas desde su deposición original. • Bojarski considera estas zonas como las más probables de acumular hidrocarburos. 22 CAPITULO II. MARCO TEORICO 2.2.6- Clasificación propuesta por Schoeller Schoeller propuso una clasificación basándose en los constituyentes disueltos en el agua de formación y para cada grupo propuesto estableció el siguiente orden de prioridad: 1. Cloruro. S O D A V R E S RE+ CO ) S(HCO O H C Bicarbonato y carbonato. E R E D 2. Sulfato. 3. 3 - 3 = 4. Indice de bases cambiables. (IBE). 5. Relaciones de prioridad entre cationes y aniones. Como se puede observar en la Tabla 2.2 la cantidad de cloruro en el agua define seis (6) tipos primarios de agua y la cantidad de sulfato define cuatro subgrupos. Los otros sirven como diferenciación adicional. Schoeller observó que según fuera la presencia de iones cloruros disueltos en el agua se presentaban distintas relaciones de prioridad en los restantes iones y en función de éstos propuso los seis tipos básicos de agua. De igual forma observó que normalmente con aguas de alto contenido de cloruro se presentaban también niveles altos de sulfato de calcio, CaSO4, los cuales matemática Ca + + × SO = 3 , caracterizaron determinando según cuatro la subgrupos relación en la clasificación. Adicionalmente, el autor usó varios parámetros de diferenciación. El primero es la relación entre la concentración de carbonato y bicarbonato definida por la fórmula matemática 3 [(HCO 3 − + CO3 ) × (Ca )]. = 2 ++ 23 CAPITULO II. MARCO TEORICO Esta fórmula es proporcional a la presión del CO2 (fase gaseosa) en equilibrio con el CaCO3 en el agua. Su valor es usado para indicar el nivel de saturación de carbonato de calcio. Para su estudio particular utilizó como valor crítico el siete. El segundo parámetro usado fue lo que el autor llamó índice de bases S O D A V R E S S RE O H C E R E D preferiblemente arcillas que están por donde ellas circulan; cambiables (IBE). Este no es más que la tendencia del agua a intercambiar o dejarse modificar sus iones con los de la roca, en otras palabras este índice se usa para indicar la razón entre los iones cambiables del agua como tal y los iones que originalmente la constituyeron. Schoeller usó la siguiente fórmula básica: ⎛ x ⎞ (a − x) = K ⎜ ⎟ ⎝a− x⎠ 1/ P unidad en meq/L (1) Para indicar la relación que existe entre la concentración inicial “a “ de los cationes en las aguas que no han reaccionado y “x “ que es igual a la concentración final de los cationes en aguas que ya reaccionaron con las rocas. La diferencia (a-x) señala la cantidad de iones cambiables y el índice de bases cambiables se presenta con la ecuación: IBE = (a − x ) a (2) Por sustitución de (2) en (1), tenemos: IBE = k / a (x / (a-x) )1 / p 24 CAPITULO II. MARCO TEORICO En esta ecuación Schoeller hace una sustitución asumiendo que en el agua original hubo tantos miliequivalentes de cloruro como de sodio y potasio, y que cuando se dio el cambio de éstos por los alcalinoterreos en la roca alcalina se produjo el intercambio. Schoeller observó en sus ensayos que aguas con un IBE > 0.129 S O D A V R E S S RE O H C E R E D de aguas meteóricas. característicos tienen una razón Cl- / Na+ > 1.17 y son características de aguas connatas. Las que tienen un IBE < 0.129 con relación Cl- / Na+ < 1.17 son Cuando el valor del IBE es positivo indica que el cambio de bases fue de metales alcalinos (Na + K) del agua por iones metales alcalinoterreos (Ca, Mg) de las arcillas, y si es negativo el cambio es al contrario. IBE= Cl − − ( Na + + K + ) Cl − IBE= Cl − − ( Na + + K + ) SO4 −2 − + HCO3 + NO − 3 25 CAPITULO II. MARCO TEORICO TABLA N. 2.2. (Sistema de Schoeller para la Clasificación de las aguas asociadas a yacimientos petrolíferos) (Collins,A.G;1975) l.- Concentración de Cl-: Muy alto si > 700 Marino sí 420-700 Alto si 140-420 S O D A V R E S Normal si 10-40 S RE O H C E R E D Bajo si <10 Promedio si 40-140 2.- Concentración de SO4: Muy alto sí > 58 Alto sí 24-58 Promedio si 6-24 Normal si <6 (SO Existe saturación crítica cuando −2 4 ) × Ca + 2 > 70 3.- Bicarbonato y Carbonato. (HCO3 + CO3): Alto sí >7 Normal si 2-7 Bajo sí <2 Se recomienda usar la ecuación: 3 (HCO − 3 + CO − 2 3 ) 2 × Ca + 2 4. - Indice de Bases Cambiable. (IBE) Sí Cl- > Na+ entonces IBE= (Cl- - Na+) / (Cl-) Sí Na+ > Cl- entonces IBE = (Cl- - Na+) / (SO4-2 + HCO-3 + CO-23) 5. - Importancia de los cationes y aniones. Cl- > SO4= > CO3= Cl- > CO3-2 > SO4= CO3-2 > Cl- > SO4= CO3-2 > SO4= > Cl- Na+ > Mg+2 > Ca+2 Na+ > Ca+2 > Mg+2 26 CAPITULO II. MARCO TEORICO 2.2.7 Clasificación propuesta por Chebotarev. Chebotarev fue un geoquímico contemporáneo a Schoeller que planteó otra clasificación de las aguas de formación basándose de igual forma en los constituyentes sólidos disueltos en el agua. En su clasificación se toman en cuenta los iones bicarbonato, sulfato y cloruro; y descarta las aguas ácidas, es decir, las que contienen ácido sulfúrico o hidroclorhídrico S O D A V R E S S RE O H C E R E D libre. Para esta clasificación el autor asume que los aniones son variables independientes y los cationes variables dependientes. Los tipos geoquímicos de agua propuestos por el autor se relacionan con los productos resultantes del proceso de meteorización que sufre la roca. Chebotarev estableció una correspondencia entre las fases que conforman el proceso meteórico y las fases de disolución y redistribución de los sólidos disueltos que constituyen el agua. Dicha correspondencia esta en función de la movilidad iónica relativa de cada elemento. En esta clasificación se proponen tres grandes grupos de aguas, divididos a su vez en varios tipos genéticos. Estos tipos genéticos se definían a partir de la concentración absoluta de cada ion, expresada en porcentaje de equivalente por litro (%meq/L). Como se puede apreciar en la Tabla 2.3, el grupo bicarbonato contiene tres tipos genéticos de agua: bicarbonato, bicarbonato-cloruro y clorurobicarbonato (este grupo lo define la suma del bicarbonato mas el carbonato y la suma de cloruro mas sulfato). El grupo sulfato se subdivide en dos tipos genéticos: sulfato-cloruro y sulfato. El grupo cloruro se subdivide en tres tipos genéticos: cloruro-bicarbonato, cloruro-sulfato y sulfato. 27 CAPITULO II. MARCO TEORICO Chebotarev, establece que los tipos químicos de agua propuestos se relacionan con los productos de meteorización, ya que el tipo de sal soluble permanece por mucho tiempo inalterable, a pesar que la concentración de sólidos disueltos varia mucho. Los productos correspondientes a la clase uno (I) provienen de la S O D A V R E S S RE O H C E R E D de meteorización de las mismas, pero además se relacionan productos meteorización de las rocas ígneas y de las rocas con metamorfismo de alto grado; las aguas de la clase dos (II) están relacionadas con los también con las acumulaciones calcáreas; la clase tres (III) únicamente se relaciona con las acumulaciones calcáreas; la clase cuatro (IV) se relaciona con la meteorización de depósitos detríticos, aluviones y de sederita; y las aguas de la clase cinco (V) se relacionan con las rocas características de los depósitos marinos y con las que proviene de la meteorización de los productos que se derivan de la clase IV. La alta concentración del ion cloruro en el agua es para Chebotarev un indicador de la ocurrencia de hidrocarburos, sin embargo, esto no siempre se cumple, porque sobre la composición química del agua influye fuertemente la situación hidrodinámica de la cuenca y el tipo de entrampamiento. Por tener una forma compleja de establecer los tipos y clases de agua, ésta clasificación es poco usada. (Collins,A.G;1975) 28 CAPITULO II. MARCO TEORICO Tabla 2. Tipos y clases de agua según Chebotarev.(Collins,A.G;1975) Grupo Clase Tipo Genético I II III IV _ III IV V Bicarbonato Bicarbonato-cloruro Cloruro-bicarbonato Sulfato-cloruro Sulfato Cloruro-bicarbonato Cloruro-sulfato Cloruro Bicarbonato Sulfatos S O D A V R E S S RE O H C E R E D Cloruros NOTA: la unidad de medida es % meq /L. 2.2.9 Gráfico de Reistle. Como puede verse en la Figura 3.1 el gráfico de Reistle utiliza barras verticales para presentar los valores de concentración iónica, los valores a plotear en el gráfico se deben expresar en meq/L o en % meq/L. Las barras tienen como origen el eje horizontal, a partir del cual, las barras que van hacia arriba agrupan a los aniones y las que van hacia abajo a los cationes. El dibujo permite identificar aguas pero no es el más idóneo para la diferenciación. 400 300 200 100 0 -1000 -2000 -3000 Muestra N° 2 Muestra N° 1 Mg Ca Mg Ca Na+K Na+K Cl Cl HCO 3 Aniones HCO 3 SO SO 4 4 Cationes -4000 Fig 3.1 (Catalan Lafuente,JG;1969) 29 CAPITULO II. MARCO TEORICO 2.2.10 Método Gráfico de Stiff Es uno de los más utilizados en la industria petrolera para representar la composición química de las aguas de formación puras; ha sido adoptado por la API (American Petroleum Institute) para tal fin. Stiff diseñó un método gráfico basado en las relaciones de concentración propuesta por Sulin. Está basado en la relación que existe entre la S O D A V R E S S RE O H C E R E Dagua de formación, su comportamiento y tendencia para varios tipo de composición química de las aguas de formación y una figura característica en forma de polígono que permite visualmente identificar el niveles estratigráficos. En los mapas pueden establecerse diferencias en la composición del agua, dibujando sobre estos el gráfico de Stiff. Su representación es sencilla y consiste en graficar en forma cartesiana (Figura 9) o logarítmica (Figura 10) las concentraciones en meq/L de los cationes (Na+, Ca++, Mg++, Fe++) y los aniones (Cl-, HCO3-, SO4= y CO3=) en líneas horizontales. En ambas escalas el área a los lados de la línea cero debe ser equivalente. En casos cuando las concentraciones son bajas, se utiliza una escala lineal, siendo necesario el uso de multiplicadores de los números debajo de cada ion de los extremos. Se establece una línea central vertical la cual representa la escala de concentración fijándose el cero; a la derecha del mismo se representan los aniones (Cl-, HCO3- ,SO4 = , CO3=) y a la izquierda los cationes (Na+, Ca++, Mg++, Fe++). Esta escala debe ser cuidadosamente escogida dependiendo de las concentraciones que quieran ser representadas. Para completar el diagrama de Stiff, los valores de concentración de cada especie se unen con líneas rectas para conformar una huella característica, observada en los gráficos que se muestran a continuación: (Patton, Ch;1995) 30 CAPITULO II. MARCO TEORICO S O D A V R E S S RE O H C E R E D Figura 9. Gráfico de Stiff. Escala lineal Figura 10. Gráfico de Stiff. Escala logarítmica En el diagrama de Stiff, la representación de aguas de tipo meteórico produce un pico prominente en la parte media de los aniones, que representa elevadas concentraciones de bicarbonato, mientras que en la representación de aguas de tipo connata se observan dos picos pronunciados en la línea superior que corresponden a los iones sodio y cloruro. 31 CAPITULO II. MARCO TEORICO PARA CONSTRUIR EL GRÁFICO PUEDE PROCEDERSE DE LA MANERA SIGUIENTE: ¾ Se colocan cuatro líneas horizontales, equidistantes y paralelas. Seguidamente, de la misma manera se trazan diez líneas verticales, hasta conseguir diez divisiones en las primeras. La línea vertical central S O D A V R E S S RE O H C E R E abajoD en el siguiente orden: Na , Ca , Mg , Fe y los iones negativos se usa como cero, en la escala lineal y uno en la escala logarítmica. ¾ Se colocan en el lado izquierdo los iones positivos, de arriba hacia + ++ ++ ++ en el lado derecho como se indica: Cl-, HCO3-, SO4=, CO3=. ¾ Las concentraciones de los iones se representan del centro hacia fuera sobre las líneas trazadas anteriormente. La escala utilizada para cada ión debe ser cuidadosamente seleccionada. ¾ A continuación los puntos se unen con líneas rectas y continuas. El polígono formado es la huella característica para la muestra de agua analizada. Si se emplea la escala logarítmica, las concentraciones que estén por debajo de uno, deben ser representadas en la línea con valor igual a 1.Con la escala lineal pueden emplearse multiplicadores distintos para cada ión a objeto de facilitar la ubicación de bajas concentraciones. La desventaja de usar esta escala es que se pueden producir evaluaciones erróneas por confusiones en la interpretación de la escala. 32 CAPITULO II. MARCO TEORICO 2.2.11 Diagrama de Sulin. Sulin conjuntamente con su sistema de clasificación propuso un gráfico representativo de los tipos genéticos de agua. En la Figura 3.2 se observa un gráfico tipo presentado por Sulin. S O D A V R E S S RE O H C E R E D luego dependiendo del signo de este valor si es positivo se (%meq/L), Este no es más que un eje de coordenadas en el cual, primero se marcan los valores resultantes de la diferencia entre los iones cloruro y sodio grafica. El valor de concentración del ion magnesio en la parte superior derecha del eje y si es negativo se toma el valor del ion sulfato en la parte inferior izquierda del eje. (Collins, A.G;1975) Fig: 3.2 2.2.12 Diagrama Ternario Constituye uno de los métodos para caracterizar y analizar aguas de formación; está representado con un diagrama triangular, que ubica las concentraciones de los iones presentes en análisis y viene generalmente expresado en porcentaje de miliequivalente por litro. Ejemplos de estos diagramas ternarios se pueden observar mas adelante en las Fig No 3.3 y Fig No 3.4 del índice de gráficos. 33 CAPITULO II. MARCO TEORICO Según P. Dickey; los parámetros químicos a utilizar en este gráfico dependen de la clasificación genética de las aguas muestreadas, es decir si el agua es meteórica, el diagrama ternario está formado por los iones Cl-, SO4=, HCO3- y CO3-, si por el contrario es connata, estará representado por los cationes Na+, Ca++ y Mg++ esto puede observarse con mayor detalle en las Figuras 2 y 3 que representan un diagrama S O D A V R E S S RE O H C E R E D En aguas connatas los cationes consisten básicamente ternario de cada tipo. de los iones Na+, Ca++, y Mg++, en ese orden, usualmente el Ca++ es de 3-5 veces mayor que el Mg++. Una característica fundamental de esta agua es que normalmente incrementa la concentración total de sólidos disueltos con profundidad. Las aguas meteóricas son mucho menos salinas que las connatas y tienen un amplio rango en su composición química, usualmente en concentración (mg/L) menor de 10000. Es importante señalar que a diferencia de las aguas connatas, el incremento de la concentración con profundidad no es sistemático. En ambos casos se representa la composición de tres componentes del agua mediante el trazo de puntos dentro de un diagrama triangular; cada punto representa una composición única expresada en porcentaje de miliequivalentes. Los iones característicos según el tipo de agua se ubican en los vértices del triángulo y el porcentaje de miliequivalentes (%meq) de cada uno, se lee en el lado opuesto a su vértice, considerando que el extremo opuesto representa 100%. 34 CAPITULO II. MARCO TEORICO Este diagrama depende de la clasificación genética de las aguas: para el agua meteórica se representan los iones Cl-, SO4=, HCO3- y CO3= S O D A V R E S S RE O H C E R E D Figura 11. Diagrama Ternario tipo agua meteórica (Catalan, Lafuente,JG;1969) Para el agua connata se representan los cationes: Na+,Ca+ y Mg++ (Figura 12). Figura 12. Diagrama Ternario tipo agua connata (Catalan, Lafuente,JG;1969) 35 CAPITULO II. MARCO TEORICO 2.2.13 MÉTODO DE MCKINNELL Se aplica para establecer la proporción de mezcla de las aguas de dos fuentes distintas. Este método permite obtener el porcentaje de mezcla entre dos tipos de aguas de formación conocidas sin tener que hacer los ensayos de laboratorio, siempre y cuando se disponga del patrón característico de los cationes y aniones expresados en S O D A V R E S puras en E R S O H C E puede ser mucha utilidad para determinar la relación ERgráfico DEste estudio. miliequivalentes por litro (meq/L). Es necesario disponer previamente de las características fisicoquímicas individuales de las aguas de mezcla de dos subunidades productoras distintas, establecer la proporción del agua de inyección en el agua producida por pozos en yacimientos sometidos a recuperación secundaria y estimar los volúmenes de agua de formación producida durante la inyección alterna de vapor. El gráfico esta representado por las ecuaciones: % (A) + % (B) = (C) % A + % B = 100 (1) (2) Siendo A y B componentes puros, y C el producto de su mezcla. La ecuación (1) es la suma algebraica de los iones equivalentes de cada componente y la (2) es la ecuación de balance de materiales que rige la mezcla de agua. Para proceder a la elaboración del gráfico (semilogarítmico), se realiza el siguiente procedimiento: 1. En la ordenada izquierda, en escala logarítmica, se representan las concentraciones, en miliequivalentes por litros, de los iones (Na+, Ca++, 36 CAPITULO II. MARCO TEORICO Mg++, Fe++, Cl-, SO4=, HCO3- y CO3=) componentes de la muestra pura tipo A. 2. En la ordenada derecha se colocan en escala logarítmica, todas las concentraciones en miliequivalentes por litros de los iones componentes de la muestra de agua de formación pura tipo B. 3. En la abscisa, la escala es lineal y va dividida del 0 al 100%, desde la S O D A V R E S S RE O H C E R E D Posteriormente se unen con líneas rectas los puntos de las ordenadas muestra de agua pura tipo B hacia la muestra de agua pura tipo A y viceversa. 4. que corresponden a un mismo ion, a modo de mostrar su variación de un tipo de agua a otra. 5. Luego, en otro gráfico semilogarítmico se representan las concentraciones de los iones en miliequivalentes por litros del agua problema a analizar. Sobreponiendo los dos gráficos, se desplaza en forma horizontal hasta que los meq/L se aproximen a las líneas dibujadas. Se sobrepone sobre el primero y se desplaza en el eje de las abscisas hasta conseguir la mayor coincidencia posible de los puntos con las líneas trazadas. Los puntos de mayor correlación se unen con una línea vertical recta y en el eje de las abcisas se lee el porcentaje de cada tipo de agua en la muestra problema. En la base del gráfico se coloca la proporción de las muestras A y B en una escala porcentual del 0 al 100. El mejor punto de correlación dará en la abscisa el porcentaje de la mezcla analizada. En caso de no acercarse a las correlaciones del gráfico, el analista decidirá si la muestra no es confiable debido a las siguientes circunstancias: • Contaminación de la muestra problema. • Selección de las aguas puras A y B equivocadas. • Mezcla con otra fuente productora de agua adicional. • Errores en los análisis de las muestras. 37 CAPITULO II. MARCO TEORICO El gráfico de McKinnell es aplicable a trabajos de rehabilitación, porque sirve como herramienta de apoyo para recomendar trabajos en pozos cuya producción presente un alto corte de agua a nivel de un intervalo que produzca en conjunto con otro. A través de él podemos determinar la fuente que aporta la mayor cantidad de agua, en un pozo que presente problemas de comunicación entre diferentes zonas completadas. Esto sólo será posible S O D A V R E S S RE O H C E R E Dtipo de inyección y el agua tipo del yacimiento. Al correlacionar el el agua si se tiene previamente la identificación de las aguas de formación de dichos intervalos. En los yacimientos sometidos a inyección de agua se representa comportamiento del agua proveniente de un pozo productor, se puede determinar si éste ha sido alcanzado o no por el frente de inyección. 38 CAPITULO II. MARCO TEORICO 2.2.14. DIAGRAMA DE PIPER Representa un análisis por medio de tres puntos, situados los dos primeros en respectivos triángulos de aniones y cationes ubicados estos en los ángulos inferiores derecho e izquierdo respectivamente, con sus bases alineadas. La punta central del diagrama tiene forma de rombo S O D A V R E S E SR O H C E de estas dos rectas (3er punto) indica el carácter del agua representado R E D sobre el cual se proyectan los puntos de cada uno de los triángulos por medio de una recta paralela al borde superior de la figura. La intersección por sus relaciones Na+ + K+ a Ca++ + Mg++ y CO3- - + HCO3- a Cl- + SO4=. Mediante este diagrama, puede saberse directamente, si un agua es mezcla de dos o más componente. Si es mezcla de dos, su punto representativo estará situado en línea recta con los de ellos, y si es de varias, estará ubicado en el interior de la figura limitada por los componentes. 39 CAPITULO II. MARCO TEORICO 2.2.15. DIAGRAMA DE SCHOELLER Propone un diagrama semilogarítmico, el cual consiste en disponer sobre el eje de abcisas intervalos regulares y sucesivos de izquierda a derecha los iones Ca++, Mg++, Na+, Cl-, SO4=, HCO3- y CO3= y en el eje de las ordenadas, a escala logarítmica, el número de miliequivalentes (meq/L) (r) de cada uno de los iones. Los puntos obtenidos se unen S O D A V R E S S RE O H C E R E por laD inclinación de los trazos las relaciones de los elementos entre sí y sucesivamente por rectas. La importancia de este tipo de gráfico es que puede verse directamente en particular las que se consideran como características o de primera importancia: rMg++/rCa++; rSO4=/rCl-; rCl- - rNa+/rCl- ; rNa+/rCa++; rNa+/rMg++ 2.2.16. DIAGRAMA DE BARRAS DE COLLINS Diagrama de Barra, en % meq/L (%r). El método consta de dos columnas juntas, cuyas alturas están subdivididas en segmentos que indican las concentraciones de los aniones y cationes, expresadas en %r. Generalmente se usan seis subdivisiones, superponiendo en la columna de la izquierda de abajo arriba y en el orden siguiente los %rc de Ca+2 , Mg+2 , y Na+ , y en una columna de la derecha los %ra de HCO3- + CO3=, SO4= y Cl-. 40 CAPITULO II. MARCO TEORICO %rc = ( rc ∑r 100 ) c %ra= ( ria x100 ) ∑ ra Si se desea se puede usar más de seis subdivisiones y deben distribuirse cada una por un dibujo o color, o colocando el símbolo del ión. S O D A V R E S S RE O H C E R E D 2.2.17. PRECIPITACIÓN DE SALES INORGÁNICAS 2.2.17.1 CARBONATO DE CALCIO Es muy importante en algunas operaciones de los campos petroleros, predecir la tendencia del agua a formar depósitos de carbonato de calcio. Antes de producirse los fluidos de un yacimiento, éstos se encuentran en estado estático y en equilibrio químico. Al iniciarse la producción y el movimiento de los fluidos, ocurre en la vecindad del pozo una caída de presión; este cambio de presión permite que gases en solución se separen y rompan el equilibrio; formando depósitos de carbonato de calcio (escamas). 41 CAPITULO II. MARCO TEORICO Las incrustaciones o escamas se definen como compuestos que se precipitan en el seno de la fase acuosa. Se originan por la escasa solubilidad que presentan algunas sustancias en agua, y que varía con los cambios de estado físico y químico del sistema. Las condiciones que deben presentarse para que las incrustaciones aparezcan son: • S O D A V R E S baja solubilidad. S RE O H C E R E D • Cambio en las condiciones físicas o composición del agua en la cual la El agua contiene iones que son capaces de formar compuestos de solubilidad este por debajo de la concentración presente. Estos precipitados pueden quedar en suspensión o depositarse como un sólido coherente; en las rocas del yacimiento puede formarse por la filtración de las partículas suspendidas en el agua, incluso puede generarse una concha sólida en la cara de la formación. Las incrustaciones que pueden producirse en las aguas de producción, manejadas por la industria petrolera son: (Tabla 10). NOMBRE FÓRMULA QUÍMICA VARIABLES PRIMARIAS Presión parcial de CO2, pH, Carbonato de calcio (calcita) CaCO3 temperatura, presión total, sólidos disueltos totales. Sulfato de calcio: Yeso (más común) Hemi-hidrato Anhidrita CaSO4 2 H2O CaSO4 ½ H2O CaSO4 Sulfato de bario BaSO4 Sulfato de estroncio SrSO4 Temperatura, sólidos totales disueltos, presión. Temperatura, sólidos totales disueltos, presión. Temperatura, sólidos totales disueltos, presión. Tabla 10. Incrustaciones comunes en los campos petroleros (PATTON, Ch; 1995) 42 CAPITULO II. MARCO TEORICO 2.2.17.2. ESCAMAS DE CARBONATO DE CALCIO El carbonato de calcio o calcita, CaCO3, es la incrustación mineral frecuentemente encontrado como escamas en operaciones de campos petroleros. Los cristales de carbonato de calcio son largos, pero cuando las escamas son encontradas como impurezas en la forma de finos S O D A V R E S S RE O H C E R E Dolor es indicativo que el carbonato está presente. gas sin cristales divididos, aparecen uniformes. Éstas pueden ser identificadas cualitativamente por la adición de ácidos minerales. La evolución de un Esto no identifica la escama como carbonato de calcio, se requieren pruebas adicionales para identificar el calcio. Los depósitos de CaCO3 se forman por la combinación del ión calcio con los iones carbonato o bicarbonato, como muestra la siguiente reacción: Ca ++ + CO3= Ca++ + 2HCO3- CaCO3 CaCO3 + CO2 + H2O En esta reacción la tendencia es hacia la formación de los productos, con poco retorno a los reactantes. El dióxido de carbono está presente como gas en el lado derecho de la ecuación. La solubilidad del carbonato de calcio está altamente influenciada por la presión del dióxido de carbono, temperatura y concentración de otras sales en solución. 43 CAPITULO II. MARCO TEORICO EFECTOS DE LAS VARIABLES PRINCIPALES EN LA FORMACIÓN DE ESCAMAS DE CARBONATO DE CALCIO Efecto de la presión parcial de dióxido de carbono. Debido al desplazamiento de la reacción de equilibrio, la presencia del dióxido de carbono incrementa la solubilidad de carbonato de calcio S O D A V R E S bicarbonatos e iones hidronio, E R S O H C DEREun valor de pH al medio. Al aumentar la concentración proporcionando en el agua. Al estar disuelto, se forma ácido carbónico, el cual se disocia en el agua de CO2 formando carbonatos, la reacción se desplaza hacia la izquierda, favoreciendo la disolución del carbonato de calcio y tornando más ácida el agua (disminución del pH). Estos cambios de la composición con el pH son debido al efecto de la disociación del ácido carbónico en el agua. La cantidad de dióxido de carbono que puede disolverse en el agua es proporcional a la presión parcial del dióxido de carbono en el gas que esta en contacto con el agua. Esto es descrito por la siguiente ecuación: Presión Parcial de CO2 = (Fracción molar de CO2)g x Presión total (1) Puede ocurrir al inverso; cuando disminuye la concentración del CO2 disuelto en el agua, la reacción se desplaza hacia la derecha y puede presentarse una precipitación de carbonato de calcio. Este efecto es una de las mayores causas de la precipitación del carbonato de calcio y sucede en partes del sistema donde ocurren caídas de presión. Cuando el dióxido de carbono entra en contacto con el agua, éste se disuelve y forma ácido carbónico. La ionización del ácido carbónico es ilustrada por las siguientes ecuaciones: 44 CAPITULO II. MARCO TEORICO CO2 + H2O H2CO3 (2) H2CO3 H+ + HCO3 – (3) HCO3 - H+ + CO3= (4) De la ecuación (2), el gas de dióxido de carbono se disuelve en S O D A V R E S S RE O H C E R E D libre en el agua. El ion carbonato libre mostrado en la ecuación carbonato agua y forma ácido carbónico. Éste ioniza para formar los iones hidrógeno y bicarbonato. El hidrógeno ionizado de (3) se puede combinar con el ion (1) puede combinarse con este hidrógeno para formar el ion bicarbonato. Se cree que el carbonato de calcio disuelto no existe en solución como iones de calcio y de carbonato, sino como iones de calcio y de bicarbonato. La precipitación del carbonato de calcio puede ser expresada por la ecuación: Ca (HCO3)2 Por H2O + CO2 + CaCO3 (5). el principio de Le Chatelier, por un incremento en la concentración de dióxido de carbono, más bicarbonato de calcio es formado. Una disminución en el dióxido de carbono contenido en el sistema en equilibrio resulta en la formación del carbonato de calcio. Además, la solubilidad del carbonato de calcio está altamente influenciada por el contenido de dióxido de carbono en el agua, es decir, por la presión parcial de éste sobre el agua. 45 CAPITULO II. MARCO TEORICO El efecto de la presión del dióxido de carbono sobre la solubilidad del carbonato de calcio a 24°C (75.2°F), fue determinado por Miller, y es mostrado el Gráfico 5. Comenzando con 1atm e incrementando la presión del dióxido de carbono a 50atm., se triplica la solubilidad del carbonato de calcio. En caso contrario, con la caída de presión del dióxido de carbono disminuye la solubilidad. S O D A V R E S S RE O H C E R E D Gráfico 3. Influencia de la presión del CO2 en la solubilidad del CaCO3 ( PATTON, Ch; 1995) Este fenómeno ocurre en algunos pozos productores o inyectores, causando que se depositen escamas de carbonato de calcio. El agua en el yacimiento es estable con respecto a la solubilidad del carbonato de calcio, porque la presión del dióxido de carbono se mantiene. Cuando el agua es producida la presión del gas CO2 disminuye a medida que el agua se aproxima a la superficie. Esto altera el equilibrio químico y origina los depósitos de escamas. 46 CAPITULO II. MARCO TEORICO • Efecto del pH La cantidad de dióxido de carbono presente en el agua afecta el pH, sin embargo, no es relevante que causa la acidez o alcalinidad en el agua, mientras mas bajo sea el pH mayor será la precipitación. • Efecto de la presión S O D A V R E S presión aumenta la solubilidad del E carbonato de calcio, básicamente por SR O H C E R E D de la presión parcial del dióxido de carbono y otros efectos el incremento En un sistema donde coexistan gas y líquido, al incrementarse la termodinámicos. En la mayoría de los casos, las pérdidas en dióxido de carbono por caídas de presión es el mayor efecto para el depósito de escamas de carbonato de calcio (igualmente ocurre para aguas de inyección). • Efecto de la temperatura. La temperatura es otro factor que influye en la solubilidad del carbonato de calcio. El carbonato de calcio presenta una particular solubilidad invertida con relación a la temperatura. Se hace menos soluble con los incrementos de temperatura. Es frecuente tener incrustaciones de carbonato de calcio en sistemas donde el agua se calienta hasta la ebullición. Un agua que no forme incrustaciones en la superficie puede formar escamas en un pozo de inyección si la temperatura es lo suficientemente alta. La solubilidad del carbonato de calcio en agua pura a la presión de una atmósfera, como una función de la temperatura. El Gráfico 4, muestra que al aumentar la temperatura, disminuye la solubilidad del carbonato de calcio. Esta curva explica que algunos problemas de escamas pueden ser encontrados por la inyección de agua saturada con carbonato de calcio a temperatura de superficie, a una formación infrayacente a una mayor temperatura. La baja temperatura 47 CAPITULO II. MARCO TEORICO cerca de la superficie incrementa la solubilidad, pero las bajas presiones causan pérdidas del dióxido de carbono que contrarresta el aumento en la solubilidad obtenido por la influencia de la temperatura. S O D A V R E S S RE O H C E R E D Gráfico 4. Efecto de la Temperatura en la Solubilidad del CaCO3( PATTON, Ch; 1995) • Efecto de los sólidos disueltos Si el contenido de sales en el agua aumenta, la solubilidad del carbonato de calcio se incrementa. Se ha encontrado que los sólidos disueltos (que no contengan calcio o iones carbonato) en el orden de los 200000 mg/L, producen la mayor solubilidad del carbonato de calcio en el agua y por ende la menor tendencia incrustante. La mezcla de aguas de formación o inyección que bajo ciertas condiciones no son incrustantes, puede originar reacciones químicas indeseables entre los componentes disueltos individualmente en las aguas. Estas reacciones pueden producir escamas de carbonato de calcio, sulfato de bario, de calcio, de estroncio y compuestos de hierro insolubles. La cantidad de los sólidos depositados depende de la concentración de los iones reaccionantes presentes en las aguas 48 CAPITULO II. MARCO TEORICO individuales y otros factores termodinámicos que determinan la solubilidad de los compuestos formados, es decir, la cantidad precipitada depende de su producto de solubilidad para las condiciones del sistema. La compatibilidad de las aguas usadas en recuperación secundaria con el agua de formación, es de primordial importancia cuando se diseña un proyecto de recuperación secundaria. Mezclas que en superficie no son S O D A V R E S S RE O H C E R E D escamas. incrustantes, pueden serlo a condiciones de fondo de pozo, o viceversa. Prácticas apropiadas de ingeniería pueden evitar la generación de Cuando dos aguas se mezclan, la concentración de los iones disueltos resulta del promedio de las concentraciones de los iones en cada agua. Si la mezcla resulta con una concentración de, por ejemplo, carbonato de calcio sobre lo que permite su producto de solubilidad, el agua queda sobresaturada de este mineral, y se precipitará el exceso hasta que el agua quede saturada. La formación de escamas de carbonatos o sulfatos, ha sido generalmente controlada en superficie por la adición continua al agua de productos químicos conocidos como inhibidores de incrustación o antiincrustantes. En los patios de tanques, suele efectuarse la inyección de este producto antes del punto de mezcla de las aguas incompatibles o antes del calentamiento del agua (entrada a los hornos), si el agua interviene en un proceso de deshidratación termoquímica de crudo. Otra manera de solucionar el problema de la incompatibilidad de las mezclas, es manejando por separado el agua que está ocasionando las incrustaciones. La única manera de prevenir la deposición de escamas en la roca del yacimiento en mezclas incompatibles de agua de formación e inyección, es con la inyección del inhibidor de incrustación en los pozos 49 CAPITULO II. MARCO TEORICO inyectores. Estos inhibidores no pueden ser utilizados para prevenir la precipitación de compuestos de hierro. Las aguas de formación tienen generalmente muy poco hierro; concentraciones elevadas indican probablemente corrosión en los equipos de completación. En el agua de inyección es frecuente encontrar S O D A V R E S S RE O H C E R E Dgenerar incrustaciones que taponen el fondo de un pozo inyector, pueden altas cantidades de hierro, producto de la corrosión interna de las tuberías y equipos. Compuestos de hierro tales como óxidos, sulfuros y carbonatos válvulas, etc. Lo más conveniente es evitar su formación, mediante el control de la corrosión en las instalaciones. Se han detectado problemas con incrustaciones de sulfato de bario por incompatibilidad de aguas de formación e inyección en el Mar del Norte – Inglaterra (SPE 25141) e incrustaciones de sulfato de bario y estroncio por la misma razón en el Campo Namorado –Brasil (SPE 21109), sin embargo no se tiene información de estos problemas en el Occidente de Venezuela, razón por la cual no se entrará en detalle sobre este tipo de incrustaciones. 2.2.17.2.1 MÉTODOS PARA PRONOSTICAR LA TENDENCIA DE DEPÓSITOS DE CARBONATO DE CALCIO (ESCAMAS) Dada la frecuencia de casos de formación de escamas en los campos petroleros, en especial de carbonato de calcio, es necesario determinar la posibilidad de su ocurrencia bajo condiciones de operación. Para esto pueden emplearse los cálculos de solubilidad o índices de incrustación y deben tomarse como una referencia puesto que las ecuaciones involucradas presentan simplificaciones que no pueden reproducir los complejos fenómenos de solubilidad que ocurren en la realidad. 50 CAPITULO II. MARCO TEORICO En general existen dos categorías de índices de saturación de carbonato de calcio: • Los índices que sólo determinan la tendencia de un agua a formar escamas (por ej. si está sobresaturada) o disolver escamas (por ej. si está subsaturada). • S O D A V R E S precipitarse en un agua sobresaturada, S RE o que puede disolverse si está O H C E R E D subsaturada. Este es más completo que el primero, pero necesita más Aquellos que especifican la cantidad de carbonato de calcio que puede datos para ser calculado, lo que dificulta su aplicación. El hecho que un agua muestre tendencia a precipitar carbonato de calcio representa una alarma que debe ser analizada cuidadosamente, luego lo más recomendable sería efectuar inspecciones para verificar la existencia de la incrustación en el sistema. En ciertos casos, los índices pueden mostrar una tendencia de precipitar o disolver escamas, pero en condiciones reales puede no suceder debido a la presencia de factores no considerados en las ecuaciones. Por ejemplo, la precipitación de carbonato de calcio en agua sobresaturada se ve inhibida por la presencia de polifósfatos, y caso contrario puede precipitar en agua subsaturada que circula en tuberías debido al efecto catódico de la corrosión sobre la superficie del metal. Todos los métodos de predicción de incrustaciones son basados en medidas de laboratorio de la solubilidad de un determinado compuesto a condiciones de equilibrio, en aguas sintéticas, dentro de un rango de temperatura a presión atmosférica. 51 CAPITULO II. MARCO TEORICO Tomando en cuenta el Principio del producto de solubilidad, se calculan el Radio de Saturación (SR) y el Índice de saturación (SI) a través del gráfico en el anexo No. 6 ó mediante las siguientes ecuaciones: SR = IP KC SI = log IP Kc Donde: S O D A V R E S RE S O H C E R E K : Constante D condicional del producto de solubilidad. SR: Radio de Saturación. IP: Producto de la concentración de iones (mol/L). c. SI: Índice de Saturación. El índice de Saturación es una medida del grado de sobresaturación e indica la fuerza de empuje necesario para causar la precipitación. A medida que aumenta, el agua tiene mayor tendencia a producir escamas. Este índice no cuantifica la cantidad de escamas que pueden producirse. Varios investigadores, han empleado diversas expresiones para describir este término. INVESTIGADOR NOMBRE DEL ÍNDICE ABREVIACIÓN Langelier Índice de saturación IS Ryznar Índice de estabilidad IS Stiff y Davis Índice de estabilidad IS Oddo y Tomson Índice de saturación IS Tabla 11. Índices de Saturación de Carbonato de Calcio (Fuente: PATTON, Ch. 1995: P. 70) A continuación se presentan los métodos más empleados para determinar la tendencia de producir incrustaciones de carbonato en el agua de formación: 52 CAPITULO II. MARCO TEORICO a) Método de Langelier Langelier desarrolló un índice para aguas frescas, en un rango de pH de 6.5 a 9.5, que le hizo posible predecir si el agua precipita o disuelve escamas de carbonato de calcio. Éste es llamado índice de saturación y es calculado a partir de la siguiente ecuación: S O D A V R E S S RE O H C E R E D Donde: SI = pH – pHs = pH – [ (pK2’- pKs’) + pCa++ + pAlk ] pH = pH del agua pHs = pH de saturación pK2’- pKs’ = constantes empíricas pCa++ = logaritmo negativo de la concentración de Ca++ en mol/Lt pAlk = logaritmo negativo de la alcalinidad total en equivalente/Lt Un valor positivo del índice de saturación indica que el agua está sobresaturada y precipitará carbonato de calcio; un valor negativo indica que el agua es corrosiva, es decir, disolverá las escamas de carbonato de calcio. Este índice de saturación sirve como una tendencia del agua a disolver o precipitar carbonato de calcio, pero no es indicativo de la capacidad. b) Larson y Buswell Modificaron la ecuación del índice de saturación para incluir la compensación por variaciones en temperatura o concentraciones de sales. I = pH + log (Ca++) + log (Alky) – (pK2´- pKs´) – 9.30 - 2 .5 μ 1 + 5 .3 μ + 5 . 5 μ 53 CAPITULO II. MARCO TEORICO Donde: I = índice de saturación. μ = fuerza iónica de la solución. PH= medida de pH (Ca++) (Alky)= las concentraciones se expresan en ppm S O D A V R E S E Desarrolló una ecuaciónS para el índice de estabilidad. El Rdesarrollar O H C E R E índiceD de estabilidad es una expresión empírica, que no sólo indica la c) Ryznar tendencia del agua a ser incrustante o corrosiva, sino que da un valor semicuantitativo para la cantidad de depósitos de escamas o la tendencia a ser corrosiva. Este índice debe ser positivo para todas las aguas. Is = 2 pHs − pH ⎡ ⎤ 2.5 μ ' = 2⎢( pK 2 − pKs ) − log(Ca++ ) − log(Alky) + 9.30 + ⎥ − pH 1 + 5 . 3 μ + 5 . 5 μ ⎣⎢ ⎦⎥ donde: Ca++ : concentración de [Ca] ppm Alky: CO3 +HCO3 concentraciones en ppm μ: Fuerza iónica PK’2 y PK’s: constantes empíricas medidas por Langelier. Un índice de estabilidad < 5.5 dará una cantidad apreciable de escamas de carbonato de calcio; entre 7.5 – 9, el agua tendrá tendencia corrosiva; y un índice de estabilidad de 9 ó mayor, será indicativo de serios problemas de corrosión. El método de Langelier y sus variaciones son sólo aplicables para aguas de esfuerzo iónico igual o menor a 0.02. 54 CAPITULO II. MARCO TEORICO d) Método de H. Stiff y L. Davis Es una extensión del método de Langelier. El índice de saturación de Langelier ha sido extendido empíricamente por Stiff y Davis para aplicarse a las aguas asociadas al crudo de los campos petroleros, quienes lo nombraron como índice de estabilidad y lo representaron por SI.(Stability Index) Stiff y Davis presentaron este método que permite predecir la S O D A V R E S S RE O H C E R E D saber cuando la tendencia es incrustante o corrosiva. agua permite formación de depósitos de carbonato de calcio en las aguas que se producen asociadas al crudo. Para ello la condición de equilibrio en el La ecuación fue desarrollada en función del índice de estabilidad iónica y toma en cuenta las altas concentraciones de sales disueltas presentes en el agua de formación, las cuales alteran el esfuerzo iónico e influyen en la solubilidad del CaCO3.como a continuación se muestra: SI = pH – pHs pHs= K +pCa +pAlk SI = pH - K - pCa – pAlk P[Ca++] = - log [Ca++] )mg/lt x 2.5X10-5 pAlk = -log [Alk] x2.0X10-5 Donde: SI: Índice de Estabilidad. pH: pH medido de la muestra de agua (pH a condiciones del sistema). K: Constante basada en la salinidad, temperatura y composición del agua. pCa: logaritmo de la concentración de calcio pAlk: logaritmo de la alcalinidad total [Ca++]: concentración de calcio (mol/l) Alk : Alcalinidad total = (mg/L CaCO3) 55 CAPITULO II. MARCO TEORICO Los resultados de índice de Stiff y Davis pueden interpretarse como se muestra a continuación: (Tabla 12). CASO CONCLUSIÓN El agua está subsaturada de CaC03, la SI es negativo formación de incrustación es imposible. El agua esta sobresaturada de CaC03. SI es positivo Esto indica la formación de escamas. SI = 0 El agua está saturada con CaC03 S O D A V R E S S RE O H C E R E D Tabla 12. Interpretación del índice de Stiff y Davis (Fuente: PATTON, Charles. 1995: p. 73) Cálculo de Fuerza Iónica El procedimiento aplicable para muestras de agua hasta una concentración total de sólidos de 4000ppm., es el siguiente: Fuerza Iónica = ppm-ión x Factor ó meq-ión x Factor Factor de conversión mostrado en la Tabla 13. FACTORES DE CONVERSIÓN ION + ppm meq/L Na 2.2 X 10 -5 5 X 10-4 Ca++ 5.0 X 10-5 1 X 10-3 Mg++ 8.2 X 10-5 1 X 10-3 Cl- 1.4 X 10-5 5 X 10-4 HCO3 - 0.8 X 10-5 5 X 10-4 CO3= 3.3x10-5 = 2.1 X 10-5 SO4 1 X 10-3 ( PATTON, Ch; 1995) Tabla 13. Factores de conversión para el cálculo de fuerza iónica 56 CAPITULO II. MARCO TEORICO Con este valor del esfuerzo iónico se va al gráfico de K vs. fuerza iónica, Gráfico C.2 del Anexo C, y para una temperatura dada (temperatura de la muestra) se determina "K". Para muestras con mayor concentración de sales (ppm > 4000), se dispone del siguiente método empírico: S O D A V R E S S RE O H C E R E 1D Fuerza Iónica μ= (C Z 2 1 2 1 + C 2 Z 2 + C 3 Z 3 + .... + C n Z n 2 2 2 ) Donde: C= meq / L STD ⎞ ⎛ V ⎜1000γ − ⎟ 1000 ⎠ ⎝ C: concentración de cada ion, expresada en moles/1000grs. de agua V: valencia de cada ion γ: Gravedad específica de la salmuera STD: sólidos totales disueltos Con este valor de esfuerzo iónico, se va al Gráfico C.2, y para una temperatura dada se determina el valor de "K". El gráfico correlaciona el esfuerzo iónico y la temperatura del agua (anexo C). Para calcular el SI, es necesario conocer el pH, alcalinidad total y temperatura. Además se requiere de un análisis de agua completo para determinar el esfuerzo iónico. Es importante que los valores de pH y alcalinidad, sean determinados en campo, inmediatamente después de tomar la muestra debido a que estos parámetros cambian rápidamente una vez que la 57 CAPITULO II. MARCO TEORICO muestra es removida del sistema presurizado. Cálculos válidos no pueden obtenerse con estos análisis efectuados en laboratorio. No obstante, las medidas de pH tomadas aún en estas condiciones no son adecuadas para aplicar este método a condiciones de fondo en pozos productores o inyectores. En el punto siguiente se encuentran las a altas presiones y S O D A V R E S temperaturas. S RE O H C E R E D ecuaciones que permiten estimar el valor del pH Las curvas para determinar K están basadas en datos experimentales medidos en las siguientes condiciones: • Esfuerzo molar iónico = 0 – 3,6. • Temperatura = 0, 30 y 50ºC. • Presión = 1 atm. Sustituyendo ahora los valores de p[Ca++], p[Alk], K y pH se obtiene el valor del indice de Stiff y Davis. 2.2.18 SULFATO DE CALCIO El sulfato de calcio es otro sólido frecuentemente depositado por las aguas de formación asociadas a hidrocarburos, usualmente se precipita directamente en las superficies metálicas de la línea de flujo, tuberías de intercambiadores de calor y otros. Los cristales de sulfato de calcio son más pequeños que los del carbonato de calcio, lo que ocasiona que no sean generalmente más fuertes y duros que los de carbonato de calcio. Las escamas de sulfato no son “efervescentes” cuando se tratan con ácidos, y no pueden ser removidas exitosamente cuando se acidifican a temperatura normal o estándar. La escama de sulfato de calcio es mucho más difícil de remover que la de carbonato de calcio. 58 CAPITULO II. MARCO TEORICO La precipitación del sulfato de calcio en el agua puede ser expresada de la siguiente manera: Ca ++ + SO4 = Ca SO4 S O D A V R E S S RE O H C E R E D (Ca ) (SO ) = K Y el producto de la solubilidad es expresado por: ++ Este producto de 4 solubilidad = sp varía con la temperatura y concentración de iones no comunes en la solución, pero no es afectada apreciablemente por variaciones de presión en operaciones de campo. Cuando el producto de los iones de calcio y sulfato excede este número, el sulfato de calcio, se precipita hasta producir que las concentraciones de los iones igualen el producto de la solubilidad. Comúnmente en aguas supersaturadas que contienen tanto el ion carbonato como sulfato además del ion calcio, el carbonato se precipita primero debido a la diferencia de solubilidad. La influencia de la temperatura en la solubilidad del sulfato de calcio en una solución de cloruro de sodio, es mostrada en el Gráfico 5. Este gráfico muestra que en el rango de temperatura de 30 a 70 °C, la solubilidad no es afectada apreciablemente por las variaciones de temperatura. Por encima de 82°C la solubilidad decrece rápidamente. Las variaciones de temperatura no afectan a la solubilidad del sulfato de calcio de la manera como afecta al carbonato de calcio. Un incremento en la temperatura disminuye notablemente la solubilidad del carbonato de calcio pero puede incrementar la solubilidad del sulfato de calcio. 59 CAPITULO II. MARCO TEORICO S O D A V R E S S RE O H C E R E D Gráfico 5. Efecto de la Temperatura en la solubilidad del CaSO4( PATTON, Ch; 1995) La presión parcial del dióxido de carbono no afecta la solubilidad del sulfato de calcio, a menos que el gas del dióxido de carbono en la solución produzca la disolución de calcitas ó argomitas que este en contacto con el agua. En este caso la concentración del ión calcio en el agua puede ser incrementada suficientemente, para causar la precipitación del sulfato de calcio como yeso. El sulfato de calcio existe como yeso (Ca SO4 . 2H2O); subhidratado (Ca SO4 . ½ H2O), ó anhidrita (CaSO4). Sólo es encontrado en la naturaleza como yeso y anhidrita. La mayoría de los depósitos de sulfato de calcio en los campos petroleros son escamas de yeso debido a las bajas temperaturas a las cuales éstas son depositadas. En pozos profundos, las temperaturas exceden los 100 O C y las anhidritas permanecen estables. Debido a la profundidad, las presiones en los pozos profundos son elevadas. Recientemente se ha demostrado que la presión incrementa la solubilidad del sulfato de calcio, pero no lo suficiente para compensar el efecto. 60 CAPITULO II. MARCO TEORICO Los depósitos de sulfato de calcio en las aguas pueden ser causados por evaporación. La evaporación sirve para remover algunas de las aguas, lo cual significa que la concentración de sales en el agua remanente es más alta. A medida que el agua se evapora el contenido de sal se incrementa y puede finalmente alcanzar, el punto donde el producto S O D A V R E S S RE O H C E R E D de la solubilidad del sulfato de calcio es excedido ocurriendo la precipitación. La evaporación de gases tales como el metano y el dióxido de carbono de las aguas saturadas con sulfato de calcio pueden arrancar suficiente vapor de agua, causando un incremento en la concentración de sales, resultando la precipitación del sulfato de calcio. Las mezclas de aguas de diferentes lentes o arenas pueden precipitar el sulfato de calcio. Las aguas de una arena pueden traer una concentración de ion calcio mayor, y el agua de la segunda arena puede contener una gran cantidad del ion sulfato. Cuando las dos aguas son mezcladas, el producto de la solubilidad del sulfato de calcio es excedido, y ocurre la precipitación hasta que la concentración del sulfato de calcio en solución se reduce hasta el punto de solubilidad. 61 CAPITULO II. MARCO TEORICO 2.2.18.1. MÉTODOS PARA PRONOSTICAR LA TENDENCIA DE DEPÓSITOS DE SULFATO DE CALCIO a) H. STIFF- L. DAVIS Una solución está en equilibrio con respecto a una “sal” dada cuando S O D A V R E S S RE O H C E R E D de dicha sal toma lugar. En base a esto, si la concentración precipitación la concentración de dicha sal es igual a su solubilidad. Si la concentración es mayor, el equilibrio es transformado y la de una sal en una solución dada es conocida y su solubilidad puede ser calculada para un conjunto de condiciones dadas, la tendencia de esta sal a formar un precipitado (depósito) puede ser pronosticada. b) DIAGRAMA DE SOLUBILIDAD Los depósitos de CaSO4 normalmente ocurren cuando dos aguas se mezclan; una conteniendo iones de Ca++ y la otra iones de sulfato. Cuando una de las aguas se va mezclando con la otra puede producirse un punto de mezcla donde la concentración de CaSO4 sea mayor a su solubilidad y por ende, se produce la precipitación o depósito. El “diagrama de solubilidad” es un gráfico patrón para determinar la ubicación de estos puntos de mezcla y por consiguiente hace posible el pronóstico de la tendencia a formar depósitos de escamas de sulfato. La solubilidad del CaSO4 a cualquier punto de mezcla puede determinarse mediante la siguiente ecuación: S = Sr * Fl * F2 * F3. 62 CAPITULO II. MARCO TEORICO Donde: Sr: solubilidad del CaSO4 en agua destilada a la temperatura T (Gráfico C.3 del Anexo A ). Fl: solubilidad del CaSO4 en la presencia de un exceso del ión Ca++ o SO4= (Gráfico C.4 del Anexo A ). F2: solubilidad del CaSO4 en la presencia del ión Na+ (Gráfico C.5 del S O D A V R E S S RE O H C E R E AnexoD A ). Anexo A ). F3: solubilidad del CaSO4 en la presencia del ión Mg++ (Grafico C.6 del El procedimiento de elaboración del gráfico a través del método de Mckinnell, es como sigue: 1. Se representa en la ordenada izquierda (escala lineal) los meq/L de cada ión, resultado del análisis de la muestra A. 2. En la ordenada derecha los meq/L de cada ión de la muestra B. 3. La abcisa o eje X es en escala lineal y está dividida en 10 partes iguales que representan los porcentajes de mezcla. 4. Se unen mediante líneas rectas las concentraciones en meq/L de cada ión en las 2 ordenadas . 5. Para construir la curva de solubilidad, sobre cada línea recta y para cada % de mezcla, las concentraciones en meq/L de cada ión y aplicar la ecuación anterior, utilizando la T (°C) del análisis de las muestras A y B. Al graficar cada % de mezcla con su respectivo valor de solubilidad, obtenemos la llamada “Curva de Solubilidad”, la cual permite predecir la tendencia de las aguas a la formación de depósitos de sulfato de calcio, CaSO4. 63 CAPITULO II. MARCO TEORICO 2.2.19. RESISTIVIDADES DE LA FORMACIÓN 2.2.19.1. RESISTIVIDAD DEL AGUA DE LA FORMACIÓN Es la medida de la resistencia que ofrece el agua de formación al paso de la corriente eléctrica, con la cual se mueven los diferentes iones S O D A V R E S S RE O H C E R E D la corriente eléctrica sólo mediante el agua que contienen. La conducen componentes del agua. La resistividad de las formaciones es indicativa de su litología y de su contenido de fluidos. Las formaciones geológicas mayoría de los minerales que constituyen las partes sólidas de los estratos, cuando están absolutamente secos son aislantes. Las pocas excepciones a esta regla son los sulfuros metálicos, como la pirita, que son conductores de la electricidad. De la misma manera, cualquier cantidad de petróleo o gas puros que se encuentren en las formaciones, son eléctricamente no conductores. Las formaciones porosas de más baja resistividad indican incrementos tanto en la cantidad de agua como en su salinidad. Otros factores importantes en la resistividad de las formaciones son la forma e interconexión de los espacios de los poros que están ocupados por el agua. Estos factores dependen principalmente de la litología y textura de la formación. La resistividad del agua de formación es uno de los parámetros más importantes en el análisis de registros a hoyo abierto, puesto que el valor de Rw es requerido para calcular la saturación de fluidos en el espacio poroso de la roca reservorio. El espacio poroso de los sedimentos marinos inicialmente esta lleno por agua de mar, pero la composición química del agua de mar no permanece constante con cambio de profundidad, ni en grandes áreas geográficas, ni a través de largos períodos de tiempo. Sin embargo, 64 CAPITULO II. MARCO TEORICO mucha parte del agua de mar probablemente no sufre cambios significantes con el paso del tiempo geológico. El agua de formación es capaz de conducir electricidad, debido a que contiene sales ionizadas en solución. Se sabe que un ion monovalente sólo puede llevar una carga eléctrica y por ello la capacidad de un S O D A V R E S S RE O H C E R E del ionD (movilidad). Por ello, la concentración y movilización de los iones electrolito (agua de formación) para conducir electricidad depende del número de iones por unidad de volumen (concentración) y de la velocidad que contenga, es responsable por la mayor o menor resistividad que manifieste. En el agua de formación puede existir casi cualquier tipo de sal susceptible de ionizarse, los más comunes son los iones monovalentes de Na+, K+, Cl-, HCO3- y los polivalentes de Ca++, Mg++, CO3= y SO4=. Además de estos elementos pueden encontrarse otros como: bromo, bario, hierro, estroncio, ácidos orgánicos y otros. El valor de resistividad del agua es muy importante en la determinación de la saturación de agua de la formación. Varía significativamente de una zona a otra, sobre todo para cada cuenca. Dicha variación está relacionada con la salinidad y las características geológicas del área que se evalúa. Las resistividades del agua pueden oscilar de 0,01 ohm-m a varios ohm-m a la temperatura del reservorio. La resistividad del agua de formación (Rw) es frecuentemente más fácil de determinar, pero ocasionalmente se hace difícil encontrar un valor exacto para este importante parámetro petrofísico. 65 CAPITULO II. MARCO TEORICO Para determinar la resistividad del agua de formación (Rw) varias fuentes o métodos son usados dependiendo de la información que se tenga. Algunos de estos métodos, a saber son: • Catálogos de información de resistividades del agua. • Medida directa de una muestra representativa. • A través de análisis químico de una muestra representativa de agua • S O D A V R E S E A partir de la curva deO potencial SP. S Respontáneo H C E R E D A partir de un perfil de resistividad de investigación profunda. • A partir de un perfil de resistividad de investigación mediana. • Archivos o catálogos de muestras de aguas e interpolando en mapas producida en el reservorio. • de igual salinidad (mapas isosalínicos o isoconnáticos) de formaciones geológicas específicas. 2.2.19.2. MÉTODOS PARA DETERMINAR LA RESISTIVIDAD DEL AGUA DE FORMACIÓN (Rw) a) Resistividad del agua de formación a partir de una medida directa de una muestra de agua representativa El éxito en obtener valores confiables de la resistividad del agua de formación (Rw) consiste en obtener muestras representativas de la misma. Para ello, existen varios métodos, a saber: 1. Muestra obtenida de la línea de flujo de un pozo de bombeo con Relación agua - petróleo (RAP) alta. 2. Muestra obtenida del separador de un pozo fluyente que produce con alta relación agua - petróleo. 3. Muestra obtenida de la tubería de producción o de perforación en pruebas de formación (se recomienda tomar varias muestras). 66 CAPITULO II. MARCO TEORICO El valor de resistividad del agua (Rw) se determina directamente en el laboratorio a una temperatura standard mediante un dispositivo denominado “pila de conductividad de inmersión”. A este valor es necesario hacerle corrección por temperatura, ya sea utilizando el gráfico Gen-9 de Schlumberger (ver Gráfico A.1 del Anexo A), ó aplicando la ecuación: S O D A V R E S + Ts 6 . 77 E @ TfR Rw S = Rw @ Ts x RECHO DE Tf + 6.77 donde: Rw @ Tf: resistividad del agua @ temperatura de la formación, ohm-m. Rw @ Ts: resistividad del agua @ temperatura de la superficie, ohm-m. Ts: temperatura de superficie o ambiente standard, °F. Tf: temperatura de la formación o del estrato en estudio, °F. b) Resistividad del agua de formación a partir de un análisis químico de una muestra de agua representativa A partir de un análisis químico de una muestra de agua representativa se puede determinar la resistividad del agua de formación. Los análisis cuantitativos de las aguas de formación, pueden presentarse en diversas formas. Deben expresar tanto la concentración total, como la concentración de cada una de las sales disueltas, o de cada uno de los iones presentes en la solución. Los valores se expresan frecuentemente en partes por millón (ppm), sin embargo, también pueden ser expresados como: • Gramos o miligramos por litro ( mg/L), • Porcentaje por peso (1% = 10.000 ppm), • Miliequivalentes por litro ( meq/L), y • Porcentaje de miliequivalentes por litro ( % meq/L). 67 CAPITULO II. MARCO TEORICO El método consiste en reducir la composición química de la muestra de agua a una equivalente en cloruro de sodio (NaCl), por medio de unos factores de conversión o factores de Dunlap. Estos factores se determinan del gráfico Gen-8 de Schlumberger, Gráfico A.2 del Anexo A, a partir de la concentración total de sólidos. Esta concentración es la sumatoria de todas las concentraciones (ppm) de los iones presentes en S O D A V R E S S RE O H C E R E D el análisis químico de la muestra. Concentrac ión total de sólidos = n ∑ ( ppm c / ion ) i i =1 Para obtener la salinidad total equivalente en cloruro de sodio, las partes por millón de cada ión se multiplican por su factor de conversión correspondiente y los productos se suman. Equivalente en Cloruro de Sodio = n ∑ ( ppm c / ion * f conversión ) i =1 Para obtener la resistividad del agua de formación se lleva el valor de la salinidad total equivalente en cloruro de sodio y la temperatura a la cual se desea el resultado, al gráfico Gen-9 de Schlumberger, ver Gráfico A.1, ó puede calcularse a temperatura de superficie (75 °F), utilizando la siguiente ecuación: Rw75 = 0.0123 + 3647.5 [NaCl( ppm)]0.995 Este valor se lleva a temperatura de yacimiento mediante la relación: 68 CAPITULO II. MARCO TEORICO ⎛ 75 + 6.77 ⎞ Rw @ Ty = Rw75 * ⎜⎜ ⎟⎟ ⎝ Ty + 6.77 ⎠ Rmfe =x Rwe (Valor obtenido del gráfico SP-1) S O D A V R E S S RE O H C E R E D Rwe = Rmfe x Determinar la Resistividad del Agua de formación, (Rw) Obtenido el valor de Rwe se utiliza el gráfico SP-2 (Gráfico A.5), para determinar la resistividad del agua de formación (Rw) en función de la temperatura del acuífero. Para finalizar, en lo que respecta al uso del Perfil del Potencial Espontáneo (SP) en el cálculo de la Rw, es necesario tratar el caso cuando el agua de formación contiene sales distintas al cloruro de sodio (NaCl). Para ello, cuando el agua de formación y/o el filtrado del lodo tienen iones de Ca++ y Mg++, además de Na+, el Potencial Espontáneo Estático (SSP) vendrá dado por la siguiente relación: ⎛ [aNa + (aCa + aMg ) ] * w SSP = − K * Log ⎜⎜ ⎝ [aNa + (aCa + aMg ) ] * mf ⎞ ⎟ ⎟ ⎠ Donde: aNa, aCa y aMg son las actividades iónicas del Na+, Ca++ y Mg++ en el agua de formación y el filtrado del lodo (se supone aquí que el ión cloruro Cl- es el anión predominante). 69 CAPITULO II. MARCO TEORICO Si se conocen las concentraciones de Na+, Ca++ y Mg++, la actividad de una solución @ 75 °F, es decir (aNa + ) aCa + aMg , puede determinarse del gráfico SP-4 de Schlumberger, que se presenta en el Gráfico A.6 del Anexo A. S O D A V R E S SEnReseEcaso, la relación Rw-Rwe puede ser llegar a ser muy importantes. O H C E R E D completamente distinta de la del cloruro de sodio. El gráfico SP-5 En aguas de formación, dulces, las sales distintas de NaCl pueden presentado en el Gráfico A.7 del Anexo A, muestra las curvas de RwRwe @ 25 °C (77°F) para soluciones de varias sales diferentes. Con una excepción, estas curvas fueron obtenidas en el laboratorio, para soluciones puras. La excepción mencionada es la curva de Rw-Rwe determinada empíricamente para aguas dulces medias. Esta curva corresponde a las curvas a trazos o rayas del gráfico SP-2 de Schlumberger (Gráfico A.5). En la gran mayoría de aguas de formación, hay suficiente NaCl como para que pueda usarse el valor de K del cloruro de sodio (71 @ 77°F). Sin embargo, en aguas muy dulces cuando predominan ciertas sales, el valor de K puede quedar afectado. Si se hacen trabajos de perfilaje en un área donde predominan sales poco usuales en el agua de formación, es conveniente desarrollar para el área gráficos empíricos de Rw-Rwe y hallar para el tipo de lodo usado, valores de K empíricos. 70 CAPITULO III. MARCO METODOLOGICO 3. MARCO METODOLOGICO La metodología utilizada, para poder cumplir con los objetivos planteados y tomando en cuenta los criterios que hay que seguir en un Trabajo Especial a Grado, se describen a continuación: S O D A V R E S S RE O H C E R E D a las características que presenta esta investigación acuerdo 3.1 TIPO DE INVESTIGACION De denominada Desarrollo de Modelos Fisico-Quimicos para la caracterización de aguas de formación/inyección del flanco Oeste de la U.E Lagomedio esta se clasifica como: 3.1.1. Investigación Descriptiva: Delimita los hechos que conforman el problema de la investigación planteado, sirve para describir, recopilar, analizar e interpretar la situación actual de algún proceso, permitiendo identificar características, hechos, sucesos con un alto grado de precisión propias del fenómeno investigado, no hace predicciones o hipótesis, describe hechos a partir de un criterio o modelo teórico definido previamente. 3.1.2. Investigación de Campo: Es el análisis sistemático de problemas en la realidad, con el propósito bien sea de describirlos, interpretarlos, entender su naturaleza y factores constituyentes, explicar sus causas y efectos, o predecir su ocurrencia, haciendo uso de métodos característicos de cualquiera de los paradigmas o enfoques de investigación conocidos o en desarrollo. La data se recoge en forma directa de la realidad donde se presentan los hechos; en este sentido se trata de investigaciones a partir de datos originales o primarios. Sin embargo, se aceptan también estudios sobre datos centrales o muéstrales no recogidos por el estudiante, siempre y cuando se utilicen los registros originales con los datos no arreglados; o cuando se trate de estudios que impliquen la 71 CAPITULO III. MARCO METODOLOGICO construcción o uso de series históricas y, en general, la recolección y organización de datos publicados para su análisis mediante procedimientos estadísticos, modelos matemáticos, econométricos o de otro tipo. 3.1.3. Investigación Analítica: Este tipo de investigación supera los términos de búsqueda y presentación de la información; inicia su proceso de conocimiento S O D A V R E S S RE O H C E R E conformen D el objeto de investigación y así obtener a partir del análisis de los por la identificación de cada una de las partes que caracterizan una realidad, para establecer las relaciones causa - efecto, entre los elementos que mismos, información que permita el futuro tratamiento de las variables que les afectan. 3.2 SELECCIÓN DE LA POBLACION Y MUESTRA DE ESTUDIO 3.2.1 Población o Universo: se refiere al conjunto para el cual serán validas las conclusiones que se obtengan, o los elementos o unidades a los cuales se refiere la investigación. Para la realización de este trabajo se tomo en cuenta el Campo Lama bloque IX y XIV al oeste de la falla Lama-Icotea segregación Lagomedio pertenecientes a Petróleos de Venezuela, S.A (PDVSA) específicamente los yacimientos C-6S/M SVS0013, C-5-SVS0014, C-7-SVS0005, C-6-I-SVS0012, cuales posee pozos que se encuentran activos y actualmente en producción y la Planta de Inyección de agua PIA-69 con los pozos inyectores, SVS-0030, SVS-0400, SVS-0049, LMA-0004. 72 CAPITULO III. MARCO METODOLOGICO 3.2.2 Muestra: Es un subgrupo de la población, es la parte del trabajo o estudio que se detalla dentro del mismo y además es la que debe tener mayor impacto en la defensa o presentación del trabajo. La selección para la muestra de este estudio se realizo una selección conformada por 26 pozos pertenecientes a los yacimientos nombrados y que se encuentran bajo los S O D A V R E S S RE O H C E R E D• Pozos que se encuentren en categoría 1 (PP o PT) es decir requerimientos siguientes: bombeando, activo o produciendo. • Pozos a los cuales no se les haya realizado ningún trabajo (reparaciones, estimulaciones, acidificaciones, entre otros) • Pozos que no presenten problemas mecánicos. • Pozos que no tengan producción por distintas arenas (commingle) es decir que no estén comunicados. Yacimiento C-6-S/M SVS0013 C-7-SVS0005 C-5-SVS0014 C-6-I-SVS0012 PIA-69 SVS-0044 SVS-0404 SVS-0052 SVS-0237 SVS-0030 SVS-0078 SVS-0159 SVS-0276 SVS-0275 SVS-0400 SVS-0393 SVS-0402 SVS-0318 SVS-0032 SVS-0049 Pozo SVS-0343 SVS-16ST SVS-0414 LMA-0004 LMA-0055 LMA-0114 SVS-0061ST Tabla 3.1 Pozos seleccionados para análisis fisico-químicos. Halina Nava. 3.3 TECNICA DE RECOPILACION DE LA INFORMACION Se reunieron (227) análisis físico-químicos de la muestras de agua de formación/inyección que fueron tomadas a los pozos pertenecientes al flanco oeste de la segregación Lagomedio. 73 CAPITULO III. MARCO METODOLOGICO 3.3.1 Técnicas e instrumentos utilizados para la recopilación de los datos Resulta indispensable registrar y estructurar toda la información que se obtenga para luego analizar y hacer posible la selección de las actividades a ser consideradas. Según la investigación que se desarrollo S O D A V R E S S RE O H C E R E D de manera directa y adecuada del personal en el área de información y las exigencias de los datos requeridos, se utilizaron fuentes de información primarias y secundarias: la primaria permite obtener estudio y la secundaria de la cual se obtuvo información básica contenida en textos especializados, revistas, enciclopedias, y trabajos realizados en el área. Se efectuó una revisión exhaustiva de toda la información perteneciente a cada uno de los pozos, para la cual fue necesario utilizar las siguientes herramientas: • Aplicación Corporativa Centinela Es un software diseñado como manejador de base de datos que soporta diversos parámetros del comportamiento y del sistema de producción de los pozos, lo cual facilita la obtención de los valores de producción bruta, producción neta, ºAPI, RGP, %AyS, etc. y manejo de la información cuantificable. Estos parámetros fueron adquiridos para la actualización de dichos pozos. También se puede consultar los cambios operacionales a nivel de pozos. Este programa almacena la data general del pozo y la producción. Es un visualizador de información petrolera, ya que es el primer producto a escala mundial que tiene como objetivo principal el incrementar y afianzar las fortalezas existentes en los procesos de petróleo y gas, con una alta capacidad de respuestas y así ser más flexible y compatible operacionalmente para satisfacer las distintas necesidades que pueden presentarse en el negocio 74 CAPITULO III. MARCO METODOLOGICO petrolero. Este programa funciona en una verdadera arquitectura cliente servidor, abierto, con una interfaz gráfica y adaptable a las necesidades requeridas en el mundo petrolero. El CENTINELA es un sistema corporativo, conformado por 14 módulos. Entre los módulos de mayor uso se encuentra: Pozo: facilita el control y seguimiento diario de los parámetros del S O D A V R E S S RE O H C E R E del resto deD los módulos para realizar los balances oficiales de crudo y gas. comportamiento de producción de los pozos, y mantiene la actualización de los datos históricos de sus pruebas y muestras. Consolida los resultados contables • Aplicación Corporativa AICO Ambiente Integrado de Consultas Operacionales. Es un manejador de datos aplicado a Centinela para construir tablas y/o tendencias a conveniencia del usuario, permitiendo un mejor manejo de la información que se requiere. • Aplicación Corporativa CARAGUA Es un sistema desarrollado que tiene la finalidad de almacenar toda la información de los resultados obtenidos de los análisis de agua de muestras recogidas de los pozos, también realiza la comparación de las muestras con los patrones seleccionados.| 3.3.1.2 Trabajo de Campo El trabajo de campo se baso en la recolección de las muestras de los pozos seleccionados previamente, para esta campaña se contó con la colaboración de los Ingenieros de Yacimiento de la Unidad de Explotación Lagomedio, para el traslado a los pozos y para supervisar que el trabajo realizado cumpliera con las normas y requerimientos necesarios para la toma de muestras representativas. Se ubico previamente el equipo de seguridad 75 CAPITULO III. MARCO METODOLOGICO personal. Las muestras se tomaron de la válvula de muestreo del pozo y se recolectaron en envases de polietileno, limpios, sellados e identificados con el número del pozo, fecha de la muestra y tipo de análisis. 3.3.1.3 Requerimiento para la toma de muestras representativas S O D A V R E S S RE y preservación de la misma. La O H C E R procedimiento para la toma, manipulación E D Uno de los aspectos de interés más importantes en lo que a la determinación de la composición de las muestras de agua, se encuentra el muestra de agua debe ser representativa 3 galones aproximadamente de lo contrario los resultados de las pruebas de laboratorio arrojarán falsas conclusiones. Previo a la toma de las muestras es necesario tomar en cuenta algunos aspectos como: • El pozo debe estar operando bajo condiciones normales tasa de flujo, presión, temperatura, etc. A menos que el propósito de la muestra sea bajo condiciones anormales. • No deben tomarse muestras inmediatamente después de una reparación, estimulación o acidificación. • Al momento de estar realizándose la circulación del lodo de perforación, esperar que la columna hidrostática se estabilice. Se recomienda circular y esperar para asegurar que sea agua de formación. • Los envases, deben ser de material químicamente inerte, de polietileno, polipropileno o vidrio, deben ser nuevos y estar perfectamente limpios. 76 CAPITULO III. MARCO METODOLOGICO • Si hay válvula de muestreo utilice una manguera o conector el cual es bastante útil para tomar la muestra, se debe abrir la válvula y dejar que corra el agua al menos durante un minuto, observar si el color del agua varía, en caso de que varie se debe esperar hasta cuando permanezca constante. Es probable que existan escombros o sedimentos en la tubería y éstas deberán ser lavadas antes de tomar S O D A V R E S RE S O H C E R E REQUERIMIENTO D ESPECIAL PARA MANIPULACION Y TOMA DE MUESTRAS DE AGUAS la muestra. DE FORMACION / INYECCION ANALISIS ENVASES CANTIDAD MINIMA DE LA MUESTRA (mL) ALCALINIDAD P,V PRESERVACION MAXIMO TIEMPO RECOMENDADO 200 REFRIGERADO 24 HORAS P,V 200 REFRIGERADO, AGREGAR HCL PARA PH < 2 7 DIAS BROMURO P,V 200 NO REQUIERE DIOXIDO DE CARBONO P,V 100 ANALISIS INMEDIATO - CLORURO CROMO CONDUCTIVIDAD FLUOR P,V P (A), V(A) P,V P 500 300 500 300 NO REQUIERE REFRIGERADO REFRIGERADO NO REQUIERE 28 DIAS 24 HORAS 28 DIAS 28 DIAS NITRATO P,V 100 ANALIZAR TAN PRONTO COMO SEA POSIBLE O REFRIGERAR 48 HORAS OXIGENO DISUELTO PH RESISTIVIDAD SILICE GRAVEDAD ESPECIFICA SULFATO V P,V 300 - P P P,V 500 500 200 SULFURO P,V 100 P,V 500 P,V - P,V P,V AMONIO BICARBONATO SOLIDOS TOTALES DISUELTOS TEMPERATURA SOLIDOS TOTALES SUSPENDIDOS TURBIDEZ VER ALCALINIDAD 28 DIAS ANALISIS INMEDIATO ANALISIS INMEDIATO VER CONDUCTIVIDAD REFRIGERAR SIN CONGELAR REFRIGERADO REFRIGERADO REFRIGERADO; AGREGAR 4 GOTAS ACETATO DE ZINC 2N / 100 ML ANALIZAR EL MISMO DIA, REFRIGERAR ANALISIS INMEDIATO 0,5 HORAS 2 HORAS 500 REFRIGERADO 7 DIAS - ANALISIS INMEDIATO - 28 DIAS 28 DIAS 28 DIAS 28 DIAS 24 HORAS - NOTAS: PARA ANALISIS QUE NO SE REFLEJAN EN LA LISTA USAR, CONTENEDORES DE PLASTICO O VIDRIO, PREFERIBLEMENTE REFRIGERAR DURANTE ALMACENAMIENTO, Y ANALIZAR LO MAS PRONTO POSIBLE. REFRIGERAR= ALMACENAMIENTO A 4 °C, EN LA OSCURIDAD P= PLASTICO (POLIETILENO, POLIPROPILENO O SU EQUIVALENTE) V= VIDRIO V(A) O P(A)= ENJUAGAR CON HNO3 1N FUENTE: PRACTICA RECOMENDADA PARA EL ANALISIS DE AGUA DE CAMPOS PETROLEROS API RP45 1998 77 CAPITULO III. MARCO METODOLOGICO El análisis inmediato de la muestra es ideal, almacenamiento a baja temperatura (4°C) por menos de las próximas 24 horas es lo mejor, pero no siempre es posible. La completa preservación de una muestra es imposible, al menos algunas técnicas de preservación solo logran retardar cambios químicos y biológicos que ocurren en la muestra colectada. Algunas propiedades y S O D A V R E S S RE O H C E R E D en campo o en el sitio, cambios en estos constituyentes ser determinados constituyentes del agua de formación no se logran preservar fácilmente como lo es el caso de la temperatura, pH y gases disueltos que rápidamente deben también afectan en la posterior determinación del calcio, dureza total y alcalinidad. 3.3.2 Calidad del Dato / Control de Calidad (CD/CC) La calidad del dato y el control de calidad son parte integral de cualquier adquisición de data y de un proceso de análisis de data debido a que estos garantizan la generación de resultados confiables. Globalmente la calidad del dato consiste en definir precisamente los análisis requeridos para un usuario en específico e implementar las medias necesarias para asegurar que lo que se requiere es efectivamente lo suministrado por el analista. Por ejemplo; en el caso de que sea necesario obtener medidas precisas de la concentración de sodio, es esencial que este valor sea medido analíticamente, en vez de ser inferido por cálculos diferenciales. Complementado con el control de calidad es igualmente importante que el personal de control de calidad chequee y asegure que los protocolos necesarios de recolección, manipulación, preservación y análisis se han seguido ha cabalidad. 78 CAPITULO III. MARCO METODOLOGICO 3.3.3 Parámetros para la Toma de Muestras Algunas propiedades del agua varían rápidamente luego de la toma de la muestra. Las siguientes determinaciones o análisis deben hacerse en sitio para mayor exactitud y precisión (calidad del dato). S O D A V R E S S RE O H C E R E D Bicarbonato 1. pH 2. Carbonato 3. 4. Oxígeno disuelto 5. Dióxido de carbono disuelto 6. H2S o Sulfuro de Hidrógeno 7. Temperatura 8. Concentración de sólidos disueltos 9. Distribución del tamaño de partículas 10. Turbidez Es difícil hacer notar la importancia del análisis en campo, ciertamente algunas propiedades empiezan a cambiar en cuestión de minutos, otras se mantienen estables por algunas horas y otras hasta por tiempo indefinido. - El pH y el contenido de gas disuelto producido en el agua; usualmente empiezan a variar inmediatamente después de tomar la muestra. Esto ocurre porque los gases disueltos se liberan de la solución tan pronto como la muestra es extraída del yacimiento, debido a los cambios de presión. - H2S disuelto y CO2, se liberan de la muestra al aumentar el pH estos gases son responsables de la acidez del agua producida. Los componentes del hierro precipitan debido al aumento del pH, también por la entrada del oxigeno presente en la atmósfera a la muestra. 79 CAPITULO III. MARCO METODOLOGICO - Al aumentar el pH aunado con el incremento de la temperatura; se originan formaciones de escamas de carbonatos de calcio. La concentración del oxigeno varia. Bacterias en la muestra se empiezan a multiplicar en solo pocas horas o es posible que comiencen a morir dependiendo de algunas condiciones específicas. Pequeñas cantidades o no de H2S o CO2 pueden S O D A V R E S S RE O H C E R E D fuese transportada al laboratorio y analizada luego de algunos Si la muestra encontrarse en la muestra luego de un corto período. días, el resultado de los análisis daría una visión completamente distorsionada del agua a condiciones de yacimiento, debido a los cambios en la composición del agua que toman lugar exactamente después de ser tomada la muestra. Sin embargo, debido a la fuente del agua, análisis en sitio son absolutamente necesarios para que los resultados sean 100 % correctos y el agua pueda generar valor agregado a los problemas de exploración y producción presentes en los yacimientos. La razón primordial de estas medidas en sitio de ciertas propiedades del agua, forman parte integral del diseño y operación exitosa de un sistema de agua de inyección. Significado y Propiedades de los Constituyentes 1. Cationes a) Calcio: el mayor constituyente en aguas de formación/inyección y se consigue en altas concentraciones. El ion calcio es el de mayor importancia debido a que rápidamente se combina con los iones bicarbonato, carbonato y sulfato formando precipitaciones, escamas y sólidos suspendidos. 80 CAPITULO III. MARCO METODOLOGICO b) Magnesio: El ion magnesio usualmente esta presente en menor concentración que el calcio, el principal problema de la presencia de este ion es la formación de escamas de carbonato de magnesio MgCO3, sin embargo se observan raramente. Presenta solubilidades 50 veces mayores que las de el carbonato de calcio, otras sales magnesicas incluyendo el sulfato de magnesio MgSO4 son bastante S O D A V R E S S RE O H C E R E yD de inyección, pero normalmente no origina ningún solubles. c) Sodio : se encuentra en grandes cantidades en aguas formacionales problema excepto en salmueras o aguas extremadamente saladas donde hay precipitaciones de cloruro de sodio NaCl. d) Hierro : El hierro natural contenido en aguas de formación/inyección es bastante bajo y su presencia es un indicador de corrosión. Esta presente en soluciones en ion férrico (Fe+++) e ion ferroso (Fe++). Los analisis de hierro usualmente se utilizan para detectar corrosión en sistemas de aguas de inyección, la presencia de precipitado de hierro causa formación de incrustaciones y taponamientos. e) Bario: el bario es sumamente importante y casi siempre esta presente, su importancia radica en la habilidad para combinarse con el ion sulfato y para formar sulfato de bario BaSO4 , el cual es altamente insoluble. Pequeñas cantidades ocasionan problemas severos. f) Estroncio: al igual que el bario y el calcio, el estroncio se combina con el sulfato formando escamas de sulfato de estroncio. 81 CAPITULO III. MARCO METODOLOGICO 2. Aniones a) Cloruro: es el anión que se produce en mayor cantidad, la mayor fuente del ion cloruro es el cloruro de sodio NaCl, por tanto la concentración del cloruro es utilizado para medir la salinidad del agua. El principal problema asociado con el cloruro esta en que el agua se hace mas corrosiva a medida que está mas salada. El ion S O D A V R E S S RE O H C E R E D Carbonato y Bicarbonato: Estos iones son de suma importancia cloruro es un constituyente estable y su concentración es una de las mas sencillas de identificar. b) debido a que forman escamas insolubles. La concentración del ion carbonato algunas veces es llamado alcalinidad fenolftaleinica y las concentraciones del ion bicarbonato alcalinidad naranja-metilica. c) Sulfato: el ion sulfato es un problema debido a su habilidad a reaccionar con el calcio, bario y estroncio formando escamas. También sirve como sustancia alimenticia para las bacterias sulfato reductoras. 3.3.4. Criterios para el descarte de resultados de análisis Basándose en los análisis físico-químicos del agua de formación recopilados, se realizó el siguiente descarte de muestras, tomando en consideración los siguientes criterios: • Análisis con datos incompletos: Fecha de muestreo, pH, concentración de iones. • Muestras tomadas en pozos con bajo corte de agua (%AyS <30%). • Muestras contaminadas por agua de vapor o fluidos de perforación, computación, reacondicionamiento, y otros. . 82 CAPITULO III. MARCO METODOLOGICO 3.4.1 Balance Iónico Para que un análisis sea considerado como representativo debe estar balanceado iónicamente, es decir, se debe verificar que la suma de los pesos equivalentes (meq/L) de los cationes (iones positivos) sea igual a la suma de los aniones (iones negativos), rechazando las muestras cuyo balance iónico sea distinto de cero o se aleje mucho de ese valor. Un valor fuera de los S O D A V R E S RE no tomadas en cuenta durante el Sespecies O C directa de la presencia deH otras E R E D parámetros estaría dando una medida de error analítico o seria evidencia análisis. Se realizó el balance iónico a todos los análisis físico-químicos restantes aceptando una tolerancia de 0,05. 3.5 CRITERIOS DE VALIDACION DE MUESTRAS Los procedimientos que se exponen a continuación para la valoración de la corrección de los análisis son aplicables de forma específica a las muestras de agua para las que se han realizado los siguientes análisis: pH, conductividad, sólidos disueltos totales (SDT) y los principales componentes aniónicos y catiónicos, que son indicadores de la calidad general del agua. Las comprobaciones que se explican a continuación no requieren análisis adicionales de laboratorio, pero se precisan la determinación de los cálculos de los SDT y la conductividad de los componentes medidos. Para calcular los sólidos totales disueltos se suman las concentraciones (en mg/L) de los componentes del siguiente modo: SDTcalculado = 0,6(Alcalinidad Total) + Na + K + Ca + Mg + Cl + SO4 + SiO3 + NO3 + F 83 CAPITULO III. MARCO METODOLOGICO Para calcular la conductividad eléctrica se utiliza la siguiente ecuación: n CE = ∑ conci × CEi i 01 FACTORES DE CONDUCTIVIDAD PARA IONES COMUNMENTE ENCONTRADO EN AGUA @ 25°C μmhos/cm ION (CEi), para meq/L (CEi), para mg/L 0.716 S O D A V R E S RE Calcio S 52.0 O 2.60 H C E R E D Carbonato Bicarbonato 43.6 34.6 2.82 Cloruro 75.9 2.14 Magnesio 46.6 3.82 Nitrato 71.0 1.15 Potasio 72.0 1.84 Sodio 48.9 2.13 Sulfato 73.9 1.54 1.- Equilibrio entre aniones y cationes Las concentraciones equivalentes de los distintos componentes en solución están en equilibrio por el principio de la electroneutralidad. La suma de los aniones y cationes, cuando se expresan en miliequivalentes por litro (r), deben estar equilibradas, es decir, son eléctricamente neutras. El examen se basa en la diferencia porcentual definida del siguiente modo: Diferenciaen% = 100 ∑ rcationes − ∑ raniones ∑ r cationes + ∑ raniones 84 CAPITULO III. MARCO METODOLOGICO Y los criterios de aceptación se establecen como sigue: Σ iones (meq/L) Diferencia aceptable en %meq/L 0,0 – 3,0 ± 0.2% 3,0 – 20,0 ±2% 20,0 - 800 ± 2 - 5% S ±A 10% O D V R E S S RE O H C E R E D > 800 2.- SDT medido = SDT calculado La concentración medida de sólidos disueltos totales debe ser superior a la calculada, ya que es posible que algún contribuyente significativo no haya sido incluido en el cálculo. La relación aceptable es la siguiente: 1,0 < STDmedido < 1,2 SDTcalculado 3. CE medida = CE calculada Si la conductividad calculada es superior al valor medido, hay que volver a analizar la muestra. La relación aceptable es: 0,9 < CEcalculad a < 1,1 CEmedida 85 CAPITULO III. MARCO METODOLOGICO 4.- Relación SDT-CE calculada Si la relación calculada SDT- CE está por debajo de 0,55 o por encima de 0,7, la suma iónica no es fiable; hay que analizar la muestra de nuevo. Si se encuentran presentes iones calcio o sulfato pobremente disociados, el SDT puede alcanzar un valor tan alto como 0,8 veces la CE. El criterio aceptable S O D A V R E S S RE O H C E R E D para esta relación es: SDT calculado / Conductividad = 0,55-0,7 5.- Relación SDT-CE medida Los criterios aceptables para esta relación comprenden desde 0,55 hasta 0,7 si la relación SDT-CE se encuentra fuera de estos limites la SDT o la conductividad medidas no son fiables; hay que analizarlas de nuevo. Existen publicaciones que contienen descripciones mas completas sobre las valoraciones del control de calidad. 5.- Relación de valores de pH A pH menores a 8,3 solo debe estar presente el bicarbonato, es decir, los carbonatos debe estar ausentes. A valores de pH mayores de 8,3 deben estar presentes carbonatos y bicarbonatos. 86 CAPITULO III. MARCO METODOLOGICO 3.6. Caracterización de las aguas de formación Luego de haber cumplido en los análisis ciertas condiciones, se procede a aplicar los diferentes métodos de clasificación. El Método de Bojarski y Schoeller: Para determinar que tipo de agua, se hará un estudio a través de su composición química. El Diagrama de Stiff: El cual servirá para determinar la huella o patrón característico de cada bloque o área de estudio. Para aplicar S O D A V R E S RE las concentraciones en miligramos Snecesita O H C análisis físico-quimicos el cual sólo E R E D estos métodos se utilizó un formato elaborado en Excel especialmente para por litro (mg/l) de los aniones y cationes, resistividad del agua y temperatura a la cual fue tomada la resistividad. 3.7. Definición del patrón de agua de formación Para definir un patrón de agua de formación, se le aplico a los análisis físico-químicos agrupados y validados anteriormente una distribución de frecuencia, a manera de obtener al valor más probable de la concentración de cada ion, y a la vez se generaron una serie de histogramas de frecuencia para apreciar de manera visible el grado de ocurrencia de cada valor. Para construir la distribución de frecuencia se identifico el rango o amplitud existente entre el valor máximo y el mínimo del grupo de datos. Rango = Max – Min Luego se calculo el número de clases representadas por K, y N como el número total de datos, para muestras cuyo número de datos sea menor a 150 se recomienda aplicarle la raíz cuadrada al número de datos. K= N 87 CAPITULO III. MARCO METODOLOGICO Se calculo el ancho de clase (Ac), y sé comprobó que el producto de KAc fuera ligeramente mayor que el rango, donde KAc es la holgura de la clase. Ac = (Max – Min) / K = Rango / K S O D A V R E S S RE O H C E R E D Algunos autores dicen que es ventajoso un ancho de clase par. Luego KAc > Rango se elige un punto inicial el cual debe ser algo menor al valor más bajo (Min). A ese valor se le adicionara el ancho de clase (Ac) tantas veces como clases (K) hayan. Estos números se denominan límite inferior de clase. El limite superior de clase debe ser menor al limite inferior de la clase siguiente (los limites superiores no pueden ser iguales a los inferiores), calculamos la marca de clase que no es mas que el limite inferior + el limite superior / 2. Luego se procede a determinar la frecuencia que no es más que el número de veces que ocurre el valor en la muestra. 3.8. Obtención del patrón de agua de formación Luego de validar la información de los pozos, resultaron candidatos para la elaboración de patrones, debido a que arrojaron análisis representativos. Con las muestras representativas de cada pozo se obtuvo el patrón del agua de formación. Dicho patrón se generó aplicando un método estadístico para obtener el valor más probable de la concentración de cada ión (Na+, Ca+2, Mg+2, Cl-, HCO3-, SO4-2 y CO3-2) y las diferentes propiedades del agua (pH). 88 CAPITULO III. MARCO METODOLOGICO 3.9. Realización de histogramas de frecuencia para cada componente En los análisis físico-químicos de las aguas de formación, la determinación del valor de sus contituyentes y/o propiedades, se ve afectada por un margen de error, que puede ser pequeño pero no nulo, el cual puede deberse a imperfecciones en los aparatos, errores casuales o accidentales, S O D A V R E S S RE O H C E R E D entre otros. En vista de esto, es necesario determinar un estimado de ese valor verdadero. Para estimar ese valor se realizaron histogramas de frecuencia para cada componente, con la finalidad de observar el comportamiento y obtener el valor más probable o moda. 0.30 Probabilidad 0.20 0.10 0.00 80 100 120 140 160 180 200 220 240 Componente Gráfico 4.1. Histograma de frecuencia. Los valores más probables fueron representados gráficamente por el Diagrama de Stiff característico del yacimiento. 89 CAPITULO III. MARCO METODOLOGICO S O D A V R E S S RE O H C E R E D Gráfico 4.2. Método de Stiff. 3.10 Clasificación de las aguas de formación El método utilizado para clasificar las aguas como meteórica o connata es el propuesto por Sulin, Bojarski y Schoeller. Para determinar la clase y el tipo de agua presente en los yacimientos, se compararon los resultados obtenidos con las relaciones presentadas por cada clasificación. 90 CAPITULO III. MARCO METODOLOGICO 3.11 Cálculo de la resistividad del agua de formación (RW) La metodología aplicada para determinar la resistividad del agua para cada yacimiento a partir de los análisis físico-químicos, consiste en reducir la composición química de la muestra de agua a una equivalente en cloruro de sodio (NaCl), mediante el siguiente procedimiento: S O D A V R E S componente en mg/L , éstas se reducen a una salinidad equivalente de cloruro S RE O H C E R E D por medio de unos factores de conversión o multiplicadores. de sodio (NaCl) • Una vez determinadas las concentraciones correspondientes a cada Estos factores se determinan haciendo uso del Gráfico 4.4, entrando por la abscisa con la concentración total de sólidos en mg/L para encontrar los factores multiplicadores de cada uno de los componentes. Gráfico 4.3. Concentración total de sólidos Vs factores multiplicadores para determinar Rw a partir de análisis físico – químicos. 91 CAPITULO III. MARCO METODOLOGICO - Se multiplica la concentración de cada componente (mg/lts) por el multiplicador correspondiente, para obtener así las ppm de NaCl para cada uno. La sumatoria de las ppm de cada ión nos permitirá obtener la concentración total equivalente en NaCl. - Para obtener la salinidad total equivalente en cloruro de sodio, las partes por millón de cada ion se multiplicaron por su factor de conversión S O D A V R E S RE de superficie (75°F), se utilizo Sa temperatura O H resistividad delE agua deC formación E R D correspondiente y los productos se sumaron. Para obtener finalmente la la siguiente ecuación: Rw 75 = 0 . 0123 + 3647 . 5 [NaCl ( ppm )]0 .995 92 CAPITULO IV. ANALISIS DE RESULTADOS Luego de aplicar la metodología planteada en el capítulo anterior, se arrojó a los siguientes resultados por yacimiento. 4.1 Caracterización del Yacimiento CS6/M-SVS0013 Se recopilaron 77 análisis físico-químicos del yacimiento, de los cuales sólo se tomaron como muestras representativas 37, S O D A V R E S S RE O H C E R E D continuación. A través de estadística descriptiva, se obtuvieron los valores para cada ión, las concentraciones iónicas de cada una de las muestras se presenta a Fecha Toma Pozo SVS-0056ST 04/02/2004 SVS-0056ST 01/07/2004 SVS-0056ST 08/08/2004 SVS-0056ST 01/10/2003 SVS-0056ST 27/10/2005 SVS-0056ST 03/09/2005 SVS-0269 16/10/2005 SVS-0269 12/05/2005 SVS-0269 27/04/2005 SVS-0269 26/04/2005 SVS-0269 22/02/2004 SVS-0269 16/10/2005 SVS-0269 24/07/2005 SVS-0269 12/05/2005 SVS-0044 17/04/2005 SVS-0044 16/05/2005 SVS-0044 21/06/2005 Sodio 85,55 94,91 127,32 96 92,01 101,89 83,53 94,99 167,07 33,5 74,93 83,53 76,76 94,99 35,79 88,95 91,11 Calcio 0,9 1,2 0,5 0,8 1,04 0,24 1,04 1,3 1,1 1,1 1 1,04 0,96 1,3 1,2 0,92 1,3 Magnesio 0,8 0,1 0,3 0,3 0,56 0,8 0,8 1,5 1,9 1 0,7 0,8 0,72 1,5 1 0,12 0,6 Cloruro 40,18 46,72 42,62 40,73 46,6 57,27 51,65 52,78 58,92 1,45 41,27 51,65 47,8 52,78 1,64 59,51 58,95 Sulfato 0,68 0,5 0,51 1,59 1,41 4,67 3,12 2,22 87,56 5,35 0,97 3,12 3,04 2,22 0,95 1,28 4,06 Carbonato 0 0 0 0 0 3,6 1,6 6 3,6 8,4 0 1,6 0 6 0,4 5,6 0 SubSubBicarbona Total Total to Cationes Aniones 46,39 48,99 84,98 54,79 45,59 37,39 28,99 36,79 18 20,4 34,39 28,99 27,59 36,79 34,99 23,6 29,99 87,25 87,25 96,21 96,21 128,12 128,12 97,1 97,1 93,61 93,61 102,93 102,93 85,37 85,37 97,78 97,78 168,07 168,07 35,59 35,59 76,63 76,63 85,37 85,37 78,44 78,44 97,78 97,78 37,98 37,98 89,99 89,99 93,01 93,01 Obteniendo el siguiente diagrama de Stiff, Collins y Piper, el valor promedio del pH para este yacimiento es de 8.4 y un rango de Rw que oscila entre 0.76 y 2.42 ohm/m. El índice de Saturación de Stiff y Davis para los pozos que se encuentran produciendo de este yacimiento esta entre (1-1.5) lo cual indica que el agua esta sobresaturada de carbonato de calcio y tiene tendencia a formar incrustaciones de CaCO3. 93 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 94 CAPITULO IV. ANALISIS DE RESULTADOS QUIMICO POZO: MOT-20,87 PATRON: MEDIDO Rw @ 75= ohm 1,209 Rw @ 75= 0 ohm DIAGRAMA DE STIFF -15 -10 -5 Na 0 5 0,00 10 15 Cl S O D A V R E S S RE O Ca H HCO C E R E D 3 0,00 Mg 0,00 Fe 0,00 SO4 CO3 (Meq/Lt) / Factor de Escala Na/ 10 Pozo: 0,00 Patron: -8,77 Ca/ HCO3/ 10 Cl/ 10 10 Mg/ 10 Fe/ 1 CO3/ 1 SO4/ 10 0,00 0,00 0,00 0,00 0,00 0,00 0,00 -0,10 -0,08 0,00 2,00 0,51 3,66 4,59 El diagrama de Schoeller, grafica las cantidades en meq/L de los iones, en el mismo se pueden colocar cuantas muestras se consideren necesarias para luego comparar con el patrón del yacimiento y verificar si realmente se encuentra produciendo del mismo y si posee las mismas cantidades iónicas del patron es decir las características físico-químicas del mismo. El Diagrama de Piper es uno de los gráficos mas completos debido a que no se limita en cuantificar los aniones y cationes, sino que señala la clasificación de las aguas en este caso el agua de formación de los yacimientos primarios del Flanco Oeste son del tipo Bicarbonato de Sodio y aguas tipo meteóricas. 95 CAPITULO IV. ANALISIS DE RESULTADOS 4.2. Caracterización del Yacimiento C6I- SVS0012 Para este Yacimiento se recolectaron 54 muestras de las cuales solo se seleccionaron 21 muestras consideradas como representativas, la concentración iónica de cada una de las muestras se presenta en la siguiente tabla. Pozo SVS-0146 SVS-0146 SVS-0146 SVS-0032 SVS-0032 SVS-0032 SVS-0032 SVS-0280 SVS-0280 SVS-0280 SVS-0033 SVS-0033 SVS-0033 SVS-015ST SVS-015ST LMA-0117 LMA-0117 LMA-031ST LMA-031ST LMA-031ST LMA-031ST S O D A V R E S S RE O H C E R E D Fecha de Toma 10/02/2006 15/01/2006 02/07/2003 14/01/2006 16/09/2005 15/03/2005 20/11/2003 18/11/2004 18/11/2004 21/09/2005 13/01/2005 19/11/2005 15/10/2005 03/07/2004 02/07/2004 11/07/2003 03/07/2003 30/10/2003 31/08/2003 31/03/2004 17/05/1996 Sodio (meq/lts) 115,65 100,39 95,79 107,36 608,5 106,6 104,89 92,46 98,79 122,68 50,89 138 105,42 109,31 107,97 118,92 117,69 7,82 120,77 124,65 123,71 Calcio (meq/lts) Magnesio (meq/lts) 1,6 0,72 1,6 0,56 7,99 0,9 0,6 1,2 1 0,48 0,9 2,4 1,36 1,8 2 1,3 1,56 89,94 1,5 0,5 0,6 0,88 1,68 0,32 3,04 27,99 0,9 1,2 0,2 0,7 0,48 0,1 1,04 0,96 0,3 0,4 0,4 0,92 30 1 0,7 0,4 Cloruro (meq/lts) 79,82 76,36 63,81 84,22 617,61 75,04 71,68 51,87 60,69 74,11 20,97 84,22 79,73 69,24 69,8 78,74 72,75 81,45 74,39 84,12 84,6 Sulfato Carbonato Bicarbonato (meq/lts) (meq/lts) (meq/lts) 1,71 1,43 1,91 0,35 0,47 0,77 0,82 2 0,8 1,14 1,33 1,43 0,82 1,17 0,57 0,88 2,82 1,41 5,68 0,74 2,52 1,6 0 0 0 0 0,8 0 0 0 10 1,6 0,8 0,4 0 0 0 0 9,2 0 0 7,2 34,99 24,99 31,99 26,39 26,39 31,79 34,19 39,99 38,99 38,39 27,99 54,99 26,79 40,99 39,99 40,99 41,59 35,59 43,19 40,99 30,4 Sub-Total Cationes 118,12 102,79 97,71 110,96 644,47 108,4 106,69 93,86 100,49 123,64 51,89 141,44 107,74 111,41 110,37 120,61 120,16 127,66 123,26 125,85 124,71 Sub-Total Aniones 118,12 102,79 97,71 110,96 644,47 108,4 106,69 93,86 100,49 123,64 51,89 141,44 107,74 111,41 110,37 120,61 120,16 127,66 123,26 125,85 124,71 El valor promedio del pH de los pozos de este yacimiento es de 8.9 lo cual indica que hay presencia de iones bicarbonato y carbonato, el indice de stiff y davis esta entre 1-17, el agua esta sobresaturada de carbonato de calcio con alta tendencia a formar incrustaciones. El rango de Rw esta entre 0.65 -1.49, generando valores de salinidad normales de 6000 ppm de NaCl. Se determinaron los valores mas probables de las concentraciones de cada uno de los componentes, generando de esta manera un patrón característico para este yacimiento, el cual esta representado en los siguientes diagramas 96 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 97 CAPITULO IV. ANALISIS DE RESULTADOS QUIMICO POZO: MOT-20,87 PATRON: MEDIDO Rw @ 75= ohm 0,770 Rw @ 75= 0 ohm DIAGRAMA DE STIFF -15 -10 Na -5 0 5 0,00 10 15 Cl S O D A V R E S S RE O Ca H HCO C E R E D 3 0,00 Mg 0,00 Fe 0,00 SO4 CO3 (Meq/Lt) / Factor de Escala Na/ HCO3/ 10 Cl/ 10 10 Ca/ 10 Mg/ 10 Fe/ 1 CO3/ 1 SO4/ 10 Pozo: 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Patron: -12,75 -0,57 -0,35 0,00 1,50 0,15 3,58 9,78 98 CAPITULO IV. ANALISIS DE RESULTADOS 4.3 Caracterización del Yacimiento C5-SVS0014 De este yacimiento se recolectaron un total de 23 muestras, de las cuales solo 13 fueron seleccionadas por cumplir los criterios de validación de muestras representativas. Las muestras presentaron valores de pH de 8.2, rango de Rw entre 1.41-2.56, así como tendencia a la formación de escamas de carbonato de S O D A V R E S S RE O H C E R E D calcio obteniendo el valor calculado del índice de saturación 0.4. Pozo SVS-0052 SVS-0276 SVS-0318 SVS-0318 LMA-0013ST LMA-0013ST LMA-0079 LMA-0079 LMA-0085 LMA-0085 LMA-0103 LMA-0103 LMA-0103 Fecha de Toma 10/02/2006 20/10/2005 22/07/2004 22/02/2004 13/03/1996 16/04/1996 19/04/1995 17/02/1998 13/07/2000 20/10/2004 01/10/2004 30/09/2004 08/10/2004 Sodio Calcio Magnesio Cloruro Sulfato Carbonato Bicarbonato (meq/lts) (meq/lts) (meq/lts) (meq/lts) (meq/lts) (meq/lts) (meq/lts) 80,74 67,73 65,97 58,6 152,87 84,1 66,11 62,15 73,03 68,74 66,1 100,78 73,09 0,4 0,48 0,7 0,8 0,24 0,4 0,24 0,4 0,48 0,6 0,6 0,5 0,4 0,4 0,48 0,5 0,5 0 0,16 0,08 0,16 0,16 0,1 0,2 0,7 0,6 25,66 16,28 25,33 18,46 111,39 42,3 21,15 19,46 35,89 27,02 18,01 17,45 18,58 2,89 0,82 10,64 0,65 1,12 1,16 1,89 0,46 0,98 1,23 0,5 55,74 1,32 0 1,2 0 0 2 2,4 7,6 3,2 9,6 0 0,4 0 0 52,99 50,39 27,99 40,79 38,59 32,79 35,79 39,59 27,19 41,19 47,99 58,79 54,19 Sub-Total Cationes 81,54 68,69 67,16 59,9 153,1 84,65 66,43 62,71 73,67 69,44 66,9 101,98 74,09 Sub-Total Aniones 81,54 68,69 67,16 59,9 153,1 84,65 66,43 62,71 73,67 69,44 66,9 101,98 74,09 Se determinaron los valores mas probables de las concentraciones de cada uno de los componentes, generando de esta manera un patrón característico para este yacimiento, el cual esta representado en los siguientes diagramas 99 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 100 CAPITULO IV. ANALISIS DE RESULTADOS QUIMICO POZO: MOT-20,87 PATRON: MEDIDO Rw @ 75= ohm 1,405 Rw @ 75= 1,923 ohm DIAGRAMA DE STIFF -15 -10 -5 Na 0 5 0,00 10 15 Cl S O D A V R E S S RE O Ca H HCO C E R E D 3 0,00 Mg 0,00 Fe 0,00 SO4 CO3 (Meq/Lt) / Factor de Escala Na/ 10 Pozo: 0,00 Patron: -7,82 Ca/ HCO3/ 10 Cl/ 10 10 Mg/ 10 Fe/ 1 CO3/ 1 SO4/ 10 0,00 0,00 0,00 0,00 0,00 0,00 0,00 -0,05 -0,03 0,00 2,03 0,61 4,22 3,05 101 CAPITULO IV. ANALISIS DE RESULTADOS 4.4 Caracterización del Yacimiento C7-SVS0005 De este yacimiento se recolectó en total de 69 muestras de las cuales solo 26 resultaron representativas, los pozos productores de este yacimiento presenta un valor promedio de pH 8.9 y un índice de saturación de Stiff & Davis entre 0.9 y 1.15, el agua de formación se encuentra sobresaturada de CaCO3 con tendencia a formar incrustaciones. S O D A V R E S S RE O H C E R E D El rango de la Rw esta entre 0.65 y 1.49. Pozo SVS-0377 SVS-0377 SVS-0377 SVS-0377 SVS-0377 SVS-0404 SVS-0404 SVS-0404 SVS-0404 SVS-0404 SVS-0404 LMA-0010 LMA-0010 LMA-0011 LMA-0048 LMA-0048 LMA-0048 LMA-0075 LMA-0075 LMA-0075 LMA-0075 LMA-0075 LMA-0075 LMA-0114 LMA-0114 LMA-0114 Fecha de Toma 13/10/2005 27/11/2003 23/10/2004 10/04/2004 12/08/2005 02/12/2003 20/12/2003 26/06/2004 14/07/2004 15/05/2005 15/02/2005 14/05/1963 02/09/2005 26/07/1989 27/04/2000 26/01/2005 03/09/2005 17/02/1989 26/07/1989 18/05/1991 26/09/1991 22/08/2002 15/02/2005 11/07/2000 16/09/2000 04/09/2005 Sodio (meq/lts) 101,95 102,5 101,19 100,56 109,25 144,29 122,96 125,72 380,04 114,18 122,86 147,54 365,44 138,65 127,35 124,12 330,19 140,76 142,57 133,65 135,62 128,8 129,15 125,48 140,79 244,73 Calcio (meq/lts) 0,88 1,5 0,3 0,9 0,96 7,49 1,7 1,5 0 1,2 2,2 0,998 7,99 0,64 1,3 3,69 3,99 1,0291 0,13 0,68 0,57 1 2,5 2,56 7,99 7,99 Magnesio (meq/lts) 0,88 1 1,1 1,2 0,72 2,5 1,05 0,9 0 1,9 0,6 1,397 8 0,39 1 0,5 2 0,51 0,2 0,76 0,73 1 1,3 0,16 15,99 4 Cloruro Sulfato Carbonato Bicarbonato (meq/lts) (meq/lts) (meq/lts) (meq/lts) 47,11 66,79 69,24 65,61 74,67 122,18 88,51 92,88 337,49 92,08 93,8 114,52 336,88 101,52 95,89 97,11 308,8 108,57 108,57 98,7 102,93 100,94 98,21 95,89 134,59 224,58 0,6 3,86 0,36 0,85 4,06 0,5 0,8 0,65 0,97 0,6 3,86 0,41 3,35 2,16 0,16 0,41 0,98 1,44 1,94 4,6 1,6 0,66 1,14 0,5 0,38 1,34 5,6 2,4 2 0 2 2,4 0 0 0 2 2 2,39 14,4 3 1,6 0 1 0 6 0 6 6,6 1,2 1,2 3,2 5,2 23,4 31,99 30,99 36,19 30,19 29,19 36,39 34,59 41,59 22,6 25,99 33,6 26,79 32,99 31,99 30,79 25,39 32,29 26,39 31,79 26,39 22,6 32,39 30,59 26,59 25,59 Sub-Total Cationes 103,71 105,05 102,59 102,66 110,93 154,27 125,71 128,12 380,04 117,28 125,66 148,67 381,42 139,68 129,65 128,32 336,18 142,3 142,9 135,09 136,92 130,8 132,95 128,19 164,77 256,72 Sub-Total Aniones 103,71 105,05 102,59 102,66 110,93 154,27 125,71 128,12 380,04 117,28 125,66 148,67 381,42 139,68 129,65 128,32 336,18 142,3 142,9 135,09 136,92 130,8 132,95 128,19 164,77 256,72 Se determinaron los valores mas probables de las concentraciones de cada uno de los componentes, generando de esta manera un patrón característico para este yacimiento, el cual esta representado en los siguientes diagramas 102 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 103 CAPITULO IV. ANALISIS DE RESULTADOS QUIMICO POZO: SVS-0016 PATRON: MEDIDO Rw @ 75= ohm 0,642 Rw @ 75= 1,923 ohm DIAGRAMA DE STIFF -15 -10 Na Ca -5 0 5 0,00 10 15 Cl S O D A V R E S S RE O H HCO C E R E D 3 0,00 Mg 0,00 Fe 0,00 SO4 CO3 (Meq/Lt) / Factor de Escala Na/ HCO3/ 10 Cl/ 10 10 Ca/ 10 Mg/ 10 Fe/ 1 CO3/ 1 SO4/ 10 Pozo: 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 Patron: -15,69 -0,24 -0,19 0,00 2,00 0,15 3,00 12,60 104 CAPITULO IV. ANALISIS DE RESULTADOS 4.5. Caracterización de la Planta de Inyección PIA-69 Se recolectaron 10 muestras representativas de la Planta de Inyección de agua en la descarga, se observaron valores de Ph entre 6 y 7, esta agua es agua del lago con tratamiento químico realizado por la empresa SIMCO. El indice de Saturación de Stiff y Davis resultó negativo lo cual indica S O D A V R E S S RE O H C E R E Dvalores de Resistividad oscilan entre 1.37 y 2.03 dando como Los que el agua de formación se encuentra subsaturada de CaCO3 y que la tendencia a formar incrustaciones es imposible es decir el agua es Corrosiva. resultando que la salinidad en el agua de inyección es mucho menor que en las aguas de formación. Fecha de Toma Pozo PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES PIA 6-9 DES 03/05/2002 07/05/2002 17/06/2002 02/07/2002 15/07/2002 21/05/2005 25/05/2006 29/05/2002 29/05/2002 12/06/2002 Sodio (meq/lts) 45,22 55,05 53,43 61,85 62,4 51,54 53,51 55,67 50,19 51,72 Calcio (meq/lts) 15,95 8,56 2,87 2,99 2,24 7,51 2,38 12,78 14,54 14,37 Magnesio (meq/lts) 5,39 8,58 16 10,2 11,84 10,07 10,83 6,42 6,33 3,32 Cloruro (meq/lts) 56,72 61,3 61,22 57,76 60,56 59,26 61,38 63,56 60,06 58,73 Sulfato (meq/lts) 7,68 8,78 8,78 15,69 14,91 8,21 4,42 8,39 8,03 8,97 Carbonato Bicarbonat (meq/lts) o (meq/lts) 0 0 0 0 0 0 0 0 0 0 2,15 2,12 2,3 1,6 1 1,65 0,92 2,92 2,96 1,72 Sub-Total Cationes 66,56 72,2 72,03 75,05 76,47 69,12 66,72 74,87 71,06 69,41 Se determinaron los valores mas probables de las concentraciones de cada uno de los componentes, generando de esta manera un patrón característico para este yacimiento, el cual esta representado en los siguientes diagramas 105 Sub-Total Aniones 66,56 72,2 72,03 75,05 76,47 69,12 66,72 74,87 71,06 69,41 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 106 CAPITULO IV. ANALISIS DE RESULTADOS S O D A V R E S S RE O H C E R E D 4.6. DISCUSION DE RESULTADOS La metodología aplicada para la caracterización de las aguas de formación del Flanco Oeste de la Segregación Lagomedio, permitió establecer los patrones para las aguas de formación de los yacimientos C6S/M-SVS0013, C6ISVS0012, C5-SVS0014, C7-SVS0005 y la Planta de Inyección PIA-69. Al comparar las aguas de los diferentes yacimientos caracterizados, se encontró que la salinidad tiende a aumentar con la profundidad y la edad de la formación, ya que el movimiento del agua a lo largo de la trayectoria de flujo, incrementa los sólidos disueltos totales. Este el caso del yacimiento C7- SVS0005, el cual presenta el mayor contenido de sólidos disueltos y la mayor concentración de los iones Na+ y Cl-. 107 CAPITULO IV. ANALISIS DE RESULTADOS En cuanto a la distribución iónica, la mayor concentración de sodio y cloro se observa en C-7, mientras que los menores valores de concentración corresponden al yacimiento C-5. Estas diferencias están altamente relacionadas con los ambientes de depositación de los sedimentos presentes en los yacimientos. S O D A V R E S S RE O H C E R E Duna arena a otra, también se presentó a lo largo de la extensión solamente de Es importante señalar que la variación de los iones Na+ y Cl- no fue areal de los yacimientos, como es el caso del yacimiento C6S/M SVS-0013, el cual presenta una mayor concentración de estos elementos hacia el área norte (96.91 y 61.08 meq/L respectivamente), mientras que hacia el sur del área, las concentraciones tienden a disminuir alcanzando 63.15 y 29.42 meq/lts para el Na+ y Cl- respectivamente. Esta diferencia se debe a la mayor influencia marina en el ambiente fluvio-deltáico de depositación de sedimentos presente en este yacimiento, ya que las concentraciones de sodio y cloruro en el agua, se ven incrementadas por la influencia del agua de mar, que tiene altas concentraciones de este anión y este catión. De igual manera los patrones de agua establecidos para el resto de los yacimientos estudiados, presentan variaciones en su composición a lo largo de toda su extensión areal, lo cual puede observarse en el Diagrama de Stiff característico de cada uno. En cuanto al bicarbonato (HCO3-), se observó mayor concentración de éste en C-4, lo que indica que esta arena estuvo más expuesta a los eventos 108 CAPITULO IV. ANALISIS DE RESULTADOS meteóricos que las otras, infiriéndole un carácter hidrodinámico al agua allí presente. Con respecto al carbonato (CO3-2), es importante señalar que la concentración de este ión está favorecida por el valor del pH del agua, la temperatura y la presión. A mayor temperatura menos soluble resultan ser los S O D A V R E S S RE O H C E R E temperaturaDse incrementa existe tendencia a formar incrustaciones carbonatos en el agua, razón por la cual en aquellas áreas donde la de carbonato de calcio, de igual manera una caída de presión a consecuencia de los múltiples factores a los cuales está sometido el yacimiento durante el proceso de producción causa la formación de carbonatos. Los resultados obtenidos de la aplicación del sistema de clasificación de Sulin, Bojarski y Schoeller indican que las aguas presentes en los yacimientos caracterizados del Flanco Oeste, son meteóricas del tipo bicarbonato de sodio, ya que las relaciones Na+/Cl- y (Na+-Cl-)/SO4-2 presentan valores mayores a uno, además de caracterizarse por un bajo contenido de sólidos totales disueltos, (inferior a 10000 mg/lts) típico en esta clase de aguas. Sulin manifiesta que las aguas tipo bicarbonato de sodio están por lo general asociadas con acumulaciones de hidrocarburos, así lo demuestran los resultados obtenidos en este estudio. Por otro lado, las aguas asociadas a los yacimientos estudiados tienen la particularidad de presentar mayores concentraciones de Na+ y HCO3-; especies dominantes en aguas que han estado en contacto con la superficie terrestre, resaltando que el tiempo del 109 CAPITULO IV. ANALISIS DE RESULTADOS último contacto con la atmósfera puede ser especificado al definir el agua meteórica como Reciente, del Pleistoceno o del Terciario. Los valores de índice de saturación obtenidos, indican una clara tendencia en los yacimientos a formar depósitos de carbonato de calcio, tal y como lo ha demostrado su comportamiento por las frecuentes acidificaciones y S O D A V R E S S RE O H C E R E D La resistividad en las aguas formacionales del Flanco Oeste, presenta limpiezas que son necesarias para eliminar la formación de escamas. valores variables. Para C7-SVS0005, cuya concentración de sólidos totales disueltos es 7660 mg/lL presenta la resistividad más alta, Rw=2.62 Ωm, mientras que el Cretáceo, SVS-0078, presenta el valor más bajo, Rw=0.09 Ωm con una concentración de sólidos totales disueltos de 76079 mg/lts, lo cual resulta completamente lógico, ya que la resistividad es un medida de la resistencia al paso de la corriente eléctrica, es decir, es una función directa de la velocidad relativa con la cual se mueven sus diferentes constituyentes, razón por la cual, para aquellas aguas cuya concentración de sólidos es baja la resistividad es alta y viceversa. 110 CONCLUSIONES CONCLUSIONES 1. Se logró obtener un patrón característico para los yacimientos, C6S/MSVS0013, C6I-SVS0012, C5-SVS0014, C7-SVS005 y PIA-69 pertenecientes al Flanco Oeste de la Segregación LAGOMEDIO, los cuales S O D A V R E S S RE O H C E R E Bojarski.D están representados gráficamente mediante el Diagrama de Stiff, Piper y 2. Se determinó el índice de saturación de Stiff y Davis -2.98, en las muestras correspondientes a la Planta de inyección de agua en la descarga y sus respectivos pozos inyectores, da negativo lo cual quiere decir que estas agua son de carácter corrosivo mas no incrustante. 3. Se caracterizó areal y verticalmente el agua de formación de los yacimientos estudiados, evidenciándose cambios en la composición de las aguas en toda la extensión de los yacimientos. La concentración de iones varía en los yacimientos, ya sea por el incremento de la profundidad o como consecuencia de los diferentes ambientes de depositación existentes a lo largo del mismo. 4. Sobre la base teórica de la metodología de clasificación de las aguas según Sulin, Bojarski y Schoeller, se logró clasificar las aguas de formación de los yacimientos estudiados como aguas meteóricas del tipo Bicarbonato de Sodio. Las aguas de formación de los yacimientos estudiados en el Flanco Oeste de la Segregación Lagomedio tienen tendencia a formar depósitos de Carbonato de Calcio. CONCLUSIONES 5. Las resistividades determinadas en los yacimientos oscilan entre 2.62 y 0.09 6. Se determinó la importancia de la toma de la muestra de agua de formación e inyección, la cual es la característica fundamental para unos resultados S O D A V R E S S RE analizados. O H C E R E D confiables, muestras tomadas por mas de 24 horas no pueden ser 7. Se determinó valores similares entre los patrones obtenidos y los ya existentes. RECOMENDACIONES RECOMENDACIONES 1. Implementar los requerimientos y normas internacionales para la correcta toma, manipulación y preservación de muestras para análisis físico-químicos ya que estos representan criterios fundamentales para arrojar resultados confiables. 2. Realizar análisis en sitio, específicamente la determinación de valores S O D A V R E S S RE O H C E R E que D al entrar en contacto con el oxígeno se producen alteraciones en la de pH, alcalinidad y temperatura, estos requieren análisis inmediatos ya muestra. 3. Determinar el constituyente Sodio (Na+K) a través del método Espectrofotometría de llama, para calcular el valor real presente en la muestra. 4. Continuar con la metodología empleada, para lograr una caracterización de aguas de formación e inyección adecuada. 5. Aplicar la caracterización por áreas para la generación de patrones en yacimientos que abarquen grandes extensiones. Debido a que se observó variaciones a lo largo y ancho del mismo, para obtener así un patrón específico por área con mayor exactitud en el comportamiento del agua de formación 6. Realizar Análisis Físico-Químicos con mayor continuidad a la PIA-69 tanto en la succión como en la descarga para detectar el tratamiento indicado a la misma y eliminar problemas de corrosión en pozos inyectores. RECOMENDACIONES 7. Determinar un inhibidor de corrosión eficiente para eliminar los problemas de corrosión en los pozos inyectores y la planta PIA 69. 8. Realizar un estudio de factibilidad para aplicar tecnologías que permitan minimizar la producción de agua en los yacimientos estudiados (geles, hidrociclones, cono invertido, inyección de agua de formación), etc. S O D A V R E S S RE O H C E R E D BIBLIOGRAFIA 1. Developments in Petroleum Science 1, Geochemistry Oilfield Waters A. Gene Collins. Elsevier Scientific Publishing Company, 1975. 2. Standard Methods for the Examination of Water and Wastewater 14 Edition. APHA. 1975. S O D A V R E S S RE O H C E R E D 3. Applied Water Technology. Charles, Patton. Campbell Petroleu Series 1986. 4. Quimica del Agua, Jose Catalan La Fuente. Editorial Blume 1969. 5. Log Interpretation Charts. Western Atlas Wireline Services 1998. 6. Recommended Practice for Análisis of oilfield Waters. American Petroleum Institute, Tercera Edición, Agosto 1998 7. Standard Test Methods for Electrical Conductivity and Resistivity of Water. ASTM D1125-95. American Standard Test Methods ,reaprobado. 2005 8. Alvarez, N. y Ferrer, L. “Caracterización de aguas de formación de las áreas VLA-11/12, VLA-62 del Blogue I del Lago de Maracaibo.” Tesis especial de grado.Universidad del Zulia. Facultad de Ingeniería. Escuela de 9. Arzola, Emir y Zambrano, Adriana.” Caracterización de las aguas de formación en el Eoceno C-Inferiror, Blogue III, Lago de Maracaibo.Maraven S.A. Agosto de 1996. 10. Heredia, M y Padilla, M. “ Caracterización de aguas de formación en el campo Ceuta.” Tesis especial de grado. Universidad del Zulia. Facultad de Ingeniería. Escuela de Petróleo. Maracaibo, Diciembre de 1990. 11. Martinez, Mirna. “ Caracterización de aguas de formación aplicadas al Blogue III y IV del Lago de Maracaibo.” Maracaibo, Diciembre de 1989. S O D A V R E S S RE O H C E R E D 12. Montgomery, D. y Runger, G. “Probabilidad y estadistica aplicada a la ingenieria” Primera Edición en Español. 13. Queipo, Ramón. “Clasificación y caracterización de las aguas de formación Aplicaciones prácticas” Tesis especial de grado. Universidad del Zulia Facultad de Ingenieria. Escuela de Petróleo. Maracaibo, Octubre de 1990. 14. Rivas, Cenobio.“Caracterización de las aguas de formación del área VLA6/8 del Bloque I del Lago de Maracaibo”. Tesis especial de grado. Universidad del Zulia. Facultad de Ingenieria. Escuela de Petróleo. Maracaibo, Septiembre de 1994. ANEXO B REQUERIMIENTOS PARA LA TOMA DE MUESTRAS REPRESENTATIVAS La toma de una muestra de agua, es el primer paso para obtener una buena caracterización de la misma. De allí la importancia de que las muestras y el posterior análisis físico-químico, cumplan con una serie de requisitos y precauciones en el momento de la toma, con el objeto de garantizar que las muestras sean representativas O D A V R E S E ECHOS R para un estudio de caracterización. DER S Entonces, previo a la toma de las muestras es necesario tomar en cuenta algunos aspectos como: 9 No debe realizarse toma de muestras de aguas inmediatamente después de una reparación, estimulación o acidificación. 9 Al momento de estar realizándose la circulación del lodo de perforación, esperar que la columna hidrostática se estabilice. Se recomienda circular y esperar para asegurar que sea agua de formación. 9 Los envases: a. Deben ser de material químicamente inerte, de plástico o de vidrio. b. Deben estar perfectamente limpios, sin grasas, aceites, perfumes, hidrocarburos, jabones, detergentes u otros. c. Deben llenarse hasta el tope, con ninguna o mínima cámara de aire. 9 La muestra: a. Debe ser envasada lo más rápido posible con el mínimo de aireación. b. Debe ser remitida al laboratorio y analizada al mínimo tiempo posible. Los análisis físico-químicos deben presentar la siguiente información: 1. Nombre del pozo y ubicación. 2. Fecha de muestreo. 3. Fecha de análisis. 4. Composición química del agua de formación: Na+, Ca++, Mg++, Cl-, SO4=, HCO3-, CO3=. En mg/lt y mili-equiv/lt. 5. Reportar los parámetros físicos: pH, alcalinidad total, dureza carbonática, no carbonática y total, resistividad del agua, índice de Langelier o incrustante, concentración total de sólidos disueltos y temperatura. DER O D A V R E S E ECHOS R S ANEXO C DESCRIPCIÓN DE LOS ANÁLISIS MÁS COMUNES EFECTUADOS AL AGUA DE CAMPOS PETROLEROS - pH Indica el grado de acidez o alcalinidad de una determinada muestra. Es un OS D A V R E S E concentración de iones hidronio (expresado S R en mol/L). En esta escala 7,00 es neutro, O H C E R E D por debajo es ácido y por encima alcalino. Su medición se efectúa mediante técnicas número comprendido entre 0 y 14 y representa el inverso del logaritmo natural de la potenciométricas con electrodos de vidrio. La solubilidad del carbonato de calcio y los compuestos de hierro están directamente influenciados por el pH; pH alto aumenta la tendencia incrustante y al bajar disminuye, pero se incrementa el potencial corrosivo. Generalmente las aguas de formación e inyección tienen pH entre 5,5 y 8,5. Los gases como el CO2 y H2S, bajan el pH al estar disueltos en el agua por presentar una ionización parcial que genera ácido. Su presencia origina que el pH cambie rápidamente después de tomar la muestra de un sistema presurizado. Por esta razón es necesario tomar las medidas de pH (cuando sea operacionalmente posible) inmediatamente después de la captación para obtener valores representativos de las condiciones del sistema. - Alcalinidad Se define como la concentración de bases titulables. Se debe a la presencia de minerales que contengan iones carbonatos (CO3=), bicarbonatos (HCO3-) e hidróxidos (OH-). Puede determinarse la alcalinidad parcial o fenolftaleínica en la cual la muestra se valora con ácidos normalizados potenciométricamente o con indicadores hasta un pH de 8,3, en el cual se consumen todos los hidróxidos y la mitad de los carbonatos. La alcalinidad total o metílica se valora hasta un pH de 4,3 y en esta se consumen todos los compuestos alcalinos. La concentración de carbonatos y bicarbonatos es determinada mediante fórmulas que relacionan ambas alcalinidades. Es necesario conocer la concentración de estos iones porque reaccionan con los cationes divalentes para formar incrustaciones. - Sodio (Na+) Es uno de los mayores constituyentes del agua de formación e inyección. Normalmente no causa problemas, excepto por la precipitación de cloruro de sodio S (NaCl) que puede presentarse en salmueras muy concentradas. Su determinación O D A V R E S E ECHOS R cuantitativa puede ser efectuada por técnicas de espectroscopía tales como la DER absorción y emisión atómica, y puede estimarse mediante la diferencia estequiométrica producto del balance iónico total de cationes y aniones en el agua. - Calcio (Ca++) y Magnesio (Mg++) El calcio es uno de los cationes que generalmente está en mayor cantidad en las aguas saladas asociadas al crudo (en menor proporción que el sodio), y su determinación es importante porque al combinarse con los iones bicarbonatos, carbonatos y sulfatos, puede formar escamas que se adhieren, o sólidos suspendidos. El ión magnesio está presente en menor concentración que el calcio en las aguas de formación. Tienden a aumentar la cantidad de incrustaciones de CaCO3 por coprecipitación con el ión calcio, y disminuir la tendencia de producir escamas de sulfato de calcio. En el agua del lago, esta relación se encuentra invertida, es decir, presenta una mayor cantidad del ión magnesio que de calcio. Puede analizarse en laboratorio mediante titulación con EDTA, con unos ensayos conocidos como dureza parcial (cantidad de calcio presente expresado como carbonato de calcio) y dureza total (suma del calcio y magnesio expresados como CaCO3), y también mediante técnicas de espectroscopía de absorción y emisión atómica. Cuando los análisis son efectuados mediante la titulación, los iones disueltos son los que intervienen en la reacción. Al efectuar el análisis por espectroscopía pueden determinarse los iones totales, disueltos y en suspensión. - Hierro (Fe++ y Fe+++) El contenido natural del hierro en el agua de formación y agua del Lago de Maracaibo, es por lo general muy bajo. Por esta razón puede usarse para monitorear el efecto de la corrosión en los sistemas que manejan estas aguas. La presencia de iones de hierro puede originar compuestos insolubles que ocasionen taponamiento de los pozos inyectores de agua, válvulas, tuberías, etc. Su determinación se efectúa mediante técnicas colorimétricas y de espectroscopía de absorción atómica. Para tomar muestras de agua en sistemas donde se sospeche la existencia de óxidos de hierro, OS D A V R E S E para evitar la precipitación de estos y obtener valores representativos en R Scompuestos O H C E R E los análisis. D debe aplicarse una baja cantidad de ácido (clorhídrico o nítrico) al momento de la toma, - Bario (Ba++)y Estroncio (Sr++) La importancia de determinar el ión bario se basa en que al combinarse con sulfato, forma compuestos que son altamente insolubles y que pueden ocasionar problemas severos aun estando en pequeñas cantidades. El estroncio al igual que el bario, forma precipitados con el sulfato. Los análisis pueden hacerse mediante espectroscopía de absorción atómica. - Cloruro (Cl-) Es el anión que está en mayor proporción en aguas saladas y aguas frescas (por ejemplo agua del Lago de Maracaibo). El compuesto que más aporta este ión es el cloruro de sodio (NaCl). Su concentración es usada para medir la salinidad del agua. El principal problema asociado con el cloruro es que aumenta el potencial corrosivo del agua. Es uno de los constituyentes más estables en el agua. Puede determinarse mediante titulación con nitrato de plata o nitrato mercúrico. - Sulfato (SO4=) Este ión produce incrustaciones cuando se combina con calcio, bario y estroncio. Adicionalmente sirve como insumo para las bacterias sulfato – reductoras (BSR), que producen corrosión en el sistema. Su cuantificación puede efectuarse mediante turbidimetría o gravimetría por precipitación como sulfato de bario. - Población de bacterias Las bacterias determinadas en el agua con mayor frecuencia, son las sulfato – reductoras (BSR), por los problemas de corrosión y taponamiento (en pozos inyectores) que pueden producir. En ambientes anaeróbicos (con muy poco oxígeno), y con baja velocidad de fluido, estas bacterias se depositan sobre la superficie de la tubería, OySproduce corrosión D A V R E S E R Sconcentración O anódica por efectos por celdas de de diferente potencial. Se pueden H C E R E D estimar su presencia en el agua (colonias/mL) mediante la incubación en medios de produciendo sulfuro de hidrógeno (H2S) que ataca el metal, cultivo. - Turbiedad Es un parámetro cualitativo empleado para medir la calidad del agua, y relaciona que tan “limpia” está el agua de materias insolubles tales como: sólidos suspendidos, aceite o crudo disperso y burbujas de aire. Ayuda a establecer la posibilidad del taponamiento en los pozos inyectores y determinar la eficiencia de los filtros en las Plantas de Inyección de Agua. Se expresa generalmente en Unidades Nefelométricas de Turbiedad (NTU) y su determinación se hace en un turbidímetro que mide la disminución de la intensidad de un haz de luz al pasar por la muestra de agua. - Sólidos Suspendidos (TSS) La cantidad de sólidos suspendidos se mide por el peso de materia retenida en un filtro de 0,45 μm de porosidad cuando se pasa una cantidad conocida de agua a través de la membrana. Representan la base para determinar la tendencia para taponar o causar daño a la formación en pozos inyectores. Es un indicador de la eficiencia de los sistemas de filtración. Los estudios iniciales del efecto del agua de inyección sobre las rocas del yacimiento, deben estar acompañados de la distribución del diámetro de partículas suspendidas permisibles que no ocasionen daño a la formación (o sea mínimo). Para efectuar esta prueba en el laboratorio pueden emplearse membranas de filtración de porosidades distintas o equipos de conteo de partículas suspendidas. La calidad del agua es una medida del volumen de agua que puede pasar por una membrana de diámetro de poro determinado. Estas pruebas deben ser efectuadas continuamente en los sistemas de filtración, para conjuntamente con los ensayos antes OS D A V R E S E anticipación los ajustes necesarios en elR sistema de filtración. S O H C E R E D mencionados, estimar la tendencia a taponar los pozos inyectores y efectuar con - Oxígeno Disuelto (O2 disuelto) Aumenta significativamente la corrosividad del agua. Está ausente en las aguas de formación, pero está presente en el agua del Lago de Maracaibo en concentraciones de 7 a 8 ppm. El oxígeno disuelto puede en un sistema donde existan iones de hierro en estado ferroso, combinarse con éste para producir óxidos de hierro insolubles que causen taponamiento en los pozos inyectores. Adicionalmente, representa un insumo que genera el crecimiento de bacterias aeróbicas y otras especies marinas que pueden ocasionar problemas diversos en estos sistemas. Por estas razones, el oxígeno disuelto es eliminado en las Plantas de Inyección de Agua mediante tratamientos químicos y mecánicos. Su determinación debe efectuarse en campo al momento de la toma de la muestra, y es común emplearse kits con ampollas de determinación directa, que mediante desarrollo de color indican la concentración del oxígeno en el agua. - Dióxido de Carbono Disuelto (CO2 disuelto) y Sulfuro de Hidrógeno (H2S) El CO2 influencia el pH del agua, aumenta la corrosividad y altera la tendencia de producir escamas de carbonato de calcio; en varias partes del sistema es el responsable de mantenerlo en solución. Está presente en el agua de formación y ausente en el agua de inyección El H2S aumenta el potencial corrosivo del agua. Cuando esta en el agua, se presenta como una mezcla de iones ácidos de hidrógeno (HS-) y gas H2S disuelto, y al medirse se reporta como “sulfuro total”. Puede estar presente en agua en forma natural, o añadido por generación bacteriana. Este compuesto reacciona con el hierro y produce sulfuro ferroso, que puede comportarse como un agente de taponamiento efectivo en los pozos inyectores. Deben ser determinados en campo inmediatamente después de captar la muestra y pueden usarse kits de determinación directa. - OS D A V R E S E R en el agua por unidad de volumen. Puede Sdisuelta O Es la cantidad total deH materia C E R E D Sólidos Totales Disueltos (TDS) ser determinada mediante la suma de todos los iones presentes en el agua (cationes y aniones), o pueden analizarse en laboratorio evaporando una cantidad medida de muestra filtrada y pesando el residuo. Los sólidos disueltos modifican la fuerza iónica del agua y por lo tanto alteran su tendencia incrustante. La conductividad y la resistividad son un factor de los sólidos disueltos; a medida que aumentan los TDS aumenta la conductividad y disminuye la resistividad, y viceversa. - Gravedad Específica (γ) Es un factor adimensional que relaciona la densidad de la muestra con la del agua pura a la misma temperatura, como lo indica la siguiente ecuación: Densidad de la muestra de agua Gravedad Específica = Densidad del agua pura La gravedad específica es una función de la temperatura, y es un indicador de la cantidad de sólidos disueltos en el agua. Este dato puede emplearse para estimar los TDS, verificar la precisión de los análisis de laboratorio y sirve de insumo para algunos programas que calculan el índice de Stiff. - Resistividad (Rw) y Conductividad La resistividad es una medida de la resistencia que ofrece el agua al flujo de corriente eléctrica. Es determinada por la cantidad de sólidos disueltos presentes en el agua y la temperatura. En aguas frescas de baja concentración de sales, puede emplearse la resistividad para estimar la cantidad de TDS y en este sentido es mucho OS D A V R E S E S yR O importancia en el áreaE deC perforación yacimientos. La unidad más empleada es ohm . H R E D m. más sensible que la gravedad específica. Rw es un parámetro petrofísico de mucha La conductividad es el reciproco de la resistividad, y puede ser calculada con la siguiente fórmula: 10000 Conductividad (μmho/cm) = Rw (ohm . m) - Sílice (SiO2) Cantidades más altas que la normal, indican el posible arenamiento en pozos productores. Generalmente no se presentan problemas por sílice en las operaciones de inyección de agua. Los mayores inconvenientes suceden en sistemas de calentamiento o enfriamiento de agua, en los cuales se depositan incrustaciones de este mineral. Se determina en laboratorio mediante técnicas colorimétricas. - Contenido de Aceite o Crudo La presencia de emulsiones o dispersiones de crudo en agua representan un problema cuando se intenta reinyectar aguas de producción. Puede causar problemas de emulsiones o de taponamiento de los poros del yacimiento, y ocasionar daño a la formación, disminuyendo la inyectividad de los pozos. La disposición del agua desechada de la deshidratación del crudo, esta sujeta a regulaciones del Ministerio de Energía y Petróleo y del Ministerio de Ambiente y Recursos Naturales Renovables , que especifican un contenido máximo de crudo en el agua. DER O D A V R E S E ECHOS R S A continuación se muestra un cuadro resumen con los análisis y los tipos de técnicas que pueden ser empleados en campo y laboratorio: RESUMEN DE LOS MÉTODOS ANÁLÍTICOS. DETERMINACIONES TÉCNICAS DE ANÁLISIS Sodio. Cálculos, espectroscopía, gravimetría. Calcio. Titulación, gravimetría, espectroscopía. Magnesio. Titulación, gravimetría, espectroscopía. OS D A Colorimetría, espectroscopía, V R E S E ECHOS R Hierro. DER titulación. Bario. Turbidimetría, espectroscopía. Estroncio. Espectroscopía. Cloruro. Titulación. Sulfato. Titulación, gravimetría. Bicarbonato. Titulación. Carbonato. Titulación. pH. pHmetro, colorimetría, papel de pH. Población de bacterias sulfato- Cultivos, microscopía. reductoras. Concentración de sólidos suspendidos. Gravimetría. Tamaño de partículas. Coulter Counter, Marvel, microscopía. Composición de sólidos suspendidos. Análisis químicos. Turbiedad. Turbidimetría. Calidad de agua. Pruebas con membranas de filtración. Oxígeno disuelto. Colorimetría, medidor de oxígeno, titulación. Dióxido de carbono. Colorimetría, titulación. Sulfuro Total. Prueba del Alkaseltzer, colorimetría, titulación. Contenido de crudo. Colorimetría, espectroscopía, gravimetría. Temperatura. Termómetro. Sólidos Totales Disueltos (TDS). Cálculos, gravimetría, conductividad. O D A V R E S E ECHOS R S Gravedad específica Hidrómetro, pignómetro. Resistividad ER D Celda de resistividad, cálculos. Sílice Gravimetría, colorimetría, espectroscopía.