P04EPAr30
Anuncio

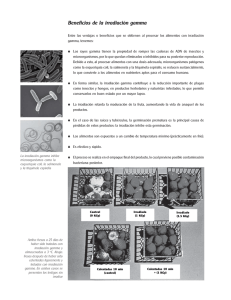
VALIDACIÓN DEL PROCESO DE RADIOESTERILIZACIÓN A.Docters, E.Bof, C. Horak, S.E.Pawlak, E.Kairiyama, M.E.González, Centro Atómico Ezeiza Comisión Nacional de Energía Atómica EL PROCESO DE RADIOESTERILIZACIÓN VENTAJAS DEL PROCESO POR RADIACIONES • Los productos pueden ser tratados en su embalaje final evitando riesgo de recontaminación posterior. • Se pueden utilizar de inmediato sin necesidad de tratamientos post esterilización. • Se puede aplicar a productos termosensibles porque no hay aumento significativo de la temperatura de los productos. • Es una tecnología que no contamina el medioambiente • Es de costo competitivo respecto a métodos alternativos. • Es aplicable a productos a granel. • El proceso es de alta confiabilidad. Se emplea siempre en instalaciones con alto nivel de seguridad y personal capacitado. INSTALACIONES NECESARIAS l l l l l l l Fuente de radiación (60Co, 137Cs, aceleradores de electrones, Rx) Recinto de irradiación con blindaje adecuado Sistema de transporte de producto Depósito diferenciado para productos irradiados y no irradiados Sistemas auxiliares Sistemas de seguridad y control Sistema de control de proceso ETAPAS DEL PROCESO • • • • • • • • Recepción del producto Almacenaje del producto sin irradiar Preparación y carga del producto Irradiación Extracción del producto irradiado Verificación de dosis Almacenaje del producto irradiado Despacho del producto Registros VALIDACIÓN Programa documentado que provee un alto grado de seguridad de que un proceso específico producirá en forma consistente un producto que cumple con los atributos de calidad y especificaciones predeterminadas • La validación del proceso de esterilización es parte del proceso de fabricación de un producto bajo los requerimientos de las Buenas Prácticas de Fabricación. El fabricante debe incluir el proceso de esterilización en su programa del proceso de producción del producto médico estéril. • En la validación del proceso de esterilización la norma ISO 11137:1995 para Esterilización de productos para el cuidado de la salud – Requerimientos para validación y control de rutina – Esterilización por radiación, incluye los siguientes elementos: • a) Calificación del producto realizada en una instalación de irradiación calificada • b) Calificación de la instalación • c) Calificación del proceso usando el producto especificado o simulado, en la instalación calificada • d) Procedimiento de certificación administrativa para revisar y aprobar la documentación de los puntos a), b) y c) • e)Actividades relacionadas el mantenimiento de la validación ESQUEMA DE VALIDACIÓN (ISO 11137:95) CALIFICACION DEL PRODUCTO Dosis máxima Dosis de esterilización CALIFICACIÓN DE LA INSTALACIÓN Documentación Ensayo Calibración Mapeo de dosis CALIFICACIÓN DEL PROCESO Esquema de carga del producto Mapeo de dosis del producto CERTIFICACIÓN Acumulación de documentación Revisión y aprobación MANTENIMIENTO DE LA VALIDACIÓN Programa de calibración Recalificación del irradiador Auditoría de dosis de esterilización CALIFICACIÓN DEL PRODUCTO DETERMINACIÓN DE LA DOSIS MÁXIMA • La necesidad de establecer la compatibilidad de los materiales con el tratamiento está contemplada en la legislación nacional vigente para dispositivos médicos (Res.255/94) y también en la norma ISO 11137:95 dedicada a la radioesterilización de productos para la atención de la salud que en su Anexo A provee lineamientos para la determinación de la compatibilidad de los materiales de envases y productos con la radiación. La norma ISO 11607:97 se dedica a los envases para dispositivos médicos esterilizados en su envase final y la AAMI/TIR 17 provee una guía para la calificación de materiales de productos a ser esterilizados por radiación. • Algunos materiales son naturalmente menos afectados por la radiación que otros pero la estabilidad bajo radiación de un dispositivo médico depende tanto del material como del diseño. • Por esto es necesario llevar a cabo un programa que demuestre la estabilidad funcional del dispositivo irradiado a lo largo de su vida útil. • Los ensayos para la selección de los materiales deben incluir cualquier propiedad específica esencial para la función prevista para el producto, como p.ej. color, claridad, integridad de envase, biocompatibilidad. • El programa deberá considerar todas las variaciones en los procesos de fabricación, tolerancias, dosis de radiación, fuentes de radiación, materias primas y condiciones de almacenamiento. • Basándose en estas consideraciones se especificará la máxima dosis admisible por el producto. • Un protocolo típico puede requerir la irradiación de dispositivos o muestras de material con niveles de dosis variados entre 10 y 100 kGy. En cualquier caso, la mínima dosis a aplicar a las muestras debe ser al menos tan alta como la máxima dosis que recibiría el producto, estimada tomando en cuenta la dosis esterilizante y el factor homogeneidad de dosis de la instalación. La irradiación de muestras se realizará en una instalación calificada. • El programa puede incluir envejecimiento acelerado para una indicación inicial de compatibilidad de los materiales, pero esto no puede sustituir el estudio de la estabilidad a tiempo real. En todos los casos se debe conservar material no irradiado como control. • Una vez que se ha seleccionado un material se llevará a cabo la calificación final para demostrar la estabilidad funcional del producto, sobre el producto completo o sus componentes. En este último caso se demostrará también que los componentes son compatibles entre sí. • Algunos materiales pueden requerir además el ensayo de biocompatiblidad dado que cambios en la estructura química del polímero podrían alterar la biocompatibilidad del material para aplicación como producto médico. El ensayo debe demostrar también la biocompatibilidad a lo largo de la vida útil prevista del producto. • La norma ISO 10993-1 Biological testing of medical and dental devices, Part 1: Guidance on the selectoin of tests provee una descripción de ensayos que pueden utilizarse para predecir la seguridad de materiales irradiados para uso en productos médicos. De acuerdo con el uso final del producto podrían requerirse ensayos específicos. • La evaluación de la compatibilidad de los materiales y la consiguiente determinación de la dosis máxima admisible por el producto deben realizarse cada vez que se verifiquen cambios en el proceso de fabricación y/o en las materias primas. • Debe conservarse la documentación correspondiente a los ensayos realizados. ENSAYOS PARA EVALUACIÓN DE MATERIALES • PROPIEDADES DE TRACCIÓN ISO/R 527 – Resistencia a la tracción – Elongación última – Módulo de elasticidad – Trabajo • PROPIEDADES DE FLEXIÓN • DUREZA – Shore – Rockwell ISO 178 ISO 868 ISO 2039 • RESISTENCIA AL IMPACTO ISO 180 • RESISTENCIA A LA COMPRESIÓN ISO 604 • RESISTENCIA AL RASGADO ISO 34 TRACCIÓN Y FLEXIÓN DETERMINACIÓN DE LA DOSIS MÍNIMA (DOSIS ESTERILIZANTE) • En la Resol. Nº 255/94 del Ministerio de salud y Acción Social – Normas sobre productos biomédicos estériles establece, en su Anexo V, las condiciones para los procedimientos de esterilización. Para cumplimentar con los requerimientos que establece esta norma en lo que respecta a asegurar que un producto alcance un coeficiente de seguridad de esterilidad 1/1 millón, se debe determinar la dosis mínima del proceso de esterilización para alcanzar tal objetivo. Para ello se debe recurrir a métodos confiables. • Los métodos confiables de determinación de la dosis de esterilización derivan de la inactivación de la población microbiana del producto en su estado natural cuando es expuesta a la irradiación. Se basan en el modelo probabilístico para la inactivación de poblaciones microbianas. En este modelo aplicado a una población de contaminantes del producto, constituida por una mezcla de varias especies microbianas, se asume que cada una de tales especies tiene su único valor de D10. • En este modelo, la probabilidad de que un producto en particular sea estéril (es decir que alcance el coeficiente de seguridad de esterilidad de 10-6) después de haberse expuesto a una dada dosis de irradiación, está definida en términos del número inicial de microorganismos de la unidad de producto previa a la irradiación y de sus valores de D10. CURVAS DE INACTIVACIÓN N = N0 10-kD (a Donde: N0: número inicial de microorganismos D: dosis absorbida 100 Log N = log N 0 D10 = 1/k N: número de organismos sobrevivientes a la dosis D 75 k: constante propia para cada tipo de organismo y condición de irradiación. 50 25 0 0 1 2 4 6 10 14 16 20 25Dosis (kGy) k D, Donde k = 1/D 10 8 6 Log Nº de organismos sobrevivientes Número de sobrevivientes Ecuación de la curva: 4 Dosis subesterilizante 2 0 Dosis (kGy) -2 -4 -6 -8 Dosis esterilizante D10 MÉTODOS AAMI/ISO 11137:1995 Anexo B Método 1: se basa en la verificación experimental de la respuesta de la microflora del producto a la radiación, si es igual o menor que la distribución standard de resistencias (W/G, 1979) mediante ensayos de esterilidad de muestras irradiadas para un CSE de 10-2 p. ej., siendo la expectativa de 1 ensayo no estéril de 100 muestras analizadas. Similares curvas pueden generarse para otros niveles de carga microbiana inicial. (Tabla B1 – B). Se debe determinar la dosis de 3 lotes fabricados consecutivamente. Método 2 : se estima el valor D10 a partir de la población natural del producto. También aquí se debe determinar la dosis con 3 lotes de producción consecutiva. • ISO 15844:1998: aplicable para la selección de dosis de un solo lote de producción. Este método es una adaptación del Método 1. • La dosis de 25 kGy, tradicionalmente considerada como dosis mínima del tratamiento de esterilización, no asevera racionalmente que el producto tratado haya recibido la efectiva dosis de esterilización. • ANSI/AAMI 32 – 1991: Método 3 de verificación de la dosis de 25 kGy como una dosis de esterilización • ISO/TR 13409:1996 ( informe técnico): convalidación de la dosis de 25 kGy como dosis de esterilización. Aplicable para lotes pequeños de producción o de producción infrecuente. • AAMI/TIR 27: 2001(informe técnico): convalidación de la dosis de 25 kGy como dosis de esterilización-Método VDmax. Se basa en el Método 1 – ISO 11137 REQUERIMIENTOS TÉCNICOS BÁSICOS • El producto médico específico a esterilizar debe estar fabricado bajo las Buenas Prácticas de Fabricación de Productos Médicos, para asegurar una producción uniforme y controlada del mismo. • Acceso a los servicios de un laboratorio de microbiología competente • Los ensayos microbiológicos para la determinación de la carga microbiana del producto y los de esterilidad, como parte de estos métodos, deberán ser realizados de acuerdo a las normas ISO 11737 – 1:1995 y 2:1999 respectivamente. • Acceso a instalaciones o equipos que entreguen dosis desde 1 kGy, pudiendo ser (Resol. 255/94): • - Fuentes de radiación de 60Co ó 137Cs • - Irradiadores de haces de electrones o rayos-X. • Los niveles energía y tasa de dosis de estos equipos deben ser similares a los usados en el proceso de esterilización del producto. AUDITORÍA DE DOSIS ESTERILIZANTE • La auditoria de la dosis se realiza periódicamente para confirmar la dosis de esterilización establecida para un producto médico específico. • Para producciones regulares, se realiza una auditoria a intervalos de cada 3 meses con el objeto de detectar cambios cualitativos o cuantitativos de la carga microbiana que pudieran requerir un incremento de la dosis de esterilización. • Cuando se introducen cambios en el proceso de producción se debe determinar la dosis de esterilización nuevamente CALIFICACIÓN DE LA INSTALACIÓN • Documentación de la Planta (especificaciones, características y descripción del irradiador, del sistema de transporte, procedimientos de operación, modificaciones realizadas, etc.). • Definición de los parámetros críticos del proceso : Para plantas gamma los parámetros críticos son el tiempo de exposición, tiempo por posición, velocidad del sistema de transporte, temporizadores y mediciones de dosis. En instalaciones con aceleradores de electrones y rayos X, los parámetros deben incluir las características del acelerador (corriente promedio, energía de los electrones, ancho de barrido), velocidad del sistema de transporte y mediciones de dosis. • Plan y manual de Mantenimiento Anual, programa de pruebas periódicas para verificar el correcto funcionamiento de la fuente de radiación, sistema de transporte, de seguridad y control, auxiliares, etc. • Plan de calibración para asegurar que los equipos y sistema dosimétricos son trazables a estándares nacionales. Para plantas gamma incluye los temporizadores, velocidad del sistema de transporte, equipo de pesaje y el sistema dosimétrico. En instalaciones con aceleradores de electrones y rayos X, se incluye la calibración de las características de la máquina generadora, velocidad del sistema de transporte, equipo de pesaje y el sistema dosimétrico • Mapeo de Dosis del Irradiador: se realiza para caracterizar al irradiador en lo que respecta a la magnitud, distribución y reproducibilidad de la dosis entregada. Para plantas gamma y de rayos X se realizan mapeos de dosis en aire y con producto simulado Es necesario recalificar la instalación periódicamente y luego de tareas de mantenimiento a sistemas con incidencia en los parámetros. CALIFICACIÓN DEL PROCESO • La calificación del proceso utiliza producto para demostrar que el irradiador opera de acuerdo a criterios predeterminados y que el resultado del proceso satisface los requisitos especificados. Para realizar este paso es necesario conocer previamente las características del producto y rango de dosis especificados por el cliente (de acuerdo a los resultados de la Calificación del Producto). DETERMINACIÓN DEL PATRÓN DE CARGA Se debe establecer el patrón de carga para cada tipo de producto. La especificación del mismo debe documentar: En plantas gamma y de rayos X: • Descripción del producto en su embalaje y su orientación dentro del mismo, incluyendo dimensiones, peso y densidad, y variaciones aceptables de ésta última • Descripción de la disposición de los bultos en el dispositivo de irradiación • Descripción del dispositivo de irradiación y sus dimensiones En aceleradores de electrones: • Descripción del producto en su embalaje y su orientación dentro del mismo, incluyendo dimensiones, peso y densidad, y variaciones aceptables de ésta última • Orientación del producto respecto a la dirección del movimiento del sistema de transporte y el haz de electrones • Descripción de la disposición de los bultos en el dispositivo de irradiación • Descripción del dispositivo de irradiación y sus dimensiones MAPEO DE DOSIS EN EL PRODUCTO • Permite conocer la distribución de la dosis -para un tiempo determinado- en todo el volumen del producto para el patrón de carga establecido y asegurar la reproducibilidad del proceso. La información obtenida se utilizará posteriormente para determinar las posiciones de monitoreo de dosis en el proceso de rutina. • Para realizarlo, se distribuyen dosímetros en puntos estratégicos del volumen, que se eligen de acuerdo a antecedentes y en base a la posición relativa productofuente. P.I.S.I. MAPEO DE DOSIS ABSORBIDA Movimiento del Carro Irradiador: P.I.S.I. Dosis Solicitada: 15 kGy Dosímetros: Red Perspex Fecha: 09 / 05 / 2003 Tiempo/NºPosiciones (min): 6 Tiempo del Ciclo(min): 120 Producto: Bolsas Valvuladas Densidad (g/cm 3 ):0,1816 Co 60 Source Dosis Absorbida (kGy) Plano Frontal 1 E (85,5cm) 2 3 Plano Central 2 3 Plano Posterior 4 5 15,5 kGy 4 D* (60cm) 5 D (50,5cm) 24,4 kGy 1 5 85,5 cm 1 C (42,5cm) 23,3 kGy 5 1 B (34,5cm) 20,0 kGy 5 1 A (0 cm) Carro Nº: 1 Inferior 2 27 cm 3 4 44 cm Realizó:------------------------------Lic. Eva Pawlak 15,3 kGy Uniformidad de Dosis: 24,4 = 1,6 15,3 Observaciones: Tener precaución al manipular la caja donde se coloca el dosímetro en la posición mínima en plano A, porque se daña. Los máximos pueden estar en el plano D a 60 cm de la base de la caja . Realizó: ----------------------------- Controló:-------------------------Lic. Elba Bof Lic. Elba Bof RLDAD RLDAD P.I.S.I. MAPEO DE DOSIS ABSORBIDA Movimiento del Carro 2 3 Irradiador: P.I.S.I. Dosis Solicitada: 15 kGy Dosímetros: Red Perspex 4 Fecha: 09 / 05 / 2003 Tiempo/NºPosiciones (min): 6 Tiempo del Ciclo(min): 120 Producto: Bolsas Valvuladas Densidad (g/cm 3):0,1826 5 1 5 1 Co 60 Source 5 1 Dosis Absorbida (kGy) 5 1 Plano Frontal 1 3 2 3 Plano Posterior 4 5 15,2 kGy 16,2 kGy 15,5 kGy E (171cm) 2 Plano Central 4 85,5 cm D* (144cm) D (136cm) 18,9 kGy 24,3 kGy C (128cm) 22,4 kGy 25,7 kGy B (120cm) 23,8 kGy 23,9 kGy A (85,5 cm) 15,1 kGy 15,7 kGy 15,3 kGy Carro Nº: 8 Superior 27 cm 44 cm Realizó:------------------------------Lic. Eva Pawlak Uniformidad de Dosis: 25,7 = 1,7 15,1 Observaciones: Tener precaución al manipular la caja donde se coloca el dosímetro en la posición mínima en plano A, porque se daña. Los máximos pueden estar en el plano D a 60 cm de la base de la caja . Realizó: ----------------------------- Controló:-------------------------Lic. Elba Bof Lic. Elba Bof RLDAD • Se realiza para un número de dispositivos de irradiación representativo de la condición real de irradiaciónsuficientes para determinar la variación de la dosis absorbida entre los mismos. • Una vez finalizado el mapeo de dosis se evalúa si la uniformidad de dosis resultante es compatible con las especificaciones del proceso, o sea si para la dosis mínima solicitada por el cliente, la dosis máxima alcanzada es menor que la máxima admisible. En caso de no serlo se modifica el patrón de carga tomando como referencia los resultados del mapeo inicial y se verifica dicho patrón mediante un nuevo mapeo. Asimismo se deben realizar verificaciones posteriores en puntos estratégicos para garantizar la repetibilidad de los resultados obtenidos. Si los resultados son aceptados, se tomarán como referencia en las irradiaciones de rutina. • Del mapeo de dosis se obtiene la siguiente información: • Identificación de la posición de los puntos de dosis mínima y máxima • Relación de dosis entre posiciones de monitoreo de dosis de rutina y las de mínima y máxima • La velocidad de dosis en distintos puntos • La uniformidad de dosis (D máx / D mín) Se debe realizar un mapeo de dosis cuando: • Se altera el patrón de carga de un producto • Se procesan productos nuevos (diferentes características y/o densidad, empaques no convencionales) • Recalificaciones de proceso DOCUMENTACIÓN • La importancia de la documentación no sólo reside en que lo que no esta escrito NO ESTA HECHO, sino que, aparte de ser un requisito de los estándares ISO (11137-1995, 9001-2000): • Es la única evidencia de que el proceso ha sido seguro y efectivo. • La 1SO 11137-1995 manifiesta que “Para asegurar la reproducibilidad , la validación, los procedimientos de proceso y otros elementos que puedan influenciar el proceso de irradiación, las actividades deberán ser completamente documentadas”. • Ofrece la evidencia legal de que se siguieron todos los requisitos para el desarrollo del proceso. • Provee evidencia objetiva para la aceptabilidad, otorgando trazabilidad al proceso FABRICANTE Producto médico fabricado bajo las 2) BPF 1) Solicita irradiación de lote/s del producto especificando la dosis mínima y la máxima Selección de laboratorios Laboratorio de microbiología Laboratorio de ensayo de materiales/químico Irradiador e Muestreo y envío de muestras Documentos generados y entregados al fabricante Informe Dosis mínima de esterilización Informe Dosis máxima compatible Certificado de irradiación