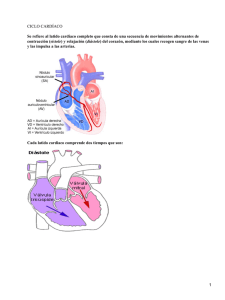
Monitorización hemodinámica invasiva: principios
Anuncio

Monitorización hemodinámica invasiva: principios fisiológicos y aplicaciones clínicas Edwards Grupo Cardiovascular Edwards Critical-Care Division Edwards Monitorización hemodinámica invasiva: principios fisiológicos y aplicaciones clínicas Autor : Jan M. Headley, RN, BS, CCRN Irvine, California Edwards Critical-Care División INDICE INTRODUCCION.............................................................................................................................. ANATOMIA FUNCIONAL............................................................................................................ Corazón derecho y corazón izquierdo....................................................................................... CICLO CARDIACO .......................................................................................................................... Sístole ............................................................................................................................................ Diástole.......................................................................................................................................... FISIOLOGIA CARDIACA APLICADA ........................................................................................ Gasto cardíaco.............................................................................................................................. Frecuencia cardíaca..................................................................................................................... Volumen sistólico......................................................................................................................... Ley de Frank-Starling .................................................................................................................. Precarga......................................................................................................................................... Poscarga........................................................................................................................................ Contractilidad ............................................................................................................................... Resumen........................................................................................................................................ CONSUMO MIOCARDICO DE OXIGENO................................................................................... BASE FISIOLOGICA DE LA MONITORIZACION DE LA PRESION EN ARTERIA PULMONAR............................................................................. TECNICAS DE INSERCION DEL CATETER DE SWAN-GANZ ....................................................................................................... Monitorización continua de la presión..................................................................................... GUIAS RESUMEN PARA LA UTILIZACION SEGURA DE LOS CATETERES DE ARTERIA PULMONAR CON BALON EN SU EXTREMO......................... DETERMINACIONES DEL GASTO CARDIACO Método de Fick............................................................................................................................ Método de dilución de un colorante indicador....................................................................... Método de termodilución ........................................................................................................... APLICACIONES CLINICAS........................................................................................................... Evaluación del rendimiento cardíaco........................................................................................ Significación de las mediciones hemodinámicas..................................................................... Mediciones directas .................................................................................................................... Parámetros derivados.................................................................................................................. UTILIZACION DEL CATETER DE SWAN-GANZ PARA EL DIAGNOSTICO DIFERENCIAL................................................................................... Situaciones de gasto bajo........................................................................................................... LIMITACIONES DE LA MONITORIZACION HEMODINAMICA ......................................... Volumen telediastólico frente a presión telediastólica ventricular izquierda...................... Complicaciones ............................................................................................................................ MONITORIZACION INTRAARTERIAL...................................................................................... Componentes del pulso arterial................................................................................................. Ondas arteriales en el diagnóstico diferencial......................................................................... RESUMEN.......................................................................................................................................... BIBLIOGRAFIA ................................................................................................................................ APENDICE I....................................................................................................................................... Parámetros hemodinámicos........................................................................................................ i INTRODUCCION Durante los últimos 25 años, la práctica de la medicina intensiva ha cambiado mucho, debido en parte a la formación de unidades especializadas de atención al paciente, a los avances tecnológicos y a un mejor conocimiento de la fisiología por parte de los profesionales sanitarios. Uno de los primeros avances tecnológicos que ayudó a impulsar este progreso fue el desarrollo, en el decenio de 1960, del catéter de Swan-Ganz. A principio del decenio de 1970, la adición de un termistor al catéter permitió la evaluación rápida del gasto cardíaco. Al mismo tiempo se desarrollaron sistemas de monitorización más sofisticados. En consecuencia, se pudieron llevar a cabo evaluaciones hemodinámicas más completas y con relativa facilidad a la cabecera del paciente. El avance tecnológico conlleva la necesidad de avances en la formación clínica. El médico intensivista debe mejorar su formación para aumentar su eficacia. El objetivo de este folleto es proporcionar al médico un amplio conocimiento de los principios hemodinámicos básicos. El libro está dividido en secciones en las que se comentan los diversos componentes de la monitorización hemodinámica, a saber : anatomía funcional y fisiología cardíaca aplicada, bases fisiológicas de la monitorización hemodinámica, determinaciones del gasto cardíaco y aplicaciones clínicas. Se puede leer en su totalidad o cada sección por separado, como una entidad independiente. 1 ANATOMIA FUNCIONAL Corazón derecho y corazón izquierdo En esta sección se revisan la anatomía funcional cardíaca y la fisiología aplicada. Estos conceptos constituyen la base de la monitorización hemodinámica. Al comentar la anatomía funcional del corazón en lo que respecta a la monitorización hemodinámica, el corazón se describe como dos bombas independientes. Cada lado, o bomba, posee su propia función y su propia producción de presión. Por esta razón se utilizan los términos corazón derecho y corazón izquierdo. El corazón derecho está constituido por la aurícula derecha y el ventrículo derecho, que actúan como una unidad. Su principal función es recibir sangre venosa no oxigenada en la aurícula derecha. Desde ahí, el ventrículo derecho sólo necesita generar una mínima presión para bombear la sangre a través de la válvula pulmonar hacia la circulación pulmonar. Es por ello que el corazón derecho está considerado como un sistema de baja presión. El corazón izquierdo es una unidad similar que recibe sangre oxigenada del sistema pulmonar. Está considerado como un sistema de alta presión, ya que el ventrículo izquierdo necesita generar una mayor presión para bombear la sangre a través de la válvula aórtica, hacia la aorta y luego hasta la circulación sistémica. Entre el corazón derecho y el izquierdo se sitúa el lecho capilar pulmonar, sistema muy distensible con una gran capacidad para almacenar sangre. Los cambios de esta capacidad se pueden detectar mediante los cambios de presión observados en ambos lados del corazón. Por tanto, el sistema circulatorio está constituido por dos circuitos dispuestos en serie : la circulación pulmonar, que es un sistema de baja presión con baja resistencia al flujo sanguíneo, y la circulación sistémica, que es un sistema de alta presión con alta resistencia al flujo sanguíneo. Los acontecimientos hemodinámicos se clasifican en sistólicos o diastólicos. Por convención, los términos suelen describir la actividad ventricular. Las aurículas poseen fases de sístole y diástole al igual que los ventrículos. Técnicamente hablando, el lado izquierdo del corazón es el primero en comenzar y completar las fases sistólica y diastólica. Para una mayor sencillez y dado que la diferencia de tiempo es mínima, se considerará que los lados derecho e izquierdo del corazón funcionan simultáneamente. 2 Circulación sistémica Estructura anatómica, Localización y abreviaturas Corazón derecho Corazón izquierdo VCS VCI AD VD VT VP AP AI VI Ao VM VAo - vena cava superior - vena cava inferior - aurícula derecha - ventrículo derecho - válvula tricúspide - válvula pulmonar - arteria pulmonar - aurícula izquierda - ventrículo izquierdo - aorta - válvula mitral - válvula aórtica Figura 1 3 CICLO CARDIACO El ciclo cardíaco está constituido por la actividad estrechamente sincronizada de aurículas y ventrículos. La secuencia es prácticamente la misma para los lados derecho e izquierdo del corazón. En términos generales, las dos fases básicas son la sístole y la diástole. Sin embargo, al examinar los ciclos con más detalle, se observa que ambas poseen diferentes subfases. El objetivo de esta sección es comentar las fases importantes del ciclo cardíaco. Históricamente, la base para el estudio de la sístole y la diástole ha sido el ECG. Para una identificación más precisa de las ondas intracardíacas, aquí se realiza una comparación del ciclo cardíaco eléctrico con el mecánico. El primer tipo de ciclo cardíaco que debe ocurrir es el ciclo cardíaco eléctrico. La fase inicial es la despolarización, que comienza en el nodo sinusal y se extiende como una onda de corriente eléctrica por las aurículas. Esta corriente se transmite después por los ventrículos. Después de la onda de despolarización, las fibras musculares se contraen, lo que produce la sístole. La siguiente actividad eléctrica es la repolarización, que da lugar a la relajación de las fibras musculares y produce la diástole. En el corazón normal, la actividad eléctrica inicial produce la actividad mecánica de la sístole y la diástole. Existe una diferencia de tiempo entre los dos denominados acoplamientos electromecánicos, o fase de excitación-contracción. Al observar un registro simultáneo del electrocardiograma y del trazado de presión, el ECG mostrará la onda adecuada antes que el trazado mecánico. Ciclo eléctrico y ciclo mecánico Figura 2 4 Como ya se ha mencionado, los términos sístole y diástole se suelen utilizar en relación con la actividad ventricular, ya que son los ventrículos los responsables de realizar la función de bomba. Es importante recordar que, mientras los ventrículos están en sístole, las aurículas están en diástole y viceversa. Esto resultará más claro al considerar las diversas fases del ciclo cardíaco. El ciclo cardíaco es un ciclo continuo de cambios de presión y de flujo sanguíneo. No importa si la discusión se comienza con la sístole o la diástole. Para nuestro objetivo, comenzaremos con la sístole. Sístole La primera fase de la sístole se denomina fase isovolumétrica o isométrica, y se muestra en el registro de presión. Esta fase tiene lugar después de la onda QRS causada por la despolarización ventricular en el ECG. En ese momento están cerradas todas las válvulas del corazón. La onda de despolarización ventricular produce un acortamiento de las fibras musculares, lo que ocasiona un aumento de la presión en los ventrículos. Una vez que esta presión supera a la existente en la arteria pulmonar (para el ventrículo derecho) y en la aorta (para el ventrículo izquierdo), se abren las válvulas aórtica y pulmonar. Es durante la fase isovolumétrica cuando se consume la mayor parte del oxígeno suministrado al miocardio. La segunda fase de la sístole es la eyección ventricular rápida. Una vez abiertas las válvulas pulmonar y aórtica, las fibras musculares se acortan todavía más, lo que ayuda a impulsar el volumen sanguíneo fuera de los ventrículos. Es durante esta fase cuando se impulsa el 80-85 % aproximadamente del volumen sanguíneo. La correlación en el ECG es con el segmento ST. Cuando la presión comienza a equilibrarse se inicia la tercera fase de la sístole ventricular, o de eyección ventricular reducida. En esta fase se produce una eyección más gradual con menos volumen. Durante esta fase las aurículas están en diástole. Existe un aumento del volumen de sangre auricular procedente de los flujos de entrada pulmonar y venoso. Este aumento de volumen ocasiona una elevación de la presión. Esta elevación resultante de la presión se registra como una onda “v” en el registro de la onda auricular. Al término de la fase de eyección ventricular reducida, casi todo el volumen a expulsar por los ventrículos se encuentra ya en la arteria pulmonar y en la aorta. Durante este período de eyección más lento, la presión en la aorta y en la arteria pulmonar son ligeramente superiores a las presiones de los ventrículos respectivos, por lo que la sangre comienza a refluir hacia ellos. Al término de la sístole ventricular, la presión ventricular desciende y las válvulas semilunares se cierran. Esto produce el ruido S2 que indica el comienzo de la diástole. La correlación en el ECG se produce con la onda T. 5 Diástole La transición entre sístole y diástole es el resultado de la continuidad de los cambios de presión entre el corazón y los grandes vasos. Al igual que la sístole, la diástole está precedida por un acontecimiento eléctrico, conocido como repolarización. Después de la repolarización comienzan a relajarse las fibras musculares. La primera fase de la diástole es similar a la primera fase de la sístole. En lugar de contracción isovolumétrica, existe una relajación isovolumétrica. Esta fase sigue a la fase de repolarización de los ventrículos y en el registro de las ondas de presión se observa después de la onda T del ECG. Al cesar la tensión en el miocardio, la presión en los ventrículos es ahora menor que en las aurículas. Con esta presión más alta en las aurículas, se abren las válvulas arteriales, lo que lleva a la segunda fase de la diástole, el llenado ventricular rápido. Durante esta fase, alrededor de las dos terceras partes del volumen sanguíneo se mueven pasivamente desde las aurículas hasta los ventrículos. La tercera fase también se denomina de llenado pasivo o lento. Durante la misma continúa pasando sangre de las aurículas a los ventrículos. En el ritmo sinusal y en algunos ritmos auriculares, la sístole auricular, que sigue a la onda P de despolarización auricular en el ECG, ayuda a impulsar el tercio de volumen ventricular restante. Esta onda se identifica como la onda “a” de los registros de presión auricular y sólo se observa con el ritmo sinusal o con algunos ritmos auriculares. En un momento dado, el volumen o la presión en aurículas es igual al de los ventrículos. Esta fase es la telediástole. Inmediatamente después de esta fase, el volumen de sangre en los ventrículos es mayor. Dado que la presión ventricular supera a la presión auricular, las válvulas arteriales comienzan a cerrarse. Una vez que se cierran las válvulas arteriales, el ruido S1 que se ausculta comienza el siguiente ciclo de sístole. 6 Ciclo cardíaco mecánico Figura 3 Figura 3a Figura 3b FASE ISOVOLUMETRICA • • • Sigue al QRS del ECG Todas las válvulas están cerradas Se consume la mayor parte del oxígeno EYECCION VENTRICULAR RAPIDA • • Tiene lugar durante el segmento ST Eyección del 80% al 85% del volumen sanguíneo EYECCION VENTRICULAR REDUCIDA • • • Tiene lugar durante la onda T Las aurículas están en diástole Produce la onda “v” en el registro auricular 1ª fase 2ª fase RELAJACION ISOVOLUMETRICA LLENADO VENTRICULAR RAPIDO • • • • • • Sigue a la onda T Todas las válvulas cerradas La presión ventricular disminuye aún más Termina en la “caída diastólica” ventricular Se abren las válvulas arteriales Pasan al ventrículo alrededor de las dos terceras partes 7 FISIOLOGIA CARDIACA APLICADA 3ª fase TELEDIASTOLE - “RETROCESO AURICULAR” • • • • Sigue a la onda “P” durante el ritmo sinusal Se produce la sístole auricular Produce la onda “a” en los registros auriculares Pasa al ventrículo el resto del volumen Figura 3e La capacidad del corazón para actuar como bomba está estrechamente regulada, a fin de asegurar un aporte adecuado que cubra las necesidades metabólicas de los tejidos. En ciertas condiciones fisiológicas, que pueden oscilar desde la enfermedad hasta el ejercicio, el corazón normal tiene capacidad de compensación para cubrir las demandas que se le plantean. El rendimiento cardíaco posee cuatro componentes fundamentales : frecuencia cardíaca, precarga, poscarga y contractilidad. En un corazón enfermo o en caso de alteración del sistema circulatorio se pueden modificar uno o más de estos determinantes para tratar de mantener un rendimiento cardíaco adecuado. En esta sección se comentará cada uno de los determinantes, así como sus acciones reguladoras y sus mecanismos compensadores. Gasto cardíaco El gasto cardíaco (en litros/minuto) se define como la cantidad de sangre impulsada desde el ventrículo (principalmente el ventrículo izquierdo) en un minuto. Es el término que se utiliza para designar la eficacia de la bomba y la función ventricular del corazón - el rendimiento cardíaco. Gasto cardíaco = Frecuencia cardíaca x Volumen sistólico Donde : Frecuencia cardíaca = Volumen sistólico = latidos/minuto cantidad de sangre impulsada por el ventrículo en un latido El gasto cardíaco se puede modificar variando la frecuencia cardíaca o el volumen sistólico. 8 Figura 4 9 Frecuencia cardíaca DETERMINANTES DEL GASTO CARDIACO La mayoría de los corazones sanos toleran modificaciones de la frecuencia cardíaca desde 40 hasta 170 latidos por minuto. Cuanto más comprometida está la función cardíaca, más estrecho se hace este margen. Los frecuencias cardíacas elevadas comprometen el gasto cardíaco por : aumento de la cantidad de oxígeno consumida por el miocardio, reducción del tiempo diastólico, que puede dar lugar a un menor tiempo de perfusión de las arterias coronarias, y acortamiento de la fase de llenado ventricular, que ocasiona una disminución del volumen de sangre a bombear en la siguiente contracción. La frecuencia cardíaca lenta o reducida también tiene algunos efectos nocivos. Inicialmente, el tiempo de llenado es más prolongado, lo que podría dar lugar a un aumento del gasto cardíaco. Sin embargo, incluso con este aumento de volumen, el miocardio puede estar tan deprimido que el músculo no se contrae lo bastante fuerte como para impulsar dicho aumento de volumen. El resultado es una disminución del gasto cardíaco. Volumen sistólico El volumen sistólico (VS) es la cantidad de sangre impulsada fuera del ventrículo izquierdo cada vez que éste se contrae. Es la diferencia entre el volumen telediastólico (VTD), o cantidad de sangre presente en el ventrículo izquierdo al final de la diástole, y el volumen telesistólico (VTS), o cantidad de sangre presente en el ventrículo izquierdo al final de la sístole. El volumen sistólico normal es de 60 a 100 ml/latido. VS = VTD - VTS Cuando el volumen sistólico se expresa como porcentaje del volumen telediastólico, recibe el nombre de fracción de eyección (FE). La fracción de eyección normal (ventrículo izquierdo) es del 65 %. FE = VS VTD x 100 El volumen sistólico, como componente del gasto cardíaco, está influido por los otros tres determinantes de la función cardíaca : precarga, poscarga y contractilidad, todos ellos interrelacionados. En muchos casos, cuando altera uno, también lo hace el otro, y así sucesivamente. 10 Ley de Frank-Starling La relación entre el volumen sistólico y el rendimiento cardíaco fue descrita a finales del decenio de 1890 y principios del de 1900 por los Dres. Frank y Starling. La ley de Frank-Starling describe la relación entre la longitud del músculo miocárdico y la fuerza de contracción. En términos sencillos, cuanto más se estire la fibra muscular durante la diástole, o más volumen haya en el ventrículo, más fuerte será la siguiente contracción sistólica. Esta ley también establece que este fenómeno se cumple hasta que se alcanza un límite fisiológico. Una vez alcanzado este límite, la fuerza de contracción comenzará a declinar, con independencia de lo que aumente el estiramiento de la fibra. En el corazón, esta capacidad para aumentar la fuerza de contracción es la que convierte el aumento del retorno venoso en un aumento del volumen sistólico. El volumen sistólico debe estar equilibrado con el retorno venoso o el corazón fracasará. Curva de Frank-Starling Figura 5 11 Precarga La precarga se refiere al grado de estiramiento de la fibra miocárdica al final de la diástole. También es la cantidad de volumen presente en el ventrículo en esta fase. En realidad, es muy difícil medir la longitud de la fibra o el volumen a la cabecera del paciente. Desde el punto de vista clínico, se ha considerado que la medida de la presión necesaria para llenar los ventrículos (PLLVI) era una medida aceptable del volumen telediastólico ventricular izquierdo (VTDVI) o de la longitud de la fibra. La relación real entre el volumen telediastólico y la presión telediastólica depende de la complianza de la pared muscular. La relación entre los dos parámetros adopta la forma de una línea curva. Con una complianza normal, aumentos relativamente grandes de volumen ocasionan aumentos relativamente pequeños de la presión. Por el contrario, en un ventrículo con mala complianza, aumentos pequeños de volumen producen una mayor presión. El aumento de la complianza del ventrículo permite mayores cambios de volumen con pocos aumentos de presión. Curvas de complianza A : Complianza normal B : Complianza disminuida C : Complianza aumentada Figura 6 12 Poscarga Este término se refiere a la resistencia, impedancia o presión que el ventrículo debe superar para impulsar su volumen sanguíneo. La poscarga está determinada por una serie de factores : volumen y masa de la sangre impulsada, tamaño del ventrículo y espesor de su pared, e impedancia de la red vascular. En el contexto clínico, la medida más sensible de la poscarga es la resistencia vascular sistémica (RVS) para el ventrículo izquierdo y la resistencia vascular pulmonar (RVP) para el ventrículo derecho. En realidad, la resistencia del sistema vascular se deriva de las mediciones del gasto cardíaco (GC) y de la presión arterial media (PAM). Las fórmulas para calcular la poscarga se basan en la diferencia de gradiente entre el principio (flujo de entrada) del circuito y el término (flujo de salida) del mismo. RVS = (PAM - PAD) x 80 GC Valor normal : 800 - 1200 dinas/s/cm-5 Donde : PAM = presión arterial media PAD = presión en aurícula derecha RVP = (PMAP - PEAP) x 80 GC Donde : PMAP = presión media en arteria pulmonar PEAP = presión de enclavamiento en arteria pulmonar La poscarga está en relación inversa con la función ventricular. Al aumentar la resistencia a la eyección, disminuye la fuerza de contracción. Ello da lugar a una disminución del volumen sistólico. La interrelación entre poscarga y volumen sistólico, como determinantes del rendimiento cardíaco, es importante. 13 Figura 7 En el corazón normal, el aumento de resistencia produce pocos cambios en el volumen sistólico. Al disminuir la función miocárdica, el aumento de resistencia produce una mayor disminución del volumen sistólico. Este nivel de disfunción a menudo es consecuencia de la disminución de contractilidad del propio miocardio. Curvas de volumen sistólica - poscarga Figura 8 Contractilidad El inotropismo es la propiedad de acortamiento inherente a las fibras musculares miocárdicas sin modificación de la longitud de la fibra o de la precarga. Existen múltiples factores que influyen en el estado contráctil del miocardio. La más importante de estas influencias es el efecto del sistema nervioso simpático sobre el corazón. La liberación de catecolaminas puede producir un aumento instantáneo de la contractilidad, o bien un aumento más lento. El aumento de la frecuencia cardíaca debido al sistema nervioso simpático también puede aumentar ligeramente la contractilidad. Otras influencias son los cambios metabólicos, como los estados de acidosis que disminuyen la contractilidad. Mediante tratamientos farmacológicos se puede desencadenar un estado inotrópico positivo o negativo, dependiendo de las condiciones del paciente o de las necesidades hemodinámicas. 14 Al igual que los efectos de los cambios de la poscarga sobre la función ventricular, los cambios de la contractilidad también se pueden representar por una curva. Es importante señalar que los cambios de la contractilidad provocan desplazamientos de las curvas, pero no de su forma básica subyacente. A : Contractilidad normal B : Contractilidad aumentada C : Contractilidad disminuida A : Contractilidad normal B : Contractilidad aumentada C : Contractilidad disminuida Figura 9 Resumen Dado que la función ventricular se puede representar como una familia de curvas, las características del rendimiento cardíaco se pueden desplazar de una curva a otra, dependiendo del equilibrio de los cuatro determinantes principales de la función cardíaca. Al evaluar el estado hemodinámico del paciente es preciso tener en cuenta las interrelaciones entre frecuencia cardíaca, precarga, poscarga y estado contráctil del miocardio. 15 El consumo miocárdico de oxígeno es la cantidad de oxígeno utilizada por el corazón para realizar su función. La carga de trabajo del corazón es costosa, incluso en los períodos de reposo. Normalmente, el miocardio consume alrededor del 65%-80% del oxígeno que recibe. En el momento actual no es posible medir directamente el consumo miocárdico de oxígeno. CONSUMO MIOCARDICO DE OXIGENO Los factores que afectan al consumo miocárdico de oxígeno se pueden dividir entre los que se refieren al aporte y los relativos a la demanda. Dado que la extracción de oxígeno no se puede aumentar mucho cuando aumentan la demanda o el trabajo, la única forma de compensación por el lado del aporte es el aumento del flujo sanguíneo. La perfusión del ventrículo izquierdo por las arterias coronarias tiene lugar sobre todo durante la diástole. El aumento de la tensión de la pared ventricular durante la sístole aumenta la resistencia hasta tal punto que es muy escasa la cantidad de sangre que fluye al endocardio. El ventrículo derecho posee menos masa muscular y, por tanto, menos tensión en la pared durante la sístole, de modo que, debido a la menor resistencia, el flujo sanguíneo que llega al ventrículo derecho por la arteria coronaria derecha durante la sístole es mayor. Para que ambas arterias coronarias sean perfundidas se precisa una presión diastólica adecuada en la raíz aórtica. Perfusión de las arterias coronarias Figura 10 16 En la parte correspondiente a la demanda del consumo miocárdico de oxígeno se encuentran todos los determinantes del rendimiento cardíaco. La manipulación del gasto cardíaco no se realiza sin coste para el corazón. En muchas enfermedades resulta difícil aumentar el aporte, mientras que los factores de la demanda pueden estar muy aumentados. Siempre que se produce un aumento de la demanda es preciso tener en cuenta el riesgo de que aumente el consumo miocárdico de oxígeno, ya que el miocardio carece relativamente de reserva de oxígeno. A través de la monitorización hemodinámica es posible realizar diversas intervenciones terapéuticas para modificar factores de la demanda como la precarga, la poscarga, la contractilidad y la frecuencia cardíaca. Estas intervenciones y sus efectos se tratarán en una sección posterior. Figura 11 A finales del decenio de 1960 y principios del decenio de 1970, los Dres. H.J.C. Swan y William Ganz desarrollaron un catéter flotante con un balón en su extremo. Su función era la medición continua de ciertas presiones intracardíacas a la cabecera del paciente. Antes, para realizar una evaluación más completa de la función cardíaca era necesario trasladar al paciente al laboratorio de cateterismo y sólo se podían obtener valores intermitentes. Mediante la introducción de un catéter flotante flexible en la arteria pulmonar y la utilización de un balón para ocluir las presiones de la misma, se podía obtener un reflejo de las presiones del lado izquierdo del corazón. Desde el diseño inicial del catéter se han introducido numerosos avances para obtener datos hemodinámicos adicionales, como las presiones de aurícula derecha. Posteriormente se añadió un termistor para realizar determinaciones del gasto cardíaco. 17 BASE FISIOLOGICA DE LA MONITORIZACION DE LA PRESION EN ARTERIA PULMONAR Las cuatro figuras siguientes muestran la justificación del catéter de SwanGanz. En ellas se representa la colocación adecuada del extremo del catéter después de la inserción y, a menos que se indique lo contrario, las presiones registradas en la luz distal. Nota: Para una descripción más detallada de la inserción del catéter, consúltese el prospecto del producto, “Procedimiento para la inserción de los catéteres de Swan-Ganz”, de Edwards Critical-Care División. 18 Ventrículos en sístole Figura 12 En la figura 12, el balón está desinflado y los ventrículos están en sístole. Durante esta fase del ciclo cardíaco, las válvulas mitral y tricúspide están cerradas, mientras que las válvulas pulmonar y aórtica están abiertas. La mayor presión generada por el ventrículo derecho durante la contracción se transmite al extremo del catéter situado en la arteria pulmonar. El catéter registra la presión sistólica en arteria pulmonar (PSAP), reflejo de la presión sistólica en el ventrículo derecho (PSVD), que en este momento constituyen una cámara común con volumen y presión comunes. 19 Ventrículos en diástole Figura 13 En la figura 13, durante la diástole, las válvulas mitral y tricúspide están abiertas. Los ventrículos se están llenando de sangre procedente de sus respectivas aurículas. En este momento, las válvulas pulmonar y aórtica están cerradas. Con el balón todavía desinflado, se registra la presión diastólica en la arteria pulmonar (PDAP). Después del cierre de la válvula pulmonar, el ventrículo derecho continúa relajándose. Eso hace que la presión diastólica en el ventrículo derecho sea menor que la de la arteria pulmonar. La PDVD es menor que la PDAP. Dado que, en condiciones normales, no existe obstrucción entre la arteria pulmonar y la aurícula izquierda, la presión registrada será prácticamente igual que la existente en aurícula izquierda. En un rango de presiones que va desde unos 6 mmHg hasta unos 20 mmHg, esta presión es casi igual a la presión diastólica en el ventrículo izquierdo. PDAP = PAI = PDVI. 20 Como se muestra en la figura 14, el balón ahora está inflado. Al inflar el balón, el catéter flota corriente adelante hasta alojarse en una rama más pequeña de la arteria pulmonar. Una vez alojado el balón, se considera que el catéter está “enclavado”. Es en esta posición de enclavamiento cuando las presiones diastólicas del lado derecho y de la AP están efectivamente ocluidas. Ventrículos en diástole: catéter enclavado Figura 14 Dado que no existen válvulas entre la válvula pulmonar y la mitral, y que el lecho capilar pulmonar es un sistema distensible, ahora existe un canal vascular sin restricciones que, desde el extremo del catéter situado en la arteria pulmonar, pasa por el lecho vascular pulmonar, la vena pulmonar, la aurícula izquierda, la válvula mitral abierta y llega hasta el ventrículo izquierdo. La luz distal está monitorizando ahora más estrechamente la presión de llenado ventricular izquierdo o presión telediastólica del ventrículo izquierdo. Para describir esta presión se han utilizado varios términos. Anteriormente, el más frecuente era el de presión de enclavamiento capilar pulmonar (PECP). En realidad, el catéter no flota en un capilar, por lo que el nombre era erróneo. Un término más correcto sería el de presión de enclavamiento de la arteria pulmonar (PEAP) o, incluso, presión de oclusión de la arteria pulmonar (PoAP). En muchos casos se utiliza el término “enclavamiento” o “cuña”. 21 La importancia de esta presión radica en que normalmente es muy aproximada a la presión existente en el ventrículo izquierdo al final de la diástole, por lo que permite medir la precarga ventricular. Con la adición de más luces al catéter, como la de aurícula derecha, se puede obtener más información relativa a la función cardíaca. Durante esta fase del ciclo cardíaco, la lectura de aurícula derecha reflejará la presión telediastólica del ventrículo derecho o precarga ventricular derecha, debido a que la válvula tricúspide está abierta. En la figura 15, el balón todavía está en posición de “enclavamiento” y los ventrículos están en sístole. Dado que el balón está ocluyendo una rama de la arteria pulmonar, las presiones del ventrículo derecho están totalmente bloqueadas. La luz distal del catéter monitoriza ahora la presión que refleja el llenado de la aurícula izquierda. La presión de enclavamiento de la arteria pulmonar se conoce también como presión de llenado de la aurícula izquierda (PLLAI). Ventrículos en sístole; catéter enclavado Figura 15 22 En las secciones previas se ha comentado la base fisiológica de la monitorización hemodinámica. En esta sección se describirán las técnicas de inserción, las ondas características observadas durante la misma y las ventajas de la monitorización continua de la arteria pulmonar. Antes de la inserción del catéter de Swan-Ganz se preparará el sistema de monitorización de presión para su utilización de acuerdo con las pautas y procedimientos de la institución. Insertar el catéter siguiendo las directrices recomendadas, y hacerlo avanzar hacia el tórax. Los puntos habituales de inserción por vía percutánea son las venas yugular interna, subclavia y femoral. Para la técnica de venotomía se pueden utilizar la fosa antecubital derecha o izquierda. El abordaje por vena subclavia puede dar lugar a la formación de bucles en el catéter debido a las variaciones anatómicas y a la angulación del introductor. La formación de bucles puede dar lugar a ondas amortiguadas. En ocasiones es necesario volver a colocar en posición el catéter. Puntos de inserción del catéter Localización Yugular interna Vena cava superior Vena femoral Fosa antecubital derecha Fosa antecubital izquierda Distancia hasta la unión vena cava/AD (cm) 15 a 20 10 a 15 30 40 50 El avance del catéter hasta la arteria pulmonar debe ser rápido, ya que la manipulación prolongada puede ocasionar la pérdida de rigidez del catéter. En general, no se precisa fluoroscopia para la inserción del catéter Swan-Ganz de termodilución, por dos razones principales. En primer lugar, el catéter está diseñado para ser dirigido por el flujo cuando el balón está inflado. Durante la inserción, el balón inflado hace que el catéter siga el flujo de sangre venosa desde el corazón derecho hasta la arteria pulmonar. En segundo lugar, las cámaras del lado derecho del corazón muestran presiones y formas de onda características. La arteria pulmonar también posee presiones y ondas características. Mediante la visualización en un monitor de las diversas ondas y presiones se puede determinar la situación del catéter. A continuación se describirán las características de las ondas y las presiones normales que se observan durante la inserción del catéter de Swan-Ganz. Para mayor claridad, las ondas se han idealizado. 23 TECNICAS DE INSERCION DEL CATETER DE SWAN-GANZ Una vez que el extremo del catéter ha alcanzado la unión de la vena cava superior o inferior con la aurícula derecha, se infla el balón con aire o con CO2 hasta alcanzar el volumen completo indicado en el cuerpo del catéter (7 a 7,5 F; 1,5 cc). Esta posición está indicada por la presencia de oscilaciones respiratorias en la pantalla del monitor. La primera cámara que se alcanza es la aurícula derecha. Las presiones son normalmente bajas y producirán dos pequeñas ondas positivas. Onda auricular derecha Figura 16 La siguiente cámara es el ventrículo derecho. Las ondas muestran elevaciones más altas y picudas como consecuencia de la sístole ventricular y bajos descensos y valores diastólicos. La presión sistólica es más alta en el ventrículo derecho, mientras que el valor diastólico es casi igual que la presión en aurícula derecha. Cuando el catéter ha pasado la válvula tricúspide, se debe prestar especial atención al ECG del paciente, a fin de identificar cualquier ectopia ventricular que pudiera surgir. Onda ventricular derecha Figura 17 24 Cuando el catéter flota dentro de la arteria pulmonar (no en posición de enclavamiento), de nuevo se pueden observar ondas características. Como consecuencia de la sístole ventricular derecha se produce una elevación de la presión en la arteria pulmonar. Esta presión se registra con un valor casi igual que el de la presión sistólica de ventrículo derecho. La onda producida realiza una gran excursión, con la pendiente ascendente más redondeada que el trazado en ventrículo derecho. El inicio de la diástole comienza con el cierre de la válvula pulmonar, que produce una escotadura dícrota en el trazado de la arteria pulmonar. La diástole continúa en los ventrículos. Una vez que se cierra la válvula pulmonar, y dado que la arteria pulmonar no se relaja más, la presión diastólica es más alta en la arteria pulmonar que en el ventrículo derecho. Dado que las presiones diastólicas son más altas en la arteria pulmonar que en el ventrículo derecho, durante la inserción se prestará atención especial a las mismas. Las presiones sistólicas del ventrículo derecho y de la arteria pulmonar son casi iguales, por lo que, si se monitorizan durante la inserción puede ser difícil distinguir entre una y otra localización del extremo del catéter pulmonar. Sin embargo, si se observan las presiones diastólicas, se notará una elevación de la misma una vez alcanzada la arteria pulmonar. Onda de la arteria pulmonar Figura 18 25 Ahora se hace avanzar aún más el catéter, con el balón todavía inflado, hasta que finalmente se enclava en una rama central de la arteria pulmonar. En este punto se ocluyen las presiones del corazón derecho y las influencias pulmonares. El extremo del catéter está “mirando” a las presiones del corazón izquierdo. La onda reflejada será la de la aurícula izquierda. Las presiones registradas serán ligeramente más altas que las de la aurícula derecha (6 mmHg a 12 mmHg). La onda tendrá dos pequeñas eminencias redondeadas que corresponden a la sístole y a la díastole de la aurícula izquierda. El valor registrado también será ligeramente inferior al de la presión diastólica de la arteria pulmonar. Esta última supera habitualmente a la presión de enclavamiento de la arteria pulmonar en 1 mmHg a 4 mmHg. Onda de enclavamiento de la arteria pulmonar Figura 19 Registros normales de inserción Figura 20 26 Tabla 1. Presiones hemodinámicas típicas Localización Valores normales en mmHg Aurícula derecha Auricular derecha (PAD) Media (PMAD) -1 a +7 4 Ventrículo derecho Sistólica (PSVD) Diastólica (PDVD) 15 a 25 0a8 Arteria pulmonar Sistólica (PSAP) Diastólica (PDAP) Media (PMAP) Enclavamiento (PEAP) 15 a 25 8 a 15 10 a 20 6 a 12 Aurícula izquierda (PAI) 6 a 12 Una vez identificada la posición de enclavamiento, se desinfla el balón retirando la jeringa y permitiendo que la presión en arteria pulmonar lo desinfle. Una vez desinflado el balón, se vuelve a colocar la jeringa en la válvula de entrada. A fin de reducir o eliminar cualquier bucle o exceso de catéter en la aurícula o el ventrículo derechos, se retirará lentamente el catéter 1 a 2 cm. A continuación se vuelve a inflar el balón para determinar el volumen de inflado mínimo necesario para obtener el trazado de la presión de enclavamiento. El extremo del catéter deberá estar en una posición tal que precise un volumen de inflado completo o casi completo (1,0 cc a 1,5 cc) para producir el registro de la presión de enclavamiento. Ahora es posible monitorizar de forma continua los registros y presiones en arteria pulmonar. Dado el riesgo potencial, siempre presente, de lesionar la arteria pulmonar durante el enclavamiento, en la mayor parte de los casos bastará con monitorizar la PDAP, como reflejo fiel de la PEAP. Monitorización continua de la presión Para obtener cifras fiables y ondas claramente identificables, el sistema de monitorización de presión debe ser óptimo. Ello implica transductores de presión de alta calidad, así como monitores y sistemas de monitorización de presión adecuadamente calibrados y puestos a cero. Para la calibración del monitor se utilizarán los procedimientos recomendados por el fabricante. Para monitorizar de forma continua las presiones de la arteria pulmonar se necesita un sistema con solución heparinizada, a fin de mantener permeable la luz del catéter. Existen muchos tipos diferentes de sistemas, configurados para la monitorización de diversas combinaciones de presiones. Para lograr un montaje adecuado de la línea y conocer las directrices de empleo, consúltese el folleto de información de producto del transductor de presión de 27 Edwards Critical-Care.La monitorización continua de la presión de la arteria pulmonar es importante por varias razones. En primer lugar, el tratamiento dependerá de los valores obtenidos en los registros continuos de arteria pulmonar y en los intermitentes de enclavamiento. En segundo lugar, los cambios en la posición del catéter suponen riesgos potenciales para el paciente. Posición correcta en la AP Figura 21 Cuando se desinfla el balón, el catéter puede emigrar de forma espontánea hacia una rama más distal de la arteria pulmonar. Esta emigración puede producirse en cualquier momento, pero es más frecuente en las primeras horas después de la inserción. Migración del catéter Figura 22 28 Esta migración se debe principalmente al ablandamiento del catéter una vez calentado a la temperatura corporal. Durante la inserción puede quedar demasiado catéter en el ventrículo derecho. Este exceso, una vez ablandado lo suficiente, puede hacer que el catéter se desplace aún más. Una técnica que ayuda a prevenir esta causa de migración consiste en disminuir el grado de formación de bucles en el ventrículo derecho mediante la retirada del catéter 1 a 2 cm una vez obtenido el enclavamiento adecuado. Luego se volverá a realizar el enclavamiento para comprobar la correcta posición del extremo del catéter con un volumen de inflado completo o casi completo. Cuando el catéter sólo está parcialmente enclavado, la presión sistólica de la arteria pulmonar será menor que la registrada previamente. También se puede perder la claridad del trazado. Si el catéter se ha enclavado por completo se observará el trazado de enclavamiento característico. Si el catéter, aún con el balón desinflado, está enclavado total o parcialmente, se retirará progresivamente, a razón de 1 a 2 cm cada vez, hasta obtener un registro claro de la arteria pulmonar. Los enclavamientos subsiguientes deberán hacerse con volúmenes de inflado máximos o casi máximos. En ocasiones, el extremo del catéter retrocede hasta el ventrículo derecho, lo que se reconoce por la observación de registros característicos del ventrículo derecho en el monitor. Las presiones sistólicas seguirán siendo prácticamente las mismas, pero la presión diastólica será menor que la registrada previamente en la arteria pulmonar. Extremo del catéter en el ventrículo derecho Figura 23 Si esto ocurre, se inflará el balón para proteger al ventrículo derecho y evitar que se irrite. Dado que se trata de un catéter dirigido por flujo, el simple inflado del balón puede hacer que vuelva a flotar de nuevo hasta llegar a la arteria pulmonar. En ocasiones, el cambio de posición del paciente puede conseguir la colocación adecuada del catéter. Si no es posible alcanzar la arteria pulmonar con estas maniobras, se intentará hacer avanzar de nuevo el catéter, pero sólo si se ha mantenido la esterilidad del segmento expuesto. Si ello no ha sido así, se retirará el catéter y, si todavía es necesario, se reemplazará por un segundo catéter. 29 Siempre que se retire el catéter desde la arteria pulmonar hasta el ventrículo derecho, y desde éste hasta la aurícula derecha, se desinflará el balón para reducir al mínimo el traumatismo valvular. Tan importantes como la colocación adecuada del extremo del catéter son las técnicas de inflado correcto del balón. El inflado excesivo puede provocar sobredistensión de la arteria pulmonar, con el consiguiente peligro de rotura del vaso. Técnicas de enclavamiento Figura 24 Figura 25 El balón se inflará siempre lentamente, al tiempo que se observa la forma de la onda en el monitor. Una vez que aparece el trazado característico del enclavamiento, se suspenderá inmediatamente el inflado del balón. Nunca se debe superar el volumen máximo de inflado. 30 Si el trazado de enclavamiento aparece con un volumen menor de inflado (por lo general, menos de 1,5 cc), es posible que el catéter haya emigrado a una localización más distal. Entonces es necesario retirar el extremo del catéter hasta situarlo en una arteria pulmonar central. Asimismo, si se observa el trazado de enclavamiento con un volumen bajo de inflado y se continúa inflando el balón, la presión resultante puede aumentar progresivamente, con pérdida de definición de la onda. Esta situación recibe el nombre de “sobreenclavamiento” y puede estar en relación con la transmisión a la luz distal del catéter de la presión procedente del balón inflado excesivamente. Un sistema de monitorización de alta calidad y presión optimizada, junto con una adecuada colocación del extremo del catéter en una rama central, permiten evaluar con exactitud las presiones de la arteria pulmonar. Una vez obtenidos estos valores se puede instaurar un tratamiento adecuado. Las siguientes directrices se proporcionan para favorecer la utilización correcta y segura de los catéteres de arteria pulmonar con balón en su extremo. Balón inflado con el volumen completo DURANTE LA INSERCION : Inflar el balón hasta el volumen completo de inflado. Esto produce un almohadillado del extremo, que ayuda a disminuir la irritación durante la inserción. También ayuda a colocar el extremo del catéter en su localización correcta en una arteria pulmonar central. Figura 26 Balón inflado con un volumen inferior al completo ENCLAVAMIENTOS SUBSIGUIENTES : Para obtener trazados de enclavamiento adecuado deben ser necesarios volúmenes de inflado completos o casi completos. Si el trazado de enclavamiento se obtiene con un volumen de inflado inferior a 1,25 a 1,5 cc de aire, es preciso volver a colocar el catéter. Figura 27 31 1. Mantener el extremo del catéter en situación central en una rama principal de GUIAS RESUMEN PARA LA UTILIZACION SEGURA DE LOS CATETERES DE ARTERIA PULMONAR CON BALON EN SU EXTREMO la arteria pulmonar. • Durante la inserción, inflar el balón hasta el volumen completo recomendado (1,5 cc) y hacer avanzar el catéter hasta la posición de enclavamiento en la arteria pulmonar. Desinflar el balón. • Para disminuir o eliminar el exceso de longitud o los bucles en la aurícula o el ventrículo izquierdos, retirar lentamente el catéter entre 1 cm y 2 cm. • No hacer avanzar el extremo del catéter demasiado periféricamente. Lo ideal es que esté localizado cerca del hilio pulmonar. Es preciso recordar que el extremo emigra hacia la periferia de los pulmones durante el inflado del balón. Por tanto, es importante que presente una localización central antes del inflado. • Mantener siempre el extremo del balón en una posición en la que sea necesario un volumen de inflado completo o casi completo (1,0 cc a 1,5 cc) para conseguir un trazado de “enclavamiento”. 2. Prever la migración espontánea del extremo del catéter hacia la periferia del lecho pulmonar : • Reducir cualquier exceso de longitud o bucle en la aurícula o el ventrículo derechos en el momento de la inserción, a fin de evitar la posterior migración periférica (véase nº 1). • Monitorizar continuamente la presión en el extremo distal para asegurarse de que el catéter no se ha enclavado inadvertidamente con el balón desinflado (lo que puede producir infarto pulmonar). • Comprobar diariamente la posición del catéter mediante una radiografía de tórax, a fin de detectar una posible localización periférica. Si se ha producido la migración, retirar el catéter hasta una posición central en arteria pulmonar, evitando cuidadosamente la contaminación del punto de inserción. • Durante la circulación extracorpórea (ref. 18) se produce la migración espontánea del extremo del catéter hacia la periferia de los pulmones. Se valorará la retirada parcial del catéter (3 cm a 5 cm) inmediatamente antes de iniciar la técnica, ya que dicha retirada puede ayudar a reducir el grado de migración distal y evitar el enclavamiento permanente del catéter en el período posterior a la circulación extracorpórea (ref. 18). Una vez terminado el procedimiento, puede ser necesario volver a colocar el catéter. Comprobar el trazado distal de arteria pulmonar antes de inflar el balón. 3. Precaución al inflar el balón : • Si se obtiene el “enclavamiento” con volúmenes inferiores a 1,0 cc, retirar el catéter hasta una posición en que se necesite un volumen de inflado completo o casi completo (1,0 cc a 1,5 cc) para conseguir dicho trazado. • Antes de inflar el balón, comprobar la forma de la onda de presión distal. Si aparece amortiguada o distorsionada, no inflar el balón. Es posible que el 32 catéter esté enclavado con el balón desinflado. Comprobar la posición del catéter. 33 • Cuando se vuelve a inflar el balón para registrar la presión de enclavamiento, añadir el medio de inflado (CO2 o aire) lentamente, bajo monitorización continua de la onda de presión de la arteria pulmonar. Suspender inmediatamente el inflado cuando se observe que el registro de arteria pulmonar cambia al trazado de enclavamiento. Retirar la jeringa para permitir el desinflado rápido del balón y volver a conectar la jeringa a la luz del balón. Nunca se debe utilizar aire para inflar el balón en aquellos casos en que pueda pasar a la circulación arterial (véase Método de inserción). • Nunca inflar excesivamente el balón por encima del volumen máximo señalado en el cuerpo del catéter (1,5 cc). Utilizar la jeringa de volumen limitado que acompaña al catéter. • No utilizar líquidos para inflar el balón ; pueden ser irrecuperables e impedir el desinflado del balón. • Mantener la jeringa conectada a la luz del balón para impedir la inyección accidental de líquidos en el interior del mismo. 4. Medir la presión de “enclavamiento” por oclusión de la arteria coronaria sólo cuando sea necesario : • Si la presión diastólica de arteria pulmonar (PDAP) y la presión de enclavamiento (PEAP) son casi idénticas no será necesario enclavar el balón ; medir la PDAP en lugar de la PEAP mientras permanezcan estables la frecuencia cardíaca, la tensión arterial, el gasto cardíaco y la situación clínica del paciente. Sin embargo, en situaciones en que el tono arterial y venoso pulmonares son cambiantes (p. ej., sepsis, insuficiencia respiratoria aguda, shock), la relación entre PDAP y presión de enclavamiento puede cambiar según la situación clínica ; en estos casos puede ser necesario medir la PEAP. • Mantener el “enclavamiento” durante el menor tiempo posible (dos ciclos respiratorios o 10 a 15 segundos), sobre todo en los pacientes con hipertensión pulmonar. • Evitar las maniobras prolongadas para obtener la presión de enclavamiento. Si se encuentran dificultades, renunciar. • Nunca lavar el catéter mientras el balón está enclavado en la arteria pulmonar. 5. Los pacientes con mayor riesgo de ruptura o perforación de la arteria pulmonar son los de edad avanzada con hipertensión pulmonar, y precisamente son pacientes de edad avanzada los sometidos a cirugía cardíaca con anticoagulación e hipotermia. La localización proximal del extremo del catéter cerca del hilio pulmonar reducirá la incidencia de perforación de la arteria pulmonar (ref. 21). 34 Las posibilidades del catéter de Swan-Ganz comentadas hasta ahora son : monitorización de la presión de la arteria pulmonar, capacidad de monitorizar las presiones de la aurícula derecha y obtención de registros de enclavamiento de la arteria pulmonar. Otra posibilidad añadida es la obtención de mediciones del gasto cardíaco por el método de termodilución. Mediante la inclusión del gasto cardíaco se puede obtener una evaluación más completa del rendimiento cardíaco. Existen tres métodos indirectos para determinar el gasto cardíaco : el método de Fick, el método de dilución de un colorante indicador y el método de termodilución. Los dos primeros se realizan fundamentalmente en el laboratorio de cateterismo. El último, el método de termodilución, se realiza más fácilmente a la cabecera del paciente. En esta sección se comentarán las diversas técnicas utilizadas, prestando especial atención al método de termodilución. Método de Fick El “patrón oro” para la determinación del gasto cardíaco se basa en los principios desarrollados por Adolph Fick en el decenio de 1870. El concepto de este autor propone que la captación o liberación de una sustancia por un órgano es el producto del flujo sanguíneo a través de dicho órgano por la diferencia entre los valores arterial y venoso de la misma sustancia. En el método de Fick la sustancia es el oxígeno y el órgano son los pulmones. Se miden el contenido arterial y venoso de oxígeno para obtener la diferencia arteriovenosa de oxígeno (A - v O2). El consumo de oxígeno se puede calcular a partir del contenido de oxígeno inspirado menos el espirado y de la velocidad de ventilación. A continuación se calcula el gasto cardíaco utilizando la fórmula siguiente : GC = Consumo de oxigeno en ml / min diferencia A - v O2 • El contenido arterial normal de oxígeno es de 20 volúmenes % (volumen % = 1 ml de oxígeno/100 cc) • El contenido normal de oxígeno de la mezcla venosa es de 15 volúmenes % (volumen % = 1 ml de oxígeno/100 cc) • El consumo normal de oxígeno es de 250 ml/min. Trasladando estos valores a la ecuación : GC = 250 ml/min. x 100/20 - 15 vol. % = 5000 ml/min. o 5 l/min. 35 DETERMINACIONES DEL GASTO CARDIACO Aunque el método de Fick ha sido descrito como el “patrón oro”, esta técnica presenta numerosos inconvenientes. El paciente debe mantener un estado fisiológico estable en el momento de su realización. Casi todos los pacientes en los que es necesario realizar mediciones del gasto cardíaco se encuentran en estado crítico, a menudo definido como “situación inestable”. Otros inconvenientes relacionados con la técnica son la necesidad de toma simultánea de muestras de aire espirado y de sangre, el contenido controlado de oxígeno inspirado y la toma de muestras de sangre arterial. El método de Fick es uno de los más exactos en los pacientes con gasto cardíaco especialmente bajo. Pero, debido a sus requisitos técnicos, es uno de los menos prácticos a nivel clínico. Método de dilución de un colorante indicador Otro método indirecto de medición del gasto cardíaco es el del colorante indicador o método de dilución de un indicador. Los principios en los que se basa fueron propuestos por vez primera en el decenio de 1890 por Stewart y ajustados posteriormente por Hamilton. La técnica del colorante indicador se basa en la adición de una concentración conocida de un indicador a un organismo o líquido; después de dejar un tiempo de mezcla adecuado, la dilución de dicho indicador permitirá conocer la cantidad de líquido a la que se añadió. En términos sencillos, el método del indicador permite medir el gasto cardíaco por medio de un dispositivo denominado densitómetro situado corriente abajo. Este dispositivo registra la concentración del colorante o del indicador en la sangre después de la inyección de una muestra del mismo corriente arriba. Curva de dilución del indicador Figura 28 36 Mediante la toma de muestras continuas de sangre se puede obtener una gráfica de tiempo-concentración, conocida como curva de dilución del indicador. Una vez representada dicha gráfica, el gasto cardíaco se puede calcular utilizando la ecuación de Stewart-Hamilton : GC = I x 60 Cm x t x 1 k Donde : GC I 60 Cm t K = = = = = = gasto cardíaco (l/min.) cantidad de colorante inyectado (mg) 60 seg./min. concentración media del indicador (mg/l) duración total de la curva (seg.) factor de calibración (mg/ml/mm de deflexión) Este método de medición del gasto cardíaco es más exacto en las situaciones de gasto cardíaco alto. Para realizar adecuadamente esta técnica se precisa un equipamiento complejo y, por tanto, resulta poco práctico en la clínica. Método de termodilución A principios del decenio de 1950, Fegler describió por primera vez la medición del gasto cardíaco por el método de termodilución, pero hubo que esperar hasta el decenio de 1970 para que los Dres. Swan y Ganz demostrar la fiabilidad y reproductibilidad de este método utilizando un catéter especial de arteria pulmonar con sensor de temperatura. Desde entonces, el método de termodilución para la medición del gasto cardíaco se utiliza de forma estándar en la práctica clínica. El método de termodilución aplica los principios de dilución del indicador, utilizando como tal el cambio de temperatura. Se inyecta rápidamente, en la luz de aurícula derecha del catéter, una cantidad conocida de solución a una temperatura conocida. Esta solución, más fría que la sangre, se mezcla con la sangre circundante y la enfría, y la temperatura se mide corriente abajo en la arteria pulmonar por medio de un termistor incluido en el catéter. A continuación se representa el cambio resultante de la temperatura en una curva de tiempotemperatura, similar a la obtenida con el método de dilución del indicador. La curva normal característica muestra una subida brusca en el momento de inyección rápida de la solución, seguida por una curva suave y una pendiente hacia abajo ligeramente prolongada hasta recuperar la situación basal. Dado que esta curva representa un cambio desde la temperatura más caliente hasta la más fría y de nuevo hasta la más caliente, su verdadera dirección sería negativa aunque, para mostrarla como la mayor parte de las gráficas, se presenta en sentido positivo. El área bajo la curva es inversamente proporcional al gasto cardíaco. 37 Cuando el gasto cardíaco es bajo se necesita más tiempo para que la temperatura recupere su valor basal, por lo que el área bajo la curva es mayor. Cuando el gasto cardíaco es alto, el inyectado frío es transportado con mayor rapidez a través del corazón, y la temperatura se recupera antes. Ello hace que el área bajo la curva sea menor. Gasto cardíaco normal Figura 29 Gasto cardíaco bajo Figura 30 Gasto cardíaco alto Figura 31 38 Para calcular el gasto cardíaco se utiliza una ecuación de Stewart-Hamilton modificada, considerando el cambio de temperatura como indicador ; las modificaciones consisten en la medición de la temperatura del indicador y de la temperatura de la sangre del paciente, junto con la densidad de la solución inyectada. CO = V x (TS - TI) A x (DI x CI ) 60 x C x K x (DS x CS) 1 Donde : GC = gasto cardíaco V = Volumen del inyectado (ml) A = área de la curva de termodilución en m2 dividida entre la velocidad del papel (mm/s) K = constante de calibración en mm/ºC TS, TI = temperatura de la sangre (S) y del inyectado (I) DS, DI = densidad de la sangre y del inyectado CS, CI = calor específico de la sangre y del inyectado (BI x CI) (DS x CS) = 1,08 cuando se utiliza dextrosa al 50 % 60 = 60 seg./min CT = factor de corrección para el calentamiento del inyectado La conexión del termistor del catéter se conecta a un ordenador o a un monitor, que realizan los cálculos y presentan los resultados en la pantalla. Algunos ordenadores y monitores presentan también la curva real de tiempo-temperatura del gasto cardíaco. Mediante la observación de dicha curva real de termodilución es posible evaluar la técnica de inyección y la presencia de artefactos. El inyectado puede estar helado o a temperatura ambiente. Los datos existentes sugieren que la variabilidad en las mediciones del gasto cardíaco será menor si se utilizan soluciones heladas. El ordenador registra un cambio (señal) en la temperatura con relación a la basal del paciente (ruido). En algunas situaciones se puede producir una variación de 0,05ºC con la respiración. Ello hace disminuir la relación “señal-ruido” y puede producir un valor de gasto cardíaco anormalmente bajo. En otros procesos existe un aumento de la relación señal-ruido que puede ser beneficioso, como ocurre en los pacientes febriles, en situaciones de gasto cardíaco bajo y en pacientes con amplias variaciones respiratorias. 39 Existen dos sistemas principales de aporte del inyectado. Uno es un sistema abierto que utiliza jeringas previamente cargadas, ya sea con solución helada o a temperatura ambiente. El otro es un sistema cerrado, ya sea para solución helada o a temperatura ambiente, que se mantiene en un asa cerrada para reducir las entradas múltiples en un sistema estéril. El usuario puede consultar las referencias sobre la utilización del sistema de inyección cerrado en comparación con el abierto. Sistema de inyección cerrado, frío Figura 32 Las situaciones en las que el método de termodilución puede producir resultados no fiables son aquellas en las que existe un flujo retrógrado de sangre en el lado derecho del corazón : regurgitación de la válvula tricúspide o pulmonar y comunicaciones interventriculares o interauriculares. Las ventajas de esta técnica sobre los otros métodos antes mencionados son su fiabilidad y su facilidad de realización a la cabecera del paciente. Asimismo, la posibilidad de realizar determinaciones seriadas del gasto cardíaco, cada minuto aproximadamente, sin necesidad de tomar muestras de sangre. 40 El catéter de termodilución Swan-Ganz constituye una poderosa herramienta de evaluación y tratamiento en el paciente crítico. La utilización del catéter no constituye en sí misma una intervención. Por el contrario, se trata de una ayuda diagnóstica que, si se utiliza adecuadamente y se interpretan correctamente los datos obtenidos, permite realizar las intervenciones terapéuticas adecuadas. APLICACIONES CLINICAS Evaluación del rendimiento cardíaco Mediante la utilización del catéter de Swan-Ganz se puede evaluar la capacidad del corazón para funcionar como una bomba. Al final de la diástole, en la mayor parte de las situaciones, la precarga ventricular está reflejada indirectamente en sus aurículas respectivas. La precarga ventricular izquierda se puede evaluar observando la PDAP o, más exactamente, la PEAP, ya que, mientras el catéter está enclavado, refleja las presiones del corazón izquierdo. Al deteriorarse la función ventricular izquierda, la presión telediastólica (precarga) aumenta. Este aumento se refleja de forma retrógrada en la aurícula donde, en el caso del corazón izquierdo, la PEAP también será más alta. En consecuencia, el gasto cardíaco disminuirá y clínicamente el paciente mostrará signos de mala perfusión orgánica. Antes se pensaba que la función del corazón izquierdo se podía evaluar mediante la determinación de la presión venosa central (PVC). En aquellos momentos, el único medio de monitorización existente era el catéter de PVC. Desde la utilización del catéter de arteria pulmonar, este concepto de la PVC como medio de monitorizar la presión del corazón izquierdo ha sido descartado. Mediante la utilización de la puerta de aurícula derecha (AD) de un catéter de triple luz en lugar de una línea venosa central se puede evaluar el estado de la precarga ventricular derecha (VD). El aumento de la precarga VD, como consecuencia de enfermedad pulmonar grave o de disfunción del VD, se reflejará en una presión elevada en AD. Existen ciertos procesos pulmonares y enfermedades del corazón derecho en los que sólo serán anormales las presiones de ese lado. También aquí el catéter de PVC resulta inadecuado para evaluar la función ventricular izquierda. Con la utilización de un catéter Swan-Ganz de triple luz se puede evaluar la función ventricula r tanto derecha como izquierda. La información obtenida a partir de la PEAP refleja la función del corazón izquierdo, mientras que la luz de AD permite conocer la función del corazón derecho. En condiciones de insuficiencia cardíaca izquierda grave e insuficiencia cardíaca derecha secundaria, estarán elevados ambos valores. Significación de las mediciones hemodinámicas Los determinantes del rendimiento cardíaco son la frecuencia cardíaca (FC), la precarga, la poscarga y la contractilidad. La monitorización hemodinámica no sólo permite determinar el gasto cardíaco sino que, mediante cálculos indirectos, se pueden evaluar otros factores del rendimiento. 41 Mediciones directas La evaluación hemodinámica del paciente puede incluir tanto parámetros invasivos como no invasivos. A partir de las mediciones directas se pueden calcular parámetros derivados para lograr una evaluación más completa del rendimiento cardíaco. • Frecuencia cardíaca Uno de los valores más fáciles de obtener en la evaluación del estado hemodinámico es la frecuencia cardíaca. Como componente del gasto cardíaco, la frecuencia cardíaca constituye una parte integral del tiempo de llenado diastólico y, por tanto, del volumen telediastólico. La frecuencia cardíaca se puede obtener por palpación o a partir del monitor de ECG. • Presiones arteriales sistólica y diastólica La tensión arterial es la presión medida en el interior de los vasos sanguíneos durante la sístole y la diástole ventricular. Este medición se puede hacer de forma indirecta con un esfigmomanómetro o con más exactitud mediante un catéter intraarterial. • Presiones de arteria pulmonar Con la utilización del catéter de Swan-Ganz se pueden obtener las presiones sistólica y diastólica en arteria pulmonar, así como la presión de enclavamiento de arteria pulmonar. La PSAP refleja la presión generada por el VD durante la sístole. La PDAP refleja la presión diastólica más alta existente en el árbol vascular pulmonar. Una vez enclavado el catéter, se ocluyen las influencias del corazón derecho y pulmonares, con lo que se reflejan las presiones de la aurícula izquierda. • Presión de aurícula derecha Mediante la utilización de la luz de AD del catéter de Swan-Ganz se pueden obtener las presiones de llenado del ventrículo derecho, en mmHg en lugar de cm H2O, igual que con una línea venosa central. Esta cifra proporciona información acerca de la función del ventrículo derecho. • Análisis de las ondas La medición de las ondas “a” y “v” de los registros de AD y de PEAP proporcionan valiosa información acerca de las presiones de llenado y de los procesos patológicos. 42 • Gasto cardíaco Mediante la utilización del catéter de termodilución se pueden realizar mediciones del gasto cardíaco a la cabecera del paciente con relativa facilidad y exactitud. La cantidad de sangre bombeada por el corazón, en l/min., proporciona una evaluación global del rendimiento cardíaco. Parámetros derivados A partir de las mediciones directas obtenidas se pueden calcular parámetros derivados para realizar una evaluación más completa del rendimiento cardíaco, y normalizar los valores obtenidos según el tamaño corporal. • Presión arterial media Es el promedio de la presión en el sistema vascular durante la sístole y la diástole. El mantenimiento de una presión mínima es necesario para la perfusión de las arterias coronarias y de los tejidos. Este valor se puede calcular electrónicamente o de forma aproximada mediante la siguiente fórmula : PAM = PAM normal PAS + (PAD x 2) 3 = 70 a 105 mmHg Donde : PAS PAD PAM = Presión arterial sistólica = Presión arterial diastólica = Presión arterial media • Índice cardíaco Los límites normales del gasto cardíaco son amplios, desde 4 l/min. hasta 8 l/min. Dado que este valor sirve para evaluar la función del ventrículo, su normalización según el tamaño corporal ofrecerá una información más precisa. Para hacer un índice del valor hemodinámico, se calcula la superficie corporal (SC) del paciente a partir de un nomograma en el que figuran el peso y la talla. Cualquier valor a normalizar se dividirá entre la SC. GC SC = 2,5 a 4,0 l/min./m2 IC = IC normal Donde : GC SC IC = = = Gasto cardíaco Superficie corporal Índice cardíaco 43 • Volumen sistólico Es la cantidad de sangre bombeada por el ventrículo en una contracción. Dado que el volumen sistólico es parte de la ecuación del gasto cardíaco, su valor se puede calcular matemáticamente. VS = GC x 1000 ml / L FC VS normal = 60 a 100 ml/latido Donde : GC = Gasto cardíaco FC = Frecuencia cardíaca VS = Volumen sistólico • Índice de volumen sistólico Al igual que con el gasto cardíaco, el VS también se puede normalizar según el tamaño corporal del paciente, lo que también se conoce como índice sistólico (IS). Hay dos formas de obtener este valor : VS IC o SC FC IVS = IVS normal = 33 a 47 mm/latido/m2 Mediante el cálculo del VS o del IVS se puede obtener alguna indicación sobre el estado de la contractilidad. • Resistencia vascular Otra variable de la función ventricular es la resistencia vascular. La resistencia es la relación entre presión y flujo. Al fluir la sangre por el árbol vascular se produce resistencia. Este valor es la representación clínica de la poscarga, el grado de resistencia que el ventrículo debe vencer para impulsar el volumen de sangre. Cada ventrículo debe vencer la poscarga de sus respectivos circuitos. • Resistencia vascular sistémica La resistencia vascular sistémica (RVS) mide la poscarga o resistencia para el ventrículo izquierdo. Dado que la resistencia relaciona la presión con el flujo, la presión se calcula midiendo el gradiente entre el principio del circuito (PAM) y el final (Aur. Der.). A continuación se divide este valor entre el flujo o gasto cardíaco. Se utiliza un factor de conversión de 80 para ajustar el valor a unidades de fuerza ; dinas-seg-cm-5RVS = RVS normal 44 = (PAM - P. Aur. Der.) x 80 GC 800 a 1200 dinas/seg./cm-5 • Resistencia vascular pulmonar La poscarga del ventrículo derecho se mide clínicamente calculando la resistencia vascular pulmonar (RVP). También aquí se mide el gradiente del circuito, PMAP menos PEAP, y a continuación se divide entre el flujo o gasto cardíaco. De nuevo se multiplica por el factor de conversión de 80 para pasar a unidades de fuerza. RVP = (PMAP - PEAP) x 80 GC RVP normal = < 250 dinas/seg./cm-5 Donde : PMAP = Presión media en arteria pulmonar PEAP = Presión de enclavamiento en arteria pulmonar • Trabajo sistólico Otra forma de evaluar la función ventricular es la medición del trabajo externo del ventrículo en una contracción. Este valor se puede calcular obteniendo la presión promedio generada por un ventrículo durante un latido cardíaco y multiplicándola por la cantidad de sangre impulsada durante un latido cardíaco. Para convertir la presión en trabajo se utiliza otro factor, 0,0136. En muchos centros se normaliza este valor según la SC, y también se puede evaluar el índice de trabajo sistólico para cada ventrículo. TS = (PAM - PTDVI) x VS x 0,0136 Donde : PAM = Presión arterial media PTDVI = Presión telediastólica del ventrículo izquierdo ITSVI = IVS (PAM - PEAP) x 0,0136 ITSVI normal = 45 a 75 gm-m/m2/latido Donde : IVS = Índice de volumen sistólico PAM = Presión arterial media PEAP = Presión de enclavamiento de arteria pulmonar ITSVD = IVS (PMAP - PADM) x 0,0136 ITSVI normal = 5 a 10 gm-m/m2/latido Donde : IVS = Índice de volumen sistólico PMAP = Presión media en arteria pulmonar PADM = Presión arterial derecha media 45 En la actualidad se diseñan numerosos sistemas nuevos de monitorización destinados a proporcionar al médico toda la gama de parámetros derivados. Los parámetros directos fundamentales, que sirven de base para la mayor parte de los parámetros calculados, son el gasto cardíaco, la tensión arterial media y las presiones de arteria pulmonar. La incorporación de estos valores a la base de datos junto con la evaluación clínica del paciente puede ayudar a ajustar con exactitud la respuesta fisiológica a las intervenciones terapéuticas, así como al diagnóstico diferencial. UTILIZACION DEL CATETER DE SWAN GANZ PARA EL DIAGNOSTICO DIFERENCIAL Los parámetros hemodinámicos no sólo ayudan a evaluar el estado de la función ventricular, sino que también proporcionan importante información para ayudar al diagnóstico diferencial en aquellos casos en que la presentación clínica es muy parecida. La utilización de los valores obtenidos puede ayudar también a “subclasificar” el estado del paciente para dirigir la terapéutica y emitir pronósticos. Situaciones de gasto bajo Durante las situaciones de gasto bajo, muchos pacientes presentan presión arterial baja, valores bajos del gasto cardíaco y signos de mala perfusió n tisular. La monitorización hemodinámica permite identificar con exactitud el proceso. Si el paciente está hipovolémico, la PA y el GC serán bajos. Además de estos valores inferiores a lo normal, la PEAP será baja. El paciente con un posible shock cardiogénico también tendrá una PA baja y un GC bajo, pero la PEAP será alta. El infarto de ventrículo derecho es otro proceso con PA y GC bajos. Dado que la disfunción se sitúa en el lado derecho, las elevaciones de las presiones de llenado del VD se registrarán como presiones elevadas en la AD. Si no existe afectación del ventrículo izquierdo, la PEAP será normal o incluso baja. Subgrupos hemodinámicos en el infarto agudo de miocardio (Clasificación de Forrester)* Indicaciones PEAP Tratamiento Mortalidad SUBGRUPO Y (sin insuficiencia) Índice cardíaco superior a 2,2 L/MIN/M2 Inferior a 18 mmHg Sedación 3% SUBGRUPO II Congestión pulmonar Índice cardíaco superior a 2,2 L/MIN/M2 Superior a 18 mmHg Presión arterial normal: Diuréticos Presión arterial elevada: Vasodilatadores 9% SUBGRUPO III Hipoperfusión periférica Índice cardíaco inferior a 2,2 L/MIN/M2 Inferior a 18 mmHg Frecue. cardíaca elevada: Añadir volumen Frecue. cardíaca deprimida: Marcapasos 23 % SUBGRUPO IV Congestión e hipoperfusión Índice cardíaco inferior a 2,2 L/MIN/M2 Superior a 18 mmHg Presión arterial deprimida: Inotropos Presión arterial normal : Vasodilatadores 51 % * Con autorización de James S. Forrester, M.D., Director Adjunto de Cardiología, Cedars-Sinai Medical Center, Los Angeles, California. 46 El infarto agudo de miocardio puede producir cuatro subgrupos hemodinámicos diferentes. James Forrester (ref. 13) estudió la relación entre índice cardíaco, como medición de la hipoperfusión periférica, y presión de enclavamiento de arteria pulmonar como medio para evaluar la congestión pulmonar. Mediante la obtención de estos valores y la colocación del paciente en el subgrupo adecuado, se pueden fijar con más exactitud los objetivos terapéuticos. Los subgrupos también se pueden utilizar para hacer valoraciones pronósticas. Dos complicaciones importantes del infarto de miocardio, la insuficiencia mitral aguda y la comunicación interventricular aguda, tienen una presentación clínica similar, con un gasto cardíaco bajo. Estas complicaciones se pueden diferenciar mediante el catéter de termodilución de Swan-Ganz. También es posible evaluar el efecto del tratamiento. Insuficiencia mitral aguda : antes de nitroprusiato Figura 33 La insuficiencia mitral aguda se puede detectar observando la forma de la onda de la PEAP. Como consecuencia de la incompetencia de la válvula, durante la fase de llenado auricular se observará una gran onda “v” de regurgitación. El tratamiento farmacológico típico comprende la utilización de una sustancia que disminuya la poscarga, como es el nitroprusiato sódico. Al reducirse la poscarga, aumenta el flujo anterógrado procedente del ventrículo, lo que a su vez hace que disminuya el flujo retrógrado. Esta mejoría se observa como una disminución de la elevación de la onda “v”. 47 Insuficiencia mitral aguda : después de nitroprusiato Figura 34 La comunicación interventricular (CIV) aguda también puede producir un gasto cardíaco bajo cuando el volumen de sangre procedente del ventrículo izquierdo pasa por la comunicación al ventrículo derecho. Este “shunt” hace que se eleve la saturación de oxígeno en el ventrículo derecho y en la arteria pulmonar. Mediante la determinación de los valores de saturación en la AP se puede detectar la CIV. En los casos graves, también se puede observar la elevación resultante de la onda “v” durante el registro de enclavamiento, y que se debe al aumento del volumen de sangre procedente del ventrículo izquierdo, que se registra como una elevación durante el llenado auricular. La cronología de la onda “v” resulta útil para identificar la causa. Durante la regurgitación de la válvula mitral, la onda “v” aparece más próxima a la onda “a”. En la CIV, la elevación de la onda “v” guardará una relación cronológica normal con la onda “a”. Al igual que en la insuficiencia de la válvula mitral, las sustancias que disminuyan la poscarga serán beneficiosas mientras que la resistencia sistémica sea superior a lo normal. CIV Figura 35 48 Los parámetros hemodinámicos permiten diferenciar entre disfunciones de origen cardíaco y pulmonar. Procesos como la hipertensión pulmonar, con independencia de su causa, mostrarán elevaciones de la PSAP y de la PDAP. Dado que el catéter enclavado permite evaluar con mayor exactitud la función del ventrículo izquierdo, las cifras de enclavamiento serán normales si no existe una enfermedad ventricular concurrente. Procesos como el taponamiento cardíaco y la pericarditis constrictiva pueden presentar alteraciones hemodinámicas previas a las manifestaciones clínicas. Aunque ambos procesos pueden producir igualamiento de las presiones diastólicas, la identificación de la forma de la onda ayuda a diferenciarlos. El taponamiento cardíaco muestra clásicamente una pérdida del seno “y” en el registro de enclavamiento o de la AD, como consecuencia de la elevación de las cifras diastólicas. En la pericarditis constrictiva existe un seno “y” exagerado, debido al rápido llenado diastólico como consecuencia de la rigidez del pericardio. Taponamiento cardíaco Figura 36 Pericarditis constrictiva 49 Figura 37 50 La monitorización hemodinámica invasiva también se ha utilizado con éxito en la evaluación preoperatoria de los pacientes de alto riesgo. Con la obtención de diversos parámetros se puede optimizar la función ventricular antes de la intervención quirúrgica. Del Guercio (ref. 11) ha desarrollado un sistema de estadificación preoperatoria basado en la monitorización hemodinámica invasiva. En consecuencia, los pacientes incluidos en el grupo de afectación moderada o intensa mostraron mejores tasas de supervivencia después del ajuste fisiológico fino que los pacientes sin afectación moderada o intensa. RESULTADOS DE LOS PACIENTES Evaluación N % Tratamiento 1. Normal 20 13,5 Cirugía según lo planeado 2. Alteración leve 3. Moderada Porcentaje de supervivencia 100 % Monitorización intraoperatoria avanzada 94 63,5 4. Alteración grave Ajuste fisiológico fino y monitorización intraoperatoria Intervención quirúrgica restringida (n = 7) 34 23 Cirugía cancelada (n = 19) Cirugía según lo planeado (n = 8) 91,5 % 100 % * 0% * Cirugía cancelada ; no incluida en el porcentaje de supervivencia. En casi todas las condiciones clínicas, la presión de enclavamiento de arteria pulmonar refleja con exactitud la presión auricular izquierda que, a su vez, refleja con exactitud la PTDVI. La evaluación clínica de la precarga, el volumen telediastólico ventricular izquierdo, medida a través de la lectura del enclavamiento, tiene algunas limitaciones. Se sabe que existen situaciones clínicas en las que se producen discrepancias entre el verdadero VTDVI y la PTDVI. Existen también ciertos procesos en los que las PEAP no reflejan con exactitud la PTDVI. En la siguiente sección se identificarán estas situaciones y procesos en los que el empleo de las cifras de enclavamiento como indicador de la precarga ventricular izquierda puede resultar inexacto. Estas situaciones de discrepancia se comentan para que el clínico realice una valoración más realista y específica de los valores obtenidos en cada paciente. 51 LIMITACIONES DE LA MONITORIZACION HEMODINAMICA Volumen telediastólico frente a presión telediastólica ventricular izquierda En el apartado de fisiología cardíaca aplicada se comentó que, debido en parte a la complianza ventricular, la relación entre presión y volumen adopta la forma de una curva. Cuando disminuye la complianza del ventrículo y éste se hace, por tanto, más rígido, la misma cantidad de volumen genera una presión más alta. Cuando la complianza del ventrículo es mayor ocurre lo contrario. Cuando el ventrículo se hace menos rígido, es capaz de contener más volumen con menos presión. La identificación de las condiciones que modifican la complianza dará más validez a los resultados obtenidos. Factores que afectan a la complianza ventricular Disminución de la complianza Aumento de la complianza Isquemia Hipertrofias VI graves Miocardiopatías restrictivas Situaciones de shock Efectos del aumento de la RVP Reductores de la poscarga Miocardiopatías Mejoría de la isquemia Presión de enclavamiento de arteria pulmonar frente a presión telediastólica ventricular izquierda Dado que el enclavamiento refleja en realidad las presiones de llenado de la aurícula izquierda, para que los resultados obtenidos sean exactos es preciso que no existan oclusiones entre el extremo del catéter de AP y el ventrículo izquierdo. Procesos como estenosis de la válvula mitral, mixoma auricular izquierdo y enfermedades pulmonares producen una cierta oclusión entre el extremo y el ventrículo izquierdo. En estas condiciones, el enclavamiento no refleja la PTDVI, y mostrará un valor anormalmente más elevado que el de la verdadera PTDVI. La regurgitación de la válvula mitral es otra situación en que, debido a la elevación de la onda “v”, el monitor leerá una PEAP anormalmente alta. Tampoco aquí es un reflejo adecuado de la PTDVI. Existen situaciones en las que los registros de enclavamiento son menores que la PTDVI real. En procesos en los que la PTDVI está muy elevada, como ocurre cuando la complianza está muy disminuida, con presiones superiores a 25 mmHg, la PTDVI registrada será menor. Ello se debe en parte al aumento de la complianza del lecho vascular pulmonar, que refleja inadecuadamente las presiones elevadas. La regurgitación aórtica también puede producir un aumento de la PTDVI debido al flujo retrógrado. En las primeras fases, esta presión retrógrada no se refleja en su totalidad en la aurícula izquierda y, por último, en el enclavamiento. 52 Situaciones en las que la PEAP es mayor que la PTDVI • • • • Estenosis mitral Mixoma de aurícula izquierda Embolia pulmonar Regurgitación mitral Situaciones en las que la PAD es menor que la PTDVI • Disminución de la complianza del ventrículo izquierdo • PTDVI alta (> 25 mmHg) • Regurgitación aórtica Situaciones en las que la PAD no equivale a la PEAP (1-4 mmHg) • • • • • Aumento de la RVP Hipertensión pulmonar "Cor pulmonale" Embolia pulmonar Síndrome de Eisenmenger 53 Las variaciones respiratorias, la aplicación de PEEP y la zona pulmonar de localización del catéter puede dar lugar asimismo a valores inexactos. Se han propuesto tres métodos para obtener presiones con variaciones respiratorias. Durante el ciclo respiratorio normal, los cambios en las presiones intratorácicas se transmiten al catéter de Swan-Ganz. Como consecuencia, en la inspiración se registrarán presiones más bajas, mientras que en la espiración serán más altas. En el final de la espiración, las presiones intratorácicas están prácticamente equilibradas y los registros obtenidos en ese momento serán más exactos. Los monitores que presentan lecturas digitales pueden ser del tipo en que el valor mostrado es el promedio de un cierto período de tiempo. Se ha recomendado la obtención de registros manuales. Otra técnica consiste en realizar el promedio de las presiones obtenidas durante algunos ciclos respiratorios. Por regla general, los valores hemodinámicos se evalúan más como tendencias que como valores absolutos (refs. 5 y 35). Lozman (ref. 24) ha realizado estudios para demostrar la correlación de la PEAP con la PAI bajo diversos valores de PEEP. Aunque cada paciente responde de forma diferente a la PEEP, se mantiene una estrecha correlación entre PEAP y PAI hasta valores de PEEP de 12 cm y 15 cm. Para valores superiores, la elevada presión intratorácica se transmite al catéter produciendo una elevación anormal del enclavamiento registrado. La zona pulmonar en la que se localiza el extremo del catéter también desempeña un papel importante en la validez de las lecturas de enclavamiento, tanto en condiciones normales como en caso de utilización de PEEP. Las zonas del pulmón se identifican por las relaciones entre la presión del flujo de entrada (presión de arteria pulmonar), la presión del flujo de salida (presión venosa pulmonar) y la presión de los alvéolos circundantes. 54 En la zona 1, la presión alveolar es mayor que la presión arterial pulmonar y que la presión venosa pulmonar. En consecuencia, no existe flujo sanguíneo procedente del lecho capilar pulmonar colapsado. Dado que el catéter de SwanGanz está dirigido por el flujo, lo más probable es que no se sitúe en esta localización. La zona 2 pulmonar también tiene una presión alveolar superior a la presión venosa pulmonar, pero la presión arterial es lo bastante alta como para permitir el flujo sanguíneo. En casi todos los casos, esta localización proporcionará lecturas de enclavamiento adecuadas. Si se instaura PEEP con valores altos se puede incrementar la presión alveolar, lo que hará que la zona 2 se parezca más a la zona 1. La presión circundante más elevada se transmitirá de forma retrógrada hasta el catéter. La zona 3 es la mejor localización para el registro de las lecturas de enclavamiento de la arteria pulmonar. En esta zona, la presión venosa pulmonar es superior a la presión alveolar circundante, y todos los capilares están abiertos. En esta posición, el extremo del catéter suele estar por debajo del nivel de la aurícula izquierda, lo que se puede demostrar en una radiografía lateral de tórax. 55 Ciertas influencias mecánicas o técnicas pueden afectar también a la exactitud de los valores obtenidos. La colocación inadecuada del transductor, sistemas de presión infraóptimos, junto con interferencias eléctricas, pueden alterar el registro. Como ya se ha mencionado, el inflado excesivo del balón puede dar lugar también a valores erróneos. En muchas circunstancias, la optimización del sistema de presión y el manejo adecuado del sistema electrónico eliminarán estas dificultades Aunque la reseña de las limitaciones de la monitorización de arteria pulmonar parece grande, en el momento actual, el empleo del catéter de Swan-Ganz para evaluar con exactitud la función ventricular sigue siendo una de las herramientas de monitorización más fiables y accesibles de que se dispone. Los valores obtenidos, en manos del clínico experto, proporcionan información para una mejor evaluación de las condiciones del paciente y como guía para las intervenciones terapéuticas. Complicaciones Aunque no existen contraindicaciones absolutas para la utilización del catéter de Swan-Ganz, los catéteres permanentes conllevan ciertos riesgos y complicaciones generales. Casi todas se pueden eliminar o reducir si se está familiarizado con las técnicas de inserción, con el mantenimiento del catéter y con la historia del paciente. Los pacientes con antecedentes de hipertensión pulmonar y edad avanzada requieren un cuidado extremo durante la inserción y el enclavamiento del catéter para evitar la posibilidad de ruptura de la arteria pulmonar. Se recomienda que el tiempo de inflado del balón no sea superior a dos ciclos respiratorios, o 10 a 15 segundos. En estas situaciones se recomienda monitorizar la PDAP en lugar de la presión de enclavamiento. En los pacientes con bloqueo completo de rama izquierda, síndrome de WolffParkinson-White y malformación de Ebstein se debe prestar una atención especial a la monitorización electrocardiográfica durante la inserción del catéter. Aunque se pueden producir algunas alteraciones del ritmo, el catéter está diseñado para que sea menos rígido que los catéteres de cateterismo estándar y, por tanto, conlleva menos riesgos. 56 Otro medio de evaluar el estado hemodinámico del paciente consiste en la monitorización directa de la presión intraarterial. La utilización de un catéter intraarterial, un sistema de monitorización de presión y un transductor permite la observación continua de la presión arterial sistémica del paciente. Muchos amplificadores de monitorización son capaces de calcular la presión arterial media a partir de la onda arterial, cifra utilizada habitualmente para el cálculo de los parámetros hemodinámicos derivados. MONITORIZACION INTRAARTERIAL Los métodos indirectos de evaluación de la presión arterial son el esfigmomanómetro con manguito y los dispositivos doppler. Si se utilizan adecuadamente, estos métodos reflejan con exactitud la presión arterial en las personas sanas. Sin embargo, en las situaciones de gasto bajo puede proporcionar valores erróneos. Los cambios de la complianza vascular pueden alterar la transmisión de los ruidos de Korotkoff utilizados clásicamente para determinar la presión arterial por métodos auscultatorios. Se cree que los sonidos distintivos que se escuchan son el resultado de la vibración de la pared arterial durante el flujo intermitente desde el punto en que el manguito ha comprimido el segmento arterial. En condiciones óptimas, los métodos indirectos tienden a subestimar la presión sistólica y a sobrestimar la presión diastólica en unos 5 mmHg. En condiciones de alta resistencia vascular sistémica existe un aumento de la tensión de la pared. Esta situación puede disminuir la capacidad de vibración y, por tanto, disminuir la formación del ruido. Las situaciones que producen una resistencia vascular sistémica baja también pueden disminuir las vibraciones debido a la ausencia de flujo de sangre intermitente a través del segmento arterial ocluido. En ambas situaciones el manguito puede detectar una presión anormalmente baja, aunque la presión arterial sea en realidad más alta. El contorno del pulso arterial cambia durante su trayecto desde la raíz aórtica hasta la periferia. Estos cambios se deben en parte a la diferencia en cuanto a características elásticas de los diferentes puntos arteriales y, también, a la pérdida de parte de la energía cinética. Al hacerse la onda más distal, el latido se hace más brusco, con una mayor presión sistólica y una menor presión diastólica. Incluso con estos cambios, la presión arterial media sigue siendo la misma. 57 Componentes del pulso arterial Al igual que las ondas intracardíacas, las ondas arteriales son consecuencia de una función mecánica. Las ondas arteriales se producen después de la activación eléctrica del corazón. Cuando se evalúan las ondas arteriales junto con las ondas eléctricas, se observará primero la actividad eléctrica seguida por la actividad mecánica. Componentes del pulso arterial Figura 39 • Presión sistólica pico (PSP) La presión sistólica pico refleja la presión sistólica ventricular izquierda máxima. Esta fase comienza con la apertura de la válvula aórtica. En el registro se observa una subida brusca que refleja el flujo de sangre desde el ventrículo hasta el sistema arterial. Esta pendiente ascendente se conoce también como rama ascendente. • Escotadura dícrota Con una mayor presión en la aorta que en el ventrículo izquierdo, el flujo sanguíneo trata de equilibrarlas retrocediendo, lo que produce el cierre de la válvula aórtica. En el registro, el cierre de la válvula aórtica se observa como una escotadura dícrota. Este acontecimiento marca el término de la sístole y el comienzo de la diástole. 58 • Presión diastólica Este valor está relacionado con el nivel de retroceso del vaso o con el grado de vasoconstricción en el sistema arterial. Existe también una relación entre la presión diastólica y el tiempo diastólico durante el ciclo cardíaco. Durante la diástole debe haber un tiempo grande para que la sangre del sistema arterial drene hacia las pequeñas ramas arteriolares. Cuando la frecuencia cardíaca es más rápida y, por tanto, el tiempo diastólico es más corto, queda menos tiempo para el drenaje hacia las ramas más distales. El resultado es una presión diastólica más alta. Esta disminución de la presión durante la diástole recibe el nombre de rama descendente. • Escotadura anácrota Durante la primera fase de la sístole ventricular (contracción isovolumétrica) se puede observar una elevación presistólica, elevación que recibe el nombre de escotadura anácrota y que se produce antes de la apertura de la válvula aórtica. Esta onda sólo se observa típicamente en la monitorización central de la presión aórtica, en los registros de raíz aórtica o en algunas situaciones patológicas. • Presión del pulso La diferencia entre presión sistólica y diastólica recibe el nombre de presión del pulso. Los factores que pueden afectar a la presión del pulso son las modificaciones en el volumen sistólico, que se reflejan en la presión sistólica, y también los cambios de la complianza vascular, que se reflejan en la presión diastólica. Onda arterial Figura 40 59 Presión arterial media Este valor refleja la presión media en el sistema arterial durante un ciclo cardíaco completo de sístole y diástole. La sístole requiere una tercera parte del tiempo del ciclo cardíaco, mientras que la diástole necesita dos tercios. Esta relación cronológica se refleja en la ecuación para calcular la PAM. PAM = S + (D x 2) o D + PP 3 Donde : PAM S D PP ONDAS ARTERIALES EN EL DIAGNOSTICO DIFERENCIAL = = = = Presión arterial media Presión arterial sistólica Presión arterial diastólica Presión del pulso La monitorización continua de la presión arterial no sólo proporciona información relativa a dicha presión, sino que también permite evaluar el estado cardiovascular mediante la observación de las características de la onda. Ciertas situaciones clínicas pueden no resultar aparentes por la simple observación de los registros de arteria pulmonar. La observación de la onda arterial añade otra dimensión a la evaluación del paciente. La estenosis aórtica produce una onda de pulso pequeña, con un pico sistólico retrasado. Esta menor presión sistólica es el resultado del enlentecimiento de la eyección ventricular a través de la válvula aórtica estenótica. La escotadura dícrota a menudo no está bien definida, debido al cierre anormal de las hojas de la válvula durante el comienzo de la diástole. Dado que la presión sistólica es menor, estos pacientes muestran una presión del pulso estrecha. Estenosis aórtica Figura 41 60 La insuficiencia aórtica también se conoce como regurgitación aórtica. Esta situación se identifica clásicamente como una presión del pulso ancha. Durante la diástole, el ventrículo izquierdo recibe más flujo sanguíneo retrógrado debido a la incompetencia de la válvula. Este aumento del volumen sanguíneo se refleja en una presión sistólica pico más alta durante la siguiente sístole. Insuficiencia aórtica Figura 42 Las alteraciones del ritmo cardíaco también afectan al carácter de los registros arteriales. La fibrilación auricular, con su clásica irregularidad, produce ondas arteriales de amplitudes variables. Durante los episodios de complejos ventriculares prematuros, el acortamiento del tiempo de llenado diastólico también se observa como una disminución consiguiente de la amplitud sistólica. Fibrilación auricular Figura 43 61 El pulso alternante es una anormalidad consistente en la aparición de alteraciones regulares de la amplitud de las presiones sistólicas pico durante un ritmo sinusal normal. Este proceso puede ser consecuencia de alteraciones del calcio o de las fibras musculares del miocardio. El pulso alternante es un signo visual importante en los pacientes con insuficiencia ventricular izquierda grave. Clínicamente, las variaciones de la amplitud pueden ser difíciles de palpar en una arteria periférica. Pulso alternante Figura 44 Durante la inspiración, la presión intratorácica es menor, lo que da lugar a una mayor mezcla de sangre en la vascularización pulmonar. Por tanto, existe menos volumen sanguíneo en el lado izquierdo del corazón. Como consecuencia de este fenómeno, las presiones sistólicas pueden ser entre 3 y 10 mmHg más bajas durante la inspiración. Durante la espiración, el volumen sanguíneo que se había acumulado en el lecho pulmonar durante la inspiración es desplazado hacia el corazón izquierdo. Este aumento del volumen sanguíneo es el responsable de la elevación de las cifras de presión sistólica durante la espiración. Cuando la diferencia entre las presiones sistólicas durante la inspiración y la espiración es superior a 10 mmHg, la anomalía se conoce como pulso paradójico, fenómeno que puede ser causado por diversos procesos. 62 Entre los procesos más frecuentes se encuentran las inspiraciones excesivas, ya sea por causas relacionadas con el paciente, por causas fisiopatológicas y por enfermedades pericárdicas. El mecanismo de producción difiere según la etiología subyacente. Un mecanismo habitual es la alteración del retorno venoso al corazón derecho y los cambios en las presiones intratorácicas o intrapericárdicas. Pulso paradójico Figura 45 En el paciente crítico, la monitorización de la presión intraarterial no sólo proporciona un acceso fácil a la toma de muestras frecuentes de sangre arterial, sino que también ayuda al diagnóstico diferencial de ciertas situaciones. También es una herramienta que el médico experto puede utilizar para optimizar el tratamiento, así como para una evaluación rápida del paciente. 63 RESUMEN La medicina y la tecnología han avanzado mucho en los últimos decenios. Al tiempo que aumenta la sofisticación de la tecnología lo hacen los requisitos que debe cumplir el médico intensivista. El desarrollo del catéter de Swan-Ganz, desde el diseño de un simple balón inflable hasta la utilización de fibra óptica para evaluar la oxigenación, de los electrodos de estimulación para el tratamiento de la frecuencia cardíaca, y de un método para aisla r el rendimiento ventricular derecho, ha hecho necesaria una mejor comprensión del sistema cardiopulmonar. Con esta mejor comprensión surge la oportunidad de evaluar las condiciones del paciente y la respuesta a los tratamientos con más rapidez y con relativa facilidad. En los próximos decenios continuarán los rápidos avances tecnológicos, lo que proporcionará el clima necesario para ensanchar el conocimiento básico de todos los médicos dedicados a la atención del paciente crítico, y dará asimismo la oportunidad de revisar una vez más el arte y la ciencia de la monitorización hemodinámica. 64 BIBLIOGRAFIA 1. Armstrong, P. and Baigrie, R. Hemodynamic Monitoring in the Critically Ill. Harper and Rowe, Publishers, San Francisco, 1980. 2. Aubin, Erian. Arterial Lines: A Review. Critical Care Quarterly -Hemodynamic Monitoring, Aspen Systems Corp., 1979, pages 57-65. 3. Bolognini, V. The.Swan-Ganz® Pulmonary Catheter: Implications for Nursing. Heart and Lung, 3(4):976-981. 1976. 4. Buchbinder, N. and Ganz, W. Hemodynamic Monitoring: Invasive Techniques. Anesthesiology, 45:146-155, 1976. 5. Cengiz, M., et al. The effect of Ventilation on the Accuracy of Pulmonary Artery and Wedge Pressure Measurements. Critical Care Medicine, July 1983, pages 502-507. 6. Chulay, M. and Miller, T. The Effect of Brackrest Elevation on Pulmonary Artery and Pulmonary Capillary Wedge Pressures in Patients After Cardiac Surgery. Heart and Lung, 13(2):138-140, March 1984. 7. Conners, A.F., et al. Evaluation of Right Heart Catheterization in the Criticall Ill Patient Without Acute Myocardial Infarction. N. Engl. J. Med., 308:263-267, 1983. 8. Daily, E.K. and Schroeder, J.S. Hemodynamic Waveforms. C.V. Mosby Co., St. Louis, 1983. 9. Daily, E.K. and Schroeder, J.S. Techniques in Bedside Hemodynamic Monitoring, C.V. Mosby Co., St. Louis, 1985. 10. Daily, E.K. and Merch, J. Thermodilution Cardiac Outputs Using Room and Iced Temperature Injectate: Comparison with the Fick Method. Heart and Lung, 16(3):294-300, May 1987. 11. Del Guercio, L.R. and Cohn, J.D. Monitoring Operative Risks in the Elderly. JAMA, 243(13):1350-1355, 1980. 12. Eisenberg, P.R., et al. Clinical Evaluation Compared to Pulmonary Artery Catheterization in the Hemodynamic Assessment of Critically Ill Patients. Crit. Care Med., 12:549-553, 1984. 13. Forrester, J.S., et al. Medical Therapy of Acute Myocardial Infarction by Application of Hemodynamic Subsets. N. Engl. J. Med., 295:1356-1362, 1404-1413, 1976. 14. Gardner, R.M. Direct Blood Pressure Measurement--Dynamic Response Requirements. Anesthesiology, 54:227, 1981. 15. Guyton, A.C. Textbook of Medical Physiology. W.B. Saunders, Co., Philadelphia, 1981. 16. Hancok, E. On the Elastic and Rigid Forms of Constrictive Pericarditis. Am. Heart J., 100(6 - Part 1), December 1980. 17. Hathaway, R. The Swanz-Ganz® Catheter: A Review. Nurses Clinics of North America. 13(3):380-407, September 1978. 65 18. Hurst, J.W. The Heart. McGraw-Hill Book Co., New York, 1978. 19. Johnston, W.E., et al. Pulmonary Artery Catheter Migration During Cardiac Surgery. Anesthesiology, 64:258-262, 1986. 20. Kaplan, J. and Wells, P. Early Diagnosis of Myocardial Ischemia Using the Pulmonary Artery Catheter. Anesth. Analg., 69(11):789-793, November 1981. 21. Kaye, W. Invasive Monitoring Technique: Arterial Cannulation, Bedside Pulmonary Artery Catheterization, An Arterial Puncture. Heart and Lung, 12(4):395-424, July 1983. 22. Keeler, D.K., et al. Pulmonary Artery Wedge Pressure Measurement During Experimental Pulmonary Hypertension: Comparison of Techniques in Relation to Catheter Induced Hemorrhage. J. Cardiothorac. Anesth., 1:305-308, 1987. 23. Kennedy, G. et al. The Effects of Lateral Body Positioning on Measurements of Pulmonary Artery and Pulmonary Artery Wedge Pressures: Heart and Lung, 13(2):155-158, March 1984. 24. Little, R.C. Physiology of the Heart and Circulation. Yearbook Medical Publishers, Inc., Chicago, 1985. 25. Lozman, J. Correlation of Pulmonary Wedge and Left Atrial Pressures. Arch. Surgery, 109:270, 1974. 26. Meehan, P. Hemodynamic Assessment Using the Automated Physiologic Profile. Critical Care Nurse, January-February 1986, pages 29-46. 27. Morris, A., et al. Frequency of Technical Problems Encountered in the Measurement of Pulmonary Artery Wedge Pressure. Crit. Care Med., March 1984, pages 164-170. 28. Morris, A.H., et al. Frequency of Technical Problems Encountered in the Measurement of Pulmonary Artery Wedge Pressure. Crit. Care Med., 12:164-170, 1984. 29. Nelson, L.D., et al. Patient Selection for Iced versus Room Temperature Injectate for Thermodilution Cardiac Output Determinations. Crit. Care Med., 13(3):182-184, 1985. 30. Nelson, L.D., et al. Incidence of Microbial Colonization in Open versus Closed Delivery Systems for Thermodilution Injectate. Crit. Care Med., 14(4):291-293, 1986. 31. Palmer, P.N. Advanced Hemodynamic Assessment. Dimensions of Critical Care Nursing, 1(3):139-144, 1982. 32. Phillip, C. Think Transmural. Critical Care Nurse, March-April 1982, pages 36-44. 33. Rao, T.L.K., et al. Reinfarction Following Anesthesia in Patients with Myocardial Infarction. Anesthesiology, 59(18):499-505, 1983. 66 34. Raper, M. and Sibbald, W. Misles by the Wedge? The Swan-Ganz® Catheter in Left Ventricular Preload. Chest, 89(3):427-434, March 1986. 35. Riedinger, et al. Reading Pulmonary Artery and Pulmonary Capillary Wedge Pressure Waveforms with Respiratory Variations. Heart and Lung, 10(4), July-August 1981. 36. Russell, R.O. and Rackley, C.E. Hemodynamic Monitoring in a Coronary Intensive Care Unit. Futura Publishing Co., New York, 1974. 37. Schroeder, J.S. (ed). Invasive Cardiology, Cardiovascular Clinics, F.A. Davis Co., Philadelphia, 1985. 38. Sharkey, S. Beyond the Wedge: Clinical Physiology and the Swan-Ganz Catheter. Am J. Med., 83:111-122, July 1987. 39. Schellock, F.G. and Riedinger, M.S. Reproducibility and Accuracy of Using Room Temperature vs. Iced Temperature Injectate for Thermodilution Cardiac Output Determination. Heart and Lung, 12:175-176, 1983. 40. Shibutani, K. and Del Guercio, L.R.M. Preoperative Hemodynamic Assessment of the High Risk Patient. Seminars in Anesthesia, II (4): 231-240, 1983. 41. Smith, R. Invasive Pressure Monitoring. Am. J. Nurs. September 1978. 42. Snyder, J.V. and Pinsky, M.R. Oxygen Transport in the Critically Ill. Yearbook Medical Publishers, Chicago, 1987. 43. Sprung, C., (ed) The Pulmonary Artery Catheter, Methodology and Clinical Applications, University Park Press, Baltimore, 1983. 44. Swan, H.J.C. Balloon Flotation Catheters: Their Use in Hemodynamic Monitoring in Clinical Practice. JAMA, 233:856-867, 1975. 45. Thys, D. Pulmonary Artery Catheterization: Past, Present and Future. The Mount of Sinai Journal of Medicine, 51(5):578-584, September 1984. 46. Tuchschmidt, J. and Sharma, O.M. Impact of Hemodynamic Monitoring in a Medical Intensive Care Unit. Crit. Care Med., 15(9):804-843, 1987. 47. Woods. S.L. Monitoring Pulmonary Artery Pressures. Am. J. Nurs., 76(11):1765-1771, 1976. 48. Yonkman, C.A. and B.H. Hamory. Comparison of Three Methods of Maintaining a Sterile Injectate System During Cardiac Output Determinations. Am. J. Injection Control, 12(5):276-281, 1984. 67 APENDICE 1 Parámetros hemodinámicos Fórmula del parámetro Valor normal Gasto cardíaco (GC) GC = FC x VS 4 - 8 l/min Indice cardíaco (IC) GC IC = SC Presión arterial media (PAM) PAS + (PAD x 2) PAM = 3 2,4 - 4,0 l/min/m2 70 - 105 mmHg Resistencia vascular pulmonar (RVP) (PMAP - PEAP) x 80 RVP = GC < 250 dinas/seg/cm-5 Resistencia vascular sistémica (RVS) (PAM - P. Aur. Der.) x 80 RVS = GC 800 - 1200 dinas/ceg/cm-5 Volumen sistólico (VS) GC x 1000 ml / l VS = FC Indice de volumen sistólico (IVS) VS IVS = SC 60 - 100 ml/latido 33 - 47 ml/latido/m2 Indice de trabajo sistólico ventricular izquierdo (ITSVI) ITSVI = IVS (PMAP - PEAP) x 0,0136 45 - 75 mg-m/m2/latido Presión de perfusión coronaria (PPC) PPC = PA diástólica - PEAP 60 - 70 mmHg Producto frecuencia por presión (PFP) PFP = FC x PA sistólica < 12000 Indice de trabajo sistólico ventricular derecho (ITSVD) ITSVD = IVS (PMAP - PAD) x 0,0136 5 - 10 gm-m/m2/latido Fracción de eyección (FE) FE = 68 VS VDE 0,67 Edwards Critical-Care Division Edwards © Copyright 1996 Edwards Corporation. 1