Sesion 9 - Página Personal de Jose Luis Mesa Rueda
Anuncio

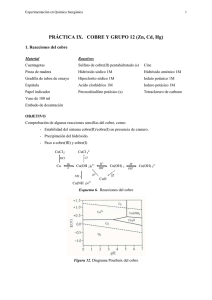
Experimentación en Química Inorgánica 1 PRÁCTICA XIII. COBRE Reacciones del cobre Material Reactivos Cuentagotas Sulfato de cobre(II) pentahidratado (s) Cinc Pinza de madera Hidróxido sódico 1M Hidróxido amónico 1M Gradilla de tubos de ensayo Hipoclorito sódico 1M Iodato potásico 1M Espátula Acido clorhídrico 1M Ioduro potásico 1M Papel indicador Peroxodisulfato potásico (s) Tetracloruro de carbono Vaso de 100 ml Embudo de decantación OBJETIVO Comprobación de algunas reacciones sencillas del cobre, como: - Estabilidad del sistema cobre(II)/cobre(I) en presencia de cianuro. - Precipitación del hidróxido. - Paso a cobre(III) y cobre(I) CuCl 2- CuCl 42Cl- HCl Cu Zn -e- Cu(OH 2)62+ NH 3 H+ OH - H+ CuO Cu(OH) 2 H+ OH - ∆ Cu(NH 3)42+ Esquema 6. Reacciones del cobre Figura 12. Diagrama Pourbaix del cobre Cu(OH) 42- Experimentación en Química Inorgánica 2 PROCEDIMIENTO Utilizar una disolución de sulfato de cobre(II) pentahidratado 1M. 1. Añadir hidróxido sódico 1M y posteriormente hidróxido sódico sólido. 2. Añadir hidróxido sódico sólido y hervir. 3. Añadir hidróxido amónico concentrado. 4. (En vitrina) Añadir hidróxido sódico 1M y después hipoclorito sódico. Acidular con HCl concentrado e identificar el gas liberado. 5. Añadir un trozo de cinc. 6. Calentar el sulfato de cobre pentahidratado sólido. 7. En un vaso de precipitados de 100 ml, disolver 100 mg de CuSO4.5H2O y 200 mg de KI, en aproximadamente 15 mL de agua destilada. En vitrina y utilizando un embudo de decantación, extraer el I2 formado en la reacción con 5 ó 6 porciones de 25 mL de CCl4. PREGUNTAS 1. Escriba todas las reacciones que tienen lugar en los diferentes ensayos. 2. ¿Qué has observado en el ensayo 6 y a qué lo atribuyes?. 3. ¿De que color es el CuI?. ¿En qué estado físico se obtiene?. 4. ¿Es anfótero el hidróxido de Cu(II)?. Experimentación en Química Inorgánica 3 PRÁCTICA XIV. GRUPO 12 (Zn, Cd, Hg) Reacciones de los elementos del grupo 12 Material Reactivos Cuentagotas Cinc Sulfato de cinc(II) Varilla de vidrio Hilo de cobre Acetato de cadmio(II) Espátula Sulfuro sódico Cloruro de mercurio(II) Vasos de 250 y 100 ml Ioduro potásico Ácido nítrico 1M Pinza de madera Ácido clorhídrico (%35) Pinza de metal Hidróxido de amonio (4M y 2M) Vidrio-reloj Ácido nítrico (concentrado) Papel indicador Hidróxido de sodio (4M y 2M) OBJETIVO Esta práctica tiene como objetivo analizar los siguientes puntos: - Propiedades ácido-base del cinc. - Precipitación de hidroxidos, sulfuros y yoduro. - Reacción redox del cobre. Zn +eH + Zn(OH 2)62+ H+ OH - Zn(OH) 2 Zn(OH) 24 ∆ H+ NH 3 H+ OH - ZnO Zn(NH 3)42+ ∆ ZnCO 3 Esquema. Reacciones del Cinc MEDIDAS DE PRECACUCIÓN Los compuestos de Cd y Hg son muy tóxicos, por lo que su manejo ha de realizarse con precaución, siempre utilizando guantes. Los residuos obtenidos tras realizar las reacciones deben depositarse en los recipientes habilitados para su recogida. Experimentación en Química Inorgánica 4 PROCEDIMIENTO 1. Tratar Zn (granalla) con unas gotas de HCl (conc), y por separado con unas gotas de HNO3 (conc) en dos tubos de ensayo distintos. 2. Colocar en diferentes tubos de ensayo disoluciones de ZnSO4, 0,1 M, Cd(AcO)2, 0,1 M y HgCl2, 0,1 M y añadir a cada una de ellas un pequeño hilo de cobre. Dejar reaccionar un periodo de tiempo largo. 3. Colocar en diferentes tubos de ensayo 2 mL de disoluciones de ZnSO4, 0,1 M, Cd(AcO)2, 0,1 M y HgCl2, 0,1 M y añadir a cada una de ellas gota a gota disolución de NaOH 2M con agitación. Tratar con exceso de reactivo concentrado los precipitados formados. 4. Repetir el ensayo anterior con hidróxido de amonio 2M. 5. Colocar en diferentes tubos de ensayo 2 mL de disoluciones de ZnSO4, 0,1 M, Cd(AcO)2, 0,1 M y HgCl2, 0,1 M y añadir a cada una de ellas gota a gota disolución de Na2S con agitación. Sobre los precipitados obtenidos añadir gota a gota HCl concentrado. En los casos en los que no haya redisolución añadir gota a gota HNO3 concentrado. 6. Colocar en diferentes tubos de ensayo 2 mL de disoluciones de ZnSO4, 0,1 M, Cd(AcO)2, 0,1 M y HgCl2, 0,1 M y añadir a cada una de ellas gota a gota disolución de KI con agitación. Sobre los precipitados obtenidos añadir exceso de reactivo. PREGUNTAS 1. ¿Qué ensayo utilizarías para identificar el estado de oxidación de una disolución que contenga mercurio? 2. ¿Por qué crees que la adición de HCl sobre una disolución de Hg22+ estabiliza el estado de oxidación +I mientras que la adición de NaOH o KCN conduce a su desestabilización? 3. Proponer dos métodos distintos para preparar Hg2Cl2. 4. Proponer una estrategia química que permita separar e identificar los iones Zn2+, Cd2+ y Hg2+ a partir de una disolución que contenga los 3. 5. ¿Por qué al adicionar Na2CO3 sobre una disolución de ZnSO4 se desprende CO2 mientras que al hacerlo sobre una disolución de CaCl2 no?.