Segundo ensayo parcial de química electivo. Química Común
Anuncio

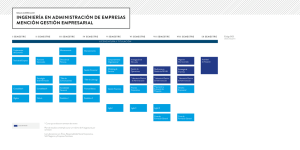
Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. Segundo ensayo parcial de química electivo. Para la resolución de algunos ejercicios propuestos en este módulo, se adjunta una parte de la tabla periódica de los elementos. Química Común 1. En el ión Cu+2, cuyo número atómico es 29, hay A) 29 protones y 29 electrones. B) 29 protones y 31 electrones. C) 29 protones y 27 electrones. D) 31 protones y 27 electrones. D) 29 protones y 31 electrones. www.preusm.cl – Coordinación de Química. Página 1 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 2. El Principio de Incertidumbre se refiere a que A) la física clásica y la cuántica no son aplicables al mismo tiempo. B) la física clásica sirve para investigar partículas subatómicas. C) la física cuántica describe perfectamente las variables y propiedades del electrón. D) los últimos modelos atómicos no están corroborados aún. E) para un electrón, su posición y cantidad de movimiento están sujetas a errores cuando se determinan simultáneamente. 3. La configuración electrónica del ión O-2 (Z=8) es A) 1s2 2s22p2 B) 1s2 2s22p3 C) 1s2 2s22p4 D) 1s2 2s22p5 E) 1s2 2s22p6 4. ¿Cuántos electrones desapareados presenta el átomo de Flúor (Z=9) en su configuración electrónica fundamental? A) B) C) D) E) 0. 1. 2. 3. 4. 5. Los números cuánticos n=3, l=1, corresponden a la notación: A) B) C) D) E) 3p 3s 3f 3d 1f www.preusm.cl – Coordinación de Química. Página 2 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 6. El número máximo de electrones en corresponden a: A) B) C) D) E) los subniveles s, p, d y f 0, 1, 2 y 3. 2, 6, 10 y 14. 4, 6, 8 y 10. 1, 2, 3 y 4. 2, 5, 7 y 9. 7. En un sistema periódico muy simplificado, como el que se muestra en la figura, los llamados gases nobles se sitúan en la zona señalada con el número A) B) C) D) E) 1. 2. 3. 4. 5. 8. ¿Cuál de las siguientes especies tiene mayor tamaño? A) B) C) D) E) Cl P S K Ar 9. La configuración electrónica de un elemento es esta única información se puede(n) determinar 1s 2 2s2 2p63s23p5 Con I) el grupo al que pertenece el elemento en la tabla periódica. II) el número atómico del elemento. www.preusm.cl – Coordinación de Química. Página 3 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. III) el período al que pertenece el elemento en la tabla periódica. Es(son) correcta(s) A) B) C) D) E) Sólo I Sólo II Sólo III Sólo I y II I, II y III 10. ¿Cuál(es) de los siguientes compuestos es (son) iónico(s)? I) CsCl II) BrCl III) CsBr Electronegatividades: Cesio (Cs): 0,7 Bromo (Br): 2,8 Cloro (Cl): 3 Es (son) correcta(s): A) Sólo I. B) Sólo II. C) Sólo I y II. D) Sólo I y III. E) I, II y III. 11. ¿Cuál opción expresa incorrectamente el significado del tipo de enlace entre dos átomos? A) Enlace covalente apolar: Igual compartición de los electrones del enlace. B) Enlace covalente polar: compartición de los electrones del enlace, pero más cercanos al átomo de mayor electronegatividad. C) Enlace covalente coordinado: donación de los electrones del enlace sin compartición. D) Enlace covalente: compartición de los electrones del enlace. E) Enlace iónico: cesión de electrones de un átomo a otro www.preusm.cl – Coordinación de Química. Página 4 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 12. Un enlace covalente cumple con una o más de las siguientes condiciones: I. Se forma entre átomos con gran diferencia de electronegatividad. II. Se forma por compartición de electrones. III. Se forma exclusivamente entre átomos iguales. Es (son) correcta (s) A) B) C) D) E) Sólo I. Sólo II. Sólo III. Sólo I y II. I, II y III. 13. ¿Cuál es la notación de configuración electrónica 1s22s22p5? Lewis para un átomo X de 14. El conocimiento de las estructuras espaciales de las moléculas de agua, H2O, y de metano, CH4, permite inferir que I) el agua es polar y el metano es apolar. II) el metano debe tener mayor punto de ebullición que el agua. III) a temperatura y presión ambiente el metano es soluble en agua. Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y III. E) I, II y III. www.preusm.cl – Coordinación de Química. Página 5 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 15. ¿Cuál de los siguientes compuestos porcentaje de hierro? (PM Fe= 56) tiene el más alto A) FeS. B) FeO. C) Fe2O3. D) Fe3O4. E) FeCO3. 16. El número o constante de Avogadro corresponde al número de moléculas por A) 1 litro de materia. B) 1 mL de materia. C) 1 g de materia. D) 1 mol de materia. E) 22,4 litros de cualquier tipo de materia. 17. El agua se puede formar a partir de sus elementos según la ecuación: 2H2(g) +O2(g) 2H2O(g) Al hacer reaccionar 4 mol de H2 con 1 mol de O2, se forma A) 5 mol de agua. B) 4 mol de agua. C) 3 mol de agua. D) 2 mol de agua. E) 1 mol de agua. 18. El CaCO3 se descompone por calentamiento según la ecuación: CaCO3(g) →CaO(s) +CO2(g) ¿Qué masa de CaO se obtiene al descomponer totalmente 100 gramos de CaCO3? www.preusm.cl – Coordinación de Química. Página 6 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. A) 40 g. B) 44 g. C) 48 g. D) 56 g. E) 60 g. Química Mención 19. De los tubos de descarga no fue posible determinar A) los neutrones. B) que los rayos catódicos viajan en línea recta. C) las emisiones de rayos X. D) los rayos canales con carga positiva. E) los rayos catódicos con carga negativa. 20. “……… estableció la masa y carga del electrón en forma separada y con gran exactitud”. En la línea punteada debiera decir A) Thomsom B) Millikan C) Goldstein D) Wein E) Chadwick 21. ¿Qué opción ordena las emisiones radiactivas α, β y γ, según su poder de penetración en un sólido? A) B) C) D) E) γ<α<β γ<β<α α<β<γ β<γ<α β<α<γ 22. Un isótopo de un elemento determinado tiene una vida media de 500 años. Considerando una muestra inicial de 1,0 [g] de este isótopo, ¿qué cantidad permanece sin desintegrarse al cabo de 1500 años? www.preusm.cl – Coordinación de Química. Página 7 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. A) 0,500 [g] B) 0,250 [g] C) 0,125 [g] D) 0,062 [g] E) 0,031 [g] 23. Utilizando la tabla periódica, indique compuestos tiene mayor carácter iónico. cuál de los siguientes A) LiF B) KF C) CsF D) CaF2 E) BaF2 24. Utilizando la tabla periódica, ordene los siguientes compuestos en orden creciente de su punto de fusión. CaO ; MgO; NaF ; NaCl ; FrF A) MgO > CaO > NaCl > NaF > FrF B) CaO > MgO > NaCl > NaF > FrF C) FrF > NaF > NaCl > CaO > MgO D) MgO > CaO > FrF > NaF > NaCl E) FrF > NaF > NaCl > MgO > CaO 25. Los elementos 12 C, 13 Cy 14 C son ejemplos de A) isótopos. B) isóbaros. C) isótonos. D) isoelectrónicos. E) isómeros. 26. Señale que tipo de protección utilizaría para detener radiación gamma A) lamina de aluminio. B) hoja de papel. www.preusm.cl – Coordinación de Química. Página 8 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. C) la piel. D) hormigón. E) lámina de oro. 27. ¿Cuál (es) molécula (s) presenta (n) enlace covalente apolar? I. O2 II. H2O III. Cl2 Es (son) correcta(s): A) B) C) D) E) Sólo I Sólo II Sólo III Sólo I y II Sólo I y III 28. La estructura de Lewis para el fósforo (grupo VA) es: 29. ¿Cuántos pares no enlazantes presenta la molécula de amoniaco (NH3)? A) B) C) D) E) 1 2 3 4 5 www.preusm.cl – Coordinación de Química. Página 9 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 30. En una reacción de óxido-reducción siempre hay transferencia de I) electrones II) protones III) neutrones Es (son) correcta(s) A) B) C) D) E) sólo sólo sólo sólo sólo I II III I y II I y III 31. ¿Cuál(es) de las siguientes ecuaciones corresponde(n) a reacción(es) de óxido-reducción? I) NaOH + HCl ––––––> NaCl + H2O II) 2H2 + O2 ––––––> 2H2O III) NH3 + HCl ––––––> NH4Cl Es (son) correcta(s): A) B) C) D) E) Sólo I Sólo II Sólo I y II Sólo I y III I, II y III 32. El proceso electroquímico para obtener aluminio corresponde a la reacción de la bauxita (Al2O3), la que se representa por la ecuación 2 Al2O3 --> 4 Al + 3 O2 Al respecto, se puede afirmar que I) el óxido de aluminio se reduce y se oxida. II) el proceso es espontáneo. III) el aluminio es la materia prima del proceso. Es (son) correcta(s) www.preusm.cl – Coordinación de Química. Página 10 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. A) sólo I. B) sólo II. C) sólo III. D) sólo I y II. E) I, II y III. 33. ¿Cuál(es) de las siguientes un proceso de reducción? semirreacciones corresponde(n) a I) Cl2 + 2 e– ––––––> 2 Cl– II) Al ––––––> Al3+ + 3 e– III) MnO4– + 8 H+ + 5e– ––––––> Mn2+ + 4 H2O Es (son) correcta(s): A) B) C) D) E) Sólo Sólo Sólo Sólo Sólo I II III I y III II y III 34. ¿A cuántos moles equivalen 63 miligramos de ácido nítrico? (HNO3, PM = 63) A) 0,001 B) 0,01 C) 0,1 D) 1,0 E) 10 35. En el compuesto M2O3 cuyo peso molecular es 168, el peso atómico de M corresponde a (PA; O = 16) A) 60 B) 120 C) 48 D) 136 E) 152 www.preusm.cl – Coordinación de Química. Página 11 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 36. Al calentar clorato de potasio (KClO3) se descompone dando cloruro de potasio (KCl) y oxígeno (O2). Los gramos de oxígeno que se obtienen con la descomposición de 122,5 g. de KClO3 son PA: K = 39; Cl = 35,5; O = 16 A) B) C) D) E) 16 g. de oxígeno. 24 g. de oxígeno. 32 g. de oxígeno. 48 g. de oxígeno. 96 g. de oxígeno. 37. Si se calienta clorato de potasio (KClO3), éste se descompone produciendo cloruro de potasio y oxígeno molecular. La ecuación equilibrada que representa la descomposición del clorato de potasio es A) 2 KCl + 3 O2 ⎯⎯→ 2 KClO3 B) KClO3 ⎯⎯→ KCl + O2 C) 2 KClO3 ⎯⎯→ KCl + 3 O2 D) KClO3 ⎯⎯→ KClO + O2 E) 2 KClO3 ⎯⎯→ 2 KCl + 3 O2 38. A) B) C) D) E) Un enlace covalente coordinado o dativo se forma entre átomos con gran diferencia de electronegatividad. exclusivamente entre átomos iguales. cuando uno de los átomos aporta los electrones de enlace. por transferencia de electrones. cuando dos átomos tienen igual intensidad para atraer electrones. 39. ¿Cuál de los siguientes compuestos presenta enlace triple? A) CO2 B) NH3 C) SO2 D) HCN E) C3H8 www.preusm.cl – Coordinación de Química. Página 12 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. 40. Los isómeros son compuestos que poseen igual A) Nomenclatura B) Comportamiento químico C) Punto de fusión D) Masa molar F) Función orgánica 41. I) II) III) Para insaturar una solución saturada de solido en líquido, se puede Aumentar la temperatura Agregar más solvente Agregar más soluto Es (son) correcta(s): A) Solo I B) Solo II C) Solo III D) I y II E) I y III 42. Cuantos enlaces posee la molécula de urea H2N(CO)NH2 A) 3 B) 4 C) 5 D) 6 E) 7 43. La “anomalía” que presenta el agua en relación a los otros líquidos es que A) Disuelve a todos los sólidos y líquidos no importando su polaridad B) En estado líquido su densidad disminuye al enfriarla bajo los 10ºC C) En estado sólido presenta mayor densidad que en estado liquido D) Al enfriar el líquido, este comienza a dilatar a partir de los 4ºC www.preusm.cl – Coordinación de Química. Página 13 Preuniversitario Solidario Santa María 2° ensayo parcial, Electivo. E) Su densidad siempre disminuye al aumentar la temperatura 44. A 100ºC y 1 atmosfera de presión el agua líquida se transforma en gas. El fenómeno físico se denomina. A) Ebullición B) Condensación C) Solidificación D) Oxidación E) Sublimación www.preusm.cl – Coordinación de Química. Página 14