Metales no ferrosos - TECNOLOGÍA - LA SERNA
Anuncio

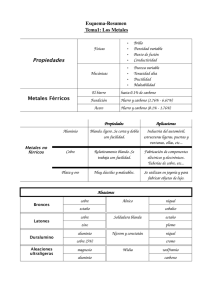
METALES NO FERROSOS Por: Cristian Sanz, Jorge de Iscar, Carlos Mateos, Carlos Iglesias y Daniel Penacho 2º Bachillerato B 19 de Noviembre de 2012 1 Metales no ferrosos 1. Cobre 1.1. Estructura atómica 1.2. Propiedades 1.3. Producción 1.4. Aleaciones 1.5. Tratamientos 1.6. Aplicaciones 1.7. Reciclaje 2. Aluminio 2.1. Estructura atómica 2.2. Propiedades 2.3. Producción 2.4. Aleaciones 2.5. Tratamientos 2.6. Aplicaciones 2.7. Reciclaje 3. Magnesio 3.1. Estructura atómica 3.2. Propiedades 3.3. Producción 3.4. Aleaciones 3.5. Aplicaciones 4. Titanio 4.1. Estructura atómica 4.2. Propiedades 4.3. Producción 4.4. Aleaciones 4.5. Tratamientos 4.6. Aplicaciones 5. Nuevas aleaciones. Fibra de Carbono 5.1. Estructura atómica 5.2. Propiedades 5.3. Aplicaciones 6. Nuevas aleaciones. Composite 6.1. Aplicaciones 7. Nuevas aleaciones. Kevlar 7.1. Tipos 7.2. Propiedades 8. Nuevas aleaciones. Fibra de vidrio 8.1. Propiedades 8.2. Aplicaciones Bibliografía 2 1. Cobre Se estima que el descubrimiento del cobre se produjo en el año 6.000 a.C. Desde épocas prehistóricas, el cobre había sido uno de los primeros metales usados por nuestros antecesores para fabricar herramientas y utensilios. Su uso fue tan importante, que incluso dio pie para que ambas épocas de la historia fueran conocidas como Edad de Cobre y Edad del Bronce. Hacia el 3000 a.C., los egipcios ya utilizaban el cobre en una variedad muy amplia de objetos creados para satisfacer las necesidades de la vida cotidiana. Asimismo, perfeccionaron el procedimiento de aleación del cobre y el estaño, mezcla de la cual se obtiene bronce. En la Edad Media se usó para fabricar principalmente piezas bélicas, tales como: hachas, espadas, cascos y corazas. 1.1 Estructura atómica En la tabla periódica de los elementos, el cobre tiene su propio símbolo, Cu. Su número atómico es 29, su masa atómica es 63,546u, su punto de fusión es de 1.080°C, su punto de ebullición es de 2.350°C, y es definido como un metal de transición, no ferroso. Tiene una estructura cristalina FCC. En la naturaleza se encuentran dos isótopos estables: 63Cu y 65Cu. Su configuración electrónica es: 1s2 2s2 2p6 3s2 3p6 4s2 3d9 1.2 Propiedades Propiedades físicas: El cobre posee varias, que propician su uso industrial en múltiples aplicaciones. Es de color rojizo y de brillo metálico, conductividad eléctrica y térmica. Es un material abundante en la naturaleza; tiene un precio accesible y se recicla de forma indefinida; forma aleaciones para mejorar las prestaciones mecánicas y es resistente a la corrosión y oxidación. Propiedades mecánicas: Tanto el cobre como sus aleaciones tienen una buena maquinabilidad, es decir, son fáciles de mecanizar. El cobre posee muy buena ductilidad y maleabilidad lo que permite producir láminas e hilos muy delgados y finos. Es un metal blando, con un índice de dureza 3 en la escala de Mohs y su resistencia a la tracción es de 210 MPa, con un límite elástico de 33,3 MPa. Admite procesos de fabricación de deformación como laminación o forja, y procesos de soldadura y sus aleaciones adquieren propiedades diferentes con tratamientos térmicos como temple y recocido. 1.3 Producción La extracción de cobre se puede hacer desde una mina al aire libre o desde una mina subterránea. La extracción subterránea: se realiza cuando un yacimiento presenta una cubierta de material estéril muy espesa, lo que hace que la extracción desde la superficie sea muy poco rentable. La extracción a rajo abierto: se hace cuando una mina presenta una forma regular y el mineral está ubicado en la superficie y el material estéril que lo cubre pueda ser retirado con facilidad. Se reduce la roca a un tamaño uniforme (chancado), se muele el material y se separa del mineral. Se eliminan otros minerales e impurezas (fundición), es decir, se refina. Los cátodos son despachados en trenes o camiones hacia a los principales mercados compradores. La metalurgia del cobre depende de que se presente en forma de sulfuros o de óxidos (cuproso u cúprico). Para los sulfuros se utiliza para producir cátodos la vía llamada pirometalurgia, que consiste en el siguiente proceso: Conminución del mineral, Concentración (flotación), fundición en horno, paso a convertidores, afino, moldeo de ánodos, electrorefinación, cátodo En cambio para los óxidos se utiliza la hidrometalurgia que consiste en el siguiente proceso: Mineral de cobre, lixiviación, extracción, electrólisis, cátodo 3 1.4 Aleaciones Latones: Cobre aleado con zinc, duro, fácil de mecanizar, resistente a la oxidación, a las condiciones salinas y es maleable. Bronces: Aleación de cobre y estaño, de color amarillento, difíciles de mecanizar. Cuproaluminios: Cobre aleado con aluminio, parecido al oro, buenas propiedades mecánicas, resistente a la corrosión. Cuproníqueles: Aleación con níquel, no corroe en agua de mar. Alpacas: Cobre aleado con níquel y zinc, buena resistencia a la corrosión y buenas cualidades mecánicas. 1.5 Tratamientos El cobre duro recocido se presenta muy bien para operaciones en frío como son: doblado, estampado y embutido. El recocido se produce calentando el cobre o el latón a una temperatura en un horno eléctrico de atmósfera controlada, y luego se deja enfriar al aire. Hay que procurar no superar la temperatura de recocido porque entonces se quema el cobre y se torna quebradizo y queda inutilizado. El refinado es un proceso controlado de oxidación seguida de una reducción. El objetivo de la oxidación es eliminar las impurezas contenidas en el cobre y se mejora la ductilidad y maleabilidad. Los tratamientos térmicos que se realizan a los latones son principalmente recocidos de homogeneización, recristalización y estabilización. Los latones con más del 35% de Zn pueden templarse para hacerlos más blandos. Los bronces habitualmente se someten a tratamientos de recocidos de homogeneización para las aleaciones de moldeo; y recocidos contra dureza y de recristalización para las aleaciones de forja 1.6 Aplicaciones El cobre forma parte del mundo que nos rodea debido a sus propiedades. El cobre refinado es transformado posteriormente en materia prima destinada a abastecer la industria de cobre, utilizado para el cableado de edificaciones, tuberías de agua y de gas, sistemas térmicos, techumbres y terminaciones. En el campo del transporte la presencia del cobre es muy importante. Este material está presente en automóviles, trenes, aviones, barcos e incluso en vehículos espaciales. Es utilizado en los motores, en los sistemas electrónicos y en los sistemas eléctricos. El cobre también es utilizado en compuestos destinados a la agricultura, por ejemplo para compensar la deficiencia de este elemento vital en los suelos o en los cultivos. 1.7 Reciclaje El cobre es uno de los pocos materiales que no se degradan ni pierden sus propiedades químicas o físicas en el proceso de reciclaje. Puede ser reciclado un número ilimitado de veces sin perder sus propiedades, siendo imposible distinguir si un objeto de cobre está hecho de fuentes primarias o recicladas. El reciclado del cobre no requiere tanta energía como su extracción minera. A pesar de que el reciclado requiere recoger, clasificar y fundir los objetos de metal, la cantidad de energía necesaria para reciclar el cobre es sólo alrededor de un 25% de la requerida para convertir el mineral de cobre en metal. 2. Aluminio El aluminio es un elemento químico extraído de un mineral llamado bauxita. Es el tercer elemento más abundante en la corteza terrestre formando un 8% de la corteza. 4 El aluminio se utilizaba en la antigüedad clásica en tintorería y medicina bajo la forma de una sal doble, conocida como alumbre y que se sigue utilizando. En el año 1825, el físico danés Hans Christian Ørsted, descubridor del electromagnetismo, consiguió aislar por electrólisis unas primeras muestras, bastante impuras. El aislamiento total fue conseguido dos años después por Friedrich Wöhler. Durante el siglo XIX, la producción era tan costosa que llegó a considerarse un material exótico, de precio desorbitado, y tan preciado como el oro y la plata. En el año 1889, Karl Bayer patentó un procedimiento para extraer la alúmina a partir de la bauxita, mientras que en el 1886, Paul Hérault y Charles Martin Hall habían patentado un proceso conocido como Hall-Hérault. Con estas nuevas técnicas la producción de aluminio se incrementó llegando a convertirse en el metal no ferroso más producido en la actualidad y perdiendo la categoría de metal exótico. 2.1 Estructura atómica El aluminio tiene 3 electrones de valencia, por ello, su estado de oxidación es 3. En la tabla periódica, se sitúa en el grupo 13, periodo 3. Su símbolo es Al y su número atómico es 13. Tiene una masa atómica de 26,9815386u y su configuración electrónica es: 1s2 2s2 2p6 3s2 3p1. En la naturaleza existen dos isótopos del aluminio, el 27Al, que es estable y el 26Al, que es radiactivo. El aluminio cristaliza en una estructura cristalina FCC (Cúbica Centrada en las Caras). 2.2 Propiedades Propiedades físicas: Es un metal ligero con poca densidad (2698,4kg7m3), su temperatura de fusión es 660C y su temperatura de ebullición de 2519C. Su calor específico es de 900 J/ K·kg. Su color natural es blanco y refleja bien la radiación electromagnética del espectro visible y térmico. Es un buen conductor eléctrico (36 m/ ·mm2) y térmico (80 a 230 W/ m·K). Es un material no ferromagnético. Propiedades mecánicas: Es un material blando (2,5 en la Escala de Mohs) y maleable. En estado puro tiene un límite de resistencia en tracción de 160 a 200 N/mm 2. Se pueden mejorar sus propiedades mediante aleaciones pudiendo llegar a alcanzar una resistencia mecánica de 690 MPa. Propiedades químicas: El aluminio es muy resistente a la corrosión. Forma con gran rapidez una fina capa de alúmina (Al2O3) debido a su estado de oxidación. Esta capa de óxido de aluminio es la que le da el color metálico. 2.3 Producción El aluminio es uno de los metales más caros en obtener. Los productores más destacados son China y Rusia. Una parte muy importante de la producción mundial es producto del reciclaje. La materia prima de la que se extrae el aluminio es la bauxita, un mineral rico en aluminio, entre un 20% y un 30% en masa. La obtención del aluminio se realiza en dos fases, la extracción de la alúmina a partir de la bauxita y la extracción del aluminio por electrólisis. El proceso Bayer comienza con el triturado de la bauxita y su lavado con una solución caliente de hidróxido de sodio a alta presión y temperatura. Los materiales no alumínicos se separan por decantación. Se enfría el hidróxido para que recristalice y se calcina a 1000C para formar alúmina. La alúmina obtenida tiene un punto de fusión de 2000C que hace imposible someterlo a un proceso electrolítico. Se disuelve en un baño de criolita, obteniendo una mezcla eutéctica con un punto de fusión de 900C. A continuación se somete a un proceso de electrolisis en el que se obtiene aluminio con una pureza de entre 99,5% a 99,9%. 2.4 Aleaciones El aluminio puro es un material blando y poco resistente a la tracción. Para mejorar sus propiedades mecánicas se alea con otros elementos. 5 Serie 1000 (99% Al): se trata de aluminio casi puro, con impurezas de hierro o cobre. Se utiliza para laminación en frío. Serie 2000 (Al + Cu): Con un tratamiento térmico adquiere una resistencia a la tracción de 442 MPa, que lo hace apto para su uso en estructuras de aviones. Serie 3000 (Al + Mn): El manganeso refuerza el aluminio y le da una resistencia a la tracción de 110 MPa. Se suele utilizar para fabricar componentes con buena mecanibilidad. Serie 5000 (Al + Mg): Alcanza una resistencia a la tracción de 193 MPa después del recocido. Serie 6000 (Al + Mg + Si): Con un tratamiento térmico alcanza una resistencia de 290 MPa, apta para perfiles y estructuras. Serie 7000 (Al + Zn): Sometido a un tratamiento térmico adquiere una resistencia de 540 MPa, apto para la fabricación de aviones. 2.5 Tratamientos. Al aluminio se le aplican varios tratamientos tanto térmicos como superficiales. El proceso de temple es un tratamiento térmico que aumenta la resistencia del aluminio. Hay dos procesos, el térmico en solución y el envejecimiento. El temple mediante envejecimiento consiste en hacer pasar los perfiles por hornos de maduración a 185C durante 240 minutos. Para un correcto enfriamiento debe producirse en menos de cuatro minutos. El aluminio después del decapado para protegerse de la acción de los agentes atmosféricos, forma una película de alúmina de 0,1m de espesor que le confiere unas propiedades de inoxidación y anticorrosión. El anodizado es un proceso electrolítico que permite obtener de manera artificial películas de óxido de mayor espesor y con mejores propiedades. El anodizado produce la oxidación del material de fuera a dentro mejorando las propiedades. El lacado consiste en la aplicación electrostática de una pintura en polvo sobre la superficie del aluminio. Las pinturas más utilizadas son las de poliéster por su resistencia a la luz y a la corrosión. La imprimación se realiza en cabinas equipadas con pistolas electrostáticas. 2.6 Aplicaciones El aluminio se utiliza en forma pura, aleado con otros materiales o en compuestos no metálicos. En estado puro se aprovechan sus propiedades ópticas para fabricar espejos. Su uso más popular es como papel de aluminio, para embalaje alimentario. La alúmina se usa tanto en forma cristalina como amorfa. En forma cristalina forma el corindón, una gema utilizada en joyería, que puede adquirir coloración roja (rubí) o azul (zafiro). La dureza del corindón permite su uso como abrasivo para pulir metales. Debido a su elevada proporción resistencia-peso es muy útil para construir aviones, vagones ferroviarios y automóviles, y para otras aplicaciones en las que es importante la movilidad y la conservación de energía. Por su elevada conductividad térmica, el aluminio se emplea en utensilios de cocina y en pistones de motores de combustión interna. Este metal se utiliza cada vez más en arquitectura, tanto con propósitos estructurales como ornamentales. Las tablas, las contraventanas y las láminas de aluminio constituyen excelentes materiales de construcción. Se utiliza también en reactores nucleares a baja temperatura porque absorbe relativamente pocos neutrones. El papel de aluminio de 0,018 cm de espesor, actualmente muy utilizado en usos domésticos, protege los alimentos y otros productos perecederos. Debido a su poco peso, a que se moldea fácilmente y a su compatibilidad con comidas y bebidas, el aluminio se usa mucho en contenedores, envoltorios flexibles, y 6 botellas y latas de fácil apertura. La resistencia del aluminio a la corrosión por el agua de mar también lo hace útil para fabricar cascos de barco y otros mecanismos acuáticos. 2.7 Reciclaje El aluminio es 100% reciclable sin la pérdida de sus propiedades físicas. El proceso de reciclaje necesita poca energía. Al aluminio reciclado se le conoce como aluminio secundario, pero mantiene las mismas propiedades que el aluminio primario. Para proceder al reciclaje del aluminio primero hay que realizar una revisión y selección de la chatarra según su análisis y metal recuperable para poder conseguir la aleación deseada. La chatarra se compactará, en cubos o briquetas o se fragmentará, lo cual facilita su almacenamiento y transporte. 3. Magnesio El nombre del Magnesio procede de Magnesia, que en griego designaba una región de Tesalia (Grecia). El inglés Joseph Black reconoció el magnesio como un elemento químico en 1755. En 1808 Sir Humphrey Davy obtuvo metal puro mediante electrólisis de una mezcla de magnesia y HgO. Magnesio (Mg), es un elemento metálico blanco plateado. Los principales países productores de magnesio son Estados Unidos, China y Canadá. 3.1 Estructura atómica Su configuración electrónica es 1s2 2s2 2p6 3s2. El magnesio es un metal alcalinotérreo, y pertenece al grupo 2 del sistema periódico. El número atómico del magnesio es 12. El magnesio tiene un punto de fusión de unos 649 ºC, un punto de ebullición de unos 1.107 ºC y una densidad de 1,74 g/cm3; su masa atómica es 24,305u. 3.2 Propiedades El magnesio es maleable y dúctil cuando se calienta. Es susceptible ante la corrosión marina y relativamente resistente a la atmosférica. Reacciona lentamente con agua a temperatura ambiente, también con los ácidos como el HCl. El óxido de magnesio tiene un volumen similar al magnesio puro, pudiendo proteger el interior al ser impermeable. El magnesio es un metal altamente inflamable, que entra en combustión fácilmente cuando se encuentra en forma de virutas o en estado líquido, en forma de masa compacta es menos inflamable. Una vez encendido es difícil de apagar, ya que reacciona tanto con nitrógeno presente en el aire como con dióxido de carbono. Al arder en aire, el magnesio produce una llama blanca muy intensa incandescente. El magnesio ocupa el sexto lugar en abundancia natural entre los elementos de la corteza terrestre. Existe en la naturaleza sólo en combinación química con otros elementos, en particular, en los minerales carnalita, dolomita y magnesita, en muchos silicatos constituyentes de rocas como sales, por ejemplo el cloruro de magnesio, que se encuentra en el mar y en los lagos salinos. Es un componente esencial del tejido animal y vegetal. 3.3 Producción El magnesio comercial se obtiene del agua de mar y conchas: Las conchas son pasadas por un horno rotatorio a 1320ºC, para producir cal. La cal es mezclada con agua de mar, la que tiene 1300 ppm de magnesio, lo que genera una reacción que produce hidrato de magnesio, el que se deposita en el fondo de un tanque de sedimentación. El hidrato de magnesio se extrae del tanque como una pasta a la que se le agrega ácido clorhídrico, con lo que se logra obtener cloruro de magnesio. 7 La mezcla es filtrada consecutivamente para aumentar su concentración. Se realiza un secado especial hasta que el cloruro de magnesio logra obtener una concentración superior al 68%. El cloruro de magnesio en forma granular se transfiere a una celda electrolítica en la el ánodo es de grafito y el cátodo es la propia tina. En la celda se hace circular corriente eléctrica a 60A con lo que se logra la descomposición del cloro y el magnesio. El cloro con agua se convierte en ácido clorhídrico, el cual sirve para convertir al hidrato de magnesio en cloruro de magnesio en el inicio del proceso. El magnesio que flota en la tina electrolítica es recogido y moldeado en lingotes de 8kg, los que posteriormente son fundidos y utilizados para las aleaciones de magnesio 3.4 Aleaciones Las aleaciones de magnesio presentan una gran resistencia a la tracción, son moldeables y forjables y algunas se pueden tratar térmicamente, sin embargo aguanta peor la fatiga que el aluminio. Cuando el peso es un factor a considerar, el metal se utiliza aleado con aluminio o cobre en fundiciones para piezas de aviones; en miembros artificiales, aspiradoras e instrumentos ópticos, y en productos como esquíes, carretillas, cortadoras de césped y muebles para exterior. 3.5 Aplicaciones La intensa llama blanca de la combustión fue muy utilizada en los comienzos de la fotografía. El polvo de magnesio todavía se utiliza en la fabricación de fuegos artificiales y en bengalas marítimas. El magnesio forma compuestos bivalentes, el óxido de magnesio (MgO) se utiliza como material refractario y aislante en hornos para la producción de acero o cemento. Para la obtención de fundición nodular o esferoidal (Fe-Si-Mg), el magnesio provoca que le grafito se presente en forma esferoidal en lugar de escamas. Como agente reductor en la obtención de uranio y otros metales a partir de sus sales. El cloruro de magnesio (MgCl2 + 6H2O), se usa como material de relleno en los tejidos de algodón y lana, en la fabricación de papel y de cementos y cerámicas. Otros compuestos son el citrato de magnesio (Mg3(C6H5O7)2+4H2O), que se usa en medicina (corrector de acidez) y en bebidas efervescentes. El hidróxido de magnesio, (Mg (OH)2), se utiliza en medicina como laxante y en el refinado de azúcar. Sulfato de magnesio (MgSO4+7H2O), llamado sal de Epson en cosméticos, como material de relleno en la fabricación de papel y como laxante antiácido suave. El polvo de carbonato de magnesio (MgCO3) es utilizado por los atletas como gimnastas y levantadores de peso para mejorar el agarre de los objetos, se usa también en la escalada de dificultad para secar el sudor de manos y mejorar la adherencia a la roca. Con el aluminio, empleándose las aleaciones aluminio-magnesio en envases de bebidas. Las aleaciones de magnesio, se emplean en componentes de automóviles, como llantas, y en maquinaria diversa. Además, el metal se adiciona para eliminar el azufre del acero y el hierro. 4. Titanio El titanio es un metal no ferroso. Dentro de los metales no ferrosos, pertenece a los ligeros junto con el aluminio. 8 Se encuentra de manera abundante en la naturaleza, ya que es uno de los componentes de casi todas las rocas de origen volcánico que contienen hierro. Es el cuarto metal estructural más abundante de la superficie terrestre. 4.1 Estructura atómica Es un elemento químico de número atómico 22 situado en el grupo 4 de la tabla periódica de los elementos. Su símbolo químico es Ti, tiene una masa atómica de 47,867u y su configuración electrónica 1s2 2s2 2p6 3s2 3p6 4s2 3d2. Posee un grado 6 de dureza en la escala Mohs. Se encuentran 5 isótopos estables en la naturaleza: 46Ti, 47Ti, 48Ti, 49Ti y 50Ti, siendo el 48Ti el más abundante (73,8%). 4.2 Propiedades del titanio Propiedades físicas: Es un metal de transición, su densidad es de 4507 kg/m 3. Su punto de fusión es de 1675 °C. Tiene un color plateado grisáceo, es paramagnético y no se imanta debido a su estructura atómica. Es mal conductor eléctrico y térmico, por ello es refractario. Propiedades mecánicas: Es un metal maleable y dúctil, muy duro y resistente a la tracción, tiene gran tenacidad y permite ser soldado. Además permite recibir varias clases de tratados termoquímicos y superficiales. Propiedades químicas: Se encuentra naturalmente en forma de óxido. Presenta dos estados alotrópicos, a temperatura ambiente en una estructura HCP y por encima de 882⁰C, BCC. Es resistente a la corrosión. A elevadas temperaturas reacciona con N, O, H, B y otros no metales. 4.3 Producción El titanio no se encuentra libre en la naturaleza. Los minerales que tienen mayor concentración del mismo son el rutilo (TiO2) y la ilmenita, además de la anatasa y la brookita. Para obtener el titanio puro, a partir de los minerales, se emplea el método de Kroll. Para ello, el óxido de titanio se convierte en tetracloruro de titanio que después es reducido a titanio por medio de sodio o magnesio en una atmósfera de argón que impide su oxidación. 4.4 Aleaciones El principal inconveniente del titanio es su alto poder de reacción con otros materiales a altas temperaturas y por ello son necesarias técnicas de moldeo y afino para obtener estas aleaciones. Tienen extremada resistencia, son muy dúctiles y forjables. Titanio comercialmente puro: Es relativamente débil en comparación con sus aleaciones. Pierde su resistencia a temperaturas elevadas, pero posee gran resistencia a la corrosión. Su resistencia a la tracción es de 662MPa. Se emplea en intercambiadores de calor, industria aeronáutica, reactores, tuberías… Aleaciones titanio alfa (5%Al-2,5%Sn): Poseen alta resistencia a la corrosión. Mantienen una buena resistencia a altas temperaturas, tienen buena soldabilidad y poseen aceptable ductilidad y conformabilidad. Su resistencia a la tracción es de 862 MPa y se emplean en equipos de procesos químicos, prótesis… La estructura atómica es HCP. 9 Aleaciones titanio beta (10%V-11%Cr-3%Al): En la condición recocida, donde sólo existe beta en la microestructura, la resistencia proviene del endurecimiento por solución sólida. La resistencia a la tracción que poseen es de 1276 MPa. Se emplean en componentes estructurales en aviación y aeroespacial (sujetadores de alta resistencia, vigas…). Aleaciones titanio alfa-beta (6%Al-45%V): Se pueden tratar térmicamente para obtener elevadas resistencias. La aleación es tratada cerca de la temperatura de transición a la fase beta, con lo que persiste una pequeña cantidad de la fase alfa. Posteriormente se enfría rápidamente para formar la martensita (forma acicular) de titanio alfa. Posteriormente se le somete a un revenido (500 ⁰C). Las resistencia a la tracción de estas aleaciones son de 1172 MPa. Se emplean en álabes, motores a reacción o trenes de aterrizaje. 4.5 Tratamientos del titanio Tratamiento termoquímico: nitruración: El tratamiento termoquímico de nitruración del titanio puro y de la aleación Ti6Al4V produce una capa de revestimiento lisa y homogénea, con incrementos de una dureza superficial de hasta 500%. La capa de nitruro de titanio tiene un espesor de 2 ó 3 mm, cuyo componente principal es el nitruro de titanio (Ti2N). Tiene gran utilidad en aplicaciones biomédicas, componentes de motocicletas, automóviles de competición… La dureza alcanza los 2600 HRB, y las piezas nitruradas poseen gran resistencia a la corrosión. Tratamiento superficial Lubricación. Para superficies en las que existen deslizamiento, se requiere lubricar las superficies de contacto con lubricantes de película seca a base de disulfuro de molibdeno, grafito o similares. Se emplea en tornillos y pernos. Oxidación térmica. Mejora la resistencia a la corrosión. Origina variedad de colores, lo que mejora sus aplicaciones en el mundo de joyería y decoración. Se emplea el procesado con plasma, oxidación electrolítica… Una alternativa es que se realice con láser. Otros métodos son la anodización (aumentar grosor de la capa de óxido) o la ionización (buenos resultados en tratamiento de engranajes y tornillería) 4.6 Aplicaciones Biomédicas. Es compatible con los tejidos del organismo y no produce reacciones alérgicas. Industria energética. Debido a su resistencia mecánica, se emplea en centrales térmicas eléctricas, para bombas, depósitos… Industria automovilística. Se fabrican componentes de titanio con el fin de aligerar el peso de los vehículos. En el caso de los muelles, se mejora el módulo de Young Industria militar. Como material de blindaje, carrocería de vehículos ligeros, fabricación de misiles… Industria aeronáutica y espacial. Se emplean sus aleaciones en aviones y cohetes espaciales, en forjados estructurales, álabes, palas de turbina… Construcción naval. Es muy resistente a la corrosión, por lo que muchas de sus aleaciones se emplean en la fabricación de hélices, ejes de timón… Otras industrias. Se emplea en fabricación de relojes, joyería, instrumentos deportivos o decoración. 10 5. Nuevas aleaciones. Fibra de Carbono La fibra de carbono es una fibra sintética de unos finos filamentos (de entre 5 y 10 μm) constituida principalmente de carbono. Cada filamento de carbono es la unión de muchas miles de fibras de carbono. Tiene propiedades mecánicas similares al acero y es tan ligera como la madera o el plástico. Por su dureza tiene menor resistencia al impacto que el acero. 5.1 Estructura atómica Su estructura atómica es similar a la del grafito, consistente en láminas de átomos de carbono ordenados en un patrón regular hexagonal. La diferencia está en la manera en que esas hojas se entrecruzan. Es conductor eléctrico y de baja conductividad térmica. Al calentarse, un filamento de carbono se hace más grueso y corto. 5.2 Propiedades Tiene una elevada resistencia mecánica, baja densidad en comparación con otros elementos y tiene un elevado precio de producción. Tiene una gran capacidad de aislamiento térmico y es resistente a las variaciones de temperatura. 5.3 Aplicaciones Tiene muchas aplicaciones en la industria aeronáutica y automovilística, al igual que en barcos y en bicicletas, donde sus propiedades mecánicas y ligereza son muy importantes. También se está haciendo cada vez más común en otros artículos de consumo como patines en línea, raquetas de tenis, edificios, ordenadores portátiles, trípodes y cañas de pesca. 6. Nuevas aleaciones. Composite Los composites compuestos son materiales sintéticos que están mezclados heterogéneamente y que forman un compuesto, como su nombre indica. Estos componentes pueden ser de dos tipos: los de cohesión y los de refuerzo. Los componentes de cohesión envuelven y unen los refuerzos manteniendo la rigidez y posición de estos. Así, esta combinación de materiales le da al compuesto unas propiedades mecánicas notablemente superiores a las de las materias primas de las que procede. 6.1 Aplicaciones Se utilizan en odontología para empastar dientes. El composite se adhiere a la superficie del diente sin depender de la cavidad. Una de las grandes ventajas de los composites es que permiten diversos colores, que emulan la coloración de las piezas. 7. Nuevas aleaciones. Kevlar El Kevlar es una poliamida sintetizada por primera vez en 1965 por la química Stephanie Kwolek. La obtención de las fibras de Kevlar fue complicada. Finalmente, en1972 se empezó a comercializar. Es muy resistente y su mecanización resulta muy difícil. La ligereza y la resistencia a la rotura excepcional de estas poliaramidas hacen que sean empleadas en neumáticos, velas náuticas o en chalecos antibalas. 7.1 Tipos de fibras de Kevlar Esencialmente hay dos tipos de fibras de Kevlar: Kevlar 29 y Kevlar 49. El Kevlar 29 es la fibra tal y como se obtiene de su fabricación. Se usa como refuerzo en tiras por sus buenas propiedades mecánicas, o para tejidos. Entre sus aplicaciones está la fabricación de ropa resistente (de protección) y chalecos antibalas. 11 Las fibras de Kevlar 49 están tratadas superficialmente para favorecer la unión con la resina. El Kevlar 49 se emplea como equipamiento para deportes extremos, para altavoces, para la industria aeronáutica y para los cascos de moto. 7.2 Propiedades El Kevlar posee una excepcional rigidez para tratarse de una fibra polimérica, una excepcional resistencia a la tracción debido a la orientación de las cadena moleculares y una elongación de rotura en torno al 3,6% (Kevlar 29) y 2,4% (Kevlar 49), mientras que el acero rompe en torno al 1% de su deformación. Esto hace que el Kevlar sea un material más tenaz que el acero. 8. Nuevas aleaciones. Fibra de vidrio La fibra de vidrio es un material que consta de fibras numerosas y extremadamente finas de vidrio. La fibra de vidrio se conforma de hebras delgadas hechas a base de sílice (SiO2) o de formulaciones especiales de vidrio. La técnica de calentar y elaborar fibras finas a partir de vidrio se conoce desde hace milenios, sin embargo, el uso de estas fibras para aplicaciones textiles es mucho más reciente. 8.1 Propiedades Las fibras de vidrio son buenos aislantes térmicos debido a su alto índice de área superficial en relación al peso. A diferencia de la fibra de carbono, la de vidrio puede soportar más alargamiento antes de romperse. 8.2 Aplicaciones Las aplicaciones normales de la fibra de vidrio incluyen recubrimientos, aislamientos térmicos, aislamientos eléctricos, aislamientos acústicos, palos de tiendas de campaña, telas resistentes al calor y la corrosión y pértigas para el salto con pértiga, entre muchos otros. 12 Bibliografía http://es.wikipedia.org http://www.portaleso.com http://www.buenastareas.com http://www.rincondelvago.com McGraw Hill Tecnología Industrial I McGraw Hill Tecnología Industrial II Encarta 2003 13