Fe2O3 Hidruro de calcio Ácido clorhídrico
Anuncio

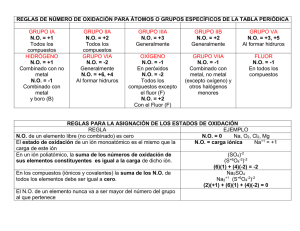
IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO EJERCICIOS DE FORMULACIÓN Y NOMENCLATURA CO2 CaCO3 H2O Ácido NH3 clorhídrico FISICA Y QUIMICA 3º ESO Fe2O3 Óxido de potasio Hidruro de calcio Nombre: ______________________________________________ Grupo: __________ 1 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-0 Da el nombre a las sustancias cuya fórmula puedes ver en la portada de estos ejercicios EJERCICIOS DE FORMULACIÓN Y NOMENCLATURA Existen infinidad de sustancias diferentes, tanto naturales como sintéticas. Los químicos han ideado unas reglas para dar un nombre a cada una de estas sustancias, nombre que tiene que ver con su composición química. Estas son las reglas de nomenclatura: Fórmula (composición química) nomenclatura Nombre Por otra parte, a partir del nombre de una sustancia química se debe de poder obtener su fórmula. Las reglas que se siguen entonces son las reglas de formulación: Nombre formulación Fórmula (composición química) Por ejemplo: la sal común tiene de fórmula NaCl y su nombre es cloruro de sodio. Comenzaremos por recordar los símbolos de los elementos principales. A-1 Rellena la tabla siguiente con los símbolos de los elementos que faltan. No tengas en cuenta las celdas sombreadas. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 He Li N Ar Ca Cr Ga Pt Recuerda: El Sistema Periódico (SP) recoge todos los elementos conocidos. Cada uno de estos elementos son sustancias que se caracterizan por tener átomos con las mismas características. Por ejemplo, cada uno de los átomos de un determinado elemento tiene un número fijo de partículas positivas o protones en su núcleo. A este número le llamamos número atómico (Z) y se corresponde con el orden que ocupa un elemento en el SP. Por ejemplo: para el helio (He), el número atómico es 2; para el litio (Li) el número atómico es 3. Además, las columnas del SP agrupan elementos similares en su comportamiento químico, por lo que se llaman también “familias”. 2 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-2 Escribe el nombre de las familias de las columnas que se indican: Columna Nombre de la familia 1 2 13 14 15 16 17 18 Recuerda: Las columnas 3 a 12 recogen los llamados “metales de transición” Repasemos ahora los nombres de los elementos, familia a familia. A.3 Escribe de nuevo los símbolos que faltan añadiendo ahora el nombre de cada elemento y la familia que forman. Recuerda: Los símbolos de los elementos empiezan siempre por mayúscula. Cuando el símbolo tiene dos letras, la segunda va en minúscula. Columnas /familia 1: (*) 2: H: Be : Na : Rb : Correcto: Ca (Calcio) Incorrecto: CA Correcto: Al (Aluminio) Incorrecto: AL Sr : (*) El elemento hidrógeno está en la columna 1 pero NO forma parte de esa familia Columnas /familia de metales de transición 6 7 8 Cr : 9 10 11 Co: 12 Zn: Columnas /familia 13: 14: 15: 16: 17: 18: He: B: C: N: O: 3 F: IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO Los elementos del SP se dividen en dos grandes grupos: por un lado los llamados “metales”, y por otro lado los llamados “no metales”. Existe una forma sencilla de diferenciarlos conociendo su posición en el SP. Observa de nuevo la tabla de la A-1: Los elementos que están a la derecha y por encima de la línea gruesa son los no metales, mientras que el resto son los metales. A-4 Clasifica estos elementos como metales o no metales: Hidrógeno, Cromo, Sodio, Cloro, Carbono, Nitrógeno, Bario, Cinc, Mercurio, Yodo, Plomo, Silicio Metales No metales Recuerda: Algunos elementos que se encuentran en el límite de la línea de trazo grueso son en realidad elementos que tienen algo de los dos grupos, por lo que se llaman semimetales. Los elementos metálicos tienen propiedades que los identifican. Así, por ejemplo, tienen un brillo característico, son sólidos a temperatura ambiente, son maleables, etc. Los elementos no metálicos, por el contrario, tienen otras propiedades. Así, por ejemplo, muchos son líquidos o gases a temperatura ambiente, y cuando son sólidos no presentan brillo (salvo algún caso). La materia viva está formada de elementos no metálicos: el carbono, el hidrógeno, el oxígeno y el nitrógeno fundamentalmente. Desde el punto de vista de la forma en que se unen entre sí los elementos para dar compuestos, cabe decir a grandes rasgos que los metales tienden a perder electrones, mientras que los no metales tienden a ganarlos. Llamamos número de oxidación1 al número de electrones que los átomos de un elemento ganan o pierden en sus combinaciones con otros. Por ejemplo: el número de oxidación del sodio es +1, por lo que cuando el sodio se combina con otro elemento para dar un compuesto pierde un electrón. A-5 Teniendo en cuenta lo anterior, anota qué ocurrirá en cada uno de los casos o deduce el número de oxidación. Sigue el modelo. Elemento Ca Número de oxidación +2 Cl -1 O -2 H +1 Fe +3 Hg +1 S 1 Significado Pierde 2 electrones al combinarse con otro elemento Gana 1 electrón al combinarse con otro elemento Gana 2 electrones al combinarse con otro elemento También llamado número de valencia 4 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO Recuerda: Los electrones son partículas de carga negativa que rodean el núcleo (positivo). Como las cargas del electrón y del protón son iguales, pero de signo contrario, un átomo neutro tiene tantos protones como electrones. Si un átomo pierde electrones, su carga se hace positiva, y negativa si los gana. A-6 Completa la tabla siguiente Elemento Ne K Cl F Fe Al Co H Carga del átomo 0 +1 -1 +3 Número de protones 10 19 17 9 26 13 +2 -1 Número de electrones 9 10 25 1 A-7 ¿Cuáles son los números de oxidación con que han actuado los elementos de la actividad anterior? Indícalos en la tabla: Elemento Número de oxidación Ne K Cl F Fe Al Co H Recuerda: La carga de un átomo nos indica con qué número de oxidación ha actuado ese elemento. En las sustancias puras elementales los números de oxidación de los elementos son igual a cero. Por ejemplo: O2 (g), Cl2 (g), N2 (s), Fe (s), C (s) Llamamos ión a un átomo o grupo de átomos cargado. Cuando el ión es negativo se llama ANIÓN y si es positivo, recibe el nombre de CATIÓN. Observa la tabla siguiente: Ión - F Ag+ O-2 Na+ Fe+3 Zn+2 CO32SO42- Nombre ión fluoruro ión plata ión óxido ión sodio ión hierro (III) ión cinc ión carbonato ión sulfato Recuerda: Los iones pueden ser monoatómicos o poliatómicos. Ejemplo: Monoatómico: ión óxido Poliatómico: ión carbonato A-8 Indica los nombres de cuatro cationes y de cuatro aniones de la tabla anterior. Cationes Aniones 5 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-9 Con ayuda del libro completa la tabla siguiente indicando los símbolos y los números de oxidación de los elementos principales. Sigue los ejemplos. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 H 17 18 He +1, -1 0 O Números de oxidación de los elementos (n.o.) -2, -1 Al +3 Fe Co Ni +2, +3 +2, +3 +2, +3 Hg +1, +2 A-10 Sombrea con el mismo color aquellas celdas con elementos cuyos n.o. sean iguales. Por ejemplo, emplea amarillo para el hierro, el cobalto y el níquel. Ahora ya estamos preparados para comenzar a practicar las reglas de formulación y nomenclatura. Empezaremos por los compuestos binarios, aquellos formados sólo por dos elementos. Dentro de estos compuestos, distinguimos: Sales binarias (p. e.: NaCl) Óxidos (p. e.: CO2) Hidruros (p. e.: NH3) Compuestos binarios: SALES BINARIAS: Están formadas por la combinación de un metal y un no metal. El no metal actúa siempre con su n. o. negativo. Observa cómo se obtiene la fórmula del cloruro de calcio: +2 -1 Ca Cl CaCl2 - Ponemos primero el símbolo del metal y después el del no metal - Arriba de los símbolos indicamos el número de oxidación correspondiente - Estos n.o. se toman en valor absoluto (sin el signo) para obtener los subíndices de cada elemento en la fórmula: al Ca se le asigna un 1 y al Cl un 2 OBSERVA: Los números de oxidación se intercambian para obtener la fórmula Recuerda: Los subíndices en una fórmula son los números a la derecha de los símbolos de los elementos. Su valor nos informa del número de átomos de un elemento que hay en una molécula, o bien de la proporción en que se encuentran los átomos de los distintos elementos en un compuesto. Por ejemplo: en la molécula H2O el subíndice del H es 2, y el del O es 1 (el uno se sobreentiende y no aparece en la fórmula) 6 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-11 Escribe las fórmulas y los nombres de las sales binarias obtenidas a partir de los elementos que se indican. Sigue el modelo. sodio y flúor +1 Na -1 F magnesio y cloro yodo y potasio aluminio y bromo azufre y sodio selenio y potasio cesio y cloro Recuerda: Para obtener el nombre de una sal binaria podemos aplicar la regla indicada en este esquema (algunos elementos modifican el nombre, por ejemplo es sulfuro pero no “azufruro”) NaF fluoruro de sodio Nombre según criterio de STOCK CaCl2 clorURO de nombre del no metal acabado en -URO calcio nombre metal del Cuando un metal tiene varios n.o. puede dar lugar a distintas sales binarias con un determinado no metal. En estos casos se indica el número de oxidación del metal al final del nombre, entre paréntesis y con números romanos. Por ejemplo: +2 Fe -1 +3 Cl Fe FeCl2 -1 Cl cloruro de hierro (II) FeCl3 cloruro de hierro (III) A-12 Escribe las fórmulas y los nombres de las sales binarias obtenidas a partir de los elementos que se indican. Sigue el modelo. níquel y bromo cobre y cloro plomo y yodo azufre y cinc plata y bromo mercurio y azufre oro y cloro +2 Ni +1 Cu +2 Pb +2 Zn +1 Ag +2 Hg +3 Au -1 Br 7 NiBr2 bromuro de níquel (II) IES Lluís Vives Departamento de Física y Química Otra forma de dar el nombre a una sal binaria se basa en el criterio de la IUPAC2, tal y como se recoge en el esquema. Física y Química 3º ESO Nombre según criterio IUPAC CaCl2 DIclorURO de PREFIJO + nombre del no metal acabado en -URO Recuerda: Los prefijos indican los subíndices de cada elemento y son los siguientes, del 1 al 7: mono-, di-, tri- , tetra- , penta- , hexa- , hepta- calcio nombre del metal A-13 Escribe las fórmulas a partir de los nombres que se indican. Sigue el modelo. ZnCl2 dicloruro de cinc tricloruro de oro tribromuro de níquel monosulfuro de dipotasio monofluoruro de plata monosulfuro de cadmio tetracloruro de plomo dibromuro de cobalto AuCl3 ÓXIDOS: Son compuestos binarios formados por la combinación del oxígeno con otro elemento (metal o no metal). En los óxidos el oxígeno siempre actúa con el número de oxidación -2. El otro elemento siempre empleará un número de oxidación positivo. Observa cómo se obtiene la fórmula del óxido de sodio: +1 -2 Na O Na2O - Ponemos primero el símbolo del otro elemento y después el del oxígeno - Arriba de los símbolos indicamos el número de oxidación correspondiente - Estos n.o. se toman en valor absoluto (sin el signo) para obtener los subíndices de cada elemento en la fórmula: al Na se le asigna un 2 y al O un 1 A-14 Completa la tabla siguiente con los nombres (según criterio de STOCK) y las fórmulas de los óxidos obtenidos a partir de los elementos que se indican. Sigue el modelo. potasio +1 K -2 O magnesio cobre aluminio estroncio plata mercurio hierro 2 K2 O Siglas en inglés de Unión Internacional de Química Pura y Aplicada 8 óxido de potasio óxido de cobre (I) óxido de mercurio (I) óxido de hierro (III) IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO Los nombres de los óxidos pueden darse además siguiendo el criterio IUPAC (también llamado de nomenclatura sistemática) tal y como hemos visto antes para las sales binarias. Así, por ejemplo: BeO P2O5 SiO2 SnO monóxido de berilio pentaóxido de difósforo dióxido de silicio monóxido de estaño Observa que no se dice “monóxido de monoberilio” o “dióxido de monosilicio” A-15 Nombra los óxidos siguientes siguiendo la nomenclatura sistemática. Indica además el número de oxidación que corresponde en cada caso al elemento combinado con el oxígeno. Sigue el modelo. As2O3 ZnO Ni2O3 CO Co2O3 arsénico +3 Ag2O CO2 Rb2O CrO3 PbO2 trióxido de diarsénico A-16 Completa la tabla siguiente con las fórmulas o los nombres de los óxidos que falten. Fórmula Nombre STOCK óxido de manganeso (IV) Nombre IUPAC monóxido de oro monóxido de mercurio óxido de cadmio monóxido de estroncio monóxido de bario Cr2O3 Cl2O5 NO2 SO3 dióxido de azufre PtO2 En todos los óxidos, el oxígeno está actuando con su número de oxidación -2. Sin embargo, existen algunos compuestos en los que el oxígeno actúa con el número de oxidación -1. Estos compuestos son los PERÓXIDOS. En este curso nos conformaremos con dar a conocer el peróxido de hidrógeno (nombre común: agua oxigenada) cuya fórmula es H2O2 Recuerda: El ión peróxido está formado por dos átomos de oxígeno que tienen dos cargas negativas: 9 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO HIDRUROS: Son compuestos binarios formados por la combinación del hidrógeno con otro elemento. Pueden ser hidruros metálicos e hidruros no metálicos. HIDRUROS METÁLICOS: Son los formados por la combinación del hidrógeno con un metal. En estos compuestos el H actúa con su número de oxidación negativo, -1. El metal siempre empleará un número de oxidación positivo. Observa cómo se obtiene la fórmula del hidruro de sodio: +1 -1 Na H NaH - Ponemos primero el símbolo del metal y después el del hidrógeno - Arriba de los símbolos indicamos el número de oxidación correspondiente - Estos n.o. se toman en valor absoluto (sin el signo) para obtener los subíndices de cada elemento en la fórmula: al Na se le asigna un 1 y al O un 1 A-17 Completa la tabla siguiente con los nombres (según criterio de STOCK) y las fórmulas de los hidruros obtenidos a partir de los elementos que se indican. Sigue el modelo. potasio +1 K -1 H KH hidruro de potasio magnesio cobre aluminio estroncio plata mercurio hidruro de mercurio (II) oro hidruro de oro (III) platino +4 Pt hidruro de cobre (I) A-18 De acuerdo con la actividad anterior, ¿cómo se obtiene el nombre de un hidruro metálico? Completa la frase: “Los hidruros metálicos, según el criterio de STOCK se nombran con la palabra ________________ seguida del nombre del __________________ e indicando entre paréntesis el número de oxidación en números romanos, sólo en caso de tener ____________de un número” Al igual que hemos visto en el caso de los óxidos, podemos nombrar los hidruros metálicos siguiendo el criterio IUPAC. En este caso, el compuesto se nombra indicando el número de átomos de hidrógeno con los prefijos, mono-, di-, tri-, tetra-, etc., seguido del nombre del metal. 10 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-19 Completa la tabla siguiente con los nombres (según criterio IUPAC) y las fórmulas de los hidruros obtenidos a partir de los elementos que se indican. Sigue el modelo. +3 Ni níquel -1 H litio bario +4 Pb +2 Pt +3 Cr plomo platino cromo NiH3 cobalto dihidruro de cobalto oro trihidruro de níquel monohidruro de oro HIDRUROS NO METÁLICOS: Son los formados por la combinación del hidrógeno con un no metal. En estos compuestos el H actúa con su número de oxidación positivo, +1. El no metal siempre empleará un número de oxidación negativo. Observa cómo se obtiene la fórmula del fluoruro de hidrógeno: +1 -1 H F HF - Ponemos primero el símbolo del hidrógeno y después el del no metal - Arriba de los símbolos indicamos el número de oxidación correspondiente - Estos n.o. se toman en valor absoluto (sin el signo) para obtener los subíndices de cada elemento en la fórmula: al H se le asigna un 1 y al F un 1 Los hidruros de los halógenos y de los anfígenos se nombran añadiendo el sufijo –URO al nombre del no metal, seguido de las palabras “de hidrógeno”: A-20 Completa la tabla siguiente de acuerdo con el modelo. HI H2Te HCl yoduro de hidrógeno H2S HBr H2Se Existe otra forma de nombrar estos hidruros, como ácidos hidrácidos, que veremos más adelante. Por otra parte, hay unos cuantos hidruros no metálicos, además del agua, que mantienen sus nombres tradicionales: BH3 CH4 SiH4 borano NH3 PH3 AsH3 metano silano 11 amoniaco fosfina arsina IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO HIDRÓXIDOS: Son compuestos formados por la combinación de un catión con el anión OH(llamado oxhidrilo). Por tanto, se asemejan a las sales binarias al estar formados por dos iones de signo opuesto que complementan sus cargas. Fíjate en que no son compuestos binarios. Observa cómo se obtiene la fórmula del hidróxido de sodio: +1 -1 Na OH NaOH - Ponemos primero el símbolo del catión (carga +) y después el del anión oxhidrilo, que siempre tendrá carga negativa de valor -1 - Arriba de los símbolos indicamos las cargas correspondientes - Estas cargas se toman en valor absoluto (sin el signo) para obtener los subíndices de cada ión en la fórmula, de forma que tanto al Na como al OH se les asigna un 1. Observa: Para obtener el nombre de un hidróxido se siguen reglas similares a las practicadas en los apartados anteriores. A-21 Escribe las fórmulas y los nombres de los hidróxidos obtenidos a partir de los elementos que se indican. Sigue el modelo: ¿cuándo emplearemos paréntesis en la fórmula? Elemento calcio Fórmula +2 Ca -1 OH plata potasio cobre cromo +1 Cu +3 Cr Nombre STOCK Ca(OH)2 hidróxido de calcio Nombre IUPAC dihidróxido de calcio cinc níquel trihidróxido de níquel A-22 Completa la tabla siguiente añadiendo el nombre que corresponde a cada fórmula. Fórmula número de oxidación del metal Nombre STOCK Sr(OH)2 HgOH Sn(OH)2 Pb(OH)4 Al(OH)3 Mn(OH)2 12 Nombre IUPAC IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO ÁCIDOS: Constituyen un grupo de compuestos químicos muy importante. Algunos son peligrosos, como el ácido sulfúrico, ya que son corrosivos y muy reactivos. Otros son inofensivos y los encontramos en algunos alimentos, como sucede con el acido cítrico. Los ácidos presentan HIDRÓGENO en su composición, pero no todos los compuestos que tienen este elemento son ácidos. Un ácido se caracteriza químicamente porque al entrar en contacto con otras sustancias reacciona desprendiendo hidrógeno en forma de ión H+. Consideraremos dos grupos de ácidos: HIDRÁCIDOS: formados por hidrógeno + no metal ( p. e.: HCl) Ácidos: OXOÁCIDOS: formados por hidrógeno + oxígeno + no metal (p. e.: HNO3) Veamos los nombres de los principales ácidos: A-23 Completa la tabla siguiente con los nombres y las fórmulas de los ácidos hidrácidos que se indican. Sigue el modelo. Elemento que lo forma flúor Fórmula del ácido +1 -1 H F cloro bromo yodo azufre selenio Nombre tradicional HF ácido fluorhídrico Observa y contesta: ¿cómo formamos el nombre de un hidrácido? El nombre se obtiene… En cuanto a los nombre de los ácidos oxoácidos, nos conformaremos este curso con esta lista de los más importantes: Principales ácidos oxoácidos Nombre H2SO4 ácido sulfúrico HNO3 ácido nítrico H2CO3 ácido carbónico H3PO4 Observa: Cuando un ácido reacciona desprende iones H+ y da lugar a un anión que toma el nombre del ácido del que procede: H2SO4 2H+ + SO42- anión sulfato La carga del anión se obtiene a partir del número de hidrógenos que hay en la fórmula del oxoácido ácido fosfórico 13 IES Lluís Vives Departamento de Física y Química Física y Química 3º ESO A-24 Completa la tabla siguiente con los nombres y las fórmulas de los aniones derivados de los oxoácidos anteriores. Sigue el modelo. H2SO4 2H+ HNO3 H + + H2CO3 2H+ + H3PO4 3H+ + + SO42- anión sulfato Recuerda: Una gran cantidad de compuestos se pueden considerar derivados de los oxoácidos y constituyen un grupo de sales similares a las que hemos estudiado en un apartado anterior. Por ejemplo: … los compuestos formados por la combinación de un catión y el anión sulfato, son “sulfatos”, como el sulfato de calcio que forma parte de la tiza. A-25 Organiza las sustancias representadas por las fórmulas de la tabla siguiente, clasifícalas por grupos y asigna a cada una el nombre que creas correcto. Sigue el modelo. CaCO3 , Mg(NO3)2 , K3PO4 , Li2CO3 , CaSO4 , AlPO4 , NaNO3 , CuSO4 , AgNO3 sulfatos nitratos carbonatos CaCO3: carbonato de calcio fosfatos A-26 Ejercicio de recapitulación. Asigna el nombre o la fórmula en cada caso, indicando además de qué tipo de sustancia se trata. Fórmula Tipo de sustancia Nombre Mg(OH)2 hidróxido hidróxido de magnesio Li2O FeS NaBr AgH ácido nítrico óxido de plomo (IV) hidruro de calcio yoduro de hidrógeno CuOH NO Autor: F. Javier Serrano /IES Lluís Vives- Departamento de Física y Química 14