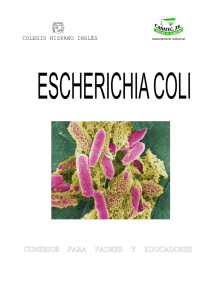
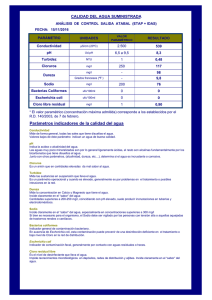
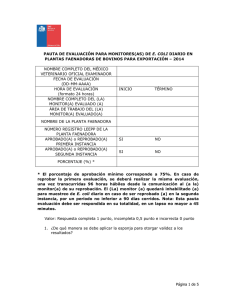
universidad central del ecuador facultad de medicina veterinaria y
Anuncio

UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA CARRERA DE MEDICINA VETERINARIA Y ZOOTECNIA CUANTIFICACIÓN DE Escherichia coli PRODUCTOR DE β - LACTAMASAS DE ESPECTRO EXTENDIDO (BLEE) EN PUNTOS CRÍTICOS DE CONTROL EN CAMALES INDUSTRIALES DE LA PROVINCIA DE PICHINCHA. Trabajo de Grado presentado como requisito parcial para optar el Título de Médico Veterinario Zootecnista AUTORA ESTEFANÍA ALEJANDRA PÉREZ CELORIO TUTOR Dr. Christian Vinueza Msc. Quito, Julio, 2015 II III IV ÍNDICE GENERAL V CONTENIDO ÍNDICE DE TABLAS ............................................................................................... 6 ÍNDICE DE GRÁFICOS .......................................................................................... 7 ÍNDICE DE ANEXOS .............................................................................................. 7 RESUMEN .............................................................................................................. 8 DEDICATORIA ...................................................................................................... 10 AGRADECIMIENTO .............................................................................................. 11 INTRODUCCIÓN .................................................................................................. 12 CAPÍTULO I .......................................................................................................... 13 EL PROBLEMA ..................................................................................................... 13 Planteamiento del Problema .............................................................................. 13 Objetivos ............................................................................................................ 14 Justificación ....................................................................................................... 14 CAPITULO II ......................................................................................................... 17 MARCO TEÓRICO ................................................................................................ 17 Antecedentes de la investigación ....................................................................... 17 Fundamentación Teórica ................................................................................... 18 CAPÍTULO III ........................................................................................................ 33 METODOLOGÍA.................................................................................................... 33 Determinación de los métodos a utilizar ............................................................ 33 Diseño de la investigación ................................................................................. 33 Descripción de la zona de estudio ..................................................................... 33 Población ........................................................................................................... 33 Técnicas e Instrumentos de Recolección de la Información .............................. 36 Técnicas de Laboratorio ..................................................................................... 36 CAPÍTULO IV ........................................................................................................ 40 RESULTADOS ...................................................................................................... 40 Presentación de Resultados .............................................................................. 40 Discusión ........................................................................................................... 49 VI CAPÍTULO V ......................................................................................................... 53 CONCLUSIONES Y RECOMENDACIONES ........................................................ 53 Conclusiones ..................................................................................................... 53 Recomendaciones ............................................................................................. 54 REFERENCIAS BIBLIOGRÁFICAS ...................................................................... 55 LISTADO DE ABREVIATURAS ............................................................................ 66 ANEXOS ............................................................................................................... 68 ÍNDICE DE TABLAS Tabla 1. Clasificación científica de Escherichia coli. ................................................. 19 Tabla 2. Patotipos de Escherichia coli. ...................................................................... 20 Tabla 3. Principales β – lactamasas .......................................................................... 26 Tabla 4. Identificación y ubicación de los camales industriales de aves de la provincia de Pichincha. ............................................................................................. 34 Tabla 5. Descripción de los puntos y unidades de muestreo. ................................... 34 Tabla 6. Número total de muestras procesadas durante la investigación. ................ 41 Tabla 7. Características de la línea de faenamiento de cada una de las empresas.. 41 Tabla 8. Promedio de UFC/g (Log10) de E. coli BLEE y Desviación Estándar por muestreo en empresas 1CT y 2CT. .......................................................................... 42 Tabla 9. Promedio de UFC/ml (Log10) de E. coli BLEE y ppm de Cloro de los tanques de Enfriamiento de las empresas 1CT y 2CT. ............................................. 46 Tabla 10. Prueba Shapiro - Wilk empresa 1CT y 2CT. ............................................. 47 Tabla 11. Análisis de varianza empresa 2CT. ........................................................... 47 Tabla 12. Correcciones de Bonferroni empresa 2CT. ............................................... 49 VII ÍNDICE DE GRÁFICOS Gráfico 1. Sitios de colonización de Escherichia coli patógena. ................................ 21 Gráfico 2. Estructura antigénica de las Enterobacterias. ........................................... 23 Gráfico 3. Descripción de la siembra en agar TBX+C. .............................................. 38 Gráfico 4. Aislamiento de Escherichia coli productor de β - lactamasas de espectro extendido en el medio TBX +C. ................................................................................. 40 Gráfico 5. Promedio de UFC/g (Log10) de Escherichia coli BLEE en cada punto muestreado en la empresa 1CT. ............................................................................... 43 Gráfico 6. Promedio de UFC/g (Log10) de Escherichia coli BLEE en cada punto muestreado en la empresa 2CT. ............................................................................... 44 Gráfico 7. Promedio y desviación estándar de UFC/g (Log10) de Escherichia coli BLEE en las empresas 1CT y 2CT............................................................................ 45 Gráfico 8. UFC/ml (Log10) de Escherichia coli BLE y ppm de cloro en los tanques de enfriamiento de la empresa 1CT. ......................................................................... 46 ÍNDICE DE ANEXOS Anexo 1. Esquema de aislamiento de E. coli BLEE. ................................................. 69 Anexo 2. Crioconservación de cepas de Escherichia coli BLEE ............................... 69 Anexo 3. Tabla de registro de información de las parvadas muestreadas. ............... 71 Anexo 4. Tabla de registro de registro de resultados de cuantificación de Escherichia coli BLEE. .............................................................................................. 72 Anexo 5. Preparación del Agar TBX+C y del Caldo TSB. ......................................... 73 Anexo 6. Promedio, Varianza, Desviación estándar y Coeficiente de Variación de E. coli BLEE (Log10/g) por muestreo en la empresa 1CT. ......................................... 74 Anexo 7. Promedio, Varianza, Desviación estándar y Coeficiente de Variación de E. coli BLEE (Log10/g) por muestreo en la empresa 2CT. ........................................ 76 Anexo 8. Promedio y Desviación Estándar de UFC (Log10/g) de E. coli BLEE empresa 1CT............................................................................................................. 79 Anexo 9. Promedio y Desviación Estándar de UFC (Log10/g) de E. coli BLEE empresa 2CT............................................................................................................. 80 VIII UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA ESCUELA DE MEDICINA VETERINARIA Y ZOOTECNIA CUANTIFICACIÓN DE Escherichia coli PRODUCTOR DE β ESPECTRO EXTENDIDO (BLEE) LACTAMASAS DE EN PUNTOS CRÍTICOS DE CONTROL EN CAMALES INDUSTRIALES DE LA PROVINCIA DE PICHINCHA. Autora: Estefanía Alejandra Pérez Celorio Tutor: Dr. Christian Vinueza M. Sc. Fecha: Julio, 2015 RESUMEN Escherichia coli productor de β - lactamasas de Espectro Extendido (BLEE) ha sido aislado en carcasas de pollos destinados al consumo humano, estas cepas transfieren sus genes a bacterias del tracto gastrointestinal por medio de un plásmido de transferencia y estas a su vez pueden actuar como fuente de infección en el organismo. El objetivo del presente estudio fue cuantificar E. coli BLEE en puntos críticos de control en dos camales industriales de pollos en la provincia de Pichincha. Se tomaron tres tipos de muestras: piel de la pechuga de las carcasas, ciegos y agua de los tanques de enfriamiento. Las muestras de piel se tomaron en diferentes etapas del faenamiento (después del desplume, después del eviscerado, antes y después del enfriamiento). Se cuantificó E. coli BLEE realizando diluciones decimales en agar TBX suplementado con Cefotaxima. La empresa 1CT presentó variables niveles de contaminación entre los muestreos, lo que indica una falta de uniformidad entre los procesos de faenamiento. Las variaciones encontradas en la empresa 2CT demostraron diferencias significativas de contaminación en el eviscerado con un incremento de 0,54 UFC/g Log10 y después del enfriamiento con una disminución de 1,1 UFC/g Log10 E. coli BLEE. En conclusión, la evisceración es un punto crítico de control que debe ser mejorado para asegurar la calidad microbiológica del producto debido a que las duchas aplicadas entre la evisceración y antes del enfriamiento no surtieron el efecto esperado en la disminución de la carga bacteriana de las carcasas. En contraste, los niveles de cloro utilizados en el agua de los tanques de enfriamiento sí disminuyen la contaminación de las canales. Palabras clave: E. coli BLEE, Cuantificación, Punto crítico de control, Pichincha IX CENTRAL UNIVERSITY OF ECUADOR FACULTY OF VETERINARY MEDICINE SCHOOL OF VETERINARY MEDICINE QUANTIFICATION OF EXTENDED SPECTRUM β- LACTAMASE PRODUCING Escherichia coli IN CRITICAL CONTROL POINTS IN INDUSTRIAL SLAUGHTERHOUSES AT PICHINCHA PROVINCE. Author: Estefanía Alejandra Pérez Celorio Tutor: Dr. Christian Vinueza M. Sc. Date: Julio, 2015 ABSTRACT Extended- Spectrum β-Lactamase producing Escherichia coli (ESBL) has been isolated from chicken carcasses destined for human consumption, these strains transfer their genes to bacteria in the gastrointestinal tract by means of a transfer plasmid and these can act as a source of infection in the body. The objective of this study was to quantify ESBL E. coli at critical control points in two industrial poultry slaughterhouses at Pichincha Province. Three types of samples were taken: breast skin carcasses, ceca and water cooling tanks. Skin samples were taken at different stages of slaughtering (after defeathering, after evisceration, before and after cooling). ESBL E. coli was quantified performing decimal dilutions in TBX agar supplemented with Cefotaxime. The company 1CT presented varying levels of contamination between samples, indicating a lack of uniformity among slaughter processes. The variations found in company 2CT show significantly differences of contamination in the evisceration with an increase of 0.54 CFU / Log10 and after cooling with a decrease of 1.1 CFU / g Log10. In conclusion, evisceration is a critical control point should be improved to ensure the microbiological quality of the product because the showers applied between the evisceration and before chilling have not the effect expected in reducing the bacterial load of the carcass. In contrast, levels of chlorine used in the water of cooling tank itself decrease the contamination of carcasses. Keywords: E. coli ESBL, Quantification, Critical Control Point, Pichincha X DEDICATORIA A mis ángeles, que aunque no se encuentren físicamente conmigo su amor vive en mi corazón. XI AGRADECIMIENTO Agradezco a mi Padre Celestial, sin él nada de esto hubiese sido posible. A mis padres y hermanos por su amor y su ejemplo, gracias a ellos he podido llegar a este punto de mi vida. A mi novio, por su apoyo incondicional y la fortaleza que me brinda día a día. Al Doctor Christian Vinueza, por la confianza que depositó en mí, por su paciencia y por toda la ayuda en la realización de esta investigación. A los doctores Marco Cisneros, María Belén Cevallos, María Inés Baquero, Carlos Gómez por cada experiencia compartida. A las empresas, por su amable cooperación en este estudio. A todas las personas que ayudaron a materializar este sueño: Cristina, Jonathan, Verónica, Marco, Jorge, Cristian, por su invaluable ayuda. A todos muchísimas gracias. INTRODUCCIÓN Escherichia coli es un microorganismo que normalmente se encuentra en el intestino de humanos y animales jugando un rol importante en la digestión y absorción de nutrientes y vitaminas (Hayhurst, 2004). Cientos de cepas son inofensivas pero otras como Escherichia coli O157:H7, cepa productora de la toxina shiga, causan graves intoxicaciones en humanos incluyendo los principales brotes de enfermedades causadas por alimentos contaminados (Ahmed & Shimamoto, 2014). Escherichia coli está asociado a infecciones intestinales y extraintestinales como: meningitis, diarrea, infecciones en el tracto urinario, peritonitis, septicemia y neumonía (Hammerum & Heuer, 2009). Con frecuencia los antibióticos empleados en animales y humanos para el tratamiento de estas enfermedades son los mismos, aumentando así el riesgo de aparición y propagación de bacterias resistentes (WHO, 2014). Estudios recientes han sugerido la transmisión de cepas de E. coli y sus genes de resistencia a los seres humanos por el consumo de la carne de pollo (de Been et al., 2014). La presente investigación se realizó en el laboratorio de Bacteriología y Micología de la Facultad de Medicina Veterinaria y Zootecnia, aplicando técnicas microbiológicas que permitieron la cuantificación de E. coli BLEE en cuatro puntos críticos de control, en muestras de agua procedentes de los tanques de enfriamiento y en el contenido cecal de pollos faenados en dos camales industriales de la provincia de Pichincha. 12 CAPÍTULO I EL PROBLEMA Planteamiento del Problema Escherichia coli es una bacteria que forma parte de la microflora intestinal normal del intestino de seres humanos y otros animales de sangre caliente. La mayoría de cepas no son patógenas, sin embargo hay otras causantes de enfermedades como: síndrome urémico hemolítico, meningitis en recién nacidos, peritonitis entre otras, además es uno de los principales agentes asociados a enfermedades de transmisión alimentaria (WHO, 2014). La carne de pollo es un reservorio importante de E. coli ya que durante el faenamiento el contenido fecal del intestino puede contaminar las carcasas (Gladys & Olayinka, 2014; Miranda et al., 2008). Un problema aun mayor es que estas cepas pueden llevar en su información genética la codificación de enzimas que le permiten resistir el mecanismo de acción de los antibióticos como es el caso de las β - lactamasas (Depoorter et al., 2012; Seiffert et al., 2013). Se ha demostrado que la contaminación de carne de pollo con E. coli productor de β- lactamasas de espectro extendido (BLEE) contribuye al aumento de la incidencia de infecciones con estas bacterias en los seres humanos (Cohen Stuart et al., 2012). Si la infección con E. coli BLEE se desarrolla en el ser humano, es posible que no respondan a los tratamientos estándar, dando lugar a una enfermedad prolongada y un mayor riesgo de muerte (da Silva & Mendonça, 2012). 13 FORMULACIÓN DEL PROBLEMA ¿Se podrá cuantificar Escherichia coli productor de β - lactamasas de espectro extendido (BLEE) en puntos críticos de control en camales industriales de la provincia de Pichincha? Objetivos Objetivo General: Cuantificar Escherichia coli productor de β - lactamasas de espectro extendido (BLEE) en puntos críticos de control en camales industriales de la Provincia de Pichincha. Objetivos Específicos: 1. Cuantificar Escherichia coli productor de β - lactamasas de espectro extendido (BLEE) por medio de técnicas de aislamiento cuantitativo. 2. Correlacionar la presencia de Escherichia coli BLEE entre los puntos críticos de control de los camales muestreados. Justificación Escherichia coli es una bacteria con forma de bacilo, Gram negativo que está asociado a diversas enfermedades gastrointestinales, e infecciones extraintestinales como afecciones urinarias, meningitis y sepsis (Murray, Rosenthal, & Pfaller, 2009). Esta bacteria actúa como comensal o patógeno en seres humanos y animales, se encuentra en el medio ambiente y su presencia en alimentos y agua es un indicador de contaminación fecal (Zhao et al., 2012). 14 Los antibióticos β- lactámicos son una de las opciones para el tratamiento de infecciones causadas por estas bacterias. Esto promueve la generación de mecanismos de resistencia en estos microorganismos, como la producción de β lactamasas de espectro extendido (BLEE) que actúan hidrolizando el anillo βlactámico de dichos antibióticos (Ma et al., 2012). E. coli es uno de los microorganismos que son comúnmente resistentes a antibióticos (Abreu et al., 2014). La Organización Mundial de la Salud señala que en la Unión Europea cerca de 25000 muertes anuales se dan por infecciones provocadas por bacterias resistentes a antibióticos (WHO, 2011a). La infección por E. coli BLEE se puede dar por consumo o manipulación de alimentos contaminados, principalmente carne de pollo (Smet et al., 2011). Estas cepas son capaces de transferir sus genes a las bacterias de la microflora intestinal a través de un plásmido de transferencia y estas a su vez pueden actuar como fuente de infección en otras partes del organismo (Abreu et al., 2014). La infección en humanos con organismos productores de betalactamasas a través de la cadena alimenticia, ha sido ampliamente discutida; se han realizado estudios en los que se demuestran la presencia de estos microorganismos en aves de corral y en carne de pollo (Leistner et al., 2013; Abreu et al., 2014). Se ha observado un aumento en la prevalencia de Escherichia coli BLEE en el tracto gastrointestinal de pollos broiler, con rangos que van de 3% en el año 2003 a 15% en el 2008 (Abreu et al., 2013). Durante el procesamiento de aves en los camales, las carcasas pueden contaminarse por la manipulación y por los procesos propios del faenamiento. Escherichia coli, Campylobacter y Salmonella revisten gran importancia en la salud pública al ser descritos como los principales agentes etiológicos de las enfermedades transmitidas por los alimentos en todo el mundo (Gladys & Olayinka, 2014). De acuerdo con esto se han identificado los puntos críticos de 15 riesgo para la contaminación de las carcasas de pollos, estos son: el desangrado, desplumado, evisceración, pre-enfriamiento, enfriamiento y envasado (Molero, 2012; Tsola, Drosinos, & Zoiopoulos, 2008). Siendo los puntos críticos de una planta de faenamiento, la fase del proceso en donde se puede aplicar un control que es esencial para prevenir o eliminar un peligro relacionado con la inocuidad de los alimentos o para reducirlo a un nivel aceptable (Ulrich, 2012). En Ecuador, en 2011 un estudio de caracterización molecular de Escherichia coli uropatogénica resistente a antibióticos, reveló un 22,4% de resistencia a β- lactámicos de amplio espectro (Chiluisa, Vásquez, Zahner, & Silva, 2014). En el país no se han realizado investigaciones sobre Escherichia coli BLEE en alimentos de origen animal (carne de pollo destinada al consumo humano), y tomando en cuenta que el promedio del consumo per cápita de carne de pollo en Ecuador es de 35 kg por habitante (CONAVE, 2013), es de suma importancia aportar con datos que nos permitan tener una visión más clara acerca de epidemiología de esta bacteria en el país. Al término de esta investigación se obtuvieron datos cuantitativos de Escherichia coli BLEE de muestras procedentes de 4 puntos críticos de control (Después del desplume, después del eviscerado, antes y después del Enfriamiento), muestras de ciegos y de agua de los tanques de enfriamiento en dos camales industriales de la provincia de Pichincha. Los puntos críticos seleccionados se identificaron tomando en cuenta las características del proceso de faenamiento y fueron considerados como los de mayor riesgo para la contaminación de las carcasas. 16 CAPITULO II MARCO TEÓRICO Antecedentes de la investigación En el año 2012, en Japón, se analizaron 41 hisopados cloacales en pollos broiler pertenecientes a cuatro granjas comerciales, en el 100% de las muestras se aisló Escherichia coli productor de β- lactamasas (Kameyama et al., 2013). En Estados Unidos, Pensilvania, un estudio de 104 muestras de carne de pollo cruda de tres cadenas comerciales, se obtuvo un total de 9 muestras en las que se identificó Escherichia coli BLEE (Park et al., 2012). En Brasil en 2014, se aisló Escherichia coli resistente a múltiples antibióticos en carne de pollo expendida en supermercados, estas cepas fueron portadoras de variantes genéticas blaCTXM -2 o blaCTXM – 8 (Casella et al., 2015). En Ecuador, en 2012, se aisló Escherichia coli de muestras de pechuga de pollo procedentes de diferentes mercados comerciales de la Provincia de Loja, de las 77 muestras tomadas, el 47% (36/77) estuvieron contaminadas con E. coli (Fernández, 2012). En el año 2014, se realizó un estudio en donde se aisló E. coli BLEE en ciegos de pollos faenados en camales industriales de la provincia de Pichincha. Los resultados indican que de 145 muestras analizadas el 86,89% (126/145) fueron positivas a E. coli BLEE (Vásconez Paucar, 2014). Por lo expuesto anteriormente en nuestro país no se han realizado estudios de cuantificación de Escherichia coli BLEE en carne de pollo. 17 Fundamentación Teórica Historia de Escherichia coli y la resistencia a antibióticos Escherichia coli fue descubierta en 1885 por el pediatra alemán Theodore Escherich durante los estudios que realizó en la flora fecal de neonatos e infantes, denominándola inicialmente como Bacterium coli commune debido a su presencia en pacientes sanos y enfermos (Donnenberg, 2002). En 1928, Alexander Fleming descubre la primera penicilina (García Hernández et al., 2011) al observar que el hongo identificado como Penicillium notatum provocaba la lisis de colonias de Staphylococcus (Fleming, 2001). Tan pronto como se descubrieron los antibióticos, apareció la resistencia de las bacterias a los mismos, es así que Abraham y Chain en 1940 descubren la enzima Penicilinasa, describiéndola como una sustancia en B. coli (ahora Escherichia coli) que inactivaba la acción de la penicilina (Abraham & Chain, 2001; Turner, 2005). Dentro de los mecanismos de resistencia bacteriana destaca el de las βlactamasas de espectro extendido (BLEE), cuya aparición en los años ochenta se atribuyó al uso masivo de cefalosporinas de amplio espectro y aztreonam (García Hernández et al., 2011). 18 Clasificación taxonómica de Escherichia coli Escherichia coli pertenece a la orden Eubacteriales, familia Enterobacteriaceae, tribu Escherichiae, género Escherichia, especie coli (Koneman et al., 2006). Tabla 1. Clasificación científica de Escherichia coli. Dominio Bacteria Reino Bacteria Filo Proteobacteria Clase Gamma Proteobacteria Orden Eubacteriales Familia Enterobacteriaceae Tribu Escherichieae Género Escherichia Especie coli Tomado de: Koneman et al., 2006 Modificado por: La autora Dentro del Género Escherichia se hallan otras especies como: E. adecarboxylata, E. blattae, E. fergusonii, E. hermanii y E. vulneris, de las cuales solo E. coli reviste importancia (Brune, 2013). Existen cepas comensales y cepas patógenas de Escherichia coli, el primer grupo tiene su nicho en la mucosa intestinal de los mamíferos, siendo el anaerobio facultativo más numeroso de la microflora intestinal humana. Estas cepas no desarrollan en sintomatología en el hospedador, excepto casos de inmunosupresión o daño de las barreras gastrointestinales como en la peritonitis (Kaper, Nataro, & Mobley, 2004). Las cepas virulentas de Escherichia coli, poseen factores que les permiten colonizar mucosas y posteriormente producir la enfermedad, se diferencian clínicamente de otras por su epidemiología, sintomatología, las respectivas 19 enfermedades que causan y las interacciones con las células del hospedador (Croxen & Finlay, 2010; Quinn et al., 2011). Además E. coli patógena se agrupa en dos categorías: patógenos Extra intestinales que son los responsables de las infecciones del tracto urinario y de meningitis (E. coli uropatógena, E. coli asociada a meningitis), y patógenos entéricos (Bélanger et al., 2011; da Silva & Mendonça, 2012). Dentro del último grupo se distinguen 6 patotipos de E. coli con diferentes mecanismos de patogenicidad que actúan como agentes etiológicos de infecciones intestinales (Rodríguez-Angeles, 2002). Tabla 2. Patotipos de Escherichia coli. PATOTIPO NOMBRE ETEC E. coli Enterotoxigénica EAEC E. coli Enteroagregativa DAEC E. coli de Adherencia difusa EHEC E. coli Enterohemorrágica EPEC E. coli Enteropatogénica EIEC E. coli Enteroinvasiva Tomado de: Murray et al., 2009 Modificado por: La autora 20 Gráfico 1. Sitios de colonización de Escherichia coli patógena. Escherichia coli puede colonizar varios sitios del cuerpo humano como: el riñón, la vejiga, intestino, cerebro. Tomado de: Croxen & Finlay, 2010 La serotipificación de E. coli se realiza en base a los antígenos somáticos (O), flagelares (H) y capsulares (K). La combinación de los antígenos O y H definen los serotipos, actualmente se conocen alrededor de 170 serogrupos con diferentes antígenos O (Koneman et al., 2006; Murray et al., 2009). Características fisiológicas y estructurales de Escherichia coli Escherichia coli es un bacilo recto gram negativo. Mide entre 1 y 1,5µm x 2 y 6µm, pueden aparecer aislados o en pares. (Stanchi, 2007). Es móvil, no forma esporas, y son anaerobias facultativas (Forbes, Sahm, & Weissfeld, 2007). Es oxidasa negativo, fermenta la glucosa, reducen los nitratos, son catalasa positivos y no produce ácido sulfhídrico (Murray et al., 2009). 21 El rango de temperatura en la que crece E. coli oscila entre los 7 y 50°C, con una temperatura óptima de 37°C, resisten un pH de 4,4 y pueden proliferar en alimentos con una actividad mínima de agua (Aw)de 0,95 (WHO, 2011b). Esta bacteria se recupera con facilidad a partir de muestras clínicas sembradas en medios comunes o selectivos como agar MacConkey, Chromocult, agar Eosina azul de metileno, incubadas a 37° C bajo condiciones aeróbicas (Quinn et al., 2011). Escherichia coli está constituida por la cápsula, pared bacteriana, membrana externa, pili o fimbrias, los flagelos perítricos (Stanchi, 2007). La cápsula tiene actividad antigénica, está formada por polisacáridos (Stanchi, 2007), al parecer brinda la capacidad de evitar la fagocitosis e impide la acción bactericida del suero humano (Abreu Rodríguez, 2012). La pared celular protege a la bacteria del daño mecánico y de la lisis osmótica, formada por una membrana interna o citoplasmática y el peptidoglicano (mureína), (Quinn et al., 2011), consta del espacio periplásmico donde se encuentran las enzimas degradativas como la fosfatasa alcalina, proteasas, β- lactamasas, nucleosidasas y aminoglucósido fosforilasa (Koneman et al., 2006). La membrana externa es una bicapa lipídica asimétrica, constituida por la membrana interna (formada por fosfolípidos) y la capa externa que consta de moléculas de lipopolisacáridos (LPS) termoestables. Los LPS tienen tres dominios: el polisacárido O somático más externo, la región bisagra (antígeno común enterobacteriano), y el lípido A responsable de la actividad de la toxina (Murray et al., 2009). Las fimbrias o pili comprenden dos clases generales: las fimbrias comunes codificadas por el cromosoma, y los pili sexuales que son codificados por 22 plásmidos conjugativos (Quinn et al., 2011), intervienen en la adhesión a las células del hospedador, la autoagregación y el intercambio genético mediante conjugación (Abreu Rodríguez, 2012). E. coli posee entre 5 a 10 flagelos distribuidos alrededor de la superficie, permiten la rotación y el movimiento de la bacteria en ambientes (Moredo, 2012). Los plásmidos constituyen elementos extracromosómicos formados por moléculas circulares de ADN bicatenario que se replican de forma autónoma, sirven como elementos de intercambio genético y propagación de genes de resistencia (Akingbade et al., 2014). Gráfico 2. Estructura antigénica de las Enterobacterias. Tomado de: Murray et al., 2009 23 Resistencia a Antibióticos Los antibióticos son sustancias que inhiben la replicación de los microorganismos, por lo que se emplean para el tratamiento de enfermedades infecciosas (OMS, 2013). La resistencia a los antibióticos que se produce en las bacterias implican un serio problema de salud pública (Mahmood, Roy, Siddiqui, & Shamim, 2015), la OMS define como resistencia a los antibióticos a la resistencia de un microorganismo a un medicamento antimicrobiano al que originalmente era vulnerable (OMS, 2013). Los antibióticos β-lactámicos constituyen la familia más numerosa de antimicrobianos, están constituidos por un anillo β-lactámico formado por la condensación de alanina y β-dimetilcisteína (Abreu Rodríguez, 2012). La acción bactericida de los β-lactámicos se da en la última fase de la síntesis del peptidoglicano de la pared celular, ya que interfieren de forma competitiva sobre las proteínas fijadoras de penicilina (PBP) que son las responsables de producir una serie de enlaces cruzados entre las cadenas de los péptidos. Estos enlaces precisamente confieren mayor rigidez a la pared bacteriana (García, Botteldoorn, & Dierick, 2013). La inhibición generada por los antibióticos β-lactámicos provoca la acumulación de los precursores de peptidoglicano, lo que produce la activación de la enzima bacteriana autolisina que destruyen el remanente de peptidoglicano. La ausencia de la pared celular en las bacterias hace que estas estallen o sean fagocitadas con mayor facilidad (Marín & Gudiol, 2003; Suárez & Gudiol, 2009). En microorganismos Gram negativos como Escherichia coli la resistencia a antibióticos está mediada principalmente por genes móviles en plásmidos que se transmiten fácilmente a las poblaciones bacterianas (Kumarasamy et al., 2010). La producción de enzimas β - lactamasas es el mecanismo de resistencia a los antibacterianos más común en los miembros de la familia Enterobacteriaceae, 24 provocan la hidrólisis del anillo β- lactámico de los antibióticos anulando su acción (Cortés et al., 2010). Existen dos grupos de β - lactamasas: las β - lactamasas del tipo AmpC, y las del tipo BLEE. Las primeras son Serin β - lactamasas o también llamadas cefalosporinasas. Son codificadas por cromosomas, hidrolizan a las aminopenicilinas, cefalosporinas de primera generación, cefamicinas (cefoxitina, cefotetán) y aminopenicilinas combinadas con inhibidores de β - lactamasas (Martínez Rojas, 2009; Tafur, Torres, & Villegas, 2008). Las enzimas tipo BLEE (β - lactamasas de espectro Extendido) degradan las oxiimino-cefalosporinas (cefotaxima, ceftazidima), confieren resistencia a las bacterias contra las penicilinas, cefalosporinas de primera, segunda, tercera generación y aztreonam, a diferencia de las enzimas de tipo AmpC, estas son sensibles a los inhibidores de β – lactamasas como el ácido clavulánico, sulbactam, tazobactam (El Salabi, Walsh, & Chouchani, 2012; Kar et al., 2015; Mosquito, Ruiz, & Ochoa, 2011). 25 Tabla 3. Principales β – lactamasas Familia Grupo/ subgrupo No. de funcional enzimas Enzimas representativas CMY 1, 1e 50 CMY -1 a CMY- 50 TEM 2b, 2be, 2br, 2ber 172 2b 12 TEM -1, TEM – 2, TEM – 13 2be 79 TEM -3. TEM- 10, TEM-26 2br 36 TEM-30 (IRT-2), TEM -31 (IRT-3),TEM – 163 2ber 9 TEM -50 (CMT- 1), TEM -158 (CMT -9) 2b, 2be, 2br 127 2b 30 SHV -1, SHV – 11, SHV -89 2be 37 SHV – 2, SHV – 3, SHV – 115 2br 5 SHV – 10, SHV – 72 CTX-M 2be 90 CTX –M -1, CTX-M-44, a CTX –M- 92 PER 2be 5 PER -1 a PER – 5 VEB 2be 7 VEB -1 a VEB- 7 GES 2f 15 GES – 2 a GES -7, GES -15 KPC 2f 9 KPC- 2 a KPC-10 SME 2f 3 SME -1, SME- 2, SEM -3 OXA 2b, 2de, 2dr SHV 158 2d 5 OXA -1, OXA -2, OXA -10 2de 9 OXA -11, OXA – 14, OXA -15 2df 48 OXA -23, OXA – 51, OXA -58 IMP 3ª 26 IMP -1, IMP -26 VIM 3a 23 VIM – 1, VIM – 23 IND 3ª 8 IND -1, IND -2, IND -2a, IND -3, a IND -7 Tomado de: Bush & Jacoby, 2010 Modificado por: La Autora Estudios realizados demuestran que los genes más prevalentes son blaCTX-M-2, blaCTX-M-8, blaCMY-2, blaCTX-M-1 en la carne de pollo (Chong, Ito, & Kamimura, 2011; Egervärn et al., 2014). 26 Distribución Geográfica y Reservorios de Escherichia coli BLEE Escherichia coli tiene una distribución mundial, y debido a su presencia en el tracto gastrointestinal de animales y humanos, contaminan la vegetación, el suelo y el agua (FAO, 2011). E. coli productor de enzimas BLEE/AmpC ha sido detectado en animales como cerdos, caballos, ganado bovino, perros, gatos y particularmente en aves de corral (Cortés et al., 2010). El tracto gastrointestinal de pollos broiler sanos es considerado un importante reservorio de E. coli BLEE (Bergenholtz, Jørgensen, Hansen, Jensen, & Hasman, 2009). Varios estudios demuestran la presencia de E. coli BLEE en la carne de pollo, es así que en países como Holanda, Alemania y España la prevalencia de E. coli BLEE en carne de pollo varía del 44 a 93% (Egea et al., 2012; Kola et al., 2012; Overdevest et al., 2011) . En Suiza se aisló E. coli BLEE en carne de pollo importada, obteniendo una prevalencia del 95%, 61% y 15% en carne procedente de Brasil, Europa y Dinamarca respectivamente (Egervärn et al., 2014), mientras que en Bélgica la prevalencia de E. coli BLEE en carne de pollo es del 42% (García et al., 2013). En Colombia se asiló E. coli resistente a múltiples antibióticos en un 83% en la carne de pollo analizada (Donado et al., 2015), y en Brasil se aislaron 121 cepas de E. coli BLEE en carne de pollo, siendo CTX-M la principal enzima hallada (Koga et al., 2015). 27 Transmisión Las enfermedades transmitidas por los alimentos son una importante causa de morbilidad y mortalidad en el mundo entero (Stein et al., 2007), así de acuerdo al CDC Escherichia coli O157:H7 ha sido responsable de 265000 infecciones cada año en Estado Unidos (CDC, 2015). Escherichia coli se transmite a los humanos por el consumo de alimentos contaminados (carnes poco cocidas, vegetales), agua contaminada con restos fecales, de persona a persona o a través de animales de granja (Berger et al., 2010; Mead, 2004). La carne de pollo es considerada como una fuente de transmisión de E. coli y genes de resistencia, se ha documentado la presencia de mismo tipo genético de E. coli BLEE en pollos y en seres humanos, representando un riesgo para la producción avícola y la salud humana (Leverstein-van Hall et al., 2011; Olsen, Bisgaard, Löhren, Robineau, & Christensen, 2014; Overdevest et al., 2011; Voets et al., 2013). Otra importante vía de transmisión es la contaminación cruzada, se ha demostrado que el corte y trituración de vegetales aumenta el riesgo de contaminación cruzada con Escherichia coli O157: H7 (Zilelidou, Tsourou, Poimenidou, Loukou, & Skandamis, 2014) . Escherichia coli BLEE ha sido aislado también en las tablas empleadas para cortar los alimentos y en las manos de cocineros, lo que indica una potencial fuente de transmisión de estos microorganismos durante la preparación de alimentos (Tschudin-Sutter et al., 2014). 28 Contaminación de carcasas durante el faenamiento La carne de pollo puede estar contaminada con microorganismos como E. coli, Campylobacter, Salmonella, Listeria, que son considerados como los principales agentes patógenos transmitidos por los alimentos en la industria avícola (Bhaisare, Thyagarajan, Churchil, & Punniamurthy, 2014; Grashorn, 2010). Las carcasas son particularmente susceptibles a la contaminación microbiana debido a su pH (cercano a la neutralidad), a su riqueza en compuestos nitrogenados (aminoácidos) y a la gran humedad. Estos factores favorecen el desarrollo de microorganismos en el músculo y piel de la carne de pollo (Maciel, Carvalho, Wiest, Majolo, & Fröder, 2012). Los microorganismos encontrados en las plantas de faenamiento industriales provienen de dos fuentes principales: el ambiente del camal y el tracto digestivo de las aves (Tsola et al., 2008). La carga bacteriana del ambiente ha sido aislada en muestras de aire, suelo, agua, las superficies del equipo y en los operadores de las plantas (Doyle & Buchanan, 2013). Mientras que el proceso de faenamiento se divide en dos zonas principales: la zona sucia que abarca los procesos de aturdimiento, sangrado, escaldado y eviscerado, y la zona limpia que implica los procesos que se realizan a bajas temperaturas y bajo estricto control de higiene como el enfriamiento y el envasado del producto (Tsola et al., 2008). A su llegada, las aves son ubicadas en el área de recepción considerada como la zona con mayor concentración de contaminación microbiológica (Johnson, 2010). Las aves vivas presentan una alta carga bacteriana en sus intestinos, patas y piel. Durante el proceso de faenamiento los equipos, las manos de los operadores y las carcasas están predispuestos a la contaminación cruzada (Bartkowiak-higgo, 2005). 29 Aturdimiento y Desangrado En Ecuador se emplea el aturdimiento eléctrico empleando una corriente de 80 a 120 volts y de 20 a 45 mAmp (Ulrich, 2012). Esto genera un ataque de tipo epiléptico al ave provocando su insensibilización, y un aumento en la presión sanguínea que va acompañado de un incremento transitorio en la velocidad de los latidos cardíacos. El desangrado se realiza a través del corte de la vena yugular y la arteria carótida (López & Casp, 2004). Debido a que el aturdimiento se realiza empleando al agua como conductor de la electricidad se transfieren bacterias patógenas a las carcasas y equipos (Barco, Belluco, Roccato, & Ricci, 2014). Escaldado y Desplume El escaldado prepara las carcasas para el desplume. Las aves son sumergidas en agua caliente y por acción de esta se rompen las proteínas que sostienen las plumas y abren sus folículos (Davies, Board, & Board, 1998). En el país se emplea un escaldado alto con temperaturas que fluctúan entre 58 y 60°C. Para el desplume, las carcasas pasan a través de dedos de goma que eliminan mecánicamente las plumas y la capa superior de la piel. En estos procesos la contaminación cruzada se da principalmente por la materia orgánica extraída en las plumas (Gladys & Olayinka, 2014; Keener & Bashor, 2004). Evisceración En este punto se da la remoción de los órganos internos (intestinos, molleja, hígado). Durante la evisceración las carcasas generalmente son lavadas con el propósito de disminuir la carga bacteriana y la sangre (Grashorn, 2010), sin embargo en este punto se puede presentar contaminación cruzada por la ruptura del tracto gastrointestinal sobre las carcasas (Gladys & Olayinka, 2014). 30 Enfriamiento El enfriamiento se realiza por inmersión de las carcasas en agua, las canales pasan a través de dos o tres tanques con agua fría generalmente con cloro (Bartkowiak-higgo, 2005). En este punto la temperatura de las carcasas disminuye drásticamente e inhibe el crecimiento bacteriano (Barco et al., 2014). Análisis de Peligros y Puntos Críticos de control El Análisis de Peligro y Puntos Críticos de Control (HACCP) se encarga de la identificación, evaluación y control de peligros sean estos biológicos, físicos o químicos en todas las etapas del faenamiento (Tsola et al., 2008). Durante el procesamiento cada punto donde se rompe la piel del ave, donde el equipo tiene contacto directo con carcasas y donde las canales tienen contacto con el agua es crítico (Mead, 2004). La contaminación cruzada puede darse especialmente durante el escaldado, la evisceración y el enfriamiento (Grashorn, 2010). La USDA ha reconocido la utilidad de carga de E. coli como medida para monitorear las condiciones sanitarias durante el faenamiento de aves. De esta manera se especifica dos criterios de evaluación de control de procesos: los establecimientos deben mantener menos de 100 UFC/ml de E. coli en el 80% de las canales lavadas y nunca deben exceder 1000 UFC/ml (Altekruse et al., 2009). Prevención Debido al reconocimiento de la carne de pollo como una fuente de contaminación de E. coli BLEE para los humanos es esencial tomar medidas preventivas. Para evitar la transmisión de E. coli BLEE o cualquier otro microorganismo se requiere aplicar buenas prácticas de higiene durante el procesamiento de las aves y aplicar un tratamiento bactericida a las carcasas (WHO, 2011b). 31 En cuanto a la preparación de alimentos, tomar en cuenta que E. coli es termosensible, por esto se recomienda la cocción completa de los alimentos (el centro de alcanzar los 70°C) (OMS, 2007) y respetar la temperatura de almacenamiento para evitar la proliferación de bacterias en la carne (García et al., 2013). También es importante utilizar utensilios diferentes (cuchillos, tablas de picar, recipientes) cuando se manipule carnes, pollo o pescado (FAO, 2011). Otra regla fundamental es lavar frutas y verduras utilizando agua microbiológicamente segura (OMS, 2007). 32 CAPÍTULO III METODOLOGÍA Determinación de los métodos a utilizar Tipo de Investigación En el presente estudio se realizó una investigación descriptiva, simple aleatoria. Diseño de la investigación En esta investigación se empleó un diseño observacional, transversal descriptivo, ya que las mediciones de la variable a investigar se realizaron en un periodo de tiempo determinado y no fueron manipuladas deliberadamente (Jaramillo & Marínez, 2010). Descripción de la zona de estudio El trabajo de campo se realizó en dos camales industriales en la Provincia de Pichincha, cantón Quito, parroquias: San Antonio de Pichincha y Pintag. El trabajo de laboratorio se efectuó en el Laboratorio de Bacteriología y Micología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Central del Ecuador. Población La población objeto de estudio de esta investigación correspondió a parvadas de aves de un mismo galpón y una misma granja faenadas en dos camales industriales de la provincia de Pichincha, durante un periodo de 6 meses. Los nombres de las empresas que colaboraron con este proyecto se mantuvieron en anonimato debido a un convenio de confidencialidad establecido, razón por la cual se emplearon códigos alfanuméricos para identificar las muestras tomadas. 33 Tabla 4. Identificación y ubicación de los camales industriales de aves de la provincia de Pichincha. Código Empresa Ubicación 1CT Pintag 2CT San Antonio de Pichincha Fuente: Investigación directa Elaborado por: La Autora Muestra Se empleó un muestreo no probabilístico aleatorio de 10 parvadas faenadas en dos camales industrializados de la Provincia de Pichincha, en cada muestreo se tomó pools de 5 muestras de cada punto crítico de control, así como también muestras de ciegos y agua procedentes de los tanques de enfriamiento tal como se describe en la tabla siguiente. Tabla 5. Descripción de los puntos y unidades de muestreo. CÓDIGO PUNTO DE MUESTREO MUESTRA P Después del desplume 5 muestras de piel de pechuga E Eviscerado 5 muestras de piel de pechuga A Antes del 5 muestras de piel de pechuga Pre- Enfriamiento D Después del Enfriamiento W Agua 5 muestras de piel de pechuga Dos muestras de agua al inicio y al final del muestreo procedentes de los tanques de enfriamiento. C Ciegos 1 muestra (pool de 25 ciegos de pollos) Fuente: Investigación directa Elaborado por: La Autora 34 Toma de Muestras: Se identificó 25 carcasas con una ficha atada al ala para la muestra D (después del Enfriamiento). Se tomó 5 carcasas al azar para las muestras correspondientes a los puntos críticos de control restantes (P, E y A). Se tomó 25 ciegos en el punto de eviscerado para la muestra C. Se tomó entre 20 y 30 ml de agua procedente de los tanques de los tanques de enfriamiento al inicio y al final del proceso de faenamiento para la muestra W. Toma de muestra de piel: Se tomó las carcasas con una funda plástica estéril empleada a manera de guante. Se colocó las carcasas en una superficie limpia, se cortó por el borde la funda plástica con tijeras estériles y se extendió con el fin de obtener un área relativamente estéril alrededor de la carcasa. Se desinfectó la pinza diente de ratón, el bisturí y las tijeras con alcohol al 70%, luego se flamearon con el propósito de consumir el alcohol residual. Se tomó con las pinzas y el bisturí aproximadamente 25 gramos de piel de la pechuga del lado izquierdo, realizando un corte desde el cuello hasta la quilla, se continuó el corte en dirección craneal a nivel de las costillas para terminar en el punto inicial procurando tomar la piel cercana al ala y al cuello. Se colocó las muestras en fundas para Stomacher debidamente identificadas y se almacenaron en un cooler desinfectado. Se transportó las muestras en refrigeración hasta la llegada al laboratorio. 35 Procedimiento de la Investigación: Se realizó en dos etapas: a. Recolección de la Información: Las personas responsables de las plantas de faenamiento proporcionaron la información de las granjas que iban a ser procesadas. Se tomaron las muestras siguiendo el orden indicado en la tabla 5. b. Procesamiento de la Información y muestras en el Laboratorio: Se cuantificó E. coli BLEE en agar TBX+C, siguiendo el protocolo descrito en el anexo 1. Se conservó dos cepas de E.coli BLEE a -80°C, de cada punto muestreado (Ver anexo 2). Técnicas e Instrumentos de Recolección de la Información Registro de muestreos: la recolección de información de la muestra se obtuvo a través de un cuestionario (Ver Anexo 3). Registro de Laboratorio: los datos obtenidos fueron detallados en el registro del Laboratorio de Bacteriología para Cuantificación de E. coli BLEE. Técnicas de Laboratorio Técnica de procesamiento de la muestra La investigación se realizó en base al Protocolo descrito por el departamento de Veterinaria, de Salud Pública y Seguridad Alimentaria de la Universidad de Gante, a la norma NF ISO 16649-2:2001 y a la norma ISO 6579:2002 (Norma ISO para el Aislamiento de Salmonella sp. que se realizó paralelamente a esta investigación) (ISO, 2002; NRL, 2013) 36 La muestra fue procesada de la siguiente manera: Técnica de dilución: Se procesaron las muestras siguiendo el esquema que se presenta en el anexo 1, en el siguiente orden: P, E, A, D, W, C. Se tomó cada muestra y se realizó la primera dilución con peptona bacteriológica obteniendo la dilución 10-1, Se homogenizó la dilución en el Stomacher durante un minuto. Se tomó un mililitro de la dilución 10-1 y se colocó en un tubo de ensayo con 9 mililitros de Peptona Bacteriológica obteniendo la dilución 10-2. Se tomó un mililitro de la dilución 10-2 y se colocó en un tubo de ensayo con 9 mililitros de Peptona Bacteriológica obteniendo la dilución 10-3. Se realizó seis diluciones para la muestra de ciegos siguiendo el mismo procedimiento anterior. Técnica de Aislamiento de Escherichia coli BLEE Siembra en el medio TBX BIO-RAD® 3J1027 Procedimiento de siembra Cada dilución realizada se sembró en por extensión en placa de la siguiente manera: Se tomó 100µl de la dilución 10-3 y se colocó en una caja Petri con agar TBX con Cefotaxima (TBX+C). Se distribuyó todo el inóculo con el asa de Digralsky estéril realizando movimientos circulares a través de toda la caja. (Igual procedimiento se sigue con la dilución 10-2). Se tomó 1000µl de la dilución 10-1 distribuida en dos cajas (500µl cada una). 37 Se distribuyó el inóculo con el asa de Digraslky estéril de la misma manera que las cajas anteriores. Se colocó la segunda capa de medio TBX+C en cada una de las cajas por medio de la técnica de vertido en placa. Gráfico 3. Descripción de la siembra en agar TBX+C. Elaborado por: La autora Incubación Se incubó las cajas Petri sembradas a 37°C por 24 horas. Identificación morfológica de colonias Las colonias de Escherichia coli BLEE son puntiformes verde/azuladas (NRL, 2013). Cuantificación Se seleccionó las cajas de cada muestra que contenían entre 15 y 200 colonias azuladas y se tomó el registro fotográfico cada una de ellas (NRL, 2013). 38 Se cuantificó las colonias y se registró los valores en hojas Excel (Ver anexo 4). Técnica de crioconservación de cepas de Escherichia coli BLEE Se conservó dos colonias azuladas puntiformes aisladas. Se sembró en 300µl de caldo Tripticasa Soya (TSB) contenido en un tubo Eppendorff® Se incubó por 24 horas a 37°C. Se adicionó 600µl glicerol estéril y se guardaron las cepas a -80°C. Técnica de Procesamiento Los datos obtenidos de cada muestreo fueron registrados en Hojas de Microsoft Excel 2010®, así como también información sobre la ubicación, estado sanitario, edad, entre otros datos de las aves faenadas. Análisis de datos La distribución normal de los datos obtenidos fue analizada con la prueba Shapiro – Wilk empleando el software IBM® SPSS ® STATISTICS, Versión 22. Se realizó un análisis de varianza (ANOVA) para comparar los resultados de cuantificación entre muestreos y entre puntos críticos de control, aplicando también la corrección de Bonferroni para el ajuste estadístico de las comparaciones realizadas. Para esto se empleó Microsoft Excel 2010®. 39 CAPÍTULO IV RESULTADOS Presentación de Resultados El aislamiento y cuantificación de E. coli BLEE se realizó en el medio TBX (Triptone Bile X-glucuronide Medium) suplementado con Cefotaxima. En el gráfico 4 se puede observar el crecimiento de colonias verde azuladas, puntiformes de Escherichia coli BLEE. Gráfico 4. Aislamiento de Escherichia coli productor de β - lactamasas de espectro extendido en el medio TBX +C. Escherichia coli posee la enzima glucoronidasa que rompe el complejo cromogénico X- glucuródino presente en el agar TBX. La liberación del cromóforo da la coloración azul verdosa característica a las colonias. La peptona proporciona los nutrientes esenciales para el crecimiento de los microorganismos, mientras que las sales biliares inhiben el crecimiento de bacterias Gram positivas. La Cefotaxima es empleada como un agente selectivo al permitir el crecimiento de bacterias resistentes a β- lactámicos. Fuente: Investigación Directa 40 Durante los seis meses de la investigación se tomó un total de 200 muestras de piel, 50 muestras de agua, y 10 muestras de ciegos (25 ciegos por cada muestra) en las plantas de faenamiento 1CT y 2CT. Tabla 6. Número total de muestras procesadas durante la investigación. EMPRESA Número de Muestreo 1 1CT 2 3 4 5 1 2CT 2 3 4 5 Número total de muestras Número de Muestras Piel Agua Ciegos 20 6 1 20 6 1 20 6 1 20 6 1 20 6 1 20 4 1 20 4 1 20 4 1 20 4 1 20 4 1 200 50 10 Fuente: Investigación directa Elaboración: La Autora Tabla 7. Características de la línea de faenamiento de cada una de las empresas. a Velocidad de la línea Aturdimiento Promedio Temperatura Escaldado Tiempo de Escaldado Tiempo de Desplumado Duchas intermedias Número de Tanques de enfriamiento Temperatura de los tanques de Enfriamiento b a Empresa 1CT 3000 Eléctrico 56,9°C 180 segundos 18 segundos Presentes 3 Empresa 2CT 3000 Eléctrico 52,9°C 150 segundos 25 segundos Presentes 2 Tanque 1: 21,6 Tanque 2: 16,85 Tanque 3: 7,75 Tanque 1: 25,13 Tanque 2: 2,08 Carcasas por hora , b Grados centígrados Fuente: Investigación directa Elaboración: La Autora 41 En las siguientes tablas y gráficos se muestra el promedio, y desviación estándar de las muestras tomadas en cada empresa. Tabla 8. Promedio de UFC/g (Log10) de E. coli BLEE y Desviación Estándar por muestreo en empresas 1CT y 2CT. Punto de muestreo, Promedio* (Desviación Estándar)* # Muestreo 1CT C** 1 2 3 4 5 Promedio 2CT 1 2 3 4 5 Promedio P E A W1 W2 W3 D 5,52 0,0 0,46(1,04) 0,29(0,66) 1,42(0,60) 1,65(0,07) 0,00 2,11(0,24) 4,78 2,01(0,27) 2,27(0,60) 0,26(0,58) 1,24(0,34) 2,50(2,12) 0,00 1,40(0,21) 5,76 6,53 6,43 5,80(0,64) 2,06(0,25) 1,32(0,82) 0,78(0,71) 1,23(0,91) 1,31(1,32) 1,03(0,94) 1,20(0,68) 1,25(1,05) 0,26(0,58) 1,89(1,35) 1,52(0,30) 0,98(1,01) 0,85(1,20) 0,50(0,71) 0,00(0,00) 0,80(0,74) 1,00(1,41) 1,93(0.89) 1,59(0,16) 1,73(1,03) 1,00(1,41) 2,09(0,27) 1,15(0,21) 0,84(0,96) 1,35(0,77) 1,80(0,24) 1,86(1,15) 1,70(0,65) 8,14 6,85 1,30 5,32 6,03 5,52(2,31) 3,07(0,13) 3,02(0,15) 2,84(0,38) 2,94(0,56) 2,37(0,26) 2,84(0,40) 3,62(0,09) 3,55(0,67) 3,24(0,28) 3,60(0,58) 2,90(0,58) 3,38(0,52) 3,50(0,19) 3,18(0,43) 2,97(0,76) 2,95(0,33) 2,36(0,46) 2,99(0,57) 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 - 2,55(0,69) 2,50(0,45) 1,89(0,25) 1,22(0,76) 1,29(0,81) 1,89(0,81) C. Ciegos, P. Después del desplume, E. Eviscerado, A. Antes del Enfriamiento, W1. Tanque de enfriamiento 1, W2. Tanque de enfriamiento 2, W3. Tanque de enfriamiento 3, D. Después del enfriamiento. *Los valores están expresados en UFC/g Log10. **Una sola muestra, no aplica desviación estándar Fuente: Investigación directa Elaboración: La Autora 42 Gráfico 5. Promedio de UFC/g (Log10) de Escherichia coli BLEE en cada punto muestreado en la empresa 1CT. 2,50 UFC/g (log10) 2,00 1,50 Muestreo 1 Muestreo 2 Muestreo 3 1,00 Muestreo 4 Muestreo 5 0,50 0,00 P E A D Puntos de Muestreo P. Después del desplume, E. Eviscerado, A. Antes del Enfriamiento D. Después del Enfriamiento. Fuente: Investigación directa Elaboración: La Autora 43 Gráfico 6. Promedio de UFC/g (Log10) de Escherichia coli BLEE en cada punto muestreado en la empresa 2CT. 4,00 3,50 UFC/g (log10) 3,00 2,50 Muestreo 1 Muestreo 2 2,00 Muestreo 3 1,50 Muestreo 4 Muestreo 5 1,00 0,50 0,00 P E A D Puntos de Muestreo P. Después del desplume, E. Eviscerado, A. Antes del Enfriamiento D. Después del Enfriamiento. Fuente: Investigación directa Elaboración: La Autora 44 Gráfico 7. Promedio y desviación estándar de UFC/g (Log10) de Escherichia coli BLEE en las empresas 1CT y 2CT. 4,50 4,00 3,50 UFC/g (Log10) 3,00 2,50 EMPRESA 1CT 2,00 EMPRESA 2CT 1,50 1,00 0,50 0,00 P -0,50 E A D Puntos muestreados P. Después del desplume, E. Eviscerado, A. Antes del Enfriamiento D. Después del Enfriamiento. Fuente: Investigación directa Elaboración: La Autora 45 Tabla 9. Promedio de UFC/ml (Log10) de E. coli BLEE y ppm de Cloro de los tanques de Enfriamiento de las empresas 1CT y 2CT. Empresa 1CT 2CT Promedio*, (Cloro**) Pre-enfriamiento 1 Pre-enfriamiento 2 W1 W2 1,43 (0,30) 1,65 (0,30) 1,24 (1,00) 2,50 (0,00) 0,85 (0,00) 1,00 (0,00) 0,50 (0,15) 1,93 (0,00) 0,00 (0,60) 1,59 (0,25) 0,80 (0,41) 1,73 (0,11) 0,00 (20,0) 0,00 (19,0) 0,00 (17,0) 0,00 (17,5) 0,00 (16,2) 0,00 (20,0) 0,00 (16,5) 0,00 (19,0) 0,00 (17,2) 0,00 (20,0) 0,00 (17,1) 0,00 (19,1) # de muestreo 1 2 3 4 5 PROMEDIO 1 2 3 4 5 PROMEDIO *Los valores están expresados en UFC/g Log10. Enfriamiento 3 W3 0,00 (0,30) 0,00 (0,00) 1,00 (0,00) 2,09 (0,00) 1,15 (0,05) 0,84 (0,07) - **Los valores están expresados en ppm. Fuente: Investigación directa Elaboración: La Autora Gráfico 8. UFC/ml (Log10) de Escherichia coli BLE y ppm de cloro en los tanques de enfriamiento de la empresa 1CT. 2 1,8 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 0,11 0,41 0,07 1,73 Cloro ppm UFC/g Log10 0,84 0,80 W1 W2 W3 Tanques de Enfriamiento W1. Tanque de enfriamiento 1, W2. Tanque de enfriamiento 2, W3. Tanque de enfriamiento 3 Fuente: Investigación directa Elaboración: La Autora 46 Distribución Normal de datos Tabla 10. Prueba Shapiro - Wilk empresa 1CT y 2CT. 1CT Estadístico gl 2CT Estadístico gl Punto de P valor* Muestreo P 0,816 25 0,000 E 0,858 25 0,002 A 0,836 25 0,001 D 0,832 25 0,001 gl. Grados de Libertad, *P valor (> 0,05) 0,963 0,954 0,987 0,939 25 25 25 25 P valor* 0,481 0,307 0,980 0,139 Fuente: Investigación directa Elaboración: La Autora La normalidad de los datos fue analizada con la prueba Shapiro – Wilk. Se consideró que los datos tuvieron una distribución normal si el P valor calculado fue mayor a 0,05. Como se observa en la Tabla 10, los datos de la empresa 1CT no presentaron una distribución normal (P valor < 0,05), por este motivo no se realizó el ANOVA propuesto en este estudio ya que la normalidad de los datos es un requisito previo para dicho análisis. Dado que los datos de la empresa 2CT sí presentaron una distribución normal (P valor >0,05), se procedió a realizar el análisis de varianza. Análisis de Varianza Tabla 11. Análisis de varianza empresa 2CT. Grupos P E A D Cuenta 25 25 25 25 Suma 71,16 84,55 74,8 47,26 Promedio 2,8464 3,382 2,992 1,8904 Varianza 0,16 0,27 0,33 0,66 47 Origen de las variaciones Suma de cuadrados Entre grupos Dentro de los Grupos 30,07 Grados de libertad 3 34,54 96 Total 64,62 99 Promedio F Probabilidad de los cuadrados 10,02 27,86 0,000 Valor crítico para F 2,69 0,35 Fuente: Investigación directa Elaboración: La Autora El análisis de Varianza de la empresa 2CT indica que existe una diferencia significativa entre los grupos analizados (Probabilidad < a 0,05), se realizó las correcciones de Bonferroni para ajustar los resultados estadísticos en las múltiples comparaciones que se efectuaron. Las correcciones de Bonferroni se realizaron empleando la prueba t para dos colas muestras suponiendo varianzas iguales en Microsoft Excel®. Para esto se dividió el p- valor (0,05) para el número de comparaciones (6). Se compara el valor P- Bonferroni con el valor de T a dos colas, si el primero es mayor se rechaza la hipótesis nula y existe diferencia. 48 Correcciones de Bonferroni Tabla 12. Correcciones de Bonferroni empresa 2CT. Comparación Después del desplume: después de eviscerado Después del desplume: antes del enfriamiento Después del desplume: después del enfriamiento Después de Evisceración: antes del enfriamiento Después de Evisceración: después del enfriamiento Antes del enfriamiento: después del enfriamiento t valor p en la prueba t student a dos colas Valor pt Diferencia 0,000 Valor P- Bonferroni 0,008 0,305 0,008 No 0,000 0,008 Sí 0,016 0,008 No 0,000 0,008 Sí 0,000 0,008 Sí Sí Fuente: Investigación directa Elaboración: La Autora Discusión En la presente investigación se aisló y cuantificó E. coli productor de β lactamasas de Espectro Extendido en diferentes etapas del proceso de faenamiento de pollos broiler en dos camales industriales de la Provincia de Pichincha. El promedio de contaminación de E. coli BLEE en ciegos fue de 5,80 UFC/g Log10 y 5,52 UFC/g Log10 en la empresa 1CT y 2CT respectivamente, esta carga bacteriana indicó la contaminación inicial de E. coli BLEE en las parvadas muestreadas. E. coli BLEE fue aislada en todas las muestras de ciegos tomadas (n=10), esto concuerda con estudios como el realizado en Alemania en donde se aisló E. coli BLEE en el 72,5% de los ciegos analizados (n=51) (Reich, Atanassova, & Günter, 2013). De la misma manera en Ecuador se encontró un 86,89% de positividad de E. coli BLEE en muestras de ciegos de pollos faenados en camales industriales de Pichincha (Vásconez Paucar, 2014). 49 La normalidad de los datos fue analizada con la prueba Shapiro – Wilk. Los datos de la empresa 1CT no tuvieron una distribución normal por lo que no se pudo realizar el análisis de varianza propuesto en este estudio. Los datos de la empresa 2CT presentaron una distribución normal (Shapiro – Wilk > 0,05), se realizó el Análisis de varianza y se encontró diferencias significativas en todos los puntos excepto dos (P y A; E y A), por lo que los valores que a continuación se menciona pertenecen a esta empresa. Después del desplume los valores de E. coli BLEE disminuyeron respecto a la contaminación de ciegos, el valor fue 2,84 UFC/g Log10. De manera similar otro estudio reportó valores de E. coli de 2,24 UFC/g después del escaldado y desplumado (n=144) (Vaidya, Paturkar, Waskar, Zende, & Rawool, 2005). Se ha demostrado que la temperatura del agua del escaldado y el tiempo de inmersión disminuye la carga bacteriana de las carcasas. Un estudio realizado en Grecia demostró que la tasa de disminución de E. coli durante el escaldado es mayor en los primeros 10 segundos de inmersión y sigue disminuyendo de manera constante hasta 150 segundos después de la inmersión a 42°C (Cason, Buhr, & Jr, 2006). En el presente estudio la temperatura promedio de escaldado fue 52,9°C con un tiempo de inmersión de 150 segundos, lo que causaría la disminución de la carga bacteriana en este punto del proceso. El punto en donde se registró una mayor carga bacteriana de E. coli BLEE fue en la evisceración con un valor de 3,38 UFC/g Log10. Esto concuerda con estudios realizados en la India y Argentina en donde las cargas bacterianas de E. coli en carcasas de pollo después del eviscerado fueron 3,07 UFC/g Log10 y 3,54 UFC/g Log10 respectivamente (Jiménez, Tiburzi, Salsi, Pirovani, & Moguilevsky, 2003; Vaidya et al., 2005). 50 El aumento de la carga bacteriana en la evisceración puede darse por la ruptura del tracto gastrointestinal de las aves durante el proceso. Así, en Brasil se determinó que la mayor incidencia de contaminación en la línea de evisceración fue fecal y biliar lo que facilitaría la propagación de microorganismos de una canal a otra (Brizio, Marin, Schittler, & Prentice, 2015). Antes del enfriamiento, el número de UFC de E. coli BLEE decreció de 3,38 a 2,99 UFC/g Log10, al igual que en una investigación realizada en Australia (n=240) en donde el conteo de E. coli disminuyó de 7,01 UFC/g Log10 a 6,9 UFC/g Log10 en este punto del faenamiento (Duffy, Blackall, Cobbold, & Fegan, 2014). Esto se explicaría por la acción de las duchas intermedias que son empleadas para remover sólidos y contaminación fecal visible de las carcasas antes del enfriamiento. En Atenas se reportó la disminución de E. coli de 4,60 a 4,41 UFC/ml Log10 antes y después del lavado de las canales (Berrang & Bailey, 2009). En el presente estudio no hubo diferencia estadística entre la evisceración y antes del enfriamiento, lo que evidencia una falta de efectividad de las duchas presentes entre estos dos pasos sobre la carga bacteriana de las carcasas. Después del enfriamiento la cantidad de E. coli BLEE disminuyó en 1,1 UFC/g Log10. La cantidad de cloro empleada fue 17,1 y 19,1 ppm en los tanques de enfriamiento 1 y 2 respectivamente. La disminución de la carga bacteriana puede atribuirse a la cantidad de cloro empleada en los tanques de enfriamiento, tal como lo demuestran un estudio realizado en la Universidad de Georgia en donde se reportó un decremento de 1,4 UFC/g Log10 de E. coli cuando se empleó 20 ± 2ppm de cloro en el agua de los tanques de enfriamiento (Northcutt, Berrang, Dickens, Fletcher, & Cox, 2003). E. coli BLEE fue aislado en el de agua de enfriamiento de la empresa 1CT en donde se registró 0,8; 1,7 y 0,8 UFC /ml Log10 en los tanques de enfriamiento 1, 2 y 3 correspondientemente. Los promedios de cloro en el agua fueron 0,41; 0,11 y 51 0,07ppm, en contraste con la empresa 2CT Los niveles bajos de cloro en la empresa 1CT no tendrían un efecto marcado en la disminución de la carga microbiana del agua utilizada para el enfriamiento lo que puede conducir a la contaminación cruzada y recontaminación de carcasas. Esto concuerda con el estudio realizado en Buenos Aires en donde se aisló E. coli Enteropatógena en el agua de enfriamiento de un camal de faenamiento de pollos broiler (Alonso, Padola, Parma, & Lucchesi, 2011). Además se conoce que Escherichia coli crece a 7°C, y la temperatura mínima que alcanzó el tanque de enfriamiento 3 fue 7,75°C lo cual facilitaría la sobrevivencia de la bacteria en este punto (James, Vincent, de Andrade Lima, & James, 2006). Las diferencias reportadas se atribuyen a las características propias de la empresa, varias investigaciones demuestran la variabilidad en la carga bacteriana en diferentes procesos de faenamiento (Cibin et al., 2014; Seliwiorstow, Baré, Van Damme, Uyttendaele, & De Zutter, 2015). De nuestro conocimiento, el presente estudio es la primera investigación en la que se reporta la contaminación de E. coli BLEE en la piel de pollo, recolectadas en puntos críticos durante el faenamiento en Ecuador. Los resultados muestran que la carga bacteriana persiste en el pollo aun después de las duchas y del enfriamiento, lo que indica que las empresas deben mejorar sus procesos de evisceración, lavado y enfriamiento con el propósito de disminuir la cantidad de E. coli BLEE y otros microorganismos potencialmente patógenos para los seres humanos. 52 CAPÍTULO V CONCLUSIONES Y RECOMENDACIONES Conclusiones 1. La cuantificación de E. coli productor de β-lactamasas de espectro extendido (BLEE) en la empresa 1CT y 2CT se realizó mediante la técnica de cuantificación de diluciones decimales. 2. Los datos de cuantificación de E. coli BLEE de la empresa 1CT no tuvieron una distribución normal, lo que indica una falta de uniformidad entre los procesos de faenamiento. 3. El valor cuantificado de E. coli BLEE en la evisceración fue 3,38 UFC/g Log10 siendo este el punto en donde se registró una mayor carga bacteriana de las carcasas en la empresa 2CT. 4. La cuantificación de Escherichia coli BLEE demostró que la carga bacteriana no disminuye después del lavado de las carcasas en la empresa 2CT. 5. Los niveles de cloro (17,1 y 19,1 ppm) utilizados en el agua durante el enfriamiento de las carcasas en la empresa 2CT ejercen un efecto importante en la disminución de la carga bacteriana. 53 Recomendaciones 1. La evisceración es un punto susceptible a ser mejorado debido al incremento en la carga bacteriana registrada en este punto. 2. Se debería mejorar el proceso de lavado de las carcasas cerciorándose de que las duchas presentes después de la evisceración ejerzan una disminución en la carga bacteriana. 3. Se recomienda investigar la presencia de E. coli productor de β- lactamasas de espectro extendido en el producto en percha con el propósito de evaluar el riesgo que representan para la población. 4. Se debería investigar los genes de resistencia presentes en las cepas coleccionadas durante la presente investigación para conocer los genes de mayor prevalencia. 5. Mantener medidas de higiene cuando se manipule la carne de pollo para evitar la contaminación cruzada. 54 REFERENCIAS BIBLIOGRÁFICAS Abraham, E. P., & Chain, E. (2001). An enzyme from bacteria able to destroy penicillin. 1940. Reviews of Infectious Diseases, 10(4), 677–678. doi:10.1038/146837a0 Abreu, R., Castro, B., Espigares, E., Rodríguez-Álvarez, C., Lecuona, M., Moreno, E., … Arias, A. (2014). Prevalence of CTX-M-Type Extended-Spectrum βLactamases in Escherichia coli Strains Isolated in Poultry Farms. Foodborne Pathogens and Disease, 11(11), 868–73. doi:10.1089/fpd.2014.1796 Abreu, R., Castro, B., Madueño, A., Espigares, E., Moreno Roldán, E., Moreno, P., … Arias, A. (2013). Prevalencia de cepas de Escherichia coli productoras de betalactamasas de espectro extendido ( BLEE ) aisladas en pollos de granjas avícolas de la isla de Tenerife ( España ). Higiene Y Sanidad Ambiental, 13(4), 1091–1096. Abreu Rodríguez, R. (2012). Prevalencia de Enterobacterias productoras de ßlactamasas de espectro extendido ( BLEE ), en exudados rectales de pollos de engorde en granjas avícolas en la isla de Tenerife , España. Universidad de la Laguna. Ahmed, A. M., & Shimamoto, T. (2014). Isolation and molecular characterization of Salmonella enterica, Escherichia coli O157:H7 and Shigella spp. from meat and dairy products in Egypt. International Journal of Food Microbiology, 168169, 57–62. doi:10.1016/j.ijfoodmicro.2013.10.014 Akingbade, O., Balogun, S., Ojo, D., Akinduti, P., Okerentugba, P., Nwanze, J., & Okonko, I. (2014). Resistant plasmid profile analysis of multidrug resistant Escherichia coli isolated from urinary tract infections in Abeokuta , Nigeria. African Health Science, 14(4), 2–6. doi:dx.doi.org/10.4314/ahs.v14i4.8 Introduction Alonso, M. Z., Padola, N. L., Parma, a. E., & Lucchesi, P. M. a. (2011). Enteropathogenic Escherichia coli contamination at different stages of the chicken slaughtering process. Poultry Science. Buenos Aires. doi:10.3382/ps.2011-01621 Altekruse, S. F., Berrang, M. E., Marks, H., Patel, B., Shaw, W. K., Saini, P., … Bailey, J. S. (2009). Enumeration of Escherichia coli cells on chicken carcasses as a potential measure of microbial process control in a random selection of slaughter establishments in the United States. Applied and Environmental Microbiology, 75(11), 3522–3527. doi:10.1128/AEM.02685-08 Barco, L., Belluco, S., Roccato, A., & Ricci, A. (2014). Escherichia coli and Enterobacteriaceae counts on poultry carcasses along the slaughter 55 processing line, factors influencing the counts and relationship between visual faecal contamination of carcasses and counts: a review. Venecia. Bartkowiak-higgo, A. (2005). A survey of post-evisceration contamination of broiler carcasses and ready-to-sell livers and intestines (mala) with Campylobacter jejuni and Campylobacter coli in a high throughput South African poultry abattoir. Universidad de Pretoria. Bélanger, L., Garenaux, A., Harel, J., Boulianne, M., Nadeau, E., & Dozois, C. M. (2011). Escherichia colifrom animal reservoirs as a potential source of human extraintestinal pathogenic E. coli. FEMS Immunology and Medical Microbiology. doi:10.1111/j.1574-695X.2011.00797.x Bergenholtz, R. D., Jørgensen, M. S., Hansen, L. H., Jensen, L. B., & Hasman, H. (2009). Characterization of genetic determinants of extended-spectrum cephalosporinases (ESCs) in Escherichia coli isolates from Danish and imported poultry meat. Journal of Antimicrobial Chemotherapy. doi:10.1093/jac/dkp168 Berger, C. N., Sodha, S. V, Shaw, R. K., Griffin, P. M., Pink, D., Hand, P., & Frankel, G. (2010, September). Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environmental Microbiology. doi:10.1111/j.1462-2920.2010.02297.x Berrang, M. E., & Bailey, J. S. (2009). On-line brush and spray washers to lower numbers of Campylobacter and Escherichia coli and presence of Salmonella on broiler carcasses during processing. Journal of Applied Poultry Research, 18(1), 74–78. doi:10.3382/japr.2008-00067 Bhaisare, D. B., Thyagarajan, D., Churchil, R. R., & Punniamurthy, N. (2014). Bacterial Pathogens in Chicken Meat : Review. International Journal of Life Sciences Research, 2(3), 1–7. Brizio, A., Marin, G., Schittler, L., & Prentice, C. (2015). Visible contamination in broiler carcasses and its relation to the stages of evisceration in poultry slaughter. International Food Research Journal, 22(1), 59–63. Retrieved from http://www.ifrj.upm.edu.my Brune, A. (2013). The Prokaryotes. doi:10.1007/978-3-642-30194-0 Bush, K., & Jacoby, G. a. (2010). Updated functional classification of Blactamases. Antimicrobial Agents and Chemotherapy. doi:10.1128/AAC.01009-09 Casella, T., Rodríguez, M. M., Takahashi, J. T., Ghiglione, B., Dropa, M., Assunção, E., … Nogueira, M. C. L. (2015). Detection of blaCTX-M-type 56 genes in complex class 1 integrons carried by Enterobacteriaceae isolated from retail chicken meat in Brazil. International Journal of Food Microbiology, 197, 88–91. doi:10.1016/j.ijfoodmicro.2014.12.001 Cason, J. A., Buhr, R. J., & Jr, A. H. (2006). Release of Escherichia coli from Feathered and Featherless Broiler Carcasses in Warm Water. Oxford Journals, 1807–1810. CDC. (2015). Centro para el control y prevención de enfermedades. Retrieved January 22, 2015, from http://www.cdc.gov/foodcore/index.html Chiluisa, C., Vásquez, R., Zahner, V., & Silva, P. (2014). Caracterización molecular de Escherichia coli uropatogénica resistentes a los antibióticos B-lactámicos, quinolonas y aminoglucósidos aislados en Quito, Ecuador. Quito. Chong, Y., Ito, Y., & Kamimura, T. (2011). Genetic evolution and clinical impact in extended-spectrum B-lactamase-producing Escherichia coli and Klebsiella pneumoniae. Infection, Genetics and Evolution. doi:10.1016/j.meegid.2011.06.001 Cibin, V., Mancin, M., Pedersen, K., Barrucci, F., Belluco, S., Roccato, A., … Ricci, A. (2014). Usefulness of Escherichia coli and Enterobacteriaceae as Process Hygiene Criteria in poultry: experimental study. Retrieved from www.efsa.europa.eu/publications Cohen Stuart, J., van den Munckhof, T., Voets, G., Scharringa, J., Fluit, A., & Hall, M. L. Van. (2012). Comparison of ESBL contamination in organic and conventional retail chicken meat. International Journal of Food Microbiology, 154(3), 212–214. doi:10.1016/j.ijfoodmicro.2011.12.034 CONAVE. (2013). Información sobre el sector avícola del Ecuador. Retrieved January 22, 2015, from http://www.conave.org/upload/noticias/Estadisticas avicolas CONAVE.pdf Cortés, P., Blanc, V., Mora, A., Dahbi, G., Blanco, J. E., Blanco, M., … Llagostera, M. (2010). Isolation and Characterization of Potentially Pathogenic Antimicrobial-Resistant Escherichia coli Strains from Chicken and Pig Farms in Spain. Applied and Environmental Microbiology, 76(9), 2799–2805. doi:10.1128/AEM.02421-09 Croxen, M. a, & Finlay, B. B. (2010). Molecular mechanisms of Escherichia coli pathogenicity. Nature Reviews. Microbiology, 8(1), 26–38. doi:10.1038/nrmicro2265 57 Da Silva, G. J., & Mendonça, N. (2012). Association between antimicrobial resistance and virulence in Escherichia coli. Virulence. doi:10.4161/viru.3.1.18382 Davies, A., Board, R. G., & Board, R. J. (1998). Microbiología de la carne y de las aves de corral. (A. Davies & R. Board, Eds.) (Primera Ed). Boundary Row: Springer Science & Business Media. De Been, M., Lanza, V. F., de Toro, M., Scharringa, J., Dohmen, W., Du, Y., … van Schaik, W. (2014). Dissemination of Cephalosporin Resistance Genes between Escherichia coli Strains from Farm Animals and Humans by Specific Plasmid Lineages. PLoS Genetics, 10(12), e1004776. doi:10.1371/journal.pgen.1004776 Depoorter, P., Persoons, D., Uyttendaele, M., Butaye, P., De Zutter, L., Dierick, K., … Dewulf, J. (2012). Assessment of human exposure to 3rd generation cephalosporin resistant E. coli (CREC) through consumption of broiler meat in Belgium. International Journal of Food Microbiology, 159(1), 30–38. doi:10.1016/j.ijfoodmicro.2012.07.026 Donado, P., Byrne, B., León, M., Castellanos, R., Vanegas, C., Coral, A., … Smit, W. (2015). Prevalence, Resistance Patterns, and Risk Factors for Antimicrobial Resistance in Bacteria from Retail Chicken Meat in Colombia. Journal of Food Protection, (4), 636 – 858. doi:dx.doi.org/10.4315/0362028X.JFP-14-349 Donnenberg, M. (2002). E. coli: Virulence Mechanisms of Versatile Pathogen. In M. Donnenberg (Ed.), Escherichia Coli (pp. xxi–I). Elsevier Science. doi:10.1016/B978-012220751-8/50001-X Doyle, M., & Buchanan, R. (Eds.). (2013). Microbiología de Alimentos: Fundamentos y Fronteras (4ta ed., Vol. 106). Washington: American Society for Microbiology. doi:10.1039/9781847557940 Duffy, L. L., Blackall, P. J., Cobbold, R. N., & Fegan, N. (2014). International Journal of Food Microbiology Quantitative effects of in-line operations on Campylobacter and Escherichia coli through two Australian broiler processing plants. International Journal of Food Microbiology, 188, 128–134. doi:10.1016/j.ijfoodmicro.2014.07.024 Egea, P., López-Cerero, L., Torres, E., Gómez-Sánchez, M. del C., Serrano, L., Navarro Sánchez-Ortiz, M. D., … Pascual, A. (2012). Increased raw poultry meat colonization by extended spectrum beta-lactamase-producing Escherichia coli in the south of Spain. International Journal of Food Microbiology, 159(2), 69–73. doi:10.1016/j.ijfoodmicro.2012.08.002 58 Egervärn, M., Börjesson, S., Byfors, S., Finn, M., Kaipe, C., Englund, S., & Lindblad, M. (2014). Escherichia coli with extended-spectrum beta-lactamases or transferable AmpC beta-lactamases and Salmonella on meat imported into Sweden. International Journal of Food Microbiology, 171, 8–14. doi:10.1016/j.ijfoodmicro.2013.11.005 El Salabi, A., Walsh, T. R., & Chouchani, C. (2012). Extended spectrum βlactamases, carbapenemases and mobile genetic elements responsible for antibiotics resistance in Gram-negative bacteria. Critical Reviews in Microbiology. doi:10.3109/1040841X.2012.691870 FAO. (2011). Prevención de la E.coli en los alimentos. El Marco de Gestión de Crisis Para La Cadena Alimentaria (FCC), 0–15. Fernández, W. (2012). Determinación de Escherichia coli por métodos de placas Petrifilm y Agar Mac Conkey en presas de pollo seleccionadas (pechugas) que se cormecializan en la ciudad de Loja. Universidad Nacional de Loja. Retrieved from http://dspace.unl.edu.ec:8080/xmlui/bitstream/handle/123456789/4343/ARELL ANO WASHINGTON - JIMENEZ GALO.pdf?sequence=1 Fleming, A. (2001). On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae. 1929. Bulletin of the World Health Organization, 79(8), 780–790. doi:10.1038/146837a0 Forbes, B., Sahm, D., & Weissfeld, A. (2007). Baily and Scott’s Diagnostic Microbiology. (L. Wilson, Ed.) (12th ed.). China: Mosby Elsevier. García, G., Botteldoorn, N., & Dierick, K. (2013). Microbial surveillance of ESBL E. coli in poultry Meat, a possible vehicle for transfer of antimicrobial resistance to humans. Food Consumer Protection. García Hernández, A., García Vázquez, E., Hernández Torres, A., Ruiz, J., Yagüe, G., Herrero, J., & Gómez, J. (2011). Bacteriemias por Escherichia coli productor de betalactamasas de espectro extendido (BLEE): significación clínica y perspectivas actuales. Revista Española de Quimioterapia, 24(2), 57–66. Gladys, T. A., & Olayinka, I. (2014, March 12). Salmonella and Escherichia coli contamination of poultry meat from a processing plant and retail markets in Ibadan, Oyo State, Nigeria. doi:10.1186/2193-1801-3-139 Grashorn, M. A. (2010). Research into poultry meat quality. British Poultry Science, 51 Suppl 1(February 2015), 60–67. doi:10.1080/00071668.2010.506761 59 Hammerum, A. M., & Heuer, O. E. (2009). Human health hazards from antimicrobial-resistant Escherichia coli of animal origin. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society of America, 48(7), 916–921. doi:10.1086/597292 Hayhurst, C. (2004). Epidemics deadly diseases throughout History E. coli (1st ed.). The Rosen. ISO. (2002). ISO 6579:2002 Microbiology of food and animal feeding stuffs Horizontal method for the detection of Salmonella spp. Retrieved July 20, 2015, from http://www.iso.org/iso/catalogue_detail.htm?csnumber=29315 James, C., Vincent, C., de Andrade Lima, T. I., & James, S. J. (2006). The primary chilling of poultry carcasses-a review. International Journal of Refrigeration. doi:10.1016/j.ijrefrig.2005.08.003 Jaramillo, C., & Marínez, J. (2010). Epidemiología veterinaria. México: Manual Moderno. Jiménez, S. M., Tiburzi, M. C., Salsi, M. S., Pirovani, M. E., & Moguilevsky, M. a. (2003). The role of visible faecal material as a vehicle for generic Escherichia coli, coliform, and other enterobacteria contaminating poultry carcasses during slaughtering. Journal of Applied Microbiology, 95(3), 451–456. doi:10.1046/j.1365-2672.2003.01993.x Johnson, A. (2010). Airborne Campylobacter in a Poultry Processing Plant. Virginia Polytechnic Insititute and State University. Kameyama, M., Chuma, T., Yabata, J., Tominaga, K., Iwata, H., & Okamoto, K. (2013). Prevalence and Epidemiological Relationship of CMY-2 AmpC betaLactamase and CTX-M Extended-Spectrum beta-Lactamase-Producing Escherichia coli Isolates from Broiler Farms in Japan. Journal of Veterinary Medical Science, 75(8), 1009–1015. doi:10.1292/jvms.12-0453 Kaper, J. B., Nataro, J. P., & Mobley, H. L. (2004). Pathogenic Escherichia coli. Nature Reviews. Microbiology, 2(2), 123–140. doi:10.1038/nrmicro818 Kar, D., Bandyopadhyay, S., Bhattacharyya, D., Samanta, I., Mahanti, A., Nanda, P. K., … Singh, R. K. (2015). Molecular and phylogenetic characterization of multidrug resistant extended spectrum beta-lactamase producing Escherichia coli isolated from poultry and cattle in Odisha, India. Infection, Genetics and Evolution, 29, 82–90. doi:10.1016/j.meegid.2014.11.003 Keener, K., & Bashor, M. (2004). Comprehensive review of Campylobacter and poultry processing. Comprehensive Reviews in Food Science and Food Safety, 3, 105–116. doi:10.1111/j.1541-4337.2004.tb00060.x 60 Koga, V. L., Rodrigues, G. R., Scandorieiro, S., Vespero, E. C., Oba, A., Brito, B. G. de, … Kobayashi, R. K. T. (2015). Evaluation of the Antibiotic Resistance and Virulence of Escherichia coli Strains Isolated from Chicken Carcasses in 2007 and 2013 from Paraná, Brazil. Foodborne Pathogens and Disease, 150514115427001. doi:10.1089/fpd.2014.1888 Kola, a., Kohler, C., Pfeifer, Y., Schwab, F., Kühn, K., Schulz, K., … Steinmetz, I. (2012). High prevalence of extended-spectrum-β-lactamase-producing Enterobacteriaceae in organic and conventional retail chicken meat, Germany. Journal of Antimicrobial Chemotherapy, 67(11), 2631–2634. doi:10.1093/jac/dks295 Koneman, E., Procop, G., Schreckenberger, P., Woods, G., Winn, W., Allen, S., & Janda, W. (2006). Diagnóstico Microbiológico texto y atlas a color (6ta ed.). Buenos Aires: Panamericana. Kumarasamy, K. K., Toleman, M. a., Walsh, T. R., Bagaria, J., Butt, F., Balakrishnan, R., … Woodford, N. (2010). Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: A molecular, biological, and epidemiological study. The Lancet Infectious Diseases, 10, 597–602. doi:10.1016/S1473-3099(10)70143-2 Laube, H., Friese, a., von Salviati, C., Guerra, B., Käsbohrer, a., Kreienbrock, L., & Roeslera, U. (2013). Longitudinal monitoring of extended-spectrum-betalactamase/ampC-producing Escherichia coli at german broiler chicken fattening farms. Applied and Environmental Microbiology, 79(16), 4815–4820. doi:10.1128/AEM.00856-13 Leistner, R., Meyer, E., Gastmeier, P., Pfeifer, Y., Eller, C., Dem, P., & Schwab, F. (2013). Risk factors associated with the community-acquired colonization of extended-spectrum beta-lactamase (ESBL) positive Escherichia Coli. an exploratory case-control study. PloS One, 8(9), e74323. doi:10.1371/journal.pone.0074323 Leverstein-van Hall, M. A., Dierikx, C. M., Cohen Stuart, J., Voets, G. M., van den Munckhof, M. P., van Essen-Zandbergen, A., … Mevius, D. J. (2011). Dutch patients, retail chicken meat and poultry share the same ESBL genes, plasmids and strains. Clinical Microbiology and Infection, 17(6), 873–880. doi:10.1111/j.1469-0691.2011.03497.x López, R., & Casp, A. (2004). Tecnología de mataderos. Madrid: Mundi Prensa. Ma, J., Liu, J. H., Lv, L., Zong, Z., Sun, Y., Zheng, H., … Zeng, Z. L. (2012). Characterization of extended-spectrum β-lactamase genes found among Escherichia coli isolates from duck and environmental samples obtained on a duck farm. Applied and Environmental Microbiology, 78(10), 3668–3673. doi:10.1128/AEM.07507-11 61 Maciel, M. J., Carvalho, H., Wiest, J., Majolo, C., & Fröder, H. (2012). The Effect of the Chiller Tank on the Decrease of Indicator Microorganisms on Poultry Carcasses in Two Slaughterhouses in the Rio Grande Do Sul State , Brazil Instituto de Ciênciae Tecnologia de Alimentos , Universidade Federal do Rio Grande do Sul ,. International Journal of Microbiological Research, 3(1), 7–11. doi:10.5829/idosi.ijmr.2012.3.1.551 Mahmood, T., Roy, S., Siddiqui, H. H., & Shamim, A. (2015). Antibiotics Resistance: A silent global threat. World Journal of Pharmacy and Pharmaceutical Sciences, 4(02), 1177–1197. Retrieved from http://www.wjpps.com/ Marín, M., & Gudiol, F. (2003). Antibióticos betalactámicos. Enfermedades Infecciosas Y Microbiologia Clinica, 21(1), 42–55. Retrieved from http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologiaclinica-28-articulo-antibioticos-betalactamicos13042137#elsevierItemBibliografias Martínez Rojas, D. D. V. (2009). Artículo de revisión Betalactamasas tipo AmpC : generalidades y métodos para detección fenotípica. Revista de La Sociedade Venezolana de Microbiología, 78–83. Mead, G. (2004). Microbiological quality of poultry meat: a review. Revista Brasileira de Ciência Avícola. doi:10.1590/S1516-635X2004000300001 Miranda, J. M., Vázquez, B. I., Fente, C. a, Barros-Velázquez, J., Cepeda, a, & Franco, C. M. (2008). Evolution of resistance in poultry intestinal Escherichia coli during three commonly used antimicrobial therapeutic treatments in poultry. Poultry Science, 87(8), 1643–8. doi:10.3382/ps.2007-00485 Molero, G. (2012). Análisis microbiológico de canales de pollo en los mataderos del estado Zulia, Venezuela. Córdoba. Moredo, F. A. (2012). Prevalencia de Escherichia coli enterotoxigénico y Escherichia coli productor de toxina Shiga en cerdos sin manifestación clínica de diarrea de la provincia de Buenos Aires. Universidad Nacional de la Plata. Mosquito, S., Ruiz, J., & Ochoa, T. J. (2011). Mecanismos Moleculares de Resistencia antibiótica en E. coli asociadas a diarrea. Rev Peru Med Exp Salud Publica, 28(4), 9–11. Murray, P., Rosenthal, K., & Pfaller, M. (2009). Microbiología Médica (Sexta). Barcelona: Elsevier. Northcutt, J. K., Berrang, M. E., Dickens, J. A., Fletcher, D. L., & Cox, N. A. (2003). Effect of Broiler Age , Feed Withdrawal , and Transportation on Levels of 62 Coliforms , Campylobacter , Escherichia coli and Salmonella on Carcasses Before and After Immersion Chilling. Poultry Science Association. NRL. (2013). Enumeration of ESBL producing E . coli in chicken carcasses. Olsen, R. H., Bisgaard, M., Löhren, U., Robineau, B., & Christensen, H. (2014). Extended-spectrum β-lactamase-producing Escherichia coli isolated from poultry: a review of current problems, illustrated with some laboratory findings. Avian Pathology : Journal of the W.V.P.A, (May 2014), 1–10. doi:10.1080/03079457.2014.907866 OMS. (2007). Manual sobre las cinco claves para la inocuidad de los alimentos. Ginebra. OMS. (2013). Resistencia a los Antimicrobianos. Retrieved March 15, 2015, from http://www.who.int/mediacentre/factsheets/fs194/es/ Overdevest, I., Willemsen, I., Rijnsburger, M., Eustace, A., Xu, L., Hawkey, P., … Kluytmans, J. (2011). Extended-spectrum β-lactamase genes of Escherichia coli in chicken meat and humans, the Netherlands. Emerging Infectious Diseases, 17(7), 1216–1222. doi:10.3201/eid1707.110209 Park, Y. S., Adams-Haduch, J. M., Rivera, J. I., Curry, S. R., Harrison, L. H., & Doi, Y. (2012). Escherichia coli producing CMY-2 β-lactamase in retail chicken, Pittsburgh, Pennsylvania, USA. Emerging Infectious Diseases, 18(3), 515–6. doi:10.3201/eid1803.111434 Quinn, P. J., Markey, B. K., Leonard, F. C., FitzPatrick, E. S., Fanning, S., & Hartigan, P. J. (2011). Veterinary Microbiology and Microbial Disease (2nd ed.). Blackwell Publishing. Reich, F., Atanassova, V., & Günter, K. (2013). Extended-Spectrum and AmpCProducing Enterobacteria in Healthy Broiler Chickens, Germany. doi:DOI 10.3201/eid1908.120879 Rodríguez-Angeles, M. G. (2002). Principales características y diagnóstico de los grupos patógenos de Escherichia coli. Salud Publica de Mexico, 44(5), 464– 475. doi:10.1590/S0036-36342002000500011 Seiffert, S., Tinguely, R., Lupo, A., Neuwirth, C., Perreten, V., & Endimiani, A. (2013). High Prevalence of Extended-Spectrum-Cephalosporin-Resistant Enterobacteriaceae in Poultry Meat in Switzerland : Emergence of CMY-2- and VEB-6-Possessing Proteus mirabilis. Antimicrobial Agents and Chemotherapy, 57(12), 6406–6408. doi:10.1128/AAC.01773-13 63 Seliwiorstow, T., Baré, J., Van Damme, I., Uyttendaele, M., & De Zutter, L. (2015). Campylobacter carcass contamination throughout the slaughter process of Campylobacter-positive broiler batches. International Journal of Food Microbiology, 194, 25–31. doi:10.1016/j.ijfoodmicro.2014.11.004 Smet, a, Rasschaert, G., Martel, a, Persoons, D., Dewulf, J., Butaye, P., … Heyndrickx, M. (2011). In situ ESBL conjugation from avian to human Escherichia coli during cefotaxime administration. Journal of Applied Microbiology, 110(2), 541–9. doi:10.1111/j.1365-2672.2010.04907.x Stanchi, Ó. (2007). Microbiología Veterinaria. (P. Martino, E. Gentilini, E. Reinoso, M. Echeverría, N. Leardini, & J. Capes, Eds.). Buenos Aires: Intermédica. Stein, C., Kuchenmüller, T., Henrickx, S., Prüss-Üstün, A., Wolfson, L., Engels, D., & Schlundt, J. (2007). The Global Burden of Disease assessments - WHO is responsible? PLoS Neglected Tropical Diseases. doi:10.1371/journal.pntd.0000161 Suárez, C., & Gudiol, F. (2009). Antibióticos betalactámicos. Enfermedades Infecciosas Y Microbiologia Clinica. doi:10.1016/j.eimc.2008.12.001 Tafur, D., Torres, J., & Villegas, V. (2008). Mecanismos de resistencia a los antibióticos en bacterias Gram negativas (Vol. 12). Cali. Tschudin-Sutter, S., Frei, R., Stephan, R., Hächler, H., Nogarth, D., & Widmer, A. F. (2014). Extended-Spectrum β-Lactamase (ESBL)-Producing Enterobacteriaceae: A Threat from the Kitchen. Infection Control and Hospital Epidemiology : The Official Journal of the Society of Hospital Epidemiologists of America, 35(5), 581–4. doi:10.1086/675831 Tsola, E., Drosinos, E. H., & Zoiopoulos, P. (2008). Impact of poultry slaughter house modernisation and updating of food safety management systems on the microbiological quality and safety of products. Food Control, 19, 423–431. doi:10.1016/j.foodcont.2007.05.003 Turner, P. J. (2005). Extended-Spectrum b -Lactamases. Oxford Journals, 273– 275. Ulrich, L. (2012). Overview on current practices of poultry slaughtering and poultry. Retrieved from www.wfsa.europa.eu/publications Vaidya, V. M., Paturkar, a. M., Waskar, V. S., Zende, R. J., & Rawool, D. B. (2005). Detection of indicator organisms on poultry carcass sites in an organized slaughterhouse. Journal of Muscle Foods, 16(2005), 289–297. doi:10.1111/j.1745-4573.2005.00021.x 64 Vásconez Paucar, D. C. (2014). Aislamiento e Identificación de E. coli BLEE en ciegos de pollos faenados en camales industriales de la Provincia de Pichincha. Universidad Central del Ecuador. Voets, G. M., Fluit, A. C., Scharringa, J., Schapendonk, C., van den Munckhof, T., Leverstein-van Hall, M. A., & Stuart, J. C. (2013). Identical plasmid AmpC beta-lactamase genes and plasmid types in E. coli isolates from patients and poultry meat in the Netherlands. International Journal of Food Microbiology, 167, 359–362. doi:10.1016/j.ijfoodmicro.2013.10.001 WHO. (2011a). Critically Important Antimicrobials for Human Medicine. Geneva. WHO. (2011b). Enterohaemorrhagic Escherichia coli (EHEC). Retrieved June 1, 2015, from http://www.who.int/mediacentre/factsheets/fs125/es/ WHO. (2014). Antimicrobial resistance Global Report on Surveillance. Geneva. Retrieved from http://apps.who.int/iris/bitstream/10665/112642/1/9789241564748_eng.pdf?ua =1 Zhao, S., Blickenstaff, K., Bodeis-Jones, S., Gaines, S. a, Tong, E., & McDermott, P. F. (2012). Comparison of the prevalences and antimicrobial resistances of Escherichia coli isolates from different retail meats in the United States, 2002 to 2008. Applied and Environmental Microbiology, 78(6), 1701–7. doi:10.1128/AEM.07522-11 Zilelidou, E., Tsourou, V., Poimenidou, S., Loukou, A., & Skandamis, P. (2014). Modeling transfer of Escherichia coli O157:H7 and Listeria monocytogenes during preparation of fresh-cut salads: impact of cutting and shredding practices. Elsevier, 45, 254–265. doi:10.1016/j.fm.2014.06.019. 65 LISTADO DE ABREVIATURAS A: antes del enfriamiento. AmpC: Serin Betalactamasa. Aw: actividad mínima de agua BLEE: Betalactamasa de espectro extendido. C: ciegos. CDC: Centro para el control y prevención de enfermedades (del inglés, Centre for Disease Control and Prevention). CONAVE: Corporación Nacional de Avicultores del Ecuador. D: después del enfriamiento. E: después del eviscerado. EFSA: Autoridad Europea de Seguridad Alimentaria (del inglés, European Food Safety Autorithy). FAO: Organización de las Naciones Unidas para la Agricultura y la Alimentación (del inglés, Food and Agriculture Organization of the United Nations). HACCP: Análisis de peligros y puntos críticos de control (del inglés, Hazard analysis and critical control points). Log10: Logaritmo de base 10. NRL: Laboratorio Nacional de Referencia (del inglés, National Reference Laboratory) P: Después del desplume. ppm: Partes por Millón. 66 TBX: Agar Triptona Bilis X- Glucurónido (del inglés, Tryptone Bile Agar XGlucuronide). UFC: Unidades Formadoras de Colonia. USDA: Departamento de Agricultura de los Estados Unidos (del inglés, United States Department of Agriculture). W: agua WHO: Organización Mundial de la Salud (del inglés, World Health Organization). 67 ANEXOS 68 Anexo 1. Esquema de aislamiento de E. coli BLEE. 69 Anexo 2. Crioconservación de cepas de Escherichia coli BLEE Colonia de Escherichia coli BLEE sembrada en 300 µl de caldo Tripticasa Soya (TSB) Colección de cepas de Escherichia coli BLEE crioconservadas a -80°C. 70 Anexo 3. Tabla de registro de información de las parvadas muestreadas. Granja Fecha muestreo en granja Fecha muestreo en camal Ubicación Lote Número de galpones de la granja Galpón Edad al faenamiento (días) AB incubadora AB recepción Promotores en alimento AB Tratamientos 1 AB Tratamientos 2 AB Tratamientos 3 Enfermedades con diagnóstico clínico Observaciones 71 Anexo 4. Tabla de registro de registro de resultados de cuantificación de Escherichia coli BLEE. Número dilución Log TBX+C Cepas -80°C Observaciones 1 P 2 3 4 5 1 E A W 2 3 4 5 1 2 3 4 5 W1a W1b W2a W2b W3a W3b D 1 2 3 4 5 C 72 Anexo 5. Preparación del Agar TBX+C y del Caldo TSB. AGAR TBX Disolver 33,6 gramos del medio en 1 litro de agua destilada. Mezclar hasta obtener una suspensión homogénea. Calentar lentamente agitando con frecuencia hasta llegar a ebullición para la disolución completa. Esterilizar por autoclave a 121°C durante 15 minutos. Diluir 3mg de Cefotaxima en 1500µl de agua destilada estéril, colocar la dilución en un litro de agar TBX cuando tenga una temperatura por debajo de los 50°C. Dispensar aproximadamente 12ml de agar en cajas Petri desechables. CALDO TSB Disolver 30 gramos del medio en 1 litro de agua destilada. Mezclar hasta obtener una suspensión homogénea. Calentar lentamente agitando con frecuencia hasta llegar a ebullición para la disolución completa. Esterilizar por autoclave a 121°C durante 15 minutos. 73 Anexo 6. Promedio, Varianza, Desviación estándar y Coeficiente de Variación de E. coli BLEE (Log10/g) por muestreo en la empresa 1CT. MUESTREO 1 Ciegos 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 5,52 5,52 5,52 5,52 5,52 5,52 0,00 0,00 0,00 Desplume Eviscerado P 0 0 0 0 0 0,00 0,00 0,00 - E 0 2,32 0 0 0 0,46 1,08 1,04 223,61 Antes de Chilling A 0 1,48 0 0 0 0,30 0,44 0,66 223,61 Agua 1 W1 1 1,85 Agua 2 W2 1,6 1,7 Agua 3 W3 0 0 1,43 0,36 0,60 42,18 1,65 0,00 0,07 4,29 0,00 0,00 0,00 - Final D 2,15 2,32 2,18 1,7 2,2 2,11 0,06 0,24 11,29 Tomado de: Investigación directa Elaboración: La Autora MUESTREO 2 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 4,78 4,78 4,78 4,78 4,78 4,78 0,00 0,00 0,00 P 1,7 2,23 2,04 1,78 2,3 2,01 0,07 0,27 13,22 E 3 2,79 1,6 1,85 2,15 2,28 0,36 0,60 26,36 Antes de Chilling A 0 0 0 1,3 0 0,26 0,34 0,58 223,61 Agua 1 W1 1 1,48 Agua 2 W2 1 4 Agua 3 W3 0 0 1,24 0,12 0,34 27,37 2,50 4,50 2,12 84,85 0,00 0,00 0,00 - Tomado de: Investigación directa Elaboración: La Autora 74 Final D 1,3 1,3 1,3 1,3 1,78 1,40 0,05 0,21 15,38 MUESTREO 3 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 5,76 5,76 5,76 5,76 5,76 5,76 0,00 0,00 0,00 P 2,38 1,85 2,11 1,78 2,18 2,06 0,06 0,25 11,94 E 1,3 0 2,77 2,48 0 1,31 1,73 1,32 100,50 Antes de Chilling A 0 0 0 1,3 0 0,26 0,34 0,58 223,61 Agua 1 W1 1,7 0 Agua 2 W2 2 0 Agua 3 W3 0 2 Final D 1,48 1,6 1,78 0 1,9 0,85 1,00 1,00 1,35 1,45 2,00 2,00 0,60 1,20 1,41 1,41 0,77 141,42 141,42 141,42 57,16 Tomado de: Investigación directa Elaboración: La Autora MUESTREO 4 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 6,53 6,53 6,53 6,53 6,53 6,53 0,00 0,00 0,00 P 1,3 1,3 2,08 1,9 0 1,32 0,66 0,82 61,93 E 1,6 0 1,78 1,78 0 1,03 0,89 0,94 91,56 Antes de Chilling A 2,8 1,3 0 1,85 3,49 1,89 1,83 1,35 71,60 Agua 1 W1 0 1 Agua Agua 2 3 W2 W3 1,3 1,9 2,56 2,28 0,50 1,93 2,09 0,50 0,79 0,07 0,71 0,89 0,27 141,42 46,16 12,86 Tomado de: Investigación directa Elaboración: La Autora 75 Final D 1,6 1,6 2,18 1,85 1,78 1,80 0,06 0,24 13,23 MUESTREO 5 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 6,43 6,43 6,43 6,43 6,43 6,43 0,00 0,00 0,00 P 0 1,3 1,3 1,3 0 0,78 0,51 0,71 91,29 E 1,6 1,6 1,3 0 1,48 1,20 0,46 0,68 56,84 Antes de Chilling A 1,3 1,78 1,9 1,3 1,3 1,52 0,09 0,30 19,71 Agua 1 W1 0 0 Agua Agua 2 3 W2 W3 1,7 1 1,48 1,3 0,00 0,00 0,00 0,00 1,59 0,02 0,16 9,78 1,15 0,05 0,21 18,45 Final D 3,91 1,3 1,3 1,48 1,3 1,86 1,32 1,15 61,88 Tomado de: Investigación directa Elaboración: La Autora Anexo 7. Promedio, Varianza, Desviación estándar y Coeficiente de Variación de E. coli BLEE (Log10/g) por muestreo en la empresa 2CT. . MUESTREO 1 Ciegos Desplume 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 8,14 8,14 8,14 8,14 8,14 8,14 0,00 0,00 0,00 P 3,02 3,03 3,14 2,9 3,25 3,07 0,02 0,13 4,32 Eviscerado E 3,66 3,49 3,64 3,72 3,57 3,62 0,01 0,09 2,45 Antes de Chilling A 3,8 3,51 3,48 3,44 3,29 3,50 0,03 0,19 5,30 Agua 1 Agua 2 Final W1 0 0 W2 0 0 0,00 0,00 0,00 - 0,00 0,00 0,00 - D 2,32 2,86 2,32 1,7 3,54 2,55 0,48 0,69 27,08 Tomado de: Investigación directa Elaboración: La Autora 76 MUESTREO 2 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE Ciegos Desplume Eviscerado C 6,85 6,85 6,85 6,85 6,85 6,85 0,00 0,00 0,00 P 3,12 2,9 2,86 3,21 3,02 3,02 0,02 0,15 4,85 E 3,51 3,28 4,71 3,06 3,2 3,55 0,45 0,67 18,79 Antes de Chilling A 2,91 3,89 3,26 2,96 2,86 3,18 0,18 0,43 13,49 Agua 1 Agua 2 Final W1 2,18 0 W2 0 0 1,09 2,38 1,54 141,42 0,00 0,00 0,00 - D 2,81 2,41 2,15 2,04 3,11 2,50 0,20 0,45 17,97 Tomado de: Investigación directa Elaboración: La Autora Muestreo 3 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 1,3 1,3 1,3 1,3 1,3 1,30 0,00 0,00 0,00 P 2,41 2,61 3,41 2,85 2,9 2,84 0,14 0,38 13,27 E 3,39 3,44 3,11 2,81 3,46 3,24 0,08 0,28 8,62 Antes de Chilling A 2,68 2,45 2,8 4,31 2,59 2,97 0,58 0,76 25,70 Agua 1 Agua 2 Final W1 0 0 W2 0 0 0,00 0,00 0,00 - 0,00 0,00 0,00 - D 1,9 2,04 1,7 2,23 1,6 1,89 0,06 0,25 13,42 Tomado de: Investigación directa Elaboración: La Autora 77 MUESTREO 4 Ciegos Desplume Eviscerado 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 5,32 5,32 5,32 5,32 5,32 5,32 0,00 0,00 0,00 P 2,08 2,79 3,07 3,61 3,15 2,94 0,32 0,56 19,18 E 3,31 3,81 4,5 3 3,36 3,60 0,34 0,58 16,19 Antes de Chilling A 3,03 3,23 3,18 2,4 2,93 2,95 0,11 0,33 11,23 Agua 1 Agua 2 Final W1 0 0 W2 0 0 0,00 0,00 0,00 - 0,00 0,00 0,00 - D 1,9 1,7 0 1 1,48 1,22 0,57 0,76 62,32 Tomado de: Investigación directa Elaboración: La Autora MUESTREO 5 Ciegos Desplume 1 2 3 4 5 PROMEDIO VARIANZA DESVIACIÓN COEFICIENTE C 6,03 6,03 6,03 6,03 6,03 6,03 0,00 0,00 0,00 P 2,59 2,18 2,58 2,48 2 2,37 0,07 0,26 11,13 Eviscerado E 2,51 2,56 2,78 3,92 2,75 2,90 0,34 0,58 19,97 Antes de Chilling A 2,74 2,88 1,95 1,85 2,38 2,36 0,21 0,46 19,46 Agua 1 Agua 2 Final W1 0 0 W2 0 0 0,00 0,00 0,00 - 0,00 0,00 0,00 - D 1,9 1,85 1 0 1,7 1,29 0,65 0,81 62,52 Tomado de: Investigación directa Elaboración: La Autora 78 Anexo 8. Promedio y Desviación Estándar de UFC (Log10/g) de E. coli BLEE empresa 1CT. #Muestreo 1 2 3 4 5 Promedio SD P 0 0 0 0 0 1,7 2,23 2,04 1,78 2,3 2,38 1,85 2,11 1,78 2,18 1,3 1,3 2,08 1,9 0 0 1,3 1,3 1,3 0 1,233 0,919 E 0 2,32 0 0 0 3 2,79 1,6 1,85 2,15 1,3 0 2,77 2,48 0 1,6 0 1,78 1,78 0 1,6 1,6 1,3 0 1,48 1,256 1,055 Punto de Muestreo 1CT A W1 0 1 1,48 1,85 0 0 0 0 1 0 1,48 0 1,3 0 1,6 1,7 0 0 1,3 2,04 0 2,8 0 1,3 1 0 1,85 3,49 1,3 0 1,78 0 1,9 1,3 1,3 0,989 0,803 1,016 0,749 W2 1,6 1,7 W3 0 0 1 4 0 0 2 0 0 2 1,3 2,56 1,9 2,28 1,7 1,48 1 1,3 1,734 1,038 0,848 0,960 D 2,15 2,32 2,18 1,7 2,2 1,3 1,3 1,3 1,3 1,78 1,48 1,6 1,78 0 1,9 1,6 1,6 2,18 1,85 1,78 3,91 1,3 1,3 1,48 1,3 1,703 0,658 Tomado de: Investigación directa Elaboración: La Autora 79 Anexo 9. Promedio y Desviación Estándar de UFC (Log10/g) de E. coli BLEE empresa 2CT. #Muestreo 1 2 3 4 5 Promedio SD P 3,02 3,03 3,14 2,9 3,25 3,12 2,9 2,86 3,21 3,02 2,41 2,61 3,41 2,85 2,9 2,08 2,79 3,07 3,61 3,15 2,59 2,18 2,58 2,48 2 2,846 0,401 Punto de Muestreo 2CT E A 3,66 3,8 3,49 3,51 3,64 3,48 3,72 3,44 3,57 3,29 3,51 2,91 3,28 3,89 4,71 3,26 3,06 2,96 3,2 2,86 3,39 2,68 3,44 2,45 3,11 2,8 2,81 4,31 3,46 2,59 3,31 3,03 3,81 3,23 4,5 3,18 3 2,4 3,36 2,93 2,51 2,74 2,56 2,88 2,78 1,95 3,92 1,85 2,75 2,38 3,382 2,992 0,528 0,576 W1 0 W2 0 0 0 0 0 0 0 0 0 0 0 0 0 D 2,32 2,86 2,32 1,7 3,54 2,81 2,41 2,15 2,04 3,11 1,9 2,04 1,7 2,23 1,6 1,9 1,7 0 1 1,48 1,9 1,85 1 0 1,7 1,890 0,816 Tomado de: Investigación directa Elaboración: La Autora 80