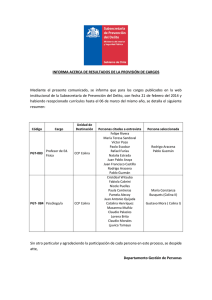
Tesis - Universidad de Colima
Anuncio

UNIVERSIDAD DE COLIMA DOCTORADO EN CIENCIAS FISIOLOGICAS ESTUDIO DE LOS EFECTOS VOLTAJE DEPENDIENTES Y VOLTAJE INDEPENDIENTES DE DIFERENTES AGONISTAS MUSCARINICOS SOBRE LA CORRIENTE DE POTASIO ACTIVADA POR ACETILCOLINA. RELACION ESTRUCTURA ACTIVIDAD. TESIS QUE PARA OBTENER EL GRADO DE DOCTOR EN CIENCIAS FISIOLOGICAS CON ESPECIALIDAD EN FISIOLOGIA PRESENTA M. en C. DORA ELENA BENAVIDES HARO ASESOR Dr. JOSE ANTONIO SANCHEZ CHAPULA CO-ASESOR Dr. RICARDO ANTONIO NAVARRO POLANCO COLIMA, COL., MAYO DE 2001 1 Mi agradecimiento a: Dr. José Antonio Sánchez Chapula Dr. Ricardo Antonio Navarro Polanco Por su paciencia y valiosa enseñanza. Por compartir conmigo sus conocimientos. Sin ellos no seria posible este trabajo. Dr. Alejandro Elizalde Lozano M. en C. Rafael Madrigal Quiñónez M. en C. Julián Torres Jacome Lic. Bioq. Tania Ferrer Villada Por su ayuda y apoyo cuando los necesité. Claudia Olivia Mercado Ruiz Juan Fernando Fernández Por su ayuda y asistencia técnica. Mis Padres Por su apoyo incondicional. Mis amigos y compañeros Por su apoyo. 2 INDICE PAGINA INDICE DE TABLAS Y FIGURAS 1 RESUMEN 4 ABSTRACT 5 INTRODUCCIÓN 6 I Canales de potasio 6 II Corrientes de potasio activadas por voltaje 6 III Rectificadores entrantes 9 IV Caracterización molecular de los canales rectificadores entrantes, 10 Kirx.x V Corriente de potasio activada por acetilcolina (IK-ACh ) 12 VI Receptores muscarínicos 13 VII 4-AP y ChCl como agentes farmacológicos 15 VIII Tertiapina, una toxina que bloquea selectivamente IK-ACh 17 HIPOTESIS 18 OBJETIVOS 22 METODOS 23 RESULTADOS 26 I Corrientes de potasio activadas por colina en miocitos auriculares 26 de diferentes especies de mamífero. II Evidencias que sugieren que la corriente activada por colina no es sino 32 Curso temporal de la activación y la desactivación de la corriente 32 una corriente de rectificación tardía “verdadera”, posiblemente la activación voltaje-dependiente de IK-ACh. dependiente de tiempo y voltaje inducida por colina. Efectos de dofetilida e indapamida sobre la corriente activada por 34 colina. Las corrientes activadas por colina y ACh durante pulsos despolarizantes pueden tener similares cursos temporales. 3 34 INDICE (continuación) PAGINA Interacción de colina y adenosina. 38 La tertiapina bloquea las corrientes activadas por diferentes 40 agonistas muscarínicos. ¿La corriente voltaje -dependiente activada por colina se debe a la 43 activación de receptores M3 o M4? Interacción de antagonistas específicos de receptores M2 , M3 y 44 M4 con ACh en miocitos auriculares de gato. Interacción de antagonistas específicos de receptores M2 , M3 y 47 M4 con colina en miocitos auriculares de gato. Una proteína G sensible a PTX está involucrada en la activación 50 de la corriente por colina. III Corrientes de potasio activadas por diferentes agonistas 52 muscarínicos en miocitos auriculares de gato. Corrientes activadas por ACh en miocitos auriculares de gato. 53 Corrientes activadas por tetrametilamonio (TMA) en miocitos 53 auriculares de gato. Corrientes activadas por 4-AP y 3-AP en miocitos auriculares de 55 gato. Corrientes activadas por trimetil(p-aminofenil)amonio en miocitos 57 auriculares de gato. Efectos del ácido p-aminobenzoico y del ácido sulfanílico en 58 miocitos auriculares de gato. Corrientes activadas por metacolina en miocitos auriculares de 61 gato. Corrientes de potasio activadas por betanecol en miocitos 62 auriculares de gato. Efecto de la tertiapina sobre la corriente activada por betanecol en miocitos auriculares de gato. 4 64 INDICE (continuación) PAGINA Interacción de antagonistas específicos de receptores M2 , M3 y 66 M4 con betanecol en miocitos auriculares de gato. DISCUSION 71 CONCLUSIONES 80 BIBLIOGRAFIA 82 5 INDICE DE TABLAS Y FIGURAS TABLA ó FIGURA Tabla No. 1 Corrientes de K + caracterizadas por técnicas PAGINA 7 electrofisiológicas. Figura No. 1 Estructuras de algunos agonistas muscarínicos. 21 Figura No. 2 Modelo antiguo del receptor muscarínico 21 Figura No. 3 Corriente activada por colina en miocitos auriculares de 27 perro. Figura No. 4 Efecto de la colina sobre miocitos auriculares de 28 cobayo. Figura No. 5 Corriente activada por colina en miocitos auriculares de 29 ratón. Figura No. 6 Corriente activada por colina en miocitos auriculares de 30 conejo. Figura No. 7 Corriente activada por colina en miocitos auriculares de 31 rata. Figura No. 8 Dependencia de la concentración de colina del curso 33 temporal de la activación. Figura No. 9 Efectos del bloqueador de IKr , dofetilida, y del bloqueador de IKs , indapamida, sobre la corriente 35 activada por colina. Figura No. 10 Las corrientes activadas por colina y por acetilcolina pueden tener cursos temporales similares o diferentes 36 durante la despolarización, dependiendo del protocolo de estimulo. Figura No. 11 Efecto de variar la duración del pulso hiperpolarizante sobre la corriente semejante a un rectificador tardío, 37 activada por colina. Figura No. 12 Efecto de adenosina sobre la corriente activada por colina en miocitos auriculares de cobayo. 6 39 TABLA ó FIGURA (continuación) Figura No. 13 Efecto del bloqueador selectivo de IK-ACh , tertiapina, PAGINA 40 sobre corrientes activadas por acetilcolina. Figura No. 14 Efecto del bloqueador selectivo de IK-ACh , tertiapina, 41 sobre corrientes activadas por colina. Figura No. 15 Efecto del bloqueador selectivo de IK-ACh , tertiapina, 42 sobre corrientes activadas por TMA. Figura No. 16 Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada por acetilcolina 44 en miocitos auriculares de gato. Figura No. 17 Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada por acetilcolina e n miocitos 45 auriculares de gato. Figura No. 18 Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada por acetilcolina en miocitos 46 auriculares de gato. Figura No. 19 Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada por colina en 47 miocitos auriculares de gato. Figura No. 20 Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada por colina en miocitos 48 auriculares de gato. Figura No. 21 Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada por colina en miocitos 49 auriculares de gato. Figura No. 22 Efecto de PTX sobre la corriente activada por colina en 51 miocitos auriculares de gato. Figura No. 23 Corriente activada por acetilcolina en miocitos auriculares de gato. 54 7 TABLA ó FIGURA (continuación) Figura No. 24 Corriente activada por tetrametilamonio (TMA) en PAGINA 55 miocitos auriculares de gato. Figura No. 25 Corriente activada por 3-AP y 4-AP en miocitos 56 auriculares de gato. Figura No. 26 Efecto del trimetil(p-aminofenil)amonio sobre miocitos 58 auriculares de gato. Figura No. 27 Efecto del ácido p–aminobenzoico sobre miocitos 59 auriculares de gato. Figura No. 28 Efecto del ácido sulfanílico sobre miocitos auriculares 60 de gato. Figura No. 29 Corriente activada por metacolina en miocitos 61 auriculares de gato. Figura No. 30 Corriente activada por betanecol en miocitos 63 auriculares de gato. Figura No. 31 Efecto del bloqueador selectivo de IK-ACh, tertiapina, 65 sobre corrientes activadas por betanecol. Figura No. 32 Efecto de la methoctramina (30 nM), antagonista M2 muscarínico, sobre la corriente activada por betanecol 66 en miocitos auriculares de gato. Figura No. 33 Efecto de la methoctramina (100 nM), antagonista M2 muscarínico, sobre la corriente activada por betanecol 67 en miocitos auriculares de gato. Figura No. 34 Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada por betanecol en miocitos 69 auriculares de gato. Figura No. 35 Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada por betanecol en miocitos auriculares de gato. 8 70 RESUMEN En el presente trabajo encontramos que colina activa una corriente de potasio con activación tiempo- y voltaje-dependiente en diferentes especies de mamífero. Hasta ahora dos hipótesis han sido planteadas para la identificación de esta corriente. Shi et al. (1999) han sugerido que colina y 4-AP activan rectificadores tardíos diferentes a través de receptores muscarínicos diferentes, M3 y M4, respectivamente. Una propuesta alternativa es que, 4-AP, colina, TMA, betanecol, y otros agonistas muscarínicos activan la corriente IK-ACh en una forma voltajedependiente. Presentamos evidencias de que la corriente activada por colina no posee características típicas de las corrientes rectificadoras tardías, el curso temporal de la activación es dependiente de la concentración del agonista, la desactivación de la corriente es voltaje-independiente y no es bloqueada por dofetilida e indapamida, bloqueadores específicos de IKr e IKs , respectivamente. La corriente activada por colina es bloqueada por tertiapina, un bloqueador específico de IK-ACh . El tratamiento de los miocitos con PTX previene la activación de la corriente por colina, indicando que una proteína Gi/o esta involucrada en el proceso de activación de la corriente. Esto descarta la participación de receptores M3 , los cuales se acoplan a proteínas Gq, insensibles a PTX. En trabajos previos utilizando registro de canal unitario hemos encontrado que el canal activado por 4-AP y colina tiene una conductancia y cinética similar al de IK-ACh . La participación de otros subtipos de receptores muscarínicos además del receptor M2 no es clara ya que los antagonistas supuestamente específicos para receptores M3 y M4 no lo son en esta preparación de miocitos auriculares de gato. Hemos mostrado evidencias de que la modulación por voltaje de la activación de IK-ACh podría estar a nivel del receptor, y que cuando la interacción del agonista con el receptor únicamente involucra la interacción del grupo amonio cuaternario del agonista con el sitio aniónico del receptor, la interacción es voltaje-dependiente. 9 ABSTRACT In the present study we found that choline activates a voltage- and timedependent potassium current in different mammalian species. To date, two hypothesis have been established to identify this current. Shi et al. (1999) have suggested that choline and 4-AP activate different delayed rectifiers through different muscarinic receptors, M3 and M4 , respectively. An alternative hypothesis propose that 4-AP, choline, TMA, bethanechol and other muscarinic agonists activate the IK-ACh in a voltage-dependent manner. We show evidence that the choline activated current do not have the characteristics of a delayed rectifier current, the activation kinetic is agonist concentration-dependent, the deactivation kinetic is voltage-independent and the current is not blocked by the specific blockers of IKr and IKs , dofetilide and indapamide. Tertiapin, a specific blocker of IK-ACh , blocks the choline activated current. The activation of the choline-induced current is prevented by pretreatment with PTX, this indicates that a Gi/o protein is involved in the process of the current activation. This evidence excludes the participation of M3 receptors, which are coupled to a PTXinsensitive Gq protein. In previous studies, we found that 4-AP and choline activate a single channel with conductance, mean open time and inward rectification properties, similar to IK-ACh . It is not clear the participation of other muscarinic receptor subtypes other than M2 receptors because there are not any of the supposed specific mAChR antagonists for M3 and M4 receptors, in cat atrial myocytes. We have shown evidences that the voltage modulation IK-ACh activation could be at the receptor level, and when the agonist interacts with the receptor it only involves the interaction of the charged amino head group present in the agonist with the receptor anionic site, this interaction is voltage-dependent. 10 INTRODUCCIÓN I CANALES DE POTASIO Los canales de K+ representan la clase más diversa de canales iónicos en el corazón. Las corrientes que fluyen a través de canales de K+ son importantes en el mantenimiento de la actividad eléctrica normal en la mayoría de las células excitables. La mayoría de corrientes salientes que participan en la repolarización del potencial de acción son corrientes de K+. Estos canales contribuyen a generar el potencial de reposo de la célula y modulan la duración del potencial de acción. Las corrientes de K+ en el miocardio pueden ser clasificadas en una de dos categorías 1) Corrientes activadas principalmente por voltaje, tal como el rectificador tardío (IKr e IKs ), la corriente de meseta (IKp) y la corriente transitoria saliente (Ito), y 2) Corrientes con rectificación entrante, tal como el rectificador anómalo (IK1), la corriente modulada por ATP (IK-ATP), la corriente activada por Acetilcolina (IK-ACh ) dependiente de Na + y la corriente intracelular (IK- Na+) (Kass y Freeman, 1993). Algunas de las corrientes de K+ en miocitos cardiacos y sus características se resumen en la Tabla 1. II CORRIENTES DE POTASIO ACTIVADAS POR VOLTAJE Las corrientes de potasio salientes, mas importantes, activadas por voltaje durante la meseta del potencial de acción de los tejidos cardiacos son: la corriente transitoria de salida independiente de la concentración de calcio intracelular, Ito1 y las corrientes de rectificación tardía IKr e IKs (Gintant, Cohen, Datyner y Kline, 1992; Barry y Nerbonne, 1996). La corriente Ito es responsable principalmente de la fase inicial de la repolarización (Gintant et al., 1992; Campbell, Rasmusson, Comer y Strauss, 1995). Las corrientes de rectificación tardía determinan la terminación de la meseta y la duración del potencial de acción (Matsuura, Ehara e Imoto, 1987). Como ya se mencionó anteriormente, la corriente Ito1 es acarreada por iones K+ a diferencia de la corriente transitoria de salida activada por [Ca++]i , Ito2 , la cual es acarreada por Cl- (Campbell et al., 1995). El umbral de activación de Ito1 esta en –30 mV y la activación máxima en +50 mV, la curva de inactivación en estado estable se 11 Tabla 1. Corrientes de K + caracterizadas en tejido cardiaco por técnicas electrofisiológicas. Conductancia de Corriente de Abreviatura Características un solo canal + K (γγ)a.pS Rectificador tardío Corriente meseta 10-11 IKs Muy lenta activación, sin inactivación. Activada por voltaje, catecolaminas, estimulación de protein-cinasa A o C, endotelina. Bloqueada por +2 quinidina, tedisamil y Co . <1-3 de Corriente saliente transitoria Corriente sostenida o ultrarápida Rectificador anómalo Activada por Acetilcolina (ACh). Dependiente de [ATP]i Activada por ácido araquidónico (AA). Activada por fosfatidilcolina Activada por [Na+ ]i Retículo Sarcoplásmico a IKr Activación moderadamente rápida, muy rápida inactivación. Activada por voltaje. Bloqueada por +3 E-4031, dofetilida, d-sotalol, La . IKp Ito1(Ieo) IKsus (IKur) IK1 IK-ACh IK-ATP IK-AA Rápida activación, sin inactivación. Activada por +2 voltaje. Bloqueada por Ba . Rápida activación y rápida inactivación. Activada por voltaje. Bloqueada por agonistas α1-adrenérgicos (fenilefrina, metoxamina), tedisamil, 4-Aminopiridina, Ba+2. 14 14-17 (5.4 K) Activada por voltaje. Más rápida que IKr , sin inactivación. Bloqueada por 4-aminopiridina. Independiente de voltaje, presenta rectificación +2 + +2 +2 entrante. Bloqueada por Ba , Cs , Mg , Ca . Similar a IK1, pero encontrada sólo en aurícula y en fibras de Purkinje. Activada por voltaje; ACh, CGRP, somatostatina, adenosina, endotelina, +2 las subunidades βγ de GK. Bloqueada por Ba , + +2 Cs , Mg , quinidina. Cerrada bajo condiciones “normales”. Activada por disminución en la [ATP]i, pinacidil, cromakalim, nicorandil, RP 49356, SR 44866, inhibidores metabólicos (CN-, 2,4-DNP). Bloqueada por elevada [ATP]i, gliburida, tolbutamida, 5-hidroxidecanoato. Activada por AA, 6-ceto bajo. PGF1 , 16.9 (5 K) 32 γα([K +]o)0.22 γ=13.3([K + ]o)0.23 γ=23.6([K + ]o)0.24 35 (5.4 K) 12-HHT, pHi IK-PC Activada por fosfatidilcolina, 12-HHT, PGF2 IK-Na+ Activada por [Na+]i > 20 mM; Kd para el Na+ = 66 mM, ouabaina, bajas [K+]e (por inhibición de Na/K-ATPasa). Bloqueada por R56865 Bloqueada por Ca+2, neomicina. SRK medida en la presencia de 150 mM [K+]o . (Datos tomados de tablas I y III, Sanguinetti, 1994). 12 124 60 210 154 encuentra entre –80 y –10 mV, con un voltaje medio de inactivación entre –40 y –30 mV (Gintant et al., 1992). La base molecular de Ito1 depende de la especie, en humano, perro y gato este canal esta formado por las subunidad Kv4.3, en rata por Kv4.2, Kv4.3 y Kv1.4, dependiendo la región ventricular de que se trate, en el conejo el correlato molecular de Ito1 es la subunidad Kv1.4 (Barry y Nerbonne, 1996). Noble y Tsien en 1969 propusieron por vez primera que el rectificador tardío en células cardiacas estaba compuesta por dos componentes de corriente Ix1 e IX2. La separación de los dos tipos de corrientes fue basada en la cinética de activación o desactivación, potencial de inversión y grado de rectificación. Posteriormente Sanguinetti y Jurkiewics (1990a), corroboraron en miocitos aislados que efectivamente la corriente saliente de K+ llamada rectificador tardío (IK ), es la suma de dos corrientes de K+ sobrepuestas, IKr e IKs . IKr activa rápidamente y lo hace a potenciales mas negativos (-40 mV) que IKs (-10 mV). IKr contribuye significativamente a la repolarización durante la meseta del potencial de acción (-20 a +10 mV). KI r es bloqueada por el E-4031, un agente antiarrítmico clase III (Sanguinetti y Jurkiewics, 1990a). Concentraciones relativamente bajas (<0.1 mM) de La3+ corren la curva de activación de IKr a potenciales mas positivos (SánchezChapula y Sanguinetti, 2000) lo cual anteriormente hacía pensar en un bloqueo de IKr por La3+ (Sanguinetti y Jurkiewics, 1990b). IKr presenta rectificación entrante la cual se debe a una rápida inactivación de la corriente (Spector, Curran, Zou, Keating y Sanguinetti, 1996). La densidad de corriente de IKr en células auriculares es 2.5 veces la medida en células ventriculares en cobayo (Sanguinetti y Jurkiewicz, 1991). IKs es una corriente mucho mas grande que activa muy lentamente, y no es bloqueada por el E-4031 o por bajas concentraciones de La3+ (Sanguinetti y Jurkiewics, 1990a y 1990b). IKs es incrementada por la activación de receptores βadrenérgicos, mientras IKr no es modulada por la activación β-adrenérgica (Sanguinetti y Jurkiewics, 1991). Las bases moleculares de los canales que acarrean las corrientes IKr e IKs han sido determinados recientemente. El canal IKr es formado por la subunidad formadora del poro ERG, la cual pertenece a la famila ether-a-go-go y la subunidad tipo β Mirp1 (Sanguinetti, Jiang, Curran y Keating, 1995; Abbot, Sesti, Splawski, Buck, Lehmann, Timothy, Keating y Goldstein, 1999). El canal IKs está 13 formado también por la combinación de la subunidad formadora del poro KvLQT1 (KCNQ1) y la subunidad tipo β minK (Sanguinetti, Curran, Zou, Shen, Spector, Atkinson y Keating, 1996). III RECTIFICADORES ENTRANTES Los canales a través de los cuales ocurre un movimiento iónico entrante o saliente simétrico, que está limitado sólo por la magnitud de la fuerza electroquímica son canales lineales u óhmicos es decir, que no rectifican (Kass y Freeman, 1993). Esta característica es producto de una resistencia constante para un determinado rango en el potencial de membrana. Por lo cual la corriente es linealmente dependiente del voltaje y es descrita por la Ley de Ohm: I = V / R (Katz, 1992). Los canales que permiten el paso de corriente mas fácilmente en un sentido que en otro son conocidos como canales rectificadores, es decir, que la relación corrientevoltaje deja de ser lineal (Kass y Freeman, 1993). La rectificación ocurre cuando la resistencia es alterada por un cambio en el voltaje (Katz, 1992). Para algunos canales de K+ con marcada rectificación entrante se ha demostrado que la rectificación puede ser removida al exponer la superficie interna de la célula a una solución libre de iones divalentes, y la rectificación entrante es restaurada cuando se adiciona de 0.5 a 1 mM de Mg+2 a la solución (Matsuda, 1991). En la presencia de Mg +2, la conductancia decrece a potenciales positivos a E K (potencial de equilibrio para el ion potasio), y la relación corriente-voltaje muestra una pendiente negativa (Vandenberg, 1987; Matsuda, 1990). El Mg+2 se mueve dentro de la parte interna del canal a través de un campo eléctrico hacia el lado externo de la membrana. El Mg+2 permanece en un sitio, el cual tiene una alta afinidad para éste, evitando el eflujo de K+. A voltajes negativos a EK, en donde el movimiento de K+ es hacia adentro, el Mg+2 es conducido hacia el interior de la célula, desbloqueando el canal (Matsuda, 1991). El bloqueo voltaje-dependiente por Mg+2 interno puede explicar la rectificación entrante en algunos canales, en otros, un bloqueo intrínseco voltaje-dependiente juega un rol importante. Esta, así llamada, rectificación entrante intrínseca, requiere factores solubles que no son Mg+2 y que se han encontrado en oocitos de Xenopus y 14 otras células (Lopatin, Makhina y Nichols, 1994). Caracterizaciones bioquímicas y fisiológicas identifican a esos factores como poliaminas (espermina, espermidina, putrescina y cadaverina). La rectificación por poliaminas es reversible. La rectificación resulta del bloqueo voltaje-dependiente del poro del canal por poliaminas, no de un sensor de voltaje propio de la proteína del canal (Lopatin et al., 1994). El Mg+2 causa un rápido bloqueo voltaje-dependiente de los canales Kir2.1 clonados (Kir2.1, canal de potasio clonado que posee características similares a IK1) y expresados en oocitos de Xenopus. Espermina y espermidina son, respectivamente, cerca de 100 y 10 veces más potentes bloqueadores de los canales Kir2.1 que putrescina o Mg+2. Se ha demostrado que el bloqueo voltaje-dependiente de las poliaminas es directamente proporcional al número de cargas positivas de éstas moléculas. (Lopatin et al., 1994). El bloqueo voltaje-dependiente por Mg+2 intracelular se observa en los canales del rectificador anómalo (IK1) (Matsuda, 1991), en los canales de K+ dependientes de ATP (IK-ATP) (Findlay, 1987; Horie, Irisawa y Noma, 1987), canales de K+ acivados por ACh (IK-ACh ) (Horie e Irisawa, 1987 y 1989) y los canales de K+ activados por Na + intracelular (IK-Na+) (Wang, Kimitsuki y Noma, 1991). IV CARACTERIZACION MOLECULAR DE LOS CANALES RECTIFICADORES ENTRANTES, Kirx.x Desde la clonación del locus del Shaker de Drosophila (Papazian, Timpe, Jan y Jan, 1987), una gran familia de genes de canales de K+ activados por voltaje (Kv) se han aislado y expresado. Las subunidades del canal Kv consisten de dos dominios citoplasmáticos un amino-terminal y otro carboxi-terminal, seis dominios transmembranales (S1-S6), y una asa hidrofóbica P o H5 entre el quinto y el sexto dominios transmembranales (Hille, 1992). Las subunidades de canales de K+ con rectificación entrante (Kir) tienen solo dos dominios transmembranales (M1 y M2) en cada subunidad, unidos por el asa H5, la cual es la responsable de la selectividad a K+ en los canales Kv (Heginbotham, Abramson y MacKinno n, 1992). La evidencia a partir de canales expresados con mutaciones con propiedades de rectificación 15 alteradas, indican que los canales Kir, como los Kv, están formados por tetrámeros (Yang, J. Jan, Y. N. y Yang L. Y., 1995a). Existen por lo menos seis subfamilias de canales Kir, llamadas Kir1 a Kir6. La subfamilia Kir1 presenta una rectificación débil, y es expresada predominantemente en el riñón, aunque también en varias áreas del cerebro. McNicholas, Wang, Ho, Hebert y Giebisch (1994) han presentado evidencia que una isoforma es inhibida por ATP citoplasmático. Xu, Yang y Hebert (1996) demostraron que tres sitios de fosforilación en los cuales actúa la protein cinasa A (PKA), son esenciales para mantener la actividad de los canales. La subfamilia Kir2 presentan fuerte rectificación entrante, son expresados en el corazón y sistema nervioso y la rectificación tiempo- y voltaje-dependiente de los canales expresados es virtualmente indistinguible del canal nativo IK1 en el corazón (Ishihara y Hiraoka, 1994; Ishihara, Mitsuiye, Noma y Takano, 1989; Oliva, Cohen y Pennefather, 1990; Stanfield et al., 1994a). La subfamilia Kir3 presenta fuerte rectificación entrante y son activados a través de proteínas G, y hay evidencia de que son expresados en corazón, cerebro y tejidos endócrinos (Ferrer et al., 1995; Karschin et al., 1994; Kubo, Reuveny, Slesinger, Jan y Jan, 1993). Krapivinsky et al. (1995) encontraron que las subunidades Kir3.4 se co-ensamblan con Kir3.1 para formar IK-ACh y que éstas subunidades no forman el canal funcional KATP. Las subfamilias Kir4 y Kir5 se ha descubierto que se encuentran en cerebro. Kir4.1 presenta una débil rectificación cuando son expresados solos, pero Kir5.1 no forma canales en expresión homomérica en ovocitos (Bond et al., 1994). Algunos trabajos han demostrado que esas dos subunidades pueden co-expresarse para formar canales (Pessia, Tucker, Lee, Bond y Adelman, 1996). Se ha encontrado que miembros de la subfamilia Kir6 codifican una subunidad KATP, pero la expresión de canales activos requiere la coexpresión de Kir6.2 o Kir6.1 con el receptor a sulfonilurea (SUR) (Ammala, Moorhouse, Gribble, Ashfield, Proks, et al., 1996). Stanfield et al., (1994b) demostraron que un residuo de glutamato en el segundo dominio transmembranal M2 es en parte responsable del bloqueo por Mg +2. Yang, Jan Y. N. y Jan L. Y., (1995b) subsecuentemente demostraron que E224 (en la porción C-terminal de Kir2.1) es el principal determinante de la sensibilidad tanto al Mg+2 como a las poliaminas, y que la ne utralización de las cargas negativas en 16 M2(D172N) y en la porción C-terminal (E224G) reducen la sensibilidad a poliaminas y Mg+2 semejante a Kir1.1. V CORRIENTE DE POTASIO ACTIVADA POR ACETILCOLINA (I K-ACh) La acetilcolina (ACh) modula las funciones cardiacas activando algunas vías de regulación celular. Para los canales iónicos las mas prominentes de esas incluyen, la activación de la corriente de K+ rectificadora entrante IK-ACh y la inhibición de la corriente de calcio tipo-L (ICa-L), tanto la basal en nodo seno-auricular, células auriculares (Iijima, Irisawa y Kameyama, 1985; Wang y Lipsius, 1995) y células de nodo auriculo-ventricular de conejo (Habuchi, Nishio, Tanaka, Yamamoto, Lu y Yoshimura, 1996), como la aumentada por estimulación β-adrenérgica. Ambos efectos son bloqueados por atropina y son mediados por la activación de receptores muscarínicos M2 (Giles y Noble, 1976; Szabo y Otero, 1990). La ACh también inhibe la corriente de marcapaso, If de células nodales, por un mecanismo que involucra la inhibición de la adenilato ciclasa, la disminución de la producción de AMPc y un corrimiento de la curva de activación de If a voltajes mas negativos (DiFrancesco y Tromba, 1988a y 1988b), mientras que las catecolaminas desplazan la curva de activación en dirección positiva (DiFrancesco, 1986). La acción de ACh sobre If también es mediada por receptores muscarínicos y es bloqueada por atropina (DiFrancesco y Tromba, 1988a). Estudios de fijación de voltaje registrando corrientes macroscópicas y de canal único, han confirmado la activación directa de IK-ACh a través de un receptor muscarínico M2. En el proceso de activación del canal de K+ activado por acetilcolina (KACh) interviene un tipo de proteína G (Gi/o (GK), sensible a toxina pertussis). Las proteínas G son heterotrímeros que constan de las subunidades α, β y γ las cuales traducen la información del receptor (muscarínico M2) hacia las moléculas efectoras (p. ejem. canal iónico). En la ausencia de un agonista, el GDP ocupa el sitio catalítico de GTPasa localizado en Gα. El cambio conformacional en la molécula del receptor, producida por la unión del agonista, influye a la proteína G para que libere al GDP que tiene unido, así el GTP intracelular toma el lugar dejado por el GDP “reacción de 17 intercambio”, hasta ser hidrolizado a GDP. La cinética de esta hidrólisis es relativamente lenta. Durante la hidrólisis Gα se disocia de Gβγ. Este estado se conoce como el estado activado de la proteína G (Spiegel, 1996). La activación desaparece cuando el GDP proveniente de la hidrólisis del GTP, ocupa el sitio catalítico en Gα, entonces Gα se reasocia con Gβγ para formar la configuración estable de la proteína G. Esta serie de eventos de la proteína GK relacionados con la activación del canal KACh, se ha demostrado que es un proceso delimitado a la membrana plasmática (Kurachi, 1995). Se ha demostrado que las subunidades Gβγ son las que activan el canal KACh (Logothetis, Kurachi, Galper, Neer y Clapham, 1987; Clapham y Neer, 1993; Wickman, Iñiguez-Lluhi, Davenport, Taussig, Krapivinski, et al., 1994). Se ha reportado que en los canales Kir3 (familia a la que pertenecen las subunidades que forman IK-ACh ), existen cuatro sitios a los cuales se les pueden unir los dímeros βγ, por lo tanto son cuatro subunidades βγ las que se unen al canal (Corey y Clapham, 2001). La aplicación de ACh a miocitos auriculares y ventriculares, causa acortamiento de la duración del potencial de acción. Los efectos de ACh son mayores en aurícula que en ventrículo, esto se debe a que la densidad del complejo receptor muscarínico-proteína G-canales KACh es menor en ventrículo (Koumi S-i., Sato y Hayakawa, 1995). En la ausencia de estimulación vagal, IK-ACh puede ser considerada como una corriente saliente de fondo que contribuye al potencial de marcapasos (Irisawa y Hagiwara, 1991). VI RECEPTORES MUSCARINICOS La evidencia acumulada indica que las respuestas funcionales muscarínicas de las células a ACh son mediadas por múltiples subtipos de receptores muscarínicos (Hulme, Birdsall y Buckley, 1990; van Zwieten y Doods, 1995). La heterogeneidad de los receptores muscarínicos a acetilcolina (mAChRs) fue sugerida primero sobre las bases de los perfiles farmacológicos (diferente afinidad y estudios funcionales) de los receptores a agonistas y antagonistas (Goyal, 1989; Hulme et al., 1990). A la fecha cuatro diferentes subtipos han sido definidos farmacológica y 18 funcionalmente en diferentes tejidos, designados como M1, M2, M3 y M4 (Eglen y Whiting, 1990; Mutschler, Moser, Wess y Lambrecht, 1995; van Zwieten y Doods, 1995, Eglen, Hegde y Watson, 1996). De acuerdo con la bien documentada heterogeneidad farmacológica de los receptores muscarínicos, los estudios de clonación molecular han revelado la existencia de cinco distintos receptores muscarínicos ( m1 a m5). m1, m3 y m5 se caracterizan por estar acoplados preferentemente a la vía del fosfatidil inositol bifosfato (PIP 2), y m2 y m4 los cuales están asociados con la inhibición de la adenilato ciclasa. (Bonner, 1989). Cuatro de esos subtipos de receptores clonados, m1, m2, m3 y m4, corresponden a los receptores funcionales M1,M2,M3 y M4. La relevancia fisiológica del receptor m5 permanece aun desconocida. Estos receptores están conformados por una proteína genérica que consiste de 7 hélices hidrofóbicas transmembranales (TM I - VII) unidas por asas intracelulares (i1 - i3) y extracelulares (o2 - o4) alternadas entre sí, un dominio extracelular amino-terminal (o1) y un dominio intracelular carboxi-terminal (i4). (Bonner, 1989). La unión de un ligando a los receptores muscarínicos se ha predicho que ocurre en un receptáculo formado por las asas extracelulares y los siete dominios TM teniendo un arreglo parecido a un anillo. La unión del ligando al receptor se inicia por una interacción iónica entre la carga positiva del grupo amino presente virtualmente en todos los ligandos de los receptores muscarínicos y un residuo de Asp localizado en TM III (Asp 147 en el receptor m3 clonado de la rata) (Wess, 1993). Todos los receptores muscarínicos conservan una serie de residuos de Thr y Tyr, lo cual no ocurre con otros receptores acoplados a proteínas G. Los grupos hidroxilo presentes en la cadena lateral de esos aminoácidos (Aa) interactúan específicamente con el éster de la ACh por medio de puentes de hidrógeno (Wess, 1993). Todos los residuos de Thr y Tyr que son críticos para la unión de ACh están localizados entre las dos primeras vueltas de la hélice de la proteína de manera que se encuentran en la superficie de la membrana sobre TM III, V, VI y VII. Esos Aa junto con el Asp en TM III definen el dominio de unión de la ACh sobre el receptor muscarínico. En base a esto se puede especular que el complejo ACh-receptor está caracterizado por un 19 enlace iónico entre el amonio cuaternario de la ACh y un Asp 147 en TM III y, una complicada red de puentes de hidrógeno mas que por pocos y bien definidos puntos de contacto. (Wess, 1993). Como se ha mencionado en párrafos anteriores los receptores muscarínicos M2 están acoplados a proteínas G. Se ha encontrado que existen múltiples mecanismos para controlar el señalamiento y densidad de receptores acoplados a proteínas G (GPRs). Las vías de señalamiento que se activan necesitan desactivarse para asegurar que el señalamiento pueda llevarse a cabo en una manera espacio-temporal que permita la regulación precisa de la función celular. Para remover los agonistas de los receptores, múltiples mecanismos intracelulares contribuyen a la terminación del señalamiento en los GPRs. Muchos de esos eventos involucran la regulación de los GPRs (GPRs fosforilados por protein cinasas y consecuentemente desacoplados de las proteínas G), mientras que otros disminuyen el número de receptores (GPRs secuestrados de la superficie celular siendo inaccesibles para su activación por ligandos). Esa terminación de los eventos de señalamiento es comúnmente referida como desensibilización, la cual se define como una disminución en el señalamiento del receptor aún en la continua presencia del estímulo. (Bünemann, Lee, Pals-Rylaarsdam, Roseberry y Hosey, 1999). VII 4-AP Y ChCl COMO AGENTES FARMACOLOGICOS Desde el estudio inicial de Pelhate y Pichon (1974) en el cual demostraron el efecto bloqueador que la 4-aminopiridina (4-AP) tiene sobre la corriente de rectificación tardía en axones de cucaracha, 4-AP ha sido ampliamente utilizada como herramienta farmacológica para bloquear distintas corrientes de K+ (Ulbricht y Wagner, 1976; Meves y Pichon, 1977). Colina (ChCl) también es utilizada como herramienta farmacológica para discriminar entre corrientes acarreadas por iones distintos. Colina se usa frecuentemente como sustituto de sodio para mantener las condiciones equimolares en las soluciones utilizadas para el registro de corrientes de K+, ya que, además, se sabe que colina no bloquea canales de K+ . Colina es además un precursor y un metabolito de ACh. Los efectos de colina como agonista de receptores muscarínicos han sido reportados en corazón, donde disminuye la 20 frecuencia cardiaca y acorta la duración del potencial de acción auricular (Shi et al., 1999). Por otra parte, estudios realizados en miocitos auriculares de perro sugieren que colina y 4-AP, además de activar IK-ACh activan rectificadores tardíos diferentes de IKr e IKs , a los cuales han llamado IKCh e IK4AP respectiva mente (Fermini y Nattel, 1994; Shi, Wang, H. y Wang, Z., 1999). Shi et al. en 1999, además, sugieren la presencia de múltiples receptores muscarínicos en aurícula de perro y muestran evidencias que IK4AP es activado a través del receptor M4, y Wang, Shi, Lu, Yang y Wang, 1999 sugieren que IKCh es activado a través de receptores M3 . Sin embargo, se han mostrado múltiples evidencias que señalan al receptor M2 como el único subtipo funcional presente en el corazón (Watson, Yamamura y Roeske, 1983; Bonner, Buckley, Young y Brann, 1987; Mizushima, Uchida, Zhou, Kagiya y Yoshida, 1987; Peralta, Ashkenazi, Winslow, Smith, Ramachandran, y Capon, 1987) y que contribuye a la regulación de la frecuencia cardiaca, la contractilidad y la forma y duración de los potenciales de acción (Jeck, Lindmar, Loffelholz y Wanke, 1988; van Zwieten y Doods, 1995). Recientemente, Meyer, Wellner-Kienitz, Biewald, Bender, Eickel y Pott, 2001, encontraron que los receptores muscarínicos M3, no están presentes en miocitos de aurícula de rata. Al hacer RT-PCR en miocitos aislados y cultivados, no encontraron el transcripto para el M3AChR, sin embargo, al hacer el RT-PCR del cultivo de la aurícula completa, sí lo encontraron. Esto es, que lo reportado por Shi et al. (1999), pudiera ser un artefacto de los M3AChR que se encuentran en células endoteliales y vasos, presentes en la aurícula completa. Mas aún, es difícil suponer la existencia de canales que puedan ser específicamente activados por sustancias exógenas. En 1997, Navarro-Polanco y Sánchez-Chapula, encontraron que en células auriculares de gato, 4-AP activa aparentemente dos componentes de corriente de K+. Un componente de fondo y un segundo componente activado por pulsos despolarizantes, con una activación claramente dependiente de tiempo, muy similar a un rectificador tardío. Sin embargo, encontraron que ambos componentes de corriente son acarreados por K+, son inhibidos por atropina, por GDPβS (análogo no hidrolizable del GDP) y por Toxina pertussis (PTX). Lo que hace evidente la participación de una proteína G en la mediación del efecto activador de 4-AP. Por 21 otra parte, mostraron que bloqueadores específicos para los rectificadores tardíos (IKs e IKr ) no tienen efecto sobre la corriente activada por 4-AP. Además, mostraron que 4-AP activa un canal con conductancia y cinética similares al canal IK-ACh . Estos resultados les permitieron descartar la participación de un rectificador tardío, al menos, de los descritos hasta ahora en células cardiacas. Otro de los resultados sorpresivos en este trabajo fue el claro antagonismo dependiente de voltaje que produce ACh sobre la corriente activada por 4-AP. Estos autores plantearon dos posibilidades para explicar sus resultados; a) la activación de un nuevo subtipo de receptor muscarínico en el cual ACh actúa como antagonista y, b) una activación voltaje y tiempo dependiente de IK-ACh por 4-AP. Recientemente, en nuestro laboratorio se encontró que colina es capaz de activar una corriente de K+ con características semejantes a las descritas para la corriente activada por 4-AP en este mismo tipo de células. De igual forma encontramos que colina activa al canal IK-ACh de manera voltaje dependiente. Esto es, que la actividad del canal (NP 0) se incrementa conforme el voltaje se hace mas positivo (datos no publicados). VIII TERTIAPINA UNA TOXINA QUE BLOQUEA SELECTIVAMENTE IK-ACh Tertiapina es un péptido compuesto por 21 aminoácidos, aislado del veneno de la abeja. Estudios recientes han mostrado evidencias de que bloquea selectivamente algunos tipos de canales rectificadores entrantes de K+, Kir (Jin y Lu, 1998). En miocitos aislados de aurícula de conejo y en corazones de conejo perfundidos por el método de Langendorff, tertiapina ha sido descrito como un bloqueador selectivo del canal IK-ACh , mostrando un IC 50 de entre 8 y 30 nM, respectivamente (Kitamura, et al., 2000; Drici, Diochot, Terrenoire, Romey y Lazdunski, 2000). Estos autores encontraron además que tertiapina aún a una concentración 1 µM no modifica otros canales iónicos cardiacos como INa, ICa-L, Ito , IKr , IK1 e IK-ATP. 22 HIPÓTESIS I La activación voltaje y tiempo dependiente de la corriente por colina es independiente de la especie. Argumento: El trabajo de Navarro-Polanco y Sánchez-Chapula (1997) fue el primero en reportar que el bloqueador de corrientes de potasio 4-AP, es capaz de activar una corriente de potasio con características de un rectificador tardío en miocitos auriculares de gato. Esto plantea la posibilidad de que este efecto es una “rareza” farmacológica observada únicamente en esa preparación. Resultados similares obtenidos con el agonista colinérgico colina, en la misma preparación (NavarroPolanco, 1997), plantean la posibilidad de que éste sea un fenómeno mas generalizado y esté presente en otras especies de mamífero comúnmente utilizadas en el laboratorio. II Las corrientes entrantes y salientes inducidas por los agonistas muscarínicos colina, 4-AP, betanecol y TMA, se deben a la activación voltaje-dependiente del canal IK-ACh , a través del recepto r muscarínico M2. Alternativamente, se deben a la activación de diferentes canales de rectificación tardía no caracterizados (Shi et al., 1999; Wang, Shi, Lu, Yang y Wang, 1999), a través de los receptores muscarínicos, colina (M3 ), TMA (M3 ), 4-AP (M4 ), betanecol (¿?). Argumento: En nuestro laboratorio hemos encontrado diferentes evidencias indirectas que nos sugieren que 4 -AP y colina activan la corriente rectificadora entrante IK-ACh en una forma voltaje-dependiente. Experimentos estudiando la inhibición de estas corrientes por el antagonista inespecífico de receptores muscarínicos, atropina, nos sugieren además que la modulación voltaje-dependiente podría ser a nivel del receptor muscarínico (Navarro-Polanco, 1997). Atropina a concentraciones relativamente bajas (< 100 nM) inhibe las corrientes activadas por 4-AP y colina a potenciales negativos, a los cuales la afinidad del receptor por estos agonistas es baja, cuando 23 se aplican pulsos despolarizantes, y la afinidad del receptor por los agonistas aumenta, la inhibición inducida por atropina disminuye. Por otro lado, el efecto inhibidor de atropina a dosis bajas o altas de las corrientes inducidas por ACh es voltaje -independiente. Otra evidencia que apoya nuestra hipótesis de que 4-AP y colina activan IK-ACh es la obtenida en experimentos registrando canal único. Los valores de la conductancia y los tiempos medios de apertura y cierre de los canales activados por 4-AP y colina es similar a los valores que presentan los canales activados por ACh (Navarro-Polanco, 1997; Navarro-Polanco y Sánchez-Chapula, 1997). En experimentos realizados en miocitos auriculares de perro, Shi et al. (1999) reportaron que 4-AP activa una corriente similar a la reportada por Navarro-Polanco y Sánchez-Chapula (1997) en aurícula de gato. Shi et al. (1999) sugieren que 4-AP a través del receptor muscarínico M4, activa una corriente rectificadora tardía aun no identificada. En ese mismo trabajo (Shi et al., 1999), se describe que TMA activa a través del receptor muscarínico M3 otra corriente rectificadora tardía, tampoco identificada. La conclusión de que las corrientes activadas por 4-AP y TMA son diferentes, las basa principalmente en el hecho de que aparentemente las cinéticas de ambas corrientes son diferentes. La conclusión de que 4-AP y TMA activan diferentes tipos de receptores muscarínicos, fueron obtenidos de experimentos estudiando antagonistas supuestamente específicos para los diferentes tipos de receptores (M2, M3 y M4). III La corriente de potasio voltaje- y tiempo-dependiente acoplada a receptores muscarínicos es capaz de activarse por agonistas muscarínicos que guardan cierta similitud estructural. El grupo amonio cuaternario es indispensable para activar al receptor muscarínico. En cambio, la presencia del grupo éster es lo que determina el que exista o no, una dependencia de voltaje de la unión del ligando al receptor y la activación de IK-ACh . Argumento: Los receptores muscarínicos pertenecen a una superfamilia de receptores llamados receptores metabotrópicos y que se caracterizan por estar acoplados a 24 proteínas G. A los receptores metabotrópicos se unen la mayoría de neurotransmisores como por ejemplo: ACh, glutamato, serotonina y GABA. Este tipo de receptores también son los responsables de la transducción del olor y el gusto y tienen la peculiaridad de ser estimulados por una gran variedad de moléculas. Residuos específicos dentro del receptáculo formado por las asas extracelulares y los siete dominios transmembranales, parecen conferir a un receptor dado la disponibilidad para unirse con relativa y variable afinidad a un amplio rango de diferentes ligandos. Por ejemplo, ésta es la base para la disponibilidad del animal para discriminar entre un sin número de moléculas odoríferas. (Mac Leish, Shepherd, Kinnamon y Santos-Sacchi, 1999). El alineamiento de las secuencias de aminoácidos de este tipo de receptores, reveló que existe un residuo Asp en el TM III, cuya posición equivale a la del Asp 147 del receptor muscarínico m3, en aquellos receptores a los que se unen aminas biógenas (endógenas) y, en cambio, no estaba presente en otros receptores acoplados a proteínas G. Partiendo de que la estructura de la ACh (Fig. 1), posee un amonio cuaternario el cual se une a la parte aniónica del receptor (Asp en TM III) y una porción éster que forma puentes de hidrógeno con los residuos de Thr y Tyr que se encuentran en TM III, V, VI y VII (Wess, 1993) y las características de activación de IK-ACh , proponemos que: La red formada por los puentes de hidrógeno entre la porción éster de la ACh y el receptor muscarínico son importantes para una alta afinidad y unión independiente de voltaje. Moléculas como la colina y 4-AP que no tienen la parte éster de la ACh (Fig. 1) sólo se unen a la parte aniónica del receptor (Fig. 2) con dependencia de voltaje. Además, suponemos que la despolarización del potencial de membrana induce a un cambio conformacional facilitando el acceso de los ligandos (efecto estérico) al sitio aniónico y consecuentemente incrementando la afinidad para los ligandos como colina y 4-AP. Esto nos hace suponer que moléculas como colina, tetrametilamonio (TMA), 4-aminopiridina (4-AP), 3-aminopiridina (3-AP), ác. paminobenzoico (PABA), ác. sulfanílico y trimetil(p-aminofenil)amonio (Fig. 1), que carecen de la porción éster, se unen al receptor muscarínico y activan IK-ACh de una manera dependiente de voltaje. Mientras que, moléculas como la metacolina y el 25 betanecol (Fig. 1), forman una red de puentes de hidrógeno debido a que poseen la porción éster, activando IK-ACh de una manera voltaje independiente. Esto es, el grupo amonio cuaternario es indispensable para activar al receptor muscarínico, en cambio, la presencia del grupo éster es lo que determina el que exista o no una dependencia de voltaje de la unión del ligando al receptor y la activación de IK-ACh . O CH3 + H3 C N CH2 CH2 O CH3 + N CH2 CH O CH3 N C CH3 CH2 CH O CH3 C N N CH3 COOH SO3 - Betanecol CH2 CH2 Ac. Sulfanílico OH Colina H3 C CH3 H3 C NH2 Ac. p-aminobenzoico CH3 + NH2 NH2 CH3 + N 3-aminopiridina O CH3 H3 C N 4-aminopiridina Metacolina CH3 + NH2 O CH3 H3 C NH2 CH3 Acetilcolina CH3 H3 C C H3 C + N H3 C CH3 NH2 Trimetil(p-aminofenil)amonio Tetrametilamonio Figura 1. Estructuras químicas de compuestos cuya acción fue probada sobre el receptor muscarínico. Figura 2. Modelo del receptor muscarínico (tomado de Wess, 1993). 26 OBJETIVOS 1.- Determinar si el agonista muscarínico colina induce en miocitos auriculares de diferentes especies de mamífero (perro, cobayo, conejo, ratón y rata) una corriente de potasio voltaje- y tiempo-dependiente similar a la observada en miocitos auriculares de gato. 2.- Realizar diferentes maniobras experimentales utilizando diferentes protocolos de pulsos, uso de antagonistas considerados específicos de los subtipos de receptores muscarínicos (M2 , M3 y/o M4), uso del bloqueador específico de IK-ACh , tertiapina, que nos permitan discernir entre las dos hipótesis planteadas (hipótesis II). Que las corrientes activadas por 4-AP, colina, TMA y betanecol se deben a la activación voltaje -dependiente de IK-ACh , a través de la activación del receptor M2, o que estos agonistas muscarínicos a través de diferentes subtipos de receptores (M3 y/o M4) activan canales de rectificación tardía aun no identificados. Diferentes explicaciones a las alternativas arriba enunciadas podrían también surgir de estos experimentos. 3.- Estudiar la posible activación de corrientes de potasio por diferentes agonistas muscarínicos ya descritos como metacolina y betanecol (Figura 1) y de compuestos químicos con ciertas similitudes estructurales con colina como el TMA, o con 4-AP como 3-AP, trimetil(p-aminofenil)amonio (Figura 1) en miocitos auriculares de gato. 27 METODOS Miocitos aislados. Los animales utilizados (perro, gato, conejo, cobayo, rata y ratón) se heparinizaron previamente (1000 U/kg) (30 min. antes de ser sacrificados) y se anestesiaron con pentobarbital sódico (35 mg/kg, ip), después de esto se les extrajo rápidamente el corazón mediante una toracotomía bilateral y se colocó en solución Tyrode oxigenada. Los miocitos se aislaron utilizando un método de separación enzimática descrito inicialmente por Isenberg y Klöckner (1982) y modificado por Sánchez-Chapula (1988). Los corazones se montaron de la aorta a un aparato de Langendorff para la perfusión retrógrada de la circulación coronaria. Los corazones se perfundieron inicialmente con una solución Tyrode lo que permite lavar el remanente de sangre del corazón y mantener la contracción a un ritmo constante. Después de 5 minutos se perfundió una solución Tyrode cero Ca++ durante 7 min, esta solución detiene las contracciones del corazón y hace que la matriz extracelular se afloje, lo que permite que sea mas eficaz el proceso de separación enzimática. A continuación se perfundió una solución cero Ca++ conteniendo colagenasa (0.24 mg/ml, tipo I, Sigma Chemical) y proteasa (0.033 mg/ml, tipo XIV, Sigma Chemical) de 6-40 minutos, dependiendo de la especie en cuestión. Las enzimas se lavaron perfundiendo una solución conteniendo alto K+, bajo Na + y bajo Cl- (solución Kraft-Bruhe, KB) durante 5 minutos. Se disecó la aurícula izquierda. Se obtuvieron las células aisladas por agitación mecánica con una pipeta Pasteur con punta flameada. Las células se guardaron en una solución de alto K+, bajo Na + y bajo Cl- a 4 ºC hasta el momento del experimento dejándolas por lo menos 2 horas en reposo para que se recuperen. La solución Tyrode tiene la siguiente composición (mM): NaCl 118, KCl 5.4, MgCl2 1.05, NaCO3 24, NaH2PO4 0.42, dextrosa 11, CaCl2 1.8, taurina 20, la solución es gasificada con 95% de O2 y 5% de CO2 (pH 7.4). La solución libre de Ca++ (cero Ca++) se preparó omitiendo CaCl2 de la solución Tyrode. La solución alto K+, bajo Na + y bajo Cl- tiene la siguiente composición (mM): ác. glutámico 70, KCl 20, taurina 10, KH2PO4 10, creatina 0.5, ác. succínico 5, dextrosa 10, HEPES-K 10, y EGTA-K 0.2, el pH se ajustó a 7.4 con KOH. 28 Técnica de Fijación de Voltaje “Whole cell” en células aisladas. Los miocitos aislados se colocaron en una cámara de registro de pequeño volumen (0.2 ml) sobre la platina de un microscopio invertido (Nikon TMS) dejándo 5 min para que las células se coloquen en el fondo de la cámara. Después de esto se lavaron con solución Ca++-Co++ a flujo constante (2 a 3 ml/min) para quitar restos de organelos y células, antes de empezar los registros electrofisiológicos. La solución Ca++-Co++ contiene cobalto para bloquear las corrientes de calcio. Todos los experimentos se realizaron a 35 ± 0.5ºC, utilizando para precalentar la solución de prueba un calentador de platina (Biowarmer MT-1). Los registros de corrientes macroscópicas se obtuvieron con el método de fijación de voltaje Whole cell originalmente descrita por Hamil, Marty, Neher, Sakman y Sigworth (1981), usando un amplificador (Axopatch 200A, Axon Instruments). Las pipetas de vidrio se construyeron con tubos capilares de borosilicato con diámetro externo de 1.5 mm e interno de 0.8 mm (WPI Inc.) utilizando un estirador horizontal modelo P-87 (Sutter Instrument), se llenaron con solución interna, teniendo una resistencia de 1-3 MΩ. La resistencia en serie con la membrana celular se compensó para obtener un transiente capacitivo lo mas rápido posible sin oscilaciones. El potencial de unión líquida (-9 mV) entre la pipeta y la solución del baño, se corrigió. Las corrientes se filtraron con un filtro pasa bajas a 1 kHz, se digitalizaron a 4 kHz, y se guardaron en una computadora Acer mate 433 vía un convertidor analógico-digital (TL -1, Axon Instruments Co.) y el programa de adquisición y análisis pClamp 6.0.4 (Axon Instruments, Co.), por medio del cual también se aplicaron los protocolos de fijación de voltaje. La capacitancia de la membrana (Cm) se calculó utilizando la ecuación Cm = Q / V donde Q es el movimiento de carga total y fue determinada integrando el área del transiente capacitivo en respuesta a un cambio en el voltaje de –10 mV desde un potencial de 0 mV. La resistencia en serie con la membrana (resistencia de acceso) fue compensada en un 80%. La resistencia de acceso antes de la compensación fue de 5.4 MΩ, de manera que después de su compensación esta resistencia fue de 0.66 MΩ. Si tomamos en consideración que la máxima corriente registrada fue menor a 2 nA, el máximo error posible en nuestra medida de voltaje fue de 2 mV. 29 Una vez que se registraron las corrientes macroscópicas en condiciones control (solución Ca++-Co++), las células se siguieron perfundiendo con la solución Ca++-Co++ pero ahora conteniendo la(s) droga(s) en cuestión. Después de 10 min se tomaron los registros de las corrientes macroscópicas. Las flechas indican el cero de corriente y las medidas de las corrientes se hicieron al final del pulso, a menos que se indique lo contrario. La solución externa Ca++ -Co++ tiene la siguiente composición (mM): NaCl 136, KCl 4, CaCl2 0.5, MgCl2 1, HEPES-Na 10, CoCl2 2 y dextrosa 11; el pH se ajustó a 7.4 con NaOH. La solución interna tiene la siguiente composición (mM): ác. aspártico 80, KCl 50, KH2PO4 10, MgSO4 1, Na 2ATP 3, HEPES-K 5, GTP 0.2 y EGTA 10; el pH se ajustó a 7.4 con KOH. Drogas. Las drogas utilizadas 4-aminopiridina (4-AP), 3-aminopiridina (3-AP), Cloruro de acetilcolina (ACh), Cloruro de colina (ChCl), Tetrametilamonio (TMA), Trimetil(p-aminofenil)amonio, Metacolina, Betanecol, Ac. p-aminobenzoico, Ac. sulfanílico y Tropicamida (Sigma Chemicals), Methoctramina y p-F-HHSiD (Research Biochemicals International), Tertiapina (Alamone Labs, Jerusalén): fueron directamente disueltas en la solución externa según se requirió. Después que se disolvió la 4-AP o la 3-AP se ajustó el pH a 7.4 con HCl. Con las demás drogas no fue necesario volver a ajustar el pH. Los datos fueron expresados como la media ± ES. La significancia estadística fue evaluada por la prueba t de Student’s. Las comparaciones múltiples fueron evaluadas usando ANOVA y la prueba de Dunnett’s. Las diferencias se consideraron significativas a P < 0.05. 30 RESULTADOS I. CORRIENTES DE POTASIO ACTIVADAS POR COLINA EN MIOCITOS AURICULARES DE DIFERENTES ESPECIES DE MAMÍFERO El primer objetivo que nos plantemos fue demostrar que el efecto de la colina activando una corriente dependiente de tiempo y voltaje, es independiente de la especie. Para este objetivo se estudió el efecto de colina en miocitos auriculares de las especies mas frecuentemente utilizadas en el laboratorio, para experimentos de electrofisiología cardiaca. En la Figura 3 se muestran trazos de corriente (restas digitales, trazos de corriente en la presencia del agonista menos los trazos de corriente en condiciones control) activada por 1,10 y 30 mM de colina en miocitos auriculares de perro (Figuras 3 A, 3 B y 3 C, respectivamente). La corriente activada por colina tiene las mismas características que cuando es activada en miocitos de gato: activa una corriente dependiente de tiempo a potenciales negativos a EK, la cual se caracteriza por un rápido aumento en la amplitud de la corriente, seguido de una disminución lenta, también dependiente de tiempo. A potenciales positivos a EK, colina activa una corriente instantánea, seguida de una corriente dependiente de tiempo, la cual activa mas rápido mientras mas alta es la concentración del agonista y mas positivo el voltaje. A potenciales positivos, esta misma corriente después de alcanzar un máximo disminuye con el tiempo durante el pulso, ésta disminución también es dependiente de la concentración, siendo mas marcada cuanto mas alta es ésta. Además, mientras mas alta es la concentración del agonista, la saturación en las corrientes se presenta a potenciales menos positivos. El registro de las corrientes de cola se hizo a -100 mV, pudiendo observarse que mientras más positivo es el potencial que se aplica durante el pulso previo, la corriente de cola es mayor. Esta corriente de cola muestra un rápido aumento seguida de una disminución dependiente de tiempo. 31 • < B 4 pA/pF A 1 s D C Colina I (pA/pF) 8 1 mM Colina 10 mM 6 4 Colina 30 mM 2 0 -120 -80 -40 0 -2 40 80 Vm (mV) Figura 3. Corriente activada (restas digitales) por colina en miocitos auriculares de perro. Trazos de corriente activada por 1 mM (A), por 10 mM (B) y por 30 mM (C) de colina, aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -100 hasta +80 mV, regresando a -100 mV. D, relación corriente-voltaje de las corrientes medidas al final del pulso para 1 mM (•), 10 mM (n ) y 30 mM ( ) de colina (n=6). Cada punto representa la media ± ES. El cobayo es otra especie que es muy utilizada en experimentación en electrofisiología cardiaca. En la Figura 4 se muestran trazos de corriente en condiciones control (Figura 4 A), en presencia de 1 mM de colina (Figura 4 B) y la resta digital de las Figuras 4 A y 4 B, es decir, la corriente activada por colina (Figura 4 C). Las características de la corriente activada por colina en miocitos auriculares de cobayo, son muy semejantes a las de la corriente activada por colina en gato o perro. Colina activa una corriente de fondo, a potenciales negativos a EK hay un rápido aumento seguido de una disminución dependiente de tiempo de la corriente. 32 A • < B 20 pA/pF A 1 s C D ♦ I (pA/pF) 60 50 Control 40 Colina 1 mM Colina 1 mM - Control 30 20 10 0 -120 -80 -40 0 -10 40 80 Vm (mV) -20 Figura 4. Efecto de la colina sobre miocitos auriculares de cobayo. Trazos de corriente en condiciones control (A), en la presencia de 1 mM de colina (B) y la corriente activada por 1 mM de colina (resta digital de B-C) (C); aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso para condiciones control (•), en la presencia de 1 mM (n) y la corriente activada por 1 mM (♦) de colina (n=6). Cada punto representa la media ± ES. potenciales positivos a EK activa una corriente instantánea seguida de una corriente dependiente de tiempo. La corriente es activada con dependencia de tiempo, voltaje y concentración. Las corrientes de cola en este caso se registraron a –40 mV, en las cuales, de igual manera, se puede observar la dependencia de voltaje de la activación de la corriente. En la Figura 4 D, se muestran las curvas corriente -voltaje correspondientes. La colina también se probó sobre células cardiacas de ratón. En la Figura 5 se muestran trazos de corriente (restas digitales) activada por 1 mM (Figura 5 A), 3 mM (Figura 5 B) y 30 mM (Figura 5 C) de colina en miocitos auriculares de ratón. La 33 colina activa la corriente de una manera muy semejante a como lo hace colina en miocitos auriculares de gato, perro y cobayo. Colina activa una corriente de fondo, a potenciales negativos al potencial de inversión de la corriente, se presenta un rápido aumento seguido de una disminución dependiente de tiempo de la corriente. A potenciales positivos a EK activa una corriente de fondo seguida de una corriente dependiente de tiempo. La amplitud de la corriente de fondo es dependiente de la concentración. El curso temporal de la corriente dependiente de tiempo es mas rápido conforme la concentración es mayor. El registro de las corrientes de cola se hizo a -110 mV, pudiendo observarse que mientras mas positivo es el potencial que se aplica en el pulso previo, la corriente de cola es mayor, mostrando dependencia • < B 10 pA/pF A 1 s C ♦ D I (pA/pF) 20 16 Colina Colina 1 mM 3 mM 12 8 Colina 30 mM 4 0 -120 -80 -40 0 -4 40 80 Vm (mV) -8 Figura 5. Corriente activada por colina (restas digitales) en miocitos auriculares de ratón. Trazos de corriente activada por 1 mM (A), por 3 mM (B) y por 30 mM (C) de colina, aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -110 mV. D, relación corriente-voltaje de las corrientes medidas al final del pulso para 1 mM (•), 3 mM (n) y 30mM (♦)de colina (n=6). Cada punto representa la media ± ES. 34 de voltaje en la activación de la corriente. Esta corriente de cola muestra un rápido aumento seguida de una disminución dependiente de tiempo. Las curvas corriente-voltaje correspondientes se muestran en la Figura 5 D. Las corrientes muestran una saturación a potenciales positivos dependiente de la concentración de colina, a mayor concentración la saturación se presenta a potenciales menos positivos. En la Figura 6 se muestran trazos de corriente (restas digitales) correspondientes a la activación de 1 mM (Figura 6 A), 3 mM (Figura 6 B) y 30 mM (Figura 6 C) de colina en miocitos auriculares de conejo. La colina activa una corriente de fondo que a potenciales negativos a E K presenta una disminución < B 4 pA/pF A • 1 s D C I (pA/pF) 10 8 Colina 1 mM Colina 3 mM 6 4 Colina 30 mM 2 0 -120 -80 -40 0 -2 40 80 Vm (mV) Figura 6. Corriente activada por colina (restas digitales) en miocitos auriculares de conejo. Trazos de corriente activada por 1 mM (A), por 3 mM (B) y por 30 mM (C) de colina, aplicando pulsos de 2 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso para 1 mM (•), 3 mM (n) y 30mM ( ) de colina (n=4). Cada punto representa la media ± ES. 35 dependiente de tiempo. A potenciales positivos a EK, la activación de la corriente es dependiente de tiempo, no mostrando un pico máximo o disminución de corriente. Las corrientes de cola registradas a -40 mV no son muy grandes, pero muestran dependencia de voltaje. Las curvas corriente-voltaje se muestran en la Figura 6 D. La última especie en la que probamos colina es la rata. En la Figura 7 se muestran trazos de corriente en condiciones control (Figura 7 A) y en la presencia de 3 mM de colina (Figura 7 B). Las corrientes activadas por colina son muy semejantes • B 10 pA/pF A 1 s C I (pA/pF) 50 40 Control 30 Colina 3 mM 20 10 0 -80 -40 0 40 80 Vm (mV) -10 Figura 7. Corriente activada por colina en miocitos auriculares de rata. Trazos de corriente en condiciones control (A), en la presencia de 3 mM (B) de colina aplicando pulsos de 2 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -90 hasta +70 mV, regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para condiciones control (•) y en la presencia de 3 mM de colina ( ) (n=6). Cada punto representa la media ± ES. 36 a las activadas por colina en conejo. Colina activan una corriente de fondo y a potenciales positivos a -40 mV se activa una corriente dependiente de tiempo que no muestra un pico máximo de corriente y su activación es voltaje dependiente, como se puede observar en las colas, las cuales fueron registradas a -40 mV. Cabe hacer notar que en algunos de los protocolos se registraron las corrientes de cola a –100 o –110 mV y en otros a –40 mV, sin afectar las mediciones hechas, ya que éstas se hicieron al final de los pulsos de prueba. En ambos casos se puede observar la dependencia de voltaje de la activación de la corriente por colina. Los resultados anteriores nos permiten concluir que la o las corrientes activadas por el agonista muscarínico colina, en miocitos auriculares de diferentes especies de mamífero, posee características similares voltaje- y tiempo- dependientes. II. EVIDENCIAS QUE SUGIEREN QUE LA CORRIENTE ACTIVADA POR COLINA NO ES UNA CORRIENTE DE RECTIFICACIÓN TARDIA “VERDADERA”, SINO POSIBLEMENTE LA ACTIVACION VOLTAJE-DEPENDIENTE DE IK-ACh Curso temporal de la activación y la desactivación de la corriente dependiente de tiempo y voltaje inducida por colina. En la Figura 8 A y 8 C, se presenta la corriente dependiente de tiempo y voltaje registrada en presencia de colina a dos diferentes concentraciones (1 y 3 mM). La corriente activada por pulsos despolarizantes a 0, +20, +40 y +60 mV es mostrada. Como se puede observar, el curso temporal de la activación de la corriente fue dependiente del voltaje y de la concentración de colina, cuanto mas positivo el voltaje y mayor la concentración de colina mas rápida la activación de la corriente. En los paneles B y D de la Figura 8 se muestran las corrientes de cola registradas a potenciales de 0, -40, -80 y -120 mV, después de aplicar desde un potencial de mantenimiento de -40 mV pulsos despolarizantes a +50 mV. Los resultados muestran que el curso temporal de la corriente de cola es independiente del voltaje y de la concentración de colina. El curso temporal de la activación fue ajustada con la siguiente ecuación: 37 < B 500 ms 750 pA 500 ms • C F Colina 1 mM Colina 3 mM Colina 10 mM 1000 800 800 τ (ms) τ (ms) • D E 1200 600 400 200 0 1 nA < A 600 400 200 0 10 20 30 40 50 60 -120 -100 -80 -60 -40 -20 Vm (mV) 0 20 Vm (mV) Figura 8. Dependencia de la concentración del curso temporal de la activación. Corrientes activadas por colina aplicando pulsos despolarizantes a diferentes potenciales de membrana (0, +20, +40 y +60 mV) desde un potencial de mantenimiento de -120 mV. Trazos de corrientes activadas por 1 mM (A) y 3 mM (C) de colina. El curso temporal de la activación se ajustó a una exponencial. Las τ de activación de la corriente activada por tres diferentes concentraciones de colina fueron graficadas en función del voltaje (n=5) (E). Corrientes de cola activadas por 1 mM (B) y 3 mM (D) de colina aplicando desde un potencial de mantenimiento de -40 mV, pulsos despolarizantes a +50 mV seguidos por pulsos repolarizantes a potenciales de membrana entre 0 y -120 mV. El curso temporal de la desactivación fue ajustada por una exponencial. Las τ de desactivación fueron graficadas en función del voltaje, a tres diferentes concentraciones de colina (n=5) (F). Cada punto representa la media ± ES. 38 I = A0 + A1 (1-e-t/τ) n (1) El decaimiento de la corriente de cola fue ajustado por la ecuación: I = A0 + A1 e-t/τ (2) Donde Ao es el nivel basal de activación, A1 es una constante , τ es la constante de tiempo de activación y t es tiempo. En la Figura 8 E se muestra la τact de activación como función del potencial de membrana (Vm) a tres diferentes concentraciones de colina (1, 3, y 10 mM). Las constantes de tiempo de decaimiento de la corriente de cola, registrada a diferentes potenciales y en presencia de las tres diferentes concentraciones de colina se muestran en la Figura 8 F. El potencial de inversión de la corriente activada por colina fue de -86.4 ± 2.3 mV, valor muy cercano al predicho por la ecuación de Nernst para una corriente de potasio. Efectos de dofetilida e indapamida sobre la corriente activada por colina. Como se mencionó anteriormente en la introducción y en los objetivos, ha sido sugerido que colina, 4-AP y TMA podrían activar una corriente rectificadora tardía (Fermini y Nattel, 1994; Shi et al., 1999). Con el fin de probar la posibilidad de que colina estuviera activando uno o los dos componentes de rectificación tardía hasta ahora caracterizados en los tejidos cardiacos (Sanguinetti y Jurkiewicz, 1990a), se observaron los efectos del bloqueador selectivo de IKr dofetilida (5 µM), mas el bloqueador selectivo de IKs indapamida (300 µM) sobre las corrientes activadas por colina. La administración de ambos bloqueadores no afectó la activación de las corrientes activadas por colina (Figura 9), sugiriendo que colina no activa IKr ni IKs . Las corrientes activadas por colina y ACh durante pulsos despolarizantes pueden tener similares cursos temporales. Uno de los argumentos de que colina y acetilcolina no estuvieran activando el mismo canal es la diferencia en la morfología de las corrientes. La corriente activada por colina en miocitos auriculares de gato tiene un curso temporal diferente al de la corriente activada por ACh (Figura 22). Sin embargo, cuando las corrientes activadas por colina y ACh fueron obtenidas usando un protocolo en el cual los canales fueron activados primero por pulsos 39 300 pA 1 s Figura 9. Efectos del bloqueador de IKr , dofetilida, y del bloqueador de IKs , indapamida, sobre la corriente activada por colina. Se aplicaron pulsos de 3 s de duración a +60 mV desde un potencial de mantenimiento de -40 mV. Los trazos de corriente antes (=), en la presencia de 5 µM de dofetilida mas 300 µM de indapamida ( ), y en la presencia de dofetilida + indapamida + 3 mM de colina (c) son presentados. despolarizantes a +50 mV, la rectificación fue removida por pulsos cortos hiperpolarizantes a -120 mV, y el pulso despolarizante de prueba fue aplicado a diferentes potenciales de membrana (Figura 10 A y 10 C). Bajo estas condiciones las corrientes obtenidas por los pulsos de prueba positivos al potencial de inversión son similares en presencia de los dos agonistas (Figura 10 A y 10 C). Las corrientes salientes mostraron un rápido incremento transitorio, seguido por un rápido decaimiento debido a una marcada rectificación entrante. El pico máximo de corriente saliente (Ipico) con ambos agonistas tuvieron similares amplitudes (Figura 10 E). Cuando en presencia de colina la duración del pulso hiperpolarizante fue de 3 s (ver protocolo Figura 10), la corriente registrada a –120 mV muestra un decaimiento claramente dependiente de tiempo. Así mismo, las corrientes salientes activadas por los pulsos de prueba muestran una lenta activación, sin el componente inicial transitorio observado con el pulso hiperpolarizante corto (Figura 10 B). Sin embargo, en presencia de ACh el curso temporal de las corrientes obtenidas con los pulsos de prueba son similares, independientemente de la duración del pulso 40 + 50 +10 -30 -70 -110 -40 B A -120 < 1 s E D ♦ 1 s F I final ( p A / p F ) 4 0 I pico ( p A / p F ) 4 0 Colina 3 mM 30 Acetilcolina 1 µM 20 A c e t i l c o l i n a 1 µ M 20 10 10 -120 10 pA/pF C 10 pA/pF • -90 -60 -30 0 -10 30 Colina 3 mM 0 30 60 Vm (mV) -20 -120 -90 -60 -30 0 -10 0 30 60 Vm (mV) -20 Figura 10. Las corrientes activadas por colina y ACh pueden tener cursos temporales similares o diferentes durante la despolarización, dependiendo del protocolo de estimulo. A, corrientes activadas por 3 mM de colina. Los canales fueron primeramente activados por pulsos despolarizantes de 500 ms de duración a +50 mV, seguido de un pulso hiperpolarizante a -120 mV por 200 ms para remover la rectificación sin permitir una significante desactivación de los canales; los pulsos de prueba se aplicaron desde este potencial. B, corrientes activadas por 3 mM de colina, obtenidas en la misma célula que en A. En este protocolo la duración del pulso hiperpolarizante a –120 mV es de 4 s. Desde este potencial se aplicaron los pulsos de prueba a diferentes potenciales de membrana. C, Corrientes activadas por 1 µM de ACh obtenidas en la misma célula que A y B, utilizando el mismo protocolo que en A. D, Corrientes activadas por 1 µM de ACh obtenidas en la misma célula, utilizando el mismo protocolo que en B. Las relaciones corriente-voltaje de las corrientes activadas por colina y ACh en A y C medidas al pico (E) y en B y D medidas al final del pulso (F) son mostradas, (n=5). Cada punto representa la media ± ES. 41 300 pA 1 s Figura 11. Efecto de variar la duración del pulso hiperpolarizante sobre la corriente semejante a un rectificador tardío, activada por colina. La corriente activada por 3 mM de colina fue registrada aplicando pulsos desde un potencial de mantenimiento de -40 mV, a +50 mV por 1 s, seguidos de un pulso hiperpolarizante a -120 mV de duración variable, aplicando después un pulso posthiperpolarizante a +50 mV. Un breve pulso hiperpolariza nte resultó en un gran aumento de la corriente activada, la cual disminuyó rápidamente, siendo similar al proceso de rectificación presente en IK-ACh (Figura 10 C). Con una gran hiperpolarización, la corriente rápida registrada con los pulsos posthiperpolarizantes disminuyó (las flechas indican el pico) y una corriente con activación lenta simultáneamente se hace mas evidente. hiperpolarizante (Figuras 10 C y 10 D). Las corrientes medidas al final de los pulsos a +50 mV con ambos agonistas tienen amplitudes similares (Figura 10 F). En la Figura 11, se muestra el curso temporal del cambio de una corriente activada por colina con características de un rectificador entrante, utilizando pulsos hiperpolarizantes cortos, a una corriente con características de rectificador tardío con pulsos hiperpolarizantes largos. Desde un potencial de membrana de -40 mV, se aplicaron pulsos a +50 mV, seguidos por pulsos hiperpolarizantes a -120 mV de duración variable, después de los cuales se aplicó el pulso de prueba a +50 mV. El 42 pulso despolarizante inicial activó la corriente, y el pulso hiperpolarizante que le siguió removió la rectificación, cuando el pulso hiperpolarizante fue corto, la corriente saliente inducida por el pulso despolarizante de prueba mostró un aumento rápido transitorio debido a la rectificación de la corriente. Cuando la duración del pulso hiperpolarizante fue incrementado progresivamente, lo cual indujo mayor desactivación, la morfología de la corriente de prueba fue progresivamente cambiando hacia una corriente similar a un rectificador tardío. Interacción de colina y adenosina. Adenosina actuando como un agonista de los receptores purinérgicos A1 activa IK-ACh de una forma voltaje-independiente, a través de una proteína Gi/o, similar a como lo hace ACh (Belardinelli e Isenberg, 1983). Si la colina activara una corriente rectificadora tardía mediante un receptor muscarínico, entonces cuando adenosina (a una concentración máxima) y colina sean aplicados conjuntamente, nosotros deberíamos observar la activación de IK-ACh por adenosina a través de la activación del receptor A1 mas la activación del rectificador tardío por colina a través de la activación del receptor muscarínico. Si colina activara IK-ACh de una manera voltaje-dependiente, la aplicación simultánea de adenosina (a una concentración máxima) induciría competición al nivel del efector (canal IK-ACh ) y, se observaría una disminución en la corriente similar al rectificador tardío, como se ha observado cuando colina y ACh son administrados juntos (Fermini y Nattel, 1994), ó ACh y 4-AP (Navarro-Polanco y Sánchez-Chapula, 1977). Desafortunadamente encontramos que adenosina no activa IK-ACh en miocitos auriculares de gato (resultados no mostrados). Una probable explicación a esto es que los receptores purinérgicos A1 no se encuentren presentes en miocitos auriculares de gato. Hasta la fecha no se ha publicado nada al respecto. Por lo tanto, la interacción entre colina y adenosina se estudió en miocitos auriculares de cobayo. Colina 1 mM indujo la corriente tiempo- y voltaje-dependiente ya descrita anteriormente (Figura 12 A). Adenosina 100 µM indujo una corriente rectificadora entrante (Figura 12 C), ya previamente descrita (Belardinelli e Isenberg, 1983). Cuando adenosina y colina fueron administradas juntas a las mismas concentraciones descritas antes, la morfología de la corriente fue similar a la de un 43 B < • 500 pA A 1 s C D ChCl 3 mM 20 ♦ C h C l + A d o 1 0 0 µM Ado ∆ I (pA) 15 10 5 0 -40 -20 0 20 40 60 80 Vm (mV) Figura 12. Efecto de adenosina sobre las corrientes activadas por colina en miocitos auriculares de cobayo. Resta digital de los trazos de corriente (condición menos el control), en la presencia de 3 mM de colina (A), 3 mM de colina + 100 µM de adenosina (B) y 100 µM adenosina (C). Las corrientes fueron registradas aplicando pulsos hiperpolarizantes y despolarizantes desde un potencial de mantenimiento de -40 mV, desde -110 y +70 mV, seguidos por un pulso a -40 mV. La flecha indica el cero de corriente. D, relación corrientevoltaje para la corriente dependiente de tiempo ( I) medidas como la corriente al final menos la corriente medida al inicio del pulso despolarizante (n=4). Cada punto representa la media ± ES. rectificador entrante, la corriente rectificadora tardía activada por los pulsos a potenciales positivos y la corriente de cola observada al regresar a -40 mV en presencia de colina sola, fueron significativamente mas pequeñas cuando se administraron los dos fármacos juntos (Figura 12 B), sugiriendo que el efecto de colina y adenosina no fue aditivo sino competitivo. 44 • < B 5 pA/pF A 1 s C ♦ D Control Acetilcolina 300 nM I (pA/pF) 30 25 20 15 Acetilcolina 300 nM + Tertiapina 200 nM 10 5 0 -120 -90 -60 -30 -5 -10 0 30 60 Vm (mV) -15 -20 Figura 13. Efecto del bloqueador selectivo de IK-ACh , tertiapina, sobre corrientes activadas por ACh. Los trazos de corriente en condiciones control (A), en la presencia de 300 nM de ACh (B) y de 300 nM de ACh + 200 nM de tertiapina (C), se registraron aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso, en condiciones control (•), en la presencia de 300 nM de ACh (n) y 300 nM de ACh + 200 nM de tertiapina (♦ ) (n=4). Cada punto representa la media ± ES. La tertiapina bloquea las corrientes activadas por diferentes agonistas muscarínicos. Como ya fue mencionado, la tertiapina es una toxina obtenida del veneno de la abeja, la cual bloquea selectivamente canales rectificadores entrantes. En tejidos cardiacos ha sido descrito que la tertiapina bloquea selectivamente la corriente IK-ACh , a concentraciones nanomolares (Kitamura et al., 2000). En la presente tesis, se estudió el efecto de tertiapina a una concentración 200 nM, sobre las corrientes activadas por los agonistas muscarínicos ACh (Figura 13), colina 45 • B < ♦ C 5 pA/pF A 1 s D E F ♦ 28 I (pA/pF) 21 Control Colina 3 mM 14 Colina 3 mM + Tertiapina 200 nM Tertiapina 200 nM 7 0 -120 -80 -40 0 -7 40 Vm (mV) Figura 14. Efecto del bloqueador selectivo de IK-ACh , tertiapina, sobre corrientes activadas por colina. Los trazos de corriente mostrados corresponden a: En una primera serie de experimentos, en condiciones control (A), en la presencia de 3 mM de colina (B) y de 3 mM de colina + 200 nM de tertiapina (C). En otra serie de experimentos, en la presencia de 200 nM de tertiapina (D) y en la presencia de tertiapina + 3 mM de colina (E). Las corrientes se registraron aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. F, relación corriente-voltaje de las corrientes medidas al final del pulso, en condiciones control (•), en la presencia de 3 mM de colina (n), 3 mM de colina + 200 nM de tertiapina ( ) y 200 nM de tertiapina ( ) (n=4). Cada punto representa la media ± ES. (Figura 14),TMA (Figura 15) y betanecol (Figura 31). En la Figura 13 se muestran los registros obtenidos en condiciones control (Figura 13 A), después de administrar 300 nM de ACh (Figura 13 B) y, en presencia de ACh mas 200 nM de tertiapina. Lo que se puede observar es que la tertiapina bloquea la corriente activada por ACh, en 46 • B < 5 pA/pF A 1 s C D 21 I (pA/pF) 18 15 Control TMA 1 mM TMA 1 mM + 12 9 6 Tertiapina 200 nM 3 0 -120 -80 -40 -3 -6 0 40 Vm (mV) Figura 15. Efecto del bloqueador selectivo de IK-ACh , tertiapina, sobre corrientes activadas por TMA. Los trazos de corriente en condiciones control (A), en la presencia de 1 mM de TMA (B) y de 1 mM de TMA + 200 nM de tertiapina (C), se registraron aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso, en condiciones control (•), en la presencia de 1 mM de TMA (n) y 1 mM de TMA + 200 nM de tertiapina ( ) (n=4). Cada punto representa la media ± ES. otras células se pudo observar un bloqueo parcial. En la gráfica de la Figura 13 se muestran las curvas corriente-voltaje de los resultados resumidos de cuatro experimentos. El efecto de tertiapina sobre las corrientes ind ucidas por colina 3 mM son mostradas en la Figura 14. Dos diferentes tipos de protocolo fueron utilizados, en el primero, se tomaron primeramente los registros control (Figura 14 A), después en presencia de colina (Figura 14 B) y en la continua presencia del agonista se agregó la tertiapina (Figura 14 C). El bloqueo inducido por tertiapina tanto de las corrientes 47 entrantes y salientes inducidas por colina es claro. Con este tipo de experimentos y tomando en cuenta la desensibilización parcial de los receptores muscarínicos que se presenta en la continua presencia de agonistas, se realizó una segunda serie de experimentos. En estos experimentos, se tomaron los registros control, en la presencia de tertiapina 200 nM (Figura 14 D). En la continua presencia de la toxina se agregó colina 3 mM (Figura 14 E), se puede observar que en presencia de la tertiapina, la colina no activa la corriente ni para pulsos hiperpolarizantes ni despolarizantes. En la gráfica de la Figura 14 F, se muestran las curvas corrientevoltaje de los resultados resumidos de cuatro experimentos. En la Figura 15, el efecto de la tertiapina sobre las corrientes inducidas en miocitos auriculares de gato por el agonista muscarínico TMA es mostrado. Tertiapina bloquea tanto las corrientes entrantes como salientes inducidas por el TMA. ¿La corriente voltaje-dependiente activada por colina se debe a la activación de receptores M3 o M4 ?. Como ya se ha mencionado, Shi et al. (1999) han planteado que las corrientes con características de rectificador tardío, inducidas por 4-AP y TMA, se deben a la activación de receptores M3 por TMA y M4 por colina. En el presente proyecto nos hemos planteado el objetivo de investigar la posible interacción de antagonistas “específicos” de receptores M2 methoctramina, M3 p-F-HHSiD y M4 , tropicamida y, el agonista muscarínico, colina. Debido a una de las características importante de los mAChRs, que es la desensibilización que presentan en la continua presencia del agonista, en el presente trabajo, para evitar errores experimentales causados por la desensibilización de los receptores, los experimentos se realizaron primeramente administrando el antagonista, luego el antagonista mas el agonista juntos, después se lavaron ambos fármacos, para luego administrar solo el agonista. Así, el receptor esta poco tiempo en contacto con el agonista y disminuyendo la desensibilización del receptor. Las corrientes mostradas de los siguientes experimentos son la resta digital de las corrientes en presencia del agonista o del agonista mas el antagonista, menos los trazos de corriente en la presencia del antagonista solo. 48 B 10 pA/pF A < • 1 s C I (pA/pF) Acetilcolina 300 nM 30 20 Acetilcolina 300 nM + 10 Methoctramina 30 nM 0 -120 -80 -40 0 -10 40 80 Vm (mV) -20 -30 Figura 16. Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada (restas digitales) por acetilcolina en miocitos auriculares de gato. Las corrientes mostradas son las restas digitales. A, Trazos de corriente activada por 300 nM de acetilcolina. B corriente activada por 300 nM de acetilcolina en la presencia de 30 nM de methoctramina. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para acetilcolina (n) y acetilcolina mas methoctramina (•) (n=4). Cada punto representa la media ± ES. Interacción de antagonistas específicos de receptores M2 , M3 , y M4 con ACh en miocitos auriculares de gato. En la Figura 16 se presenta el efecto de la ACh y de la methoctramina (antagonista M2 ). En la Figura 16 A se presentan trazos de corriente activada por 300 nM de ACh y en la Figura 16 B se puede observar el efecto de 300 nM ACh y 30 nM de methoctramina. Las curvas corriente-voltaje se muestran en la Figura 16 C. La methoctramina disminuye la corriente activada por ACh a todos los potenciales explorados, siendo estas diferencias significativas. 49 10 pA/pF A < B • 1 s C I (pA/pF) Acetilcolina 300 nM 15 10 Acetilcolina 300 nM + 5 p-F-HHSiD 30 nM 0 -120 -80 -40 0 -5 40 80 Vm (mV) -10 -15 -20 Figura 17. Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada (restas digitales) por acetilcolina en miocitos auriculares de gato. A, Trazos de corriente activada por 300 nM de acetilcolina. B corriente activada por 300 nM de acetilcolina en la presencia de 30 nM de p-F-HHSiD. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -100 hasta +70 mV , regresando a -40 mV. C, relación corriente-voltaje de las corrientes medidas al final del pulso para acetilcolina (n) y acetilcolina mas p-F-HHSiD (•) (n=5). Cada punto representa la media ± ES. En la Figura 17 se muestra el efecto de la ACh y el p-F-HHSiD (antagonista M3). En la Figura 17 A se presenta la corriente activada por 300 nM de ACh y en la Figura 17 B se puede observar el efecto 300 nM de ACh mas 30 nM de p-F-HHSiD. En la Figura 17 C se muestran las curvas corriente - voltaje correspondientes. Los resultados nos muestran que p-F-HHSiD disminuye la corriente activada por ACh. En la Figura 18 A se presenta la corriente activada por 300 nM de ACh. En la Figura 18 B se presentan trazos de corriente de la corriente activada por ACh en la presencia de 200 nM de tropicamida (antagonista M4 ). Las curvas corriente-voltaje 50 10 pA/pF A < • B 1 s C Acetilcolina 300 nM I (pA/pF) 30 20 Acetilcolina 300 nM + 10 Tropicamida 200 nM 0 -120 -80 -40 0 -10 40 80 Vm (mV) -20 -30 -40 Figura 18. Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada (restas digitales) por acetilcolina en miocitos auriculares de gato. A, Trazos de corriente activada por 300 nM de acetilcolina. B, corriente activada por 300 nM de acetilcolina en la presencia de 200 nM de tropicamida. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -100 hasta +70 mV , regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para acetilcolina (n ) y acetilcolina mas tropicamida (•) (n=4). Cada punto representa la media ± ES. correspondientes se presentan en la Figura 18 C. La corriente activada por ACh disminuye muy poco a todos los potenciales de prueba. Los resultados anteriores nos muestran que los tres fármacos supuestamente específicos para los diferentes tipos de receptores muscarínicos, producen un bloqueo parcial de la corriente activada por ACh, la cual ha sido identificada por diferentes autores como mediada a través de receptores M2 . 51 < • B 10 pA/pF A 1 s C I (pA/pF) 30 Colina 1 mM 20 Colina 1 mM + Methoctramina 30 nM 10 0 -120 -80 -40 0 40 80 Vm (mV) -10 Figura 19. Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada (restas digitales) por colina en miocitos auriculares de gato. A, Trazos de corriente activada por 1 mM de colina. B, corriente activada por 1 mM de colina en la presencia de 30 nM de methoctramina. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente-voltaje de las corrientes medidas al final del pulso para colina (n) y colina mas methoctramina (•) (n=5). Cada punto representa la media ± ES. Interacción de antagonistas específicos de receptores M2, M3, y M4 con colina en miocitos auriculares de gato. En la siguiente serie de experimentos el efecto de los diferentes antagonistas sobre las corrientes activadas por colina fueron estudiadas. En la Figura 19 A se presenta la corriente activada por 1 mM de colina, los trazos de corriente muestran las características cinéticas ya descritas para la corriente activada por colina. En la Figura 19 B se presentan trazos de la corriente activada por 1 mM de colina en la presencia de 30 nM de methoctramina. En la 52 < B • 5 pA/pF A 1 s C I (pA/pF) 12 10 Colina 1 mM Colina 1 mM + p-F-HHSiD 30 nM 8 6 4 2 0 -120 -80 -40 0 -2 40 80 Vm (mV) Figura 20. Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada (restas digitales) por colina en miocitos auriculares de gato. A, Trazos de corriente activada por 1 mM de colina. B, corriente activada por 1 mM de colina en la presencia de 30 nM de p-F-HHSiD. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente-voltaje de las corrientes medidas al final del pulso para colina (n) y colina mas p-FHHSiD (•) (n=5). Cada punto representa la media ± ES. Figura 19 C se presentan las curvas corriente-voltaje correspondientes. El efecto de methoctramina sobre la corriente activada por colina, presenta características similares al bloqueo inducido por el antagonista de receptores muscarínicos atropina (Navarro Polanco, 1997). El antagonismo es mas marcado a potenciales negativos. En la Figura 20 A se muestran las corrientes activadas por colina 1mM, y en la Figura 20 B se muestran trazos de corriente activada por 1 mM de colina en la presencia de 30 nM de p -F-HHSiD. Las curvas corriente-voltaje se muestran en la 53 < • B 10 pA/pF A 1 s C I (pA/pF) 32 24 Colina 1 mM 16 Colina 1 mM + Tropicamida 200 nM 8 0 -120 -80 -40 0 -8 40 80 Vm (mV) Figura 21. Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada (restas digitales) por colina en miocitos auriculares de gato. A, Trazos de corriente activada por 1 mM de colina. B, corriente activada por 1 mM de colina en la presencia de 200 nM de tropicamida. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corrientevoltaje de las corrientes medidas al final del pulso para colina (n) y colina mas tropicamida (•) (n=5). Cada punto representa la media ± ES. Figura 20 C. El p-F-HHSiD disminuye la corriente activada por colina a todos los potenciales entre -110 hasta +70 mV, siendo estas diferencias significativas. En la Figura 21 A se presentan trazos de la corriente activada por 1 mM de colina. La corriente activada por 1 mM de colina en presencia de 200 nM de tropicamida se presenta en la Figura 21 B. Las curvas corriente -voltaje se muestran en la Figura 21 C. La corriente activada por colina también es disminuida por tropicamida a todos los potenciales estudiados, siendo estas diferencias significativas, sin embargo, al igual que el antagonismo de methoctramina, el antagonismo de tropicamida es mayor a potenciales negativos. Similar a lo 54 observado con la corriente activada por ACh, los tres antagonistas “específicos” de receptores muscarínicos, producen un bloqueo parcial de la corriente activada por colina. Debo hacer notar que el efecto de methoctramina y tropicamida presenta características voltaje-dependientes, el bloqueo es mayor para potenciales negativos, mientras que el bloqueo de p-F-HHSiD es voltaje-independiente. Una proteína G sensible a PTX está involucrada en la activación de la corriente por colina. En otra serie de experimentos se probó el efecto de la PTX (toxina pertussis) sobre la corriente activada por colina. La PTX se une irreversiblemente a las proteínas G que son sensibles a ella, impidiendo que la proteína G active al efector correspondiente (Kurachi, 1995). Las células dispersadas en un mismo día se dividieron en dos grupos, una parte de ellas se trataron con PTX y la otra parte no. Las células tratadas se incubaron con el PTX 2 horas antes de ser utilizadas. Los resultados obtenidos se pueden observar en la Figura 22. En la Figura 22 A, se muestran trazos de corriente que pertenecen a una célula no tratada con PTX a +50 mV en condiciones control (Figura 22 Aa) y en la presencia de 3 mM de colina (Figura 22 Ab). En la Figura 22 B, se muestran trazos de corriente a +50 mV de una célula tratada con PTX, en condiciones control (Figura 22 Bc) y en la presencia de 3 mM de colina (Figura 22 Bd). Los resultados se sumarizan en la Figura 22 C, en donde se muestra el curso temporal del efecto de la colina y el lavado de la misma, en una célula no tratada y en otra tratada con PTX. Como se puede observar el incubar la célula con PTX previene la activación de la corriente por colina. Por lo que, en la activación de la corriente por colina están involucradas proteínas G, las cuales son sensibles a PTX. 55 A b C 500 ms 20 pA/pF a Tratada con PTX No Tratada con PTX Colina 30 Lavado b I (pA/pF) 25 B 20 15 10 c d 5 d c Figura 22. 500 ms 8 pA/pF a 0 0 2 4 6 8 10 12 tiempo (min) Efecto de PTX sobre la corriente activada por colina en miocitos auriculares de gato. A, Trazos de corriente de una célula no tratada con PTX, en condiciones control (Aa) y en la presencia de 3 mM de colina (Ab). B, trazos de corriente de una célula tratada con PTX, en condiciones control (Bc) y en la presencia de 3 mM de colina (Bd). Aplicando pulsos de 2 segundos de duración a partir de un potencial de mantenimiento de -40 mV a +50 mV, regresando a -40 mV. C, curso temporal de la aplicación de colina y el lavado de la misma, en una célula tratada (n) y en otra célula no tratada ( ) con PTX. 56 III. CORRIENTES DE POTASIO ACTIVADAS POR DIFERENTES AGONISTAS MUSCARINICOS EN MIOCITOS AURICULARES DE GATO A partir de las diferencias encontradas en las corrientes activadas por ACh, colina y 4-AP, se han propuesto dos diferentes hipótesis para explicarlas. Que colina y 4-AP actúan a través de un receptor diferente que ACh, M3 y M4 , respectivamente, y que esto activa dos diferentes canales rectificadores tardíos (Shi et al., 1999). La otra hipótesis sugiere que colina y 4-AP a través del M2 como ACh activan IK-ACh , pero la activación de la corriente es voltaje dependiente. Se han presentado algunas evidencias que sugieren que la dependencia de voltaje se presenta a nivel de la interacción del agonista con el receptor muscarínico (Navarro-Polanco y SánchezChapula, 1997; Navarro-Polanco, 1997). Se ha propuesto que la ACh interacciona con el receptor muscarínico en cuando menos dos sitios diferentes, el amonio cuaternario interacciona con un grupo aniónico del recepto r y la fracción éster de la ACh establece interacciones con grupos catiónicos del receptor. En esta hipótesis proponemos que cuando el agonista interacciona únicamente con el grupo aniónico del receptor, esta interacción tiene una baja afinidad (requiere concentraciones mayores del agonista) y es voltaje-dependiente, siendo mayor la afinidad a potenciales más positivos. Los resultados con colina, la cual posee el amonio cuaternario de ACh pero no el grupo éster apoya nuestra hipótesis, ya que la afinidad de colina por el receptor es mucho mas baja que la de ACh (requiere concentraciones en el rango milimolar). Además, la corriente activada por colina es voltaje -dependiente. En el presente proyecto, otro de nuestros objetivos fue estudiar el efecto de dos grupos de compuestos, uno de ellos son fármacos no descritos anteriormente como agonistas de receptores muscarínicos, que tuvieran un grupo amino (4-AP) o amonio cuaternario que pudieran interaccionar únicamente con el grupo aniónico del receptor. Se estudiaron también otro grupo de fármacos que ya han sido descritos como agonistas muscarínicos, para determinar cuales de ellos activan IK-ACh en una forma voltaje -independiente como ACh y cuales pudieran activar la corriente en forma voltaje-dependiente como colina y 4-AP. 57 Como ya se mencionó en publicaciones previas de nuestro laboratorio, la corriente activada por ACh presenta características cinéticas muy diferentes a las observadas en la corriente inducida por colina y 4-AP. A continuación presentamos resultados experimentales en los que podemos observar la corriente activada por ACh en miocitos auriculares de gato. Corrientes activadas por ACh en miocitos auriculares de gato. En la Figura 23 A se muestra la corriente macroscópica activada por ACh, los trazos de corriente se obtuvieron mediante la sustracción digital de los trazos de corriente en la presencia de ACh menos los trazos de corriente en condiciones control. Se aplicaron pulsos hiperpolarizantes y despolarizantes desde un potencial de mantenimiento de -40 mV, entre -110 y +70 mV con incrementos de 20 mV con una duración del pulso de 3 s, regresando a -40 mV durante 3 s. La ACh induce una corriente que presenta una clara rectificación entrante. Cuando se aplican pulsos a potenciales negativos al potencial de equilibrio del potasio (E K) desde un potencial de mantenimiento de -40 mV, se observa un incremento rápido de la corriente entrante. Cuando el potencial de membrana se regresa a -40 mV, la corriente aumenta rápidamente, siendo ésta mas grande que la corriente al pico correspondiente a +70 mV, presentando inmediatamente después una disminución dependiente de tiempo de la corriente saliente. Los pulsos despolarizantes inducen una corriente saliente que exhibe rectificación entrante, lo que se puede corroborar en la curva corriente -voltaje de la Figura 23 B. Quiero puntualizar que aun cuando es obvio que el curso temporal de la corriente activada por ACh durante la aplicación de pulsos despolarizantes es completamente diferente que la corriente activada por colina durante la aplicación de los mismos pulsos despolarizantes, las amplitudes de las corrientes máximas activada a +50 mV, medida al final del pulso, no son significativamente diferentes (Figura 10 F). Corrientes activadas por tetrametilamonio (TMA) en miocitos auriculares de gato. El TMA es un amonio cuaternario que posee cuatro grupos metilo. Al igual que colina, la diferencia con la ACh es que el TMA no posee el grupo éster (Figura 1). En 58 A B I (pA/pF) 10 pA/pF < 15 10 5 0 -120 1 s -80 -40 0 -5 40 80 Vm (mV) -10 -15 -20 Figura 23 Corriente activada por acetilcolina en miocitos auriculares de gato. A, trazos de corriente activada (resta digital) por 300 nM de ACh (resta digital de ACh menos el control), aplicando pulsos de 3 segundos de duración a partir de un pote ncial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. B, relación corriente -voltaje de las corrientes medidas al final del pulso (n) (n=6). Cada punto representa la media ± ES. la Figura 24 A, 24 B y 24 C se muestran trazos de corriente activada por 0.1, 0.3 y 3 mM de TMA (restas digitales), respectivamente. El TMA aumenta la corriente al potencial de mantenimiento (-40 mV), este aumento es mayor conforme aumenta la concentración de la droga. Los trazos de corriente también muestran que a potenciales negativos al potencial de mantenimiento (-40 mV), se observa una lenta disminución después de un rápido aumento de la corriente. A potenciales positivos a -40 mV, las corrientes mostraron un aumento tiempo dependiente, inmediatamente después se observa una disminución de la corriente, el curso temporal de ésta es mas lento que el aumento. Las corrientes de cola registradas a -100 mV inducidas por pulsos positivos a este potencial, muestran un incremento inicial seguido por un decremento tiempo-dependiente. Las corrientes de cola a –100 mV son mas grandes conforme el pulso anterior es mas positivo. En la Figura 24 D se muestran las curvas corriente -voltaje de la corriente activada por 0.1, 0.3 y 3 mM de TMA, medida al final 59 < B • 10 pA/pF A 1 s C ♦ D I (pA/pF) 20 16 TMA 0.1 mM 12 TMA 0.3 mM TMA 3 mM 8 4 0 -120 -80 -40 0 -4 40 80 Vm (mV) Figura 24. Corriente activada por TMA en miocitos auriculares de gato. A, trazos de corriente activada (restas digitales) por 0.1 mM de TMA aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -100 hasta +80 mV, regresando a -100 mV. B, corriente activada por 0.3 mM de TMA. C, corriente activada por 3 mM de TMA. D, relación corriente -voltaje de las corrientes medidas al final del pulso para 0.1 mM (•), 0.3 mM (n) y 3mM (♦)de TMA (n=6). Cada punto representa la media ± ES. del pulso. Estos resultados nos muestran que el TMA activa la corriente de una manera muy semejante a colina. Corrientes activadas por 4-AP y 3-AP en miocitos auriculares de gato. NavarroPolanco y Sánchez-Chapula en 1997, encontraron que la 4-AP activa a través de receptores muscarínicos una corriente dependiente de voltaje. La estructura de la 4AP es una amina unida en la posición cuatro a un anillo de piridina, lo cual hace pensar que la interacción de la 4-AP con el receptor muscarínico sería el de la amina cargada con el sitio aniónico del receptor. En la Figura 25 se muestran trazos de 60 • B 5 pA/pF A E 1 s 16 I (pA/pF) 12 Control 3-AP C < D 8 1 mM 3-AP 10 mM ♦ 4-AP 4 1 mM 0 -120 -80 -40 0 -4 40 80 Vm (mV) Figura 25. Corriente activada por 3-AP y 4-AP en miocitos auriculares de gato. Trazos de corriente en condiciones control (A), en la presencia de 1 mM de 4-AP (B), en la presencia de 1 mM de 3-AP (C) y 10 mM de 3-AP (D), aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, a potenciales desde -110 hasta +70 mV, regresando a -40 mV. E, relación corriente-voltaje de las corrientes medidas al final del pulso para condiciones control (•), en la presencia de 1 mM (n ) y 10 mM(♦) de 3-AP y en la presencia de 1 mM de 4-AP ( ) (n=6). Cada punto representa la media ± ES. corriente en condiciones control (Figura 25 A) y en la presencia de 1 mM de 4-AP (Figura 25 B). A potenciales negativos a -40 mV la 4-AP activa una corriente de fondo que presenta rectificación entrante y a potenciales positivos a -40 mV activa una corriente instantánea seguida de una corriente que activa lentamente. Las corrientes de cola registradas al regresar a -120 mV después de aplicar los pulsos, aumentan rápidamente para luego disminuir lentamente. Las corrientes de cola son mayores conforme el pulso previo es mas positivo. La corriente activada durante el 61 pulso y la corriente de cola tienen características semejantes a las características de la corriente que activa colina. Existe otra molécula que es muy semejante a la 4-AP, solo que la amina cambia de posición a la posición 3, este compuesto es llamado 3-aminopiridina (3-AP). El cambio en la posición del grupo amino, modifica el PKa de la molécula de 9.2 a 6.0. Este cambio en el PKa significa que a un pH de 7.4 la fracción de moléculas de 4-AP que tienen el grupo amino cargado (amonio cuaternario) es de 63.1 y que a ese mismo pH la fracción de moléculas de 3-AP cargadas es de 0.04. Si nosotros estamos proponiendo que solo las moléculas con carga positiva (amonio cuaternario) son capaces de interaccionar con el receptor, 4-AP seria mas potente para activar el receptor muscarínico que 3-AP. En la Figura 25 C y 25 D se muestran trazos de corriente en la presencia de 3-AP 1 y 10 mM respectivamente. La 3-AP activa la corriente muy semejante que la 4-AP, solo que es una orden de magnitud menos potente. Las curvas corriente-voltaje tanto de 4-AP como de 3-AP se muestran en la Figura 25 E, mostrando que la activación de la corriente es voltaje-dependiente. Corrientes activadas por el trimetil(p-aminofenil)amonio en miocitos auriculares de gato. El trimetil(p-aminofenil)amonio, como su nombre lo indica es un benceno al cual están unidos una amina y un grupo amonio en posición para (Figura 1). La característica por la cual fue escogida esta molécula para estudiarla es que el grupo amonio cuaternario predice que podría interaccionar con el receptor muscarínico. En la Figura 26 se muestran trazos de corriente en condiciones control (Figura 26 A), en la presencia de 0.3 µM (Figura 26 B) y 3 µM (Figura 26 C) de trimetil(p-aminofenil)amonio. El trimetil(p-aminofenil)amonio activa una corriente con características similares a un rectificador tardío. La corriente es activada durante el pulso, dependiente tanto de tiempo como de voltaje. La activación de la corriente es dependiente de la concentración de trimetil(p-aminofenil)amonio siendo el curso temporal de la activación mas rápido a la concentración mas alta. Las corrientes de cola se registraron a -120 mV, pudiendo observarse un aumento inicial rápido en la corriente seguido de una disminución de la misma dependiente de tiempo. Las corrientes de cola son mayores conforme el pulso previo es mas positivo a los 62 • < B 10 pA/pF A 1 s C ♦ D I (pA/pF) 24 20 Control Trimetil(p-aminofenil) 16 12 -amonio 30 µM Trimetil(p-aminofenil) -amonio 300 µM 8 4 0 -120 -80 -40 0 -4 40 80 Vm (mV) Figura 26. Efecto del trimetil(p-aminofenil)amonio sobre miocitos auriculares de gato. Trazos de corriente en condiciones control (A), en la presencia de 0.3 µM (B) y en la presencia de 3 µM (C) de trimetil(p-aminofenil)amonio aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -100 hasta +60 mV, regresando a -120 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso para condiciones control (•), en la presencia de 0.3 µM (n) y 3 µM (♦) de trimetil(paminofenil)amonio (n=5). Cada punto representa la media ± ES. valores del potencial de membrana explorados. En la Figura 26 D se muestran las curvas corriente-voltaje correspondientes. Estos resultados nos muestran claramente que diferentes compuestos que poseen un amonio cuaternario son capaces de activar esta corriente voltaje -dependiente. Efectos del ácido p-aminobenzoico y del ácido sulfanílico en miocitos auriculares de gato. La estructura del Ac. p-aminobenzoico (PABA), es como su nombre lo indica una amina en posición para unida a un ác. benzoico (Figura 1). En 63 < B • 5 pA/pF A 1 s C ♦ D I (pA/pF) 12 8 Control PABA 1 mM 4 PABA 3 mM 0 -120 -80 -40 0 -4 40 80 Vm (mV) Figura 27. Efecto de PABA sobre miocitos auriculares de gato. Trazos de corriente en condiciones control (A), en la presencia de 1 mM (B) y en la presencia de 3 mM (C) de PABA aplicando pulsos de 2 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. D, relación corriente -voltaje de las corrientes medidas al final del pulso para condiciones control (•), en la presencia de 1 mM (n) y 3 mM (♦) de PABA (n=4). Cada punto representa la media ± ES. la Figura 27 se muestran trazos de corriente en condiciones control (Figura 27 A), en la presencia de 1 mM (Figura 27 B) y 3 mM de PABA (Figura 27 C). En la Figura 27 D se muestran las curvas corriente-voltaje correspondientes. El PABA no es capaz de activar la corriente a ninguna de las concentraciones probadas. El ác. sulfanílico en su estructura tiene un grupo amino unido en la posición para a un ác. benzensulfónico. En la Figura 28 se muestran trazos de corriente en condiciones control (Figura 28 A), en la presencia de 1 mM (Figura 28 B) y 3 mM (Figura 28 C) de ác. sulfanílico. Las curvas corriente-voltaje respectivas se muestran en la Figura 28 64 • B < 5 pA/pF A 1 s D C I (pA/pF) 16 12 Control Ac. sulfanílico 1 mM Ac. sulfanílico 3 mM 8 4 0 -120 -80 -40 0 -4 40 80 Vm (mV) Figura 28. Efecto del ác. Sulfanílico sobre miocitos auriculares de gato. Trazos de corriente en condiciones control (A), en la presencia de 1 mM (B) y en la presencia de 3 mM (C) de ác. sulfanílico aplicando pulsos de 2 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. D, relación corriente-voltaje de las corrientes medidas al final del pulso para condiciones control (•), en la presencia de 1 mM (n) y 3 mM ( ) de ác. sulfanílico (n=4). Cada punto representa la media ± ES. D. El ác. sulfanílico no activa la corriente a ninguna concentración probada. Los ácidos p-aminobenzoico y sulfanílico aun cuando tienen el grupo amino en su estructura, la presencia en la molécula de los grupos benzoico y benzensulfónico, respectivamente hacen que por el PKa del grupo amino, a un pH de 7.4, éste se encuentre en su forma neutra, la cual de acuerdo a nuestra hipótesis no interaccionaría con el grupo aniónico del receptor. 65 A B < 10 pA/pA • 1 s C I (pA/pF) 20 15 Metacolina 1 µM 10 Metacolina 3 µM 5 0 -120 -80 -40 0 -5 40 80 Vm (mV) -10 -15 -20 Figura 29. Corriente activada (restas digitales) por metacolina en miocitos auriculares de gato. A, trazos de corriente activada por 1 µM de metacolina aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. B, corriente activada por 3 µM de metacoli na. C, relación corriente-voltaje de las corrientes medidas al final del pulso para 1 µM (•) y 3 µM (<) de metacolina (n=6). Cada punto representa la media ± ES. Corrientes activadas por metacolina en miocitos auriculares de gato. La metacolina es un agente colinérgico que mimetiza a la ACh. La estructura de la metacolina es muy semejante a la ACh, a excepción que posee un grupo metilo unido al carbono en la posición tres. En la Figura 29 A y 29 B se muestran trazos de corriente (resta digital) activada por 1 y 3 µM de metacolina respectivamente, en miocitos auriculares de gato. La corriente activada por la metacolina tiene características similares a la activada por la ACh. La metacolina induce una corriente de fondo que presenta rectificación entrante (Figura 29 C). 66 A potenciales negativos al potencial de equilibrio del potasio (E K), se observa un incremento dependiente de tiempo en la corriente entrante. Cuando el potencial de membrana se regresa a -40 mV, se observa una disminución dependiente de tiempo en la corriente saliente. Los pulsos despolarizantes inducen una corriente saliente instantánea que exhibe marcada rectificación entrante. En la Figura 29 C se muestran curvas corriente-voltaje de la corriente activada por metacolina. La activación de la corriente es concentración-dependiente, mientras mas alta la concentración de metacolina, mas corriente activada. Estos resultados sugieren que la metacolina activa la corriente IK-ACh de igual manera que la ACh. Corrientes de potasio activadas por betanecol en miocitos auriculares de gato. Existe otro compuesto que presenta similitudes estructurales con ACh y metacolina, el cual posee una amina terminal en lugar de un metilo, llamado betanecol (Figura 1) el cual es un agonista muscarínico. En la Figura 30 se muestran trazos de corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. En la Figura 30 A se presentan los trazos de corriente activada por 3 µM de betanecol y en la Figura 30 B por 10 µM de betanecol. El betanecol activa la corriente de dos diferentes maneras. Cuando se aplican pulsos hiperpolarizantes desde un potencial de mantenimiento de -40 mV, el betanecol activa la corriente muy semejante a la activada por ACh (Figura 30 Ab y 30 Bb). El betanecol activa una corriente de fondo que presenta un aumento de las corrientes entrantes con dependencia de tiempo y una rectificación de las corrientes salientes a potenciales mas negativos que -40 mV. Cuando el potencial de membrana se regresa a -40 mV después de aplicar los pulsos previos a diferentes potenciales de membrana, se observa una disminución rápida dependiente de tiempo en la corriente saliente. Los pulsos despolarizantes inducen una corriente saliente instantánea que exhibe rectificación entrante y un aumento en la corriente, el cual es tiempo y voltaje dependiente. El curso temporal de este aumento dependiente de tiempo de la corriente es mas rápido conforme la concentración es mayor (Figura 30 Aa y 30 Ba). Al regresar al potencial de -40 mV después de aplicar los pulsos despolarizantes, las corrientes de cola, 67 • < B a 6 pA/pF A a 1 s b b C Betanecol I (pA/pF) 15 3 µM 10 Betanecol 10 µM 5 0 -120 -80 -40 0 -5 40 80 Vm (mV) Figura 30. Corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. Trazos de corriente activada por 3 µM (A) y por 10 µM (B) de betanecol aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta -50 (Ab y Bb) y desde -30 hasta +70 mV (Aa y Ba), regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para 3 µM (•) y 10 µM (<) de betanecol (n=6). Cada punto representa la media ± ES. muestran un incremento inicial seguido por una disminución dependiente de tiempo. Las corrientes de cola son mas grandes conforme el potencial del pulso previo es mas positivo. En la Figura 30 C se muestran las curvas corriente-voltaje de la corriente activada por betanecol a 3 y 10 µM. La activación de la corriente por betanecol, como se puede observar es concentración dependiente, a mayor concentración de betanecol mayor corriente activada. Hasta aquí los resultados de probar 10 diferentes compuestos (algunos agonistas muscarínicos), de los cuales 8 de ellos activan la corriente que nosotros suponemos es IK-ACh . Dos de ellos (ACh y metacolina) la activan sin dependencia de 68 tiempo y voltaje y con una alta afinidad, a concentraciones en el rango micromolar, cinco (colina, TMA, 4-AP, 3-AP y trimetil(p-aminofenil)amonio) la activan con dependencia de tiempo y voltaje pero con una baja afinidad (concentraciones en el rango milimolar), y uno, betanecol, la activa de las dos diferentes maneras. Estos resultados nos sugieren que la interacción de un amonio cuaternario es indispensable para activar IK-ACh con dependencia de tiempo y voltaje; pero si además la molécula contiene un grupo éster el cual interacciona con otros grupos del receptor, la activación de la corriente es independiente de tiempo y voltaje y la afinidad aumenta significativamente. Efecto de la tertiapina sobre la corriente activada por betanecol en miocitos auriculares de gato. Como ya se describió previamente, la corriente activada por betanecol muestra características de una corriente rectificadora entrante cuando se aplican pulsos hiperpolarizantes, desde el potencial de mantenimiento de -40 mV, y características de un rectificador tardío cuando se aplican pulsos despolarizantes. Una posibilidad para explicar este hallazgo es el de que betanecol podría estar activando dos corrientes diferentes, un rectificador entrante y un rectificador tardío. Como ya se comentó anteriormente, tertiapina bloquea selectivamente corrientes rectificadoras entrantes de potasio, en tejidos cardiacos, mas específicamente IK-ACh , sin afectar corrientes dependientes de voltaje como corrientes transitorias de salida o de rectificación tardía. Por lo tanto es una buena herramienta farmacológica para determinar si la corriente activada por betanecol consta de dos corrientes de potasio diferentes o se debe a la activación de IK-ACh . En la Figura 31 se muestran los registros obtenidos en condiciones control (Figura 31 A), en presencia de betanecol 3 mM (Figura 31 B), al agregar tertiapina 200 nM en la continua presencia de betanecol (Figura 31 C), y la lavar la tertiapina, en presencia del betanecol (Figura 31 D). Como se puede observar betanecol activó la corriente con la cinética ya previamente descrita, tertiapina bloquea casi en su totalidad tanto las corrientes entrantes como las corrientes salientes, y el efecto es parcialmente reversible. Estos resultados sugieren que la corriente activada por 69 A • B < E C D Control I (pA/pF) Betanecol 10 µM Betanecol 10 µM + Tertiapina 200 nM Betanecol 10 µM (Después lavado Terti.) ♦ 8 6 4 2 0 -120 -80 -40 0 -2 40 Vm (mV) -4 -6 Figura 31. Efecto del bloqueador selectivo de IK-ACh , tertiapina, sobre corrientes activadas por betanecol. Los trazos de corriente en condiciones control (A), en la presencia de 10 µM de betanecol (B), de 10 µM de betanecol + 200 nM de tertiapina (C) y el lavado de tertiapina con betanecol 10 µM (D), se registraron aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV, regresando a -40 mV. E, relación corriente-voltaje de las corrientes medidas al final del pulso, en condiciones control (•), en la presencia de 10 µM de betanecol (<), 10 µM de betanecol + 200 nM de tertiapina ( ) y betanecol 10µM después del lavado de teriapina ( ) (n=4). Cada punto representa la media ± ES. betanecol tanto para potenciales positivos como negativos es IK-ACh . Una posibilidad poco probable, pero que no se puede descartar por completo con estos experimentos es que la corriente activada por betanecol sea una corriente rectificadora tardía sensible a tertiapina. 70 Interacción de antagonistas específicos de receptores M2 , M3, y M4 con betanecol en miocitos auriculares de gato. La interacción de los relativamente específicos antagonistas methoctramina, p-F-HHSiD y tropicamida con el agonista muscarínico betanecol fueron las últimas combinaciones que se estudiaron. La cinética de la corriente activada por betanecol muestra características que parecen ser intermedias entre las activadas por ACh y colina. Ya que se ha planteado la posibilidad de que ACh estuviera activando la corriente rectificadora entrante, IK-ACh < B • 10 pA/pF A 1 s C I (pA/pF) 40 30 Betanecol 3 µM Betanecol 3 µM + 20 Methoctramina 30 nM 10 0 -120 -80 -40 0 -10 Figura 32. 40 80 Vm (mV) Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. A, Trazos de corriente activada por 3 µM de betanecol. B, corriente activada por 3 µM de betanecol en la presencia de 30 nM de methoctramina. Se aplicaron pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente-voltaje de las corrientes medidas al final del pulso para betanecol (<) y betanecol mas methoctramina (•) (n=5). Cada punto representa la media ± ES. 71 < B • 15 pA/pF A 1 s C I (pA/pF) 40 Betanecol 3 µM 30 Betanecol 3 µM + 20 Methoctramina 100 nM 10 0 -120 -80 -40 0 -10 40 80 Vm (mV) -20 Figura 33. Efecto de la methoctramina, antagonista M2 muscarínico, sobre la corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. A, Trazos de corriente activada por 3 µM de betanecol. B, corriente activada por 3 µM de betanecol en la presencia de 100 nM de methoctramina. Las corrientes se registraron aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente-voltaje de las corrientes medidas al final del pulso para betanecol (<) y betanecol mas methoctramina (•) (n=5). Cada punto representa la media ± ES. mediante receptores M2 y otros agonistas muscarínicos como TMA, colina y 4-AP estuvieran activando un rectificador tardío mediante otros receptores muscarínicos M3 o M4 (Shi et al., 1999), betanecol podría ser un agonista que estuviera activando simultáneamente IK-ACh mediante receptores M2 y un rectificador tardío mediante receptores M3 o M4 . En la Figura 32 A se presenta la corriente activada por 3 µM de betanecol (restas digitales). La cual muestra las características ya descritas previamente, a 72 potenciales negativos al potencial de mantenimiento de -40 mV, la corriente activada presenta características típicas de un rectificador entrante, sin embargo, para potenciales positivos a -40 mV, betanecol activa una corriente con características de un rectificador tardío. En la Figura 32 B se presentan trazos de la corriente activada por 3 µM de betanecol en la presencia de 30 nM de methoctramina. En la Figura 32 C se presentan las curvas corriente-voltaje correspondientes. La methoctramina disminuyó la corriente de fondo (corriente entrante) activada por betanecol a todos los potenciales estudiados. Sin embargo, también disminuyó la corriente dependiente de tiempo activada durante los pulsos a potenciales positivos a -40 mV, siendo éstas diferencias significativas. La corriente activada por 3 µM de betanecol en otra célula se presenta en la Figura 33 A, y en la Figura 33 B se muestra la corriente activada por 3 µM de betanecol en la presencia de una concentración mayor de methoctramina, 100 nM. Las curvas corriente -voltaje se presentan en la Figura 33 C. El betanecol en presencia de la methoctramina a esta concentración solo logró activar una pequeña corriente dependiente de tiempo a potenciales positivos a +30 mV. Es claro al observar los registros, que el efecto bloqueador de methoctramina de la corriente activada por betanecol, presenta una dependencia de voltaje similar al bloqueo de la corriente activada por colina por el antogonista inespecífico de receptores muscarínicos atropina, como por el bloqueador específico de receptores muscarínicos M2, methoctramina. En la Figura 34 A se muestra la corriente activada por 3 µM de betanecol en una célula diferente. En la Figura 34 B se muestran los trazos de corriente activada por 3 µM de betanecol en la presencia de 30 nM del antagonista de receptores M3, p-F-HHSiD. En la Figura 34 C se muestran las curvas corriente -voltaje correspondientes. El p-F-HHSiD produce una discreta disminución de las corrientes entrantes y salientes inducidas por el betanecol. El efecto bloqueador del p-F-HHSiD de la corriente activada por betanecol es claramente voltaje-independiente. La corriente activada por 3 µM de betanecol, la cual presenta las características ya antes descritas se muestra en la Figura 35 A. La corriente activada por 3 µM de betanecol en la presencia de 200 nM de tropicamida se 73 < B 20 pA/pF A • 1 s C I (pA/pF) Betanecol 3 µM 30 20 Betanecol 3 µM + 10 p-F-HHSiD 30 nM 0 -120 -80 -40 0 -10 40 80 Vm (mV) -20 -30 Figura 34. Efecto del p-F-HHSiD, antagonista M3 muscarínico, sobre la corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. A, Trazos de corriente activada por 3 µM de betanecol. B, corriente activada por 3 µM de betanecol en la presencia de 30 nM de p-F-HHSiD. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de 40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para betanecol (<) y betanecol mas p-F-HHSiD (•) (n=5). Cada punto representa la media ± ES. muestra en la Figura 35 B. En la Figura 35 C se presentan las curvas corrientevoltaje correspondientes. La corriente activada por betanecol es disminuida por tropicamida a todos los potenciales probados, siendo estas diferencias significativas. La corriente de fondo prácticamente es bloqueada por completo. A potenciales positivos a -40 mV, la corriente activada durante el pulso es disminuida y enlentecida en la presencia de tropicamida. Como se puede observar el antagonismo inducido por el agonista “específico” de receptores M4 tropicamida, 74 < B • 10 pA/pF A 1 s C I (pA/pF) Betanecol 3 µM 30 20 Betanecol 3 µM + Tropicamida 200 nM 10 0 -120 -80 -40 0 -10 40 80 Vm (mV) Figura 35. Efecto de la tropicamida, antagonista M4 muscarínico, sobre la corriente activada (restas digitales) por betanecol en miocitos auriculares de gato. A, Trazos de corriente activada por 3 µM de betanecol. B, corriente activada por 3 µM de betanecol en la presencia de 200 nM de tropicamida. Aplicando pulsos de 3 segundos de duración a partir de un potencial de mantenimiento de -40 mV, desde -110 hasta +70 mV , regresando a -40 mV. C, relación corriente -voltaje de las corrientes medidas al final del pulso para betanecol (<) y betanecol mas tropicamida (•) (n=5). Cada punto representa la media ± ES. es muy similar al antagonismo inducido por el antagonista “específico” de receptores M2, methoctramina, esto es voltaje -dependiente. 75 DISCUSIÓN En experimentos realizados en nuestro laboratorio se encontró que en miocitos auriculares de gato, la 4-AP y la colina inducen una corriente de potasio tiempo- y voltaje-dependiente mediante la estimulación de receptores muscarínicos (Navarro-Polanco, 1997; Navarro-Polanco y Sánchez-Chapula, 1997; Fermini y Nattel, 1994). Fermini y Nattel (1994), describieron en miocitos auriculares de perro una corriente de potasio dependiente de tiempo con características de un rectificador tardío activada por colina. Ellos sugirieron que esta supuesta corriente rectificadora tardía era activada probablemente por un receptor no determinado. Posteriormente Shi et al. (1999) describieron que en esta misma preparación de miocitos auriculares de perro, 4-AP activaba otra corriente de rectificación tardía a través de receptores muscarínicos M3, y que tetrametilamonio (TMA) activaba otra corriente rectificadora tardía diferente, pero a través de receptores M4. En trabajos previos (Navarro-Polanco y Sánchez-Chapula, 1997; Navarro Polanco, 1997) de nuestro laboratorio, se ha caracterizado cinéticamente la corriente activada por 4-AP, y se ha encontrado que la cinética de activación e inactivación de la corriente no corresponden a la de una corriente de rectificación tardía. El curso temporal de la activación es no solamente voltaje-dependiente, sino también dependiente de la concentración de 4-AP, siendo mas rápida la activación, cuanto mayor es la concentración del agonista. Además, se ha encontrado que el decaimiento de la corriente de cola (supuesta desactivación de la corriente) es voltaje -independiente. Estas características cinéticas de la corriente activada por 4AP abren serias dudas de que el canal activado por 4-AP sea un rectificador tardío “verdadero”. Por otro lado, en experimentos registrando canal unitario, se encontró que la conductancia y el tiempo medio de apertura de los canales activados por 4-AP son similares a los canales activados por ACh, en la misma preparación. En el presente trabajo hemos caracterizado cinéticamente la corriente activada por colina. Al igual que la corriente activada por 4-AP, el curso temporal de la activación además de ser dependiente del voltaje, es dependiente de la concentración de colina. Además, la desactivación de la corriente es independiente 76 del voltaje. Los bloqueadores de IKr e IKs , dofetilida e indapamida respectivamente, no afectan la corriente activada por colina semejante a un rectificador tardío, sugiriendo que ninguna de esas corrientes estan involucradas. Hemos sugerido que la colina puede estar activando IK-ACh de una manera dependiente de tiempo y voltaje, esto es, la despolarización incrementa la activación de la corriente. Uno de los argumentos que surgen en contra de la posibilidad de que ACh y colina estuvieran activando el mismo canal, es la diferente morfología que presentan ambas corrientes cuando se aplican pulsos hiperpolarizantes y despolarizantes, desde un potencial de mantenimiento de -40 mV (Navarro-Polanco y Sánchez-Chapula, 1997; NavarroPolanco, 1997). Sin embargo, cuando los canales son activados primeramente por un pulso despolarizante a +50 mV, seguido por un corto pulso hiperpolarizante a -120 mV, las corrientes salientes activadas por ACh y colina durante la subsecuente despolarización tienen cursos temporales similares, sugiriendo que ACh y colina podrían estar activando la misma corriente. La corriente IK-ACh ha sido demostrada de ser activada por adenosina, a través de la estimulación del receptor purinérgico A1. El mecanismo de activación del canal es el mismo que el sugerido para la activación del canal por ACh. La ocupación del receptor por el agonista activa una proteína GK, y el dímero formado por las subunidades βγ a su vez activa el canal (Logothetis et al., 1987; Clapham y Neer, 1993; Wickman et al., 1994). En la presente tesis estudiamos la interacción de adenosina y colina. El razonamiento de nuestro experimento fue de que si adenosina a una concentración máxima, a través de los receptores A1 activa IK-ACh, una corriente rectificadora entrante, en una forma voltaje-independiente y si colina activa a través de un receptor diferente (muscarínico) un canal diferente (un rectificador tardío), la administración de los dos fármacos juntos, induciría la suma de las dos corrientes. Por otro lado, si adenosina a una concentración máxima activa IK-ACh en una forma voltaje independiente y colina a una concentración sub-máxima activa la misma corriente, en forma voltaje-dependiente, la aplicación de los dos fármacos al mismo tiempo, produciría la competencia de los mismos por el mismo efector. Si la adenosina es aplicada a una concentración máxima y colina a una concentración sub-máxima, la morfología de la corriente registrada sería mas la de un rectificador 77 entrante. Los resultados obtenidos sugieren fuertemente que la segunda opción es la correcta, es decir, ambos agonistas están compitiendo por el mismo efector. Otra posible explicación de que los efectos de adenosina sean mas marcados que los de colina, es que el acople entre el receptor muscarínico y la proteína Gi/o , es menos eficiente cuando el receptor es activado por colina. Entonces, cuando se aplican la adenosina y la colina juntas, la adenosina podría activar un mayor número de proteínas Gi/o, utilizando la mayoría de subunidades βγ y por lo tanto la relación de corriente activada por colina es menor con respecto a la corriente activada por adenosina. Una evidencia adicional que sugiere que colina, betanecol y ACh podrían estar activando IK-ACh es que la toxina tertiapina, bloquea tanto la corriente con características de rectificador entrante activada por ACh, IK-ACh , como la corriente con características de rectificador tardío, activada por colina, TMA o betanecol, y que nosotros sugerimos es IK-ACh , activada de una forma voltaje dependiente. Tertiapina es un péptido de 21 residuos obtenido del veneno de la abeja, se ha demostrado que ésta toxina bloquea selectivamente IK-ACh en miocitos auriculares de conejo, sin afectar otros canales de potasio como el rectificador entrante, IK1, el canal modulado por ATP, IK-ATP, los rectificadores tardíos IKr e IKs , y el canal que acarrea la corriente transitoria de salida, Ito (Kitamura et al., 2000; Drici et al., 2000). Los resultados obtenidos al estudiar el efecto de colina en miocitos auriculares de las especies mas frecuentemente utilizadas en el laboratorio para experimentos de electrofisiología cardiaca, nos permiten concluir que la corriente activada por el agonista muscarínico colina, posee características similares voltaje- y tiempodependientes en todas ellas. Las diferencias en la activación de la corriente por colina en las diferentes especies se deben probablemente a que en cada una de ellas existe diferente densidad, tanto de receptores como de canales. Nuestro razonamiento en estos experimentos fue probar si el efecto activador voltajedependiente de la colina se presentaba solo en miocitos auriculares de gato o era un fenómeno mas generalizado que se presentaba en las diferentes especies de mamífero. Además, se sabe que existe una gran variedad de canales dependientes de voltaje en las diferentes especies, sin embargo, el canal IK-ACh se encuentra 78 presente en todos los mamíferos. Las densidades de corriente para IK-ACh que encontramos en experimentos realizados en el laboratorio y resultados publicados (Horie e Irisawa, 1987; Koumi et al., 1995) fueron en este orden: conejo < rata < cobayo < gato. Mientras que las densidades para la corriente activada por colina que encontramos a +40 mV en pA/pF son: conejo 4.38, perro 5.96, rata 11.3, ratón 12.1, cobayo 22.23 y gato 27.33. Como se puede observar el orden de las densidades de corriente activada tanto por ACh como por colina, en diferentes especies siguen un orden similar, para algunas especies no encontramos en la literatura datos obtenidos bajo condiciones experimentales similares a las nuestras. Así, nuestros resultados podrían sugerir indirectamente que la corriente que esta siendo activada por colina es IK-ACh . Por otra parte, las τ (ms) de desactivación encontradas en las diferentes especies para la corriente activada por colina a –100 mV son: perro 579.48, gato 620 y ratón 907.56; y a –40 mV son: perro 571.12, conejo 483.33, cobayo 545.49, rata 391.08, gato 580 y ratón 890.92. Como se puede notar a l desactivación de la corriente es independiente de voltaje y encontramos que también es independiente de la concentración en las diferentes especies estudiadas. Los valores de las τ de desactivación en las diferentes especies son muy semejantes entre ellas, a diferencia solo con el ratón que la desactivación es mas lenta e incluso no llega a desactivarse completamente en 3 s. Sin embargo, estas diferencias en las τ de desactivación es algo muy interesante que podría ser estudiado en futuros proyectos de investigación, por lo pronto con los resultados obtenidos en este trabajo no podemos sugerir cual sea la causa. Durante mucho tiempo se ha sostenido que el receptor muscarínico M2 es el único subtipo funcional de mAChR que se encuentra en el corazón de mamíferos (Bonner et al., 1987) y contribuye a la regulación de la frecuencia cardiaca y a la forma del potencial de acción. Sin embargo, algunos estudios han mostrado la expresión de otros subtipos de mAChR en tejidos cardiacos. Por ejemplo, se ha mostrado que los mRNAs que codifican para M2, M3 y M4 son expresadas en el corazón de pollo (McKinnon y Nathanson, 1995). Mas recientemente, Shi et al. (1999) han sugerido que 4-AP activa un corriente de rectificación tardía a través de receptores M4 y que TMA y colina activan otro rectificador tardío a través de 79 receptores M3 . En gran medida estas conclusiones de Shi et al. (1999) han estado basadas en el supuesto de que los antagonistas de los diferentes subtipos de receptores utilizados son específicos. En la presente tesis presentamos evidencias de que en la preparación que hemos utilizado, miocitos auriculares de gato, la supuesta especificidad de éstos antagonistas no lo es. Los tres antagonistas, methoctramina, p-F-HHSiD y tropicamida, bloquean la corriente rectificadora entrante activada por ACh, IK-ACh . Abundantes evidencias experimentales han demostrado claramente que la activación de esta corriente es mediada por receptores M2 (Koumi S-i. et al., 1995; Kurachi, 1995). Además, en la presente tesis hemos mostrado evidencias de que los tres antagonistas también bloquean las corrientes activadas por colina y betanecol. En el caso de la colina, encontramos que el antagonismo de la corriente por la methoctramina, la tropicamida y el p-F-HHSiD, es similar. Cuando el betanecol fue el agonista se observa un antagonismo mas marcado cuando el antagonista es el bloqueador de receptores muscarínicos M4. Un experimento a realizar sería el utilizar antagonistas mucho mas específicos para los diferentes receptores, como la MT-3 (toxina mamba tipo 3), un antagonista que ha sido encontrado altamente específico para los receptores M4 , con una EC50 de 5 nM (D’Agostino et al., 2000). La falta de especificidad mostrada por los antagonistas supuestamente específicos de los subtipos de receptores M2, M3 y M4 no nos permiten responder a la pregunta de si colina, betanecol y otros agonistas muscarínicos que activan corrientes de potasio que presentan dependencia de voltaje lo hacen a través de receptores M2 y/u otro subtipo de receptor. Los receptores muscarínicos están acoplados a proteínas G. En el caso de los receptores M2 , activan a una proteína Gi/o que activa al canal KACh, de una manera delimitada a la membrana (Kurachi, 1995). Los receptores M2 y M4 activan a la proteína Gi/o (sensible a PTX), que también inhibe a la adenilato ciclasa, disminuyendo el AMPc y la activación de PKA (Picatoste, Sarri y Claro, 1996a). Se ha reportado que los receptores M3 están acoplados a proteínas Gq/11 (no sensibles a PTX) (Wess, 1993) que a su vez activa una fosfolipasa C, PLC, que promue ve la hidrólisis del fosfatidilinositol 4,5 difosfato, en diacilglicerol (DAG) y en inositol(1,4,5)trifosfato (InsP3), los cuales modulan diversas isoenzimas de la familia 80 de las PKC y son responsables de la movilización del Ca++ i (Picatoste, Sarri y Claro, 1996b). Al parecer, por lo anterior, el canal KACh podría estar siendo modulado a través de los receptores muscarínicos M2 (de una manera delimitada a la membrana), ya que otros tipos de receptores muscarínicos, M3 y M4 , activan cascadas de segundos mensajeros diferentes que son responsables de la movilización del calcio intracelular y, de la inhibición o activación de corrientes de calcio. Por otra parte, Heath y Terrar en el 2000, reportaron que la activación de PKA por isoprenalina o forskolin, fosforila los canales de Ca++ tipo L, conduciendo a un incremento en la concentración de Ca++i . Este incremento de Ca++ puede entonces conducir a la activación de PKC sensible a Ca++ , aun sin la producción de derivados de fosfolípidos tal como el DAG, causando un incremento en el componente del rectificador tardío IKr , en células cardiacas de cobayo (Heath y Terrar, 2000). Por lo anterior, la activación de proteínas Gi/o inducida por agonistas muscarínicos, a través de los receptores M2 y M4, inhibirían la activación de la PKA, por lo que la PKC, no incrementaría un rectificador tardío por ésta vía. Además, Meyer et al. en el 2001, encontraron que los receptores muscarínicos M3, no están presentes en miocitos aislados, pero sí se encuentran en la suspensión de células producto de la dispersión de aurícula de rata. Lo que pone en evidencia que, lo reportado por Shi y col. (1999), pudiera ser un artefacto de los M3AChR que se encuentran en células endoteliales y vasos, presentes en la aurícula completa. Otra evidencia que obtuvimos es que la proteína G que está involucrada en la activación de la corriente por colina es sensible a PTX, indicándonos que esta proteína G es del tipo Gi/o . Lo anterior nos sugiere que los receptores muscarínicos que pueden estar involucrados en la activación de la corriente por colina son el M2 y el M4. Los receptores muscarínicos pueden activar varias proteínas G (Gi2 , Gi3 y Go) con subunidades α sensibles a PTX, las cuales están involucradas en el señalamiento para la activación de canales de K+ en el corazón (Sowell et al. 1997). Estos autores también demostraron que la activación de IK-ACh requiere la expresión de dos proteínas G, Gi2 y Gi3, y que en su ausencia otras proteínas G no son capaces de sustituirlas en la activación de IK-ACh. Mostraron que la expresión de dos subunidades α, α i2 y α i3, son requeridas para la activación normal por agonistas de 81 IK-ACh . Lei et al. (2000) reportaron que de las cinco subunidades β que hasta la fecha se han identificado por biología molecular, se ha reportado que β 1, β 2, β3 y β 4 se unen con múltiples subunidades γ, especialmente β 3 y β4 con subunidades γ2 y γ11, para activar los canales Kir3 (familia a la que pertenecen las subunidades que forman IK-ACh ). Los dímeros βγ que contienen β 5 se asocian preferentemente a α q, activando la PLC-β, resultando en la movilización del Ca++i . También reportaron que los dímeros que contienen β 5 inhiben los canales Kir3, y sugieren que éstos dímeros podrían estar actuando como antagonistas competitivos de otros dímeros βγ . Dadas las diferentes vías divergentes que se pueden activar no podemos descartar inequívocamente que algunos agonistas muscarínicos pudieran estar activando además de IK-ACh un canal rectificador tardío. Sin embargo, las evidencias cinéticas y la dependencia de voltaje de la corriente activada por estos agonistas, no corresponden a los de un rectificador tardío. Además, evidencias farmacológicas como son el bloqueo que induce el bloqueador altamente específico de IK-ACh , tertiapina, sobre este supuesto rectificador tardío. La modulación por voltaje de la activación de IK-ACh por colina, TMA y 4-AP ha sido sugerida de depender de la interacción del agonista con el receptor (Navarro Polanco, 1997). Las evidencias que han permitido sugerirlo son que la interacción de 4-AP y colina con el antagonista de receptores muscarínicos atropina es modulado por el voltaje. A los potenciales mas negativos, el efecto antagónico es mayor, y conforme el potencial es menos negativo el efecto antagónico es revertido. Por otro lado, el efecto antagónico de atropina de la corriente activada por ACh es voltajeindependiente, lo cual nos sugiere que la interacción de atropina con el receptor M2 es voltaje-independiente. Todo lo anterior nos permite suponer que en la interacción atropina- colina o 4-AP, la afinidad del receptor por los agonistas colina o 4-AP es modulada por el voltaje, siendo mayor la afinidad a potenciales positivos. En el modelo original desarrollado para explicar la interacción de la ACh con el receptor muscarínico, se plantea la interacción del amonio cuaternario de la ACh con un grupo aniónico del receptor, y de interacciones de los oxígenos del grupo éster y del grupo carbonilo de la ACh con sitios catiónicos del receptor. Información reciente obtenida mediante estudios de biología molecular de los receptores muscarínicos, 82 han determinado la presencia de un Asp en el segmento transmembranal III, el cual es esencial para la interacción de los agonistas con el receptor y ha sido identificado como el probable sitio de unión del amonio cuaternario de los agonistas (Wess, 1993). Asimismo, se ha identificado en el receptor muscarínico varios residuos de Thr y Tyr, los cuales serían importantes en la formación de puentes de hidrógeno con la ACh (Wess, 1993). Nuestra hipótesis propone que la interacción entre el amonio cuaternario del agonista y el Asp del receptor son esenciales para la interacción, sin embargo, la interacción del resto de la molécula de ACh con las Thr y Tyr del receptor le proporciona a la interacción una mayor afinidad y una independencia del voltaje. En el caso de la colina, la cual no posee el grupo éster de la ACh, la interacción del agonista con el receptor depende esencialmente de la interacción del amonio cuaternario con el Asp del receptor, lo cual provocaría que la interacción sería de baja afinidad y voltaje-dependiente. Si nuestra hipótesis es correcta, una primera suposición sería que el compuesto TMA, el cual solamente consta del amonio cuaternario, unido a cuatro metilos, debería inducir un efecto similar al de la colina. Nuestros resultados y los de otros (Shi et al., 1999) demuestran que TMA activa una corriente voltaje-dependiente. Esta hipótesis también explicaría el efecto agonista de la 4-AP, la cual en su forma cargada interaccionaría con el grupo aniónico del receptor en una forma voltaje-dependiente. Esta evidencia se ve reforzada por los resultados con la 3-AP, la cual con PKa de 6.0 en contra de un PKa de 9.2 de la 4-AP, es menos potente que la 4-AP, lo cual podría ser explicado por el hecho que a un pH de 7.4, la relación droga cargada / droga es de 0.04 para 3-AP y 63.1 para 4-AP. Esta evidencia se ve aun mas reforzada por los experimentos con el trimetil(p-aminofenil)amonio, el cual consta de un amonio cuaternario unido a un p-amonifenil. Esta molécula se encuentra totalmente cargada a un pH de 7.4, y como nos muestran los resultados, activa la corriente de potasio en forma voltajedependiente y con una potencia aproximadamente diez veces mayor que la 4-AP. Los compuestos ácido p-aminobenzoico y ácido sulfanílico, aun cuando poseen el grupo amino en su estructura, éste es incapaz de interaccionar con el grupo aniónico del receptor por la presencia de los grupos benzoico y benzensulfónico, respectivamente. 83 La metacolina y el betanecol son agonistas muscarínicos que poseen tanto el amonio cuaternario como los oxígenos éster y carbonilo en su molécula, de tal manera que se esperaba que IK-ACh se activara con las características voltajeindependientes con que lo hace la ACh. La metacolina, posee una estructura similar a la ACh solo tiene un grupo metilo en la posición 3. La corriente activada por metacolina tiene características de un rectificador entrante, similar a la corriente activada por la ACh (Figura 29), es decir, el grupo metilo en la posición 3 no interfiere en la forma de activación de la corriente. La diferencia de las moléculas de metacolina y ACh con el betanecol es que esta última posee un grupo amino terminal. El betanecol activa IK-ACh de una manera tiempo- y voltaje-independiente cuando se aplican pulsos hiperpolarizantes a partir del potencial de mantenimiento de -40 mV. Mientras que aplicando pulsos despolarizantes al potencial de mantenimiento -40 mV, el betanecol activa KI -ACh tiempo- y voltaje-dependiente. Es decir, el betanecol puede activar la corriente en forma independiente y dependiente del voltaje. Los resultados hasta ahora obtenidos no nos permiten tener una explicación razonable para estos resultados. La diferencia observada en la activación de los diferentes agonistas muscarínicos o compuestos con cierta similitud estructural a colina o 4-AP, se deben a las diferentes relaciones del número de moléculas cargadas con las moléculas no cargadas, que al pH con el que se trabaja (7.4) se encuentran. Esto debido a que en cada compuesto el pK de los respectivos grupos aminos es diferente. Y como lo estamos proponiendo es necesario la presencia del amonio cuaternario (grupo amino cargado) para la activación del receptor. 84 CONCLUSIONES 1. La activación de una corriente de potasio dependiente de voltaje por 4-AP y colina en miocitos auriculares de gato no es una “rareza farmacológica” de esta especie, los experimentos realizados en diferentes especies de mamífero nos muestran que esta corriente es activada en todas ellas. 2. Hasta ahora dos hipótesis han sido planteadas para la identificación de esta corriente o corrientes. Shi et al. (1999) han sugerido que 4-AP induce una corriente rectificadora tardía a través de la activación de receptores muscarínicos M4. Mientras que TMA y colina activan otro rectificador tardío diferente a través de receptores muscarínicos M3. Nuestra propuesta es que 4-AP, colina, TMA, betanecol y otros agonistas muscarínicos activan la corriente KI -ACh en una forma vo ltaje-dependiente. Sin embargo, no podemos descartar completamente la activación de un canal rectificador tardío. 3. En el presente trabajo y en previos trabajos hemos presentado evidencias de que la o las corrientes activadas por estos agonistas muscarínicos no poseen características típicas de las corrientes rectificadoras tardías, el curso temporal de la activación es dependiente de la concentración del agonista, la desactivación de la corriente es voltaje -independiente. En trabajos previos utilizando registro de canal unitario hemos encontrado que el canal activado por 4-AP y colina tiene una conductancia y tiempo de apertura similar al de IK-ACh . 4. La participación de otros subtipos de receptores muscarínicos además del receptor M2 no es clara ya que los antagonistas supuestamente específicos para receptores M3 y M4 no lo son en esta preparación de miocitos auriculares de gato. 85 5. Hemos mostrado evidencias de que la modulación por voltaje de la activación de IK-ACh podría estar a nivel del receptor, y que cuando la interacción del agonista con el receptor únicamente involucra la interacción del grupo amonio cuaternario del agonista con el sitio aniónico del receptor, la interacción es voltaje -dependiente. 86 BIBLIOGRAFIA Abbot, G. W., Sesti, F., Splawski, I., Buck, M. E., Lehmann, M. H., Timothy, K. W., Keating, M. T. and Goldstein, S. A. N. (1999). MiRP1 forms IKr potassium channels with HERG and is associated with cardiac arrhythmia. Cell, 97, 175-187. Ammala, C., Moorhouse, A., Gribble, F., Ashfield, R., Proks, P., et al. (1996). Promiscuous coupling between the sulphonylurea receptor and inwardly rectifying potassium channels. Nature, 379, 545-548. Barry, D. M. and Nerbonne, J. M. (1996). Myocardial potassium cha nnels: Electrophysiological and molecular diversity. Annual Review of Physiology, 58, 363394. Belardinelli, L. and Isenberg, G. (1983). Isolated atrial myocytes: adenosine and acetylcholine increase potassium conductance. American Journal of Physiology, 244, H734-H737. Bond, C. T., Pessia, M., Xia, X. M., Lagrutta, A., Kavanaugh, M. P. and Adelman, J. P. (1994). Cloning and expression of a family of inward rectifier potassium channels. Recept. Channels , 2, 183-191. Bonner, T. I., (1989). The molecular basis of muscarinic receptor diversity. TINS, 12 (4), 148-151. Bonner, T. I., Buckley, N. J., Young, A. C. and Brann, M. R. (1987). Identification of a family of muscarinic acetylcholine receptor genes. Science (Wash DC), 237, 527532. Bünemann, M., Lee, K.B., Pals-Rylaarsdam, R., Roseberry, A.G. and Hosey, M.M. (1999). Desensitization of G-protein-coupled receptors in the cardiovascular system. Annual Review of Physiology, 61,169-192. Campbell, D. L., Rasmusson, R. L., Comer, M. B. and Strauss, H. C. (1995). The cardiac calcium-independent transient outward potassium current: Kinetics, molecular properties and role in ventricular repolarization. In: D. P. Zipes and J. Jalife (Eds). Cardiac Electrophysiology. From cell to bedside, (pp 83-96) (2ª Ed), Philadelphia: W. B. Saunders Company. 87 Clapham, D. E. and Neer, E. J. (1993). New roles for G-protein βγ-dimers in transmembrane signaling. Nature (London) , 365. 403-406. Corey, S. and Clapham, D. E. (2001). The stoichiometry of Gβγ binding to G-proteinregulated inwardly rectifying K+ channels (GIRKs). Journal of Biological Chemistry, Paper in Press. Published on January 8 as manuscript. D’Agostino, G., Bolognesi, M. L., Lucchelli, A., Vicine, D., Balestra, B., Spelta, V., Melchiori C. And Tonini, M. (2000). Prejuntional muscarinic inhibitory control of acetylcholine release in the human isolated detrusor: involvement of the M4 receptor subtype. British Journal of Pharmacology, 129, 493-500. DiFrancesco, D. (1986). Characterization of single pacemaker channels in cardiac sino-atrial node cells. Nature, 324, 470-473. DiFrancesco, D. and Tromba, C. (1988a). Inhibition of the hyperpolarizing-activated current, if, induced by acetylcholine in rabbit sino-atrial node myocytes. Journal of Physiology, 405, 477-491. DiFrancesco, D. and Tromba, C. (1988b). Muscarinic control of the hiperpolarizingactivated current fI in rabbit sino -atrial node myocytes. Journal of Physiology, 405, 493-510. Drici, M.D., Diochot, S., Terrenoire, C., Romey, G., Lazdunski, M. (2000). The bee venom peptide tertiapin underlines the role of I(KACh) un acetylcholine-induced atrioventricular blocks. British Journal of Pharmacology, 131, 569-577. Eglen, R. M., Hegde, S. and Watson, N. (1996). Muscarinic receptor subtypes and smooth muscle function. Pharmacological Reviews , 48, 531-565. Eglen, R. M. and Whiting, R. L. (1990). Heterogeneity of vascular muscarinic receptors. Journal of Autonomic Pharmacology, 10, 233-245. Fermini, B. and Nattel, S. (1994). Choline chloride activates time-dependent and time-independent K+ currents in dog atrial myocytes. American Journal of Physiology, 266, C42-C51. Ferrer, J., Nichols, C. G., Makhina, E. N., Salkoff, L., Bernstein, J. et al. (1995). Pancreatic islet cells express a family of inwardly rectifying K+ channel subunits which interact to form G-protein-activated channels. Journal of Biological Chemistry, 270, 2086-2091. 88 Findlay, I. (1987). ATP-sensitive channels in rat ventricular myocytes are blocked and inactivated by internal divalent cations. Plügers Archiv. European Journal of Physiology, 410, 313-320. Giles, W. and Noble, S.J. (1976). Changes in membrane currents in bullfrog atrium produced by acetylcholine. Journal of Physiology, 261, 103-123. Gintant, G. A., Cohen, J. S., Datyner, N. B. and Kline, R. P. (1992). Timedependent outward currents in the heart. In: H. A. Fozzard, E. Haber, R. B. Jennings, A. M. Katz and H. E. Morgan (Eds), The heart and cardiovascular system: Scientific Fundation (pp 637-669) (2ª Ed). New York: Raven Press. Goyal, R. K. (1989). Muscarinic receptor subtypes: Physiology and clinical implications. The New England Journal of Medicine, 321,1022-1028. Habuchi, Y., Nishio, M., Tanaka, H., Yamamoto, T., Lu, L-L. and Yoshimura, M. (1996). Regulation by acetylcholine of Ca2+ current in rabbit atrioventricular node cells. American Journal of Physiology, 271, H2274-H2282. Hamil, O. P., Marty, A., Neher, E., Sakman, B. and Sigworth, F. J. (1981). Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv, 391, 85-100. Heath, B. M. and Terrar, D. A. (2000). Protein kinase C enhances the rapidly activating delayed rectifier potassium current, IKr , through a reduction in C-type inactivation in guinea-pig ventricular myocytes. Journal of Physiology, 522, 391-402. Heginbotham, L., Abramson, T. and MacKinnon, R. (1992). A functional connection between the pores of distantly related ion channels as revealed by mutant K+ channels. Science, 258, 1152-1155. Hille, B. (1992). Ionic channels of excitable membranes. Sunderland, M.A.: Sinauer. Horie, M. and Irisawa, H. (1987). Rectification of muscarinic K+ current by magnesium ion in guinea pig atrial cells. American Journal of Physiology, 253, H210H214. Horie, M. and Irisawa, H. (1989). Dual effects of intracellular magnesium on muscarinic potassium channel current in single guinea pig atrial cells. Journal of physiology, 408, 313-332. 89 Horie, M., Irisawa, H. and Noma, A. (1987). Voltage-dependent magnesium block of adenosine-triphosphate -sensitive potassium channel in guinea pig ventricular cells. Journal of Physiology (London), 387, 251-272. Hulme, E. C., Birdsall, N. J. and Buckley, N. J. (1990). Muscarinic receptor subtypes. Annual Review of Pharmacology and Toxicology, 30,633-673. Iijima, T., Irisawa, H. and Kameyama, M. (1985). Membrane currents and their modification by acetylcholine in isolated single atrial cells of the guinea-pig. Journal of Physiology (London), 359, 485-501. Irisawa, H. and Hagiwara, N. (1991). Ionic current in sinoatrial node cells. Journal of Cardiovascular Electrophysiology, 2, 531-540. Isenberg, G. and Klöckner, U. (1982). Calcium tolerant ventricular myocytes prepared by pre-incubation in a KB-medium. Plügers Archiv, 395, 6-18. Ishihara, K. and Hiraoka, M. (1994). Gating mechanisms of the cloned inward rectifier potassium channel from mouse heart. Journal of Membrane Biology, 142, 5564. Ishihara, K., Mitsuiye, A., Noma, A. and Takano, M. (1989). The Mg+2 block and intrinsic gating underlying inward rectification of the K+ current in guinea-pig cardiac myocytes. Journal of Physiology, 419, 297-320. Jeck, D., Lindmar, R., Loffelholz, K. and Wanke, M. (1988). Subtypes of muscarinic receptor on cholinergic nerves and atrial cells of chicken and guinea-pigs hearts. British Journal of Pharmacology, 93, 357-366. Jin, W. and Lu, Z. (1998). A novel high-affinity inhibitor for inward-rectifier K+ channels. Biochemistry, 37, 13291-13299. Karschin. C., Schreibmayer, W., Dascal, N., Lester, H., Davidson, N. and Karschin, A. (1994). Distribution and localization of a G protein-coupled inwardly rectifying K + channel in the rat. FEBS letters, 348, 139-144. Kass, R. S. and Freeman, L. C. (1993). Potassium channels in the heart. Cellular, molecular and clinical implications. T.C.M., 3, 149-159. Katz, A. M. (1992). Physiology of the heart (2a ed). New York: Raven Press. 90 Kitamura, H., Yokoyama, M., Akita, H., Matsushita, K., Kurachi, Y. and Yamada, M. (2000). Tertiapin potently and selectively blocks muscarinic K+ channels in rabbit cardiac myocytes. Journal of Pharmacology and Experimental Therapeutics, 293.1, 196-205. Koumi, S-i., Sato, R. and Hayakawa, H. (1995). Characterization of the acetylcholine-sensitive muscarinic K+ channel in isolated feline atrial and ventricular myocytes. Journal of Membrane Biology, 145, 143-150. Krapivinsky, G., Gordon, E.A., Wickman, K., Velimirivic, B., Krapivinsky, L. and Clapham, D.E. (1995). The G-protein-gated atrial K+ channel IK-ACh is a heteromultimer of two inwardly rectifying K(+ )-channel proteins. Nature, 374,135-141. Kubo, Y., Reuveny, E., Slesinger, P. A., Jan, Y. N. and Jan, L. Y. (1993). Primary structure and functional expression of a rat G-protein coupled muscarinic potassium channel. Nature, 364, 802-806. Kurachi, Y. (1995). G protein regulation of cardiac muscarinic potassium channel. American Journal of Physiology, 269, C821-C830. Lei, Q., Jones, M. B., Talley, E. M., Schrier, A. D., Mclntire, W. E., Garrison, J. C. and Bayliss, D. A. (2000). Activation and inhibition of G protein-coupled inwardly rectifying potassium (Kir3) channels by G protein βγ subunits. PNAS, 97, 9771-9776. Litter, M. (1970). Agentes colinérgicos o parasimpaticomiméticos. En: Farmacología, experimental y clínica (pp 525-547) (4ª ed). Buenos Aires: El Ateneo. Logothetis, D. E., Kurachi, Y., Galper, J., Neer, E. J. and Clapham, D. E. (1987). The βγ subunits of GTP-binding proteins activate the muscarinic K+ channel in heart. Nature, 325, 321-326. Lopatin, A. N., Makhina, E.N. and Nichols, C.G. (1994). Potassium channel block by cytoplasmic polyamines as the mechanism of intrinsec rectification. Nature, 372, 366-369. Mac Leish, P. R., Shepherd, G. M., Kinnamon, S. C. and Santos-Sacchi, J. (1999). Sensory Transduction. In: M. J. Zigmond, F. E. Bloom, S. C. Landis, J. L. Roberts and L. R. Squire (Eds), Fundamental Neuroscience (pp 671-717). San Diego: Academic Press. 91 Matsuda, H. (1990). Voltage-dependent block of cardiac inwardly rectifying K+ channels by internal Mg+2. In: P. Strata (Ed), Mg+2 and excitable membranes, Eidelberg: Springer-Verlag. Matsuda, H. (1991). Magnesium gating of the inwardly rectifying K+ channel. Annual Review of Physiology, 53, 289-298. Matsuura, H., Ehara, T. and Imoto Y. (1987). An analysis of the delayed outward current in single ventricular cells of the guinea-pig. Plügers Archiv, 410, 596-603. McKinnon, L. A. and Nathanson, N. M. (1995). Tissue-specific regulation of muscarinic acetylcholine receptor expression during embryonic development. Journal of Biological Chemistry , 270, 20636-20642. McNicholas, C. M., Wang, W., Ho, K., Hebert, S.C. and Giebisch, G. (1994). Regulation of ROMK1 K+ channel activity involves phosphorilation processes. Proceedings of the National Academy of Sciences of the United States of America, 1, 8077-8081. Meves, H. and Pichon, Y. (1977). The effect of internal and external 4-aminopyridine on the potassium currents in intracellularly perfused squid giant axons. Journal of Physiology, 268, 511-532. Meyer, T., Wellner-Kienitz, M-C., Biewald, A., Bender, K., Eickel, A. and Pott, L. (2001). Depletion of phosphatidylinositol 4,5-biphosphate by activation of phospholipase C-coupled receptors causes slow inhibition but not desensitization of G protein-gated inward rectifier K+ current in atrial myocytes. The Journal of Biological Chemistry, 276, 5650-5658. Mizushima, A., Uchida, S., Zhou, X. M., Kagiya, T. and Yoshida, H. (1987). Cardiac M2 receptors consist of two different types, both regulated by GTP. European Journal of Pharmacology, 135, 403-409. Mutschler, E., Moser, U., Wess, J. and Lambrecht, G. (1995). Muscarinic receptor subtypes-pharmacological, molecular biological Pharmaceutica Acta Helvetiae, 69, 243-258. 92 and therapeutical aspects. Navarro-Polanco, R. A. (1997). Mecanismo de activación del canal de potasio activado por acetilcolina IK-ACh , por 4-AP y por ChCl en miocitos auriculares de gato. Modulación voltaje - y tiempo-dependiente. Tesis doctoral. Universidad de Colima, Facultad de Medicina, Centro Universitario de Investigaciones Biomédicas, Colima, México. Navarro-Polanco, R. A. and Sanchez -Chapula, J. A. (1997). 4-Aminopiridina activates potassium currents by activation of a muscarinic receptor in feline atrial myocytes. Journal of Physiology, 498 (3), 663-678. Noble, D. and Tsien, R. W. (1969). Outward membrane currents activated in the plateau range of potential in cardiac Purkinje fibres. Journal of Physiology (London), 200, 205-231. Oliva, C., Cohen, I. S. and Pennefather, P. (1990). The mechanism of rectification of IK1 in canine Purkinje myocytes. Journal of General Physiology, 96, 299-318. Papazian, D. M., Timpe, L. C., Jan Y. N. and Jan L. Y. (1987). Cloning of genomic and complementary DNA from Shaker, a putative potassium channel gene from Drosophila. Science, 237, 749-753. Pelhate, M. and Pichon, Y. (1974). Selective inhibition of potassium currents in the giant axon of the cockroach. Journal of Physiology, 242, 90. Peralta, E. G., Ashkenazi, A., Winslow, J. W., Smith, D. H., Ramachandran, J. and Capon, D. J. (1987). Distinct primary structures, ligand-binding properties and tissue-specific expression of four human muscarinic acetylcholine receptors. EMBO Journal, 6, 3923-3929. Pessia, M., Tucker, S. J., Lee, K., Bond, C. T. and Adelman, J. P. (1996). Subunit positional effects revealed by novel heteromeric inwardly rectifying K+ channels. EMBO Journal, 15, 2980-2987. Picatoste, F., Sarri, E. y Claro, E. (1996a). Proteínas G y sistema adenil ciclasa. En: J. A. García Sevilla (Ed), Receptores para neurotransmisores (pp 327-343). España: Rubes Editorial, S.L. Picatoste, F., Sarri, E. y Claro, E. (1996b). Proteínas G y fosfolipasas. En: J. A. García Sevilla (Ed), Receptores para neurotransmisores (pp 345-362). España: Rubes Editorial, S.L. 93 Sánchez -Chapula, J. A. (1988). Effects of bupivacaine on membrane currents of guinea-pig ventricular myocytes. European Journal of Pharmacology, 156, 303-308. Sánchez -Chapula, J. A. and Sanguinetti, M. C. (2000). Altered gating of HERG potassium channels by cobalt and lanthanum. Plügers Archiv, 440, 264-274. Sanguinetti, M. C. (1994). Potassium channels of cardiac myocytes. In: Toshio Narahashi (Ed.), Ion channels pf excitable cells. Methods in Neurociences (pp 205219). Academic Press. Sanguinetti, M. C., Curran, M. E., Zou, A., Shen, J., Spector, P. S., Atkinson, D. L. and Keating, M. T. (1996). Coassembly of K v LQT1 and mink (IsK) proteins to form cardiac IKs potassium channel. Nature, 384, 80-83. Sanguinetti, M. C., Jiang Ch., Curran, M. E. and Keating, M. T. (1995). A mechanistic link between an inherited and an acquired cardiac arrhythmia: HERG encodes the IKr potassium channel. Cell, 81, 299-307.3 Sanguinetti, M. C. and Jurkiewiks, N. K. (1990a). Two components of cardiac delayed rectifier K+ current: differential sensitivity to block by class III antiarrhythmic agents. Journal or General Physiology, 96,195-215. Sanguinetti, M. C. and Jurkiewiks, N. K. (1990b). Lanthanum blocks a specific component of KI and screens membrane surface charge in cardiac cells. American Journal or Physiology, 259, H1881-H1889. Sanguinetti, M. C. and Jurkiewiks, N. K. (1991). Isoproterenol antagonizes prolongation of refractory period by the class III antiarrhythmic agent, E-4031 in guinea pig myocytes: mechanism of action. Circulation Research, 68,77-84. Shi, H., Wang, H. and Wang, Z. (1999). Identification and characterization of multiple subtypes of muscarinic acetylcholine receptors and their physiological functions in canine hearts. Molecular Pharmacology, 55,497-507. Sowell, M. O., Ye, C., Ricupero, D. A., Hansen, S., Quinn, S. J., Vassilev, P. M. And Mortensen, R. M. (1997). Targeted inactivation of α i2 or α i3 disrupts activation of the cardiac muscarinic K+ channel, IK-Ach, in intact cells. Proceedings of the National Academy of Sciences of the United States of America, 94, 7921-7926. 94 Spector, P. S., Curran, M. E., Zou, A., Keating, M. T. and Sanguinetti, M. C. (1996). Fast inactivation causes rectification of the IKr channel. Journal of General Physiology, 10, 611-619. Spiegel, A. M. (1996). Defects in G protein-coupled signal transduction in human disease. Annual Review of Physiology, 58, 143,170. Stanfield, P. R., Davies, N. W., Shelton, P. A., Khan, I. A., Brammar, W. J., et al. (1994a). The intrinsic gating of inward rectifier K+ channels expressed from the murine IRK1 gene depends on voltage, K+ and Mg+2. Journal of Physiology, 475, 14. Stanfield, P. R., Davies, N W., Shelton, P. A., Sutcliffe, M. J., Khan, I. A., et al. (1994b). A single aspartate residue is involved in both intrinsic gating and blockage by Mg+2 of the inward rectifier IRK1. Journal of physiology, 478, 1-6. Szabo, G. and Otero, A. S. (1990). G protein mediated regulation of K+ channels in heart. Annual Review of Physiology, 52, 293-305. Ulbricht, W. and Wagner, H. H. (1976). Block of potassium channels of the nodal membrane by 4-aminopyridine and its partial removal by depolarization. Pflügers Archiv, 267, 77-87. Vandenberg, C. A. (1987). Inward rectification of a potassium channel in cardiac ventricular cells depends on internal magnesium ions. Proceedings of the National Academy of Sciences of the United States of America, 84, 2560-2564. van Zwiten, P. A. and Doods, H. N. (1995). Muscarinic receptors and drugs in cardiovascular medicine. Cardiovascular Drugs and Therapy, 9,159-167. Wang, Y. G. and Lipsius, S. L. (1995). Acetylcholine elicits a rebound stimulation of Ca2+ current mediated by pertussis toxin-sensitive G protein and cAMP-dependent protein kinase A in atrial myocytes. Circulation Research, 76, 634-644. Wang, Z., Kimitsuki, T. and Noma, A. (1991). Conductance properties of the Na +activated K+ channel in guinea-pig ventricular cells. Journal of Physiology, 433, 241257. Wang, H., Shi, H., Lu, Y., Yang, B. and Wang, Z. (1999). Pilocarpine modulates the cellular electrical properties of mammalian hearts by activating a cardiac M3 receptor and a K + current. British Journal of Pharmacology, 126, 1725-1734. 95 Watson, M., Yamamura, H. I. and Roeske, W. R. (1983). A unique regulatory profile and regional distribution of [3H]pirenzepine binding in the rat provide evidence for distinct M1 and M2 muscarinic receptor subtypes. Life Science, 32, 3001-3011. Wess, J. 1993. Molecular basis of muscarinic acetylcholine receptor function. TIPS, 14, 308-313. Wickman, K. D., Iñiguez-Lluhi J. A., Davenport, P.A., Taussig, R., Krapivinski, G.B. et al. (1994). Recombinant G-protein βγ-subunits activate the muscarinic-gated atrial potassium channel. Nature, 368, 255-257. Xu, Z. C., Yang, Y. and Hebert, S. C. (1996). Phosphorilation of the ATP-sensitive, inwardly rectifying K+ channel, ROMK, by cyclic AMP-dependent protein kinasa. Journal of Biological Chemistry, 271, 9313-9319. Yang, J., Jan, Y. N. and Jan, L. Y. (1995a). Determination of the subunit stoichiometry of an inwardly rectifying potassium channel. Neuron, 15, 1441-1447. Yang, J., Jan, Y. N. and Jan, L. Y. (1995b). Control of rectification and permeation by residues in two distinct domains in an inward rectifier K+ channel. Neuron, 14, 1047-1054. Ye, C., Sowell, M. O., Vassilev, P. M., Milstone, D. S. and Mortensen, R. M. (1999). Gα i2, Gα i3 and Gα o are all required for normal muscarinic inhibition of the cardiac calcium channels in nodal/atrial-like cultured cardiocytes. Journal of Molecular and Cellular Cardiology, 31, 1771-1781. 96