Enlace
Anuncio

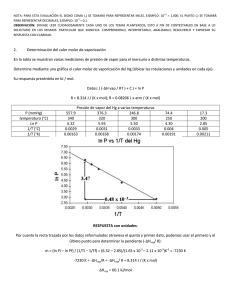
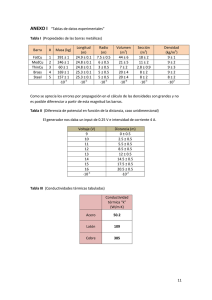
Lunes 18 de noviembre de 2013 Autor: Q.I. Eduardo García Ramírez Recordando a Michael Faraday. Para lograr un depósito de 4.74 gr de un metal sobre una superficie se necesitó aplicar una corriente de 40 A durante 6 minutos. Si originalmente el metal formaba parte de un compuesto de fórmula MCl2, ¿cuál es la identidad del metal? Respuesta corta: El metal es el cobre, Cu. Respuesta desarrollada: En primer lugar determinamos la cantidad de carga, Q, empleada para lograr la deposición: Q = It = (40 A) (360 s) = 14 400 C Con este valor de carga estimamos la masa molar del metal: Masa molar = (m Z F) / Q = [(4.74 g) (2 eq/mol) (96480 C/eq)] / 14 400 C = 63.51 g/mol El metal que corresponde a esta masa molar es el cobre, Cu. Miércoles 20 de noviembre de 2013 Autor: Q.I. Eduardo García Ramírez La fuerza de los débiles. El ácido cloroacético, ClCH2-COOH, tiene una constante de acidez, Ka = 1.38 X 10-3. ¿Cuál será el valor de pH y la fracción disociada de una solución 0.05 M de este ácido? Respuesta corta: El pH es de 2.11 y la fracción disociada, α, es 0.15 Respuesta desarrollada: La ecuación de la disociación del ácido cloroacético es: ClCH2-COOH + H2O ClCH2-COO1- + H3O+ La expresión de la constante de equilibrio es la siguiente: Ka = [H3O+] [ClCH2-COO1-] / [ClCH2-COOH] Las concentraciones de cada una de las especies involucradas en este equilibrio son: [ClCH2-COOH]= 0.05 – x [H3O+] = x [ClCH2-COO1-] = x Sustituyendo las concentraciones en la expresión del equilibrio: Ka = [x][x] / [0.05 – x] = x2/0.05-x 1.38 X 10-3 = x2 / 0.05 – x Resolviendo para x tenemos que x = 7.64 X 10-3 Con este valor determinamos el pH: pH = - log 7.64 X 10-3 = 2.11 La fracción disociada, α, se calcula de la siguiente manera: α = (7.64 X 10-3) / 0.05 = 0.15 Viernes 22 de noviembre de 2013 Autor: Q.I. Eduardo García Ramírez ¡Poquito pero me disuelvo! Cuántos miligramos de Cu(OH)2,Kps = 2.2 X 10-20 estarán disueltos en 1 litro de una solución saturada con este compuesto. Respuesta corta: La solubilidad es de 0.0172 mg/L Respuesta desarrollada: Planteamos la constante de solubilidad del hidróxido de cobre (II): Cu(OH)2 (s) Cu2+ (ac) + 2 OH1- (ac) Kps = [Cu2+][OH1-]2 Las concentraciones en el equilibrio de cada uno de los iones son: [Cu2+] = x [OH1-] = 2x Sustituyendo el valor de estas concentraciones en la constante de equilibrio: 2.2 X 10-20 = (x) (2x)2 = 4x3 Resolviendo para X 32.2 10 – 20/4 = 1.765 X 10-7 mol /L Transformando los moles/L de Cu(OH)2 a miligramos/L: mg/ L = (1.765 X 10-7 mol / L) (97.55 g/mol) (1 000 mg/ 1 g) = 0.0172 mg/L