Ficha, Informe y Evaluación (Doc. PDF=205 Kb)
Anuncio

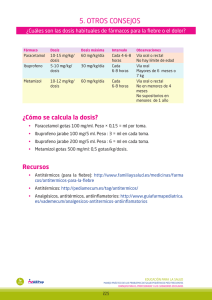
Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica MEDICAMENTOS INFORMACIÓN Y EVALUACIÓN DE NOVEDADES TERAPÉUTICAS INFORME 1ž=#46 46 Principio activo: Dexibuprofeno Especialidades: Seractil, Atriscal Fecha de la última revisión: Diciembre 2001 Revisores: Horga JF, Lasso de la Vega MC, Zapater P. CONTENIDO Ficha informativa Informe y Evaluación Ficha Técnica remitida por el laboratorio: • Seractil ELABORADO POR: Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica 1 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica FICHA INFORMATIVA FICHA Nº: 13 , Atriscal DEXIBUPROFENO (DCI); Seractil Ultima Actualización: Diciembre 2001 EFICACIA La eficacia analgésica de dexibuprofeno 600-1200 mg /día es equivalente a la de ibuprofeno racémico 1200-2400 mg/día en diversas patologías. Unicamente un estudio de analgesia tras extracción de molares mostró que el efecto analgésico aparecía antes con dexibuprofeno que con ibuprofeno. Falta por confirmar si esa mayor rapidez de acción ocurre también en otras patologías dolorosas. No se han visto diferencias significativas en el efecto analgésico entre dexibuprofeno y diclofenaco. TOXICIDAD MÁS RELEVANTE El porcentaje de pacientes tratados con dexibuprofeno que sufrieron reacciones adversas fueron: reacciones adversas gastrointestinales 9,4%, sistema nervioso central 2,5%, piel 0,7%, alteraciones analíticas 2,5% y otros 0,5%. Por sistemas, sólo las reacciones adversas a nivel del Sistema Nervioso Central aparecieron con una frecuencia estadísticamente significativa menor entre los pacientes tratados con dexibuprofeno (2.5% de los pacientes) que en los tratados con ibuprofeno (4.6% de los pacientes). COSTE / EFICACIA No hay pruebas ni datos indicadores de que esta relación sea diferente que con otros AINES. INDICACIONES AUTORIZADAS Osteoartritis, dismenorrea y dolor. APORTACIONES PRINCIPALES Ninguna clínicamente relevante que le diferencie del ibuprofeno racémico ni del resto de AINES. 2 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Mecanismo de Acción y Farmacocinética reacciones adversas gastrointestinales - 9,4%, sistema nervioso central - 2,5%, piel - 0,7%, alteraciones analíticas – 2,5% y otros – 0,5%. Por sistemas, sólo las reacciones adversas a nivel del Sistema Nervioso Central aparecieron con una frecuencia estadísticamente significativa menor entre los pacientes tratados con dexibuprofeno (2.5% de los pacientes) que en los tratados con ibuprofeno (4.6% de los pacientes). Los estudios realizados con animales gestantes que fueron tratados con dexibuprofeno (Monografía del producto) o ibuprofeno no han registrado efectos teratógenos. Sin embargo, no existen estudios adecuados y bien controlados en humanos. No obstante, con el uso crónico durante el 3º trimestre, podría producirse teóricamente, por el mecanismo de acción del fármaco, el cierre prematuro del ductus arterioso del feto. El uso de AINEs, especialmente durante el tercer trimestre, sólo se acepta en caso de ausencia de alternativas terapéuticas más seguras. No se ha detectado paso del fármaco a leche materna. Dexibuprofeno ó S(+)-ibuprofeno, es el estereoisómero dextro y activo del ibuprofeno. Su biodisponibilidad oral es del 90-100% y no se modifica con la comida. La Tmáx es de 2 horas. Se une a proteínas plasmáticas en más del 99% y su volumen de distribución es de 12 L. Alcanza mayores concentraciones en fluido cerebroespinal y en líquido sinovial que el isómero R. Ibuprofeno tiene una baja tasa de extracción hepática y un aclaramiento relativamente bajo comparado con el flujo sanguíneo hepático (aclaramiento plasmático de 50-150 ml/min para ambos enantiómeros). La vida media de eliminación de los dos enantiómeros es de 2 horas en adultos sanos (Evans AM. Eur J Clin Pharmacol 1992; 42: 237-56). El aclaramiento de dexibuprofeno se enlentece en pacientes con alteración de la función renal y hepática (Li G y cols. Clin Pharmacokinet 1993; 25: 154-63; Chen CY, Chen CS. Br J Clin Pharmacol. 1995; 40: 6772). Eficacia Pauta terapéutica e indicaciones La eficacia analgésica de dexibuprofeno 6001200 mg /día es equivalente a la de ibuprofeno racémico 1200-2400 mg/día (Rahlfs VW, Stat C. J Clin Pharmacol 1996; 36: 33S-40S; Singer F y cols. Int J Clin Pharmacol Ther 2000; 38: 15-24; Dionne RA, McCullagh L. Clin Pharmacol Ther 1998; 63: 694-701; Phleps W. Clin Rheumatol 2001 (Suppl 1): 15-21) y a la de diclofenaco 150 mg/día (Hawel R y cols. Wien Klin Wochenschr 1997; 109: 53-9) en diversas patologías osteoarticulares y dismenorrea. Unicamente un estudio de analgesia tras extracción de molares mostró que el efecto analgésico aparecía antes con 200 ó 400 mg de dexibuprofeno que con 400 mg de ibuprofeno (Dionne RA, McCullagh L. Clin Pharmacol Ther 1998; 63: 694-701). Falta por confirmar si esa mayor rapidez de acción ocurre también en otras patologías dolorosas. Dexibuprofeno ha sido aprobado para su uso en el tratamiento de: a) Osteoartritis: 300 mg/812 h, siendo la dosis máxima por toma de 400 mg de dexibuprofeno. En pacientes con procesos agudos o exacerbaciones, puede aumentarse la dosis temporalmente hasta 1.200 mg/día. Dosis máxima diaria: 1.200 mg, b) Dismenorrea: 300 mg/8-12 h, siendo la dosis máxima por toma de 300 mg. Dosis máxima diaria: 900 mg, y c) Dolor: dosis inicial, 300 mg de dexibuprofeno por toma y dosis máximas diarias de 600 mg. Los pacientes con disfunción hepática o renal leve-moderada deberán iniciar el tratamiento con dosis reducidas y ser cuidadosamente vigilados. No se deberá utilizar dexibuprofeno en pacientes con insuficiencia hepática o renal grave. No se ha establecido la seguridad ni la eficacia de este fármaco en niños ni adolescentes. Seguridad Coste del tratamiento Se han revisado los datos de un total de 1330 pacientes con una edad media de 49 años (529 hombres y 801 mujeres) que habían recibido, durante 21 días como máximo, un rango de dosis de 600-1200 mg de dexibuprofeno y 1200-2400 mg de ibuprofeno racémico. En ninguno de los pacientes analizados ocurrió una reacción adversa grave. Hubo 18 abandonos entre los tratados con dexibuprofeno (2.4%) y 19 entre los tratados con ibuprofeno racémico (3.2%). El porcentaje de pacientes tratados con dexibuprofeno que sufrieron reacciones adversas fueron: El coste diario de un tratamiento analgésico con dexibuprofeno es de 0,5-1 euro diario, 2 veces superior a ibuprofeno racémico. Lugar en la terapéutica Hasta el momento la información disponible de dexibuprofeno no permite establecer la trascendencia clínica de sus peculiaridades farmacocinéticas ni de su perfil de seguridad. En los estudios publicados hasta el momento su eficacia ha sido similar a la de ibuprofeno racémico con las pautas terapéuticas señaladas. 3 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica INFORME Y EVALUACIÓN Informe Nº: 13 Fármaco: DEXIBUPROFENO Denominación química: Acido (S)-alfa-metil-4(2-metilpropil)bencenoac‚tico Composición cuantitativa: H 8.80% C 75.69% O 15.51% Fórmula empírica: C13H18O2 Peso molecular: 206,28 Fuente: http://www.portalfarma.com/home.nsf Especialidades comercializadas en España que contienen DEXIBUPROFENO: Clase Código Nombre ESPEC. 669465 SERACTIL 300 MG 30 COMPR RECUB ESPEC. 669572 SERACTIL 400 MG 30 COMPR RECUB ESPEC. 669564 SERACTIL 300 MG 60 COMPR RECUB ESPEC. 669689 SERACTIL 400 MG 60 COMPR RECUB ESPEC. 675611 ATRISCAL 300 MG 30 COMPR RECUB ESPEC. 675645 ATRISCAL 300 MG 60 COMPR RECUB ESPEC. 675512 ATRISCAL 400 MG 30 COMPR RECUB ESPEC. 675595 ATRISCAL 400 MG 60 COMPR RECUB Fuente: http://www.portalfarma.com/home.nsf 4 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Indicaciones autorizadas en España: - Osteoartritis: Tratamiento sintomático del dolor y la inflamación asociados a la osteoartritis. - Dismenorrea: Tratamiento sintomático del dolor agudo producido durante la menstruación (dismenorrea primaria). - Dolor: Tratamiento sintomático del dolor de leve a moderado, como el dolor músculoesquelético. (Fuente: ficha técnica del producto) Grupo Terapéutico: M01AE: ANTIINFLAMATORIOS: DERIVADOS DE ÁCIDO PROPIÓNICO Coste de las especialidades de Dexibuprofeno comercializadas en España: Especialidad Laboratorio PVP (IVA incl.): Fecha de alta SERACTIL 300 MG 30 COMPR RECUB 91: MADAUS 1249 Pts 7,51 EUR 01/01/2001 SERACTIL 400 MG 30 COMPR RECUB 91: MADAUS 1578 Pts 9,48 EUR 01/01/2001 ATRISCAL 300 MG 30 COMPR RECUB 318: LACER 1249 Pts 7,51 EUR 01/01/2001 ATRISCAL 400 MG 30 COMPR RECUB 318: LACER 1578 Pts 9,48 EUR 01/01/2001 Fuente: http://www.portalfarma.com/home.nsf 5 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica INDICE INDICE ......................................................................................................................................7 A) INTRODUCCIÓN .................................................................................................................8 1.- Farmacocinética..........................................................................................................8 1.1.- Absorción...........................................................................................................................................8 1.2.- Distribución .......................................................................................................................................9 1.3.- Metabolismo y excreción .................................................................................................................11 2.4.- Farmacocinética: potenciales factores modificadores ...................................................................... 11 B) EFICACIA ..........................................................................................................................12 B.1.) - TRATAMIENTO DEL DOLOR .................................................................................................. 12 1.- Ensayos clínicos de eficacia comparada con ibuprofeno racémico .........................12 2.- Ensayos clínicos comparativos con otros tratamientos estándar usados en el tratamiento del dolor....................................................................................................16 C) SEGURIDAD......................................................................................................................16 1.- Descripción ...............................................................................................................16 Teratogénesis ...........................................................................................................................................16 Mutagénesis .............................................................................................................................................17 Estudios de tolerancia gástrica .................................................................................................................17 Eventos adversos......................................................................................................................................18 Intoxicación..............................................................................................................................................22 2.- Contraindicaciones y precauciones ..........................................................................24 Contraindicaciones...................................................................................................................................24 Precauciones.............................................................................................................................................24 3.- Interacciones.............................................................................................................25 D) PAUTA TERAPÉUTICA E INDICACIONES .....................................................................27 ADULTOS, ORAL: ............................................................................................................................... 27 E) FARMACOECONOMÍA .....................................................................................................28 Estudios de Farmacoeconomía .................................................................................................................28 Precios comparativos................................................................................................................................29 F) CONCLUSIONES...............................................................................................................30 REFERENCIAS BIBLIOGRÁFICAS ......................................................................................31 6 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica A) Introducción Dexibuprofeno ó S(+)-ibuprofeno, es el estereoisómero dextro del ibuprofeno, donde residen de forma casi exclusiva las propiedades antiinflamatorias derivadas de la inhibición de la enzima ciclooxigenasa (Evans, 1992). Los fármacos antiinflamatorios no esteroideos (AINES) ejercen la mayoría de sus efectos farmacológicos inhibiendo la transformación del ácido araquidónico a tromboxano y diversas prostaglandinas mediada por la enzima ciclooxigenasa. En los casos de ibuprofeno, naproxeno y ketoprofeno se conoce que sus respectivos enantiómeros-S son inhibidores efectivos in vitro de las dos isoformas existentes de ciclooxigenasa (COX 1 y 2) y muestran efectos analgésicos y antiinflamatorios in vivo (Evans, 2001). En general, al enantiómero-R, el otro enantiómero que junto al S compone los actuales preparados racémicos de estos fármacos, se le ha considerado inefectivo como analgésico y antiinflamatorio in vivo puesto que no inhibe la síntesis de prostaglandinas. Sin embargo, en el caso de ibuprofeno y fenoprofeno, el enatiómero-R sufre un extenso proceso de transformación metabólica (conocido como inversión quiral) al enantiómero-S lo que hace que cuando se estudian en animales de experimentación las propiedades de este enantiómero muestre cierto grado de eficacia analgésica y antiinflamatoria (Evans, 1992; Hutt and Caldwell, 1983; Wechter, 1992; Adams et al, 1976). Además, ibuprofeno y otros AINES ejercen toda una serie de efectos independientes de la inhibición de la ciclooxigenasa que suelen ser efectos no estereoselectivos y por tanto efectos ejercidos por ambos enantiómeros (Evans, 1996; Evans, 2001). Ibuprofeno es uno de los fármacos mas utilizados en el mundo desde su comercialización hace 30 años. Dexibuprofeno se sintetizó como molécula para su aplicación clínica por el laboratorio austríaco Gebro Pharma y se comercializó en Austria en 1993, extendiéndose posteriormente su uso a diferentes países. Recientemente dexibuprofeno se ha comercializado en España. En el presente informe se revisan sus propiedades y se evalúa los aspectos novedosos y las posibles ventajas y/o inconvenientes de dexibuprofeno, especialmente en comparación con el ibuprofeno racémico, el único existente hasta el momento en el mercado español. 7 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica 1.- Farmacocinética 1.1.- Absorción Tras la administración oral, el dexibuprofeno se absorbe rápidamente (vida media de absorción = 30 min.), una parte en el estómago y la mayoría en el intestino delgado. La biodisponibilidad absoluta supera el 90% con valores entre un 90 y un 100% (Evans, 1996). Las concentraciones plasmáticas máximas (Cmáx) se obtuvieron a las 2,1 horas de la administración oral de una dosis de 200 mg (Cmáx = 12,4±2.2 µg/ml) y a las 2,2 horas de una dosis de 400 mg (Cmáx = 24,1±3.6 µg/ml) a voluntarios sanos varones (Eller y cols, 1998). Se ha evaluado la influencia de la comida sobre la biodisponibilidad del dexibuprofeno en un estudio cruzado, controlado y aleatorizado. En este estudio se trató a 6 voluntarios sanos con una dosis oral de 200 mg del fármaco en ayunas, repitiéndose la administración del fármaco una semana después, pero en este caso tras una comida estandarizada. La Cmáx y Tmáx que se alcanzaron fueron 11,22 ± 3.3 µg/ml a las 1,8 ± 0.6 horas en ayunas y 11,37 ± 3.7 µg/ml a las 1,6 ± 1.1 horas tras la comida (Klein, 1993). Ninguna de estas diferencias se consideró relevante. Estos resultados confirman los obtenidos en otro estudio publicado en 1992 por Levine y colaboradores en el que se administró en ayunas y tras una comida ibuprofeno a 11 voluntarios sanos midiéndose los dos enantiómeros del fármaco en sangre, no observándose modificaciones en la biodisponibilidad del enantiómero-S por la comida (Levine et al, 1992). 1.2.- Distribución El grado de unión a las proteínas plasmáticas es superior al 99% y el volumen de distribución de 12 L (Evans, 1996). Varios estudios han mostrado que el estereoisómero (S) alcanza mayores concentraciones en fluido cerebroespinal y en líquido sinovial que el (R). En el estudio de Bannwarth y cols, (1995) se compara la disposición de los dos enantiómeros del ibuprofeno en líquido cefalorraquídeo (LCR) en un total de 46 pacientes que tenían dolor por compresión de raíces nerviosas y precisaban una punción lumbar. A todos los pacientes se les extrajo una muestra de 8 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica sangre y otra de LCR a diferentes tiempos entre 30 minutos y 8h tras recibir una dosis oral de 800 mg de ibuprofeno racémico. Las concentraciones máximas de los dos isómeros se alcanzaron a las 3h en LCR y a la 1.5h en plasma, patrón compatible con un paso de la barrera hematoencefálica (BHE) por difusión pasiva primaria (ver tabla 1). El resultado del cociente entre las áreas bajo la curva concentración-tiempo (AUC) en LCR y plasma (AUCLCR/AUCPlasma) es el parámetro que mejor cuantifica la cantidad de fármaco que atraviesa la BHE, siendo tres veces superior a la fracción libre en plasma de cualquiera de los enantiómeros lo que sugiere que el ibuprofeno pasa en cantidades relativamente importantes a LCR y/o se elimina más lentamente desde LCR hacia plasma. El enantiómero S(+) alcanzó concentraciones plasmáticas y en LCR superiores al R(-) y su vida media de eliminación (t1/2 ) en plasma y LCR fue mas prolongada. TABLA 1: Parámetros farmacocinéticos de los enantiómeros R(-) y S(+) del ibuprofeno en plasma y fluido cerebroespinal (LCR) tras la administración de 800 mg de ibuprofeno racémico a 46 pacientes. Parámetros Plasma LCR R(-) S(+) R(-) S(+) Fu 0.002 ± 0.001 0.005 ± 0.002 Cmax (ng/ml) 20712 ± 7035 26103 ± 6391 168 ± 61 315 ±116 63 ± 28 133 ± 39 1.5 1.5 3 3 1.7 (1.4-2.3) 2.5 (1.9-3.8) 3.9 (2.7-7.0) 7.9 (4.275.2) AUC (0.8h)(ng*h/ml) 65470 85547 595 1241 AUCu (0.8h)(ng*h/ml) 164 375 Cu max (ng/ml) t max (h) t1/2 (h) fu =fracción libre no unida a proteínas. Cu max y AUCu son la Cmax y AUC calculadas a partir de las concentraciones medidas del fármaco libre. Los valores son medias ± DS, excepto para la tmáx que es la mediana. Entre paréntesis los intervalos de confidencia del 95%. Day y cols. (1988) estudiaron la disposición de los enantiómeros del ibuprofeno en líquido sinovial y plasma de 8 pacientes con artritis en tratamiento con ibuprofeno racémico, observando que las concentraciones de (S)-ibuprofeno en líquido sinovial superaban a las alcanzadas por el enantiómero R(-) (CS / CR = 2.1 ± 9 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica 0.3; media ± ES). Las t1/2 de regreso de los enantiómeros (R)- y (S)- desde líquido sinovial a plasma fueron de 2.6 y 2.3 h y las t1/2 de eliminación en plasma fueron de 1.6 y 2.3 h, respectivamente. Las concentraciones máximas de ambos enantiómeros en líquido sinovial fueron menores y fluctuaron menos que las plasmáticas. Las concentraciones medias en líquido sinovial fueron superiores a las plasmáticas a partir de las 5.4 ± 0.3 h en el caso del enantiómero R(-) y de 5.5 ± 0.6 h con el (S)-ibuprofeno (media ± ES). El análisis de los datos farmacocinéticos sugirió que aunque los enantiómeros difunden a líquido sinovial principalmente en su forma libre, en algunos pacientes puede haber entre un 10% y un 20% que podría pasar unido a proteínas plasmáticas. Sin embargo, las dosis administradas a los pacientes no fueron exactamente homogéneas y no se tuvo en cuenta que hasta un 60% del (R)-ibuprofeno puede convertirse en la forma (S)-ibuprofeno. El isómero inactivo R-ibuprofeno forma un tioéster con el coenzima A, que puede dar lugar a la formación de triglicéridos híbridos no naturales (Williams, 1986). Se sabe que estos triglicéridos no naturales entran en el tejido adiposo donde pueden formar depósitos de larga duración (Fears, 1985). La movilización, habitualmente lenta, de estos depósitos tisulares de larga duración y la consiguiente formación de tioésteres xenobióticos con el coenzima A podría interferir en la homeostasis de la síntesis y catabolismo de los lípidos (Mayer, 1996). Todavía no se conocen con claridad las implicaciones toxicológicas de la intervención del isómero inactivo R en el metabolismo de los lípidos. En ratas, la formación de triglicéridos híbridos conteniendo ibuprofeno en lugar de ácidos grasos endógenos se ha demostrado tras la administración de R-ibuprofeno pero no tras la administración de S-ibuprofeno (Williams, 1986; Evans, 2001). 1.3.- Metabolismo y excreción Los dos enantiómeros de ibuprofeno se metabolizan fundamentalmente en el hígado por vías oxidativas y los metabolitos inactivos resultantes (S)- hidroxibuprofeno y (S)-carboxibuprofeno sufren con posterioridad y previo a su excreción un proceso de glucuronidación convirtiéndose en acilglucurónidos y siendo excretados principalmente por vía renal (recuperación en orina mayor del 90% de una dosis oral), y en menor proporción con las heces (Evans, 2001). 10 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Los acilglucurónidos que se forman como consecuencia del metabolismo de cualquiera de los dos enantiómeros son capaces de unirse a macromoléculas endógenas como la albúmina y existen algunas evidencias de que estos complejos entre el fármaco y las proteínas podrían participar en la aparición de reacciones de hipersensibilidad potencialmente graves (Spahn-Langguth y Benet, 1992; Evans, 2001). En el caso del ibuprofeno se han detectado estos complejos tras la administración del fármaco racémico y no se ha podido establecer la propensión relativa de cada isómero individual para formar estos complejos. Se ha sugerido que el dextroibuprofeno al ser un enantiómero puro podría asociarse a una menor cantidad de complejos fármaco-proteína (Evans, 1996). Las implicaciones clínicas de esta posibilidad están por confirmar (Evans, 2001). Ibuprofeno tiene una baja tasa de extracción hepática y un aclaramiento relativamente bajo comparado con el flujo sanguíneo hepático (aclaramiento plasmático de 50-150 ml/min para ambos enantiómeros) (Evans, 2001). La vida media de eliminación de los dos enantiómeros es de 2 horas en adultos sanos (Evans, 2001). 2.4.- Farmacocinética: potenciales factores modificadores En pacientes con insuficiencia hepática se observa un aumento del tiempo de vida media de eliminación y del AUC. Tras la administración de 400 mg de dexibuprofeno a 8 pacientes con cirrosis hepática moderada o grave, la vida media de eliminación fue de 2.6 ± 0.5 horas frente a las 1,6 ± 0.1 horas observada en los 8 controles (p<0.001), y el AUC fue de 144 ± 41 mg*h/L vs 101±35 mg*h/L en los controles (p=0.041)(Li y cols, 1993). En un estudio se evaluó la farmacocinética de ibuprofeno y sus dos enantiómeros en 32 pacientes a los que se trató con una dosis de 800 mg de ibuprofeno racémico. Todos los pacientes tenían al menos un factor de riesgo cardiovascular: hipertensión, diabetes, hipercolesterolemia, hiperuricemia y podían o no haber sufrido una complicación cardiovascular. Potencialmente todos estos pacientes tendrían una hemodinámica renal inestable, aunque específicamente no se midió en este estudio dicha hemodinámica. Al final del estudio se observó una mayor AUC del enantiómero S y una mayor relación AUC(S) / AUC(R) en los 11 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica pacientes que en 10 individuos sanos que se usaron como controles. La edad avanzada y la hipertensión arterial fueron los dos factores independientes que contribuyeron de forma destacada al aumento del AUC (S) en este grupo de pacientes (Chen y Chen, 1995). No se dispone de estudios sobre la farmacocinética del dexibuprofeno, administrado como tal, en pacientes con deterioro moderado-grave de la función renal. B) Eficacia B.1.) - Tratamiento del dolor La eficacia de dexibuprofeno como analgésico se ha comparado con la eficacia de ibuprofeno y diclofenaco en una serie de estudios en los que han participado más de 1000 pacientes con diferentes patologías dolorosas con o sin inflamación asociada. 1.- Ensayos clínicos de eficacia comparada con ibuprofeno racémico Se realizó un primer ensayo clínico cruzado y aleatorizado en el que 24 pacientes con diferentes enfermedades reumáticas inflamatorias y degenerativas crónicas fueron tratados en un primer período de 8 días con dosis iniciales de 600 mg/8 horas de ibuprofeno racémico o 300 mg/8 horas de dexibuprofeno para posteriormente, en un segundo período, ser tratados con el fármaco que no habían recibido en el primer período. Al final de este estudio se observó que las dosis totales de dexibuprofeno y de ibuprofeno racémico consumidas fueron, respectivamente, 7484 mg y 14242 mg sin diferencias en el control del dolor entre los dos grupos. Este primer estudio sirvió para mostrar que la dosis eficaz de dexibuprofeno era aproximadamente un 50% de la dosis de ibuprofeno racémico (Klein y cols, 1992). En 1996, Rahlfs y Stat (1996) publicaron una revisión de un total de 6 ensayos clínicos realizados para comparar los efectos de una dosis de 1200 mg diarios de dexibuprofeno con la dosis de 2400 mg diarios de ibuprofeno racémico. En la tabla 2 se muestra un resumen de las características de estos 6 estudios. 12 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica TABLA 2: Ensayos clínicos randomizados y paralelos realizados para comparar los efectos de una dosis de 1200 mg diarios de dexibuprofeno con la dosis de 2400 mg diarios de ibuprofeno racémico. Estudio Patología Nº pacientes Duración del Ibuprofeno / estudio Variable principal de eficacia Variables secundarias Dexibuprofeno Tiempo hasta desaparición del dolor y de la restricción del movimiento por el dolor Juicio clínico del investigador; Presencia del signo de Lasègue; Intensidad del dolor (escala analógica visual o VAS) 21 días Juicio clínico del investigador Indice de Ritchie; Intensidad del dolor (VAS); Rigidez matutina; Pérdida de fuerza; VSG/proteína C reactiva; Consumo de paracetamol 60 / 59 14 días Número de pacientes recuperados a los 7 días Capacidad de flexión dorsal; Movilidad activa; Edema; Intensidad del dolor (VAS) Artrosis de rodilla 75 / 75 21 días Juicio clínico del investigador Intensidad del dolor (VAS); Flexibilidad; Edema de la cápsula articular; Efusión articular; Consumo de paracetamol SIB-CAS 5 Espondilitis anquilopoyética 59 / 60 21 días Juicio clínico del investigador Intensidad del dolor (VAS); Rigidez matutina; Restricción de movimientos SIB-CAS 7 Artrosis activa de cadera 56 / 59 21 días Juicio clínico del investigador Intensidad del dolor (VAS); Restricción de movimientos; Consumo de paracetamol SIB-CAS 1 Síndrome de columna vertebral lumbar 60 / 60 7 días SIB-CAS 2 Artritis reumatoide 81 / 85 SIB-CAS 3 Torcedura de tobillo SIB-CAS 4 R = randomizado, P = paralelo 13 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Un análisis de estos datos realizado por los autores no encuentra diferencias en cuanto a eficacia entre los dos tratamientos evaluados, aunque cabe indicar que esta conclusión es de una gran debilidad metodológica puesto que el tamaño muestral de todos y cada uno de los estudios es muy reducido lo que implica la falta de poder para detectar diferencias y la variable principal utilizada en la mayoría de los estudios es el juicio clínico del investigador, una variable subjetiva muy difícil de controlar especialmente cuando no se garantiza adecuadamente el enmascaramiento del tratamiento. Singer y colaboradores (2000) publicaron en el año 2000 los resultados de un ensayo clínico paralelo, randomizado y doble ciego llevado a cabo en 178 pacientes con artrosis dolorosa de la cadera. En este estudio se incluyó un 97% de pacientes con artrosis degenerativa mientras que el 3% restante padecía artrosis de origen traumático. La edad media de los pacientes fue 55 años y un 47% fueron mujeres. Los pacientes se asignaron aleatoriamente a uno de los tres grupos de tratamiento: dexibuprofeno 400 mg/ 8 horas (N=56), dexibuprofeno 200 mg/ 8 horas (N=60) e ibuprofeno racémico 800 mg/ 8 horas (N=59). La situación clínica de los pacientes se evaluó antes de iniciar el tratamiento y a los 8 y 15 días del mismo usando el cuestionario índice de la artrosis de las Universidades Western Ontario y McMaster (WOMAC), un instrumento validado diseñado para evaluar la situación clínica de pacientes con artrosis de rodilla o cadera. Este cuestionario consta de 24 cuestiones individuales divididas en 3 subescalas: dolor (5 ítems), rigidez (2 ítems) e incapacidad (17 ítems). Concretamente cada subescala consiste en: - Subescala de dolor (WOMAC): al paciente se le pregunta sobre la cantidad de dolor que ha tenido en las últimas 48 horas en las siguientes circunstancias: caminando sobre una superficie plana, subiendo o bajando escaleras, por la noche en la cama, permaneciendo sentado o tumbado y al levantarse. Las respuestas posibles a cada una de estas preguntas van desde “no dolor” (0 mm) a “dolor extremo” (100 mm) en una escala analógica visual. La puntuación de la subescala de dolor es la media de las 5 respuestas. - Subescala de rigidez (WOMAC): al paciente se le pregunta sobre la rigidez que ha tenido en las últimas 48 horas en las siguientes circunstancias: al levantarse por la mañana y al sentarse o acostarse al final del día. Las respuestas posibles 14 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica a estas preguntas podían ir desde “no rigidez” (0 mm) a “rigidez extrema” (100 mm) en una escala analógica visual. La puntuación de la subescala de rigidez es la media de las 2 respuestas. - Subescala de incapacidad (WOMAC): al paciente se le hacen 17 preguntas acerca de sus capacidades y funcionalidad. Las respuestas posibles a cada una de estas preguntas podían ir desde “no dificultad” (0 mm) a “dificultad extrema” (100 mm) en una escala analógica visual. La puntuación de la subescala de incapacidad es la media de las 17 respuestas. Cuando se han calculado los valores de las 3 subescalas es posible calcular una puntuación media total (WOMAC) que es la media de las respuestas a las 24 preguntas y un promedio de las subescalas (WOMAC) que es la media de los valores de las 3 subescalas consideradas. Los valores basales de las tres escalas fueron similares en los tres grupos de pacientes estudiados y tras 15 días de tratamiento se produjo una reducción media del 50% de las puntuaciones en cada una de las subescalas estudiadas sin que existieran diferencias estadísticamente significativas entre ninguno de los tres grupos estudiados. Dione y McCullagh (1998) publicaron los resultados de un ensayo clínico paralelo y doble ciego que evaluó la eficacia analgésica de dexibuprofeno administrado en dosis única en el dolor agudo postquirúrgico (cirugía dental). En este ensayo clínico se incluyó a pacientes mayores de 16 años, de ambos sexos, sometidos a la extracción de al menos 3 molares, uno de ellos incluído en hueso, con dolor postoperatorio moderado o severo. Se excluyeron los pacientes con un historial de alergias o reacciones adversas a aspirina o AINES, y aquellos que hubiesen tomado cualquier analgésico en las 24h previas a la intervención. Un total de 176 pacientes entraron en el estudio, de los que 51 fueron tratados con 200mg de dexibuprofeno, 50 con 400mg de dexibuprofeno, 50 con 400mg de ibuprofeno racémico y 25 con placebo. La variable de eficacia primaria fue la actividad analgésica medida usando la escala analógica visual (VAS) antes de la administración de los fármacos y a diferentes tiempos durante 6 horas tras dicha administración. Se realizó una estimación del área bajo la curva tiempo-efecto de los tratamientos. Como variables secundarias se valoraron las concentraciones plasmáticas de β–endorfina, la cantidad y duración de la analgesia y los efectos adversos. 15 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Entre 15 y 60 minutos tras la administración de los fármacos las dosis de 200 y 400mg de dexibuprofeno produjeron un efecto analgésico superior al logrado tanto con ibuprofeno racémico como con placebo (p<0.05). 400 mg de dexibuprofeno produjo una mayor analgesia a las 2 y 3 horas de la administración que ibuprofeno racémico (400 mg) (p<0.05). La dosis de 200 mg de dexibuprofeno no se diferenció del efecto de ibuprofeno racémico (dosis de 400 mg) Los niveles plasmáticos de βendorfinas inmunorreactivas descendieron en todos los grupos al iniciar el efecto analgésico; sin embargo, entre los 30-120 minutos posteriores a la administración, disminuyeron significativamente más con las dos dosis de dexibuprofeno que con placebo. Tanto 200 mg como de 400mg de dexibuprofeno consiguieron un alivio del dolor en menos tiempo que ibuprofeno racémico (22 y 23 minutos vs 35 minutos (p<0.05)). En otro ensayo clínico se comparó la eficacia de dexibuprofeno 600 y 900 mg/día e ibuprofeno racémico 1200 mg/día en pacientes con dismenorrea (Internal Report Gebro Pharma III/21.3, 1998; Phleps, 2001). Se trató de un ensayo clínico cruzado, randomizado y doble ciego en el que se incluyeron 102 pacientes a las que se trató durante 3-5 días de cada uno de tres ciclos menstruales consecutivos. Sólo se incluyó a mujeres que catalogaban el dolor que experimentaban como moderado o severo en escalas verbales de valoración del dolor (0 = no dolor; 1 = poco dolor; 2 = dolor moderado; 3 = dolor considerable; 4 = máximo dolor). La variable principal era la diferencia en la intensidad de dolor percibido medido mediante estas escalas y no se encontraron diferencias significativas entre los tres tratamientos estudiados. En resumen la eficacia analgésica de dexibuprofeno 600-900 mg /día es equivalente a la de ibuprofeno racémico 1200 mg/día en diversas patologías. Unicamente un estudio de analgesia tras extracción de molares mostró que el efecto analgésico aparecía antes con dexibuprofeno que con ibuprofeno. Falta por confirmar si esa mayor rapidez de acción ocurre también en otras patologías dolorosas. 16 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica 2.- Ensayos clínicos comparativos con otros tratamientos estándar usados en el tratamiento del dolor Se ha llevado a cabo un ensayo clínico doble ciego para comparar la eficacia de dexibuprofeno 300 mg/8 horas con la de 50 mg/8 horas de diclofenaco sódico vía oral en 110 pacientes con osteoartritis dolorosa de la rodilla (Hawel et al, 1997). A los pacientes se les trató durante 15 días al final de los cuales el índice funcional de Lequesne, usado para valorar el grado de función en osteoartritis de rodilla, mejoró una media de 7,4 puntos en los pacientes tratados con dexibuprofeno y de 7,3 puntos en los tratados con diclofenaco. Tampoco hubo diferencias en otras variables secundarias evaluadas. C) Seguridad 1.- Descripción Teratogénesis El ibuprofeno racémico está incluído en la categoría B de la FDA (estudios sobre animales gestantes no han demostrado riesgo fetal pero no existen estudios controlados en mujeres gestantes o los efectos en animales gestantes no se han demostrado en estudios controlados en mujeres gestantes) durante el primer y segundo trimestre de gestación. Durante el 3º trimestre se le incluye en la categoría D de la FDA. Concretamente, los estudios realizados con animales gestantes que fueron tratados con dexibuprofeno (Monografía del producto) o ibuprofeno no han registrado efectos teratógenos. Sin embargo, no existen estudios adecuados y bien controlados en humanos. En general, no parece que el uso ocasional de AINEs, salvo poco antes del parto, produzca efectos adversos fetales. No obstante, con el uso crónico durante el 3º trimestre, podría producirse teóricamente, por el mecanismo de acción del fármaco, el cierre prematuro del ductus arterioso del feto. Los antiinflamatorios también producir efecto antiagregante plaquetario, que podría complicar o prolongar la hemorragia materna y predisponer al recién nacido. Antes del parto, pueden reducir e incluso anular la contractilidad uterina, provocando un retraso anómalo del parto y una prolongación no fisiológica de la gestación. El uso 17 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica de estos fármacos, especialmente durante el tercer trimestre, sólo se acepta en caso de ausencia de alternativas terapéuticas más seguras. Mutagénesis Dextroibuprofeno no causó un aumento significativo del número de aberraciones cromosómicas cuando se expuso a una línea de células de pulmón de hamster chino a concentraciones entre 350 y 1000 µg/ml. En las mismas células el ibuprofeno racémico a la concentración de 2000 µg/ml sí causó un aumento significativo de las células aberrantes que se ha propuesto podría guardar relación con su capacidad de incorporarse en los lípidos dando lugar a una porterior transformación celulas (Monografía del producto). Estudios de tolerancia gástrica La principal preocupación médica a la hora de utilizar los AINES, y también ibuprofeno, es la seguridad gastroduodenal de estos fármacos debido a la frecuencia con que originan problemas hemorrágicos a este nivel. Diferentes estudios han demostrado una correlación entre las concentraciones séricas de pepsinógeno I y la máxima secreción de ácido gástrico. Concretamente se ha observado que las concentraciones séricas de pepsinógeno I en ayunas están aumentadas en un 60% de los pacientes con úlcera duodenal, un 95% de los pacientes con gastritis atrófica y un 95% de los pacientes con Síndrome de Zollinger-Ellison. Lanas y su equipo de gastroenterólogos del Hospital Clínico Universitario de Zaragoza demostraron en células pépticas humanas obtenidas de especímenes de biopsia que tanto aspirina como ibuprofeno potenciaban la secreción de pepsinógeno estimulada por secretagogos mediante un proceso regulado por calcio e independiente de la inhibición endógena de prostaglandinas (Lanas y cols, 1995). Un estudio realizado en pacientes tratados con diferentes AINES por vía oral (Kullich y cols, 1991) detectó que ibuprofeno y diclofenaco estaban entre los AINEs que menos elevaban el pepsinógeno I (se elevaba en un 20 y 23,5% de los pacientes tratados con estos dos fármacos) mientras que con indometacina el pepsinógeno aumentaba en el 45% de los pacientes. 18 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Se estudió a 41 pacientes con enfermedades reumáticas degenerativas a los que se dividió en dos grupos: un grupo de 21 pacientes que recibieron 600 mg de dexibuprofeno diarios (3 x 200mg) y otro grupo con 20 pacientes que tomaron 900 mg diarios de dexibuprofeno (3 x 300 mg) durante 14 días. (Kullich y cols, 1994). Se midió en todos los pacientes mediante radioinmunoensayo las concentraciones séricas del pepsinógeno I y del pepsinógeno II. En el 80% de los pacientes que recibieron la dosis más elevada de dexiburpofeno y en el 90% de los que recibieron la dosis menor no hubo cambios en el pepsinógeno sérico tras la administración del fármaco. Eventos adversos Un meta-análisis (documento interno de la compañía) de 5 ensayos clínicos aleatorizados (Adam y cols, 1996; Evans, 1992; Rahlfs, 1996; Klein, 1994; Hawel, 1997) comparó las reacciones adversas, es decir aquellos eventos que se consideraron relacionados con el tratamiento por los investigadores, entre los pacientes tratados con dexibuprofeno y los tratrados con ibuprofeno racémico. En conjunto en estos ensayos un total de 1330 pacientes con una edad media de 49 años (529 hombres y 801 mujeres) habían recibido los tratamientos durante 21 días como máximo y un rango de dosis de 600-1200 mg de dexibuprofeno y 1200-2400 mg de ibuprofeno racémico. El análisis encontró que las características basales de los dos grupos de pacientes no diferían entre sí. En ninguno de los pacientes analizados ocurrió una reacción adversa grave. Hubo 18 abandonos en el grupo tratado con dexibuprofeno (2.4%) y 19 en el grupo tratado con ibuprofeno racémico (3.2%). En la tabla 3 se resumen por sistemas las reacciones adversas mas frecuentes: 19 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Tabla 3: resumen por sistemas de las reacciones adversas mas frecuentes en los ensayos clínicos con dexibuprofeno Sistema Número de reacciones adversas (% de pacientes que los experimentaron) Dexibuprofeno Ibuprofeno racémico (n=747) (n=583) Tracto Gastrointestinal 70 (9.4%) 57 (9.8%) Sistema Nervioso Central 19 (2.5%) 27 (4.6%)* Piel 5 (0.7%) 5 (0.9%) 0 0 Otros 4 (0.5%) 4 (0.7%) Cambios analíticos 19 (2.5%) 26 (3.5%) Total 117 (16%) 119 (20%)* Cardiovascular * p < 0.05. Por sistemas, sólo las reacciones adversas a nivel del Sistema Nervioso Central aparecieron con una frecuencia estadísticamente significativa menor entre los pacientes tratados con dexibuprofeno (2.5% de los pacientes) que en los tratados con ibuprofeno (4.6% de los pacientes). En global la incidencia de reacciones adversas fue significativamente menor con dexibuprofeno. En Austria, uno de los países donde primero se comercializó el fármaco, se hizo un seguimiento, a modo de estudio postcomercialización, de 1400 pacientes con patología reumática tratados y seguidos por 459 médicos durante 30 días. Se identificó un total de 104 reacciones adversas (81 gastrointestinales) y se produjeron 32 abandonos del tratamiento (23 por problemas gastrointestinales) (Phleps, 2001). Un segundo estudio post-comercialización se llevó a cabo en Sudamerica en 5322 pacientes con dismenorrea, cefalea, odontalgia, dolor de garganta-nariz-oído y dolor musculoesquelético tratados con dexibuprofeno a dosis entre 400 y 1200 mg/día durante un tiempo medio de 5,4 días. En este segundo 20 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica estudio se documentaron 428 eventos adversos de los cuales 295 se consideró que eran reacciones adversas al dexibuprofeno (5,5% de los pacientes). Por último, se hizo un seguimiento postcomercialización de 411 pacientes con dolor post-quirúrgicos o post-traumático tratados con dexibuprofeno durante un tiempo medio de 9 días (se administró tabletas con cubierta entérica de 400 mg). Un 6,5% de los pacientes experimentó alguna reacción adversa al fármaco y un 2,7% abandonó el tratamiento e igual a los estudios postcomercialización previos la mayoría de reacciones adversas y causas de retirada del tratamiento eran gastrointestinales. Se asume, y es de hecho la información sobre reacciones adversas que consta en la ficha técnica del producto, que las reacciones adversas de dexibuprofeno deben ser las mismas que las conocidas previamente para ibuprofeno racémico. A continuación, a modo de recordatorio, se indican las reacciones adversas y su frecuencia asociadas al uso de ibuprofeno racémico. Es importante considerar que muchas de las señaladas como menos frecuentes no se han observado todavía con dexibuprofeno o no se han evidenciado con la frecuencia mencionada. 21 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Reacciones adversas descritas para ibuprofeno racémico - Gastrointestinales: Muy habituales (>10%): dispepsia, diarrea. Habituales (>1%-<10%): náuseas, vómitos, dolor abdominal. No habituales (>0.1%-<1%): hemorragias y úlceras gastrointestinales, estomatitis ulcerosa. Raras (<0.1%): perforación gastrointestinal, flatulencia, estreñimiento, esofagitis, estenosis esofágica. Exacerbación de enfermedad diverticular, colitis hemorrágica inespecífica, colitis ulcerosa o enfermedad de Crohn. Si se produjera hemorragia gastrointestinal, podría ser causa de anemia y de hematemesis. - Dermatológica y alérgicas: Habituales (>1%-<10%): erupción cutánea. No habituales (>0.1%-<1%): urticaria, prurito, púrpura (incluida la púrpura alérgica), angioedema, rinitis, broncoespasmo. Raras (<0.1%): reacción anafiláctica. Muy raras (<0.01%): eritema multiforme, necrólisis epidérmica, lupus eritematoso sistémico, alopecia, reacciones de fotosensibilidad, reacciones cutáneas graves como el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica aguda (síndrome de Lyell) y vasculitis alérgica. - Sistema nervioso central: Habituales (>1%, <10%): fatiga o somnolencia, cefalea, mareo, vértigo. No habituales (>0.1% <1%): insomnio, ansiedad, intranquilidad, alteraciones visuales, tinnitus. Raras: reacción psicótica, agitación, irritabilidad, depresión, confusión o desorientación, ambliopía tóxica reversible, trastornos auditivos. Muy raras: meningitis aséptica (véanse reacciones de hipersensibilidad). - Hematológicas: Puede prolongarse el tiempo de sangrado. Los raros casos observados de trastornos hematológicos corresponden a trombocitopenia, leucopenia, granulocitopenia, pancitopenia, agranulocitosis, anemia aplásica o anemia hemolítica. - Cardiovasculares: Se ha comunicado edema periférico asociado al tratamiento con dexibuprofeno. Parece existir una mayor predisposición en los pacientes con hipertensión o trastornos renales a sufrir retención hídrica. Podría aparecer hipertensión o insuficiencia cardíaca (especialmente en pacientes ancianos). - Renales: En base a la experiencia con los AINEs en general, no pueden excluirse casos de nefritis intersticial, síndrome nefrótico e insuficiencia renal. - Hepáticas: En raros casos se han observado anomalías de la función hepática, hepatitis e ictericia con ibuprofeno racémico. - Otras: En muy raros casos podrían verse agravadas las inflamaciones asociadas a infecciones. Hasta la fecha no se han comunicado reacciones de hipersensibilidad generalizada con dexibuprofeno, pero no pueden ser descartadas a la vista de la experiencia clínica con ibuprofeno racémico. Los síntomas podrían incluir fiebre con erupción cutánea, dolor abdominal, cefalea, náuseas y vómitos, signos de alteración hepática e incluso meningitis aséptica. En la mayor parte de los casos en los que se ha comunicado meningitis aséptica con ibuprofeno, el paciente sufría alguna forma de enfermedad autoinmunitaria (como lupus eritematoso sistémico u otras enfermedades del colágeno) lo que suponía un factor de riesgo. En caso de reacción de hipersensibilidad generalizada grave puede aparecer hinchazón de cara, lengua y laringe, broncoespasmo, asma, taquicardia, hipotensión y shock. 22 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Intoxicación - Síntomas: No se han descrito consecuencias fatales incluso tras la administración de dosis únicas elevadas de hasta 54 g de ibuprofeno racémico. La mayoría de casos de sobredosis han sido asintomáticos. Existe un riesgo de sintomatología con dosis > 80-100 mg/kg de ibuprofeno racémico. Los síntomas por sobredosis aparecen habitualmente en un plazo de 4 horas. Los síntomas leves son los más comunes, e incluyen dolor abdominal, náuseas, vómitos, letargia, somnolencia, cefalea, nistagmus, tinnitus y ataxia. Raramente han aparecido síntomas moderados o intensos, como hemorragia gastrointestinal, hipotensión, hipotermia, acidosis metabólica, convulsiones, alteración de la función renal, coma, distress respiratorio del adulto y episodios transitorios de apnea (en niños muy pequeños después de ingerir grandes cantidades). - Tratamiento: sintomático. No se dispone de antídoto específico. Para cantidades que no es probable que produzcan síntomas (menos de 50 mg/kg de dexibuprofeno) se puede administrar agua para reducir al máximo las molestias gastrointestinales. En caso de ingestión de cantidades importantes, deberá administrarse carbón activado. El vaciado del estómago mediante emesis sólo deberá plantearse durante los 60 minutos siguientes a la ingestión. Así, no debe plantearse el lavado gástrico, salvo que el paciente haya ingerido una cantidad de fármaco que pueda poner en compromiso su vida y que no hayan transcurrido más de 60 minutos tras la ingestión del medicamento. El beneficio de medidas como la diuresis forzada, la hemodiálisis o la hemoperfusión resulta dudoso, ya que el dexibuprofeno se une intensamente a las proteínas plasmáticas. 23 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica 2.- Contraindicaciones y precauciones Contraindicaciones - Pacientes con hipersensibilidad conocida al dexibuprofeno, a otros AINEs o a alguno de los excipientes del producto. - Pacientes que hayan experimentado crisis de asma, broncoespasmo, rinitis aguda, urticaria o edema angioneurótico, tras haber utilizado sustancias de acción similar (p.ej., ácido acetilsalicílico u otros AINEs), especialmente en pacientes con pólipos nasales. - Ulcera gástrica o duodenal activa, sospecha de la misma o con antecedentes de úlcera gastrointestinal. - Hemorragia digestiva u otro tipo de hemorragia activa, o con trastornos hemorrágicos. - Enfermedad de Crohn o colitis ulcerosa. - Insuficiencia cardíaca grave. - Insuficiencia renal grave (tasa de filtración glomerular < 30ml/min). - Insuficiencia hepática grave. - Diátesis hemorrágica y otros trastornos de la coagulación, o pacientes que reciban tratamiento anticoagulante. Precauciones - Trastornos gastrointestinales: Se recomienda precaución en las enfermedades o condiciones que predispongan a los pacientes a presentar los efectos adversos gastrointestinales de los AINEs, como el dexibuprofeno. Debido a la posible aparición de trastornos digestivos, especialmente sangrado gastrointestinal, deberá realizarse una cuidadosa vigilancia de estos pacientes cuando se les administre dexibuprofeno u otros AINEs. En general, las consecuencias de las hemorragias o úlceras/perforaciones gastrointestinales son más serias en los pacientes ancianos y pueden producirse en cualquier momento del tratamiento con o sin síntomas de aviso o antecedentes de episodios gastrointestinales graves. En el caso excepcional de que en pacientes tratados con dexibuprofeno 24 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica se produzca hemorragia o úlcera gastrointestinal, deberá suspenderse el tratamiento de inmediato. - Reacciones anafilácticas: Como ocurre con otros AINEs, también pueden producirse reacciones alérgicas, tales como reacciones anafilácticas/anafilactoides, sin exposición previa al fármaco. - Retención de líquidos/edema. En el tratamiento de pacientes con insuficiencia cardíaca, hipertensión, enfermedad hepática o renal, y especialmente durante el tratamiento simultáneo con diuréticos, debe tenerse en cuenta el riesgo de retención de líquidos y de deterioro de la función renal. En caso de ser administrado en estos pacientes, la dosis de dexibuprofeno debe mantenerse lo más baja posible, y vigilar regularmente la función renal. - Lupus eritematoso: los pacientes con lupus eritematoso sistémico y enfermedad mixta del tejido conjuntivo, por su mayor predisposición a sufrir los efectos adversos de los AINEs en el SNC y a nivel renal. - Asma: los AINEs pueden inducir broncoespasmo en este tipo de pacientes. - Efectos renales: los AINEs pueden aumentar los niveles plasmáticos de nitrógeno ureico y de creatinina. Tal como sucede con otros inhibidores de la síntesis de prostaglandinas, el dexibuprofeno puede estar asociado a efectos adversos renales, que pueden dar lugar a nefritis glomerular, nefritis intersticial, necrosis papilar renal, síndrome nefrótico e insuficiencia renal aguda. En general, el empleo habitual de analgésicos, especialmente la combinación de varios de ellos, puede dar lugar a lesiones renales persistentes, con riesgo de insuficiencia renal (nefropatía por analgésicos). - Pruebas hepáticas: Como ocurre con otros AINEs, puede producir aumentos transitorios leves de algunos parámetros hepáticos, así como aumentos significativos de la SGOT y la SGPT. En caso de producirse un aumento importante de estos parámetros, deberá suspenderse el tratamiento. - Al igual que sucede con otros AINEs, el dexibuprofeno puede inhibir de forma reversible la agregación y la función plaquetarias, y prolongar el tiempo de hemorragia. Se recomienda precaución cuando se administre dexibuprofeno concomitantemente con anticoagulantes orales. - Monitorización: Los pacientes sometidos a tratamiento de larga duración con dexibuprofeno deberán ser vigilados como medida de precaución (funciones renal y hepática, función hematológica/recuentos hemáticos). 25 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica - Durante un tratamiento prolongado con dosis elevadas, la toma no prescrita de analgésicos sin seguir las indicaciones recomendadas, puede producir cefaleas que no deben tratarse en ningún caso aumentando la dosis de dexibuprofeno. - Efectos sobre la capacidad para conducir y utilizar maquinaria: Advertir al paciente que, excepcionalmente, este medicamento puede producir mareos o fatiga como efectos adversos provocando una disminución de la capacidad de reacción del paciente, como ocurre al conducir o utilizar maquinaria. 3.- Interacciones La información descrita a continuación se basa en la experiencia previa con ibuprofeno racémico y otros AINEs. En general, los AINEs deben emplearse con precaución cuando se utilizan con otros fármacos que pueden aumentar el riesgo de ulceración gastrointestinal, hemorragia gastrointestinal o disfunción renal. - Anticoagulantes: Los AINEs pueden potenciar los efectos de los anticoagulantes sobre el tiempo de sangrado. Por consiguiente, deberá evitarse el uso simultáneo con estos fármacos. Si ello no fuera posible, deberían realizarse tests de coagulación al inicio del tratamiento con dexibuprofeno, y, si es necesario, ajustar la dosis del anticoagulante. - Metotrexato administrado a dosis de 15 mg/semana o superiores: Si se administran AINEs y metotrexato dentro de un intervalo de 24 horas, puede producirse un aumento del nivel plasmático de metotrexato, con el consiguiente aumento del riesgo de toxicidad por metotrexato. Evitar la asociación en pacientes que reciban tratamiento con metotrexato a dosis elevadas. - Hidantoínas (fenitoína, etc.) y sulfamidas: Los efectos tóxicos de estas sustancias podrían verse aumentados. - Ticlopidina: Los AINEs no deben combinarse con ticlopidina debido al riesgo de un efecto aditivo en la inhibición de la función plaquetaria. - Litio: Los AINEs pueden incrementar los niveles plasmáticos de litio, posiblemente por reducción de su aclaramiento renal. Deberá evitarse su administración conjunta, a menos que se vigilen los niveles de litio. Debe considerarse la posibilidad de reducir la dosis de litio. 26 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica - Otros AINEs: Debe evitarse el uso simultáneo con otros AINEs, pues la administración de diferentes AINEs puede aumentar el riesgo de úlcera gastrointestinal y hemorragias. - Antihipertensivos (incluidos los inhibidores de la ECA o los beta-bloqueantes): Los fármacos antiinflamatorios del tipo AINE pueden reducir la eficacia de los antihipertensivos. El tratamiento simultáneo con AINEs e inhibidores de la ECA puede asociarse al riesgo de insuficiencia renal aguda. - Ciclosporina, tacrolimus: Su administración simultánea con AINEs puede aumentar el riesgo de nefrotoxicidad debido a la reducción de la síntesis renal de prostaglandinas. En caso de administrarse concomitantemente, deberá vigilarse estrechamente la función renal. - Corticosteroides: La administración simultánea de AINEs y corticosteroides puede aumentar el riesgo de úlcera gastrointestinal. - Digoxina: Los AINEs pueden elevar los niveles plasmáticos de digoxina, aumentando así el riesgo de toxicidad por digoxina. - Pentoxifilina: En pacientes que reciben tratamiento con dexibuprofeno en combinación con pentoxifilina puede aumentar el riesgo de hemorragia, por lo que se recomienda vigilar el tiempo de sangrado. - Quinolonas: Se han notificado casos aislados de convulsiones que podrían haber sido causadas por el uso simultáneo de quinolonas y ciertos AINEs. - Sulfonilureas: Los AINEs podrían potenciar el efecto hipoglucemiante de las sulfonilureas, desplazándolas de su unión a proteínas plasmáticas. - Tiazidas, sustancias relacionadas con las tiazidas, diuréticos del asa y diuréticos ahorradores de potasio: Los AINEs pueden contrarrestar el efecto diurético de estos fármacos, y el empleo simultáneo de un AINE y un diurético puede aumentar el riesgo de insuficiencia renal como consecuencia de una reducción del flujo sanguíneo renal. Como ocurre con otros AINEs, el tratamiento concomitante con diuréticos ahorradores de potasio podría ir asociado a un aumento de los niveles de potasio, por lo que es necesario vigilar los niveles plasmáticos de este ion. - Trombolíticos: Podrían aumentar el riesgo de hemorragia. - Zidovudina: Podría aumentar el riesgo de toxicidad sobre los hematíes a través de un efecto sobre los reticulocitos, apareciendo anemia grave una semana después del inicio de la administración del AINE. Durante el tratamiento 27 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica simultáneo con AINEs deberían vigilarse los valores hemáticos, sobre todo al inicio del tratamiento. - Alimentos: La administración de dexibuprofeno junto con los alimentos retrasa la velocidad de absorción (aumento del Tmáx de 2,1 a 2,8 horas). D) Pauta terapéutica e indicaciones Adultos, oral: - Osteoartritis: 300 mg/8-12 h, siendo la dosis máxima por toma de 400 mg de dexibuprofeno. En pacientes con procesos agudos o exacerbaciones, puede aumentarse la dosis temporalmente hasta 1.200 mg/día. Dosis máxima diaria: 1.200 mg. En caso de administración crónica, la dosificación deberá ajustarse a la dosis mínima de mantenimiento que proporcione el control adecuado de los síntomas. Durante el tratamiento inicial, se recomienda administrar dexibuprofeno a la mitad de la dosis recomendada para el ibuprofeno racémico. - Dismenorrea: 300 mg/8-12 h, siendo la dosis máxima por toma de 300 mg. Dosis máxima diaria: 900 mg. - Dolor: dosis inicial, 200 mg de dexibuprofeno por toma y dosis máximas diarias de 600 mg. Dosis en situaciones especiales: - Alteración renal – En pacientes con disfunción renal leve o moderada deberá reducirse la dosis inicial. No se deberá utilizar dexibuprofeno en pacientes con disfunción renal grave. - Alteración hepática – Los pacientes con disfunción hepática leve o moderada deberán iniciar el tratamiento con dosis reducidas y ser cuidadosamente vigilados. No se deberá utilizar dexibuprofeno en pacientes con insuficiencia hepática grave. - Ancianos – Los ancianos parecen ser más susceptibles a los efectos adversos de los AINEs. El riesgo de padecer enfermedad ulcerosa grave esta incrementado en mayores de 65 años, y parece ser dosisdependiente. Además pueden causar retención de líquidos, pudiendo 28 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica producir complicaciones cardiovasculares y reducción de la eficacia de los tratamientos antihipertensivos. Se recomienda precaución en su uso e iniciar la terapia con dosis menores. - Niños y adolescentes– No existen estudios en niños y adolescentes (menores de 18 años). Dado que no se ha establecido su seguridad y eficacia no se recomienda su uso. - Madres lactantes- No se han detectado concentraciones de ibuprofeno en leche materna. La Academia Americana de Pediatría considera el uso de ibuprofeno compatible con la lactancia materna. - Normas para la correcta administración: Los comprimidos recubiertos pueden tomarse solos o con alimentos. En general, es preferible tomar los AINEs (antiinflamatorios no esteroideos) durante las comidas para reducir la irritación gastrointestinal, especialmente durante su uso crónico. No obstante, cabe esperar un ligero retraso en el inicio de la acción terapéutica cuando se administra este medicamento durante o inmediatamente después de las comidas. E) Farmacoeconomía Estudios de Farmacoeconomía No se han publicado hasta la fecha estudios farmacoeconómicos con dexibuprofeno. 29 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica Precios comparativos En la tabla 4 se indica el coste diario de un tratamiento con dexiubprofeno comparado con el de algunos de los fármacos analgésicos disponibles en el mercado español. Tabla 4 - coste diario de un tratamiento analgésico calculado con las dosis iniciales establecidas para algunos de los fármacos mas utilizados en nuestro país. Fármaco Especialidad (Laboratorio) Dosis diaria total Neobufren (Knoll) 1,2 – 2,4 g Comp 600 mg (env 40). 5,63. 0,28 – 0,56 Aspirina (Bayer) 1,5 – 3 g Comp 500 mg (env 20). 2,70. 0,40 – 0,81 Diclofenaco Voltaren (Novartis) 100–150 mg Comp 50 mg (env 40). 6,00. 0,30 – 0,45 Naproxeno Naprosyn (Roche) 1g Comp 500 mg (env 40). 7,66. 0,38 Piroxicam Feldene Feldene Flas (Pfizer) 20 mg Caps 20 mg (env 20). 6,85. Liotabs 20 mg (env 20). 7,18. 0,34 0,36 Metamizol Nolotil (Europharma) 1,5-2 g Caps 575 mg (env 20). 2,78. 0,42 – 0,56 Termalgin (Novartis) 2-3g Comp 500 mg (env 20). 1,42. 0,28 – 0,43 Seractil (Madaus) 600 - 1200 mg Comp recub 300 mg (env 30). 7,52. Comp recub 400 mg (env 30). 9,48. 0,50 – 1,00 Ibuprofeno Acetilsalicílico Paracetamol Dexibuprofeno Envase. Precio (Euros). Coste (Euros) tratamiento/día Los precios considerados son los de especialidades de referencia de cada uno de los productos en el año 2002. De muchos de los productos existen especialidades genéricas que pueden tener precios inferiores a los aquí reseñados. La dosis elegida es la habitual en el uso como analgésicos en el adulto. Existen otras preparaciones de cada uno de los fármacos que pueden tener precios distintos. Precios (PVP IVA incluido) tomados de la Base de datos del medicamento del Consejo General de Colegios Farmacéuticos de España: http://www.portalfarma.com/home.nsf 30 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica F) Conclusiones Dexibuprofeno ó S(+)-ibuprofeno, es el estereoisómero dextro del ibuprofeno. Hasta el momento los datos clínicos disponibles no permiten establecer la existencia de ninguna diferencia clínica relevante ni en eficacia ni en seguridad cuando se compara con ibuprofeno racémico. 31 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica REFERENCIAS BIBLIOGRÁFICAS - Adams SS, Bresloff P, Mason GG. Pharmacological differences between the optical isomers of ibuprofen: evidence for metabolic inversion of the (-)-isomer. J Pharm Pharmacol 1976; 28: 2567. - Bannwarth B, Lapicque F, Pehourcq F, glillet P, Schaeverbeke TK, Laborde C, Dehais J, Gaucher A and Netter P. Stereoselective disposition of ibuprofen enantiomers in human cerebrospinal fluid. Br J Clin Pharmacol 1995; 40: 266-9. - Chen CY, Chen CS. Stereoselective disposition of ibuprofen in patients with compromised renal haemodynamics. Br J Clin Pharmacol. 1995; 40: 67-72. - Davies NM, Wright MR, Russell AS, Jamali F. Effect of the enantiomers of flurbiprofen, ibuprofen and ketoprofen on intestinal permeability. J Pharmaceut Sci 1996;85(11):1170-3. - Day RO, Willians KM, Graham GG, Lee EJ, Knihinicki RD, Hons BS and Champion GD. Stereoselective disposition of ibuprofen enentiomers in synovial fluid. Clin Pharmacol Ther 1988;43:480-7. - Dionne RA and McCullagh L. Enhaced analgesia and suppression of plasma beta-endorphin by the S(+)-isomer of ibuprofen. Clin Pharmacol Ther 1998;63(6):694-701. - Eller N, Kollenz CJ, Schiel H, Kikuta C and Mascher H. Pharmacokinetics of dexibuprofen administered as 200 mg and 400 mg film-coated tablets in healthy volunteers. International J Clin Pharmacol Therapeutics 1998;36(8):414-7. - Evans, AM. Enantioselective pharmacodynamics and pharmacokinetics of chiral non-steroidal anti-inflammatory drugs. Eur J Clin Pharmacol 1992;42:237-56. - Evans AM. Pharmacodynamics and pharmacokinetics of the profens: enantioselectivity, clinical implications, and special reference to S(+)-ibuprofen. J Clin Pharmacol 1996;36:7S-15S. - Evans AM. Comparative pharmacology of S(+)-Ibuprofen and (RS)-Ibuprofen. Clin Rheumatol 2001 (Suppl 1): 9-14. - Fears R. Lipophilic xenobiotic conjugates: the pharmacological and toxicological consequences of the participation of drugs and other foreign compounds as substrates in lipid biosynthesis. Prog Lipid Res. 1985; 24: 177-95. - Geisslinger G, Schuster O, Stock KP, Loew D, Bach GL and Brune K.. Pharmacokinetics of S(+)and R(-)-ibuprofen in volunteers and first clinical experience of S(+)-ibuprofen in rheumatoid arthritis. Eur J Clin Pharmacol 1990;38:493-7. - Hawel R, Klein G, Mitterhuber J, Brugger A. A double-blind study to compare the efficacy and tolerance of dexibuprofen 900 mg with diclofenac sodium in patients with painful osteoarthritis of the knee. Wien Klin Wochenschr 1997; 109: 53-9. - Henz, BM. The pharmacologic profile of desloratadine: a review. Allergy 2001:56;7-13. - Hutt AJ, Caldwell J. The metabolic chiral inversion of 2-arylpropionic acids – a novel route with pharmacological consequences. J Pharm Pharmacol 1983; 35: 693-704. 32 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica - Internal Report Gebro Pharma III/21.3. Study to compare the efficacy and tolerability of dexibuprofen (200/300 mg) versus ibuprofen racemate 400 mg in patients suffering from primary dysmenorrhea. 1998. - Klein G, Neff H, Kullich W, Phleps W, Kollenz CJ. S(+) versus racemic ibuprofen. Lancet. 1992; 339: 681. - Klein G. Isomerischer Ballast: Pharmakologische Spitzfindigkeit oder medizinischer Fortschritt? Therapiewoche Ö¨sterreich, 1993; 8: 652-7. - Klein G, Hawel R, Wallner H, Kullich W. NSAR-Therapie: Schielbt wirksamkeit verträglichkeit aus? Klinische erfahrungen mit dem neuen antirheumatikum dexibuprofen. Der praktische Arzt 1994; 48: 3-7. - Klein G and Hawel R. Comparing efficacy and tolerability of Dexibuprofen versus racemic ibuprofen in a predetermined daily dosage. Internal Final Report II/20. 8P. - Kullich W, Pöllmann G, Zmerekar Ch, Klein G. Stellenwert der bestimmung von pepsinogen I im serum als screeningmethode zur früherkennung gastroduodenaler läsionen und als verlaufskontrolle unter der therapie mit nicht-steroidalen antirheumatika. Z Rheumatol 1991; 50: 39-45. - Kullich W, Wallner H, Klein G. Determination of serum pepsinogen I and II for assessment of gastroduodenal tolerance of S(+) ibuprofen. Wien Klin Wochenschr 1994; 106: 208-11. - Lanas AI, Nerin J, Esteva F, Sainz R. Non-steroidal anti-inflammatory drugs and prostaglandin effects on pepsinogen secretion by dispersed human peptic cells. Gut 1995; 36: 657-63. - Lee EJD, Williamas K, Day R, Graham G and Champion D. Stereoselective disposition of ibuprofen enetiomers in man. Br J Clin Pharmacol 1985;19:669-74. - Levine MA, Walker SE, Paton TW. The effect of food or sucralfate on the bioavailability of S(+) and R(-) enantiomers of ibuprofen J Clin Pharmacol 1992; 32: 1110-4. - Li G, Treiber G, Maier K, Walker S and Klotz U. Disposition of ibuprofen in patients with liver cirrhosis. Stereochemical considerations. Clin Pharmacokinet 1993;25(2):154-63. - Mayer JM. Ibuprofen enantiomers and lipid metabolism. J Clin Pharmacol. 1996 Dec;36(12 Suppl):27S-32S. - Meta-andlysis of adverse drug reactions of performed clinical trials comparing S(+)-ibuprofen with racemic ibuprofen. Study Report (meta-analysis) of adverse drug reactions. 2001. Medical Department Gebro Pharma GmbH. - Phleps W. Overview on clinical data of dexibuprofen. Clin Rheumatol 2001 (Suppl 1): 15-21. - Rahlfs VW and Stat C. Reevaluation of Some Double-Blind, Randomized Studies of Dexibuprofen (Seractil): A State-of-the-Art Overview. Studies in Patients with Lumbar Vertebral Column Syndrome, Rheumatoid Arthritis, Distortion of the Ankle Joint, Gonarthrosis, Ankylosing Spondylitis, and Activated Coxarthrosis. J Clin Pharmacol 1996;36:33S-40S. - Singer F, Mayrhofer F, Klein G, Hawel R and Kollenz CJ. Evaluation of the efficacy and doseresponse relationship of dexibuprofen (S(+)-ibuprofen) in patients with osteoarthritis of the hip and comparison with racemic ibuprofen using the WOMAC osteoarthritis index. Int J Clin Pharmacol Ther 2000;38:15-24. 33 Unidad de Farmacología Clínica Hospital General Universitario de Alicante Dirección General para la Prestación Farmacéutica - Spahn-Langguth H, Benet LZ. Acyl glucuronides revisited: is the glucuronidation process a toxification as well as a detoxification mechanism?. Drug Metab Rev. 1992; 24: 5-47. - Wechter WW. Drug chilarity: on the mechanism of R-aryl propionic acid class NSAIDs. Epimerization in humans and the clinical implications for the use of racemate. J Clin Pharmacol 1992; 34: 1036-42. - Williams K, Day R, Knihinicki R, Duffield A. The stereoselective uptake of ibuprofen enantiomers into adipose tissue. Biochem Pharmacol. 1986; 35: 3403-5. 34