Anexo I Relación de los nombres del medicamento, formas
Anuncio

Anexo I
Relación de los nombres del medicamento, formas farmacéuticas, dosis, vía
de administración, titulares de la autorización de comercialización en los
estados miembros
1
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
GlaxoSmithKline Pharma GmbH
Austria
Albert-Schweitzer-Gasse 6
1140 Wien
Austria
GlaxoSmithKline Pharma GmbH
Austria
Albert-Schweitzer-Gasse 6
1140 Wien
Austria
GlaxoSmithKline s.a. / n.v.
Bélgica
Rue du Tilleul 13
1332 Genval
Bélgica
GlaxoSmithKline s.a. / n.v.
Bélgica
Rue du Tilleul 13
1332 Genval
Bélgica
Bélgica
Dosis
Flolan 0,5 mg 0,5 mg
zur
Infusionsbereitung
Flolan 1,5 mg -
1,5 mg
zur
Infusionsbereitung
Flolan 0.5 mg
solvent for
0,5 mg
solution for
Flolan 1.5 mg
solvent for
1,5 mg
solution for
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/100ml
Vía intravenosa
1,5mg /vial
disolvente para
solución para
disolvente para
solución para
perfusión
infusion
infusion
1,5mg/100ml
solución para
Polvo y
powder and
Bélgica
Vía intravenosa
disolvente para
perfusión
infusion
solution for
0,5mg/50ml
solución para
Polvo y
powder and
1332 Genval
Vía intravenosa
disolvente para
perfusión
mit Lösungsmittel
powder for
(Concentración)
Polvo y
Trockensubstanz
Rue du Tilleul 13
Contenido
administración
perfusión
mit Lösungsmittel
Flolan 1.5 mg
Vía de
farmacéutica
Polvo y
Trockensubstanz
GlaxoSmithKline s.a. / n.v.
Forma
Polvo para
1,5 mg
solución para
perfusión
2
Estado
miembro
UE/EEE
República
Checa
República
Checa
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
The Wellcome Foundation Ltd.,
Flolan 0.5 mg,
Berkeley Avenue 21,
powder and
Greenford, Middlesex,
solvent for
UB6 0NN
solution for
Reino Unido
infusion
The Wellcome Foundation Ltd.,
Flolan 1.5 mg,
Berkeley Avenue 21,
powder and
Greenford, Middlesex,
solvent for
UB6 0NN
solution for
Reino Unido
infusion
Dosis
Dinamarca
Nykaer 68,
2605 Broendby
0,5 mg
Nykaer 68,
2605 Broendby
(Concentración)
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/50ml
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/50ml
Vía intravenosa
0,5mg/50ml
disolvente para
solución para
Polvo y
1,5 mg
disolvente para
solución para
perfusión
Polvo y
Epoprostenol 500
micrograms
0,5 mg
disolvente para
solución para
perfusión
GlaxoSmithKline
Dinamarca
Contenido
administración
perfusión
Dinamarca
Pharma A/S
Vía de
farmacéutica
Polvo y
GlaxoSmithKline
Pharma A/S
Forma
Polvo y
Epoprostenol 1.5
mg
1,5 mg
disolvente para
solución para
perfusión
Dinamarca
Glaxo Wellcome UK Limited trading
as Glaxo Wellcome Operations
Estonia
Glaxo Wellcome House
Berkeley Avenue, Greenford
Polvo y
Flolan
0,5 mg
Middlesex UB6 0NN
disolvente para
solución para
perfusión
Reino Unido
3
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
Laboratoire GLAXOSMITHKLINE
Francia
100, route de Versailles
78163 Marly-le-Roi Cedex
Francia
Laboratoire GLAXOSMITHKLINE
Francia
100, route de Versailles
78163 Marly-le-Roi Cedex
Francia
Dosis
Flolan 0.5 mg,
Forma
Vía de
Contenido
farmacéutica
administración
(Concentración)
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/50ml
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/50ml
Vía intravenosa
0,5mg/50ml
Polvo y
powder and
0,5 mg
solvent for
solution for
disolvente para
solución para
perfusión
injection
Flolan 1.5 mg,
Polvo y
powder and
1,5 mg
solvent for
solution for
disolvente para
solución para
perfusión
injection
Flolan 500
Irlanda
GlaxoSmithKline (Ireland) Limited
micrograms
Stonemasons Way
Powder and
Rathfarnham, Dublin 16
Solvent for
Irlanda
Solution for
Polvo y
0,5 mg
disolvente para
solución para
perfusión
Infusion
GlaxoSmithKline (Ireland) Limited
Irlanda
Stonemasons Way
Rathfarnham, Dublin 16
Irlanda
Flolan 1.5mg
Polvo y
Infusion, powder
1,5 mg
and solvent for
solution for
disolvente para
solución para
perfusión
infusion
The Wellcome Foundation Ltd.
Polvo y
Glaxo Wellcome house
Italia
Berkeley Avenue
Greenford
Flolan
0,5 mg
disolvente para
solución para
perfusión
Middlesex UB6 ONN
Reino Unido
4
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
Dosis
Forma
Vía de
Contenido
farmacéutica
administración
(Concentración)
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/50ml
Vía intravenosa
0,5mg/50ml
Vía intravenosa
1,5mg/100ml
The Wellcome Foundation Ltd.
Glaxo Wellcome house
Italia
Berkeley Avenue
Greenford
Polvo para
Flolan
0,5 mg
solución para
perfusión
Middlesex UB6 ONN
Reino Unido
The Wellcome Foundation Ltd.
Polvo y
Glaxo Wellcome house
Italia
Berkeley Avenue
Greenford
Flolan
1,5 mg
disolvente para
solución para
perfusión
Middlesex UB6 ONN
Reino Unido
GlaxoSmithKline Pharmaceuticals SA
Luxemburgo
2-4-6, Avenue Pascal
B-1330 Wavre
Bélgica
GlaxoSmithKline Pharmaceuticals SA
Luxemburgo
2-4-6, Avenue Pascal
B-1330 Wavre
Bélgica
Flolan 0.5 mg
Polvo y
powder and
0,5 mg
solvent for
solution for
disolvente para
solución para
perfusión
infusion
Flolan 1.5 mg
Polvo y
powder and
1,5 mg
solvent for
solution for
disolvente para
solución para
perfusión
infusion
5
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
Glaxo Wellcome UK Limited
Glaxo Wellcome House
Malta
Berkeley Avenue
Greenford
Middlesex UB6 ONN
Reino Unido
GlaxoSmithKline B.V.
Holanda
Huis ter Heideweg 62
3705 LZ Zeist
Holanda
Dosis
Flolan 0.5mg
Forma
Vía de
Contenido
farmacéutica
administración
(Concentración)
Vía intravenosa
0,5mg/50ml
Vía intravenosa
0,5mg/50ml
Vía intravenosa
0,5mg/100ml
Vía intravenosa
1,5mg/vial
Polvo y
Injection Powder
and solvent for
0,5 mg
solution for
disolvente para
solución para
perfusión
Infusion 0.5mg
Flolan 500
Polvo para
microgram,
0,5 mg
powder for
solución para
perfusión
solution for
infusion
Flolan 500
Holanda
GlaxoSmithKline B.V.
microgram,
Huis ter Heideweg 62
powder and
3705 LZ Zeist
solvent for
Holanda
solution for
Polvo y
0,5 mg
disolvente para
solución para
perfusión
infusion
GlaxoSmithKline B.V.
Holanda
Huis ter Heideweg 62
3705 LZ Zeist
Holanda
Flolan 1500
Polvo para
microgram,
1,5 mg
powder for
solution for
solución para
perfusión
infusion
6
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
Forma
Vía de
Contenido
farmacéutica
administración
(Concentración)
Vía intravenosa
1,5mg/100ml
Vía intravenosa
0,5mg/100ml
Vía intravenosa
1,5mg/100ml
0,5 mg
Polvo y
disolvente para
solución para
perfusión
Vía intravenosa
0,5mg/50ml
0,5 mg
Polvo liofilizado
Vía intravenosa
0,5mg/50ml
Dosis
Flolan 1500
Holanda
GlaxoSmithKline B.V.
microgram,
Huis ter Heideweg 62
powder and
3705 LZ Zeist
solvent for
Holanda
solution for
Polvo y
1,5 mg
disolvente para
solución para
perfusión
infusion
GlaxoSmithKline AS
Polvo y
Forskningsveien 2 A
Noruega
Postboks 180 Vinderen
Flolan
0,5 mg
0319 Oslo
GlaxoSmithKline AS
Polvo y
Forskningsveien 2 A
Postboks 180 Vinderen
Flolan
1,5 mg
0319 OSLO
GlaxoSmithKline, S.A.
P.T.M. - C/ Severo Ochoa, 2
28760 - Tres Cantos
disolvente para
solución para
perfusión
Noruega
España
solución para
perfusión
Noruega
Noruega
disolvente para
Flolan
Madrid
España
Glaxo Wellcome UK Ltd
Stockley Park West
Reino Unido
Uxbridge
Middlesex, UB11 1BT
Flolan 0.5mg
Injection
Reino Unido
7
Estado
miembro
UE/EEE
Titular de la autorización de
Nombre (Marca
comercialización
de fantasía)
Dosis
Glaxo Wellcome UK Ltd
Stockley Park West
Reino Unido
Uxbridge
Middlesex, UB11 1BT
Forma
Vía de
Contenido
farmacéutica
administración
(Concentración)
Vía intravenosa
1,5mg/50ml
Polvo estéril
liofilizado para
Flolan 1.5mg
1,5 mg
Injection
solución para
perfusión
Reino Unido
8
Anexo II
Conclusiones científicas y motivos para la modificación de los términos de
las autorizaciones de comercialización
9
Conclusiones científicas
Introducción
Flolan contiene epoprostenol sódico, que es la sal monosódica del epoprostenol, una prostaglandina
que se produce de forma natural en los vasos sanguíneos y que es un potente inhibidor de la
agregación plaquetaria, así como un potente vasodilatador.
El epoprostenol sódico está indicado en la diálisis renal, cuando el uso de heparina conlleva un alto
riesgo de provocar o agravar las hemorragias. También se utiliza en el tratamiento de la hipertensión
arterial pulmonar (HAP).
Flolan cuenta con autorización en los siguientes Estados miembros: Austria, Bélgica, República Checa,
Dinamarca, Estonia, Francia, Irlanda, Italia, Luxemburgo, Malta, Países Bajos, España, Reino Unido y
Noruega.
Flolan se ha incluido en la lista para la armonización del resumen de las características del producto
(RCP), de acuerdo con el artículo 30, apartado 2, de la Directiva 2001/83/CE. Debido a las decisiones
nacionales divergentes tomadas por los Estados miembros con respecto a la autorización del producto
arriba mencionado (y sus denominaciones asociadas), la Comisión Europea notificó al CHMP/la
Secretaría de la EMA, el 15 de junio de 2011, el establecimiento de un procedimiento de arbitraje
conforme al artículo 30 de la Directiva 2001/83/CE con el fin de solucionar las diferencias en los RCP
autorizados por procedimientos nacionales y, así, armonizar sus distintos RCP, etiquetados y
prospectos en la Unión Europea.
El CHMP evaluó la información sobre el producto armonizada propuesta por el titular de la autorización
de comercialización (TAC), teniendo en cuenta las distintas informaciones nacionales sobre el producto
y los datos científicos existentes, y estudió las indicaciones para cada situación médica en particular.
Flolan está indicado en la HAP y la diálisis renal. El TAC presentó los estudios clínicos disponibles para
ambas indicaciones, junto con datos obtenidos desde la comercialización del producto y artículos
publicados en la literatura médica, y debatió con el CHMP los aspectos relativos tanto a la eficacia
como a la seguridad. Las principales divergencias se encontraron en los siguientes apartados del RCP:
Sección 4.1 - Indicaciones terapéuticas
Esta sección es una de las que se deben armonizar. Las indicaciones autorizadas en los distintos
Estados miembros son: hipertensión arterial pulmonar y diálisis renal. Se solicitó al CHMP que evaluara
los datos disponibles para dichas indicaciones y confirmara el redactado propuesto por el TAC.
El TAC presentó los datos que siguen, procedentes de estudios clínicos, que se debatieron durante la
evaluación de este procedimiento.
Se estudió el tratamiento crónico mediante infusiones continuas de epoprostenol en pacientes con
hipertensión arterial pulmonar (HAP) idiopática o hereditaria en 2 ensayos prospectivos, abiertos y
aleatorizados de 8 y 12 semanas de duración (N = 25 y N = 81, respectivamente) en los que se
comparó epoprostenol más un tratamiento convencional frente al tratamiento convencional solo. El
tratamiento convencional utilizado, que variaba según los pacientes, consistía en: anticoagulantes
prácticamente en todos los pacientes; vasodilatadores orales, diuréticos y digoxina en la mitad a las
dos terceras partes de los pacientes, y oxígeno suplementario aproximadamente en la mitad de los
pacientes. Excepto 2 pacientes de la clase funcional II, todos los demás correspondían a las clases
funcionales III o IV de la New York Heart Association (NYHA). Los resultados fueron similares en
ambos estudios y se describen agrupados. La mediana de los valores basales combinados de la prueba
10
de marcha de 6 minutos (PM6M) para el grupo del tratamiento convencional y para el grupo de
epoprostenol más el tratamiento convencional fue de 266 metros y 301 metros, respectivamente.
Las mejorías respecto a los valores basales en el índice cardíaco (0,33 frente a -0,12 l/min/m2), el
volumen sistólico (6,01 frente a -1,32 ml/latido), la saturación arterial de oxígeno (1,62 frente a 0,85%), la presión arterial pulmonar media (-5,39 frente a 1,45 mm Hg), la presión auricular derecha
media (-2,26 frente a 0,59 mm Hg), la resistencia pulmonar total (-4,52 frente a 1,41 U Wood), la
resistencia vascular pulmonar (-3,60 frente a 1,27 U Wood) y la resistencia vascular sistémica (-4,31
frente a 0,18 U Wood) fueron estadísticamente distintas entre los pacientes que recibieron
epoprostenol de forma crónica y los que no lo recibieron. La presión arterial sistémica media no fue
significativamente distinta entre ambos grupos (-4,33 frente a -3,05 mm Hg). En un estudio abierto y
no aleatorizado, estas mejorías hemodinámicas parecían mantenerse cuando se administraba
epoprostenol durante al menos 36 meses.
Se observó una mejoría estadísticamente significativa (p = 0,001) en la capacidad de realizar ejercicio,
medida con la PM6M, en pacientes que recibieron epoprostenol en infusión intravenosa continua más el
tratamiento convencional durante 8 o 12 semanas (N = 52) comparado con los que solo recibieron el
tratamiento convencional (N = 54) (cambio combinado para las semanas 8 y 12 respecto al momento
basal; mediana: 49 frente a -4 metros; media: 55 frente a -4 metros). Las mejorías ya se observaron
desde la primera semana del tratamiento. Al final del período de tratamiento, en el estudio de 12
semanas, mejoró la supervivencia en los pacientes de las clases funcionales III y IV de la NYHA. De los
40 pacientes que recibieron solo el tratamiento convencional, 8 (el 20%) murieron, mientras que no
falleció ninguno de los los 41 que recibieron epoprostenol (p = 0,003).
Se estudió el tratamiento crónico mediante infusiones continuas de epoprostenol en pacientes con
hipertensión arterial pulmonar asociada a esclerodermia (HAP-E), en un ensayo prospectivo, abierto y
aleatorizado de 12 semanas de duración en el que se comparó epoprostenol más un tratamiento
convencional (N = 56) frente al tratamiento convencional solo (N = 55). Excepto 5 pacientes de la
clase funcional II, todos los demás correspondían a las clases funcionales III o IV de la NYHA. El
tratamiento convencional utilizado, que variaba según los pacientes, consistía en: anticoagulantes
prácticamente en todos los pacientes; oxígeno suplementario y diuréticos en dos terceras partes de los
pacientes; vasodilatadores orales en el 40% de los pacientes y digoxina en una tercera parte de los
pacientes. El criterio de valoración principal de la eficacia en el estudio fue la mejora en la PM6M. La
mediana de los valores basales para el grupo del tratamiento convencional y para el grupo de
epoprostenol más el tratamiento convencional fue de 240 metros y 270 metros, respectivamente. Se
observó un aumento estadísticamente significativo en el índice cardíaco (IC), así como descensos
estadísticamente significativos en la presión arterial pulmonar media (PAP m ), la presión auricular
derecha media (PAD m ), la
resistencia vascular pulmonar (RVP) y la presión arterial sistémica
media (PAS m ) tras 12 semanas de tratamiento en los pacientes que recibieron epoprostenol de forma
crónica respecto a los que no lo recibieron.
Al cabo de 12 semanas, se observó una diferencia estadísticamente significativa (p < 0,001) en el
cambio de la PM6M respecto al momento basal en el grupo que recibió epoprostenol más el
tratamiento convencional, comparado con el grupo que recibió solo el tratamiento convencional
(mediana: 63,5 frente a -36,0 metros; media: 42,9 frente a -40,7 metros).
Las mejorías fueron evidentes en algunos pacientes al final de la primera semana del tratamiento. Los
aumentos en la capacidad de realizar ejercicio se acompañaron de mejorías estadísticamente
significativas de la disnea, medida por el índice de disnea de Borg. En la semana 12, la clase funcional
de la NYHA mejoró en 21 de los 51 pacientes (41%) tratados con epoprostenol, mientras que no
11
mejoró en ninguno de los 48 pacientes que recibieron solo el tratamiento convencional. Sin embargo,
la mayor parte de los pacientes en ambos grupos de tratamiento (28/51 [55%] con epoprostenol y
35/48 [73%] con el tratamiento convencional solo) no mostraron cambios en la clase funcional y
empeoraron 2/51 (4%) del grupo de epoprostenol y 13/48 (27%) del grupo de tratamiento
convencional solo.
En el caso de la diálisis renal, el TAC presentó un resumen de 14 estudios clínicos que investigaron el
uso de epoprostenol en esta situación: 3 estudios cruzados, 6 estudios controlados a gran escala y 5
estudios de urgencia, también conocidos como estudios de acceso expandido.
Dos estudios (el 30 y el 31) abordaron la posibilidad de aparición de refractariedad plaquetaria con el
uso repetido de epoprostenol, lo que reduciría la eficacia de la diálisis con el uso prolongado. Se utilizó
epoprostenol o heparina en cada diálisis: durante 1 mes en el estudio 30 y durante 2 meses en el
estudio 31. No se encontraron indicios de reducción de la eficacia por el uso repetido de epoprostenol o
heparina, como se demostró por la eliminación intradialítica de BUN, creatinina y potasio y los cambios
en el peso corporal.
En los estudios controlados a gran escala y en los estudios de acceso expandido, se produjo
coagulación importante aproximadamente en el 9% (n = 56) de todas las diálisis con epoprostenol y
en < 1% (n = 1) de las diálisis con heparina. La mayor parte de las diálisis con epoprostenol (67%)
que requirieron sustitución del riñón artificial se completaron posteriormente con epoprostenol sin
coagulación. No obstante, 9 de 27 diálisis con epoprostenol no consiguieron realizarse con éxito
después de varios intentos.
Dos de los estudios controlados a gran escala (el 19 y el 27) y los 5 estudios de acceso expandido se
llevaron a cabo para investigar el sangrado durante la diálisis. Se asignó a los pacientes a 1 de 4
grupos de riesgo de sangrado antes de someterse a la primera diálisis del estudio. Se aleatorizó a cada
paciente a una secuencia de diálisis con heparina o epoprostenol y se realizaron hasta 6 diálisis por
entrada en el estudio 19 y hasta 3 diálisis por entrada en el estudio 27.
En los estudios controlados a gran escala se evaluó a pacientes con riesgo muy alto de hemorragia; 12
pacientes se sometieron a 35 diálisis con epoprostenol y 11 pacientes se sometieron a 28 diálisis con
heparina. En los estudios de acceso expandido, 16 pacientes se sometieron a 24 diálisis con
epoprostenol. Cuando se combinaron todas las diálisis para cada tratamiento (heparina o
epoprostenol), hubo más pacientes con heparina que sangraron durante el día anterior a la diálisis (24 a 0 horas), el día de la diálisis (0 a 24 horas) y el día siguiente a la diálisis (24 a 48 horas), en
comparación con epoprostenol durante el mismo período.
Los pacientes con alto riesgo de hemorragia justo antes de su primera diálisis del estudio, pero que
sangraron dentro de los 3 días anteriores, se clasificaron como de alto riesgo de hemorragia. En los
estudios controlados a gran escala, 19 pacientes se sometieron a 51 diálisis con heparina y otros 19
pacientes se sometieron a 44 diálisis con epoprostenol. En los estudios de acceso expandido, 8
pacientes se sometieron a 21 diálisis con epoprostenol.
En los estudios controlados a gran escala, cuando se combinaron todas las diálisis, se observó un
número ligeramente mayor de pacientes con epoprostenol que sangraron durante el día previo a la
diálisis, el día de la diálisis y el día posterior a la diálisis, en comparación con heparina durante el
mismo período. No hubo pruebas coherentes claras de que los pacientes que recibían uno de los dos
tratamientos mejorasen con más frecuencia o empeorasen con menos frecuencia.
En los estudios de acceso expandido, en comparación con la evaluación previa a la diálisis, la
incidencia de sangrados se redujo por lo general en cada diálisis con epoprostenol. En los estudios
12
controlados a gran escala, entre los pacientes que continuaron sangrando, la gravedad generalmente
mejoró con más frecuencia y empeoró con menos frecuencia en los pacientes que recibieron heparina.
En general, estos resultados indican que la diálisis renal con epoprostenol resultó sistemáticamente
beneficiosa en los pacientes con riesgo muy alto de hemorragia. La mayoría de los pacientes dejaron
de sangrar con epoprostenol y, en los que continuaron sangrando, la gravedad del sangrado mejoró
con más frecuencia que en los pacientes dializados con heparina.
Tras debatir los datos sobre la eficacia y seguridad, el CHMP estuvo de acuerdo en las indicaciones
finales de Flolan para la hipertensión arterial pulmonar y la diálisis renal, con el redactado siguiente:
Flolan está indicado para
Hipertensión arterial pulmonar
Flolan está indicado en el tratamiento de la hipertensión arterial pulmonar (HAP) (HAP idiopática
o hereditaria y HAP asociada a enfermedades del tejido conjuntivo) en pacientes con síntomas
correspondientes a las clases III o IV de la OMS para mejorar la capacidad de realizar ejercicio
(véase la sección 5.1).
Diálisis renal
Flolan está indicado para uso en hemodiálisis en situaciones de urgencia cuando el uso de
heparina conlleva un alto riesgo de provocar o agravar las hemorragias o cuando la heparina
está contraindicada por cualquier otro motivo (véase la sección 5.1).
Sección 4.2 - Posología y forma de administración
La sección 4.2 del RCP difería entre los Estados miembros. En algunos casos, estas diferencias se
deben a que las indicaciones son distintas. El uso de Flolan en niños y ancianos no está armonizado.
El CHMP evaluó los datos presentados y recomendó rehacer esta sección para separar la posología de
la administración de epoprostenol para la HAP en la determinación de la dosis a corto plazo
(administración aguda) frente a la administración en infusión continua a largo plazo.
Para la diálisis renal, el CHMP recomendó añadir a la IP que Flolan solo es adecuado para infusión
continua, tanto intravascularmente como en la sangre que pasa por el dializador. También estuvo de
acuerdo en la pauta recomendada para la infusión en adultos.
Sección 4.3 - Contraindicaciones
Hay diferencias en cuanto al redactado de las contraindicaciones entre los Estados miembros, así como
en los detalles que se ofrecen respecto a tales contraindicaciones.
El CHMP evaluó los datos procedentes de los estudios clínicos disponibles, datos obtenidos desde la
comercialización del producto y artículos publicados en la literatura médica, y estuvo de acuerdo con
las siguientes contraindicaciones:
Flolan está contraindicado en pacientes con hipersensibilidad conocida al principio activo o a cualquiera
de los excipientes, así como en pacientes con insuficiencia cardíaca congestiva causada por una
disfunción grave del ventrículo izquierdo. Flolan no debe administrarse en tratamiento crónico a
pacientes que desarrollen edema pulmonar durante la determinación de la dosis.
13
Sección 4.4 - Advertencias y precauciones especiales de empleo
Hay diferencias en cuanto a las advertencias y precauciones especiales de empleo incluidas en la
sección 4.4, así como en los detalles que se ofrecen respecto a tales advertencias y precauciones.
Estas diferencias incluyen acontecimientos producidos durante la infusión, isquemia en pacientes con
angina grave.
El CHMP estuvo de acuerdo en rehacer esta sección y añadir la advertencia relativa a pacientes con
arteriopatía coronaria. También se insistió en la advertencia sobre el aumento de los efectos
hipotensores del epoprostenol debido al tampón de acetato utilizado durante la diálisis renal.
Otras secciones del RCP
Sección 4.6 - Fertilidad, embarazo y lactancia
El CHMP estuvo de acuerdo en la escasez de datos relativos al uso de epoprostenol en mujeres
embarazadas (Schaefer 2007, Reprotox 2010), lo que se reiteró en esta sección del RCP. El CHMP
estuvo también de acuerdo en que, dada la falta de medicamentos alternativos, el epoprostenol puede
utilizarse en aquellas mujeres que decidan proseguir el embarazo, a pesar del riesgo conocido de la
hipertensión arterial pulmonar durante el embarazo. Por último, dado que no hay datos sobre los
efectos del epoprostenol sobre la fertilidad en seres humanos, se añadió esta información al RCP, junto
con los datos obtenidos de los estudios reproductivos en animales, los cuales han demostrado la falta
de efectos sobre la fertilidad.
Sección 4.8 – Reacciones adversas
Los cambios propuestos en la sección 4.8 se basaron principalmente en el perfil de seguridad básico
(PSB) acordado en 2009 durante el procedimiento de división del trabajo del PSUR
(IE/H/PSUR/0018/001).
Dicha información ya estaba disponible en la mayor parte de los Estados miembros y, en general, fue
aceptable. El CHMP solicitó cambios del redactado y aclaraciones en el listado de las RAM.
Se añadió en esta sección el efecto de la sobredosificación sobre la presión arterial.
Sección 5.1 - Propiedades farmacodinámicas
El CHMP estuvo de acuerdo en considerar que, según las últimas directrices relativas a los RCP, debe
añadirse a esta sección la información procedente de estudios clínicos, conocida desde hace tiempo,
que justifique las indicaciones.
Se solicitó al TAC que evaluase todas las demás secciones de los RCP aprobados por procedimientos
nacionales e indicase los cambios pertinentes en aquellos textos en los que hubiese divergencias.
Además, se corrigieron errores tipográficos menores. El CHMP aceptó todos estos cambios.
Etiquetado
El etiquetado se ha actualizado de acuerdo con la última plantilla del QRD, versión 8.
Prospecto
Todos estos cambios en el RCP se correspondieron con algunos cambios en el prospecto. Tras aplicar
las correcciones, se realizaron pruebas de legibilidad que se enviaron y evaluaron durante el
procedimiento de arbitraje. El CHMP aprobó el redactado final del prospecto.
14
Calidad - Módulo 3
El TAC presentó una propuesta para la armonización del módulo Calidad. Se ha presentado de forma
satisfactoria la información sobre el desarrollo, fabricación y control del polvo y el disolvente para
solución de infusión. Los resultados de las pruebas realizadas indican una uniformidad y regularidad
satisfactorias para las características de calidad relevantes, por lo cual se espera que los productos
tengan un rendimiento uniforme y satisfactorio en la práctica clínica. Basándose en la revisión de los
datos, el CHMP aprobó un módulo 3 armonizado.
En resumen, a partir de la evaluación de la propuesta y las respuestas del TAC, y tras los
correspondientes debates del CHMP, este aprobó la información sobre el producto armonizada para
Flolan y las denominaciones asociadas. Se armonizaron en particular las indicaciones y sus
correspondientes recomendaciones posológicas, las advertencias y la información sobre fertilidad,
embarazo y lactancia. También se aprobó el módulo 3 armonizado. A partir de lo expuesto, el CHMP
considera favorable la relación beneficio-riesgo de Flolan y las denominaciones asociadas, y determina
que pueden aprobarse los documentos de información sobre el producto armonizados.
Motivos para la modificación de los términos de las autorizaciones de comercialización
Considerando que
el Comité ha examinado el arbitraje de conformidad con el artículo 30 de la Directiva
2001/83/CE;
el Comité ha examinado las divergencias identificadas para Flolan y las denominaciones
asociadas, en cuanto a indicaciones terapéuticas, posología, contraindicaciones y advertencias;
el Comité ha revisado la información presentada por el TAC, procedente de estudios clínicos,
datos de farmacovigilancia y artículos publicados en la literatura médica, para justificar la
armonización de la información sobre el producto propuesta;
el Comité está de acuerdo en la armonización del resumen de características del producto, el
etiquetado y el prospecto, propuesta por los titulares de la autorización de comercialización;
el CHMP ha recomendado la modificación de los términos de las autorizaciones de comercialización, a
cuyo efecto se incluyen en el anexo III el resumen de las características del producto y el prospecto
para Flolan y las denominaciones asociadas (véase el anexo I).
15
Anexo III
Resumen de las características del producto, etiquetado y prospecto
Nota: Esta versión del RCP, del etiquetado y del prospecto es la válida en el momento de la decisión
tomada por la Comisión.
Una vez tomada esa decisión, las autoridades competentes de los Estados miembros, en contacto con
el Estado miembro de referencia, actualizarán la información del producto según sea necesario. Por
consiguiente, el RCP, el etiquetado y el prospecto que aquí aparecen pueden no representar
necesariamente el texto actual.
16
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO,
ETIQUETADO Y PROSPECTO
17
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
18
1.
NOMBRE DEL MEDICAMENTO
Flolan 0,5 mg polvo y disolvente para solución para perfusión
Flolan 1,5 mg polvo y disolvente para solución para perfusión
2.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Epoprostenol 0,5 mg polvo para solución para perfusión:
Cada vial contiene epoprostenol de sodio equivalente a 0,5 mg de epoprostenol.
Un ml de solución concentrada reconstituida contiene 10.000 nanogramos de epoprostenol (como
epoprostenol de sodio).
Epoprostenol 1,5 mg polvo para solución para perfusión:
Cada vial contiene epoprostenol de sodio equivalente a 1,5 mg de epoprostenol.
Un ml de solución concentrada reconstituida contiene 30.000 nanogramos de epoprostenol (como
epoprostenol de sodio).
La cantidad de sodio contenida en la solución concentrada reconstituida es aproximadamente 55,9 mg.
La cantidad de sodio contenida en el polvo para solución para perfusión es aproximadamente 2,7 mg por
vial.
La cantidad de sodio contenida en el disolvente para uso parenteral es aproximadamente 53,2 mg por vial.
Para consultar la lista completa de excipientes ver sección 6.1.
3.
FORMA FARMACÉUTICA
Polvo para concentrado para solución para perfusión:
Polvo liofilizado blanco o blanquecino
Disolvente para uso parenteral:
Solución transparente, incolora (pH 10,3 – 10,8)
4.
DATOS CLÍNICOS
4.1
Indicaciones terapéuticas
Flolan está indicado para:
Hipertensión Arterial Pulmonar
Flolan está indicado para el tratamiento de la hipertensión arterial pulmonar (HAP) (hipertensión arterial
pulmonar idiopática o heredable e hipertensión arterial pulmonar asociada a enfermedades del tejido
conectivo) en pacientes con síntomas pertenecientes a las Clases funcionales III y IV según la OMS para
mejorar la capacidad de ejercicio (ver sección 5.1).
Diálisis Renal
Flolan está indicado para el uso en hemodiálisis en situaciones de emergencia cuando la utilización de
heparina conlleva un alto riesgo de causar o exacerbar la hemorragia o cuando la heparina está
contraindicada (ver sección 5.1).
19
4.2
Posología y forma de administración
Posología
Epoprostenol está indicado únicamente para perfusión continua por vía intravenosa.
Hipertensión Arterial Pulmonar
El tratamiento sólo debe ser iniciado y supervisado por un médico con experiencia en el tratamiento de la
hipertensión arterial pulmonar.
Búsqueda de dosis de corta duración (aguda):
Este proceso debe realizarse en un hospital con un equipo de reanimación apropiado.
Para determinar la velocidad de perfusión de larga duración se requiere un proceso de búsqueda de dosis
de corta duración administrado bien a través de una línea venosa central o periférica. La velocidad de
perfusión se inicia a 2 nanogramos/kg/min y se aumenta con incrementos de 2 nanogramos/kg/min cada
15 minutos o más hasta que se produzca el beneficio hemodinámico máximo o efectos farmacológicos
limitantes de la dosis.
Si la velocidad de perfusión inicial de 2 nanogramos/kg/min no es tolerada, se debe identificar una dosis
más baja que sea tolerada por el paciente.
Perfusión continua de larga duración:
La perfusión continua de larga duración de Flolan se debe administrar a través de un catéter venoso
central. Se pueden utilizar perfusiones intravenosas periféricas temporales hasta que se establezca el
acceso central. Las perfusiones de larga duración deben iniciarse a 4 nanogramos/kg/min menos que la
velocidad de perfusión máxima tolerada determinada durante la fase de búsqueda de dosis de corta
duración. Si la velocidad de perfusión máxima tolerada es inferior a 5 nanogramos/kg/min, la perfusión de
larga duración debe comenzar a la mitad de la velocidad de perfusión máxima tolerada.
Ajustes de dosis:
Los cambios en la velocidad de perfusión de larga duración se deben basar en la persistencia, recurrencia
o empeoramiento de los síntomas de hipertensión arterial pulmonar en el paciente o en la aparición de
reacciones adversas debidas a dosis excesivas de Flolan.
En general, se debe esperar la necesidad de incrementos en la dosis con respecto a la dosis inicial de larga
duración. Se debe considerar un incremento de dosis si los síntomas de hipertensión arterial pulmonar
persisten o recurren después de una mejoría. La velocidad de perfusión se debe incrementar en 1 a 2
nanogramos/kg/min a intervalos suficientes para permitir la evaluación de la respuesta clínica; estos
intervalos deben ser, de al menos, 15 minutos. Una vez establecida una nueva velocidad de perfusión, se
debe observar al paciente, controlando la presión sanguínea en posición erecta y en posición supina así
como el ritmo cardiaco durante varias horas para asegurar que la nueva dosis es tolerada.
Durante la perfusión de larga duración, la aparición de acontecimientos farmacológicos relacionados con
la dosis, similares a los observados durante el periodo de búsqueda de dosis, puede hacer necesaria una
disminución de la velocidad de perfusión, aunque las reacciones adversas a veces se pueden resolver sin
ajuste de dosis. Las disminuciones de dosis se deben hacer gradualmente con disminuciones de 2
nanogramos/kg/min cada 15 minutos o más hasta que se resuelvan los efectos limitantes de la dosis. Se
deben evitar la retirada brusca de Flolan o grandes reducciones repentinas en las velocidades de perfusión
debido al riesgo de un posible efecto rebote fatal (ver sección 4.4). Excepto en situaciones que representen
20
un riesgo para la vida (por ejemplo inconsciencia, colapso, etc.), las velocidades de perfusión de Flolan se
deben ajustar únicamente bajo indicación de un médico.
Diálisis Renal
Flolan es adecuado sólo para perfusión continua, bien por vía intravascular o en la sangre que alimenta el
dializador.
Se ha visto que el siguiente esquema de perfusión es eficaz en adultos:
Antes de la diálisis: 4 nanogramos/kg/min por vía intravenosa durante 15 minutos.
Durante la diálisis: 4 nanogramos/kg/min en la entrada arterial del dializador.
Se debe suspender la perfusión al final de la diálisis.
La dosis recomendada para diálisis renal sólo se debe sobrepasar con un adecuado control de la presión
sanguínea del paciente.
Pacientes de edad avanzada
No se dispone de información específica sobre el uso de Flolan en pacientes mayores de 65 años para
diálisis renal o hipertensión arterial pulmonar. En general, la selección de dosis para un paciente de edad
avanzada se debe realizar cuidadosamente, reflejando la mayor frecuencia de disminución en las funciones
hepática, renal (en el caso de hipertensión arterial pulmonar) o cardiaca y de enfermedad concomitante o
de otro tratamiento con medicamentos.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de epoprostenol en niños menores de 18 años.
Forma de administración
Preparación de la solución inyectable intravenosa de Flolan
Las soluciones reconstituidas, preparadas en tiempo real, no se deben administrar más allá de las 12 horas
cuando se utilizan a temperatura ambiente (entre 15ºC y 25ºC). Se deben conservar por debajo de 25ºC y
protegidas de la luz.
Es posible refrigerar las soluciones reconstituidas de Flolan, antes de que se usen a temperatura ambiente,
entre 2ºC y 8ºC y sin exceder un periodo de almacenamiento superior a 40 horas. En este caso, las
soluciones no se deben utilizar más allá de las 8 horas cuando se administran a temperatura ambiente.
Se debe examinar la solución reconstituida antes de la administración. Se prohíbe su uso en caso de que
presente partículas o decoloración.
Para consultar las instrucciones de reconstitución y dilución del medicamento antes de la administración,
ver sección 6.6.
Epoprostenol no se debe administrar como inyección en bolo.
4.3
Contraindicaciones
Flolan está contraindicado en pacientes:
con hipersensibilidad conocida al principio activo o a alguno de los excipientes mencionados en la
sección 6.1.
con insuficiencia cardiaca congestiva derivada de una disfunción grave del ventrículo izquierdo.
21
Flolan no se debe utilizar de forma crónica en aquellos pacientes que desarrollen edema pulmonar
durante la fase de búsqueda de dosis.
4.4
Advertencias y precauciones especiales de empleo
Debido al pH elevado de las soluciones finales para perfusión, se debe tener precaución para evitar la
extravasación durante su administración y el riesgo consecuente de daño tisular.
Flolan es un potente vasodilatador pulmonar y sistémico. Los efectos cardiovasculares durante la
perfusión desaparecen en 30 minutos después de finalizar la administración.
Flolan es un potente inhibidor de la agregación plaquetaria, por tanto, se debe considerar un aumento del
riesgo de complicaciones hemorrágicas, especialmente en pacientes con otros factores de riesgo de
sangrado (ver sección 4.5).
Si apareciera una hipotensión excesiva durante la administración de Flolan, se debe reducir la dosis o
interrumpir la perfusión. En caso de sobredosis la hipotensión puede ser profunda y puede ocasionar una
pérdida de conciencia (ver sección 4.9).
Se deben controlar durante la administración de Flolan la presión sanguínea y el ritmo cardiaco.
Flolan puede disminuir o aumentar el ritmo cardiaco. Se piensa que el cambio depende tanto del ritmo
cardiaco basal como de la concentración de Flolan administrada.
Los efectos de Flolan sobre el ritmo cardiaco pueden estar enmascarados por el uso conjunto de otros
medicamentos que afecten a los reflejos cardiovasculares.
Se aconseja extremar la precaución en pacientes con enfermedad arterial coronaria.
Se han notificado casos de niveles de glucosa en suero elevados (ver sección 4.8).
Hipertensión Arterial Pulmonar
Algunos pacientes con hipertensión arterial pulmonar han desarrollado edema pulmonar durante la fase de
búsqueda de dosis, que puede estar relacionado con enfermedad pulmonar veno-oclusiva. Flolan no se
debe utilizar de forma crónica en pacientes que desarrollan edema pulmonar durante el inicio de la dosis
(ver sección 4.3).
Se deben evitar una retirada o una interrupción de la perfusión brusca, excepto en situaciones que
representen un riesgo para la vida. Una interrupción brusca del tratamiento puede provocar un rebote de la
hipertensión arterial pulmonar dando lugar a mareo, astenia, aumento de disnea, y puede conducir a la
muerte (ver sección 4.2).
Flolan se administra en perfusión continua a través de un catéter venoso central permanente mediante una
pequeña bomba de perfusión portátil. En consecuencia, el tratamiento con Flolan requiere el compromiso
por parte del paciente de una reconstitución estéril del fármaco, la administración del fármaco, el cuidado
del catéter venoso central permanente y el acceso a una educación intensa y continua del paciente.
Se debe adoptar una técnica estéril para preparar el fármaco y para el cuidado del catéter. Incluso breves
interrupciones en la administración de Flolan pueden conducir a un rápido deterioro sintomático. La
decisión de administrar Flolan en hipertensión arterial pulmonar debe basarse en la comprensión, por parte
del paciente, de que existe una alta probabilidad de que el tratamiento con Flolan se necesite durante
periodos prolongados, posiblemente años, y se debe considerar cuidadosamente la capacidad del paciente
para aceptar y cuidar un catéter intravenoso permanente y una bomba de perfusión.
22
Diálisis Renal
El efecto hipotensor de Flolan se puede ver incrementado por el uso de tampón acetato en el baño de
diálisis durante la diálisis renal.
Durante la diálisis renal con Flolan se debe asegurar que el gasto cardiaco se incrementa al menos de
forma que no disminuya la liberación de oxígeno al tejido periférico.
Flolan no es un anticoagulante convencional. Flolan ha sido utilizado con éxito en lugar de heparina en
diálisis renal, pero en una pequeña proporción de las diálisis, ha tenido lugar coagulación en el circuito de
ésta, precisándose la interrupción de la misma. Cuando Flolan se utiliza solo, pueden no ser fiables
determinaciones tales como el tiempo de coagulación activado en sangre total.
El disolvente no contiene conservantes; por lo tanto, cada vial debe utilizarse sólo una vez y desecharse
posteriormente.
Este medicamento contiene sodio, lo que deberá tenerse en cuenta en el tratamiento de pacientes con
dietas pobres en sodio.
4.5
Interacción con otros medicamentos y otras formas de interacción
Cuando Flolan se administra a pacientes que reciben anticoagulantes de forma concomitante, se aconseja
una monitorización estándar de los anticoagulantes.
Los efectos vasodilatadores de Flolan pueden aumentar o ser aumentados por el uso concomitante de otros
vasodilatadores.
Como se ha informado con otros análogos de prostaglandinas, Flolan puede reducir la eficacia
trombolítica del activador del plasminógeno tisular (t-PA) por incremento del aclaramiento hepático del tPA.
Cuando se utilizan de forma concomitante AINEs u otros fármacos que afectan la agregación plaquetaria,
puede aumentar el riesgo de hemorragia con Flolan.
Los pacientes tratados con digoxina pueden mostrar elevaciones de las concentraciones de digoxina tras
iniciar el tratamiento con Flolan, lo que, aunque transitorio, puede ser clínicamente significativo en
pacientes propensos a toxicidad con digoxina.
4.6
Fertilidad, embarazo y lactancia
Embarazo
Existen datos limitados relativos al uso de epoprostenol en mujeres embarazadas.
Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad
para la reproducción (ver sección 5.3).
En ausencia de otros medicamentos alternativos, se puede usar epoprostenol en aquellas mujeres que
desean continuar con su embarazo, a pesar del riesgo conocido de hipertensión arterial pulmonar durante
el embarazo.
23
Lactancia
Se desconoce si epoprostenol o sus metabolitos se excretan en leche humana. No se puede excluir un
riesgo para el niño lactante. Se debe interrumpir la lactancia durante el tratamiento con Flolan.
Fertilidad
No hay datos sobre los efectos de epoprostenol sobre la fertilidad en humanos. Los estudios de
reproducción en animales no mostraron efectos dañinos sobre la fertilidad (ver sección 5.3).
4.7
Efectos sobre la capacidad para conducir y utilizar máquinas
La hipertensión arterial pulmonar y el manejo de su tratamiento pueden afectar la capacidad para conducir
y manejar máquinas.
No existen datos relativos al efecto de Flolan utilizado en diálisis renal sobre la capacidad de conducir o
manejar máquinas.
4.8
Reacciones adversas
Las reacciones adversas se enumeran a continuación, clasificadas por sistemas, órganos y frecuencia. Las
frecuencias se definen como: muy frecuentes 1/10 ( 10 %); frecuentes 1/100 y < 1/10 ( 1 % y < 10
%); poco frecuentes 1/1.000 y < 1/100 ( 0,1 % y < 1 %); raras 1/10.000 y < 1/1.000 ( 0,01 % y <
0,1 %); muy raras < 1/10.000 (< 0,01 %) y frecuencia no conocida (no puede estimarse a partir de los
datos disponibles).
Infecciones e infestaciones
Frecuentes
Sepsis, septicemia (generalmente relacionada con el sistema de
administración de Flolan)1
Trastornos de la sangre y del sistema linfático
Disminución del recuento de plaquetas, sangrado en diversas
Frecuentes
localizaciones (por ejemplo pulmonar, gastrointestinal,
epistaxis, intracraneal, postprocedimiento, retroperitoneal)
Trastornos endocrinos
Muy raras
Hipertiroidismo
Trastornos psiquiátricos
Frecuentes
Ansiedad, nerviosismo
Muy raras
Agitación
Trastornos del sistema nervioso
Muy frecuentes
Dolor de cabeza
Trastornos cardiacos
Frecuentes
Taquicardia2, bradicardia3
Trastornos vasculares
Muy frecuentes
Rubor facial (observado incluso en pacientes anestesiados)
Frecuentes
Hipotensión
Muy raras
Palidez
Trastornos respiratorios, torácicos y mediastínicos
Frecuencia no
Edema pulmonar
conocida
Trastornos gastrointestinales
Muy frecuentes
Náuseas, vómitos, diarrea
Cólico abdominal, a veces descrito como malestar abdominal
Frecuentes
Poco frecuentes
Sequedad de boca
24
Trastornos de la piel y del tejido subcutáneo
Frecuentes
Erupción
Poco frecuentes
Sudoración
Trastornos musculoesqueléticos y del tejido conjuntivo
Muy frecuentes
Dolor de mandíbula
Frecuentes
Artralgia
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes
Dolor (inespecífico)
Frecuentes
Dolor en el lugar de la inyección*, dolor torácico
Raras
Infección local*
Muy raras
Enrojecimiento sobre el lugar de perfusión *, oclusión del catéter
intravenoso largo *, desfallecimiento, opresión en el pecho
Investigaciones
Frecuencia no
Aumento de la glucosa en sangre
conocida
* Asociado con el sistema de administración de Flolan.
1
Se han notificado infecciones relacionadas con el catéter causadas por organismos
que no siempre se consideran patógenos (incluidos micrococcus).
2
Se ha descrito taquicardia como respuesta a dosis de Flolan de 5 nanogramos/kg/min
e inferiores.
3
Ha aparecido bradicardia, a veces acompañada de hipotensión ortostática, en
voluntarios sanos, a dosis de Flolan superiores a 5 nanogramos/kg/min. Tras la
administración por vía intravenosa de una dosis de Flolan equivalente a 30
nanogramos/kg/min en voluntarios sanos conscientes, ha aparecido bradicardia
asociada a un descenso considerable en la presión sistólica y diastólica.
4.9
Sobredosis
Es probable que la hipotensión sea la característica principal de la sobredosis.
En general, los acontecimientos observados por causa de una sobredosis de Flolan son una manifestación
exagerada de los efectos farmacológicos del fármaco (por ej. hipotensión y complicaciones de la
hipotensión).
En caso de sobredosis, reducir la dosis o interrumpir la perfusión e iniciar las medidas de apoyo
apropiadas como por ejemplo, expansión del volumen plasmático y/o ajuste del flujo de la bomba.
5.
PROPIEDADES FARMACOLÓGICAS
5.1
Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antitrombóticos; Inhibidores de la agregación plaquetaria excl.
heparina, código ATC: B01AC09.
Mecanismo de acción
Epoprostenol de sodio, la sal monosódica de epoprostenol, es una prostaglandina natural producida por la
capa íntima de los vasos sanguíneos. Epoprostenol es el inhibidor de la agregación plaquetaria más
potente que se conoce. También es un potente vasodilatador.
Muchas de las acciones de epoprostenol se ejercen por estimulación de la adenilatociclasa, lo que conduce
a un incremento de los niveles intracelulares de adenosin 3’5’monofosfato cíclico (AMPc). En las
plaquetas humanas, se ha descrito una estimulación secuencial de la adenilatociclasa, seguida de una
activación de la fosfodiesterasa. Niveles elevados de AMPc regulan las concentraciones intracelulares de
25
calcio por estimulación de su eliminación, inhibiéndose consecuentemente la agregación plaquetaria, por
la reducción del calcio citoplásmico, de lo cual depende la variación de la forma de las plaquetas, el grado
de agregación y la reacción de liberación.
Efectos farmacodinámicos
Se ha demostrado que perfusiones de 4 nanogramos/kg/min durante 30 minutos carecen de efectos
significativos sobre el ritmo cardiaco o la presión sanguínea, aunque puede aparecer rubor facial a estos
niveles.
Hipertensión Arterial Pulmonar
Se ha visto que perfusiones intravenosas de epoprostenol de hasta 15 minutos producen incrementos
relacionados con la dosis en el índice cardiaco (IC) y volumen sistólico (VS), así como disminuciones
relacionadas con la dosis en la resistencia vascular pulmonar (RVP), resistencia pulmonar total (RPT) y
presión arterial sistémica media (PASm). Los efectos de epoprostenol sobre la presión arterial pulmonar
media (PAPm) en pacientes con HAP fueron variables y poco importantes.
Las perfusiones continuas crónicas de epoprostenol en pacientes con hipertensión arterial pulmonar (HAP)
idiopática o heredable se estudiaron en 2 ensayos clínicos prospectivos, abiertos, aleatorizados de 8 y 12
semanas de duración (N=25 y N=81, respectivamente) en los que se comparaba epoprostenol más el
tratamiento convencional frente al tratamiento convencional solo. El tratamiento convencional variaba
entre los pacientes e incluía algunos o todos de los siguientes medicamentos: anticoagulantes en
prácticamente la totalidad de los pacientes; vasodilatadores orales, diuréticos, y digoxina en la mitad o dos
tercios de los pacientes; y oxígeno complementario en aproximadamente la mitad de los pacientes.
Excepto 2 pacientes pertenecientes a la Clase funcional II según la New York Heart Association (NYHA),
todos los pacientes pertenecían bien a la Clase funcional III o a la Clase funcional IV. Como los resultados
fueron similares en los 2 estudios, se describen los resultados agrupados. Los valores basales combinados
de la mediana del test de la marcha de los 6 minutos (TM6M) fueron 266 metros para el grupo de
tratamiento convencional y 301 metros para el grupo de epoprostenol y tratamiento convencional.
Las mejoras respecto a los valores basales en el índice cardiaco (0, 33 vs. -0,12 l/min/m2), el volumen
sistólico (6,01 vs. -1,32 ml/latido), la saturación arterial de oxígeno (1,62 vs. -0,85%), la presión arterial
pulmonar media (-5,39 vs. 1,45 mmHg), la presión auricular derecha media (-2,26 vs. 0,59 mmHg), la
resistencia pulmonar total (-4,52 vs. 1,41 Unidades Wood), la resistencia vascular pulmonar (-3,60 vs.
1,27 Unidades Wood), y la resistencia vascular sistémica (-4,31 vs. 0,18 Unidades Wood) fueron
estadísticamente diferentes entre los pacientes que recibieron epoprostenol de forma crónica y aquellos
que no. La presión arterial sistémica media no fue significativamente diferente entre los dos grupos (-4,33
vs. -3,05 mmHg). En un estudio abierto, no aleatorizado, se ha visto que estas mejoras hemodinámicas
persisten cuando se administra epoprostenol durante al menos 36 meses.
Se observó una mejora estadísticamente significativa en la capacidad del ejercicio (p=0,001), medido por
el TM6M en pacientes que recibieron epoprostenol por vía intravenosa continua junto con el tratamiento
convencional (N=52) durante 8 o 12 semanas en comparación con aquellos que recibieron el tratamiento
convencional solo (N=54) (cambio combinado en la semana 8 y 12 respecto a basal de los valores –
mediana: 49 vs. -4 metros; media: 55 vs. -4 metros). Las mejoras fueron evidentes ya en la primera
semana de tratamiento. Al final del periodo de tratamiento en el estudio de 12 semanas, la supervivencia
mejoró en los pacientes pertenecientes a las Clases funcionales III y IV según NYHA. Ocho de 40
pacientes (20%) que recibieron solo tratamiento convencional murieron, mientras que ninguno de los 41
pacientes que recibió epoprostenol murió (p=0,003).
Se estudiaron pacientes con HAP/Enfermedad de Espectro de la Esclerodermia que recibían perfusiones
continuas de epoprostenol de forma crónica en un ensayo clínico prospectivo, abierto, aleatorizado de 12
semanas de duración que comparaba epoprostenol administrado junto con el tratamiento convencional
(N= 56) frente al tratamiento convencional solo (N= 55). Excepto 5 pacientes pertenecientes a la Clase
26
funcional II según NYHA, todos los pacientes pertenecían bien a la Clase funcional III o a la Clase
funcional IV. El tratamiento convencional variaba entre los pacientes e incluía algunos o todos de los
siguientes medicamentos: anticoagulantes en prácticamente la totalidad de los pacientes; oxígeno
complementario y diuréticos en dos tercios de los pacientes, vasodilatadores orales en el 40% de los
pacientes, y digoxina en un tercio de los pacientes. La variable de eficacia primaria para el estudio fue la
mejora en el TM6M. El valor basal de la mediana para el grupo que recibía el tratamiento convencional y
para el grupo que recibió epoprostenol junto con el tratamiento convencional fue 240 metros y 270 metros,
respectivamente. Se observó un aumento estadísticamente significativo en el IC y una disminución
estadísticamente significativa en la PAPm, PADm, RVP, y PASm tras 12 semanas de tratamiento en los
pacientes que recibieron epoprostenol de forma crónica en comparación con aquellos que no.
Al cabo de 12 semanas, se observó una diferencia estadística (p<0,001) en el cambio respecto a los valores
basales del TM6M en el grupo que recibió epoprostenol y el tratamiento convencional en comparación
con el grupo que recibió el tratamiento convencional solo (mediana; 63,5 vs. -36,0 metros; media: 42,9 vs.
-40,7 metros).
Las mejoras fueron evidentes en algunos pacientes al final de la primera semana de tratamiento. Aumentos
en la capacidad del ejercicio fueron acompañados por mejoras estadísticamente significativas en la disnea,
medido por el Índice de Disnea Borg. En la semana 12, la clase funcional NYHA mejoró en 21 de los 51
(41%) pacientes tratados con epoprostenol en comparación con ninguno de los 48 pacientes tratados con el
tratamiento convencional solo. Sin embargo, no mostraron cambios en la clase funcional más pacientes en
ambos grupos de tratamiento (28/51 [55%] con epoprostenol y 35/48 [73%] con el tratamiento
convencional solo), y empeoraron 2/51 (4%) con epoprostenol y 13/48 (27%) con el tratamiento
convencional solo.
No se observó diferencia estadística en la supervivencia al cabo de 12 semanas en los pacientes con
HAP/Enfermedad de Espectro de la Esclerodermia tratados con epoprostenol en comparación a los que
recibieron el tratamiento convencional solo. Al final del periodo de tratamiento, murieron 4 de 56 (7%)
pacientes que recibieron epoprostenol, mientras que en el grupo que recibió solo el tratamiento
convencional murieron 5 de los 55 (9%) pacientes.
Diálisis Renal
Los efectos de epoprostenol sobre la agregación plaquetaria están relacionados con la dosis cuando se
administran por vía intravenosa entre 2 y 16 nanogramos/kg/min, y se observa una inhibición significativa
de la agregación inducida por la adenosin difosfato a dosis de 4 nanogramos/kg/min y superiores.
Se ha visto que los efectos sobre las plaquetas desaparecen a las 2 horas de la interrupción de la perfusión,
volviendo los cambios hemodinámicos debidos a epoprostenol a los valores iniciales al cabo de 10
minutos de la finalización de perfusiones de 60 minutos entre 1 a 16 nanogramos/kg/min.
Dosis circulantes más elevadas de epoprostenol (20 nanogramos/kg/min) dispersan los agregados de
plaquetas circulantes e incrementan hasta el doble el tiempo de hemorragia cutánea.
Epoprostenol potencia la actividad anticoagulante de heparina en aproximadamente el 50%, posiblemente
reduciendo la liberación del factor neutralizante de heparina.
Seis estudios controlados con heparina y cinco estudios de emergencia exploraron el lugar de epoprostenol
en el manejo general de la diálisis renal, utilizando distintas técnicas. Entre las medidas primarias de
eficacia se incluían eliminación intradiálisis de nitrógeno ureico en sangre (BUN) y creatinina,
eliminación intradiálisis de fluido (ultrafiltración), y coagulación en el circuito extracorpóreo.
En los principales estudios controlados y en los estudios de emergencia se produjeron casos de
coagulación importante (suspensión permanente de la diálisis, o que requirieron cambiar de riñón
artificial) en aproximadamente 9% (N=56) de todas las diálisis con epoprostenol y en <1% (N=1) de las
27
diálisis con heparina. La mayoría de las diálisis de epoprostenol (67%) que requirieron reemplazar el riñón
artificial se completaron posteriormente sin coagulación con epoprostenol. Sin embargo, 9 de 27 diálisis
con epoprostenol no tuvieron éxito después de varios intentos.
Independientemente de las dificultades técnicas, que se produjeron muy raramente con ambos
tratamientos, no se produjeron coagulaciones importantes que limitaran la diálisis en el 93% de todas las
diálisis con epoprostenol y en el 99% de todas las diálisis con heparina.
Se notificaron coagulaciones leves (suficientes como para requerir intervención, pero no suspensión
permanente de la diálisis o cambio del riñón artificial) más frecuentemente durante la diálisis con
epoprostenol que durante la diálisis con heparina. Ninguna de las diálisis que utilizaron heparina y 5%
(N=32) de las diálisis que utilizaron epoprostenol tuvieron casos de coagulaciones leves. Se notificó
coagulación notable (no fue necesario intervención) en otro 31% de las diálisis con epoprostenol y 5% de
las diálisis con heparina.
Para establecer que los pacientes en diálisis renal con riesgo incrementado de sufrir hemorragias
sangraban con menor frecuencia con el uso de epoprostenol que con el uso de heparina, se realizaron dos
estudios principales controlados prospectivamente. Cada paciente fue asignado aleatorizadamente a una
secuencia de diálisis con heparina o epoprostenol y recibieron hasta 6 diálisis por entrada en un estudio y
hasta 3 diálisis por entrada en otro estudio.
El riesgo de hemorragia se definió como:
Riesgo muy alto – presencia de hemorragia activa en el momento del inicio de la diálisis
Riesgo alto – si en los 3 días previos a la diálisis ha tenido una hemorragia activa que se detiene
en la fase previa a la diálisis, o ha sufrido heridas quirúrgicas o traumáticas en los 3 días anteriores
a la diálisis.
En los principales estudios controlados doce pacientes con riesgo muy alto de hemorragia recibieron 35
diálisis con epoprostenol y 11 pacientes recibieron 28 diálisis con heparina. Dieciséis pacientes recibieron
24 diálisis con epoprostenol en estudios de emergencia.
En los principales estudios controlados, cuando todas las diálisis se combinan para cada tratamiento
(heparina o epoprostenol), sangraron más pacientes con heparina durante el día antes de la diálisis
(N=13/17 vs. 8/23), el día de la diálisis (N=25/28 vs. 16/35) y el día siguiente de la diálisis (N=16/24 vs.
5/24) que en los pacientes con epoprostenol durante los mismos periodos de tiempo.
Aquellos pacientes que continuaron sangrando fueron evaluados para determinar los cambios en la
gravedad de la hemorragia. La gravedad de la hemorragia en estos pacientes mejoró más frecuentemente
con epoprostenol el día antes de la diálisis y el mismo día de la diálisis (prediálisis: N=4/8; diálisis:
N=6/16) que con heparina (prediálisis: N=4/13; diálisis: N=4/25). Sin embargo, se observó lo inverso en
los días posteriores a la diálisis con epoprostenol (N=1/5) en comparación con heparina (N=8/16). La
gravedad de la hemorragia empeoró únicamente durante 1 día de diálisis con epoprostenol (N=1/16)
mientras que la gravedad empeoró durante 5 días de diálisis (N=5/25) y 2 días de prediálisis (N=2/13) con
heparina.
Los pacientes que no tuvieron una evidencia clara de sangrado justo antes de su primer estudio de diálisis,
pero que sangraron en los 3 días antes fueron clasificados de alto riesgo de hemorragia. En los principales
estudios controlados, 19 pacientes recibieron 51 diálisis con heparina y 19 pacientes recibieron 44 diálisis
con epoprostenol.
Cuando se combinan todas las diálisis, parece que ligeramente más pacientes con epoprostenol sangraban
durante los días antes de la diálisis (N=12/25 vs. 8/32), el día de la diálisis (23/44 vs. 14/51) y los días
28
después de la diálisis (8/34 vs. 5/44) en comparación a los pacientes tratados con heparina durante el
mismo periodo.
5.2
Propiedades farmacocinéticas
Debido a la inestabilidad química, la elevada potencia y la corta semivida de epoprostenol, no se ha
considerado apropiado ningún análisis preciso y exacto para la cuantificación de epoprostenol en líquidos
biológicos.
Epoprostenol administrado por vía intravenosa, se distribuye rápidamente desde la sangre a los tejidos.
A pH y temperatura fisiológicos normales, epoprostenol se descompone espontáneamente a 6-oxoprostaglandin F 1 alfa, aunque existe cierta degradación enzimática a otros productos.
Tras la administración de epoprostenol radiomarcado a humanos, se encontraron al menos 16 metabolitos,
10 de los cuales fueron identificados estructuralmente.
A diferencia de muchas otras prostaglandinas, epoprostenol no se metaboliza durante su paso por la
circulación pulmonar.
En el hombre, se espera que la semivida de la descomposición espontánea a 6-oxo-prostaglandin F 1 alfa no
supere los 6 minutos, pudiendo ser tan sólo de 2 a 3 minutos, tal y como se ha determinado a partir de
velocidades de degradación in vitro de epoprostenol en sangre humana completa.
Tras la administración de epoprostenol radiomarcado a humanos, las recuperaciones de radiactividad en
orina y heces fueron del 82% y del 4% respectivamente.
5.3
Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los
estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y
toxicidad para la reproducción y el desarrollo. No se han realizado estudios de larga duración en animales
para determinar el potencial carcinogénico de epoprostenol.
6.
DATOS FARMACÉUTICOS
6.1
Lista de excipientes
Polvo para solución para perfusión:
Manitol
Glicina
Cloruro de sodio
Hidróxido de sodio (para ajuste de pH)
Disolvente para uso parenteral:
Glicina
Cloruro de sodio
Hidróxido de sodio (para ajuste de pH)
Agua para preparaciones inyectables
6.2
Incompatibilidades
29
Este medicamento no debe mezclarse con otros fármacos, excepto con los mencionados en la sección 4.2.
6.3
Periodo de validez
Polvo y disolvente para solución para perfusión: 3 años.
Periodo de validez de la solución reconstituida/disolvente para perfusión:
Las soluciones reconstituidas no se deben administrar más allá de las 12 horas cuando se utilizan a
temperatura ambiente (entre 15ºC y 25ºC). Se deben conservar por debajo de 25ºC y protegidas de la luz.
Cuando la bomba de perfusión permita el uso de una bolsa de frío, la solución se puede usar durante un
periodo de 24 horas, siempre que se cambie la bolsa de frío cuando sea necesario durante el día.
Es posible refrigerar las soluciones reconstituidas de Flolan, antes de que se usen a temperatura ambiente,
entre 2ºC y 8ºC y sin exceder un periodo de almacenamiento superior a 40 horas. En este caso, las
soluciones no se deben utilizar más allá de las 8 horas cuando se administran a temperatura ambiente.
6.4
Precauciones especiales de conservación
Polvo para solución para perfusión:
Conservar los viales por debajo de 25ºC. Proteger de la luz. Mantener en un lugar seco. No congelar.
Conservar en el embalaje original.
Disolvente para uso parenteral:
Conservar el disolvente por debajo de 25ºC. No congelar. Proteger de la luz. Conservar en el embalaje
original. El disolvente no contiene conservantes; por lo tanto, cada vial se debe utilizar sólo una vez y
desecharse posteriormente.
La reconstitución y dilución se debe realizar inmediatamente antes de su uso (ver secciones 4.2, 6.3 y 6.6).
Las soluciones de epoprostenol recién preparadas para el tratamiento de la hipertensión arterial pulmonar
se deben usar en las 12 horas siguientes a 25ºC, o bien ser almacenadas durante un periodo no superior a
40 horas entre 2 y 8ºC y posteriormente utilizarse en las 8 horas siguientes a 25ºC. Cuando la bomba de
perfusión permita el uso de una bolsa de frío, la solución de epoprostenol se puede usar durante un periodo
de 24 horas, siempre que se cambie la bolsa de frío cuando sea necesario durante el día.
6.5
Naturaleza y contenido del envase
Polvo para solución para perfusión:
Viales de vidrio (tipo I) transparente con tapón de goma de butilo sintético y un sellado de aluminio con
una tapa desprendible.
Disolvente para uso parenteral:
Viales de vidrio (tipo I) transparente con tapón de goma de butilo sintético y un sellado externo de
aluminio con una tapa de plástico de tipo flip off.
Tamaños de envases:
Hipertensión Arterial Pulmonar
Hay disponibles cuatro envases para su uso en hipertensión arterial pulmonar:
Un vial de 0,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 1,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 0,5 mg de polvo.
Un vial de 1,5 mg de polvo.
30
Diálisis renal
Solo el envase de 0,5 mg es apropiado para el uso en diálisis renal.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6
Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con
él, se realizará de acuerdo con la normativa local.
La estabilidad de las soluciones de Flolan depende del pH. Únicamente se debe utilizar el disolvente
suministrado para la reconstitución de Flolan liofilizado y sólo se deben usar las soluciones de perfusión
recomendadas, en la relación establecida, de lo contrario puede que no se mantenga el pH requerido.
Reconstitución, dilución y cálculo de la velocidad de perfusión:
Se debe tener un cuidado especial en la preparación de la perfusión y en el cálculo de la velocidad de
perfusión. Se debe seguir fielmente el procedimiento descrito a continuación.
La reconstitución y dilución de Flolan se deberá realizar en condiciones asépticas, inmediatamente antes
de la utilización clínica.
Diálisis renal
El envase apropiado para el uso en diálisis renal contiene 0,5 mg de polvo liofilizado de Flolan y 50 ml de
disolvente.
Reconstitución:
1.
Utilizar únicamente el disolvente suministrado para la reconstitución.
2.
Retirar unos 10 ml aproximadamente del disolvente con una jeringa estéril, inyectarlos dentro del
vial que contiene 0,5 mg de Flolan en polvo liofilizado y agitar suavemente hasta que se haya
disuelto el polvo.
3.
Rellenar la jeringa con la solución resultante de Flolan, volver a inyectarla con el volumen
remanente del disolvente y mezclar concienzudamente.
A esta solución se le denomina ahora solución concentrada y contiene 10.000 nanogramos/ml de Flolan.
Sólo esta solución concentrada es adecuada para posterior dilución antes del uso.
Cuando 0,5 mg de Flolan en polvo para perfusión intravenosa se reconstituyen con 50 ml del disolvente, la
inyección final tendrá un pH aproximado de 10,5 y un contenido de ión sodio de unos 56 mg
aproximadamente.
Dilución:
Normalmente, la solución concentrada, se diluye más antes de usar. Se puede diluir con una solución de
cloruro de sodio al 0,9% p/v, siempre que no se sobrepase la proporción de 6 volúmenes de solución de
cloruro de sodio al 0,9% p/v a 1 volumen de solución concentrada, es decir, 50 ml de solución concentrada
posteriormente diluida con un máximo de 300 ml de solución de cloruro de sodio al 0,9% p/v.
Otros fluidos intravenosos comunes no son adecuados para la dilución de la solución concentrada ya que
no se alcanza el pH requerido. Las soluciones de Flolan son menos estables a pH bajo.
Para diluir la solución concentrada, introducirla en una jeringa más grande y luego acoplar la jeringa al
filtro estéril proporcionado.
31
Administrar la solución concentrada directamente en la solución de perfusión elegida a una presión
suficiente pero no excesiva; el tiempo habitual que lleva la filtración de 50 ml de solución concentrada es
de 70 segundos. Mezclar bien. El filtro se debe usar solamente una vez y luego será desechado.
Si se reconstituye y se diluye como se ha descrito anteriormente, las soluciones de perfusión de Flolan
tendrán un pH aproximado de 10 y mantendrán un 90% de su potencia inicial durante unas 12 horas a
25ºC.
Cálculo de la velocidad de perfusión:
La velocidad de perfusión se puede calcular a partir de la siguiente fórmula:
dosis (nanogramos/kg/min) x peso corporal (kg)
Velocidad de perfusión (ml/min) =
concentración de la solución (nanogramos/ml)
Velocidad de perfusión (ml/h) = velocidad de perfusión (ml/min) x 60
Fórmulas de velocidad de perfusión - ejemplos
Cuando se utiliza Flolan en diálisis renal, éste se puede administrar como solución concentrada (a) o en la
forma diluida (b).
a)
Con la solución concentrada, es decir, 10.000 nanogramos/ml de Flolan:
Dosis
Peso corporal (Kilogramos)
(nanogramos
/kg/min)
30
40
50
60
70
80
90
100
1
0,18
0,24
0,30
0,36
0,42
0,48
0,54
0,60
2
0,36
0,48
0,60
0,72
0,84
0,96
1,08
1,20
3
0,54
0,72
0,90
1,08
1,26
1,44
1,62
1,80
4
0,72
0,96
1,20
1,44
1,68
1,92
2,16
2,40
5
0,90
1,20
1,50
1,80
2,10
2,40
2,70
3,00
Velocidades de flujo en ml/hora
b)
Diluido: una dilución utilizada habitualmente es:
10 ml de solución concentrada + 40 ml de solución de cloruro de sodio al 0,9% p/v.
Concentración resultante = 2.000 nanogramos/ml de Flolan:
32
Dosis
Peso corporal (Kilogramos)
(nanogramos
/kg/min)
30
40
50
60
70
80
90
100
1
0,90
1,20
1,50
1,80
2,10
2,40
2,70
3,00
2
1,80
2,40
3,00
3,60
4,20
4,80
5,40
6,00
3
2,70
3,60
4,50
5,40
6,30
7,20
8,10
9,00
4
3,60
4,80
6,00
7,20
8,40
9,60
10,80
12,00
5
4,50
6,00
7,50
9,00
10,50
12,00
13,50
15,00
Velocidades de flujo en ml/hora
Para la administración mediante una bomba capaz de suministrar perfusiones constantes de pequeño
volumen, se pueden diluir alícuotas adecuadas de la solución concentrada con una solución estéril de
cloruro de sodio al 0,9% p/v.
Hipertensión Arterial Pulmonar
Hay cuatro envases disponibles para el uso en hipertensión arterial pulmonar:
Un vial conteniendo polvo liofilizado estéril de Flolan equivalente a 0,5 mg de Flolan, acompañado de
uno o dos viales de 50 ml de disolvente y un filtro.
Un vial conteniendo polvo liofilizado estéril de Flolan equivalente a 1,5 mg de Flolan, acompañado de
uno o dos viales de 50 ml de disolvente y un filtro.
Un vial conteniendo solo polvo liofilizado estéril de Flolan equivalente a 0,5 mg de Flolan.
Un vial conteniendo solo polvo liofilizado estéril de Flolan equivalente a 1,5 mg de Flolan.
Inicialmente se debe utilizar un envase que contenga disolvente para uso parenteral. Durante el
tratamiento crónico de Flolan la solución concentrada final se puede aumentar mediante la adición de otro
vial de polvo liofilizado de 0,5 mg o 1,5 mg de Flolan.
Para aumentar la concentración final de la solución sólo se deben utilizar viales de la misma cantidad que
los incluidos en el envase inicial.
Reconstitución:
Se debe llevar a cabo de acuerdo a las instrucciones descritas para diálisis renal. Cuando un envase que
contiene 1,5 mg de Flolan se reconstituya con 50 ml de disolvente, la concentración resultante es 30.000
nanogramos/ml.
Dilución:
Se puede utilizar Flolan en solución concentrada o en forma diluida en el tratamiento de la hipertensión
arterial pulmonar. Sólo el disolvente suministrado se puede ser utilizar en la dilución posterior de Flolan
reconstituido. La solución de cloruro de sodio al 0,9% p/v no se debe utilizar si se va a administrar Flolan
en el tratamiento de la hipertensión arterial pulmonar. Flolan no se debe administrar con otras soluciones o
medicaciones parenterales cuando se administre en la hipertensión arterial pulmonar.
Para diluir la solución concentrada, introducirla en una jeringa más grande y luego acoplar la jeringa al
filtro estéril proporcionado.
Dispensar la solución concentrada directamente al disolvente utilizando una presión suficiente pero no
excesiva. Normalmente se tardan unos 70 segundos para la filtración de 50 ml de solución concentrada.
Mezclar bien.
El filtro se debe utilizar una sola vez y luego será desechado.
33
Las concentraciones habitualmente utilizadas en el tratamiento de la hipertensión arterial pulmonar son las
siguientes:
5.000 nanogramos/ml – un vial que contiene 0,5 mg de Flolan reconstituido y diluido a un volumen
total de 100 ml en el disolvente.
10.000 nanogramos/ml - dos viales que contienen 0,5 mg de Flolan reconstituido y diluido a un
volumen total de 100 ml en el disolvente.
15.000 nanogramos/ml - 1,5 mg de Flolan reconstituido y diluido a un volumen total de 100 ml en
el disolvente.
Cálculo de la velocidad de perfusión:
La velocidad de perfusión se puede calcular a partir de la fórmula descrita anteriormente para la diálisis
renal. A continuación se citan ejemplos para algunas concentraciones habitualmente utilizadas en la
hipertensión arterial pulmonar.
Velocidades de perfusión para una concentración de 5.000 nanogramos/ml:
Ejemplo de dosificación utilizando una concentración de 5.000 nanogramos/ml
Peso corporal (Kilogramos)
Dosis
(nanogramos/
kg/min)
10
20
30
40
50
60
70
80
2
1,0
1,2
1,4
1,7
1,9
4
1,0
1,4
1,9
2,4
2,9
3,4
3,8
6
1,4
2,2
2,9
3,6
4,3
5,0
5,8
8
1,0
1,9
2,9
3,8
4,8
5,8
6,7
7,7
10
1,2
2,4
3,6
4,8
6,0
7,2
8,4
9,6
12
1,4
2,9
4,3
5,8
7,2
8,6
10,1
11,5
14
1,7
3,4
5,0
6,7
8,4
10,1
11,8
13,4
16
1,9
3,8
5,8
7,7
9,6
11,5
13,4
15,4
Velocidades de flujo en ml/hora
90
2,2
4,3
6,5
8,6
10,8
13,0
15,1
17,3
100
2,4
4,8
7,2
9,6
12,0
14,4
16,8
19,2
Velocidades de perfusión para una concentración de 15.000 nanogramos/ml:
Ejemplo de dosificación utilizando una concentración de 15.000 nanogramos/ml
Dosis
Peso corporal (Kilogramos)
(nanogramos
/kg/min)
30
40
50
60
70
80
90
100
4
6
1,0
1,1
1,3
1,4
1,6
1,0
1,2
1,4
1,7
1,9
2,2
2,4
8
1,0
1,3
1,6
1,9
2,2
2,6
2,9
3,2
10
1,2
1,6
2,0
2,4
2,8
3,2
3,6
4,0
12
1,4
1,9
2,4
2,9
3,4
3,8
4,3
4,8
14
1,7
2,2
2,8
3,4
3,9
4,5
5,0
5,6
16
1,9
2,6
3,2
3,8
4,5
5,1
5,8
6,4
Velocidades de flujo en ml/hora
34
En la administración de Flolan a largo plazo pueden ser necesarias velocidades de perfusión mayores, y
por tanto, soluciones más concentradas.
7.
TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
[Ver Anexo I – Para completar a nivel nacional]
{Nombre y dirección}
<{teléfono}>
<{fax}>
<{e-mail}>
8.
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
[Para completar a nivel nacional]
9.
FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
[Para completar a nivel nacional]
10.
FECHA DE LA REVISIÓN DEL TEXTO
[Para completar a nivel nacional]
35
ETIQUETADO
36
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
ESTUCHE que incluye viales de polvo y viales de disolvente:
Flolan 0,5 mg polvo y disolvente para solución para perfusión
Flolan 1,5 mg polvo y disolvente para solución para perfusión
1.
NOMBRE DEL MEDICAMENTO
Flolan 0,5 mg polvo y disolvente para solución para perfusión
Flolan 1,5 mg polvo y disolvente para solución para perfusión
Epoprostenol
2.
PRINCIPIO(S) ACTIVO(S)
Cada vial contiene epoprostenol de sodio equivalente a 0,5 mg de epoprostenol.
Cada vial contiene epoprostenol de sodio equivalente a 1,5 mg de epoprostenol.
3.
LISTA DE EXCIPIENTES
Polvo para solución para perfusión: manitol, glicina, cloruro de sodio, hidróxido de sodio (para ajuste de
pH)
Disolvente para uso parenteral: glicina, cloruro de sodio, hidróxido de sodio (para ajuste de pH), agua para
preparaciones inyectables
Este medicamento contiene sodio: para mayor información consultar el prospecto
4.
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para perfusión
Polvo para solución para perfusión
Disolvente para uso parenteral
Vial de 0,5 mg de polvo para solución para perfusión, 1 vial de disolvente y un filtro
Vial de 0,5 mg de polvo para solución para perfusión, 2 viales de disolvente y un filtro
Vial de 1,5 mg de polvo para solución para perfusión, 1 vial de disolvente y un filtro
Vial de 1,5 mg de polvo para solución para perfusión, 2 viales de disolvente y un filtro
5.
FORMA Y VÍA(S) DE ADMINISTRACIÓN
Es necesario reconstituir y diluir el polvo antes de la perfusión.
Leer el prospecto antes de utilizar este medicamento.
37
Vía intravenosa
6.
ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Utilizar según las indicaciones del médico.
8.
FECHA DE CADUCIDAD
CAD
Leer el prospecto para consultar el periodo de validez del producto una vez reconstituido/diluido
9.
CONDICIONES ESPECIALES DE CONSERVACIÓN
Polvo para solución para perfusión:
Conservar los viales por debajo de 25ºC. Proteger de la luz. Mantener en un lugar seco. No congelar.
Conservar en el embalaje original.
Disolvente para uso parenteral:
Conservar el disolvente por debajo de 25ºC. No congelar. Proteger de la luz. Conservar en el
embalaje original.
El disolvente no contiene conservantes; por lo tanto, cada vial se debe utilizar sólo una vez y se desechará
posteriormente.
10.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO
CORRESPONDA)
11.
NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
[Ver Anexo I – Para completar a nivel nacional]
{Nombre y dirección}
<{teléfono}>
<{fax}>
<{e-mail}>
12.
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
[Para completar a nivel nacional]
38
13.
NÚMERO DE LOTE
Lote
14.
CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15.
INSTRUCCIONES DE USO
[Para completar a nivel nacional]
16.
INFORMACIÓN EN BRAILLE
[Para completar a nivel nacional]
39
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS
ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA para el vial de disolvente
1.
NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para uso parenteral de Flolan
Vía intravenosa
2.
FORMA DE ADMINISTRACIÓN
Vía intravenosa
Leer el prospecto antes de utilizar este medicamento.
3.
FECHA DE CADUCIDAD
CAD
Leer el prospecto para consultar el periodo de validez del producto una vez reconstituido/diluido
4.
NÚMERO DE LOTE
Lote
5.
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Cada vial contiene 50 ml de disolvente para uso parenteral.
6.
OTROS
40
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS
ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA para el vial de polvo
1.
NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Flolan 0,5 mg polvo para solución para perfusión
Flolan 1,5 mg polvo para solución para perfusión
Vía intravenosa
Epoprostenol
2.
FORMA DE ADMINISTRACIÓN
Vía intravenosa
Leer el prospecto antes de utilizar este medicamento.
3.
FECHA DE CADUCIDAD
CAD
Leer el prospecto para consultar el periodo de validez del producto una vez reconstituido/diluido
4.
NÚMERO DE LOTE
Lote
5.
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Cada vial contiene 0,5 mg de epoprostenol (como epoprostenol de sodio).
Cada vial contiene 1,5 mg de epoprostenol (como epoprostenol de sodio).
6.
OTROS
41
PROSPECTO
42
Prospecto: información para el usuario
Flolan 0,5 mg polvo y disolvente para solución para perfusión
Flolan 1,5 mg polvo y disolvente para solución para perfusión
Epoprostenol
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene
información importante para usted.
Conserve este prospecto, ya que puede tener que volver a leerlo.
Si tiene alguna duda, consulte a su médico, o farmacéutico o enfermero.
Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas
aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico, o farmacéutico o enfermero, incluso si se
trata de efectos adversos que no aparecen en este prospecto.
Contenido del prospecto:
1.
Qué es Flolan y para qué se utiliza
2.
Qué necesita saber antes de empezar a usar Flolan
3.
Cómo usar Flolan
4.
Posibles efectos adversos
5.
Conservación de Flolan
6.
Contenido del envase e información adicional
1.
Qué es Flolan y para qué se utiliza
Flolan contiene el principio activo epoprostenol, el cual pertenece a un grupo de medicamentos
denominados prostaglandinas que evita la coagulación de la sangre y ensancha los vasos sanguíneos.
Flolan se utiliza para tratar una enfermedad del pulmón conocida como “hipertensión arterial pulmonar”.
Esta se produce cuando la presión de los vasos sanguíneos en el pulmón es alta. Flolan ensancha los vasos
sanguíneos para disminuir la presión de la sangre en los pulmones.
Flolan se utiliza para prevenir la coagulación de la sangre durante diálisis renal cuando la heparina no se
puede utilizar.
2.
Qué necesita saber antes de empezar a usar Flolan
No use Flolan
si es alérgico a Flolan o a cualquiera de los demás componentes de este medicamento (incluidos en la
sección 6).
si tiene un fallo del corazón.
si empieza a desarrollar una acumulación de líquido en sus pulmones causando dificultad para respirar
tras el inicio del tratamiento.
Si considera que le aplica alguna de estas situaciones, no use Flolan hasta que haya consultado a su
médico.
Advertencias y precauciones
Antes de empezar a usar Flolan su médico necesita saber:
43
si tiene problemas de sangrado.
Lesión en la piel en el lugar de la inyección
Flolan se inyecta en una vena. Es importante que el medicamento no salga o filtre fuera de la vena a los
tejidos de alrededor. Si lo hace, dañará la piel. Los síntomas son:
sensibilidad
quemazón
picor
hinchazón
enrojecimiento.
Esto puede continuar con la formación de ampollas y descamación de la piel. Es importante que controle
el área de inyección mientras está siendo tratado con Flolan.
Contacte inmediatamente con el hospital si la zona de inyección se vuelve dolorosa, le escuece o se
inflama o nota cualquier formación de ampollas o descamación.
Efecto de Flolan sobre la presión sanguínea y la frecuencia cardiaca
Flolan puede acelerer o enlentecer el latido del corazón. También su presión sanguínea puede volverse
muy baja. Mientras está siendo tratado con Flolan su frecuencia cardiaca y su presión sanguínea deberán
ser controladas. Los síntomas de una baja presión sanguínea incluyen mareo y desmayo.
Informe a su médico si tiene cualquiera de estos síntomas. Puede ser necesario disminuir su dosis o
interrumpir la perfusión.
Uso de Flolan con otros medicamentos
Comunique a su médico o farmacéutico que está tomando, ha tomado recientemente o podría tener que
tomar cualquier otro medicamento, incluso los adquiridos sin receta médica.
Algunos medicamentos pueden afectar al funcionamiento de Flolan, o hacer que sea más probable que
aumenten sus efectos adversos. Flolan también puede afectar al funcionamiento de otros medicamentos si
se toman al mismo tiempo. Entre estos se incluyen:
medicamentos utilizados para tratar la presión sanguínea alta
medicamentos utilizados para evitar la formación de coágulos en la sangre
medicamentos utilizados para disolver los coágulos de la sangre
medicamentos utilizados para tratar la inflamación o el dolor (también llamados AINEs)
digoxina (utilizado para el tratamiento de trastornos cardiacos).
Comunique a su médico o farmacéutico si está tomando alguno de estos medicamentos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de
quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento ya que los
síntomas pueden empeorar durante el embarazo.
Se desconoce si los componentes de Flolan pueden pasar a la leche humana. Debe interrumpir la
lactancia mientras está siendo tratada con Flolan.
Conducción y uso de máquinas
El tratamiento puede afectar a la capacidad para conducir y usar máquinas.
No conduzca o utilice máquinas a menos que se sienta bien.
44
Flolan contiene sodio.
3.
Cómo usar Flolan
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o
farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Su médico le indicará cuánto Flolan es conveniente para usted. La cantidad que se le administra está
basada en su peso corporal y en el tipo de enfermedad. Su dosis puede ser aumentada o disminuida
dependiendo de lo bien que responda al tratamiento.
Flolan se administra mediante perfusión lenta (goteo) en una vena.
Hipertensión arterial pulmonar
El primer tratamiento se le administrará en un hospital. Esto es debido a que el médico necesita
monitorizarle e identificar la mejor dosis para usted.
Se comenzará con una perfusión de Flolan. Se irá aumentando la dosis, hasta que sus síntomas se alivien,
y se controlen los efectos adversos. Una vez se ha identificado la mejor dosis, se colocará un catéter
permanente (vía) en una de sus venas. A continuación podrá ser tratado mediante una bomba para
perfusión.
Diálisis renal
Se le administrará una perfusión de Flolan durante la duración de su diálisis.
Uso de Flolan en casa (únicamente para el tratamiento de hipertensión arterial pulmonar)
Si está siendo tratado en casa, su médico o enfermero le enseñarán cómo debe preparar y usar Flolan. Le
indicarán también cómo debe interrumpir el tratamiento si fuese necesario. La interrupción de Flolan debe
realizarse gradualmente. Es importante que siga cuidadosamente todas las instrucciones.
Flolan viene como un polvo en un vial de vidrio. Antes de usar, el polvo necesita disolverse en el líquido
suministrado. El líquido no contiene conservantes. Deberá desechar cualquier líquido que no utilice.
Cuidado del catéter
Si se le ha colocado un catéter en una vena es muy importante mantener este área limpia, si no podría
infectarse. Su médico o enfermero le enseñarán cómo limpiar el catéter y el área alrededor de este. Es muy
importante que siga cuidadosamente todas las instrucciones.
Si usa más Flolan del que debiera
Busque atención médica urgente si piensa que ha utilizado o se le ha administrado demasiado Flolan.
Los síntomas de sobredosis pueden incluir dolor de cabeza, naúseas, vómitos, latido rápido del corazón,
calor u hormigueo o sensación de que se puede desmayar (sensación de mareo/vértigo).
Si olvidó usar Flolan
No use una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Flolan
La interrupción de Flolan se debe hacer gradualmente. Si interrumpe el tratamiento demasiado rápido
puede tener efectos adversos graves, incluidos mareos, sensación de debilidad y dificultad para respirar. Si
tiene problemas con la bomba de perfusión o el catéter, porque se detiene o impide el tratamiento con
Flolan, póngase inmediatamente en contacto con su médico, enfermera u hospital.
45
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o
enfermero.
4.
Posibles efectos adversos
Al igual que todos los medicamentos, Flolan puede producir efectos adversos, aunque no todas las
personas los sufran.
Informe a su médico o enfermero inmediatamente, ya que estos pueden ser signos de infección de la
sangre o bajada de la presión sanguínea o hemorragias graves:
Siente que su corazón late más deprisa, o que tiene dolor en el pecho o dificultad para respirar.
Siente que está mareado o siente desfallecimiento, especialmente estando de pie.
Tiene fiebre o escalofríos.
Sangra con mayor frecuencia, o durante periodos más prolongados.
Si experimenta efectos adversos, consulte a su médico, farmacéutico, o enfermero, incluso si se trata de
efectos adversos que no aparecen en este prospecto.
Efectos adversos muy frecuentes
Estos pueden afectar a más de 1 de cada 10 personas:
dolor de cabeza
dolor de mandíbula
dolor inespecífico
sentirse mareado (vómitos)
sensación de malestar (náusea)
diarrea
enrojecimiento de la cara (rubor facial)
Efectos adversos frecuentes
Estos pueden afectar hasta 1 de cada 10 personas:
infección de la sangre (septicemia)
latidos rápidos del corazón
latidos lentos del corazón
presión sanguínea baja
sangrado en diversas localizaciones y mayor facilidad de aparición de hematomas, por ejemplo
sangrado por la nariz o encías
malestar o dolor de estómago
dolor de pecho
dolor en las articulaciones
sensación de ansiedad, sensación de nerviosismo
erupción en la piel
dolor en el lugar de la inyección
Efectos adversos frecuentes que pueden aparecer en sus análisis de sangre
disminución del número de plaquetas en la sangre (células de la sangre que ayudan a la coagulación)
Efectos adversos poco frecuentes
Estos pueden afectar hasta 1 de cada 100 personas:
sudoración
sequedad de boca
46
Efectos adversos raros
Estos pueden afectar hasta 1 de cada 1.000 personas:
infección en el lugar de la inyección
Efectos adversos muy raros
Estos pueden afectar hasta 1 de cada 10.000 personas:
sensación de opresión alrededor del pecho
cansancio, debilidad
agitación
palidez
enrojecimiento en el lugar de la inyección
glándulas tiroideas muy activas
oclusión del catéter intravenoso
Otros efectos adversos
No se conoce cuántos pacientes están afectados:
acumulación de líquido en los pulmones (edema pulmonar)
aumento de azúcar (glucosa) en sangre
5.
Conservación de Flolan
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta.
No conservar por encima de 25ºC.
Conservar Flolan en un lugar seco.
Conservar en el estuche original para protegerlo de la luz.
No congelar.
Hipertensión arterial pulmonar
Una vez que el polvo de Flolan se ha disuelto, y diluido, lo ideal es utilizarlo inmediatamente. Si le están
administrando Flolan mediante una bomba para perfusión, se puede utilizar una bolsa de frío para
mantener la temperatura de la solución.
Cuando se utiliza una bolsa de frío, la solución puede conservarse en la bomba hasta 24 horas a 2-8ºC si es
necesario. La bolsa de frío debe cambiarse regularmente a lo largo del día, para mantener la temperatura
de la solución.
Si no está utilizando una bolsa de frío, la solución se puede conservar en la bomba:
hasta 12 horas a 25ºC, si se acaba de preparar
durante un máximo de 8 horas si ha sido preparada previamente y se ha conservado entre 2 y 8ºC.
Diálisis renal
Una vez que Flolan se ha disuelto y diluido, cualquier solución que no se haya utilizado puede conservarse
a 25ºC y usarse en las 12 horas siguientes.
6.
Contenido del envase e información adicional
Composición de Flolan
El principio activo es epoprostenol de sodio. Flolan inyectable viene en diferentes concentraciones.
47
Cada vial contiene bien:
0,5 mg de epoprostenol de sodio
1,5 mg de epoprostenol de sodio.
Los demás componentes son manitol, glicina, cloruro de sodio, hidróxido de sodio y agua para
preparaciones inyectables.
Aspecto del producto y contenido del envase
Inyección:
Flolan es una solución inyectable compuesta de polvo y solución. El polvo es de blanco a blanquecino y la
solución es transparente e incolora.
Hay cuatro envases de Flolan disponibles para el uso en hipertensión arterial pulmonar, el contenido de
cada estuche incluye:
Un vial de 0,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 1,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 0,5 mg de polvo.
Un vial de 1,5 mg de polvo.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
[Ver Anexo I – Para completar a nivel nacional]
{Nombre y dirección}
<{teléfono}>
<{fax}>
<{e-mail}>
<Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con
los siguientes nombres:>
[Ver Anexo I – Para completar a nivel nacional]
Fecha de la última revisión de este prospecto:
[Para completar a nivel nacional]
<----------------------------------------------------------------------------------------------------------------------Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
7.
INFORMACIÓN PARA LOS PROFESIONALES SANITARIOS
Diálisis renal
Solo hay un envase disponible para el uso en diálisis renal:
Un vial de 0,5 mg de polvo y un vial de disolvente.
48
Reconstitución:
1.
Utilizar únicamente el disolvente suministrado para la reconstitución.
2.
Retirar unos 10 ml aproximadamente del disolvente con una jeringa estéril, inyectarlos dentro del
vial que contiene 0,5 mg de Flolan en polvo liofilizado y agitar suavemente hasta que se haya
disuelto el polvo.
3.
Rellenar la jeringa con la solución resultante de Flolan, volver a inyectarla con el volumen
remanente del disolvente y mezclar concienzudamente.
A esta solución se le denomina ahora solución concentrada y contiene 10.000 nanogramos por ml de
Flolan. Sólo esta solución concentrada es adecuada para posterior dilución antes del uso.
Cuando 0,5 mg de Flolan en polvo para perfusión intravenosa sean reconstituidos con 50 ml del
disolvente, la inyección final tendrá un pH aproximado de 10,5 y un contenido de ión sodio de
aproximadamente unos 56 mg.
Dilución:
Normalmente, la solución concentrada se diluye con posterioridad antes de la utilización. Se puede diluir
con una solución de cloruro de sodio al 0,9% p/v, siempre que no se sobrepase la proporción de 6
volúmenes de solución de cloruro de sodio al 0,9% p/v a 1 volumen de solución concentrada, es decir, 50
ml de solución concentrada posteriormente diluida con un máximo de 300 ml de solución de cloruro de
sodio al 0,9% p/v.
Otros fluidos intravenosos comunes no resultan satisfactorios para la dilución de la solución concentrada
ya que no se alcanza el pH requerido. Las soluciones de Flolan son menos estables a pH bajo.
Para diluir la solución concentrada, introducirla en una jeringa más grande y luego acoplar la jeringa al
filtro estéril proporcionado.
Administrar la solución concentrada directamente en la solución de perfusión elegida a una presión
suficiente pero no excesiva; el tiempo habitual que lleva la filtración de 50 ml de solución concentrada es
de 70 segundos. Mezclar bien. El filtro se debe usar solamente una vez y luego será desechado.
Si se reconstituye y se diluye como se ha descrito anteriormente, las soluciones de perfusión de Flolan
tendrán un pH aproximado de 10 y mantendrán un 90% de su potencia inicial durante unas 12 horas a
25ºC.
Cálculo de la velocidad de perfusión:
La velocidad de perfusión se puede calcular a partir de la siguiente fórmula:
dosis (nanogramos/kg/min) x peso corporal (kg)
Velocidad de perfusión (ml/min) =
concentración de la solución (nanogramos/ml)
Velocidad de perfusión (ml/h) = velocidad de perfusión (ml/min) x 60
Para la administración mediante una bomba capaz de suministrar perfusiones constantes de pequeño
volumen, se pueden diluir alícuotas adecuadas de la solución concentrada con una solución estéril de
cloruro de sodio al 0,9% p/v.
Hipertensión arterial pulmonar
49
Hay cuatro envases disponibles para el uso en hipertensión arterial pulmonar:
Un vial de 0,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 1,5 mg de polvo y uno o dos viales de disolvente y un filtro.
Un vial de 0,5 mg de polvo.
Un vial de 1,5 mg de polvo.
Puede que solamente estén comercializados algunos tamaños de envases.
Inicialmente se debe utilizar un envase que contenga disolvente para uso parenteral. Durante el
tratamiento crónico de Flolan la solución concentrada final puede aumentarse mediante la adición de otro
vial de polvo liofilizado de 0,5 mg o 1,5 mg de Flolan.
Para aumentar la concentración final de la solución sólo se deben utilizar viales de la misma cantidad que
los incluidos en el envase inicial.
Reconstitución:
1.
2.
3.
Utilizar únicamente el disolvente suministrado para la reconstitución.
Retirar unos 10 ml aproximadamente del disolvente con una jeringa estéril, inyectarlos dentro del
vial que contiene Flolan en polvo y agitar suavemente hasta que se haya disuelto el polvo.
Rellenar la jeringa con la solución resultante de Flolan, volver a inyectarla con el volumen
remanente del disolvente y mezclar concienzudamente.
A esta solución se le denomina ahora solución concentrada y contiene 10.000 nanogramos por ml de
Flolan (para la concentración de 0,5 mg) o 30.000 nanogramos por ml de Flolan (para la concentración de
1,5). Sólo esta solución concentrada es adecuada para posterior dilución antes del uso. Cuando 0,5 mg de
Flolan en polvo se reconstituyen con 50 ml del disolvente, la inyección final tendrá un pH aproximado de
10,5 y un contenido de ión sodio de aproximadamente unos 56 mg.
Dilución:
Se puede utilizar Flolan en solución concentrada o en forma diluida en el tratamiento de la hipertensión
arterial pulmonar. Sólo el disolvente suministrado se puede utilizar en la dilución posterior de Flolan
reconstituido. La solución de cloruro de sodio al 0,9% p/v no se debe utilizar si se va a administrar Flolan
en el tratamiento de la hipertensión arterial pulmonar. Flolan no se debe administrar con otras soluciones o
medicaciones parenterales cuando se administre en la hipertensión arterial pulmonar.
Para diluir la solución concentrada, introducirla en una jeringa más grande y luego acoplar la jeringa al
filtro estéril proporcionado.
Dispensar la solución concentrada directamente al disolvente utilizando una presión suficiente pero no
excesiva. Normalmente se tardan unos 70 segundos para la filtración de 50 ml de solución concentrada.
Mezclar bien.
El filtro se debe utilizar una sola vez y luego será desechado.
Las concentraciones habitualmente utilizadas en el tratamiento de la hipertensión arterial pulmonar son las
siguientes:
5.000 nanogramos/ml – un vial que contiene 0,5 mg de Flolan reconstituido y diluido a un volumen
total de 100 ml en el disolvente.
10.000 nanogramos/ml - dos viales que contienen 0,5 mg de Flolan reconstituido y diluido a un
volumen total de 100 ml en el disolvente.
15.000 nanogramos/ml - 1,5 mg de Flolan reconstituido y diluido a un volumen total de 100 ml en
el disolvente.
50
Cálculo de la velocidad de perfusión:
La velocidad de perfusión se puede calcular a partir de la siguiente fórmula:
dosis (nanogramos/kg/min) x peso corporal (kg)
Velocidad de perfusión (ml/min) =
concentración de la solución (nanogramos/ml)
Velocidad de perfusión (ml/h) = velocidad de perfusión (ml/min) x 60
En la administración de Flolan a largo plazo pueden ser necesarias velocidades de perfusión mayores, y
por tanto, soluciones más concentradas.
Precauciones especiales de conservación
No conservar por encima de 25ºC.
Conservar el envase dentro del estuche para protegerlo de la luz.
Mantener en un lugar seco.
No congelar.
Cualquier bolsa de frío usada debe ser capaz de mantener la temperatura de la solución reconstituida.
Conservar entre 2 y 8ºC durante todo el periodo de administración.
La reconstitución y dilución se debe llevar a cabo inmediatamente antes de usar.
El disolvente no contiene conservantes; por lo tanto, cada vial se debe utilizar sólo una vez y se desechará
posteriormente.
51

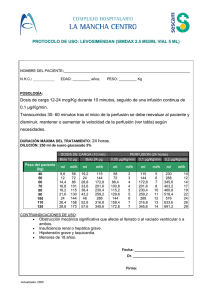






![[ ] INVESTIGACIÓN Paciente con diabetes, hipertensión arterial, ...](http://s2.studylib.es/store/data/000470660_1-d782614fea5040ed4721f34526e3a263-300x300.png)
