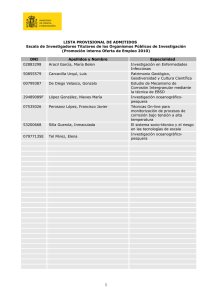
Manual De Apoyo Para El Laboratorio De Electroquímica
Anuncio

Manual De Apoyo Para El Laboratorio De Electroquímica INGENIERIA QUIMICA TRABAJO RECEPCIONAL MEIF TRABAJO PRÁCTICO EDUCATIVO “Manual de apoyo para el laboratorio de electroquímica” PRESENTA: Paola Aurora Morales Amaro DIRECTOR DEL TRABAJO RECEPCIONAL M.C. IQ Ignacio Sánchez Bazán ORIZABA, VER. 2011 1 Manual De Apoyo Para El Laboratorio De Electroquímica 2 Manual De Apoyo Para El Laboratorio De Electroquímica AGRADECIMIENTOS A DIOS Quiero en esta oportunidad agradecer en primer lugar a dios que me conservo con vida, con salud, que me dio paciencia, y me guio y cuido hasta hoy. Sin duda Dios se manifestó en este tiempo puesto que su Espíritu toco mi corazón y me permitió llegar hasta este momento A MI MAMA Al término de esta etapa de mi vida, quiero expresar un profundo agradecimiento a quien con su ayuda, apoyo y comprensión me alentó a logar esta hermosa realidad. Porque eres de esa clase de personas que todo lo comprenden y dan lo mejor de si mismos sin esperar nada a cambio… porque me supiste escuchar y brindar tu ayuda cuando me fue tan necesario, porque de no ser por ti hoy no estaría terminando este sueño. A MIS ABUELOS. A esas dos personas que no pudieron festejar conmigo este momento, pero que sus consejos siempre estuvieron presentes, que siempre me alentaron para no darme por vencida y ahora sé que desde donde se encuentren están muy felices por verme terminar este sueño que también fue de ellos. Los extraño y siempre estarán en mi corazón. A MIS HERMANAS . Porque siempre supieron darme su apoyo y estar conmigo cuando lo necesite, porque también padecieron mis desvelos, mis enojos y nunca se quejaron Porque siempre me dieron su cariño con el cual he logrado culminar mi esfuerzo, terminando así mi carrera profesional, que es para mí la mejor de las herencias. A MI FAMILIA. A Othon que siempre estuvo ahí para darme animo, porque ah sido como un padre para mí y también es parte de este esfuerzo. También agradezco a mis 3 Manual De Apoyo Para El Laboratorio De Electroquímica tíos, tías, primos, primas y sobrinos que siempre me apoyaron y me dieron palabras de aliento para no rendirme. A MI NOVIO.(MARKO) Porque eres una de las personas más importantes en mi vida y porque este camino lo hemos recorrido juntos y todo el esfuerzo de este tiempo también fue gracias a ti, porque nunca me dejaste sola y siempre estuviste para apoyarme en las buenas y en las malas. Por acompañarme todo este tiempo y siempre estar para mí Porque nuestro sueño apenas empieza y espero que sigamos toda la vida juntos. TE AMO A MI MEJOR AMIGA.(ANNEL) Porque este sueño es de las dos y ahora lo estamos cumpliendo, porque llevamos toda una vida juntas y has estado para mí siempre como de las personas que ya no hay en este mundo, porque tu apoyo fue fundamental en mi vida y quiero que siempre tengas presente que te agradezco todo lo que hiciste por mí. Te Quiero Amiga A MIS AMIGOS. A ustedes amigas y amigos que hicieron este camino más fácil, porque los momentos que pasamos juntos jamás los podre olvidar. Recuerden que en mi siempre tendrán una amiga y agradezco a dios haberlos puesto en mi camino. Ana, Erika, Yeye, Madai, Edith, Sarahi, Alejandra, David y jorge, asi como mis amigos de siempre, Armando, Toledo, Adan, Izthel, Jackie, y pedro. A MIS MAESTROS. A usted maestra lupita que fue parte de este logro y por apoyarme siempre y darme esos consejos que me ayudaron tanto. A usted Maestro nacho que me oriento para poder concluir este trabajo, gracias por apoyarme siempre. ¡¡ GRACIAS A TODOS!! 4 Manual De Apoyo Para El Laboratorio De Electroquímica Índice General Introducción: 8 Justificación: 10 Objetivo General: 11 Capítulo 1 12 ELECTROQUIMICA, CORROSION Y CONDUCTIVIDAD 12 1.1 Antecedentes de electroquímica. 1.1.1 Desarrollo histórico de la electroquímica 1.1.2 Fenómenos electroquímicos relevantes 13 13 14 1.2 Fenómenos de transporte iónico 1.2.1 Potenciales Standard 17 18 1.3 Celda electroquímica a) Celda primaria 1.3.1 Origen de la Pila 19 21 22 1.4 Electrodos de medida y de referencia 24 1.5 Corrosión 24 1.6 Mecanismos de la corrosión. 25 1.7 Métodos anticorrosivos 29 c) Selección de materiales 30 a) Recubrimientos Recubrimientos inorgánicos Recubrimientos orgánicos 31 32 32 Alteración por el entorno 32 La Corrosión en la Industria y sus Procesos. 34 1.8 Conductividad eléctrica 34 1.9 Aplicaciones de la conductividad eléctrica. 37 CAPITULO 2 39 PRACTICAS DE LABORATORIO. 39 5 Manual De Apoyo Para El Laboratorio De Electroquímica CAPITULO 3 73 VALIDACION DE PRÁCTICAS 73 Conclusiones 84 Referencias Bibliográficas 85 Páginas Web. 85 6 Manual De Apoyo Para El Laboratorio De Electroquímica Índice de figuras Figura 2.1 Figura 2.2 Figura 2.3 Figura 2.4 Figura 2.5 Figura 2.6 Figura 2.7 Figura 2.8 Figura 2.9 Figura 2.10 Figura 2.11 Figura 2.12 Figura 3.1 Figura 3.2 Figura 3.2 Figura 3.4 Figura 3.5 Figura 3.6 41 43 47 49 51 54 57 59 63 66 68 71 74 76 77 79 81 81 7 Manual De Apoyo Para El Laboratorio De Electroquímica Índice de tablas Tabla 1 Tabla 2 19 28 8 Manual De Apoyo Para El Laboratorio De Electroquímica Introducción: En la actualidad, las aplicaciones de la electroquímica son muy diversas y van desde estudiar la transformación entre la energía eléctrica y la energía química hasta la elaboración de reacciones químicas más complejas. Debido a este amplio campo de investigación y más aun a su enorme importancia en este programa educativo, fue que me di a la tarea de realizar un manual que sea práctico y fácil de entender, en el siguiente párrafo les damos una pequeña reseña de lo que es científicamente la electroquímica, desde sus inicios hasta el día de hoy. Este primer tema se dedica en primer lugar a situar la Electroquímica como Ciencia, estableciendo su campo de acción. A continuación se repasan algunos conceptos de Química General que el alumno debe conocer, lo que nos permitirá situarnos en condiciones de abordar los distintos procesos electroquímicos con más profundidad y que serán necesarios a lo largo de la impartición de este laboratorio. Se continúa el tema con una clasificación de las practicas que aborden algunos temas que se mencionan antes, antecedentes de la electroquímica y con la explicación de los conceptos básicos como son, corrosión y conductividad eléctrica lo que nos permitirá profundizar más en el objeto de la Electroquímica y en la diferenciación de cada una de sus partes, Se acaba este tema con unas prácticas validadas de Electroquímica y dando una relación de los campos de la Ingeniería donde la Electroquímica es de importancia. 9 Manual De Apoyo Para El Laboratorio De Electroquímica Justificación: Actualmente la electroquímica es ampliamente utilizada a nivel universitario y en la industria química. En la electroquímica hay muchas cosas muy complejas que a veces son difíciles de comprender y entender es por eso que en este trabajo quiero hacer un manual que sea muy práctico y de fácil comprensión para que su uso sea con menos complicaciones que con los que nos son facilitados en nuestra facultad. El manual de laboratorio contiene la teoría básica y procedimientos de las prácticas a realizar, algunas hojas adicionales son para la elaboración del reporte final y un cuestionario. Es necesario que el estudiante encuentre una forma más dinámica para llevar a cabo sus prácticas y reportes. Es muy importante que el estudiante lea la práctica y conteste el cuestionario para que se dé una idea de lo que está por hacer en su práctica, es por eso que este manual será más dinámico para su comprensión sea más fácil. Los cuestionarios vendrán anexados en el manual en la parte final de cada practica así el alumno deberá contestar de acuerdo a su experiencia vivida en cada practica. El estudiante podrá escribir los datos de laboratorio obtenidos y elaborar su reporte final detrás de las hojas del procedimiento de la práctica o en las hojas adicionales que aparecen en el manual. El manual de laboratorio es una guía que nos permite llevar a cabo las prácticas que son asignadas de acuerdo a la experiencia educativa que se esté cursando. Se cubren los campos fundamentales de la Electroquímica, a un nivel de principios o fundamentos, pero que a la vez sea lo suficientemente amplio para que pueda servir de base eficaz a los estudios posteriores del alumno en cualquier campo de la Ciencia o de la Técnica, o de herramienta en el desarrollo de su actividad profesional, lo que se conseguirá exponiendo cada tema con claridad y exactitud. 10 Manual De Apoyo Para El Laboratorio De Electroquímica Objetivo General: Ampliar el panorama de las aplicaciones más importantes de la Electroquímica en el área electroanalítica, electrosíntesis industrial, baterías y celdas de combustible y técnicas de vanguardia utilizadas en la caracterización de procesos electroquímicos en superficies de electrodos. 11 Manual De Apoyo Para El Laboratorio De Electroquímica Capítulo 1 ELECTROQUIMICA, CORROSION Y CONDUCTIVIDAD 12 Manual De Apoyo Para El Laboratorio De Electroquímica 1.1 Antecedentes de electroquímica. Es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química En otras palabras, las reacciones químicas que se dan en la interface de un conductor eléctrico llamado electrodo, que puede ser un metal o un semiconductor y un conductor iónico pudiendo ser una disolución y en algunos casos especiales, un sólido. Si una reacción química es conducida mediante una diferencia de potencial aplicada externamente, se hace referencia a una electrólisis. En cambio, si la caída de potencial eléctrico, es creada como consecuencia de la reacción química, se conoce como un acumulador de energía eléctrica, también llamado batería o celda galvánica. Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o en caso contrario, son producidos como consecuencia de ella. En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidación y reducción encontrándose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito eléctrico. Esto último es motivo de estudio de la química analítica, en una subdisciplina conocida como análisis potenciométrico. 1.1.1 Desarrollo histórico de la electroquímica Es muy difícil conocer el nacimiento de la electroquímica, pues existen evidencias que indican, la existencia de baterías y acumuladores de energía eléctrica, desde la antigüedad. Todo ello sumado a los aportes de Charles François de Cisternay du Fay quien creó la teoría de la polaridad, Benjamin Franklin quien descubrió la electricidad atmosférica, Charles Augustin de Coulomb en 1781 y los estudios de Joseph Priestley 13 Manual De Apoyo Para El Laboratorio De Electroquímica en Inglaterra, se logró pavimentar el camino para el nacimiento científico de la electroquímica. Galvani pensó que esta nueva fuerza vital, era una nueva forma de generación de electricidad natural, además de las ya conocidas por el hombre como la existente en los truenos y relámpagos o en algunos animales como la anguila eléctrica o las rayas eléctricas. Años más tarde todo ello desembocaría en el descubrimiento de la termoelectricidad por Thomas Johann Seebeck. Para mediados del siglo XIX, el modelamiento y estudio de la electroquímica, se vieron aclarados por Michael Faraday quien creó las leyes de la electrolisis y John Daniell. Hacia finales de siglo, dicha disciplina comenzó a influenciar campos tan importantes como las teorías de conductividad de electrolitos, presentado por Svante August Arrhenius y Friedrich Ostwald y subsecuentemente en el modelamiento matemático de las baterías por Walther Hermann Nernst. A partir del siglo XX, la electroquímica permitió el descubrimiento de la carga del electrón por Millikan, y el establecimiento de la moderna teoría de ácidos y bases de Brønsted y Lowry, así como el estudio de disciplinas tan importantes como las áreas médicas y biológicas con la electroforesis, desarrollada por Arne Tiselius en 1937. (Brckrs, Reddy, 2003) 1.1.2 Fenómenos electroquímicos relevantes Reacciones de reducción-Oxidación Las reacciones de reducción-oxidación son las reacciones de transferencia de electrones. Esta transferencia se produce entre un conjunto de elementos químicos, uno oxidante y uno reductor una forma reducida y una forma oxidada respectivamente. En dichas reacciones la energía liberada de una reacción espontánea se convierte en electricidad o bien se puede aprovechar para inducir una reacción química no espontánea. 14 Manual De Apoyo Para El Laboratorio De Electroquímica Balanceo de las ecuaciones Redox Las reacciones electroquímicas se pueden balancear por el método ión-electrón donde la reacción global se divide en dos semirreacciones una de oxidación y otra de reducción, se efectúa el balance de carga y elemento, agregando H+, OH−, H2O y/o electrones para compensar los cambios de oxidación. Antes de empezar a balancear se tiene que determinar en qué medio ocurre la reacción, debido a que se procede de una manera en particular para cada medio. Medio Ácido Se explicará por medio de un ejemplo, cuando una sal magnésica reacciona con bismutato de sodio que se describe en la ecuación 1.1 El primer paso es escribir la reacción sin balancear: Mn2(aq)+NaBiO3(s) Bi3+(aq)+MnO4-(aq) ………………………………...........…..… (1.1) Luego se divide en dos semirreacciones: Semireaccion de oxidación: Mn2+ (aq) MnO4- (aq)… ………………………………………………..…........……. (1.2) Semireaccion de reducción: BiO3-(s) Bi3+ (aq)…………………………………………………………........….… (1.3) Cada semirreación se balancea de acuerdo con el número y tipo de átomos y cargas. Como estamos en medio ácido los iones H+ se agregan para balancear los átomos de H y se agrega H2O para balancear los átomos de O. 4H2O (l) + Mn2+(aq)+8H+ (aq) + 5e- ………………………...……….........……...…….(1.4) Finalmente se multiplica cada semirreacción por un factor para que se cancelen los electrones cuando se sumen ambas semireacciones. 10e- + 30H+ (aq) + 5BiO3- (s) 5Bi3+(aq) + 15H2O(l) …………………….........….. (1.5) 8H2O (l) + 2Mn2+ (aq) 2MnO4- (aq) + 16H+ (aq) + 10e- ……...........…...…………. (1.6) 15 Manual De Apoyo Para El Laboratorio De Electroquímica Reacción Balanceada: 14H+(aq)+2Mn2+(aq)+5NaBiO3(s)7H2O(l)+2MnO4-(aq)+5Bi3+(aq)+5Na+(aq)…….….(1.7) En algunos casos es necesario agregar contra iones para terminar de balancear la ecuación. Para este caso, si se conociera el anión de la sal magnésica, ese sería el contra ión. Se agrega por igual de ambos lados de la ecuación lo necesario para terminar de balancearla. Medio Alcalino También se explicará por medio de un ejemplo, cuando el Permanganato de potasio reacciona con el Sulfito de sodio. El primer paso es escribir la reacción sin balancear: Reacción sin balancear: KMnO4 + Na2SO3 + H2O MnO2 + Na2SO4 + KOH ……………....……………. (1.8) Luego se divide en dos semirreacciones: Semireaccion de reducción: MnO4- MnO2 ………………………………………………..…………....…………(1.9) Semireaccion de oxidacion: SO32- SO42- ………………………………....…………………….………………(1.10) Cada semirreación se balancea de acuerdo con el número y tipo de átomos y cargas. Como estamos en medio alcalino los OH− se agregan para balancear los átomos de H y normalmente se agrega la mitad de moléculas de H2O del otro lado de la semirreacción para balancear los átomos de O. 3e- + 2H2O + MnO4- MnO2 + 4OH- ……………………………….....…………. (1.11) 2OH- + SO32- SO42- + H2O + 2e- ……………………………………….....…… (1.12) Finalmente se multiplica cada semirreación por un factor para que se cancelen los electrones cuando se sumen ambas semireacciones. 16 Manual De Apoyo Para El Laboratorio De Electroquímica Ecuación balanceada: 6e- + 4H2O + 2MnO4- 2MnO2 + 8OH- ………………………….....…………… (1.13) 6OH- + 3SO32- 3SO42- + 3H2O + 6e- …………….…………….....……………. (1.14) Reacción Balanceada: 2KMnO4 + 3Na2SO3 + H2O 2MnO2 + 3Na2SO4 + 2KOH…………….........… (1.15) En este caso se agregaron contra iones para terminar de balancear la ecuación (los cationes K+ y Na+). (Garritz, Chamizo, 1998) 1.2 Fenómenos de transporte iónico Los fenómenos de transporte son aquellos procesos en los que hay una transferencia neta o transporte de materia, energía o momento lineal en cantidades grandes o macroscópicas. Estos fenómenos físicos tienen rasgos comunes que pueden ser descritos mediante la ecuación diferencial para la propagación unidimensional a) La conducción eléctrica en los metales No todos los materiales conducen la electricidad de la misma forma. Para diferenciarlos, decimos que algunos presentan mayor resistencia que otros a conducir la electricidad. La resistencia eléctrica es una medida cuantitativa respecto de cuán buen conductor es un material. La resistencia eléctrica se mide en ohmios, en honor a Georg Simon Ohm (1787-1854), que desarrolló los principios agrupados en la ley de Ohm. A los materiales que presentan baja resistencia eléctrica se les llama buenos conductores eléctricos. A su vez, a aquellos que poseen alta resistencia eléctrica se les denomina malos conductores eléctricos. Cambios en la resistencia. 17 Manual De Apoyo Para El Laboratorio De Electroquímica b) La conducción eléctrica en los electrolitos. La conductividad en medios líquidos está relacionada con la presenciade sales en solución, cuya disociación genera iones positivos y negativos capaces de transportar la energía eléctrica si se somete el líquido a un campo eléctrico. Estos conductores iónicos se denominan electrolitos o conductores electrolíticos.Las determinaciones de la conductividad reciben el nombre de determinaciones conductométricas y tienen muchas aplicaciones. Como por ejemplo: 1. En la electrolisis, ya que el consumo de energía eléctrica en este proceso depende en gran medida de ella. 2. En los estudios de laboratorio para determinar el contenido de sales de varias soluciones durante la evaporación del agua. 3. En el estudio de las basicidades de los ácidos, puesto que pueden ser determinadas por mediciones de la conductividad. 4. Para determinar las solubilidades de electrolitos escasamente solubles y para hallar concentraciones de electrolitos en soluciones por titulación. La base de las determinaciones de la solubilidad es que las soluciones saturadas de electrólitos escasamente solubles pueden ser consideradas como infinitamente diluidas. Midiendo la conductividad específica de semejante solución y calculando la conductividad equivalente según ella, se halla la concentración del electrólito, es decir, su solubilidad. (Damaskin, Petry, 1981). 1.2.1 Potenciales Standard En la tabla de potenciales estándar se utiliza para determinar el potencial electroquímico o el potencial de un electrodo de una celda electroquímica o de una celda galvánica. 18 Manual De Apoyo Para El Laboratorio De Electroquímica Estos potenciales de reducción vienen dados en relación de un electrodo estándar de hidrogeno. Los valores de los potenciales estándar de reducción que se presentan en la tabla son en condiciones normales o estándar, es decir, a una temperatura de 25°C/298K, una presión de 1atm/100Pa y en una solución acuosa con una concentración de 1 M. A continuación se presenta una tabla de potenciales estándar donde se encuentra los electrodos más usados, el proceso catódico y los valores de cada uno. Tabla 1 potenciales Standard [1] POTENCIALES DE REDUCCIÓN Electrodo Proceso reducción catódico de Li+|Li Li + e = Li -3,045 K+|K K+ + e = K -2,925 Ca2+|Ca Ca2+ + 2e = Ca -2,866 Na+|Na Na+ + e = Na -2,714 Mg2+|Mg Mg2+ + 2e = Mg -2,363 Al3+|Al Al3+ + 3e = Al -1,662 Mn2+|Mn Mn2+ + 2e = Mn -1,179 Eo(volt) 1.3 Celda electroquímica La Celda Electroquímica es el dispositivo utilizado para la descomposición mediante corriente eléctrica de sustancias ionizadas denominadas electrolitos. También se conoce como celda galvánica o voltaica, en honor de los científicos Luigi Galvani y Alessandro Volta, quienes fabricaron las primeras de este tipo a fines del S. XVIII. Las celdas electroquímicas tienen dos electrodos: El Ánodo y el Cátodo. El ánodo se define como el electrodo en el que se lleva a cabo la oxidación y el 19 Manual De Apoyo Para El Laboratorio De Electroquímica cátodo donde se efectúa la reducción. Los electrodos pueden ser de cualquier material que sea un conductor eléctrico, como metales, semiconductores. También se usa mucho el grafito debido a su conductividad y a su bajo costo. Para completar el circuito eléctrico, las disoluciones se conectan mediante un conductor por el que pasan los cationes y aniones, conocido como puente de sal. Los cationes disueltos se mueven hacia el Cátodo y los aniones hacia el Ánodo. La corriente eléctrica fluye del ánodo al cátodo por que existe una diferencia de potencial eléctrico entre ambos electrolitos. Esa diferencia se mide con la ayuda de un voltímetro y es conocida como el voltaje de la celda. También se denomina fuerza electromotriz (fem) o bien como potencial de celda. Celdas de investigación En una celda galvánica donde el ánodo sea una barra de Zinc y el cátodo sea una barra de Cobre, ambas sumergidas en soluciones de sus respectivos sulfatos, y unidas por un puente salino se le conocen como Pila de Daniell. Sus semireacciones son estas: Reacción Anódica: Zn(s) Zn2+ (aq) + 2e- …………........……………………………………..… (1.16) Reacción Catódica: Cu2+ (aq) + 2e- Cu(s)…………………………........…..…………….……… (1.17) Reaccion Neta: Zn(s) + Cu2+ (aq) Cu(s) + Zn2+ (aq)………….………………...………….… (1.18) La notación convencional para representar las celdas electroquímicas es un diagrama de celda. En condiciones normales, para la pila de Daniell el diagrama sería: Zn(s) Zn2+ (1M) [Cu2+(1M)]Cu(s) ………………………..…………………….. (1.20) 20 Manual De Apoyo Para El Laboratorio De Electroquímica La línea vertical representa el límite entre dos fases. La doble línea vertical representa el puente salino. Por convención, el ánodo se escribe primero a la izquierda y los demás componentes aparecen en el mismo orden en que se encuentran al moverse de ánodo a cátodo. Potenciales estándar de reducción: Es posible calcular el potencial estándar de reducción de una celda determinada comparando con un electrodo de referencia. Básicamente el cálculo relaciona el potencial de reducción con la redox H2 2H+(aq)+ 2e- . Arbitrariamente se le asignó el valor cero al electrodo de Hidrógeno, cuando se encuentra en condiciones estándar. La reacción se lleva a cabo burbujeando gas hidrógeno en una disolución de HCl, sobre un electrodo de Platino. Las condiciones de este experimento se denominan estándar cuando la presión de los gases involucrados es igual a 1 Atm., trabajando a una temperatura de 25 °C y las concentraciones de las disoluciones involucradas son igual a 1M. En este caso se denota que: 2H+(aq)(1M)+2e- H2(1Atm) ………………...………………………. (1.21) E°=0,0000V a) Celda primaria Una celda primaria es un tipo especial de celda electroquímica en la cual la reacción no puede ser revertida, y las identidades del ánodo y cátodo son, por lo tanto, fijas. El cátodo siempre es el electrodo positivo. La celda puede ser descargada pero no recargada. b) Celda secundaria Una celda secundaria, una batería recargable por ej. Es una celda en que la reacción es reversible. Cuando la celda está siendo cargada, el ánodo se convierte en el electrodo positivo (+) y el cátodo en el negativo (-). 21 Manual De Apoyo Para El Laboratorio De Electroquímica Esto también se aplica para la celda electrolítica. Cuando la celda está siendo descargada, se comporta como una celda primaria o voltaica, con el ánodo como electrodo negativo y el cátodo como positivo. (Harper, 1994) 1.3.1 Origen de la Pila En 1780 Luis Galvani, profesor de anatomía de la Universidad de Bolonia, Italia, al realizar un experimento, observó que las ancas de una rana recién muerta se crispaban y pataleaban al tocárselas con dos barras de metales diferentes. La explicación del fenómeno la dio poco tiempo después Alejandro Volta, quien descubrió que la causa de tales movimientos crispantes de las ancas de la rana se hallaban en el paso de una corriente eléctrica producida por los dos metales diferentes; investigó como producir electricidad por reacciones químicas y en 1800, después de una amplia experimentación, inventó un dispositivo que se conoce como pila voltaica. Colocó una serie de pequeñas placas de zinc y plata, en pares, una arriba de la otra, separando cada par de placas por una tela humedecida con agua salada; el conjunto produjo una corriente eléctrica y fue este el origen de la primera pila eléctrica. Pronto la perfeccionó reemplazándola por una pila de dos elementos; cobre y zinc, sumergidos en una solución de ácido sulfúrico contenida en un recipiente. En esta sencilla forma de pila primaria, las placas de zinc y de cobre están separadas por el electrolito. Si se conectan con un alambre, la corriente eléctrica fluye a través del conductor, pero tan pronto como el circuito se interrumpe porque el alambre se desconecta, deja de fluir. Esta pila no dura indefinidamente, ya que el ácido sulfúrico ataca al zinc, y cuando éste se consume, la pila se agota. Para reactivarla, será necesario reponer la placa de cinc y el ácido del electrólito. Debido a las reacciones químicas que tienen lugar dentro de la pila, se desprenden pequeñas burbujas de hidrógeno que se adhieren al electrodo de cobre y forman una capa 22 Manual De Apoyo Para El Laboratorio De Electroquímica aislante; cuando esto sucede, la corriente no pasa y se dice que la pila está polarizada. Para eliminar este inconveniente, se agregan ciertas sustancias químicas que se combinan con el hidrógeno y evitan los efectos polarizantes. [3] a) Definición De Pila. Se denomina pila a un sistema en el que la energía química de una reacción química es transformada en energía eléctrica que hace funcionar a los aparatos. Se clasifican en: Baterías. Pilas Primarias. Pilas secundarias. Acumuladores. Pilas botón, pilas de oxido de mercurio y oxido de plata. [4] Pilas de potencia Hay dos maneras de producir electricidad para aplicarla a usos prácticos: bien mediante máquinas llamadas dinamos o generadores de corriente eléctrica, cuando se trata de un consumo apreciable para instalaciones fijas; o bien mediante el empleo de baterías de pilas secas o de acumuladores, si se trata de aparatos portátiles o vehículos automóviles. Una pila transforma la energía química en energía eléctrica; parte de esa energía química se transforma en calor o energía calorífica y el resto en corriente eléctrica. Pilas Galvánicas: Una aplicación realmente útil de lo visto antes, es aprovechar el traspaso de electrones en forma espontánea. Esto se puede hacer por medio de un hilo conductor, pero se debe tener en cuenta el mantener separados los átomos de 23 Manual De Apoyo Para El Laboratorio De Electroquímica cobre de los de plata para, de esta forma, evitar la entrega directa de electrones. La conocida pila galvánica o voltaica, es un generador de corriente eléctrica que se produce por el flujo espontáneo de electrones desde el electrodo 1 al electrodo 2. El electrodo 1 toma carga negativa al recibir los electrones cedidos por los átomos de cobre. En cambio, el electrodo 2, del que los iones Ag+ retiran electrones, toma carga positiva. (Gómez, Alcaraz, 2004) 1.4 Electrodos de medida y de referencia Un electrodo es una placa de membrana rugosa de metal, un conductor utilizado para hacer contacto con una parte no metálica de un circuito.A continuación de nombran los electrodos más comunes. 1. Electrodos para fines médicos, como EEG, EKG, ECT, desfibrilador. 2. Electrodos para técnicas de electrofisica en investigación biomédica. 3. Electrodos para ejecución en silla eléctrica. 4. Electrodos para galvanoplastia. 5. Electrodos para soldadura. 6. Electrodos para protección catódica. 7. Electrodos inertes para hidrólisis, los cuales son hechos de platino. 8. Electrodos para puesta a tierra, también conocidos como pica o jabalina. 9. Ultramicroelectrodo. (Castellan, 1987) 1.5 Corrosión Se entiende por corrosión la interacción de un metal con el medio que lo rodea, produciendo el consiguiente deterioro en sus propiedades tanto físicas como químicas. Las características fundamentales de este fenómeno, es que sólo ocurre en presencia de un electrólito, ocasionando regiones plenamente identificadas, 24 Manual De Apoyo Para El Laboratorio De Electroquímica llamadas estas anódicas y catódicas: una reacción de oxidación es una reacción anódica, en la cual los electrones son liberados dirigiéndose a otras regiones catódicas. Este mecanismo que es analizado desde un punto de vista termodinámico electroquímico, indica que el metal tiende a retornar al estado primitivo o de mínima energía, siendo la corrosión por lo tanto la causante de grandes perjuicios económicos en instalaciones enterradas. Por esta razón, es necesaria la oportuna utilización de la técnica de protección catódica. En la práctica suele utilizarse comúnmente el valor de la resistividad eléctrica del suelo como índice de su agresividad. La protección catódica es un método electroquímico cada vez más utilizado hoy en día, el cual aprovecha el mismo principio electroquímico de la corrosión, transportando un gran cátodo a una estructura metálica, ya sea que se encuentre enterrada o sumergida. Para este fin será necesaria la utilización de fuentes de energía externa mediante el empleo de ánodos galvánicos, que difunden la corriente suministrada por un transformadorrectificador de corriente. 1.6 Mecanismos de la corrosión. Tipos de Corrosión Se clasifican de acuerdo a la apariencia del metal corroído, dentro de las más comunes están: 1. Corrosión uniforme. 2. Corrosión galvánica. 3. Corrosión por picaduras. 4. Corrosión intergranular. 5. Corrosión por esfuerzo. . 25 Manual De Apoyo Para El Laboratorio De Electroquímica 1) Corrosión uniforme La corrosión implica la pérdida de metal en un punto de la superficie expuesta. La corrosión se produce de varias formas, que van desde ataques uniformes sobre toda la superficie hasta ataques locales agudos. En general, la corrosión metálica implica la pérdida de metal en un punto de la superficie expuesta. La corrosión se produce de varias formas, que van desde ataques uniformes sobre toda la superficie hasta ataques locales agudos. La corrosión uniforme o general se caracteriza por ataques corrosivos que se desarrollan uniformemente sobre toda la superficie, o sobre una gran parte del área total. El metal sigue perdiendo espesor hasta que se desmorona. La corrosión uniforme es el tipo de corrosión que echa a perder la mayor cantidad de metal. 2) Corrosión galvánica La corrosión galvánica es un proceso electroquímico en el que un metal se corroe preferentemente cuando está en contacto eléctrico con un tipo diferente de metal y ambos metales se encuentran inmersos en un electrolito o medio húmedo. Por el contrario, una reacción galvánica se aprovecha en baterías y pilas para generar una corriente eléctrica de cierto voltaje. Un ejemplo común es la pila de carbonozinc donde el zinc se corroe preferentemente para producir una corriente. La batería de limón es otro ejemplo sencillo de cómo los metales diferentes reaccionan para producir una corriente eléctrica. Cuando dos o más diferentes tipos de metal entran en contacto en presencia de un electrolito, se forma una celda galvánica porque metales diferentes tienen diferentes potenciales de electrodo o de reducción. El electrolito suministra el 26 Manual De Apoyo Para El Laboratorio De Electroquímica medio que hace posible la migración de iones por lo cual los iones metálicos en disolución pueden moverse desde el ánodo al cátodo. Esto lleva a la corrosión del metal anódico se retrasa hasta el punto de detenerse. La presencia de electrolitos y un camino conductor entre los dos metales puede causar una corrosión en un metal que, de forma aislada, no se habría oxidado. Incluso un solo tipo de metal puede corroerse galvánicamente si el electrolito varía en su composición, formando celdas de concentración. 3) Corrosión en grietas La corrosión por también llamada crevice o por fisuras es la que se produce en pequeñas cavidades o huecos formados por el contacto entre una pieza de metal igual o diferente a la primera, o más comúnmente con un elemento no- metálico. En las fisuras de ambos metales, que también pueden ser espacios en la forma del objeto, se deposita la solución que facilita la corrosión de la pieza. Se dice, en estos casos, que es una corrosión con ánodo estancado, ya que esa solución, a menos que sea removida, nunca podrá salir de la fisura. Además, esta cavidad se puede generar de forma natural producto de la interacción iónica entre las partes que constituyen la pieza. Algunas formas de prevenir esta clase de corrosión son las siguientes: Rediseño del equipo o pieza afectada para eliminar fisuras. Cerrar las fisuras con materiales no-absorbentes o incorporar una barrera para prevenir la humedad. Prevenir o remover la formación de sólidos en la superficie del metal. 4) Corrosión por picaduras 27 Manual De Apoyo Para El Laboratorio De Electroquímica Es altamente localizada, se produce en zonas de baja corrosión generalizada y el proceso anódico produce unas pequeñas picaduras en el cuerpo que afectan. Puede observarse generalmente en superficies con poca o casi nula corrosión generalizada. Ocurre como un proceso de disolución anódica local donde la pérdida de metal es acelerada por la presencia de un ánodo pequeño y un cátodo mucho mayor. Esta clase de corrosión posee algunas formas derivadas. a) Corrosión por fricción o fretting: b) Corrosión por Cavitación: c) Corrosión Selectiva: 5) Corrosión Intergranular Se define como corrosión intergranular al grado de desintegración electroquímica que se produce en los límites de grano de un metal, como consecuencia de la pérdida de características debidas al calentamiento generado, Si la concentración de cromo llega a descender por debajo del 12 % entonces la zona de transición mencionada se convierte en un ánodo corroible, debido al flujo electroquímico generado entre el mismo y los otros granos adyacentes, los cuales actúan como cátodo. Para determinar el grado de resistencia a la corrosión intergranular de los metales y sus aleaciones, y en especial de los aceros inoxidables, se utilizan las cámaras de ensayos de corrosión acelerada, según la norma ASTM A262 y todas sus homólogas y equivalentes. 6) Corrosión Selectiva La Corrosión selectiva es un tipo de corrosión que ataca un solo elemento de una aleación disolviéndolo en la estructura de la aleación. Como consecuencia la estructura de la aleación de debilita. 28 Manual De Apoyo Para El Laboratorio De Electroquímica Ejemplo de corrosión selectiva: 1. La descincacion del latón no estabilizado provoca una estructura de cobre poroso y debilitado. Así mismo, la grafitación del hierro fundido gris, deja un esqueleto de grafito quebradizo por la disolución del hierro. (Gómez, Alcaraz, 2006) 1.7 Métodos anticorrosivos Los métodos para un tratamiento anticorrosivo de metales que presentan por lo menos parcialmente, una superficie metálica, siendo por lo menos el 90% de la misma, en relación al total de la superficie metálica de zinc, aluminio y/o magnesio o aleaciones de diversos metales. Protección contra la corrosión Luego de haber analizado la corrosión y sus formas, es momento de ver qué conocimientos se tienen hoy en día para prevenirla. Antes de ver un análisis un tanto más profundo a las formas de proteger sobre la corrosión, hablaremos un poco sobre la Protección Catódica y la Protección Anódica. La protección catódica ocurre cuando un metal es forzado a ser el cátodo de la celda corrosiva adhiriéndole de un metal que se corroa más fácilmente que él, de forma tal que esa capa recubridora de metal se corroa antes que el metal que está siendo protegido y así se evite la reacción corrosiva. Por otro lado, la protección anódica es un método similar que consiste en recubrir el metal con una fina capa de óxido para que no se corroa. Existen metales como el Aluminio que al contacto con el aire son capaces de generar espontáneamente esta capa de óxido y por lo tanto, se hacen resistentes a la corrosión. Aún así, la capa de óxido que recubre al metal no puede ser cualquiera. Tiene que ser adherente y muy firme, ya que de lo contrario no serviría para nada. 29 Manual De Apoyo Para El Laboratorio De Electroquímica c) Selección de materiales La selección de los materiales que vayamos a usar será factor decisivo en el control de la corrosión a continuación se enunciaran algunas reglas generales para la selección de materiales: 1- Para condiciones no oxidantes o reductoras tales como ácidos y soluciones acuosas libres de aire, se utilizan frecuentemente aleaciones de Ni y Cr. 2- Para condiciones oxidantes se usan aleaciones que contengan Cr. 3- -Para condiciones altamente oxidantes de aconseja la utilización de Ti. 4- Los elementos cerámicos poseen buena resistencia a la corrosión y a las altas temperaturas pero son quebradizos, su utilización se restringe a procesos que no incluyen riesgo. a) Protección catódica La protección catódica es una técnica de control de la corrosión, que está siendo aplicada cada día con mayor éxito en el mundo entero, en que cada día se hacen necesarias nuevas instalaciones de ductos para transportar petróleo, productos terminados, agua; así como para tanques de almacenamientos, cables eléctricos y telefónicos enterrados y otras instalaciones importantes. En la práctica se puede aplicar protección catódica en metales como acero, cobre, plomo, latón, y aluminio, contra la corrosión en todos los suelos y, en casi todos los medios acuosos. De igual manera, se puede eliminar el agrietamiento por corrosión bajo tensiones por corrosión, corrosión intergranular, picaduras o tanques generalizados. Como condición fundamental las estructuras componentes del objeto a proteger y del elemento de sacrificio o ayuda, deben mantenerse en contacto eléctrico e inmerso en un electrólito. 30 Manual De Apoyo Para El Laboratorio De Electroquímica Dentro de las medidas utilizadas industrialmente para combatirla corrosión están las siguientes: 1. Uso de materiales de gran pureza. 2. Presencia de elementos de adicción en aleaciones, ejemplo aceros inoxidables. 3. Tratamientos térmicos especiales para homogenizar soluciones solidas, como el alivio de tensiones. 4. Inhibidores que se adicionan a soluciones corrosivas para disminuir sus efectos, ejemplo los anticongelantes utilizados en los radiadores de los automóviles. 5. Recubrimiento superficial: pinturas, capa de oxido, recubrimientos metálicos. 6. Protección catódica. Polarización catódica. La protección catódica no elimina la corrosión, éste remueve la corrosión de la estructura a ser protegida y la concentra en un punto donde se descarga la corriente. Para su funcionamiento práctico requiere de un electrodo auxiliar, e este caso es el ánodo. Una fuente de corriente continua cuyo terminal positivo se conecta al electrodo auxiliar y el terminal negativo a la estructura a proteger, fluyendo la corriente desde el electrodo a través del electrolito llegando a la estructura. (Bilurbina, et al, 2003) a) Recubrimientos Los recubrimientos se aplican mediante capas finas que separen el ambiente corrosivo del metal, es decir que puedan servir como ánodos sacrificables que puedan ser corroídos en lugar del metal subyacente. Los galvanizados son un buen ejemplo de este caso. 31 Manual De Apoyo Para El Laboratorio De Electroquímica Un recubrimiento continuo de zinc y estaño aísla el acero respecto al electrolito. A veces se presentan fallas con estos metales, cuando el riesgo de corrosión es muy elevado se recomienda hacer un recubrimiento con Alclad. El Alclad es un producto forjado, compuesto formado por un núcleo de una aleación de aluminio y que tiene en una o dos superficies un recubrimiento de aluminio o aleación de aluminio que es anódico al núcleo y por lo tanto protege electroquímicamente al núcleo contra la corrosión. Recubrimientos inorgánicos En algunos casos es necesario hacer recubrimientos con material inorgánico, los más usados son el vidrio y los cerámicos, estos recubrimientos proporcionan acabados tersos y duraderos. Aunque si se expone un pequeño lugar anódico se experimenta una corrosión rápida pero fácil de localizar. Recubrimientos orgánicos El uso de pinturas, lacas, barnices y muchos materiales orgánicos poliméricos han dado muy buen resultado como protección contra la corrosión. Estos materiales proveen barreras finas tenaces y duraderas para proteger el sustrato metálico de medios corrosivos. El uso de capas orgánicas protege más el metal de la corrosión Que muchos otros métodos. Aunque debe escogerse muy bien, ya que hay procesos que incluyen tratamientos con alcoholes que en algún momento pueden disolver los materiales orgánicos. Alteración por el entorno Las condiciones ambientales son muy importantes para el control de corrosión, algunos métodos usados son: Bajando la temperatura se consigue disminuir la velocidad de reacción. Disminuyendo la velocidad de un fluido corrosivo se reduce la corrosión se reduce por erosión. 32 Manual De Apoyo Para El Laboratorio De Electroquímica Eliminar el oxigeno de las soluciones acuosas reduce la corrosión especialmente en las calderas de agua. La reducción de la concentración de iones corrosivos en una solución que esta corroyendo un metal, se utiliza principalmente en aceros inoxidables. La adición de inhibidores que son principalmente catalizadores de retardo disminuye las probabilidades de corrosión. (Becker, Wenworth, 1977) Criterios de protección Cuando se aplica protección catódica a una estructura, es extremadamente importante saber si esta se encontrará realmente protegida contra la corrosión en toda su plenitud. Varios criterios pueden ser adoptados para comprobar que la estructura en mención está exenta de riesgo de corrosión, basados en unos casos en función de la densidad de corriente de protección aplicada y otros en función de los potenciales de protección obtenidos. No obstante, el criterio más apto y universalmente aceptado es el de potencial mínimo que debe existir entre la estructura y terreno, medición que se realiza con un electrodo de referencia. El criterio de potencial mínimo se basa en los estudios realizados por el Profesor Michael Pourbaix, en 1939, quién estableció a través de un diagrama de potencial de electrodo Vs pH del medio, un potencial mínimo equivalente a -850 mv con relación al electrodo de referencia cobre-sulfato de cobre, observando una zona definida por la inmunidad del acero. Los criterios de potencial mínimo de protección que se utilizará es de –850 mv respecto al Cu/SO4Cu como mínimo y permitiendo recomendar así mismo, un máximo potencial de protección que pueda estar entre los 1200 mv a -1300 mv, sin permitir valores más negativos, puesto que se corre el riesgo de sobre protección, que afecta de sobre manera al recubrimiento de la pintura, ya que hay riesgos de reacción catódica de reducción de hidrógeno gaseoso que se manifiesta como un ampollamiento en la pintura. (Bilurbina, Liesa,2003) 33 Manual De Apoyo Para El Laboratorio De Electroquímica La Corrosión en la Industria y sus Procesos. Como se mencionó en un principio, la mayor problemática de la corrosión es la destrucción del metal al que afecta. Ahora intentaremos ver un enfoque desde la industria, el sector más afectado por la corrosión, a cerca de los ataques que este proceso causa. Podemos hablar desde fracturas, hasta fugas en tanques, disminución de la resistencia mecánica de las piezas y muchas otras maneras de efectos por los ataques. Aún así, lo peor de todo es que si no son prevenidas estas clases de ataques por corrosión, la seguridad de las personas es algo que se ve permanentemente afectado. Existen dos clases de pérdidas desde el punto de vista económico. 1- DIRECTAS: Las pérdidas directas son las que afectan de manera inmediata cuando se produce el ataque. Estas se pueden clasificar en varios tipos también, de las cuales las más importantes son el Coste de las Reparaciones, las Sustituciones de los Equipos Deteriorados y Costes por Medidas Preventivas. 2- INDIRECTAS: Se consideran todas las derivadas de los fallos debidos a los ataques de corrosión. Las principales son la Detención de la Producción debida a las Fallas y las Responsabilidades por Posibles Accidentes. (Gomez, Alcaraz, 2006) 1.8 Conductividad eléctrica La conductividad se define como la capacidad de una sustancia de conducir la corriente eléctrica y es lo contrario de la resistencia. La conductividad es una variable que se controla en muchos sectores, desde la industria química a la agricultura. Esta variable depende de la cantidad de sales disueltas presentes en un líquido y es inversamente proporcional a la resistividad del mismo. Con los instrumentos 34 Manual De Apoyo Para El Laboratorio De Electroquímica convencionales, la medida de la conductividad se obtiene aplicando un voltaje entre dos electrodos y midiendo la resistencia de la solución. Las soluciones con conductividad alta producen corrientes más altas. Para contener la intensidad de la corriente en una solución altamente conductiva, es necesario disminuir la superficie de la sonda o incrementar la distancia entre los polos. Por esta razón se deben usar sondas diferentes para rangos de medida diferentes. Sólo el método de 4 anillos puede medir distintos rangos usando una única sonda. Las ventajas de este método respecto al de dos puntas son numerosas: lecturas lineales en un amplio rango, sin ninguna polarización, y sin necesidad de limpiezas exhaustivas por las incrustaciones. En general, el flujo de electricidad a través de un conductor es debido a un transporte de electrones. Según la forma de llevarse a cabo este transporte, los conductores eléctricos pueden ser de dos tipos: conductores metálicos o electrónicos y conductores iónicos o electrolíticos. A este segundo tipo pertenecen las disoluciones acuosas. En ellas la conducción de electricidad al aplicar un campo eléctrico se debe al movimiento de los iones en disolución, los cuales transfieren los electrones a la superficie de los electrodos para completar el paso de corriente. La conductividad eléctrica de una disolución puede definirse como la aptitud de ésta para transmitir la corriente eléctrica, y dependerá, además del voltaje aplicado, del tipo, número, carga y movilidad de los iones presentes y de la viscosidad del medio en el que éstos han de moverse. En disoluciones acuosas, y puesto que su viscosidad disminuye con la temperatura, la facilidad de transporte iónico o conductividad aumentará a medida que se eleva la temperatura. Según la ley de Ohm, cuando se mantiene una diferencia de potencial (E), entre dos puntos de un conductor, por éste circula una corriente eléctrica directamente proporcional al voltaje aplicado (E) e inversamente proporcional a la resistencia del conductor (R). 35 Manual De Apoyo Para El Laboratorio De Electroquímica I = E/R.........................................................................................................(1.15) En disoluciones acuosas, la resistencia es directamente proporcional a la distancia entre electrodos (l) e inversamente proporcional a su área (A): R = r·l/A ..............................................................................................................(1.16) Donde r se denomina resistividad específica, con unidades W·cm, siendo su inversa (1/r), la llamada conductividad específica (k), con unidades W-1·cm-1 o mho/cm (mho, viene de ohm, unidad de resistencia, escrito al revés). Actualmente se emplea la unidad del SI, siemens (S), equivalente a mho; y para trabajar con números más manejables se emplean submúltiplos: 1 mS/cm = 1 dS/m = 1000 (S/cm = 1 mmho/cm) (Enriquez,1994) Medida de Conductividad Es posible diferenciar los distintos conductivímetros según el método de medición que utilicen, es decir amperométrico o potenciométrico. El sistema amperimétrico aplica una diferencia potencial conocida (V) a dos electrodos y mide la corriente (I) que pasa a través de ellos. Según la ley de Ohm: I = V/R......................................................................................................... (1.17) Donde R= Es la resistencia, V= Es el voltaje Conocido como la corriente que va de un electrodo (sonda) a otro. Por lo tanto, cuanto más elevada sea la corriente obtenida, mayor será la conductividad. La resistencia, sin embargo, depende de la distancia entre los dos electrodos y sus superficies, las cuales pueden variar debido a posibles depósitos de sales u otros materiales. 36 Manual De Apoyo Para El Laboratorio De Electroquímica Por esta razón se recomienda el sistema amperométrico para soluciones con baja concentración de sólidos disueltos, generalmente hasta un gramo por litro (aproximadamente 2000 µS/cm). El sistema potenciométrico de cuatro anillos está basado en el principio de inducción, y elimina los problemas comunes asociados al sistema amperométrico como los efectos de la polarización. Los dos anillos externos aplican un voltaje alternativo e inducen un bucle de voltaje en la solución. Los dos anillos internos miden las bajadas de voltaje inducidas por el bucle de corriente, que depende de la conductividad de la solución. Una capa de PVC mantiene el campo de corriente fijo (I) y constante. Utilizando el método de 4 anillos es posible medir la conductividad con rangos de hasta 200000 µS/cm y 100g/l. Por tanto se presenta como el método más efectivo para la medida de la conductividad eléctrica en disoluciones. [9] 1.9 Aplicaciones de la conductividad eléctrica. En primer lugar, la conductividad de las soluciones desempeña un importante papel en las aplicaciones industriales de la electrolisis, ya que el consumo de energía eléctrica en la electrólisis depende en gran medida de ella. Las determinaciones de la conductividad se usan ampliamente en los estudios de laboratorios. Así, se las puede usar para determinar el contenido de sal de varias soluciones durante la evaporación del agua Las basicidades de los ácidos pueden ser determinadas por mediciones de la conductividad. El método conductimétrico puede usarse para determinar las solubilidades de electrólitos escasamente solubles y para hallar concentraciones de electrólitos en soluciones por titulación. 37 Manual De Apoyo Para El Laboratorio De Electroquímica Un método práctico sumamente importante es el de la titulación conductométrica, o sea la determinación de la concentración de un electrólito en solución por la medición de su conductividad durante la titulación. Este método resulta especialmente valioso para las soluciones turbias o fuertemente coloreadas que con frecuencia no pueden ser tituladas con el empleo de indicadores. [10] En la siguiente tabla podemos mencionar algunas de las aplicaciones más importantes que tiene la conductividad eléctrica, notamos que abarca muchos sectores y aquí se mencionan los más comunes e importantes. Tabla 2 Aplicaciones de la conductividad eléctrica [10] SECTOR. APLICACIÓN. Artes graficas. Baños de calibración, procesado de películas. Producción de cerveza y levadura. Limpieza y control de filtros en las instalaciones, dosificación de la sal en la levadura. Tratamiento de las aguas de entrada en las instalaciones, control de agotamiento de resinas de suavización, control de membranas osmóticas Control de pérdidas en los intercambiadores de calor, control de la concentración de soluciones ácidas y alcalinas y de la concentración de sales en procesos productivos Intercambiadores iónicos, redichos de sales en el agua de las calderas, control de pérdidas en humedecedores y condensadores Desalinización. Industria química. Generadores de calor. 38 Manual De Apoyo Para El Laboratorio De Electroquímica CAPITULO 2 PRACTICAS DE LABORATORIO. 39 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: CONSTRUCCION DE UNA BATERIA CON I LIMONES. Objetivo: Mostrar al alumno la cotidianidad de la química, sus consecuencias prácticas y otra identificación de baterías y sus componentes, en un marco natural. Fundamento: Para fabricar una batería, solo necesitas tener una especie que pueda oxidar a otra y una manera de separar reacciones. En este caso, aprovecharas dos cosas; por un lado, los diferentes potenciales de reducción de dos metales conocidos, y por el otro el contenido normal de sales de un organismo viviente: En este caso un limón; este nos proporcionara iones Cu (II) y Zn (II) para hacer funcionar la batería. (Damaskin, Petry, 1981). Material: 4 Limones Duros (maduros) 1 Multimetro 4 Clavos galvanizados o 4 placas de 1 Cuchillo zinc pequeñas. 4 monedas de cobre o 4 placas de 8 Alambres de Cobre u 8 Caimanes. cobre pequeñas. 2 Leds pequeño. 1 Reloj digital. Técnica: a) Apriete bien los limones haciéndolos rodar sobre la mesa, para destruir las membranas interiores y liberar más fácilmente el jugo. b) Realice dos cortes al limón, introduce las laminas de cobre y zinc (haberlas limpiado anteriormente con vinagre y agua) a cada limón, atravesando la piel de este, pero sin que ellas lleguen a tocarse. c) Cree un Circuito en serie entre los limones, teniendo en cuenta de unir los limones con materiales diferentes cobre-zinc y zinc-cobre. d) Cierre el circuito en el led o reloj digital. e) Conecte mediante un cable de conexión las dos láminas con el multimetro para medir la tensión de la batería, conecta el multimetro en medida de tensión en corriente continua. 40 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: CONSTRUCCION DE UNA BATERIA CON I LIMONES. Esquemas: Figura 2.1Circuito en serie con limones y placas de cobre y zinc. Cuestionario: 1.- ¿Qué Pasaría Si usamos grafito en lugar de Cu? 2.- ¿De dónde salen los iones de Cu(II) y Zn (II)? 3.- ¿Por que utilizamos el limón y no otra fruta? 41 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FISICA BASICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 2 PRODUCIR CORRIENTE ELÉCTRICA A PARTIR DE JUGO DE LIMÓN Y NARANJA. Objetivo: Comprobar cómo el jugo de limón y naranja puede llegar a producir corriente eléctrica suficiente como para encender un led por medio de jugos de frutas cítricas. Fundamento: Desde hace miles de años se sabe que el jugo de limón y muchos otros alimentos tienen un sabor ácido. Sin embargo, no fue hasta hace unos años que se descubrió por qué estas cosas tenían un sabor ácido. Aunque hay muchas diferentes definiciones de los ácidos y las bases. Robert Boyle primero denominó las substancias como ácidos o bases (llamó a las bases álcalis) de acuerdo a las siguientes características. Los Ácidos tienen un sabor ácido, corroen el metal, cambian el litmus tornasol (una tinta extraída de los líquenes) a rojo, y se vuelven menos ácidos cuando se mezclan con las bases. Las Bases son resbaladizas, cambian el litmus a azul, y se vuelven menos básicas cuando se mezclan con ácidos. (Damaskin, Petry, 1981). Material. Led de 1.3 volts (rojo o amarillo) 5 vasos pp. De 50 ml. Minas de lápiz de 10 cm de largo Etiquetas adheribles. Juego de caimanes Trozo de alambre de cobre sin forro. (15 cm) Reactivos: Vinagre Azúcar NaCl.y H2O Jugos de limón, naranja y toronja 42 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FISICA BASICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 2 PRODUCIR CORRIENTE ELÉCTRICA A PARTIR DE JUGO DE LIMÓN Y NARANJA. Técnica: a) Llene cada frasco hasta la mitad (40ml) y etiquétalos con el nombre de la sustancia de acuerdo a lo que contengan cada uno. b) Con ayuda de los caimanes, conecte los electrodos a las terminales del led en sustitución de la pila como se indica en la figura. c) Pruebe el sistema con anticipación para asegurarse de que las terminales estén bien conectadas, si esto no funciona cambie los caimanes, invierta los cables. d) Asegúrese de que los electrodos estén limpios de preferencia con una solución de agua y vinagre. e) Sumerja los electrodos en cada vaso, para una mejor respuesta cada frasco debe tener 40ml de agua con una cucharada (10 gr) de NaCl y el siguiente frasco 40ml d agua con una cucharada (10gr) de azúcar. Esquema: Figura 2.2 Frascos con las diferentes soluciones: Agua con NaCl, vinagre, toronja, limón y naranja. Cuestionario: 1.- ¿Trabajo el led con las diferentes sustancias? 2.- ¿Podrían utilizarse otros jugos después de la actividad? 43 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FISICA BASICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 2 PRODUCIR CORRIENTE ELÉCTRICA A PARTIR DE JUGO DE LIMÓN Y NARANJA. 3.- ¿Cómo clasificarías este proceso? 4.- ¿Qué otros jugos frutales podrían utilizarse en esta práctica? 44 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. Objetivo: La electrolisis es de gran importancia en la producción de metales como Al, K, Mg y Na a partir de electrolitos, se buscaran las aplicaciones de cada uno dentro del laboratorio. Fundamento: Se aplica una corriente eléctrica continua mediante un par de electrodos conectados a una fuente de alimentación eléctrica y sumergida en la disolución. El electrodo conectado al polo positivo se conoce como ánodo, y el conectado al negativo como cátodo. Cada electrodo atrae a los iones de carga opuesta. Así, los iones negativos, o aniones, son atraídos y se desplazan hacia el ánodo (electrodo positivo), mientras que los iones positivos, o cationes, son atraídos y se desplazan hacia el cátodo (electrodo negativo). La energía necesaria para separar a los iones e incrementar su concentración en los electrodos es aportada por la fuente de alimentación eléctrica. En los electrodos se produce una transferencia de electrones entre éstos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al cátodo (+) y los iones positivos o cationes toman electrones del ánodo (-). En definitiva lo que ocurre es una reacción de oxidación-reducción, donde la fuente de alimentación eléctrica se encarga de aportar la energía necesaria. (Harper, 1994) 45 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. Material. Pila de 9 volteos. 2 laminas de lápiz o grafito. 3 frascos de vidrio numerados. Etiquetas. Juego de caimanes Cucharas. Reactivos: NaCl Agua destilada. Azúcar. SO4Cu Técnica: 1. Conecta el circuito eléctrico, los caimanes y las minas de lápiz como se indica en la foto. 2. Preparamos en los 3 frascos las siguientes disoluciones. No olvidar etiquetar los frascos. Agua con NaCl. Agua con SO4Cu. Agua destilada. 3. Introduzca las minas de lápiz en el frasco que contiene NaCl (Disolución de agua con NaCl) ¿Qué observas? 4. Desconecte, enjuague y limpie las minas de lápiz. Conecte e introdúzcalas en el agua destilada. ¿Qué sucede? 5. Desconecte, enjuague y limpie las minas de lápiz. Conecta e introdúzcalas en el agua destilada. ¿Qué pasa? 46 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. Esquema: Figura 2.3 Esquema de electrolisis Cuestionario. 1. ¿Cómo paso la corriente eléctrica a través de la disolución de sulfato de cobre? 2. ¿Qué origino la formación de cobre en el cátodo? 3. ¿Qué origino la formación de sulfato en el ánodo? 4. ¿Alguna diferencia como la corriente eléctrica pasa a través de las disoluciones de sales que cuando pasa a través de los sólidos metálicos? 5. Define el proceso de la electrolisis. 6. ¿Cuál es la función del grafito en este experimento? 47 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. Objetivo. Conocer el fenómeno de disociación del yoduro de potasio asi como sus características. Fundamento. Es un proceso general en el cual complejos, moléculas o sales se separan en moléculas más pequeñas, iones o radicales, usualmente de manera reversible. Disociación es lo opuesto de la asociación, síntesis o a la recombinación. Cuando un ácido de Bronsted-Lowry se pone en el agua, un enlace covalente entre un átomo electronegativo y un átomo de hidrógeno se rompe por la fisión heterolítica, lo que da un protón y un ion negativo. (Harper, 1994) Material. 1 Tubo de vidrio en forma de U. 2 Electrodos de grafito. 1 Barra de plastilina Juego de caimanes 1 Pila de 9 voltios. Reactivos. Yoduro de potasio Indicador Fenolftaleína Técnica. 1. Doble un tubo de vidrio en forma de U con una altura aproximada de 6 cm y una base de 3 cm. 2. Con plastilina hacer la base para el tubo de vidrio. 3. Coloque en su interior un poco de disolución acuosa de yoduro de potasio (3gotas) 48 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. 4. Coloque 2 gotas de fenolftaleína (indicador acido-base) en cualquiera de las entradas del tubo. 5. Coloque 2 electrodos de grafito en 2 caimanes y conectarlos a la pila de 9 voltios; después introducir en cada tubo y sumergirlos en la disolución, espere unos minutos. 6. Al poner el grafito con la solución de él yoduro de potasio con el indicador este vira, a un color violeta. Esquema: Figura 2.4 Esquema de disociación de yoduro de potasio Cuestionario. 1. 2. 3. 4. ¿Qué Propiedades tiene el yoduro de potasio? ¿Cuál es el fin de hacer esta práctica? ¿En qué momento vira la solución? ¿Podría utilizarse otra solución en lugar de agua con NaCl? 49 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: CONDUCTIVIDAD DE UN COMPUESTO 5 IONICO Y UN COMPUESTO COVALENTE. Objetivo: Diferenciar por medio de la conductividad eléctrica un compuesto iónico de un compuesto covalente. Fundamento: ENLACE IONICO. Consiste en la atracción electrostática entre átomos con cargas eléctricas de sigo contrario, este tipo de enlace se establece entre átomos de elementos poco electronegativos, cuando una molécula de una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales que se transforman en iones con carga negativa, los metales a su vez se convierten en iones con carga positiva. Entonces los iones de diferente signo se atraen electrostáticamente formando enlaces iónicos. Las sustancias iónicas conducen la electricidad cuando están en estado líquido o en disoluciones acuosas, pero no en estado cristalino, por que los iones individuales son demasiado grandes para moverse libremente a través del cristal. ENLACE COVALENTE. La combinación de no metales entre si no puede tener lugar mediante este proceso de transferencia de electrones, en estos casos, el enlace consiste en una compartición de electrones; el enlace covalente es la formación de pares electrónicos compartidos independientemente de su número. Es la unión que se forma entre dos o más átomos que comparten electrones. Estas sustancias no conducen la electricidad, ni tienen brillo, ni ductibilidad, ni maleabilidad. La Falta de conductividad en estas sustancias se puede explicar porque los electrones están fuertemente localizados atraídos por los dos núcleos de los átomos enlazados. La misma explicación de puede dar para las disoluciones de estas sustancias en disolventes del tipo del benceno, donde se encuentran moléculas individuales sin carga neta, moviéndose en la disolución. No obstante, cuando el numero de enlaces es limitado como sucede en la mayor parte de las sustancias (oxigeno, Hidrogeno, Amoniaco, etc) con enlaces covalentes, al quedar saturados los átomos enlazados en la molécula, será débil, lo que justifica que con frecuencia estas sustancias se encuentran en estado 50 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: CONDUCTIVIDAD DE UN COMPUESTO 5 IONICO Y UN COMPUESTO COVALENTE. gaseoso a temperatura y presión ordinarias y que sus puntos de fusión y ebullición sean bajos. Materiales: 1 pila de 9 voltios 1 foco de poco voltaje 2 caimanes Reactivos: Solución de azúcar. 1 tabla de 15x15 cm 1 soquett para el foco Solución de cloruro de sodio. Técnica: 1. Construye un dispositivo para demostrar la conductividad. 2. En los vasos de precipitados coloca las soluciones de cloruro de sodio y azúcar. 3. Introduce las puntas de los cables que quedaron libres en el vaso que contiene la solución de cloruro de sodio, cuidando que las puntas no se toquen, observando la luminosidad del foco. 4. Repite el paso anterior con la solución de azúcar. Esquema: Figura 2.5 Circuito simple conectado a la solución de cloruro de sodio. 51 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: CONDUCTIVIDAD DE UN COMPUESTO 5 IONICO Y UN COMPUESTO COVALENTE. Cuestionario: 1. Contesta el recuadro de acuerdo a tus resultados obtenidos. Sustancia ¿El compuesto se disuelve totalmente en el agua? ¿La Solución conduce electricidad? Tipo de compuesto. NaCl 50% C12H22O11 50% 2. ¿Qué diferencias existen entre las propiedades de los compuestos iónicos y los covalentes? 3. ¿Las soluciones de algunos compuestos conductoras de electricidad? ¿Por qué? covalentes son buenas 52 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. Objetivo: Comprobar los principios básicos de la generación de electricidad por métodos químicos en el laboratorio. Fundamento: Se pueden realizar reacciones químicas para generar electricidad, ya que las reacciones oxido-reducción espontaneas dan lugar a una transferencia de electrones del elemento que se reduce, produciéndose una corriente eléctrica. Es decir transformación de energía química en química eléctrica. De esta manera funcionan las pilas y baterías ordinarias. Los primeros científicos en observar e investigar estos fenómenos fueron: LUIGI GALVANI: Cuando realizaba experimentos con ancas de ranas, contemplo la existencia de electricidad animal, y sugirió erróneamente que la electricidad era movida por el tejido muscular. ALESSANDRO VOLTA: Descubrió que no fue la electricidad animal la causante de las contracciones si no la reacción química que ocurría entre el metal y el barandal y el gancho donde colgaba galvani las ancas de los ensayos. En uno de sus experimentos, volta coloco 2 piezas circulares de plata y zinc, respectivamente y entre ellas un trozo de tela humedecida en una disolución salina; Material: Vasos pp. De 50 ml. Juego de caimanes Electrodos de hierro Electrodos de zinc, cobré y grafito. Galvanómetro. 53 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. Reactivos: Acido sulfúrico Acido clorhídrico Dióxido de manganeso Hidróxido de sodio Técnica: 1. Vierte en cualquiera de las disoluciones antes mencionadas en el frasco hasta un poco más de la mitad (60ml). 2. Coloque en uno de los caimanes el electrodo de cobre y en el otro el electrodo de zinc, los cuales se conectaran al galvanómetro como se indica. 3. Anote en una tabla sus observaciones. 4. Con la misma disolución se repite la actividad anterior, ahora con electrodos de grafito y cobre, zinc y grafito, ambos de grafito y por ultimo ambos hierro. Anota tus resultados en una tabla. Esquema: Figura 2.6 Esquema de circuito simple con conexión a Agua con NaCl Observaciones: ELECTRODOS. Cobre y zinc. ¿CONDUCE ELECTRICIDAD? Si Grafito y cobre. Si Zinc y grafito. Si Grafito y grafito. Si Hierro y Hierro. Si 54 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. . Cuestionario. 1. 2. 3. 4. ¿Por qué es posible generar electricidad? ¿Se podría sustituir el hierro, cobre y zinc por otros metales? ¿Por qué el grafito es conductor de electricidad? ¿De qué otra manera se podría generar corriente eléctrica? 55 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 7 GALVANOPLASTIA. Objetivo: Conocer el proceso de la galvanoplastia a través del cobre a nivel laboratorio. Fundamento: El proceso de galvanoplastia (también conocido como electrodeposición) es bastante simple. Para empezar, una carga negativa se coloca en el objeto que se va recubrir. El objeto se sumerge en una solución de sal de metal que se utilizará para la placa del objeto. A partir de ahí, es simplemente una cuestión de atracción, los iones metálicos de la sal tienen carga positiva y por tanto son atraídos por el objeto con carga negativa. Una vez que se conectan, los iones con carga positiva vuelven a su forma metálica de nuevo y tiene un objeto recién galvanizado. Controlar el espesor del objeto galvanizado generalmente se alcanza mediante la alteración de la hora del objeto pasa en la solución de sal. Cuanto más tiempo permanece en el interior del baño, el grueso del depósito se convierte electrolíticamente. por supuesto, también debe haber una cantidad suficiente de iones metálicos en el baño de recubrimiento para continuar el objeto también tendrá un efecto sobre el espesor, antes la galvanoplastia se debe limpiar a fondo y todas las manchas y las rayas se deben pulir, como se menciono, por lo que un cero se vuelve más prominentes, en lugar de ser suavizadas por el material plateado. Material: vasos pp. de 50ml. Juego de caimanes. Llaves de cerradura o candado. Placas pequeñas de cobre. Trozo de alambre de cobre. Pila de 9 volts. Reactivos: Disolución de sulfato de cobre Técnica: 1. Vierte en el frasco de vidrio la disolución de sulfato de cobre al 10% 56 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 7 GALVANOPLASTIA. Aproximadamente ¾ partes de su capacidad. 2. Con el juego de caimanes, conecta una punta al polo positivo de la pila de 9 volts. Y a la llave el laton. 3. El alambre de cobre al polo negativo de la pila y a la placa de cobre como se indica en la figura: Esquema: Figura 2.7 Esquema de galvanoplastia de un metal. Cuestionario: 1. ¿Cómo se lleva a cabo este proceso a nivel industrial? 2. ¿Qué otros métodos se pueden llevar a cabo? 57 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: DEMOSTRACION DE LA PRESENCIA DE 8 ELECTRONES. Objetivo: Dada la práctica, demostrar la presencia de electrones a través de los experimentos indicados a nivel laboratorio. Fundamento: El átomo está constituido principalmente por tres partículas subatómicas. El protón es una partícula con carga eléctrica positiva, el neutrón es una partícula sin carga eléctrica ambas se encuentran en el núcleo. La tercera partícula fundamental del átomo es el electrón, con carga negativa y se encuentra en la periferia del átomo; no se puede ver, pero se perciben sus efectos. Para cargar los átomos positivamente deben perder algunos de sus electrones quedando con su exceso de protones; es decir, de partículas con carga positiva. Cuando el vidrio se frota con seda, algunos electrones pasan a esta, dejando el vidrio con carga positiva. Los átomos contienen electrones que pueden separarse fácilmente. Material: 2 Soportes universales. 3 Varillas de vidrio de 15cm de largo. 2 Globos. 1 Trozo de tela de seda. 2 Varillas de hierro. 1 Trozo de franela. 2 Pinzas de nuez 1 Cuerda o hilo. Técnica: 1. Infle 2 globos y haga un nudo en cada uno para que no se desinflen, amárrales un hilo. 2. Sobre una varilla con soporte, cuélgueles dándoles una separación entre uno y otro aprox de 5cm. 3. Cargue eléctricamente los 2 globos, frotándolos con el cabello de un compañero; suéltalos y observe lo que sucede. 4. Ate 2 varillas de vidrio con un hilo y cuélgalos en la varilla de hierro. 58 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: DEMOSTRACION DE LA PRESENCIA DE 8 ELECTRONES. 5. Frote las varillas de vidrio que cuelgan con una tela de seda; suéltala suavemente de tal manera que no tengan movimiento y observe lo que sucede. 6. Repite el paso 5 pero ahora frota las varillas con una franela y anota tus observaciones. 7. Frote otra varilla de vidrio con una tela de seda y acércala a un globo colgado, cargando eléctricamente al frotarlo con el cabello anota tus observaciones. 8. Repite el paso anterior pero ahora frotando la varilla con el trozo de franela, y anota tus observaciones. Esquema: Figura 2.8 Globos atados a una cuerda. Cuestionario: 1. 2. 3. ¿Cómo explicarías este fenómeno observado? ¿Por qué se pegan los globos a la ropa después de frotarlos? ¿Qué pasa cuando los frotas en tu cabello? 59 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. Objetivo: En este experiencia se investigaran algunos de los factores que intervienen en la corrosión y se tratará de relacionarlos entre si. Fundamento: La Corrosión es un término general que se aplica al proceso por el que los metales se convierten en óxidos u otros compuestos; esta es la causa del deterioro gradual de los metales. Aunque la química detallada de la corrosión del hierro no se conoce del todo; es seguro que interviene la oxidación de alguna forma. La forma de corrosión más común y destructiva desde el punto de vista económico es la oxidación del hierro, este problema significa un derroche de energía y de dinero, debido a que en el mundo se gastan millones de dólares, tanto en proteger como en reponer los materiales y estructuras metálicas corroídas. Material: Papel tornasol. 1 mechero. Alambre de cobre Tira de estaño y zinc. Capsula Petri. Trozo de hilo de cobre. Clavos. Reactivos: 1 gr de Agar-agar en polvo. Fenolftaleína. Ferrocianuro potásico. Soluciones: Todas a 0,1 Molar. Grupo A NaOH HCl Grupo B KOH HNO3 Grupo C Na2PO4 H2SO4 60 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. Técnica: Parte 1. Reacción del hierro con algunos reactivos en solución acuosa. 1. Coloque un clavo limpio y brillante en cinco tubos de ensayo; deje que cada clavo se deslice suavemente por el lado del tubo para evitar romper el fondo. 2. Llene cada uno de los tubos de ensayo con uno de los siguientes reactivos, de forma que el clavo quede cubierto entero. El profesor le indicará que grupo ah de usar. Todas las soluciones con 0,1 molar. 3. Llene cada uno de los tubos de ensayo con uno de los siguientes reactivos, de forma que el clavo quede cubierto entero. El profesor le indicará que grupo ah de usar. Todas las soluciones con 0,1 molar. 4. Determine si la solución es acida, básica o neutra usando papel tornasol o de otra clase apropiado. Dejar los clavos durante toda una noche en la solución y continuar con la parte II. 5. Cuando las soluciones hayan estado toda una noche reaccionando, observe y anote los cambios que se hayan producido. Añadir a cada solución una o dos gotas de ferrocianuro potásico 0,1 molar, K 3Fe(CN)6 [El cual contiene los iones K+ (aq)y Fe(CN)6 3-(aq)] y observar cualquier cambio. Comparar los resultados obtenidos con los de tus compañeros que usaron los otros grupos de reactivos. Anotar todas las observaciones de los otros alumnos junto con las propias, en forma de tabla. 6. Añada una gota de solución de ferrocianuro potásico 0,1 molar a 1ml aprox. De solución de sulfato ferroso. Comparar el resultado con el obtenido cuando se añadió la solución de ferrocianuro potásico a las soluciones que contenían los clavos. Parte II. Reacciones con intervención de dos metales. 1. Prepare 100ml de suspensión de agar-agar tal como sigue: Caliéntese 100 ml de agua destilada, repetir este procedimiento utilizando una tira de zinc y un cuarto de clavos. Si no se dispone de una tira de zinc se puede usar un trozo delgado de zinc atravesándolo por lo menos 2 veces con el clavo. Póngase este clavo en la 61 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. segunda capsula petri tal como se indica en el esquema. Cuídese de que los clavos no se toquen entre ellos. 2. Añada unas 5 gotas de ferrocianuro potásico 0,1 molar y 3 gotas de solución de fenolftaleína al 0,1 % a la suspensión de agar-agar y agíte a fondo la mezcla. Parte II. Reacciones con intervención de dos metales. 3. Prepare 100ml de suspensión de agar-agar tal como sigue: Caliéntese 100 ml de agua destilada, repetir este procedimiento utilizando una tira de zinc y un cuarto de clavos. Si no se dispone de una tira de zinc se puede usar un trozo delgado de zinc atravesándolo por lo menos 2 veces con el clavo. Póngase este clavo en la segunda capsula petri tal como se indica en el esquema. Cuídese de que los clavos no se toquen entre ellos. 4. Añada unas 5 gotas de ferrocianuro potásico 0,1 molar y 3 gotas de solución de fenolftaleína al 0,1 % a la suspensión de agar-agar y agítese a fondo la mezcla. 5. Mientras la suspensión de agar-agar se enfría, prepare 4 clavos limpios y brillantes, tal como se mostro en la figura, colocar un clavo a un lado de una capsula petri o vaso pp. Doblar otro clavo con ayuda de unos alicates y colóquese en el otro lado de la capsula. Enrollar un trozo de hilo de cobre limpio alrededor de un tercer clavo; quítese entonces el clavo y estírese el hilo de cobre de forma que cuando se vuelva a colocar otra vez el clavo, el contacto sea mejor. Colóquese una segunda capsula repetir este procedimiento utilizando una tira de zinc y un cuarto de clavo; atravesándolo por lo menos dos veces con el clavo. Póngase este clavo en la segunda capsula petri tal como se indico en el esquema, cuídese de que los clavos no se toquen entre ellos. 6. Cuando la mezcla de agar-agar este templada y aun fluida, viértase con cuidado en las capsulas hasta que tape los clavos y las otras piezas de metal. 7. Haga observaciones durante todo el tiempo que quede el periodo de clase, colocar las capsulas en su mesa y observar lo sucedido después de haber permanecido una noche. Corrosión de los metales: 62 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. 1. Tome 4 clavos nuevos de 1in, enrolle en uno una tira angosta de estaño; en otro, un alambre de cobre y en el tercer clavo una tira angosta de zinc. 2. Ponga los 4 clavos en 4 tubos diferentes y cúbralos parcialmente con agua, dejarlos reposar d 2a3 días y observar los resultados. 3. Anote los cambios. Esquema: Figura 2.9 Capsula Petri con clavos corroídos. En la siguiente tabla se encuentran los diferentes reactivos que se utilizan para acelerar la corrosión, anote si es acido o neutro. Reactivo Tipo de solución H2O Na3PO4 HNO3 NaCl 63 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. Después le agregamos 2 gotas de ferrocianuro potásico a cada uno de los tubos y determinamos los colores siguientes: Reactivo Color. HCl H2O Na3PO4 HNO3 NaCl 64 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 10 ELECTRONIQUELADO. Objetivo: En esta experiencia se analizará el proceso del electro niquelado y como se lleva a cabo, principalmente en metales. Fundamento: El electro niquelado con cadmio fue inventado y era el uso más importante del cadmio hasta el desarrollo comercial de la batería del níquel-cadmio. En los procesos de electro niquelado se utiliza una disolución de sulfato de níquel, el dióxido de NiO2 se usa como agente oxidante en las placas positivas del acumulador de edición, que es un acumulador con electrolito alcalino, de larga vida (las placas y los recipientes que forman la batería son de níquel puro que no es atacada por las bases). Material: 1 pila de 9 voltios. 1 frasco de 150ml 1 varilla de grafito. Alambre de cobre. 1 tira de cobre de 2x6 cm Reactivos: 100ml de una solución que contiene 1.5 gr de NH4Cl 7.5 gr de NiSO4 (NH4)2SO4°6H2O 1.5 gr de acido bórico. Técnica: 1. Tener en el vaso de precipitado las disoluciones de todas las siguientes soluciones NiSO4 (NH4)2 SO4°6H2O. 2. La tira de cobre conectara los electrodos. 3. Con los caimanes conectar a las baterías y a la tira de cobre. 4. Sumergir los electrodos en la disolución. 65 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 10 ELECTRONIQUELADO. 5. El aparato quedara montado como se muestra en el esquema. Esquema: Figura 2.10 Esquema de electroniquelado. Cuestionario: 1. ¿En qué consiste el electro niquelado? 2. ¿Cuáles son los elementos que se utilizan para el electro niquelado? 3. ¿Por qué el grafito de degrada al introducirlo a la disolución? 66 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: MATERIALES CONDUCTORES Y NO 11 CONDUCTORES. Objetivo: En esta práctica es importante saber que tipos de materiales son conductores y cuales otros no son conductores de electricidad. Fundamento: La conductividad eléctrica es la propiedad de los materiales que cuantifica la factibilidad con que las cargas pueden moverse cuando un material es sometido a un campo eléctrico. La resistividad es una magnitud inversa a la conductividad, aludiendo al grado de dificultad que encuentran los electrones en sus desplazamientos, dando una idea de lo bueno o mal conductor que puede llegar a ser. Un valor alto de resistividad indica que el material es mal conductor mientras que uno bajo indicara que es buen conductor. Generalmente la resistividad de los metales aumenta con la temperatura, mientras que la de los semiconductores disminuye ante el aumento de la temperatura. Los materiales se clasifican según su conductividad eléctrica o resistividad en conductores, dieléctricos, semiconductores y superconductores. Conductores eléctricos, son los materiales que, puestos en contacto con un cuerpo cargado de electricidad, transmiten esta a todos los puntos de superficie. Los mejores conductores eléctricos son los metales y sus aleaciones. Existen otros materiales, no metálicos, que también poseen la propiedad de conducir electricidad, como son el grafito, las soluciones salinas y cualquier material en estado de plasma. Para el transporte de la energía eléctrica, asi como para cualquier instalación de uso domestico o industrial, el metal mas empleado es el cobre en forma de cables de uno o varios hilos. Material: Circuito eléctrico simple. Objetos metálicos: Clips, agujas, etc Objetos no Metálicos: Lápiz, Plástico, etc. Caimanes. 67 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: MATERIALES CONDUCTORES Y NO 11 CONDUCTORES. Técnica: 1. Arme un circuito eléctrico simple con una pila de 9 voltios, un foco de pequeño voltaje y alambres de cobre o caimanes. 2. Antes de unir los alambres que cierran el circuito, coloca entre ellos los diversos objetos metálicos y no metálicos para checar cuales conducen electricidad y cuáles no Esquema: Figura 2.11 Esquema de circuito simple En esta práctica es necesario llenar un cuadro donde indiquemos que materiales fueron conductores de electricidad y cuáles no. Materiales. Conduce Electricidad. Clip Alambre de cobre Lápiz Grafito Cuestionario: 1. ¿En qué Consiste que unos materiales conduzcan electricidad y otros no? 68 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: MATERIALES CONDUCTORES Y NO 11 CONDUCTORES. 2. ¿En qué consiste un circuito eléctrico? 3. ¿Qué materiales sirvieron para la conducción de electricidad? 4. ¿El foco enciende? 69 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 12 PILA DE DANIELL Objetivo: Se trata de fabricar una pila (Daniell) utilizando las reacciones de oxidación-Reducción de los productos utilizados posteriormente uniéndolas a través de un puente salino. Fundamento: La pila de daniell, dada a conocer en 1836 y de la que luego se han usado ampliamente determinadas variantes constructivas, está formada por un electrodo de zinc, sumergido en una disolución de sulfato de zinc y otro electrodo sumergido en una disolución concentrada de sulfato de cobre. Ambos electrolitos están separados por una pared porosa para evitar su reacción directa. En esta situación la tensión de disolución de zinc es mayor que la presión de los iones Zn++ y el electrodo se disuelve, emitiendo Zn ++ y quedando cargado negativamente, proceso en el que se liberan electrones y que recibe el nombre de oxidación. En la disolución de sulfato de cobre, debido a su gran concentración de iones Cu ++, se deposita Cu sobre el electrodo de este metal de modo que queda cargado positivamente, mediante el proceso denominado reducción, que implica la incorporación de electrones. Material. 2 vasos pp. De 10ml c/u. Tubo de vidrio en forma de U. Algodón. Papel tornasol. 1 Tira de cobre. 1 Tira de zinc. Alambre delgado de cobre. Reactivos: Solucion de CuSO4 ELABORADO POR: MORALES AMARO PAOLA REVISO: M.C. IGANACIO SANCHEZ BAZAN APROBO: M.C. IGNACIO SANCHEZ BAZAN FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 REVISIÓN No.1 70 PÁGINA 70 DE 5 FECHA DE ÚLTIMA REVISIÓN: UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 12 PILA DE DANIELL Técnica: 1. En un vaso de pp. De 50 ml, diluya 10 ml de una solución 2N de CuSO 4 con 10 ml de agua. 2. En otro vaso de 50 ml, diluya 10 ml de una solución 2N de ZnSO 4 con 10 ml de agua. 3. Los niveles deberán ser iguales en los dos vasos. 4. Con un tubo de vidrio doblado en U, construya un puente salino, llene este tubo con una solución al 10% NaCl, tape los extremos con algodón y úselo para conectar los dos vasos. 5. Evite que haya burbujas en el tubo con sal. 6. En la solución con sulfato de cobre, coloque una tira de cobre y en la de sulfato de zinc, una tira de zinc. 7. A cada uno de estos electrodos, ateles un alambre en contacto con un papel rojo tornasol, colocándolo en un vidrio de reloj y humedecido con una solución de NaCl. 8. Deje que esta electrolisis prosiga por algunas horas, cuidando de que el papel tornasol este siempre húmedo, anote todos los cambios que ocurran. Esquema: Figura 2.12 Esquema de una pila de daniell ELABORADO POR: MORALES AMARO PAOLA REVISO: M.C. IGANACIO SANCHEZ BAZAN APROBO: M.C. IGNACIO SANCHEZ BAZAN FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 REVISIÓN No.1 71 PÁGINA 71 DE 5 FECHA DE ÚLTIMA REVISIÓN: UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 12 PILA DE DANIELL Cuestionario: 1. ¿Qué es una pila de daniell? 2. ¿Cómo la diferenciamos de las otras pilas? 3. ¿Por qué ocurrió reacción dentro de las disoluciones? 4. ¿A qué se debe el cambio de color en el papel tornasol? 5. ¿Para qué sirvió el puente salino? ELABORADO POR: MORALES AMARO PAOLA REVISO: M.C. IGANACIO SANCHEZ BAZAN APROBO: M.C. IGNACIO SANCHEZ BAZAN FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 FECHA: OCTUBRE 2011 REVISIÓN No.1 72 PÁGINA 72 DE 5 FECHA DE ÚLTIMA REVISIÓN: CAPITULO 3 VALIDACION DE PRÁCTICAS 73 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: PRODUCIR CORRIENTE A PARTIR DE 2 JUGO DE LIMON, NARANJA Y TORONJA. En esta práctica el objetivo principal es experimentar de manera rápida y sencilla la manera más fácil de producir corriente eléctrica a partir de jugos de frutas cítricas, ya que los ácidos tienen un sabor ácido, corroen el metal, cambian el litmus tornasol a rojo, y se vuelven menos ácidos cuando se mezclan con las bases. En el caso de las bases son resbaladizas, cambian el litmus a azul, y se vuelven menos básicas cuando se mezclan con ácidos. Fotos: Figura 3.1 Frascos con 60 ml de jugos de frutas cítricas (Toronja, limón y naranja) Observaciones: Para las observaciones será necesario hacer una tabla donde se anote los resultados obtenidos a partir de cada solución utilizada. Frasco con Jugo de fruta cítrica. Jugo de Toronja Jugo de Limón Jugo de Naranja Agua Destilada Vinagre ¿Enciende el Led? Si Si Si Si Si 74 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: PRODUCIR CORRIENTE A PARTIR DE 2 JUGO DE LIMON, NARANJA Y TORONJA. Conclusiones: Los jugos que fueron utilizados en esta práctica al igual que el vinagre y el agua con sal poseen suficientes electrolitos aparte de que en algunos casos el acido cítrico de las frutas nos ayudaran a producir corriente eléctrica. Por otro lado el jugo de limón, naranja y vinagre son PH ácidos por lo que su constitución está dirigida a los iones hidrogeno (H+). 75 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 4 DISOCIACION DE YODURO DE POTASIO. La parte importante de esta práctica es analizar el fenómeno de la disociación de yoduro de potasio a partir de la construcción de un puente salino. Fotos: Figura 3.2 Puente Salino Conectado a una pila de 9 volts. Observaciones: Al poner el grafito con la solución del yoduro de potasio con la fenolftaleína este vira (morado) y el grafito empieza a tener espuma a su alrededor, lo que nos indica que está teniendo reacción. Se puede observar la disociación del yoduro de potasio. Conclusión: La fenolftaleína es un indicador muy útil, ya que en este caso ayuda a acelerar la disociación en el yoduro de potasio, al notar el vire al introducir el grafito en la solución preparada con anterioridad. 76 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. En esta práctica la Falta de conductividad en estas sustancias se puede explicar porque los electrones están fuertemente localizados atraídos por los dos núcleos de los átomos enlazados. La misma explicación de puede dar para las disoluciones de estas sustancias en disolventes del tipo del benceno, donde se encuentran moléculas individuales sin carga neta, moviéndose en la disolución. Fotos: . Figura 3.3 Circuito simple conectado a 1 vaso pp. que contiene NaCl Observaciones: Al tener el circuito ya instalado, se prosigue a conectar los caimanes al grafito y ya teniéndolos instalados se introducen a las soluciones y observamos que este es capaz de encender el foco (1.3volts), para que esto funcione es necesario que la pila sea de 9 voltios. Las dos soluciones funcionan si son preparadas correctamente, pudiendo concluir que los compuestos son iónicos lo que permite que los focos enciendan porque con capaces de conducir electricidad, mientras que los compuestos covalentes no son capaces de conducir electricidad, los átomos enlazados en la molécula serán débiles. 77 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. Conclusiones: Sustancia NaCl 50% C12H22O11 50% ¿El compuesto se disuelve totalmente en el agua? Si. ¿La Solución conduce electricidad? Tipo de compuesto. Si. Iónico. Si, quedando muy poco residuo. No. Covalente. 78 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. El objetivo principal de esta práctica es comprobar los principios básicos de la generación de electricidad por métodos químicos en el laboratorio. Se pueden realizar reacciones químicas para generar electricidad, ya que las reacciones oxido-reducción espontaneas dan lugar a una transferencia de electrones del elemento que se reduce, produciéndose una corriente eléctrica. Fotos: Figura 3.4 Solución de NaCl con dos electrodos, uno de zinc y cobre respectivamente. Observaciones: ELECTRODOS. Cobre y zinc. ¿CONDUCE ELECTRICIDAD? Si conduce electricidad. Grafito y cobre. Si conduce electricidad. Zinc y grafito. Si conduce electricidad. Grafito y grafito. Si conduce electricidad. Hierro y Hierro. Si conduce electricidad. 79 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: QUIMICA Y GENERACION DE 6 ELECTRICIDAD. Al sumergir los diferentes electrodos en las diferentes soluciones todos son capaces de generar corriente eléctrica. Conclusiones: Todos los electrodos fueron capaces de producir corriente eléctrica siempre y cuando las soluciones hayan sido preparadas correctamente, es decir que tengan la cantidad correcta de HCl, H2SO4 e NaOH. . 80 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. En este experiencia se investigaran algunos de los factores que intervienen en la corrosión y se tratará de relacionarlos entre sí. La forma de corrosión más común y destructiva desde el punto de vista económico es la oxidación del hierro, este problema significa un derroche de energía y de dinero, debido a que en el mundo se gastan millones de dólares, tanto en proteger como en reponer los materiales y estructuras metálicas corroídas. Fotos: Figura 3.5 Microtubos con clavos en soluciones distintas HCl, H2SO4, NaOH, H2O y Agua destilada. Figura 3.6 Capsula petri con agar-agar y clavos con tiras de zinc. 81 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. Observaciones: Al dejar sumergidos los clavos en distintas soluciones observamos varios cambios, la mayoría de los clavos ya estaban oxidados y aun mas el clavo que estaba sumergido en agua. Posteriormente determinamos si eran acido, base o neutro mediante el papel tornasol. HCl H2O Na3PO4 HNO3 NaCl Acido Neutro Acido Acido Neutro Despues se le agregan 2 gotas de ferrocianuro potásico a cada uno de los tubos y determinamos los colores siguientes: HCl H2O Na3PO4 HNO3 NaCl Azul Amarillo Amarillo Azul Amarillo Cuando se observaba el color azul en los tubos pudimos observar la presencia de hierro. La corrosión de los metales: En esta parte de la practica pudimos observar que los clavos se oxidaban de acuerdo a la solución en la fueron sumergidos, el agua y el acido clorhídrico fueron los que dejaron mayor oxidación. Capsula con agar-agar: aquí notamos que la mezcla se consume casi por completo en la capsula digamos que se seca y queda cuarteada y con un color diferente como entre verde seco y azul, cuando en un principio era color ámbar. 82 UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS FENOMENOS DE SUPERFICIE Y ELECTROQUIMICA LABORATORIO No. DE NOMBRE DE LA PRÁCTICA: PRÁCTICA: 9 CORROSION DEL HIERRO. Conclusiones: En esta práctica se hizo un estudio de la corrosión mediante diferentes experimentos, se practico con varias técnicas, dado que la corrosión es un factor muy importante en la industria que puede provocar graves daños estructurales con las consecuencias económicas lo que implica una herramienta importante al momento (en decisión del material adecuado) elegir el material indicado con el cual será fabricado ciertos componentes de la planta química. 83 Manual De Apoyo Para El Laboratorio De Electroquímica Conclusiones Este manual es muy versátil, aspecto que puede comprobarse fácilmente en las diversas opciones de prácticas que se presentan en este trabajo y programas de Electroquímica de los diferentes laboratorios. De los aspectos descritos en este en este proyecto se ha optado por un enfoque fundamentalmente deductivo en lo que se refiere a la ordenación de los temas en los que se divide este programa. El contenido de este programa presenta una visión general de los aspectos más prácticos de esta compleja disciplina, pero suficiente, en mi opinión, para un programa de Electroquímica, como pretende ser éste, que va dirigido a alumnos de Ingeniería. Por todo lo anterior, cuando los temas así lo requieran, se alternará la ordenación deductiva con otra inductiva, para evitar una concepción demasiado abstracta de la Electroquímica. Por otra parte, se ha obviado la inclusión de temas específicos de contenido eminentemente teórico, más propios de las Licenciaturas en Química, Física o Farmacia. 84 Manual De Apoyo Para El Laboratorio De Electroquímica Referencias Bibliográficas - A. Garritz, J.A. Chamizo, Química, 1998, pág. 783 - B.B. Damazkin, O.A. Petry, Fundamentos de la electroquímica teórica, MirMoscu, 1981 - Gilberto Enríquez Harper, Fundamentos de la electricidad, 1994 - Félix Cesáreo Gómez, Diego J. Alcaraz Lorente, Manual básico de corrosión para ingenieros, 2004 - Gilbert W. Castellan, Fisicoquímica, 1987 - Wenceslao González Viñas, Héctor L. Mancini, Ciencia de los materiales, 2003 - Luis Bilurbina Alter, Francisco Liesa Mestres, Corrosión y protección, 2003 - Ralph Becker, Wayne E. Wenworth, Quimica General, 1977 - Consejo superior de investigaciones científicas, Corrosión y protecciones metálicas - Oscar Delgadillo, Alan Camacho, Depuración de aguas residuales por medio de humedad artificial, 2010 - J.O.M. Beckers, A.K.N. Reddy, Electroquímica, Reverte Páginas Web. [1] http://www.acienciasgalilei.com/qui/tablas 85 Manual De Apoyo Para El Laboratorio De Electroquímica [2] http://www.monografias.com/trabajos11/pila/pila.shtml [3] http://www.textoscientificos.com/quimica/corrosion/tipos] [4]http://2.bp.blogspot.com/_bNtyzzBvpZU/SZcSsSGS4I/AAAAAAAAB08/IXk9xtof P2w/s1600-h/DSC00343.jpg [9]http://www.infoagro.com/instrumentos_medida/doc_conductividad_electrica.asp ?k=53 [10] http://www.reitec.es/web/descargas/agua01.pdf 86